荨麻提取物及在制备治疗抗过敏的药物上的应用的制作方法
本发明涉及一种荨麻的提取物,并将其应用于制备治疗抗过敏的药物中,属于生物制药技术领域。
背景技术
荨麻(urticafissaepritz)属于被子植物门下属的荨麻科(urticaceae)荨麻属(urtical.)植物,为多年生草本植物,稀灌木,具刺毛,主要分布于我国安徽、湖南、湖北、河南、陕西、甘肃、四川、贵州及四川等地,全草均可入药。具有祛风解痉,活血除湿以及解蛇毒等作用。据文献报道,荨麻的化学成分主要有黄酮类、有机酸类、酚类、多糖类、香豆素类、木质素类、甾醇类以及丰富的蛋白质等。聂鲁研究发现,正彝族药物荨麻,可用于治疗丘疹、湿疹、荨麻疹等过敏性皮肤病,疗效十分显著。国外研究发现,荨麻属植物提取物可抑制与过敏性鼻炎相关的受体和酶的表达。
技术实现要素:
本发明的技术方案鉴于荨麻提取物对过敏反应有潜在的抑制作用,提供一种荨麻抗过敏成分的提取物
本发明分别对荨麻全草干粉及新鲜荨麻采用了醇提和水提;冷水提和热水提及有机溶剂逐步提取方法,分析荨麻抗过敏物质的耐热性、及溶解性。具体包括如下内容:
荨麻提取物,所述的提取物为85-95℃的热水提取物。
荨麻提取物,所述的提取物为质量浓度70-80%乙醇提取物,所述的提取温度为65-75℃。
上述荨麻提取物,所述的提取物为荨麻干粉或荨麻全草干粉,其中提取物与所述的5-95℃的热水提取物或质量浓度70-80%乙醇提取物的质量比为1:10-50。
进一步优选方案为所述的提取物为经质量浓度70-80%乙醇提取物提取后再依次经石油醚萃取、乙酸乙酯萃取、正丁醇萃取后冻干制剂。
本发明的技术方案将所述的荨麻提取物在制备治疗抗过敏的药物上的应用。具体是通过各组分对透明质酸酶的抑制率大小来评价其抗过敏活性。
采用本发明的技术方案得到的荨麻抗过敏活性成分在热乙醇中溶出较为完全,而经过石油醚、乙酸乙酯以及正丁醇萃取后,纯度提高而导致透明质酸酶抑制率升高。然后根据单因子正交实验方案,最后获得荨麻的最佳提取工艺条件。
附图说明
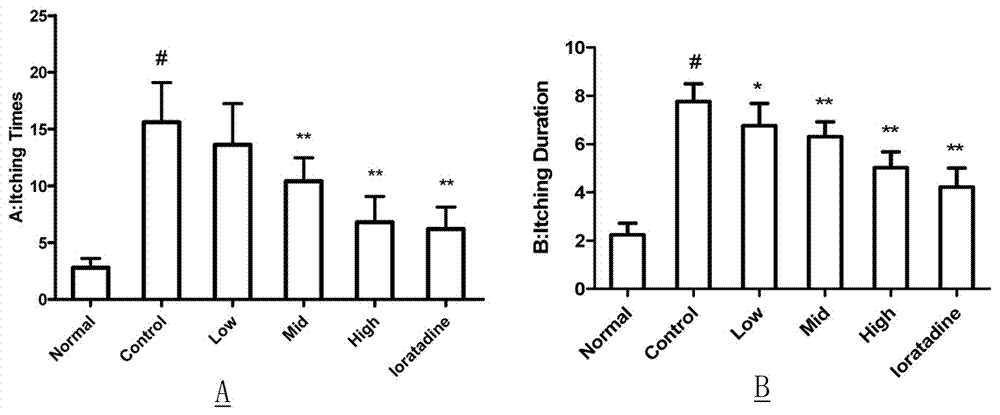
图1荨麻提取物对小鼠低分子右旋糖酐致瘙痒的影响,其中,a:荨麻提取物对小鼠瘙痒频率的影响;b:荨麻提取物对小鼠瘙痒次数的影响。
图2balb/c小鼠被动皮肤过敏过程中耳部皮肤蓝染图。
图3荨麻提取物对致敏激发后balb/c小鼠被动皮肤过敏反应的影响。
图4荨麻提取物对致敏激发后balb/c小鼠血清中ige及组胺浓度的影响。
其中,a:荨麻提取物对致敏激发后balb/c小鼠血清中ige浓度的影响;b荨麻提取物对致敏激发后balb/c小鼠血清中组胺浓度的影响。
图5荨麻提取物对rbl-2h3细胞增殖活性的影响。
图6不同浓度荨麻提取物对rbl-2h3细胞活化β-hex释放的影响。
图7不同浓度荨麻提取物对rbl-2h3细胞活化组胺释放的影响。
图8不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-lyn/lyn、p-syk/syk蛋白表达的灰度值结果。a:不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-lyn/lyn蛋白表达的灰度值结果;b不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-syk/syk蛋白表达的灰度值结果。
图9不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-lyn/lyn、p-syk/syk蛋白表达的统计学结果。a:不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-lyn/lyn蛋白表达的统计学结果;b不同浓度荨麻提取物对致敏激化后rbl-2h3细胞活化脱颗粒p-syk/syk蛋白表达的统计学结果。
具体实施方式
荨麻:产于湖北省宜昌市远安县,经宜昌市药品检验所检测符合中国药典2005年版一部(检验编号:20061188)。
实施本发明的技术方案用到的仪器如下:
suprafuge22型离心机(heraeus公司);蒸发器re-52a(上海亚荣生化仪器厂);kq-250b型超声波清洗器(昆山市超声仪器有限公司);ab204-n分析天平(瑞士mettlertoledo公司);721e可见分光光度计(上海光谱仪器有限公司);kdm型调温电热套(山东鄄城永光仪器厂);中草药粉碎机(中国);dk-s26电热恒温水浴锅(上海精宏实验设备有限公司);微量取样器(200μl,1000μl各一)。
实施本发明的技术方用到的试剂如下:
浓硫酸(分析纯)、苯酚(分析纯)、葡萄糖(分析纯)、95%乙醇(医用级)。自制双蒸水。
荨麻有效活性成分的提取如下:
将样品荨麻洗净,取部分荨麻鲜品置于4℃冰箱保存备用,另取部分置于鼓风烘箱中60℃烘干。用高速粉碎机粉碎,过20目筛后,的干粉置于干燥器中保存备用。
荨麻干粉热水浸提
精密称取30g干粉,经90℃热水浸提1h,料液比为1:40,冷却,过滤,滤渣重复上述操作,合并两次滤液后,浓缩,冷冻干燥,得到荨麻干粉热水浸提物,作为样品a。
荨麻鲜叶热水浸提
精密称取新鲜荨麻200g,经90℃热水浸提1h,料液比为1:15,过滤后再将滤渣重复上述操作,合并两次提取液后浓缩冷冻干燥,得到荨麻鲜叶热水浸提物,作为样品b。
荨麻干粉热乙醇回流提取
精密称取30g干粉,经75%乙醇70℃条件下回流提取1h,料液比为1:40,过滤后再将滤渣重复上述操作,合并两次提取液后浓缩冷冻干燥,得到荨麻干粉热乙醇提取物,作为样品c。
荨麻干粉冷水浸提
精密称取30g干粉,经冷水浸提24h,料液比为1:40,除去滤渣后将提取液浓缩冷冻干燥,得到荨麻干粉冷水浸提物,作为样品d。
荨麻醇提取物经不同溶剂分离萃取
精密称取荨麻干粉60g,75%乙醇在70℃下回流提取2h,料液比为1:40,冷却,过滤,再重复上述步骤,合并两次提取液,浓缩后得到乙醇提取物,经石油醚萃取至石油醚层无色,得石油醚层,低压浓缩,冷冻干燥得到石油醚萃取物,为样品e。将样品e一部分再经乙酸乙酯萃取,至乙酸乙酯层无色,得乙酸乙酯层,低压浓缩,冷冻干燥得到乙酸乙酯萃取物,为样品f。将样品f一部分再经正丁醇萃取,至正丁醇层无色,得正丁醇层,萃取液浓缩、冷冻干燥后得到正丁醇萃取物,为样品g。将样品g一部分经-20℃冷冻干燥,为样品h。
透明质酸酶体外抑制的方法
透明质酸酶参与ⅰ型超敏反应的发生,与过敏反应以及炎症反应有很强的相关性,能影响肥大细胞脱颗粒反应的药物均能对透明质酸酶的活性产生影响。因此本发明以透明质酸酶体外抑制率作为荨麻提取物抗过敏活性的评判标准,以此优化筛选出荨麻提取物抗过敏活性最高的部分。具有步骤如下:
(1)溶剂的配制
透明质酸酶溶液:将0.01g透明质酸酶加入到4ml醋酸缓冲溶液,配置成最终浓度为1250μg/ml的透明质酸酶溶液。
透明质酸钠溶液:将0.005g透明质酸钠加入到10ml醋酸缓冲溶液中,充分溶解后得到0.5μg/ml透明质酸钠溶液。
醋酸缓冲溶液(ph=5.6):取2300μl冰乙酸于容量瓶中,加入去离子水稀释至200ml,混匀后取4.8ml作为a溶液;取5.44g乙酸钠试剂,加入去离子水溶解并定容至200ml,混匀后量取45.2ml作为b溶液;将a、b溶液混匀,加入去离子水定容至100ml。用ph仪精确测定ph值,并用溶液a或b调整ph值至5.6。
埃尔利希试剂:将0.8g对-二甲氨基苯甲醛溶于15ml浓盐酸和15ml无水乙醇中。
乙酰丙酮溶液:将7ml乙酰丙酮溶于100ml1.0mol/l的碳酸钠溶液中(本溶液需现配现用)。
(2)过敏反应方法如下:
将0.1ml的cacl2(0.25mmol/l)溶液和透明质酸酶液0.5ml放入试管中,37℃孵育20分钟,向试管中加入0.5ml样品溶液并在37℃下孵育20分钟。加入0.5ml透明质酸钠溶液并在37℃孵育30min。然后常温静置5min,加0.1ml0.4mol/lnaoh溶液和0.5ml乙酰丙酮溶液,在沸水中加热15min,再冰浴5min,加入1.0mlerlich试剂并用3.0ml无水乙醇稀释。放置20分钟直至其颜色发生改变。用酶标仪测定吸光度值,并计算其透明质酸酶抑制率。具体方案分为4组:a组中的样品溶液用醋酸缓冲液替代,b组中的样品溶液和透明质酸酶溶液以醋酸缓冲溶液替代,c组是正常受试溶液吸光度;d组中透明质酸酶溶液以醋酸缓冲溶液替代。
透明酸酶抑制率=〔(a-b)-(c-d)〕/(a-b)×100%
采用上述技术方案得到的结果如下:
以上述提取方法得到样品a、样品b、样品c、样品d、样品e、样品f、样品g和样品h,再通过透明质酸酶体外抑制的实验评价其抗过敏活性,得到结果如下:
表1荨麻活性成分的透明质酸酶抑制率(
注:#表示与样品a组比较p<0.01,*表示与样品a组比较p>0.05。
透明质酸酶体外抑制的技术方案中药物的透明质酸酶的抑制率与其抗过敏作用呈正相关。根据国际标准,将抗过敏作用分为强、中等、弱以及无抗过敏作用,其对应的抑制率p分别为p≥70%、p≥50%、30%≤p<50%,p<30%。透明质酸酶体外抑制结果显示:样品a和样品b的抑制率相当(p>0.05),说明新鲜荨麻在干燥过程中没有损失抗过敏组分。样品c、样品h的抑制率大于样品a的抑制率(p<0.01),且样品d的冷水浸提的抑制率很小,仅为32.6%,表明了荨麻抗过敏成分在的75%热乙醇中溶出的较完全。h样的抑制率最高,为65.9%。正交试验方法如下
在乙醇浓度a、提取温度b以及料液比c的单因素实验结果的基础上,进行了三因素三水平的正交试验。
表2荨麻提取工艺因素水平表
由表可知,本实验为三个水平,三个因素,因此采用正交表l9(34)来安排实验。
表3l9(34)正交试验结果
表4方差分析表
从上表可知,各因素对综合评分的影响顺序为a>c>b,再从各因素水平来看(k值分析),a因素为k1>k2>k3,b因素为k2>k1>k3,c因素为k3>k2>k1,其提取条件以a1b2c3为佳。结合生产的实际情况,确定珠子参多糖的最佳提取工艺条件为:料液比为8∶1,提取次数为2次,提取时间为3小时。
表5乙醇浓度对荨麻提取物透明质酸酶抑制率的影响(
注:*表示与其他各组比较p<0.05
结果:荨麻提取物在乙醇浓度为75%-95%浓度范围内抑制率较高,且变化幅度较小,因此乙醇浓度选用范围确定为75%-95%之间。
表6温度对荨麻提取物透明质酸酶抑制率的影响(
注:*表示与其他各组比较p<0.05
结果:荨麻提取物的透明质酸酶抑制率随着温度的升高而升高,而在70-90℃范围内变化不大,因此提取温度选取在70-90℃之间。
表7料液比对荨麻提取物透明质酸酶抑制率的影响(
注:*表示与其他各组比较p<0.05
结果:荨麻提取物的透明质酸酶抑制率在料液比为1:40以上时较高,故料液比选取在1:40-1:50之间。
采用上述技术方案进行的荨麻抗过敏成分的提取及抗过敏活性的评价
h样透明质酸酶抑制率最高,表明荨麻抗过敏活性成分在热乙醇中溶出较为完全,而经过石油醚、乙酸乙酯以及正丁醇萃取后,纯度提高而导致透明质酸酶抑制率升高。
如表3和4所示,各因素对荨麻提取物抑制率的影响由大到小为:a>b>c,a因素即乙醇浓度对抑制率有显著影响,a2>a3>a1,而b、c因素即温度和料液比对抑制率影响不大,考虑到技术方案的条件问题,选择a2b2c1,即:85%乙醇浓度、80℃温度和1:40料液比。
通过透明质酸酶体外抑制实验筛选出的最强抗过敏活性组分,在体内实验建立balb/c小鼠低分子右旋糖酐模型、毛细血管通透模型和全身主动和被动皮肤过敏实验评价荨麻提取物的抗过敏活性,分析体外实验检测荨麻提取物对rbl-2h3细胞增殖活性的影响,建立rbl-2h3细胞脱颗粒模型,检测组胺及β-氨基己糖苷酶释放量的变化,westernblot检测荨麻提取物对rbl-2h3细胞致敏激活后fcεri信号通路相关蛋白syk/p-syk与lyn/p-lyn表达的影响。具体方法如下:
实施本发明的技术方案用到的仪器如下:
倒置显微镜(ckx41)、image-proplus7.0c多功能及图像分析系统、gzx-9070meb鼓风烘干箱、全自动组织脱水机、全波长酶标仪(mutiskanspectrum)、倒置显微镜(ckx41)。
实施本发明的技术方案用到的试剂如下:
cck8试剂盒、0.25%胰酶、dnp-hsa、抗dnp-ige单克隆抗体、小鼠组胺elisa试剂盒、小鼠卵清蛋白特异性ige试剂盒、mem高糖型培养基、syk抗体、p-syk抗体、lyn抗体、p-lyn抗体、透明质酸钠等。
本发明的技术方案进行的小鼠低分子右旋糖酐致瘙痒方案如下
选取重量为20±2g的babl/c小鼠,雌雄各半,随机分为空白对照组、模型组、氯雷他定对照组(1.3mg/kg)、荨麻提取物高(624mg/kg)、中(312mg/kg)、低剂量组(156mg/kg),每组6只。各组分别按规定剂量灌胃0.1ml/10g,空白对照组予以相同剂量的生理盐水。连续给药7天,末次给药后30min,每组小鼠尾静脉注射0.04%的低分子右旋糖酐注射液0.1ml/10g,以小鼠的前爪挠头,后爪挠身,嘴咬全身为指征,记录小鼠的瘙痒次数及持续时间。结果如图1所示,ne能有效抑制低分子右旋糖酐所导致小鼠瘙痒,且在一定范围内呈浓度依赖性,其效果在高剂量时十分显著,与阳性对照药氯雷他定相似。
本发明的技术方案进行的小鼠低分子小鼠血管通透性方案如下
选取重量为20±2g的babl/c小鼠,雌雄各半,随机分为空白对照组、模型组、氯雷他定对照组(1.3mg/kg)、荨麻提取物高(624mg/kg)、中(312mg/kg)、低剂量组(156mg/kg),每组6只。各组分别按规定剂量灌胃0.1ml/10g,空白对照组予以相同剂量的生理盐水。连续给药7天,末次给药后30min,各组小鼠均尾静脉注射0.1ml/10g剂量的1%伊文氏蓝溶液,随后在小鼠腹部正中脱毛处皮内注射0.1ml浓度为1%磷酸组胺。30分钟后颈椎脱臼法处死小鼠,分离腹部皮肤,以打孔器取出相同大小的蓝染皮肤,剪碎后放入试管中,再加入4ml的70%丙酮溶液,混匀后在60℃水浴过夜,12h后在2000r/min转速下离心10min,取上清液在全波长多功能酶标仪上测其在610nm处的od值,组间比较,并求出抑制率。结果如表5所示,荨麻提取物在低、中、高剂量时均能明显降低组胺所致小鼠毛细血管通透性,在高剂量时作用十分显著,效果与抗过敏药物氯雷他定相仿。
表8荨麻提取物对组胺致敏小鼠毛细血管通透性的影响(
注:#表示与正常组比较p<0.01,**表示与模型组比较p<0.01
本发明的技术方案进行的小鼠低分子小鼠全身被动皮肤过敏方案如下
抗血清的制备:取雌性sd大鼠6只,皮下给予20ml/ml浓度卵清蛋白和等体积明矾佐剂致敏,剂量为0.5ml。隔天给药,连续3次。末次致敏后第11天,以5%水合氯醛0.7ml/100g腹腔注射麻醉,待其麻醉后腹主动脉动脉取血,在转速为4000r/min下离心15min,取上层血清,分装于ep管中,-20℃保存备用。致敏:选取重量为20±2g的babl/c小鼠,雌雄各半,随机分为空白对照组、模型组、氯雷他定对照组(1.3mg/kg)、荨麻提取物高(624mg/kg)、中(312mg/kg)、低剂量组(156mg/kg),每组6只。各组分别按规定剂量灌胃0.1ml/10g,对照组给予相同剂量的生理盐水。隔天给药,连续三次,在末次给药后用浓度为5%的水合氯醛0.1ml/10g小鼠麻醉后,除正常组外每只小鼠右耳皮内注射20μl的致敏血清,同时左耳注入等量生理盐水,在致敏处做好标记。正常组小鼠两只耳朵均注入20μl的生理盐水。
激发:24h后再次灌胃给药,剂量同前。给药1h后,除空白对照组外,每只小鼠尾静脉注射0.2mlova与伊文氏蓝混合溶液(20mg/ml的ova与等体积的1%伊文氏蓝),用相机记录小鼠耳部皮肤颜色变化。1h后处死小鼠,并用打孔器取相同面积大小皮肤,要求同一部位且具有颜色,随即浸润于甲酰胺溶液中,于64℃水浴锅恒温过夜,12h后在2500r/min转速下离心15min,取上清液,置于全波长多功能酶标仪中测定在650nm波长下的od值,并做组间比较。结果如图2和图3所示,荨麻提取物具有抑制ova引起的被动皮肤过敏反应的作用,且在高剂量作用显著,但相比与阳性药氯雷他定稍弱。
本发明的技术方案进行的小鼠低分子小鼠全身主动皮肤过敏方案如下
致敏:选取重量为20±2g的babl/c小鼠,雌雄各半,随机分为空白对照组、模型组、氯雷他定对照组(1.3mg/kg)、荨麻提取物高(624mg/kg)、中(312mg/kg)、低剂量组(156mg/kg),每组6只。各组小鼠均隔日一次皮下注射ova和明矾佐剂混合溶液(1mg/ml的ova和等体积明矾混合)0.2ml,共计三次,空白对照组给予生理盐水。
激发:末次致敏第10天起,每组小鼠灌胃给药相对应的药物0.2ml/只,隔天给药,共计三次。末次给药30min后,小鼠尾静脉注射4mg/ml的ova溶液0.2ml致敏,空白对照组予以生理盐水代替。随后眼球取血,在3000r/min转速下离心10分钟,取上层血清后,用小鼠elisa试剂盒测血清中组胺以及ova特异性ige含量。结果如图4和图5所示,荨麻提取物能明显降低小鼠血清中ova特异性ige和组胺浓度水平,且作用趋势相近,在一定浓度范围内呈剂量依赖性。由此推断荨麻提取物能有效抑制由ova引起的小鼠全身主动过敏反应。
本发明的技术方案进行的体外方案如下
荨麻提取物对rbl-2h3细胞活化β-hex释放的影响
取对数期生长的rbl-2h3细胞,经消化后制成细胞悬液并计数,调整细胞浓度为2.5×105个/ml,在mem完全培养基中混合细胞并接种到平底24孔板中,每孔接种1ml。接种时不断混合细胞悬液,以确保每孔接种的细胞数量大致相同。将24孔板放入恒温培养箱中温育。设置正常组、模型组、荨麻提取物浓度梯度组(100μg/ml、200μg/ml、400μg/ml)、阳性药组(5ng/ml的氯雷他定),正常组不经致敏、激发以及药物处理,模型组经过致敏和激发但不经药物处理,ne组和阳性药物组需经致敏、激发以及相应药物处理。模型组和荨麻提取物组以及阳性药物对照组用0.2μg/ml抗dnpige单克隆抗体致敏。次日,将各组细胞用含有对应药物的mem无血清培养基孵育1h。孵育1h后,吸出培养基并用pbs缓冲液冲洗细胞3次。接下来将200μl浓度为30ng/ml的dnp-hsapbs缓冲液加入到除正常组外各组细胞中激发。正常组用等量的无菌生理盐水代替。将24孔板在培养箱中孵育1小时后,取上清液。将上清液置于96孔板中,每孔50μl,然后加入50μl显色溶液。在培养箱中孵育1小时后,向每个孔中滴加200μl终止溶液以终止显色反应。全波长酶标仪405nm波长处检测od值。
各组β-hex释放的抑制率采用公式进行计算:β-hex抑制率(%)=[1-(tod-cod)/(mod-cod)]×100%。结果如图5所示,50、100、200、400μg/ml的荨麻提取物对rbl-2h3无增殖毒性影响。可在此范围内选择100、200、400μg/ml的荨麻提取物做为药物作用细胞的低、中、高剂量。
荨麻提取物对rbl-2h3细胞活化组胺及β-hex释放的影响
取对数期生长的rbl-2h3细胞,经消化后制成细胞悬液并计数,调整细胞浓度为2.5×105个/ml,在mem完全培养基中混合细胞并接种到平底24孔板中,每孔接种1ml。接种时不断混合细胞悬液,以确保每孔接种的细胞数量大致相同。将24孔板放入恒温培养箱中温育。设置正常组、模型组、荨麻提取物浓度梯度组(100μg/ml、200μg/ml、400μg/ml)、阳性药组(5ng/ml的氯雷他定),正常组不经致敏、激发以及药物处理,模型组经过致敏和激发但不经药物处理,ne组和阳性药物组需经致敏、激发以及相应药物处理。模型组和荨麻提取物组以及阳性药物对照组用0.2μg/ml抗dnpige单克隆抗体致敏。次日,将各组细胞用含有对应药物的mem无血清培养基孵育1h。孵育1h后,吸出培养基并用pbs缓冲液冲洗细胞3次。接下来将200μl浓度为30ng/ml的dnp-hsapbs缓冲液加入到除正常组外各组细胞中激发。正常组用等量的无菌生理盐水代替。将24孔板置于培养箱中孵育1h,4000r/min离心5min后再次收集上清液,通过大鼠组胺elisa试剂盒检测上清液中组胺含量。将上清液置于96孔板中,每孔50μl,然后加入50μl显色溶液。在培养箱中孵育1小时后,向每个孔中滴加200μl终止溶液以终止显色反应。结果如图6所示,荨麻提取物可明显抑制活化后rbl-2h3细胞β-hex的释放,作用在一定范围内呈浓度依赖性,且在高剂量时效果与阳性药氯雷他定相仿。如图7所示,荨麻提取物可明显抑制致敏rbl-2h3细胞组胺的释放,作用在一定范围内呈浓度依赖性,且在中、高剂量时作用显著。
荨麻提取物对活化后的rbl-2h3细胞中p-lyn/lyn、p-syk/syk蛋白表达的影响
蛋白提取:取对数期生长的rbl-2h3细胞,经消化后制成细胞悬液并计数,调整细胞浓度为5×105个/ml,在mem完全培养基中混合细胞并接种到平底6孔板中,每孔接种2ml。接种时不断混合细胞悬液,以确保每孔接种的细胞数量大致相同。将6孔板放入恒温培养箱中温育。设置正常组、模型组、荨麻提取物浓度梯度组(100μg/ml、200μg/ml、400μg/ml)、阳性药组(lyn抑制剂pp210μm,syk抑制剂oxsi-20.1μm),正常组不经致敏、激发以及药物处理,模型组经过致敏和激发但不经药物处理,荨麻提取物组和阳性药物组需经致敏、激发以及相应药物处理。模型组和荨麻提取物组以及阳性药物对照组用0.2μg/ml抗dnpige单克隆抗体致敏。次日,将各组细胞用含有对应药物的mem无血清培养基孵育1h。孵育1h后,吸出培养基并用pbs缓冲液冲洗细胞3次。接下来将200μl浓度为30ng/ml的dnp-hsapbs缓冲液加入到除正常组外各组细胞中激发。正常组用等量的无菌生理盐水代替。激发完成后,弃去细胞上清液,细胞培养瓶内加入4℃预冷的pbs1ml洗涤细胞2次,刮起细胞制成细胞悬液,用移液枪将细胞悬液转入1.5mlep管内,冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。在4℃下12000rpm离心10min。收集上清液,作为蛋白总液。
蛋白浓度测定:用bca蛋白浓度测定试剂盒测蛋白浓度,具体方法参照试剂盒的说明书。
蛋白电泳:清洗玻璃板,待玻璃板晾干后,将一个毛玻璃板和一个平玻璃板组成一对,玻璃板之间是灌胶的缝隙,放入制胶器,插入楔子将玻璃板固定,检查底部是否对齐以免漏胶。①选用8%的分离胶和5%的浓缩胶。将分离胶灌到适当的的高度,灌胶之前可以用梳子试一下,梳子齿距离分离胶上液面大约5-8mm为宜。然后将纯水缓慢均匀加入到缝隙中直到灌满,过程不要把胶冲散。②依照浓度,将总量为50μg的每种样品吸取并小心添加到聚丙烯酰胺凝胶的孔中。每个样品保留一个样品孔,加入3μl蛋白质标记物作为目标蛋白转膜效率的指示;③胶凝剂置于电泳槽中,电泳后加入足够的电泳溶液。将样品加入电泳孔并进行电泳。集中凝胶电压75v,与120v分离胶。电泳至溴酚蓝刚跑完就停止电泳,转膜。
转膜:取下玻璃板并撬开,根据目的蛋白的分子量切取胶片段,并转入转膜缓冲液中。剪裁pvdf膜使其大小几乎与胶片段相同并浸泡于甲醇中活化。同时,将转膜夹子、海绵垫、滤纸也放置于转移缓冲液中。打开夹子依次放置海绵、滤纸、pvdf膜和胶,合起转膜夹子将其转入转膜槽中,200ma恒流转膜(约1h)。免疫反应:①转膜完毕后用5%的脱脂牛奶,封闭1h。②稀释一抗(tbst溶解的5%脱脂牛奶,磷酸化蛋白使用tbst溶解的5%bsa),4℃孵育过夜。③用tbst在室温下脱色摇床上洗三次,每次5min。④二抗用tbst稀释3,000倍,在室温下孵育30分钟,并在室温下在脱色摇床上用tbst洗涤三次,每次5分钟。
化学发光:在暗室中将ecl的a液和b液等体积混合,将pvdf膜的蛋白面朝上放在曝光匣两层薄膜之间,加入ecl混合液,2-3min后,去除残液开始曝光。曝光后的胶片进行显影和定影。
凝胶图像分析:将胶片进行扫描存档,整理去色,并用相关软件处理目标条带的光密度值。结果如图8、9所示,400μg/ml的荨麻提取物能明显降低fcεri信号通路中lyn以及syk的磷酸化水平。
本发明将透明质酸酶抑制率做为指标,对荨麻提取物的提取工艺做出优化。采用对荨麻全草干粉及新鲜荨麻采用醇提和水提、冷水提和热水提以及有机溶剂逐步提取方法,来鉴别荨麻抗过敏物质的耐热性、及溶解性,再经过单因素实验及正交试验优化荨麻提取物的提取工艺,由此筛选出荨麻抗过敏活性最强的部分。
动物体部分,本研究选用了多个经典ⅰ型过敏反应模型,从多方面评价荨麻提取物的抗过敏活性:低分子右旋糖酐致瘙痒结果表明,荨麻提取物对低分子右旋糖酐所致瘙痒有明显抑制作用,主要表现在能显著降低小鼠的舔体次数以及舔体持续时间;组胺诱导的小鼠毛细血管通透性增高结果可以看出,荨麻提取物有效减低过敏反应所引起的毛细血管通透性增高;ova诱导全身主动过敏反应结果表明,荨麻提取物能明显减低过敏小鼠血清中的组胺以及ova特异性ige的浓度;被动皮肤过敏反应结果提示,荨麻提取物能有效抑制ova致敏激发引起的局部皮肤过敏反应。
细胞部分,本发明成功建立rbl-2h3体外培养模型,并检测荨麻提取物对抗原诱导的rbl-2h3细胞脱颗粒的影响。rbl-2h3细胞与肥大细胞以及嗜碱性粒细胞拥有近乎相同的脱颗粒途径,与ige高亲和力受体(fcεri)交联,释放一系列的预合成和新和成的介质,唤起一个强有力的免疫过敏反应。这个细胞株具备易培养、性状稳定、单一等优势,是体外分析与肥大细胞相关的各类生理、病理、药物作用机制等的理想替代模型。本发明首先通过cck-8细胞增殖毒性验证荨麻提取物对rbl-2h3细胞无细胞毒性作用,以排除毒性作用干扰结果。再通过检测活化后rbl-2h3细胞中组胺和β-氨基己糖苷酶的释放,进一步验证了荨麻提取物对肥大细胞脱颗粒反应具有明显的抑制作用。最后通过westernblot的方法检测活化后的rbl-2h3细胞fcεri信号通路中上游蛋白syk及lyn的磷酸化水平,结果发现荨麻提取物可明显抑制syk及lyn的磷酸化。
- 还没有人留言评论。精彩留言会获得点赞!