一种用于提高肿瘤组织渗透性的纳米粒子及其制备方法和应用与流程
本发明涉及用于治疗肿瘤的医药技术领域,尤其涉及一种用于提高肿瘤组织渗透性的纳米粒子及其制备方法和应用。
背景技术:
癌症是威胁人类健康的首要顽疾,化疗是临床上治疗肿瘤的基本手段。纳米药物由于具有血液长循环、选择性肿瘤富集、肿瘤部位滞留时间长、低毒性等优势,有望克服小分子化疗药物存在的不足,提高其抗肿瘤效果。然而,到达肿瘤部位的纳米粒子平均只有注射剂量的0.7%,绝大部分纳米粒子只能停留在血管周围而无法进入到肿瘤中心区域,这极大限制了纳米药物的治疗效果。如梁兴杰教授研究了金纳米粒子在肿瘤部位的渗透性能,发现大部分金纳米粒子(100nm)位于肿瘤的外围和肿瘤血管附近,被阻止渗透到肿瘤深层区域;又如赵宇亮通过肿瘤组织切片清晰的发现,经尾静脉注射载阿霉素纳米粒子16小时后,大部分阿霉素仍分布在肿瘤的边缘。因此,人们迫切需要找到一种提高肿瘤组织渗透性的途径,促进纳米药物向肿瘤内渗透。
研究发现,肿瘤细胞外基质(ecm)是由大分子构成的复杂立体网络结构,主要包括透明质酸、胶原蛋白、弹性蛋白等,不仅为实体瘤的生长和转移提供了肥沃的土壤,同时也限制了纳米药物向实体瘤的渗入。并且,ecm会随着肿瘤恶性程度的提高而更加致密,致密的ecm会提高肿瘤内部压力,从而进一步阻止纳米药物向肿瘤内的渗透。因此,通过降解ecm有望促进纳米药物向肿瘤内渗透。目前,已有学者对此进行了研究,如高会乐教授通过瘤内注射氯沙坦降解ecm中胶原蛋白的方式来提高纳米粒子在肿瘤组织的渗透,刘庄教授通过瘤内注射透明质酸酶降解ecm中透明质酸的方式来提高纳米粒子在肿瘤组织的渗透。然而,较高的瘤内压会提高瘤内注射的困难度,同时反复的肿瘤注射刺激也会加快肿瘤的恶化,因此限制了该方法的应用。
技术实现要素:
本发明的目的在于提供一种用于提高肿瘤组织渗透性的纳米粒子,该纳米粒子可提高抗肿瘤药物在肿瘤组织的渗透性,且制备方法和使用方法简单,易操作。
为了实现上述发明目的,本发明提供了以下技术方案:
一种用于提高肿瘤组织渗透性的纳米粒子,其组成包括中空介孔普鲁士蓝纳米粒子、相变材料、肿瘤基质降解材料和抗肿瘤药物;所述相变材料包载于中空介孔普鲁士蓝纳米粒子的中空部分;所述肿瘤基质降解材料和抗肿瘤药物镶嵌于相变材料内部;所述相变材料为月桂酸、9-十七烷酮、癸酸或1-十四烷醇。
优选的,所述中空介孔普鲁士蓝纳米粒子的水合粒径为150~200nm,壁厚为15~30nm,zeta电位为-2~-20mv。
优选的,所述肿瘤基质降解材料的载药量为2~12wt.%。
优选的,所述抗肿瘤药物的载药量为2~15wt.%。
优选的,所述肿瘤基质降解材料为透明质酸酶、氯沙坦、菠萝蛋白酶或胶原蛋白酶。
优选的,所述抗肿瘤药物为阿霉素、紫杉醇或羟基喜树碱。
本发明还提供了一种上述技术方案所述的用于提高肿瘤组织渗透性的纳米粒子的制备方法,包括如下步骤:
(1)将相变材料、肿瘤基质降解材料和抗肿瘤药物溶解于甲醇中,得到包载材料的溶液;
(2)将所述包载材料的溶液和中空介孔普鲁士蓝纳米粒子混合后,在50~80℃搅拌2~6h,然后将所述搅拌得到的混合溶液与水混合,再经离心,得到用于提高肿瘤组织渗透性的纳米粒子。
优选的,所述相变材料、抗肿瘤药物、肿瘤基质降解材料和中空介孔普鲁士蓝纳米粒子的质量比为1:0.1~2.4:0.1~2.4:0.01~4。
优选的,所述离心的转速为4500~8000rpm,所述离心的时间为8~20min。
本发明还提供了一种上述技术方案所述的用于提高肿瘤组织渗透性的纳米粒子或上述技术方案所述的制备方法制备得到的用于提高肿瘤组织渗透性的纳米粒子的用途,将所述用于提高肿瘤组织渗透性的纳米粒子与光热疗法结合使用。
本发明提供了一种用于提高肿瘤组织渗透性的纳米粒子,其组成包括中空介孔普鲁士蓝纳米粒子、相变材料、肿瘤基质降解材料和抗肿瘤药物;所述相变材料包载于中空介孔普鲁士蓝纳米粒子的中空部分;所述肿瘤基质降解材料和抗肿瘤药物镶嵌于相变材料内部;所述相变材料为月桂酸、9-十七烷酮、癸酸或1-十四烷醇。本发明以中空介孔普鲁士蓝纳米粒子为载体,其本身带有负电性,可有效防止对蛋白以及细胞的非特异性吸附,具有良好的血液稳定性,还可通过epr效应(增强渗透滞留效应)实现被动靶向;且肿瘤基质降解材料和抗肿瘤药物镶嵌于熔点较高的相变材料中,再包载于中空介孔普鲁士蓝纳米粒子的中空部分,使得所得纳米粒子在人体血液内循环时实现药物零释放,而当所述纳米粒子达到肿瘤部位时,进行激光照射即可使相变材料熔化释放肿瘤基质降解材料和抗肿瘤药物,肿瘤基质降解材料可降解肿瘤基质,促进抗肿瘤药物向肿瘤组织渗透。采用本发明所提供的用于提高肿瘤组织渗透性的纳米粒子进行抑瘤实验,其抑瘤率可达81.3%。
附图说明
图1实施例1所得用于提高肿瘤组织渗透性的纳米粒子的dls表征粒径图;
图2实施例1所得中空介孔普鲁士蓝纳米粒子的tem图和sem图,其中a为透射电镜tem图,b为a中普鲁士蓝纳米粒子的放大图,c为扫描电镜sem图;
图3实施例1所得用于提高肿瘤组织渗透性的纳米粒子的药物释放曲线;
图4不同样品的肿瘤细胞杀伤力结果图;
图5不同纳米粒子的抑瘤实验结果;
图6阿霉素在肿瘤组织切片中的分布图,a为第(5)组小鼠的冷冻组织切片,b为第(4)组小鼠的冷冻组织切片。
具体实施方式
本发明提供了一种用于提高肿瘤组织渗透性的纳米粒子,其组成包括中空介孔普鲁士蓝纳米粒子、相变材料、肿瘤基质降解材料和抗肿瘤药物;所述相变材料包载于中空介孔普鲁士蓝纳米粒子的中空部分;所述肿瘤基质降解材料和抗肿瘤药物镶嵌于相变材料内部;所述相变材料为月桂酸、9-十七烷酮、癸酸或1-十四烷醇。
在本发明中,以中空介孔普鲁士蓝纳米粒子为载体,其本身带有负电性,可有效防止对蛋白以及细胞的非特异性吸附,具有良好的血液稳定性,还可通过epr效应(增强渗透滞留效应)实现被动靶向;且肿瘤基质降解材料和抗肿瘤药物镶嵌于熔点较高的相变材料中,再包载于中空介孔普鲁士蓝纳米粒子的中空部分,使得所得纳米粒子在人体血液内循环时实现药物零释放,而当所述纳米粒子达到肿瘤部位时,进行激光照射即可使相变材料熔化释放肿瘤基质降解材料和抗肿瘤药物,肿瘤基质降解材料可降解肿瘤基质,促进抗肿瘤药物向肿瘤组织渗透。
在本发明中,所述相变材料为月桂酸、9-十七烷酮、癸酸或1-十四烷醇。上述相变材料在人体体温范围内呈现为固体,但在激光照射后,温度达到38℃~55℃时能够熔化,其熔化温度是人体所能承受的,且相变材料对人体无毒无副作用。
在本发明中,所述中空介孔普鲁士蓝纳米粒子的水合粒径优选为150~200nm,更优选为170~180nm;所述中空介孔普鲁士蓝纳米粒子的壁厚优选为15~30nm,更优选为20~25nm;所述中空介孔普鲁士蓝纳米粒子的zeta电位优选为-2~-20mv,更优选为-10~-15mv。在本发明中,所述粒径的中空介孔普鲁士蓝纳米粒子可以渗透进肿瘤组织内部,使更多抗肿瘤药物进入肿瘤组织;而普鲁士蓝的负电性可有效防止对蛋白以及细胞的非特异性吸附,具有良好的血液稳定性。
在本发明中,所述肿瘤基质降解材料的载药量(相对于中空介孔普鲁士蓝纳米粒子的质量百分比)优选为2~12wt.%,更优选为5~10wt.%。
在本发明中,所述抗肿瘤药物的载药量(相对于中空介孔普鲁士蓝纳米粒子的质量百分比)优选为2~15wt.%,更优选为5~10wt.%。
在本发明中,所述肿瘤基质降解材料优选为透明质酸酶、氯沙坦、菠萝蛋白酶或胶原蛋白酶。
在本发明中,所述抗肿瘤药物优选为阿霉素、紫杉醇或羟基喜树碱。
本发明还提供了一种上述技术方案所述的用于提高肿瘤组织渗透性的纳米粒子的制备方法,包括如下步骤:
(1)将相变材料、肿瘤基质降解材料和抗肿瘤药物溶解于甲醇中,得到包载材料的溶液;
(2)将所述包载材料的溶液和中空介孔普鲁士蓝纳米粒子混合后,在50~80℃搅拌2~6h,然后将所述搅拌得到的混合溶液与水混合,再经离心,得到用于提高肿瘤组织渗透性的纳米粒子。
本发明将相变材料、肿瘤基质降解材料和抗肿瘤药物溶解于甲醇中,得到包载材料的溶液。本发明对所述相变材料、肿瘤基质降解材料和抗肿瘤药物溶解于甲醇的加料顺序没有特殊限定,能够得到包载材料的溶液即可。在本发明实施例中,由于肿瘤基质降解材料和抗肿瘤药物加入量较少,为了保证加料的准确性,将两者配制成甲醇溶液使用。
在本发明中,所述相变材料的质量与甲醇的体积之比优选为1mg:0.06~5ml,更优选为1mg:1.5~3.4ml。
在本发明中,所述相变材料、肿瘤基质降解材料和抗肿瘤药物的质量比优选为1:0.1~2.4:0.1~2.4,更优选为1:1~1.5:1~1.5。
完成溶解后,本发明优选将所得混合溶液搅拌25~35min,得到包载材料的溶液。在本发明中,对所述混合溶液的搅拌可以使包载材料混合更均匀。
得到包载材料的溶液后,本发明将所述包载材料的溶液和中空介孔普鲁士蓝纳米粒子混合后,在50~80℃搅拌2~6h,然后将所述搅拌得到的混合溶液与水混合,再经离心,得到用于提高肿瘤组织渗透性的纳米粒子。
本发明对所述中空介孔普鲁士蓝纳米粒子的来源没有特殊限定,可以根据现有技术得到所需的中空介孔普鲁士蓝纳米粒子即可。在本发明实施例中,优选采用现有技术“cellmembranecamouflagedhollowprussianbluenanoparticlesforsynergisticphotothermal-/chemotherapyofcancer”(wchen,adv.funct.mater.2017)制备,具体的制备方法包括如下步骤:
(1)介孔普鲁士蓝(mpb)的制备:将1.0~5.0g聚乙烯吡咯烷酮和100~180mg铁氰化钾溶于20~60ml浓度为0.01m~0.05m的盐酸中,室温搅拌10~50min;当溶液变为浅黄色透明液体时,将溶液置于高压反应釜,并在60℃~100℃的电烘箱中反应18~36h;反应完成后,通过离心得到mpb纳米粒子,然后将所得mpb纳米粒子经冷冻干燥得到mpb纳米粒子;
(2)中空介孔普鲁士蓝(hmpb)的制备:将10~30mgmpb和150~300mg聚乙烯吡咯烷酮溶于10~30ml浓度为0.01~2m的盐酸中,室温搅拌1~5h;将所得混合溶液置于高压反应釜,在100~160℃的电烘箱中反应1~5h;反应完成后,将所得反应产物通过离心得到固体产物,将所述固体产物冷冻干燥,得到中空介孔普鲁士蓝纳米粒子。
在本发明中,所述相变材料与中空介孔普鲁士蓝纳米粒子的质量比优选为1:0.01~4,更优选为1:1~2。
本发明对所述中空介孔普鲁士蓝纳米粒子的加料方式没有特殊限定,可以将中空介孔普鲁士蓝纳米粒子直接与所述包载材料溶液混合,也可将中空介孔普鲁士蓝纳米粒子分散于甲醇中,再与所述包载材料溶液混合。在本发明实施例中,优选将中空普鲁士蓝纳米粒子与甲醇混合为中空介孔普鲁士蓝纳米粒子甲醇分散液,然后将所述包载材料的溶液与中空介孔普鲁士蓝纳米粒子甲醇分散液混合;所述中空介孔普鲁士蓝纳米粒子甲醇分散液的浓度优选为2~4mg/ml。
在本发明中,在50~80℃相变材料能够熔化,在此温度对包载材料的溶液与中空介孔普鲁士蓝纳米粒子甲醇分散液的混合液搅拌,有利于包载材料溶液均匀的填充入中空介孔普鲁士蓝纳米粒子的中空部位。
搅拌完成后,本发明将所述搅拌得到的混合溶液与水混合,再进行离心。在本发明中,在50~80℃搅拌过程中,体系中的甲醇会挥发,搅拌完成后得到的体系是以相变材料为介质的,中空介孔普鲁士蓝纳米粒子的中空部位填满包载材料(即相变材料、肿瘤基质降解材料和抗肿瘤药物),包载材料仍为液态,此时,将所述搅拌得到的混合溶液与水混合,经离心后,体系会分为上下两层,上层为液态相变材料和没有被包载进去的肿瘤基质降解材料,下层主要为填充有包载材料的中空介孔普鲁士蓝纳米粒子水分散液,留取下层作为离心所得产物。
在本发明中,所述搅拌得到的混合溶液与所述水的体积比优选为1:0.025~0.1。
在本发明中,所述水优选为去离子水。
在本发明中,所述离心的转速优选为4500~8000rpm,更优选为4500~5500rpm;所述离心的时间优选为8~20min,更优选为10~15min。在本发明中,在上述低速条件离心,能够尽量避免包载材料从中空介孔普鲁士蓝纳米粒子中甩出。
完成离心后,本发明优选将所述离心所得产物分散于水中,然后进行冷冻干燥,得到用于提高肿瘤组织渗透性的纳米粒子。在本发明中,将离心所得产物重新分散于水中,在分散的过程中,产物的温度会降低,当温度低于相转变材料熔点时,相变材料会固化。
在本发明中,所述离心所得产物与分散所述离心所得产物所用的水的质量比优选为1:0.025~0.1。
在本发明中,所述分散所述离心所得产物所用的水优选为去离子水。
本发明对冷冻干燥的条件没有特殊限定,能够得到干燥的产品即可。在本发明实施例中,所述冷冻干燥的温度优选为-40~-70℃,冷冻干燥的时间优选为24h~36h。
本发明还提供了一种上述技术方案所述的用于提高肿瘤组织渗透性的纳米粒子或上述技术方案所述的制备方法制备得到的用于提高肿瘤组织渗透性的纳米粒子的用途,将所述用于提高肿瘤组织渗透性的纳米粒子与光热疗法结合使用。
在本发明中,所述用于提高肿瘤组织渗透性的纳米粒子到达肿瘤部位后,进行激光照射(即光热疗法),可使用于提高肿瘤组织渗透性的纳米粒子中的相变材料熔化,从而释放出肿瘤基质降解材料和抗肿瘤药物,使得肿瘤基质降解材料能够对肿瘤基质进行降解,抗肿瘤药物向肿瘤组织内部渗透,同时避免了抗肿瘤药物在血液循环过程中流失。
下面结合实施例对本发明提供的一种用于提高肿瘤组织渗透性的纳米粒子及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
(1)介孔普鲁士蓝(mpb)的制备:将3.0g聚乙烯吡咯烷酮和132mg铁氰化钾溶于40ml浓度为0.01m的盐酸中,室温搅拌30min;当溶液变为浅黄色透明液体时,将溶液置于高压反应釜并在80℃的电烘箱中反应24h;反应完成后,通过离心得到固体产物,将所述固体产物经冷冻干燥,得到mpb;
(2)中空介孔普鲁士蓝(hmpb)的制备:将20mgmpb和200mgpvp溶于20ml浓度为1m的盐酸中,室温搅拌3h;搅拌完成后,将所得溶液置于高压反应釜并在140℃的电烘箱中反应3h;反应完成后,将反应所得产物通过离心得到固体产物,将所述固体产物经冷冻干燥,得到hmpb;
(3)用于提高肿瘤组织渗透性的纳米粒子的制备:将50mg月桂酸、2.0ml浓度为6.0mg/ml的阿霉素甲醇溶液和2.0ml浓度为6mg/ml的氯沙坦甲醇溶液溶于甲醇中,搅拌30min,得到包载材料的溶液;
将2.0ml浓度为3mg/ml的中空介孔普鲁士蓝纳米粒子甲醇分散液加入到所述包载材料的溶液中,并在70℃搅拌4h;搅拌完成后,加入100μl水,然后在5000rpm离心10min,留取下层作为离心所得产物;将所述离心所得产物分散于去离子水中,然后在-50℃冷冻干燥24h得到用于提高肿瘤组织渗透性的纳米粒子(简写为(dox+losartan)@hmpb)。
将所得(dox+losartan)@hmpb溶于甲醇,取溶液,采用紫外-可见光分光光度计测定阿霉素和氯沙坦的载药量,得到阿霉素和氯沙坦的载药量分别为7.2wt.%和8.5wt.%。
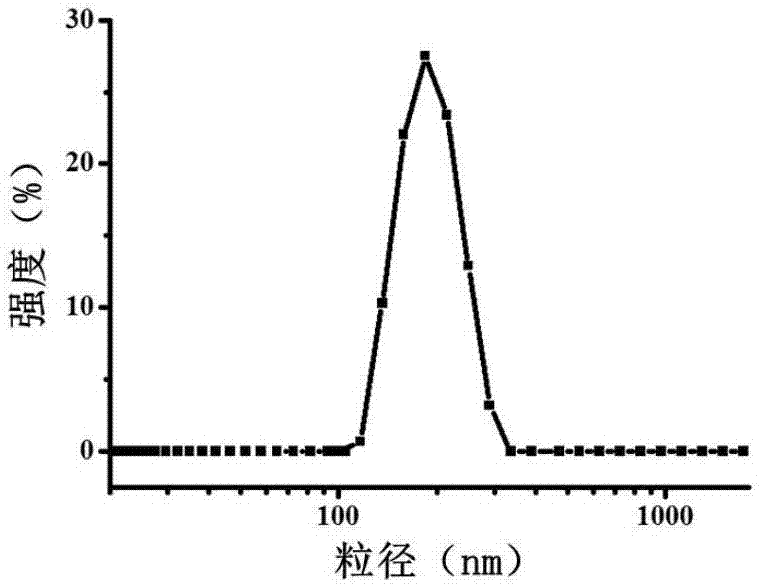
采用dls和透射电镜(tem)对步骤(2)所得中空介孔普鲁士蓝纳米粒子进行表征,结果如图1和图2所示;由图1可知,本实施例所得中空介孔普鲁士蓝纳米粒子的粒径为150nm~200nm;图2中a为tem图,b为a中普鲁士蓝纳米粒子的放大图,c为扫描电镜sem图,由图2可知本实施例所得中空介孔普鲁士蓝纳米粒子内部中空,且表面存在介孔,经测量本实施例所得中空介孔普鲁士蓝纳米粒子的壁厚为20nm。
实施例2
(1)按照实施例1中步骤(1)和步骤(2)所述的方法制备中空介孔普鲁士蓝纳米粒子;
(2)将50mg月桂酸、2.0ml浓度为4.0mg/ml的阿霉素甲醇溶液和2.0ml浓度为3mg/ml的氯沙坦甲醇溶液溶于甲醇中,搅拌30min,得到包载材料的溶液;
将2.0ml浓度为3mg/ml的中空介孔普鲁士蓝纳米粒子甲醇分散液加入到所述包载材料的溶液中,并在70℃搅拌4h;搅拌完成后,加入800μl水,然后在5000rpm离心10min,留取下层作为离心所得产物;将所述离心所得产物分散于去离子水中,然后在-50℃℃冷冻干燥24h得到用于提高肿瘤组织渗透性的纳米粒子(简写为(dox+losartan)@hmpb)。
将所得(dox+losartan)@hmpb溶于甲醇,取溶液,采用紫外-可见光分光光度计测定阿霉素和氯沙坦的载药量,得到阿霉素和氯沙坦的载药量分别为4.3wt.%和4.0wt.%。
实施例3
(1)按照实施例1中步骤(1)和步骤(2)所述的方法制备中空介孔普鲁士蓝纳米粒子;
(2)将50mg月桂酸、2.0ml浓度为5.0mg/ml的阿霉素甲醇溶液和2.0ml浓度为4mg/ml的氯沙坦甲醇溶液溶于甲醇中,搅拌30min,得到包载材料的溶液;
将2.0ml浓度为3mg/ml的中空介孔普鲁士蓝纳米粒子甲醇分散液加入到所述包载材料的溶液中,并在70℃搅拌4h;搅拌完成后,加入800μl水,然后在5000rpm离心10min,留取下层作为离心所得产物;将所述离心所得产物分散于去离子水中,然后在-50℃冷冻干燥24h得到用于提高肿瘤组织渗透性的纳米粒子(简写为(dox+losartan)@hmpb)。
将所得(dox+losartan)@hmpb溶于甲醇,取溶液,采用紫外-可见光分光光度计测定阿霉素和氯沙坦的载药量,得到阿霉素和氯沙坦的载药量分别为4.9wt.%和4.4wt.%。
实施例4
以ph值为7.4的磷酸缓冲溶液为模拟人体生理环境的缓释体系,将实施例1所得(dox+losartan)@hmpb配制为浓度为1.0mg/ml的水分散液,取1ml所述水分散液置于截留分子量为3500的透析袋中,再将透析袋置于温度为37℃的磷酸缓冲溶液(pbs,ph值为7.4)中,计为a组;另取1ml所述水分散液置于截留分子量为3500的透析袋中,再将透析袋置于温度为50℃的磷酸缓冲溶液(pbs,ph值为7.4)中,计为b组,然后在固定的时间从上述a组和b组的溶液中取出2ml溶液,使用紫外-可见光分光光度计测定a组和b组液体中阿霉素的浓度,并进行计算,得到阿霉素在不同温度下的释放曲线,结果如图3所示。
由图3可知,在37℃的条件下,(dox+losartan)@hmpb并不会释放阿霉素,说明本发明所提供的用于提高肿瘤组织渗透性的纳米粒子在人体血液中可以达到药物零释放的效果;在50℃的条件下,(dox+losartan)@hmpb缓慢释放出阿霉素。
采用同样的方法检测实施例2和实施例3所得用于提高肿瘤组织渗透性的纳米粒子的释放性能,所得结果与实施例1相同。
实施例5
将处于正常状态的4t1人类乳腺癌细胞种植在96孔板中,每孔12000细胞,并分为8组,分别计为(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8),将8组人类乳腺癌细胞置于培养箱预先培养24h后,
对第(1)组癌细胞不做处理,作为空白对照组;
对第(2)组癌细胞继续培养4h,然后用808nm激光器照射5min,然后继续培养24h后加入噻唑蓝(mtt);
对第(3)组癌细胞注入150μl浓度为11.71μg/ml的中空介孔普鲁士蓝纳米粒子的pbs溶液,继续培养24h后加mtt;
对第(4)组癌细胞注入150μl浓度为1.18μg/ml的氯沙坦pbs溶液,继续培养24h后加入mtt;
对第(5)组癌细胞注入150μl浓度为1μg/ml的阿霉素pbs溶液,继续培养24h后加入mtt;
对第(6)组癌细胞注入150μl浓度为11.71μg/ml的中空介孔普鲁士蓝纳米粒子pbs溶液,继续培养4h后用808nm激光器照射5min,继续培养24h后加mtt;
对第(7)组癌细胞注入150μll浓度为13.89μg/ml的(losartan+dox)@hmpbspbs溶液,继续培养24h后加入mtt;
对第(8)组癌细胞注入150μl浓度为13.89μg/ml的(losartan+dox)@hmpbspbs溶液,继续培养4h后用808nm激光器照射5min,继续培养24h后加mtt;
用酶标仪检测上述8组癌细胞的存活率,结果如图4所示。
由图4可知,第(2)组~第(4)组和第(7)组的癌细胞存活率较高,即分别单独使用近红外激光照射、中空介孔普鲁士蓝纳米粒子、氯沙坦和(losartan+dox)@hmpbs,对癌细胞的杀伤力并不强,而(losartan+dox)@hmpbs与近红外激光照射结合(即与光热疗法结合)对癌细胞的杀伤力高于光热疗法(即第(6)组)和单纯化学疗法(即第(5)组),具有最高的癌细胞杀伤力,细胞存活率仅为3.7%。
采用上述方法对实施例2和3所得用于提高肿瘤组织渗透性的纳米粒子的细胞杀伤力进行检测,结果类似,细胞存活率分别达到4.5%和4.1%。
实施例6
将balb/c小鼠分为6组,分别计为(1)、(2)、(3)、(4)、(5)、(6)组;
将4t1细胞(1x106/50μl)接种于上述6组balb/c小鼠腋下,当肿瘤尺寸增长至120mm3时,通过尾静脉给小鼠注射不同的液体,每隔两天注射一次:
第(1)组注射200μl生理盐水,作为对照组;
第(2)组注射浓度为8.3mg/ml的氯沙坦pbs溶液,所述氯沙坦pbs溶液的注射量为8.3mg/kg(即每千克小鼠注射8.3mg氯沙坦);
第(3)组注射浓度为90mg/ml的(losartan+dox)@hmpbs(由实施例1制备得到)的pbs溶液,注射量以阿霉素的注射量计为7mg阿霉素/kg;
第(4)组注射浓度为90mg/ml的(losartan+dox)@hmpbs(由实施例1制备得到)的pbs溶液,注射量以阿霉素的注射量计为7mg阿霉素/kg,每次注射完成后,用808nm激光器照射6min;
第(5)组注射按照实施例1的方法不加氯沙坦制备的纳米粒子,即dox@hmpbs的pbs溶液,注射量以阿霉素的注射量计为7mg阿霉素/kg,每次注射完成后,用808nm激光器照射6min;
第(6)组注射浓度为80mg/ml的hmpbs的pbs溶液,注射量为200μl,每次注射完成后,用808nm激光器照射6min;
并每天检测小鼠体内的肿瘤体积,结果如图5所示。由图5可知,在培养小鼠的第18天,第(1)组小鼠肿瘤体积为800mm3、第(2)组小鼠的肿瘤体积为700mm3,抑瘤率为12.5%,第(3)组小鼠的肿瘤体积为664mm3,抑瘤率为16.8%,第(4)组小鼠的肿瘤体积为150mm3,抑瘤率为81.3%;第(5)组小鼠的肿瘤体积为252mm3,抑瘤率为68.5%、第(6)组小鼠的肿瘤体积为392mm3,抑瘤率为51.0%。
采用上述第(4)组的方法对实施例2和3所得用于提高肿瘤组织渗透性的纳米粒子的抑瘤率进行检测,结果类似,两者的抑瘤率分别是73.2%和69.5%。
实施例7
按照实施例6中第(4)组和第(5)组的方案培养balb/c小鼠,在培养18天后,将肿瘤解剖下来制作冷冻组织切片,再用正置荧光显微镜检测组织切片中阿霉素的分布,最后用imagej软件计算肿瘤组织切片中阿霉素(dox)和4',6-二脒基-2-苯基吲哚(dapi)的灰度值,结果如图6所示。图6中横坐标是肿瘤切片边缘到肿瘤切片中心的距离,纵坐标是灰度值,其中a为第(5)组培小鼠的冷冻组织切片,b为第(4)组小鼠的冷冻组织切片。由图6可以看到两幅图中dapi的灰度值并没有区别,但是a图中dox的灰度值在200以后就消失了,说明dox没有向肿瘤深处渗透,而b图中dox的灰度值一直存在,说明从表面到肿瘤切片深处一直都散布着dox,即本发明所提供的用于提高肿瘤组织渗透性的纳米粒子能够有效促进抗肿瘤药物向肿瘤组织渗透。
采用上述方法对实施例2和3所得用于提高肿瘤组织渗透性的纳米粒子的肿瘤组织渗透性进行检测,结果类似,阿霉素的渗透到了肿瘤切片的深处。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!