一种影响伊立替康所致小鼠腹泻和肠道菌群的富硒益生菌的制作方法
本发明属于微生物技术领域,具体地说,本发明涉及一种影响伊立替康所致小鼠腹泻和肠道菌群的富硒益生菌。
背景技术:
伊立替康(irinotecan,cpt-11)是一种衍生自喜树碱的化合物,广泛应用于各类肿瘤疾病治疗,如非小细胞肺癌、胃癌和直肠癌等。cpt-11进入体内后能迅速在胃肠道和肝脏组织中水解为活性化合物sn-38,sn-38在肝葡萄糖醛酸化过程中代谢为无活性代谢物sn-38葡糖苷酸(sn-38g),随后被输出到肠道。但是,sn-38g可被肠道细菌β-d-葡糖醛酸糖苷酶水解为sn-38,从而导致肠毒性。cpt-11还会造成脊髓抑制毒性、中性粒细胞和白细胞减少等不良反应。
双歧杆菌是活的肠道微生物,作为药物或食品补充剂有助于维持人类或其他宿主消化道的微量平衡,并且可以通过自身转化吸收微量元素,改变生理生化功能。微量元素硒(selenium,se)是人体必需元素,与蛋白质组成硒蛋白维持生理功能,与25-30种遗传特异性酶组成硒酶维持催化功能,在生物化学和生理学上具有重要作用。高通量筛选得到耐硒长双歧杆菌优势菌株,通过16srdna测序及核苷酸序列blast分析,表明长双歧杆菌dd98菌株是一株新的长双歧杆菌(cgmccno.16573)。
富硒长双歧杆菌是将长双歧杆菌dd98菌株接种于rcm改良培养基中,厌氧培养12h后,向培养基中加入亚硒酸钠,继续培养至24h,在高硒环境下发酵制备se-dd98,冷冻干燥48h后得到冻干菌粉。在此前公开的专利(cn108721337a)详细阐述了富硒长双歧杆菌的详细制备过程以及对肠道粘膜的保护作用。
由于cpt-11的不良反应限制其临床应用,因此本发明探究富硒长双歧杆菌dd98菌株对伊立替康所致小鼠腹泻和肠道菌群的影响。
技术实现要素:
本发明针对目前cpt-11临床应用的不良反应,提供一种影响伊立替康所致小鼠腹泻和肠道菌群的益生菌。建立伊立替康所致腹泻小鼠模型,通过长期灌胃给予富硒益生菌,能够抑制伊立替康所致的体重下降和免疫功能降低;降低小鼠腹泻发生率和平均腹泻等级,缓解伊立替康所致的小鼠腹泻;减少与β-d-葡糖醛酸糖苷酶相关的梭菌、大肠杆菌和拟杆菌含量,增加肠道内双歧杆菌含量;缓解伊立替康导致的小鼠肠道粘膜、细胞和腺体的损伤。
本发明具体实验方案如下:
小鼠分为正常对照组、cpt-11组、se-dd98低剂量组、se-dd98高剂量组。正常对照组和cpt-11组灌胃蒸馏水,se-dd98低剂量组灌胃菌粉(活菌数1×108cfu/kg),se-dd98高剂量组灌胃菌粉(活菌数1×109cfu/kg)。建立伊立替康腹泻模型。第0天到第24天,各组小鼠灌胃无菌水或者菌液;第18天,正常对照组腹腔注射无菌生理盐水,其余各组每只小鼠腹腔注射150mg/kgcpt-11;第17天和第24天,每组各取6只小鼠,考察生理生化指标及肠道菌群变化。
本发明所述的富硒益生菌是将长双歧杆菌dd98菌株接种于rcm改良培养基中,厌氧培养12h后,向培养基中加入亚硒酸钠,继续培养至24h,在高硒环境下发酵制备se-dd98,冷冻干燥48h后得到冻干菌粉。高通量筛选得到耐硒长双歧杆菌优势菌株,通过16srdna测序及核苷酸序列blast分析,表明长双歧杆菌dd98菌株是一株新的长双歧杆菌(cgmccno.16573)。此前公开专利(cn108721337a)已经详细阐述了富硒益生菌的制备过程。
本发明的第一方面,提供了富硒长双歧杆菌在制备药物中的应用,所述药物用于:
(1)伊立替康的辅助治疗:和/或;
(2)缓解伊立替康所致不良反应;
(3)调节肠道菌群。
在另一优选例中,所述药物用于缓解伊立替康所致的体重下降。
在另一优选例中,所述药物用于缓解伊立替康所致免疫功能降低。
在另一优选例中,所述药物用于降低小鼠腹泻发生率和平均腹泻等级,缓解伊立替康所致的小鼠腹泻。
在另一优选例中,所述药物用于降低肝脏谷草转氨酶和谷丙转氨酶,缓解伊立替康所致小鼠肝脏毒性。
在另一优选例中,所述肠道菌群包括:梭菌、大肠杆菌、拟杆菌含量和双歧杆菌。
在另一优选例中,所述药物用于调节伊立替康注射前后的正常小鼠肠道菌群。
在另一优选例中,所述药物用于缓解伊立替康导致的小鼠肠道粘膜、细胞和腺体的损伤。
在另一优选例中,所述富硒长双歧杆菌为富硒长双歧杆菌dd98菌株。
本发明的第二方面,提供了一种富硒益生菌菌粉,所述富硒益生菌菌粉为富硒长双歧杆菌dd98菌株活菌粉。
在另一优选例中,所述富硒长双歧杆菌为液体制剂、粉剂或片剂。
在另一优选例中,所述富硒长双歧杆菌中含硒量为0.349μg/mg。
在另一优选例中,所述富硒长双歧杆菌中活菌数为5.2×108cfu/g。
本发明的第三方面,提供了一种预防和/或治疗伊立替康所致肠道紊乱的方法,所述方法包括步骤;给需要的对象使用预防和/或治疗有效量的富硒长双歧杆菌。
在另一优选例中,所述对象为肿瘤患者。
在另一优选例中,所述肠道菌群紊乱为伊立替康引起的肠道菌群变化。
在另一优选例中,所述富硒长双歧杆菌的使用剂量为1×108~1×1010cfu/kg,优选为1×109cfu/kg。
在另一优选例中,所述对象为人。
在另一优选例中,所述方法中在伊立替康治疗前给需要的对象使用预防和/或治疗有效量的富硒长双歧杆菌。
在另一优选例中,所述方法中在伊立替康治疗前18天给需要的对象使用预防和/或治疗有效量的富硒益生菌;优选地,每次使用剂量为1×108cfu/kg;更优选地,每次使用剂量为1×109cfu/kg。
本发明优点:
1.本发明采用动物实验模型,探究长期给予富硒益生菌,对正常动物的体重、腹泻、免疫指标、肝脏指标、肠道菌群和回肠结构的影响;
2.本发明通过小鼠腹腔注射cpt-11,探究富硒益生菌对cpt-11所致不良反应的影响,其不良反应包括体重变化、腹泻发生、免疫能力降低、肠道菌群和回肠结构的变化;
3.本发明提供了一种影响伊立替康所致小鼠腹泻和肠道菌群的富硒益生菌,为cot-11的临床应用提供新思路。
附图说明
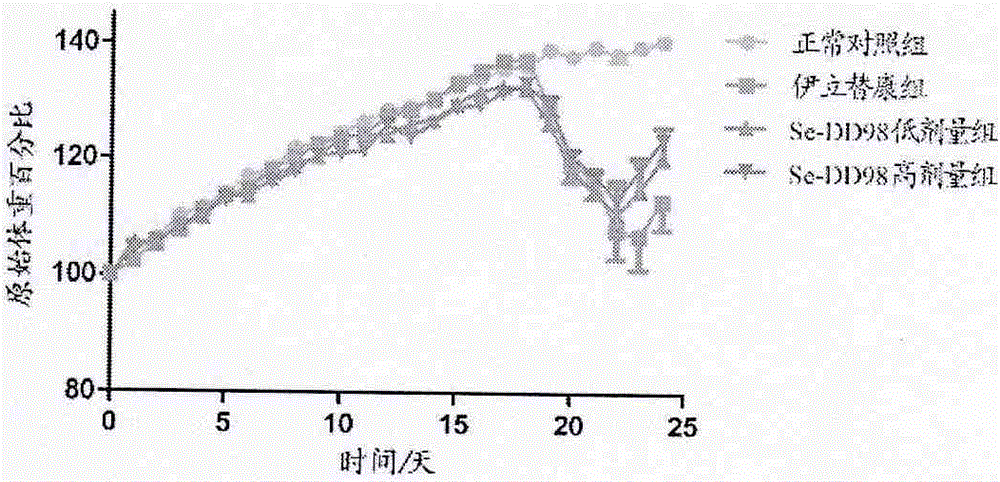
图1为本发明实施例2中小鼠原始体重百分比变化曲线。
图2为本发明实施例3中富硒益生菌对小鼠腹泻发生率的影响曲线。
图3为本发明实施例6中富硒益生菌对小鼠肠道菌群的影响对比图(图注:a梭菌;b大肠杆菌;c拟杆菌;d双歧杆菌)。
图4为本发明实施例7中富硒益生菌对小鼠回肠组织结构的影响对比图(图注:a第17天正常对照组;b第17天伊立替康组;c第17天se-dd98低剂量组;d第17天se-dd98高剂量组;e第24天正常对照组;f第24天伊立替康组;g第24天se-dd98低剂量组;h第24天se-dd98高剂量组)。
具体实施方式
下面结合实施例对本发明作进一步详细描述,但是本发明不限于所给出的例子。
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实例。
实施例1se-dd98的制备
本发明所用长双歧杆菌dd98菌株(bifidobacterium.longumdd98),提取细菌基因组dna后,采用细菌的16s通用引物进行扩增,扩增获得该细菌的16srdna基因序列,该序列如seqidno:1所示。
通过使用16srdna测序和核苷酸序列blast分析,所述菌株与目前已知的其它所有长双歧杆菌的相应序列皆不完全相同,但具有一定的同源性。经糖发酵特性分析,与《伯杰氏细菌鉴定手册》比较,进一步证实所述菌株属于长双歧杆菌,但其与标准菌株长双歧杆菌jcm11342(其16srdna序列参见genebank编号:lc306854.1)比较16srdna序列的结果显示,本发明的菌株与所述标准菌株存在序列上的不同。因此可见,本发明的菌株是一种以往未被分离的新的长双歧杆菌。
rcm(改良)培养基:牛肉膏1%,蛋白胨0.5%,酵母粉0.3%,葡萄糖0.6%,氯化钠0.5%,无水乙酸钠0.3%,l-半胱氨酸盐酸盐0.05%,琼脂1.5%~1.8%。
培养方法:将长双歧杆菌dd98接种于培养基中活化24h,然后接种到种子培养基中培养12h,将种子液按照5%(v/v)接种到发酵培养基中培养至16h后,将发酵罐中的发酵液放出部分,然后开始补料(含亚硒酸钠)继续培养12h,最终在高硒环境下发酵制备se-dd98。补料结束后收集se-dd98菌液,14000r/min高速离心10min,弃去上清,离心后菌体用无菌生理盐水(0.9%)清洗三次,得到浓缩的se-dd98。se-dd98浓缩菌液放入冻干机中,冷冻干燥48h后得到冻干se-dd98菌粉,密封保存于4℃。
se-dd98菌粉中硒含量的检测方法参考国标gb5009.93-2010《食品中硒的测定》。
se-dd98菌粉中活菌数测定:准确称取适量菌粉于1.5ml离心管中,向离心管中加入1.0ml的无菌生理盐水,涡旋振荡至完全溶解,采用梯度稀释法至合适的稀释度,进行平板涂布,37℃厌氧培养48h,待菌落清晰可见且菌落大小适宜时取出进行活菌计数。
活菌数(cfu/g)=(3个平皿菌落数之和)/3*10*最终稀释度/菌粉重量。
表1英文缩写词表
实施例2小鼠体重变化
小鼠随机分为4组,每组12只,分别为正常对照组、cpt-11组、se-dd98低剂量组、se-dd98高剂量组。正常对照组和cpt-11组灌胃蒸馏水,se-dd98低剂量组灌胃菌粉(活菌数1×108cfu/kg),se-dd98高剂量组灌胃菌粉(活菌数1×109cfu/kg),0.2ml/10g,1次/天。建立伊立替康腹泻模型。第0天到第24天,各组小鼠灌胃无菌水或者菌液;第18天,正常对照组腹腔注射无菌生理盐水,其余各组每只小鼠腹腔注射150mg/kgcpt-11,注射体积0.1ml/10g;第17天和第24天,每组各取6只小鼠,考察生理生化指标及肠道菌群变化。实验开始后每天早上9:00观察小鼠状态,测量各组小鼠体重并记录。
表2实验分组及给药
表3小鼠在18天到24天的原始体重百分比
表注:与正常组比较,*p<0.05,**p<0.01;与伊立替康组比较,△p<0.05,△△p<0.01;与低剂量比较,#p<0.05,##p<0.01。
以上研究结果表明:
1.图1显示,伊立替康组、se-dd98低剂量组和高剂量组小鼠的原始体重百分比在第18天注射伊立替康后均呈现先下降后回升的趋势;
2.表3结果显示,注射伊立替康后,伊立替康组、se-dd98低剂量组和高剂量组的原始体重百分比均显著降低(p<0.05或p<0.01)。但与伊立替康组比较,se-dd98低剂量组和高剂量组的原始体重百分比前期显著降低(p<0.05或p<0.01),后期显著升高(p<0.05或p<0.01),且se-dd98高剂量组的原始体重百分比显著高于低剂量组(p<0.05或p<0.01);
3.结果表明,伊立替康会造成小鼠体重下降,而长期预防给予se-dd98菌粉能够抑制伊立替康造成的体重下降,并且存在剂量依赖性。
实施例3小鼠腹泻发生率和腹泻等级评价
各组小鼠在伊立替康注射24h后,分别在48、72、96、120和144h观察小鼠腹泻情况并进行腹泻评分。
表4小鼠腹泻评价标准
表5se-dd98对伊立替康所致腹泻小鼠平均腹泻等级的影响
表注:与正常组比较,*p<0.05,**p<0.01;与伊立替康组比较,△p<0.05,△△p<0.01。
结论:
1.图2结果显示,伊立替康组和se-dd98低剂量组腹泻发生率随着时间而变化,呈现先逐渐上升,后期下降后保持不变的趋势。se-dd98高剂量组在48h下降后保持不变,但se-dd98高、低剂量组的腹泻发生率均低于伊立替康组;
2.表5结果显示,伊立替康组和se-dd98高、低剂量组的平均腹泻等级也显示随时间而变化,出现先升高后下降的现象。伊立替康组在各时间点的平均腹泻等级均显著高于正常对照组(p<0.05或p<0.01)。se-dd98低剂量组在最后时间点,se-dd98高剂量组在中后期的各时间点的平均腹泻等级均显著低于伊立替康组(p<0.05或p<0.01);
3.结果表明,伊立替康会导致小鼠不同程度的腹泻且平均腹泻等级呈现先升高后下降的现象,预防给予se-dd98菌粉能够降低小鼠腹泻发生率和平均腹泻等级,缓解伊立替康所致的小鼠持续腹泻。
实施案例4小鼠脾脏指数和外周血常规指标测定
第17天和第24天,各组小鼠随机取出6只并称重,采用眼内眦法采集血液至含肝素的抗凝管中,上下颠倒混匀,用于外周血常规检测。采用颈椎脱臼法处死小鼠,冰上操作,取出脾脏并称重,按照公式脏器指数=脏器质量(mg)/体质量(g)计算脾脏指数。
表6se-dd98对伊立替康所致腹泻小鼠免疫指标的影响
表注:与正常组比较,*p<0.05,**p<0.01;与伊立替康组比较,△p<0.05,△△p<0.01。
结论:
1.实验数据表明,第17天(伊立替康注射前),各组小鼠的脾脏指数、白细胞指数、淋巴细胞指数和中性粒细胞指数均没有显著差异。第24天(伊立替康注射后),与正常对照组比较,伊立替康组的脾脏指数和白细胞数目均显著降低(p<0.01)。与伊立替康组比较,se-dd98低剂量组的脾脏指数和中性粒细胞指数均显著升高(p<0.05),se-dd98高剂量组的脾脏指数、白细胞指数和中性粒细胞均显著升高(p<0.05或p<0.01);
2.结果表明,伊立替康注射前,长期预防给予se-dd98菌粉对小鼠免疫功能没有影响。伊立替康注射后造成小鼠免疫功能下降,而预防给予se-dd98菌粉能够提高小鼠免疫功能。由此推知,se-dd98菌粉能够缓解伊立替康所致的机体免疫下降,增强免疫功能。
实施例5小鼠肝脏指数和alt、ast指标测定
第17天和第24天,各组小鼠随机取出6只并称重,采用眼内眦法采集血液至含不含肝素的离心管中,静置1h后,6000rpm离心10分钟,取上清得到血清,按照alt和ast试剂盒操作,在全自动生化分析仪检测。采用颈椎脱臼法处死小鼠,冰上操作,取出肝脏并称重,按照公式脏器指数=脏器质量(mg)/体质量(g)计算脾脏指数。
表7se-dd98对伊立替康所致腹泻小鼠肝脏指标的影响
表注:与正常组比较,*p<0.05,**p<0.01;与伊立替康组比较,△p<0.05,△△p<0.01;与se-dd98低剂量组比较,#p<0.05,##p<0.01。
由上述结果可知:
1.实验数据表明,第17天(伊立替康注射前),与正常对照组比较,se-dd98高剂量组的肝脏指数显著降低(p<0.01)。与伊立替康组比较,se-dd98低剂量组和高剂量组的肝脏指数均显著降低(p<0.01)。各组小鼠的白细胞指数、淋巴细胞指数和中性粒细胞指数均没有显著差异。第24天(伊立替康注射后),与正常对照组比较,伊立替康组的肝脏指数显著降低(p<0.01),se-dd98高剂量组的alt显著降低(p<0.01),伊立替康组、se-dd98低剂量组和高剂量组的ast均显著降低(p<0.01)。与伊立替康组比较,se-dd98低剂量组和高剂量组的ast均显著降低(p<0.01)。与se-dd98低剂量组比较,se-dd98高剂量组显著降低(p<0.01);
2.结果表明,伊立替康注射前,长期预防给予se-dd98菌粉对肝脏指数有影响。伊立替康注射后造成小鼠肝脏指数和ast下降,而预防给予se-dd98菌粉能够改善小鼠肝脏功能。由此推知,se-dd98菌粉能够缓解伊立替康所致的肝脏指标下降,增强肝脏功能。
实施例6小鼠肠道微生物相对丰度测定
采用颈椎脱臼法处死小鼠,冰上操作,取出0.2g盲肠内容物装入干净的ep管中,放入-80℃冰箱冻存。使用粪便基因dna提取试剂盒提取粪便总dna,超微量紫外分光光度计测定dna浓度并稀释。使用荧光定量qpcr测定拟杆菌、长双歧杆菌、乳杆菌、梭菌和大肠杆菌的相对丰度,ct检测限为40个循环。
表8qpcr引物设计
表9qpcr反应体系
表10qpcr反应条件
结论:
1.拟杆菌、梭菌和大肠杆菌能够增强β-d-葡糖醛酸糖苷酶的活性,促使肠道内非活性化合物sn-38g转化为活性化合物sn-38,从而加剧小鼠腹泻。kulkarni课题组研究表明[24],饮食中的长双歧杆菌能够影响某些与β-d-葡糖醛酸糖苷酶相关的肠道微生物菌群的代谢活性;
2.图3结果显示,第17天(伊立替康注射前),与正常对照组比较,se-dd98组的梭菌、大肠杆菌和拟杆菌相对丰度显著减少(p<0.05或p<0.01);而双歧杆菌相对丰度显著增加(p<0.01)。与伊立替康组比较,se-dd98组的大肠杆菌、拟杆菌相对丰度显著降低(p<0.01);双歧杆菌相对丰度显著升高(p<0.01)。se-dd98低剂量组和高剂量组的拟杆菌的减少和双歧杆菌的增加呈剂量依赖性;
3.第24天(伊立替康注射后),与正常对照组比较,伊立替康组的梭菌和拟杆菌显著增加(p<0.01)、大肠杆菌和双歧杆菌显著减少(p<0.01);se-dd98低剂量组和高剂量组的大肠杆菌、拟杆菌显著减少(p<0.01),而梭菌和双歧杆菌显著增加(p<0.01)。与伊立替康组比较,se-dd98低剂量组和高剂量组的梭菌、大肠杆菌和拟杆菌相对丰度显著减少(p<0.01),而双歧杆菌显著增加(p<0.01)。se-dd98低剂量组和高剂量组的拟杆菌的减少和双歧杆菌的增加呈剂量依赖性(图3);
4.上述结果表明,伊立替康注射后导致小鼠肠道内与β-d-葡糖醛酸糖苷酶相关的梭菌和拟杆菌相对丰度增加。长期预防给予se-dd98菌粉能够降低小鼠肠道内的梭菌、大肠杆菌和拟杆菌相对丰度,增加长双歧杆菌相对丰度。由此推知,se-dd98菌粉能够减少与β-d-葡糖醛酸糖苷酶相关的肠道菌含量,增加双歧杆菌含量。
实施例7小鼠回肠组织苏木精-伊红(hematoxylinandeosin,he)染色
采用颈椎脱臼法处死小鼠,距回盲瓣5cm处获取回肠组织,0.9%生理盐水冲洗干净,福尔马林固定24h。将石蜡组织切片脱蜡至水,水洗3次,每次2分钟;将切片置于苏木素液中浸染5分钟,之后水洗1分钟;盐酸酒精分化30秒之后,流水冲洗5分钟;伊红染液浸染3分钟,之后流水冲洗30秒;逐级乙醇脱水,最后用二甲苯透明,中性树胶封片固定后,于光学显微镜下观察。
结果分析:
1.图4结果显示,第17天(伊立替康注射前),各组小鼠的小肠肠壁各层结构完好,无溃疡形成,腺体大小、形态、分布正常,肠壁未见炎细胞浸润。第24天(伊立替康注射后),与正常对照组比较,伊立替康组小肠粘膜变薄、粘膜上皮细胞变性、坏死、脱落,见大量炎细胞浸润,腺体有萎缩,肠腺减少。与伊立替康组比较,se-dd98低剂量组和高剂量组部分粘膜上皮细胞变性、坏死、脱落,少量炎细胞浸润;
2.结果表明,伊立替康会导致小鼠回肠粘膜变薄、粘膜细胞变性以及腺体萎缩等损伤。长期预防给予se-dd98菌粉对正常小鼠回肠粘膜、细胞和腺体无影响,但能够缓解由伊立替康导致的肠道粘膜、细胞和腺体的损伤。
序列表
<110>江苏德禧生物科技有限公司;上海交通大学
<120>一种影响伊立替康所致小鼠腹泻和肠道菌群的富硒益生菌
<130>2019
<160>1
<170>siposequencelisting1.0
<210>2
<211>1227
<212>dna
<213>长双歧杆菌dd98(bifidobacteriumlongumdd98)
<400>2
cggagtctacttagacggctcatcccacaaggggttaggccaccggcttcgggtgctgcc60
cactttcatgacttgacgggcggtgtgtacaaggcccgggaacgcattcaccgcgacgtt120
gctgattcgcgattactagcgactccgccttcacgcagtcgagttgcagactgcgatccg180
aactgagaccggttttcagggatccgctccgcgtcgccgcgtcgcatcccgttgtaccgg240
ccattgtagcatgcgtgaagccctggacgtaaggggcatgatgatctgacgtcatcccca300
ccttcctccgagttaaccccggcggtcccccgtgagttcccggcataatccgctggcaac360
acggggcgagggttgcgctcgttgcgggacttaacccaacatctcacgacacgagctgac420
gacgaccatgcaccacctgtgaacccgccccgaagggaagccgtatctctacgaccgtcg480
ggaacatgtcaagcccaggtaaggttcttcgcgttgcatcgaattaatccgcatgctccg540
ccgcttgtgcgggcccccgtcaatttctttgagttttagccttgcggccgtactccccag600
gcgggatgcttaacgcgttagctccgacacggaacccgtggaacgggccccacatccagc660
atccaccgtttacggcgtggactaccagggtatctaatcctgttcgctccccacgctttc720
gctcctcagcgtcagtaacggcccagagacctgccttcgccattggtgttcttcccgata780
tctacacattccaccgttacaccgggaattccagtctcccctaccgcactcaagcccgcc840
cgtacccggcgcggatccaccgttaagcgatggactttcacaccggacgcgacgaaaccg900
cctacgagccctttacgcccaataattcccggataacgcttgcaccctacgtattaccgc960
ggctgctggcacgtagttagccggtgcttattcaacgggtaaactcactctcgcttgctc1020
ccgataaaagaggttacaacccgaaggcctccatccctcacgcggcgtcgctgcatcagg1080
cttgcgcccattgtgcaatattcccccactgctgcctcccgtagagtctggacgtattcc1140
tcagtccatgtgacatcgcccctcttcagtcggctacgttcgaagcctacgggtgggccg1200
tagccggcgttcaagcctggtatatag1227
- 还没有人留言评论。精彩留言会获得点赞!