氯离子通道抑制剂兰雪醌在抗腹泻药物中的应用的制作方法
本发明涉及医药领域,具体地说,涉及兰雪醌对氯离子通道的抑制作用及其在细菌性和病毒性腹泻治疗中的应用。
背景技术:
腹泻是一类严重威胁人类健康的疾病,在世界范围内特别是在儿童和老人中有较高的病发率和死亡率。根据2015年的不完全统计,全世界约有577,000的5岁以下儿童及502,000的70岁以上老人死于分泌型腹泻。在发展中国家,引起腹泻的肠道致病菌主要为霍乱弧菌和致病性大肠杆菌,致病病毒主要为轮状病毒及肠侵袭性病毒。
肠道是人体重要的消化器官,主要的生理功能涉及物质吸收、肠液分泌和肠运动等生理过程。液体在肠道和血液间的流动主要受na+、cl-、hco3-和k+及葡萄糖等溶质的驱动。肠道液体分泌主要是通过基底膜和顶膜的cl-通道和转运蛋白对cl-的分泌实现的。参与肠液分泌的cl-通道主要有囊性纤维化跨膜电导调节剂(cftr)和钙激活氯离子通道(cacc)。霍乱弧菌及产肠毒素型大肠杆菌分泌的霍乱毒素和耐热性大肠杆菌内毒素可以升高细胞内camp、cgmp和ca2+水平,而这些分子均可以激活cftr活性。细菌也能升高体液中各种受体激动剂、神经递质及神经肽受体水平例如5-羟色胺(5-ht),血管活性肠肽(vip)和甘丙肽i型受体,从而激活肠道细胞对cl-的分泌。轮状病毒感染可导致液体分泌并使肠道上皮结构发生变化,引发与年龄相关的分泌型腹泻。每年全球约有50万婴幼儿死于轮状病毒腹泻,在我国,因轮状病毒感染住院的婴幼儿约占全部由于急性胃肠病住院的婴幼儿的40%。目前研究表明轮状病毒产生的非结构性蛋白(nsp4)通过与膜受体(integrinα1β2)结合,或通过丙甘肽与受体结合,或刺激肠道神经,引起胞浆内ca2+浓度升高,通过细胞表面的cacc产生cl-分泌而引起腹泻。除了液体分泌机制外,cl-通道也参与肠动力的调节。tmem16a作为一种已知的cacc在肠道间质cajal细胞(icc)具有很高的表达量。icc的主要功能是作为起搏点,参与胃肠道电慢波的产生和传导,构成了感觉神经与平滑肌细胞之间的纽带。正常的肠道肌肉的收缩功能主要依赖于肠神经系统(ens)和icc的协调活性,多种消化道动力障碍性疾病与icc异常密切相关,例如:巨结肠、便秘、长期胰岛素依赖型糖尿病患者常出现的腹痛、便秘等并发症。研究显示tmem16a蛋白在鸟类,非人灵长类以及人类胃肠道所有部位的icc都有特异性的表达,cacc阻断剂尼氟灭酸和dids能够以剂量依赖的方式减弱胃和小肠收缩频率,阻断慢波产生。tmem16a选择性抑制剂能够明显减弱小鼠肠段平滑肌收缩,而tmem16a激活剂则增强收缩,并能恢复阿托品抑制后的小肠收缩力。tmem16a功能缺失使小鼠胃肠道无法形成慢波,但不影响icc网络的形成。上述结果证明了tmem16a在胃肠道慢波产生和平滑肌收缩性调节中的基础性作用。
鉴于cl-通道激活可能是多种腹泻产生的共同机制,因此从组合化学小分子库中筛选针对不同cl-通道的抑制剂成为了腹泻治疗和防治研究的热点,目前已经发现了一些分属不同结构家族的小分子抑制剂,部分抑制剂已经应用于临床疾病治疗。
技术实现要素:
为弥补现有技术的空白,本发明提供了一种氯离子通道抑制剂兰雪醌(plumbagin)在制备抗腹泻药物、肠动力异常疾病药物中的应用。
本发明的发明构思是:天然小分子具有结构多样、生物活性高、结构相对稳定、生物利用率高、毒副作用小等特点,本发明的发明人从天然小分子库中发现了兰雪醌,兰雪醌在转染tmem16a的frt细胞顶膜侧抑制了cl-电流,其具有tmem16a抑制活性。本发明首次利用多种手段在体外研究了兰雪醌对cftr和肠上皮cacc的调节活性,利用离体小鼠肠组织对兰雪醌的肠液分泌和肠动力调节进行了系统分析,最终在多种小鼠腹泻模型上证明了兰雪醌的抗腹泻作用,提示兰雪醌将在临床抗腹泻治疗方面具有较高的应用价值。
化合物兰雪醌具有如下结构:
经本发明实验证实天然的cl-通道抑制剂兰雪醌对结肠癌ht-29细胞上cacc和cftr活性具有抑制作用。
兰雪醌降低了大肠杆菌热稳定性肠毒素(sta)和霍乱毒素(ct)诱导的肠液分泌。
在霍乱毒素新生小鼠腹泻模型上,兰雪醌的抑制腹泻率>40%,在轮状病毒诱导的新生小鼠腹泻模型上兰雪醌的抑制腹泻率为50%。
兰雪醌显著抑制肠道运动,增加肠道液体吸收时间;抑制肠道平滑肌收缩力,但对收缩频率无明显影响。
因此,兰雪醌及其药学上的可用盐被制成口服剂作为用于制备抗腹泻和肠动力异常相关疾病的药物的用途。
上述疾病或病症包括:治疗肠动力紊乱、霍乱毒素引起的腹泻或轮状病毒腹泻等。
本发明发现了兰雪醌的一个新的药理学活性,即通过抑制cl-通道活性可抑制肠道病原体诱导的肠液分泌和肠道蠕动增强。兰雪醌可以作为一种先导化合物,用于霍乱毒素引起的腹泻、旅行者腹泻、轮状病毒腹泻以及其他类型的分泌性腹泻的治疗。
附图说明
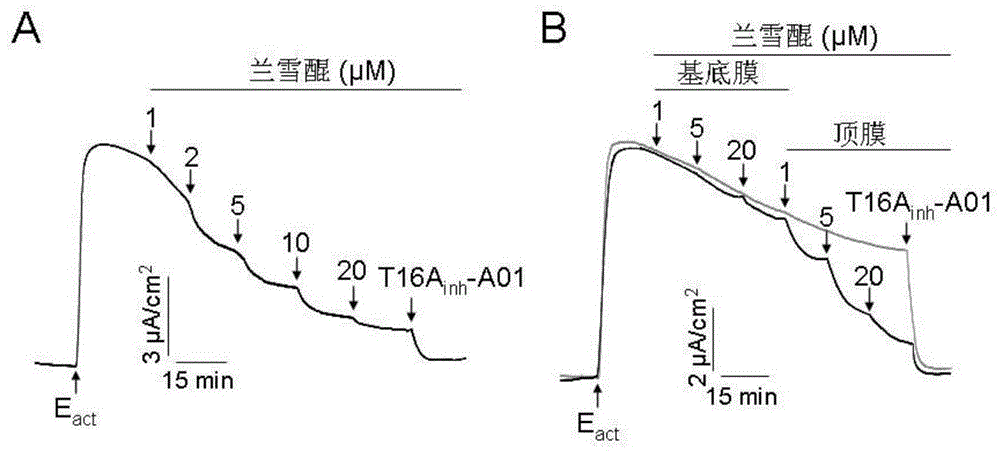
图1兰雪醌对tmem16a抑制作用的短路电流测定;
图2兰雪醌对肠上皮cacc和cftr抑制作用的短路电流测定;
图3兰雪醌抑制离体肠管内由sta和ct诱导的肠液分泌;
图4兰雪醌抑制霍乱毒素和轮状病毒侵染诱导的新生小鼠腹泻;
图5兰雪醌对肠动力的抑制作用。
具体实施方式
为了更好地解释本发明的技术方案,下面将结合实例对本发明的具体实施方式作进一步详细描述。以下实例用于说明本发明,但不用来限制本发明的范围。本发明所使用的兰雪醌标准品购自大连美仑生物技术有限公司。具体信息如下:兰雪醌纯度hplc≥98%;分子式:c11h8o3;分子量:188.18。
实施例1兰雪醌对tmem16a抑制作用的短路电流测定
将生长在snapwell的insert(1.12cm2表面积)上的稳定表达tmem16a的frt细胞安装在ussingchamber(美国生理仪器公司)中。frt细胞沐浴在碳酸盐缓冲液中(顶端侧缓冲液包含:65mmnacl,65mmna-gluconate,2.7mmkcl,1.5mmkh2po4,0.5mmmgcl2,2mmcacl2,10mmhepes和10mmglucose,ph7.4;基底膜侧缓冲液包含:130mmnacl,2.7mmkcl,1.5mmkh2po4,0.5mmmgcl2,2mmcacl2,10mmhepes和10mmglucose,ph7.4),30min后,使用250μg/ml两性霉素b将frt细胞的基底膜通透。短路电流数值通过vccmc6多通道电压/电流钳测量,并使用acquireandanalysis2.3((worldprecisioninstruments,美国)进行记录。实验结果如图1所示,tmem16a选择性激活剂t16ainh-a01能够激活tmem16a的通道开放,表现出cl-电流升高现象,兰雪醌(1~20μm)能够以剂量依赖方式抑制tmem16a介导的clˉ电流(图1a)。基底膜测使用兰雪醌(1和5μm)对clˉ电流没有抑制作用,20μm兰雪醌产生轻微的抑制;而在顶膜侧添加兰雪醌(1、5和20μm)却完全抑制了clˉ电流(图1b),证明了兰雪醌通过与tmem16a直接作用而抑制其tmem16a通道活性。
实施例2兰雪醌对肠上皮cacc和cftr抑制作用的短路电流测定
将生长在snapwell的insert(1.12cm2表面积)上的结肠癌ht-29细胞安装在ussingchamber中。ht-29细胞的顶膜和基底膜小室中加入相同的碳酸盐缓冲液(119mmnacl,0.6mmkh2po4,2.4mmk2hpo4,1.2mmmgcl2,1.2mmcacl2,21mmnaco3和10mmglucose,ph7.4),短路电流数值通过vccmc6多通道电压/电流钳测量,并使用acquireandanalysis2.3(worldprecisioninstruments,美国)进行记录。结果如图所示,atp可通过细胞膜上p2y受体刺激细胞钙库释放ca2+,进而激活cacc活性。ht-29细胞顶膜测加入兰雪醌(1~20μm)可抑制atp诱导的clˉ电流(图2a)。cpt-camp(非水解性、可渗透细胞内的camp类似物)被添加到细胞外液中可以穿透细胞膜进入细胞内,快速提升camp水平进而激活cftr通过开放,细胞顶膜侧应用兰雪醌可抑制cftr介导的clˉ电流(图2b)。
实施例3兰雪醌抑制离体肠管内由sta和ct诱导的肠液分泌
雄性c57小鼠(8~10周龄)在本实验前禁食不禁水饲养24h,实验时,小鼠通过腹腔注射戊巴比妥钠(40mg/kg)麻醉,经腹部小切口后,用缝合线分离出4个闭合的中段空肠(每段约15mm)。向结扎的肠段内分别注入100μl生理盐水,100μl盐水含有sta(0.1μg)或ct(1μg),100μl盐水含有sta(0.1μg)+兰雪醌(20μm)或ct(1μg)+兰雪醌(20μm),用缝合线缝合腹部切口,让小鼠从麻醉中恢复。4h后,腹腔内过量戊巴比妥钠(100mg/kg)处死小鼠,取出各肠段,肠液分泌量按肠管重量/长度计算,数据以mean±ses表示并通过graphpadprism7软件进行组件差异的统计,p<0.05代表有显著性差异,以**表示。结果如图3所示,在已建立的sta和ct诱导的肠道分泌物模型中,与生理盐水处理的肠段相比,sta和ct处理肠段内的液体积累量显著增加,而同时注射兰雪醌的肠段内的液体积累量明显减少,其作用效果与已知的cftr抑制剂cftrinh-172的效果相似。
实施例4兰雪醌抑制霍乱毒素和轮状病毒侵染诱导的新生小鼠腹泻
新生儿c57小鼠(3-4天)灌胃3μgct或25μl(1.2×107pfu/ml)猴sa-11轮状病毒。在ct诱导的小鼠腹泻模型中,小鼠在灌胃ct前8h以及灌胃ct后的两天内灌胃0.4μg兰雪醌,每天两次。在轮状病毒诱导的小鼠腹泻模型中,治疗组小鼠在接种轮状病毒后的3天内每天灌胃1次兰雪醌。粪便含水量以水印迹法测量,具体操作为轻揉小鼠腹部以促进小鼠排便,将粪便塞入聚二甲基硅氧烷平板的小孔内(高1.5mm、直径1mm、粪便体积为1.17mm3),将圆柱形粪便通过金属推杆推出并置于醋酸纤维素膜上,使粪便在潮湿环境中与膜接触2min。通过体式显微镜观察粪便在膜上留下的水印并通过数码相机记录图像,使用imagej软件测量水印面积,以此评价小鼠粪便含水量。结果如图4所示,与正常小鼠相比,灌胃ct和接种轮状病毒小鼠的粪便含水量明显升高,尤其是在ct感染后第1天和第2天,以及轮状病毒接种后第2天和第3天,而通过灌胃给予兰雪醌治疗小鼠的粪便含水量均有不同程度的减少,且在ct感染后第1天和第2天,以及轮状病毒接种后第2天和第3天粪便含水量减少的最为明显。
实施例5兰雪醌对肠动力的抑制作用
在肠动力测定前c57(8~10周龄)禁食不禁水饲养24h,然后通过灌胃方式给予生理盐水、eact(tmem16a激活剂)、兰雪醌或eact+兰雪醌。15min后,小鼠灌胃炭0.2ml10%活性炭粉(悬浮于5%阿拉伯胶中),30分钟后处死小鼠,分离全肠。蠕动指数(%)=活性炭移动距离/十二指肠至盲肠的距离×100。在平滑肌收缩实验中,将回肠从麻醉小鼠体内取出,用冰凉的碳酸氢盐溶液清洗以清除肠道内容物。将回肠段(~10mm)与拉力传感器连接,并在碳酸氢盐溶液中平衡60min,维持静拉力1mm,每20min更换一次缓冲液。利用组织器官灌流系统dmt750tobs连续监测张力,并使用750tobs软件(丹麦dmt公司)进行分析。图5a显示,灌胃兰雪醌后,活性炭在成年小鼠肠道蠕动指数为50.1%,低于生理盐水组(66.2%)。由于eact可通过激活tmem16a介导的肠道节律收缩促进胃肠蠕动,因此将eact设为阳性对照。腹腔内注射eact(50μm)后,蠕动指数上升到83.2%,该效果被兰雪醌逆转至蠕动指数为56.5%,且接近于正常生理水平。在离体肠段上进行的平滑肌收缩实验对兰雪醌的肠动力调节机制进行了进一步验证。正常成年小鼠离体回肠段收缩表现为协调收缩力和自发节律性,而使用兰雪醌处理后2min后,肠段收缩力明显下降。此外,在处理3min后,肠段的节律性和协调性逐渐丧失(图5b)。张力记录的分析显示,与正常肠段相比,经兰雪醌处理的肠段的收缩力明显较低,但收缩频率无明显差异(图5c)。
- 还没有人留言评论。精彩留言会获得点赞!