用于检测生物电信号的电极的制作方法
本发明涉及一种用于检测生物电信号的电极、一种用于制造用于检测生物电信号的电极的方法以及一种包括这样的电极的耳装置。
背景技术:
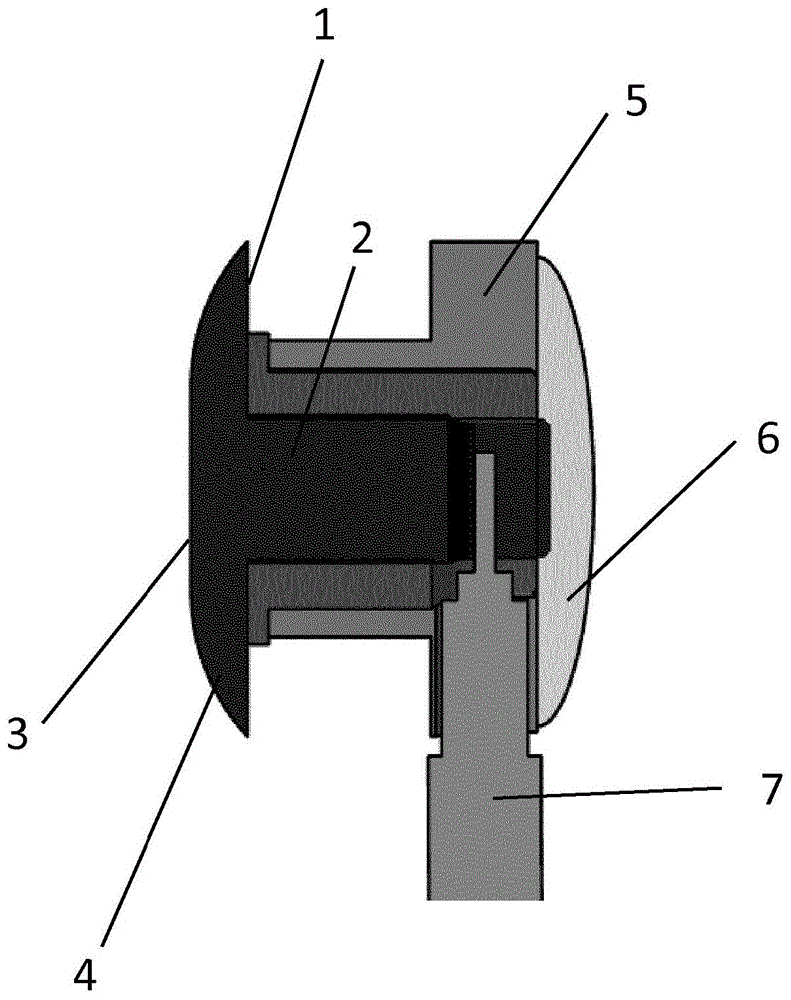
:在此将生物电信号理解为源自活体的电位差。众所周知的示例是心电图(ecg)信号和脑电图(eeg)信号。通常将用于检测耳朵处生物电信号的耳部部件用于检测eeg信号,但也可以应用于检测诸如ecg、眼电图(eog)或肌肉活动的其他生物电信号。eeg信号是由人的大脑活动产生的电信号。近年来,已经设计了可以由被监测者连续携带或佩戴的eeg监测系统。目标是拥有个人可穿戴式eeg监测器,即使携带数月或数年,其携带起来也不会比眼镜或现代小型助听器带来更多麻烦。这样的eeg监测器可以用于不同的目的。一个示例是监控人的状况,例如用于在满足预定条件的情况下提供警报或信息。该监测器还可以应用于数据收集(例如用于诊断用途或研究使用)。应用示例是用于监控患有糖尿病或癫痫的人。另一示例是作为助听器的控制或调节的输入。此外,近年来,经颅神经刺激内有许多活动(例如tdcs和tacs)。在此,电极不仅用于记录电信号,还用于神经刺激。另一应用可以是皮肤电反应(gsr)的测量。此外,也可以使用耳装置测量源自颅神经和脑干中神经活动的电位。这例如与听力损失的评估有关,其中常见的是测量来自颅神经(颅神经8)和脑干的反应(如听觉脑干的反应)。但是,其也可以与测量来自在外耳中分支的例如迷走神经(颅神经10)的反应或刺激有关。这可以例如与癫痫病有关。从wo2011/000383a1中获知在耳道中测量eeg信号,其公开一种具有eeg电极的耳塞,其中耳塞的形状根据使用者的耳道单独匹配或定制。wo2007/047667a2公开一种由可压缩材料制成并提供有eeg耳道电极的耳塞。外耳电极布置在佩戴在耳朵后面的测量设备上。由此,测量设备的壳体被成形/定制为个人耳朵的弯曲轮廓。通常已知的是,特别是在医学领域内,通过将电极放置在对象的头皮上测量脑电波,希望使用合适的装备测量该对象的脑电波、处理和解释所测量的脑电波。典型地,这样的装备是脑电图仪,通过其可以实现所谓的脑电图(eeg)。这样的eeg通过测量对象大脑中突触后电流在对象头皮表面产生的电位来提供对象大脑中的电活动的测量和记录。在医学领域内,eeg用于各种诊断目的。从wo-a1-2006/047874中获知一种用于这种用途的系统,其描述了通过使用与对象的至少一只耳朵连接放置的电极,即放置在外耳部分上或放置在耳道中的电极来测量脑电波。该测量尤其用于检测癫痫发作的发作。wo-a1-2006/047874还描述了成对的电极分别用作检测电极和参考电极,这种设置在脑电图领域是众所周知的。用于测量脑电波的已知系统通常使用起来很复杂,并且需要合格的人员进行操作,或者需要手术来放置电极,并且即使正确放置,由于电耦合的变化,记录的eeg仍然会有很大的变化。常规的eeg记录系统具有相对较大的功耗。尽管有可能在医学和物理科学的许多不同领域中连续监控使用者的脑电图反应,但已知的系统很大程度上仅限于实验室使用。常规的实验室eeg记录通常使用湿ag/agci电极执行,其中电极凝胶在电极和皮肤之间施加。电极凝胶通常是离子浓度高于人体细胞外液的溶液。电极凝胶改善了皮肤和电极之间的离子传输。即使在使用导电电极凝胶时,由于使用者皮肤上的湿气、灰尘和头发,电气路径仍然可能很差。当要长时间使用监测器时,其中使用者处于活动状态并处于非实验室环境(例如,灰尘、潮湿等)中,这特别是一个问题。广泛使用ag/agci电极的理由之一是,电极-皮肤界面上的电位在几分钟之内稳定,从而在应用电极后不久实现低噪声记录。对于实验室环境,在电极和皮肤之间应用凝胶通常不是问题。然而,由于导电凝胶是油腻的并且不限于电极所覆盖的区域,因此对导电凝胶的需求使得这种系统在公共场合使用时没有吸引力。此外,如果将导电凝胶彼此紧密靠近放置,则导电凝胶很可能使电极短路,因此,这些已知系统需要电极之间的间隔,从而导致用于监测eeg的装置大而笨重。因此,本发明旨在提供一种用于长期地、连续地、无创监测地检测生物电信号的电极,该电极可以在临床和实验室环境之外的日常生活中以简单的方式使用,同时获得来自使用者的高质量的生物电信号响应。技术实现要素:根据本发明的第一方面,通过提供一种用于检测皮肤表面上的生物电信号的电极实现该目的,其中该电极包括皮肤接触部分、由金属制成的基板以及包括氧化铱的涂层。涂层覆盖电极的皮肤接触部分的至少一部分,并且涂层具有纳米结构的表面图案。在本申请的上下文中,纳米结构是指微米级和/或纳米级的三维微观结构。纳米结构的表面图案包括多个脊,该多个脊基本上均匀地分布在被涂层覆盖的电极的皮肤接触部分上方。该多个脊形成相交脊的网格。纳米结构的表面图案提供毛细作用,使皮肤接触部分的被涂层覆盖的部分在用于皮肤上时具有亲水性。电极的这种亲水特性提高电极的效率,显著产生与已知的湿电极相似的结果,同时为使用者提供使用干电极的便捷性,因为在放置电极之前不必像湿电极那样冲洗皮肤或应用电极凝胶。在专利说明书的末尾包括对根据本发明的电极和常规的湿ag电极的比较研究的测试结果。因为eeg电极依靠凝胶与皮肤接触,通常,eeg电极表面平坦。对于干表面电极,由于电极阻抗与其接触表面积成反比,因此电极表面与皮肤直接接触至关重要。对于平面电极,这理想地意味着必须将其放置在平坦的皮肤表面上。这样的平坦皮肤表面在人类上不存在,但是实际上,因为皮肤可以被电极稍微压紧,几乎平坦的表面都存在。当电极用于耳朵中时,除非电极直径很小,否则不能认为皮肤表面平坦。否则,电极将仅在其外围与皮肤接触。理想地,将用于耳朵的干表面电极成形为使得其适合该特定耳朵的曲率。非定制的耳电极应模仿人耳的一般特征,这意味着电极表面应呈圆顶形或具有与人耳特征中的曲率相匹配的曲率半径的其他形式弯曲。因为电极表面可以依靠某些皮肤压缩来补偿差异,电极表面的曲率不需要完全匹配耳朵的特征。然而,如果曲率半径变得小于皮肤压缩所能吸收的曲率半径,则电极将在其外围失去皮肤接触。如果曲率半径变得大于皮肤压缩所能吸收的曲率半径,其将在其中心失去皮肤接触。由于皮肤的可压缩性,将存在一定的曲率半径间隔,以确保电极的整个表面或至少其主要部分与皮肤接触。在优选的实施例中,电极的皮肤接触部分包括弯曲表面,该弯曲表面适于在使用电极时面向使用者的皮肤表面。电极具有底径d。在优选的实施例中,底径d在1.0mm至5.0mm之间,更优选在1.5mm-3.5mm之间,甚至更优选在2.0mm-3.0mm之间,并且最优选的底径d为2.6mm。在优选的实施例中,电极的皮肤接触部分的适于在使用电极时接触使用者的皮肤的表面弯曲成曲率半径r在2mm至7mm之间。更优选的曲率半径r在2.1mm至5mm之间,最优选的曲率半径在2.2mm至4mm之间。如在本专利申请的说明书最后部分的对比研究中所示,与湿ag电极相比,如测试结果所示,已证明氧化铱在亲水特性和效率方面非常适合用于根据本发明的电极的涂层。在本专利申请的上下文中,亲水性被定义为当液滴在平面表面上时的接触角小于90°。对于皮肤接触部分的被涂层覆盖的部分,亲水特性已经通过分别在电极上施加水和正十六烷证明。水开始10分钟后测试159.6°34.4°测试254.3°33.6°正十六烷开始10分钟后测试126.7°-测试226.1°22.0°使用接触角系统oca20s/no02e0412f7a6(德国菲尔施塔特的数据物理仪器股份有限公司)进行测量。在优选的实施例中,电极的基板由钛制成。钛是一种稳定且具有生物相容性的材料,因此非常适合用于检测使用者皮肤表面上的生物电信号的电极,特别是当电极使用时间较长时,其中使用者处于活动状态并受到非实验室环境的影响。其他材料(例如银(ag))可以被用于基板。生物相容性材料是优选的。基板可以优选地是销的形状。涂层可以包括不同的材料,例如gb1147442a和gb1195871a中公开的用于涂层的材料,这两个文件均通过引用并入本文。在优选的实施例中,根据本发明的电极的涂层包含选自钽、钛、铂和钌的组中的添加剂。这些材料是生物相容的。这些材料的优点之一是其干扰了氧化铱涂层的结晶过程,使涂层多孔。该涂层具有纳米结构的表面图案和提供毛细作用的多孔表面,使皮肤接触部分的被涂层覆盖的部分在用于皮肤上时具有亲水性。电极的这种亲水特性显著提高电极的效率,产生与已知湿电极相似的可靠性,同时克服已知湿电极的一些缺点。根据本发明的第二方面,提供一种用于制造用于在皮肤表面上检测生物电信号的电极的方法。该方法包括以下步骤:提供由金属制成的基板;蚀刻基板的至少一部分以准备用于涂覆;使用包括铱化合物的涂层组合物涂覆基板的所蚀刻的部分;并且在400摄氏度至600摄氏度之间的温度下加热所涂覆的基板。通过执行这些步骤,提供一种包括具有纳米结构的表面图案的氧化铱涂层的电极。纳米结构的表面图案提供毛细作用,使皮肤接触部分的被涂层覆盖的部分在用于皮肤上时具有亲水性。电极的这种亲水特性显著提高电极的效率,产生与已知湿电极相似的可靠性,同时克服已知湿电极的一些缺点。因此,提供一种不需要像湿电极那样在放置电极之前冲洗皮肤或施加电极凝胶的电极。因此,该电极可以用作干电极,具有易于处理的所有优点和优势,并且适合在实验室环境之外的较长时间内使用。在专利说明书的末尾包括对根据本发明的电极和常规的湿ag电极的比较研究的测试结果。根据本发明的电极的涂层包含氧化铱。如在本专利申请的说明书最后部分的对比研究中所示,与湿ag电极相比,如测试结果所示,已证明氧化铱在亲水特性和效率方面非常适合用于根据本发明的电极的涂层。通过使用任何合适的蚀刻剂或钝化剂来执行蚀刻步骤。这种蚀刻剂或钝化剂的示例包括氢氟酸、硝酸或草酸。涂覆步骤和加热步骤可以重复一次或多次,以获得厚度增加的涂层,即在被涂层覆盖的电极的面积上测量,每m2包括较大量的氧化铱。在被涂层覆盖的电极的面积上测量,氧化铱的优选量为12g/m2。在本发明第二方面的优选实施例中,在加热步骤中将所涂覆的基板加热达3分钟至19分钟,更优选为6分钟至16分钟,最优选为9分钟至13分钟。在本发明第二方面的优选实施例中,该方法进一步包括在涂覆步骤之后且在加热步骤之前的干燥步骤。涂覆步骤、干燥步骤和加热步骤可以重复一次或多次,以获得厚度增加的涂层,即每m2包括较大量的氧化铱。在被涂层覆盖的电极的面积上测量,氧化铱的优选量为12g/m2。在本发明第二方面的实施例中,干燥步骤在100摄氏度-120摄氏度下执行,更优选在大约105摄氏度下执行。在本发明第二方面的优选实施例中,加热步骤的温度为500摄氏度-550摄氏度,更优选为大约525摄氏度。在本发明第二方面的优选实施例中,所提供的基板由钛制成。钛是一种稳定且具有生物相容性的材料,因此非常适合用于检测使用者皮肤表面上的生物电信号的电极,特别是当电极使用时间较长时,其中使用者处于活动状态并受到非实验室环境的影响。其他材料(例如银)可以被用于基板。生物相容性材料是优选的。优选地,铱化合物以液体组合物的形式提供。在本发明第二方面的优选实施例中,铱化合物是氯化铱。涂层可以包括不同的材料,例如gb1147442a和gb1195871a中公开的用于涂层的材料,这两个文件均通过引用并入本文。在本发明第二方面的优选实施例中,根据本发明的电极的涂层包括选自钽、钛、铂和钌的组中的添加剂。这些材料的优点如上在本发明第一方面下所述的。根据本发明第三方面,提供一种可通过本发明第二方面的方法获得的电极。根据本发明第四方面,一种用于布置在人的耳朵处的耳装置,该耳装置包括根据本发明第一或第三方面的至少两个电极,当耳装置被布置在人的耳朵处时,该耳装置适于检测来自皮肤表面的生物电信号。耳装置进一步包括外表面和包括电源装置的电子模块。电极被提供有布置在耳装置的外表面上的皮肤接触部分。电源装置可以是电池、可再充电电池或燃料电池,优选地为直接甲醇燃料电池dmfc类型。电子模块可以包括控制器(cpu)。电子模块可以包括存储器装置。电子模块可以包括例如蓝牙连接装置或wifi连接装置、例如wlan连接装置的通信装置。电子模块可以包括实时时钟rtc。电子模块可以包括扬声器装置。耳装置可以由适合于耳道形状的柔性材料制成。电极可以被固定到耳装置的内部非柔性部分,被覆盖具有与耳道的形状相符的外部柔性部分。在根据本发明第四方面的一个实施例中,电极均匀地分布在耳装置的周围上方。在本发明的上下文中,电极是指伪电容电极。伪电容电极是具有可极化(电容)电极的电化学特征的材料,但其中电荷不被静电存储。相反,伪电容界面中的电荷转移是由于电极表面上快速且可逆的法拉第氧化还原反应引起的。因此,伪电容源自通过电极材料的氧化态的变化的电子电荷转移,以及遍及双层的电解质的相应的离子插入(电吸附)。这意味着没有电极材料的离子释放到电解质中。对于某些电极材料,伪电容是电荷转移的主要方法,伪电容远高于双层电容。双层电容是通过双电层效应来存储电能。在电极和电解质(在这种情况下为湿润的皮肤)之间的界面中形成双层电容。对于氧化钌(ruo2)和氧化铱(iro2)等涂层就是这种情况。附图说明现在将参考附图更详细地描述本发明的实施例,其中图1a是插入电极壳体中的根据本发明的电极的横截面示意图,图1b是根据本发明的电极的示意俯视图,图1c是根据本发明的电极的示意侧视图,图1d是根据本发明的电极的示意俯视图,图2是插入电极壳体中的根据本发明的电极的图像,图3是根据本发明的电极的另一实施例的分解图,图4是根据本发明的电极的皮肤接触部分的纳米结构的表面图案的电子显微镜图像,图5是在系统图中的包括根据本发明的电极的耳装置,图6a和图6b示出电极插入在位置a、b、c、t、e和i的用于左耳的软听筒,图6c是听筒的示意图,表示用于改善干接触电极记录的皮肤接触的装置,图7a是安装在耳朵中的插入式耳机的听筒的图片,图7b是配戴ssvep眼镜和配戴具有iro2头皮电极的帽子的测试对象的图片,图8a和图8b是示出针对cz参考配置(图8a)和耳内参考配置(图8b)的assr的总平均功率谱的图,图8c和图8d是示出针对cz参考配置(图8c)和耳内参考配置(图8d)的ssvep的总平均功率谱的图,图9a、图9b和图9c是示出针对不同参考配置的总平均mmn响应的图,图10a是示出包括在本说明的最后部分的研究对象11的功率谱和频谱的图,其中具有睁眼间隔和闭眼间隔的指示,图10b是示出均值α带功率的总平均的图,图11a是示出图例中所示的电极-皮肤界面的参数模型的参数值的比较的图,图11b和图11c是示出根据本发明的干接触iro2电极的阻抗谱的图。具体实施方式图1a示出根据本发明的第一方面的电极1的实施例的横截面。电极1包括钛的基板2,该基板具有由包括氧化铱的涂层3所覆盖的皮肤接触部分4。电极1插入电极壳体5中,该电极壳体5在与皮肤接触部分4相对的电极的一部分上包括密封装置6。密封装置6可以由例如环氧树脂的任何合适的材料制成。电极1包括同轴电缆形式的连接装置7。密封装置6使位于电极壳体5中的电极1的一部分相对于围绕电极壳体5的外部环境密封。在一个实施例中,密封装置6由金属制成。在优选实施例中,密封装置6在密封装置6和电极壳体5之间提供基本上防水的密封。对于干接触电极,电极-皮肤界面中的电解质将主要由皮肤出汗形成。因此,电解质的量通常将非常有限,并且电极-皮肤界面中的双层可能容易受到运动的干扰。双层的扰动将改变电极-皮肤界面的半电池电位和电容。另外,运动将改变电极和皮肤之间的几何区域,这也将改变界面的电容。与湿电极相比,这些方面导致干接触电极的电极-皮肤界面的更高和更多变化的阻抗。因此,为了使用干接触电极测量脑电图,必须将电子仪器设计为适应这些更高和更多变化的阻抗。通常通过增加电极的表面积可以减小电极-皮肤界面的阻抗。然而,通常在电极的尺寸和电极之间的距离之间进行折衷。为了获得更好的折衷,利用纳米结构的表面涂层可以增加电极的表面积而不增加电极的尺寸。尽管根据本发明的电极适合于不施加导电凝胶的情况下使用,即作为干电极,但是根据本发明的电极和耳装置可以与导电凝胶的施加一起使用。图1b是电极1的示意俯视图。d表示电极的底径。图1c是电极1的示意侧视图。d表示电极的底径,r表示电极的圆顶的曲率半径。虚线圆表示具有曲率半径r的圆。因此,在附图中可以看出d和r之间的关系。如果r远大于d,则圆顶,即适于接触使用者皮肤的电极的表面基本上是平坦的。在此背景下,当r是d的五倍时,可以更大。如果r=d/2,则圆顶为半球形。为了获得具有优选曲率半径的电极,使用以下公式:r=β*d/2β值在1-20的间隔内,包括适合本发明目的的电极的所有实际解决方案。优选的间隔为1.2至9的β,更优选为1.4-3.6,最优选为大约1.8的β。图1d是根据本发明的电极1的实施例的示意俯视图。在该实施例中,电极1为椭圆形。在这种情况下,如在俯视图的附图中所看,d的值被设置为椭圆形电极的短轴x的两倍。对于其他形状,如从与图1d类似的俯视图所看,d的值被设置为最小轴x的两倍。图2是图1的电极1的图像,其包括基板2、皮肤接触部分4、涂层3以及包括密封装置6和连接装置7的电极壳体5。图3是根据本发明的电极的另一实施例的分解图。在该实施例中,连接装置7是柔性pcb的形式。此外,示出前端asic8。图4a是根据本发明的电极的皮肤接触部分的纳米结构的表面图案的电子显微镜图像。该图像示出包括多个脊的纳米结构的表面图案,这些脊基本上均匀地分布在被涂层覆盖的电极的皮肤接触部分上方。多个脊形成相交脊的网格。在该示例中,脊的宽度为大约1μm-10μm的量级。图4b是根据本发明的电极的皮肤接触部分的纳米结构的表面图案的另一电子显微镜图像。如图4a所示,该图像示出包括多个脊的纳米结构的表面图案,这些脊基本上均匀地分布在被涂层覆盖的电极的皮肤接触部分上方。多个脊形成相交脊的网格。在该示例中,脊的宽度为大约1μm-10μm的量级。图5在系统图中示出包括根据本发明的电极的耳装置。耳装置115适用于监测eeg,并且可以佩戴在要监测的人的耳朵内,例如,用于检测低血糖症,例如就像本身已知的耳道式(itc)助听器一样。此外,该装置将允许医疗保健人员一次持续几天远程监测或记录eeg。然后,将允许医疗保健人员监测患有癫痫发作或微睡眠等经常性发作问题的患者。因为耳装置115具有声孔116,因此佩戴者将能够听到声音,耳装置115将不会干扰正常生活。一段时间之后,佩戴者忘记他佩戴了耳装置115。耳装置115在其外表面上提供有根据本发明的两个有源电极1。耳装置115在内部包含电子模块118。耳装置115形成为装配到佩戴者的外耳道111中,并与鼓膜110一起在外耳道111中限定腔,并且该腔通过延伸穿过耳装置115的整个长度的声孔116打开。优选地,耳装置115不延伸超过耳廓112。在虚线框118中以放大视图示意地示出电子模块118。电子模块118包括基于用于为电子设备供电的标准助听器电池的电源120。在耳装置115的表面上提供的两个电极1拾取电位,并经由充当电极前端和模数转换器(adc)的模块125将数据传输到数字信号处理器124。数字信号处理器124接收放大的数字化信号以进行处理。根据一个实施例,数字信号处理器124通过监测脑电波频率来分析用于检测低血糖而拾取的eeg信号,并且如果脑电波频率落入预定义间隔之外,则这可以指示可能发生医疗紧急情况。低血糖症是一种涉及血液中葡萄糖含量异常减少的医疗紧急情况。在检测到异常脑电波活动时,数字信号处理器124将这些发现传达到装置操作控制器122。装置操作控制器122负责几种操作,并且具有包括麦克风和扬声器的音频前端模块123。利用麦克风,装置操作控制器122能够拾取音频样本并对当前的声音环境进行分类。此外,装置操作控制器122可以访问来自内部时钟模块或经由无线电模块121可访问的个人通信装置(例如,智能电话)的实时时钟信息。个人通信装置和无线电模块121可以通过诸如bluetoothtm低能耗标准的短程通信标准建立无线通信链路。装置操作控制器122根据实时时钟信息和声音环境分类来调整正常的脑电波活动的预定义间隔。使用扬声器,装置操作控制器122能够警告耳装置115的佩戴者可能发生医疗紧急情况并且必须采取预防措施。迄今为止,已经将电极的数量识别为以差分模式操作的一对有源电极。然而,两个或更多个有源电极可以用作感测电极,用于测量相对于用作公共参考电极的有源电极的电位差。电极将以单极引线模式操作。如果处理器被提供有用于减轻佩戴者的听力损失的增益,则在另一实施例中,耳装置115可以用作助听器。耳装置115可以有利地集成到耳道式(itc)助听器、耳道式接收器(ric)助听器或另一类型的助听器中。根据所提出的发明的耳装置可以用于连续监测指示如低血糖、癫痫或类似状况的医学发作的eeg信号。该装置用于通过数字信号处理器分析eeg信号来预测发作,并在分析的信号表明可能发作的情况下通知使用者。信号处理器通过统计数据分析和机器学习方法连续评估eeg记录。信号处理器、电源装置、麦克风、扬声器等可以位于耳装置处或耳后(bte)部分处。这些部分是位于耳装置处还是位于bte部分中取决于耳道的尺寸和形状,即耳塞是否足够大以容纳所有部件。电极板的尺寸由于耳道的物理尺寸而受到限制,并且因此受到耳装置的表面的限制,因此,由于小的电极电容,电极的电容受到限制。放大器的阻抗应保持高阻抗。匹配电路的频率特性应提供截止频率大约为1hz的高通滤波器。电极的尺寸是能够在有限的空间内装配多个电极与电极的电容与面积成比例(这指向较大的电极尺寸)之间的折中。优选的尺寸在5mm2至100mm2之间。电极可以是柔性的,但是优选地以双弯曲形状预成型以最佳地适合将要放置其的耳朵的区域。监测装置具有多个电极,其中每个电极可以具有单独的形状,以最佳地适合应该适合使用者的特定区域。使用者可以将耳装置放在耳朵中,而无需经过培训的人员的帮助。在一个实施例中,耳装置可以使用大约1mw的电池或其他小型独立电源操作。耳装置记录使用者的例如eeg的生物电信号。通过使用高级统计数据和机器学习技术,可以表征eeg的异常或模式的特定变化。这可以用于监测或确定神经系统疾病或神经发生性疾病,并且这可以用于例如警告某人或亲戚潜在的癫痫发作、降血糖发作等。通过跟踪eeg的特定变化,耳装置可以进一步用于改善痴呆症的治疗。其他使用领域包括睡眠的诊断和康复、精神病和情绪障碍的预防、康复和治疗评估、疲劳检测、脑机接口。耳装置可以具有许多不同的形状,所有形状的共同目标是要有与使用者的皮肤紧密贴合并佩戴舒适的耳塞,这意味着该耳塞应尽可能少地遮住耳朵。在一个实施例中,耳装置包括针对使用者的耳道的定制形状。耳装置是中空的壳,并且根据耳道的印记用于特定的耳道。电极可以安装在中空壳的内部或外部。如果将其安装在壳的内部,则壳本身可以具有足够的电介质以确保纯的电容耦合,此外,与将电极外部安装相比,将电极安装在壳的内部使电子设备的布线更加容易。在另一个实施例中,耳装置包括管,其中电极可以安装在管的内圆周或外圆周上。该管被制成不同的直径,以最适合耳道的直径。该管也可以成形为在纵向上适合耳道的形状。在外圆周上,管覆盖有如硅胶、泡沫、橡胶或其他柔软材料的柔软的柔性材料,其确保使用者安全舒适地佩戴。在另一个实施例中,耳装置为支架的形式。支架具有以下优点:其是柔性的,可以以收缩状态插入耳道,在释放后形成紧密贴合的耳装置。在图6a和图6b中示出用于左耳的软听筒10。软听筒10包括插入在位置a、b、c、t、e和i(在图6a和图6b中用ela、elb、elc、elt、ele和eli表示)中的根据本发明的电极。图6c是听筒10的图示,其表示用于改善皮肤接触的装置,以用于使用根据本发明的电极的干接触电极记录。最短的虚线11表示听筒的柔性接头的位置,而较长且弯曲的虚线12表示听筒的边缘的横截面,从中可以看出听筒10的边缘比听筒10的其余部分厚,以实现更刚性的结构。还可以看出,电极支座被制造使得电极将从听筒10的表面突出。图7a是在本专利申请的说明书末尾处描述的比较测试中,在测试对象的耳朵中安装的插入式耳机的听筒的图片。图7b是配戴ssvep眼镜和配戴具有iro2头皮电极的帽子的测试对象的图片。图8a和图8b是示出针对cz参考配置(图8a)和耳内参考配置(图8b)的assr的总平均功率谱的图。褪色的线是每个对象的响应。图例中给出一次谐波响应的snr,星号表示基于f-测试的统计显著性(p<0.05)响应。图8c和图8d是示出针对cz参考配置(图8c)和耳内参考配置(图8d)的ssvep的总平均功率谱的图。褪色的线是每个对象的响应。图例中给出一次谐波响应的snr,星号表示基于f-测试的统计显著性(p<0.05)响应。图9a、图9b和图9c是示出针对不同参考配置的总平均mmn响应的图。褪色的线是每个对象的mmn响应。虚线示出对标准刺激的响应,短划线示出对偏差刺激的响应,实线示出偏差响应和标准响应之间的差异(即mmn响应)。图10a是示出研究对象11的功率谱和频谱图的图,其具有睁眼间隔和闭眼间隔的指示。图10b是示出平均α带功率([8;12]hz)的总平均的图。使用3抽头均值滤波器对总平均曲线图进行平滑处理。所有db值均相对于图11a是示出图例中所示的电极-皮肤界面的参数模型的参数值的比较的图。黑线表示单个记录的参数值。图11b和图11c是示出根据本发明的干接触iro2电极的阻抗谱的图。所有阻抗测量都是通过将听筒插入测试对象的耳朵中执行的。图11b示出放置在使用者的耳道中的电极的数据,而图11c示出放置在耳甲中的电极的数据。图11b和图11c分别位于右上角的直方图示出从0.1hz到10hz的均值阻抗分布。带有“rem.”标记的一些记录在直方图中是异常值,被排除在研究分析之外。比较测试结果目的:耳-eeg是一种记录方法,其中从放置在插入耳朵的听筒上的电极获取eeg信号。因此,耳-eeg提供一种无创且谨慎的方式来记录eeg,并有潜力用于现实环境中的长期脑部监测。鉴于先前报道的耳-eeg记录是使用湿电极执行的,这项研究的目的是开发和评估干接触电极耳-eeg。方法:为了获得功能良好的干接触界面,开发一种新的耳-eeg平台。该平台包括嵌入个性化软听筒中的主动屏蔽和纳米结构电极。该平台在对12位对象和4种eeg范例的研究中进行评估:听觉稳态响应、稳态视觉诱发电位、失配负性和α带调制。结果:对于头皮参考配置和耳朵参考配置,将原型干接触耳-eeg平台与常规头皮eeg进行比较。当所有电极均参考通用头皮电极(cz)时,该平台的性能与通过靠近耳朵的电极测得的头皮eeg相当。参考电极位于耳朵内,对所有范例测量统计显著性(p<0.05)响应,尽管对于失配负性,有必要使用耳间参考配置以获得统计显著性响应。结论:研究表明,干接触电极耳-eeg是一种可行的eeg记录技术。意义:因为消除电极-皮肤界面中对凝胶的需求,原型干接触耳-eeg平台代表该方法在使用者友好性方面的重要技术进步。介绍几十年来,研究人员和临床医生一直渴望在受控实验室环境之外测量eeg。近年来,由于可穿戴装置的重大发展以及对更好和更有效的保健技术的需求,对此产生越来越大的兴趣。动态eeg系统存在并且可以进行长期的现实生活记录,但是对于使用者的日常活动而言,该动态eeg系统通常笨重且笨拙,必须由受过训练的人员进行安装[1]。可穿戴eeg系统试图克服动态系统的局限性,针对易于安装并在日常生活中能够进行长期记录的使用者友好系统。一些可穿戴eeg系统将这种趋势进一步发展,并且被设计为在日常生活活动中不引起注意[2][3][4]。常规的实验室eeg记录是使用全盖系统和湿电极执行的,以获得具有高空间分辨率的高质量测量结果。可穿戴eeg系统通常具有较低的空间分辨率,并且干接触电极技术用于改善长期记录的使用者友好性和质量。对于干接触电极,在电极和皮肤之间不施加电极凝胶,而是将仪器和电极设计为容纳并减少电极-皮肤界面变化的影响[5][6]。已经提出各种设计的干接触电极,包括层压在皮肤上的网状电极[3]、基于柔性聚合物的电极[2][7][8]和弹簧承载式电极[9][10]。耳-eeg是从外耳中的电极记录eeg的一种方法[11][12]。耳-eeg解决现实环境中无创且鲁棒性eeg采集的实际挑战。耳-eeg装置的形状与用于助听器的听筒非常相似,并提供记录eeg的谨慎且舒适的方式。因此,基于耳-eeg的可穿戴eeg系统可以用于持续几天的eeg监测[4]。先前的耳-eeg记录是使用湿电极执行的,其中在电极和皮肤之间施加导电凝胶[11][13][12]。干接触电极耳-eeg可以提高耳-eeg装置的舒适度和使用者友好性,并使得使用者无需帮助即可插入装置。另外,可以避免湿耳电极通常需要的皮肤准备[5]。本文呈现一种新颖的干接触耳-eeg平台,其包括干接触电极和软听筒。电极和听筒的设计已通过对标准eeg范例的研究得到验证。将使用干接触耳-eeg平台执行的记录与标准的湿电极头皮eeg记录进行比较。该研究得到区域科学伦理委员会的批准(案例号:1-10-72-46-17)。ii方法.本节分为四个主要部分。第一部分(节ii-a和节ii-b)描述新颖的干接触耳-eeg平台。第二部分(节ii-c)描述实验设置。第三部分(节ii-d、节ii-e、节ii-f和节ii-g)描述用于评估所记录的eeg信号的质量的实验范例和信号处理方法。最后,第四部分(节ii-h和节ii-i)描述用于表征电极-皮肤阻抗和半电池电位的评估方法。a.干接触耳-eeg电极。来自放置在皮肤表面上的电极的生物电信号的记录关键取决于电极-皮肤界面。对于干接触电极,该界面主要由电极材料的电化学特性、电极的机械设计、电极的表面特性以及如何将电极紧靠皮肤限定。因此,用于耳-eeg的良好的干接触电极界面不仅依靠电极本身,还依靠其在耳中的安装方式。本小节描述已开发的电极,以下小节描述用于电极的软听筒。该电极基于涂覆有氧化铱(iro2)的钛(ti)销,并经过机械设计以嵌入软听筒中。iro2是一种具有拟电容特性和低阻抗的特性良好的材料。iro2涂层先前已用于组织刺激[14][15]和生物电位测量[16]。当前研究的iro2涂层是在蚀刻的ti表面上形成的热氧化铱膜(tirof)[17][18]。根据eniso10993-1标准,该电极已通过ul(2017,德国)评估为生物相容性1。该涂层具有机械坚固性和高度惰性,因此适于在日常生活中进行记录期间的长期皮肤接触。另外,该涂层具有亲水特性,使其在施加到皮肤时容易变湿。电极组件基于圆形iro2涂覆的ti销,由银(ag)制成的壳体进行电屏蔽。如图1和图2所示,ti销和屏蔽壳体通过由聚合物制成的垫片电隔离。同轴电缆的芯连接到ti销,并且电缆的屏蔽层连接到壳体。施加环氧树脂粘合剂以加强结构。如图6a所示,电极被设计为插入软听筒中的孔中。先前的耳-eeg听筒由硬质丙烯酸塑料构造,该听筒的表面上涂有环氧银制成的电极。因此,电极不能再用于另一听筒。所设计的iro2电极是通用的,可以从一个听筒移动到另一听筒。b.软听筒。为了获得牢固的电极-皮肤接触,我们发现将开发的电极安装在根据单个耳朵的解剖形状定制的软听筒中是至关重要的。这对于在耳朵的耳甲部分实现良好而可靠的接触尤其重要。听筒的柔韧性使其能够顺应耳朵形状的变化,并在这些变化期间帮助电极保持与皮肤的稳定接触。对于当前研究,在外耳的耳甲部分中的exa、exb和exc位置中以及耳道中的exe、exi和ext位置中创建电极孔,其中x表示左耳(l)或右耳(r)[11]。ext电极面向耳朵的耳屏。图6a和图6b示出电极在听筒上的位置。如图6c所示,用于该研究的听筒被设计为在听筒的耳道和耳甲部分之间具有柔性接头。这使得听筒的耳道和耳甲部分能够独立移动,从而有利于电极在例如颌骨移动期间的较少运动[19]。ext电极和位于耳甲中的电极安装在朝向皮肤抬高的柔性轴承中,从而在电极位置处产生增加的皮肤压力。位于耳甲的电极特别容易失去皮肤接触。因此,耳甲电极位于听筒的边缘处,其中在耳甲艇和对耳屏之间的c形有助于朝向皮肤产生压力。听筒由生物相容的弹性耳模硅胶(detaxsoftwear2.0,shorea60)制成。c.实验设置。在对12位对象的eeg研究中测试干接触耳-eeg平台。通过32通道便携式tmsimobitaeeg放大器(tmsi,荷兰)以500hz的采样率采集eeg记录。该放大器的特点是具有高输入阻抗(>4gω)、低噪声(<0.4μv@0.1至10hz)和能够对耳电极直到12个电极中的每个的背面进行有源屏蔽的保护线。如图7b所示,包含20个湿iro2电极的easycap(easycap,德国)用于头皮记录。头皮电极根据10-20系统进行定位。右臂上的导电手镯连接到eeg放大器的gnd。在插入听筒之前,先用酒精和水清洁耳朵。平均年龄为30.9(标准=5.6)岁的听力和视力正常的12个对象(1个女性)参加该研究。记录在实验室执行,其中对象坐在舒适的椅子上并且被指示为放松。如图7b所示,通过改良的主动式快门眼镜(ssvep眼镜)给予稳态视觉诱发电位(ssvep)刺激。移除眼镜中的电子设备,并将电线直接连接到lcd面板,覆盖眼镜的镜片。从而可以调制环境光。调制由5v50%占空比信号控制。调制的上升时间和下降时间分别为20μs和1000μs。对于听觉范例,音频是通过插入耳机(3me-a-rtonetmgold)呈现给对象的,两耳的相位和强度均相等。将耳机的管插入听筒的孔中。以高于在1000hz处测量的个体听力阈值的55db的声音水平呈现刺激。在听觉范例期间,对象正在观看无字幕的无声电影。所有记录均通过eeglabfir滤波器功能“popeegfiltnew()”进行带通滤波[20]。下面针对每个范例给出滤波器的截止频率。d.丢弃耳电极。为了定位皮肤接触不良的电极,使用40hz的听觉稳态响应(assr)作为丢弃电极的基础。对于每个耳电极,研究了同一只耳朵内的所有可能参考配置。根据数据分析丢弃其中没有参考配置导致统计显著性assr(f-测试,p<0.05)的电极。更具体地,将数据从2hz至100hz带通滤波,并以1s的段进行分段。对于每个参考配置,选择具有最低均值功率从55hz至75hz的256段。通过段的时域平均(tda)提取assr,并将snr计算为一次谐波assr的功率(在40hz时)与从45hz至55hz的均值功率(排除40hz)之比。e.稳态响应。研究两种稳态刺激。将每种刺激呈现给对象达5分钟。assr刺激是高斯分布的白噪声,幅度调制为40hz。通过使用上述ssvep眼镜以9hz调制环境光来执行ssvep刺激。对象坐在显示白色屏幕的40英寸显示器前面。前额到显示器的距离为600毫米。对记录进行带通滤波以保持2hz至100hz之间的频率,并应用二阶50hz陷波滤波器以减少电源线干扰。然后,将数据分段为1s的段。为确保稳态响应(ssr)的相干平均,这些段与assr的8hz触发器和ssvep的9hz触发器对齐。对于cz参考数据,选择具有从55hz至75hz的最低均值功率的256段,并执行这些段的tda。当耳电极以同一只耳朵内的电极为参考时,与头皮参考耳电极相比,由于小的电极距离,ssr的功率自然降低[11][19]。较低的幅度意味着必须为每个对象优化参考配置以获得可靠响应[21]。因此,为了获得所有对象的可靠ssr,为每个对象精心选择参考配置。为了避免过度拟合,对参考配置进行一半提取段的训练,并对另一半段进行测试。执行100次交叉验证,并计算所有测试数据的tda。具体地,对于每个交叉验证,使用从具有55hz到75hz的最低均值功率的256段中随机选择的128段进行训练。然后,选择引起一次谐波ssr的最高snr的参考配置。测试是使用选定的参考配置以及其余128段执行的。ssr被计算为100次交叉验证的测试数据的tda。对于snr计算,信号是ssr谐波的功率,而噪声是相对于信号频率的+/-5hz的均值功率。从噪声估计中排除信号频率。snr被计算为信号与噪声之比。f.失配负性。标准刺激是持续时间为75ms(包括5ms上升时间和下降时间)的1khz正弦波。偏差刺激的频率(2khz)有偏差,以0.2的概率被随机选择。在500ms到800ms之间随机选择刺激发生异步(soa)。以两个11分钟序列呈现总共2000个刺激(400个偏差)。所记录的beg数据从1hz到25hz被带通滤波,并相对于刺激发生在-100ms到500ms的范围内进行分段。基于未过滤的eeg数据,每个时期的噪声水平估计为55hz到75hz的均值功率。通过512段的tda提取与标准刺激有关的事件相关电位(err),从每个序列中选择具有最低噪声水平的256段。类似地,通过256段的tda提取对偏差刺激的err,其中从每个序列中选择具有最低噪声水平的128段。-100ms到0ms的均值幅度用于基线校正。g.α带调制。为了补充稳态和事件相关响应,该研究还包括自发性eeg的记录。该研究集中于α带活动,α带活动是由视觉注意力调制的。对象被告知两种条件:1)睁开眼睛,观看无声电影,2)闭上眼睛放松。听觉提示表明条件每60秒发生一次条件变化。第一条件始终是条件1。测量的持续时间为4分钟。eeg数据从2hz到45hz被带通滤波,并且以4s段被分段,重叠2s。对于每个段,计算均值α功率[8,12]hz。具有高于100μv2/hz(cz参考)和1μv2/hz(耳内参考)的均值α功率的段不在分析之列。闭眼期间主要的α源是枕骨的,因此其不在耳朵附近[22]。考虑到耳朵内的小的电极距离,因此有必要针对每个对象优化耳内参考配置。将数据分为两个序列,第一序列包含前120s数据,其余120s被包含在另一序列中。然后,针对每个序列定位引起最高α带调制比的耳内参考配置。为了避免过度拟合,将引起每个序列的最高α调制的参考配置用于对相反序列的分析。h.电极-皮肤阻抗。为了更好地了解所开发的干接触耳-eeg平台的电极-皮肤界面,对所有对象执行电极-皮肤阻抗谱表征。在研究结束时测量所有12个耳电极的阻抗谱,其中对象已经佩戴听筒大约2小时。先前已经在[5]中针对银(ag)对湿接触耳-eeg电极和干接触耳-eeg电极的电极-皮肤阻抗进行了表征。研究描述了用于测量阻抗谱的设备,并且呈现了电极的阻抗谱。使用相同的设备以表征经开发的iro2干接触电极的电极-皮肤阻抗。阻抗测量在0.5ma/cm2的电流密度下执行,并在每只耳朵的6个电极的10个组合之间测量阻抗谱。这样就可以对单个电极(单个电极-皮肤界面)的电极-皮肤阻抗进行可靠的估计。对于每只耳朵,在耳电极和左臂上的导电手镯之间进行6次阻抗测量。阻抗设置的gnd始终连接到右臂上的导电手镯。电极-皮肤界面的电模型的阻抗谱和参数如[5]所述估算。i.半电池电位。测量5个电极的半电池电位,其中只有iro2涂层被暴露。相对于si分析2820+参考电极(3molkci溶液中的2ag/agcl电极、陶瓷膜)进行所有测量。将电极浸没在温度为25℃的1molkcl容器中。根据能斯特方程,将测得的电位减去27.7mv,以校正容器和参考电极中的不同kci溶液。使用rohde&schwartzhmc8012万用表(输入阻抗>10gω)进行测量。对于每次测量,将电极浸没在容器中,20分钟后,测量半电池电位,取出电极并用水清洗。每个电极重复此过程4次。iii.结果。在下文中,我们介绍了使用开发的干接触耳-eeg平台和湿头皮电极进行的eeg记录。给出针对不同参考配置的结果,以说明响应如何随参考配置变化。根据以上给出的丢弃标准,如表i所示,一些耳电极丢弃。表i.鉴于每个耳电极位置,数据分析的丢弃比率。耳甲电极用灰色标记。a.稳态响应。图8a和图8b示出总平均assr,图8c和图8d示出总平均ssvep。cz参考的功率谱分别如图8a和图8c中所示,图8b和图8d分别用于耳内参考,如上所述,其中参考配置已针对每个对象进行优化。图例中给出一次谐波响应的snr,星号表示统计显著性响应(f-测试,p<0.05)。对于cz参考配置,头皮和耳电极的assr和ssvep相似。查看耳内参考数据,snr值较低,但一次谐波响应仍易于观察且具有统计显著性。对于耳内配置和cz参考配置,功率谱的本底噪声可相比。b.失配负性。ele-cz参考配置的总平均mmn响应如图9a中所示,耳间配置tp7-tp8和ele-ere的总平均mmn响应如图9b和图9c所示。绿线颜色表示通过一个样本t-测试测得的mmn响应在统计学上与零显著不同(p<0.05)的间隔。标准erp和偏差erp的发作响应都示出众所周知的p1-n1-p2波形,其时序和幅度类似于先前的湿电极耳-eeg记录[13]。当参考配置从cz更改为耳间时,响应的时序稍有变化。仅示出针对耳间参考配置的mmn响应,因为对于耳内配置,mmn响应不具有统计显著性。c.α带调制。图6示出具有用于从单个对象记录的相应功率谱的频谱图。每个频谱图下方的曲线图示出均值α功率的[8,12]hz的总平均。为了计算图中所示的总平均的均值α功率,根据上述标准,8%的cz参考数据和9%的耳内参考数据被丢弃。elt-cz配置的频谱图和总平均α功率示出清晰且统计显著(p<0.001)的α带调制。对于耳内参考配置,调制较低,但总平均调制仍具有统计显著性(p<0.001)。根据表ii,对于ele-cz配置,α调制对10名对象中的9名具有统计显著性(p<0.05),对于耳内参考配置,α调制对12名对象中的5名具有统计显著性。表ii.睁眼/闭眼的α带调制比率,以及未配对t-测试的对应p值。“-”指示丢弃的记录。d.电极-皮肤阻抗。图7(a)示出刚性听筒上的湿接触银(ag)电极和干接触银(ag)电极的总平均模型参数以及开发的iro2干接触电极的总平均模型参数。ag电极的参数取自[5]。干ag电极和干iro2电极的电阻和电容相当。对于干接触电极,r1主导电极-皮肤界面的电阻部分。为了进行比较,耳道电极在约50hz时的阻抗对于湿ag为4kω(std=3kω),对于干ag为452kω(std=737kω),对于干iro2为435kω(std=515kω)。图7(b)和图7(c)示出分别在耳道和耳甲中的干iro2电极的总平均阻抗谱。图7(b)和图7(c)右上角的直方图显示从0.1hz到10hz的平均值阻抗分布。带有“rem.”标记的一些测量值在直方图中是异常值,并且不在分析之列。总计,来自12个电极(7.1%)的测量结果被排除分析之外。e.半电池电位。测得的半电池电位平均为99mv(std=29mv),相当于以标准氢电极为参考的322mv的半电池电位。半电池电位的测量是在电解质溶液(1mkci)中执行的,与干性皮肤接触不相似。为了补充半电池电位测量并获得需要使用皮肤上开发的电极进行测量的偏移容差的估计值,对所有包括的assr记录都计算了dc偏移。对两只耳朵中的耳电极执行计算,并使用平均参考。对于122次测量的偏移的标准偏差为46mv(最小=-108mv,最大=176mv)。iv.讨论。a.稳态响应。一次谐波assr对于头皮(cz)配置和耳内参考配置均具有统计显著性。当参考从头皮配置更改为耳内配置时,assr的一次谐波的幅度降低约10db。这种减小较小,但仍与先前的基于湿电极[11][13]的耳-eeg记录相当,并且主要是由较小的电极距离引起的。但是,从头皮配置到耳内参考配置,assr的snr降低5-8db。这与先前报道的结果不一致,耳内参考记录的snr相似或更高[11][19][23]。snr降低是由头皮配置和耳内参考配置的功率谱的相似本底噪声引起的。与湿电极相比,这最有可能与干接触电极的电极-皮肤界面中的噪声增加有关。当参考cz时,ssvep的前8次谐波对于头皮电极和耳电极均具有统计显著性。但是,对于耳内参考配置,只有前两次谐波始终具有统计显著性。与cz参考耳电极相比,耳内参考耳电极的ssvep幅度低大约20db。这在很大程度上与先前报道的湿电极结果一致[11]。从头皮配置到耳内参考配置,ssvep的snr降低9-13db。至于assr结果,这主要是由于ssvep降低,而头皮配置和耳内参考配置的功率谱的本底噪声相似。b.失配负性。ele-cz配置的mmn响应具有与先前的mmn研究相对应的峰值时序,其中参考配置和范例相似[24]。对于cz参考,在150ms左右引发mmn响应的第一峰值,与[25]一致。当参考配置更改为tp7-tp8和ele-ere时,mmn响应的幅度较低,并且峰的时序也略有更改。这可能是参考配置更改的结果,该更改的参考配置导致与mmn响应相关的神经源的权重不同。尽管有必要利用耳间参考配置以获得统计显著性响应,但当前的研究是第一个提出用耳-eeg测量mmn响应的研究。c.α带调制。图6(a)示出ele-cz参考配置的清晰的总平均α带调制。当参考改为耳内时,总平均α调制不那么明显,但仍具有统计显著性。与先前使用湿耳电极执行的α带调制的研究相比,当前研究中的耳内参考配置的调制更低[19]。较低的调制可能与干接触电极的噪声水平升高有关,这在ssr记录中也被观察到。但是,图6清晰地示出,可以使用开发的干接触耳-eeg平台来测量α带调制。d.电极-皮肤阻抗。即使iro2电极的电极面积比干ag电极的面积小约1.5倍(iro2电极的电极面积是干ag电极的面积的约1/1.5),但是干ag电极和干iro2电极的模型参数相当。此外,ag电极涂在个性化的刚性听筒的表面上,使电极遵循耳道的轮廓。开发的iro2电极具有固定的形状,这可能导致皮肤接触面积小于电极表面积。因此,ag电极与iro2电极的接触面积之间的比率可能大于1.5。电极-皮肤界面的双层由建模电解质、皮肤和大块组织的欧姆电阻的c1、r1和r2建模[6]。对于干接触电极,双层的形成受到来自冷凝在电极表面上的人体水分量的限制。与湿电极相比,这导致双层的阻抗增加。这可以解释为什么r1在干接触电极的电极-皮肤界面的电阻部分占主导地位。在[5]中,由于这些电极的极端阻抗,不包括对位于耳朵耳甲区域的干ag电极的阻抗测量。当前的研究表明,使用软听筒和iro2电极,对于耳甲中的干接触电极可以获得可接受的电极皮肤阻抗。但是,耳甲电极的阻抗高于耳道电极的阻抗。这证实了耳朵耳甲区域中的电极更灵敏的电极-皮肤界面的实践经验。在先前对耳-eeg中的生理伪影的研究中[19],我们推测软听筒可以比刚性听筒更好。耳甲电极的阻抗测量结果证实了这种推测。为了使用开发的干接触电极测量eeg,必须适当设计仪器。主要重点应放在高输入阻抗和低输入参考噪声上。输入阻抗必须很高,以获得足够的共模抑制比(cmrr),并且具有电极之间的高阻抗失配。预期阻抗失配与电极-皮肤阻抗处于相同的数量级[5]。系统的cmrr受的限制,其中δze是阻抗失配,zc是仪表放大器的共模输入阻抗[6][5]。关于输入参考噪声,因为电流噪声乘以电极阻抗;ninput=vn+ze·in,其中ninput是总输入参考噪声,vn是输入参考电压噪声,并且in是输入参考电流噪声,主要重点应放在电流噪声上。e.半电池电位。半电池电位的测量值具有29mv的标准偏差,这证实了电极和测量值之间的相似半电池电位。此外,对所需偏移容差的计算示出,有必要使用偏移容差至少为92mv(2·std)的放大器以通过干接触耳-eeg平台获得可靠记录。v.结论。开发并原型化一种新颖的干接触耳-eeg平台,该平台包括嵌入个性化软听筒中的有源屏蔽的纳米结构电极。对12名对象和4种eeg范例的研究评估了干接触耳-eeg平台:听觉稳态反应(assr)、稳态视觉诱发电位(ssvep)、失配负性(mmn)和α带调制。对于头皮参考耳电极,assr和ssvep与来自靠近耳朵的头皮电极的测量值相当。对于耳内参考耳电极,assr和ssvep较低,这与先前研究一致,这是由于可以在耳内实现的电极距离更小。不幸的是,记录的本底噪声没有像稳态响应那样下降,因此获得较低的信噪比(snr)。尽管信噪比较低,但响应可被清晰地观察到且具有统计显著性(p<0.05)。对于头皮参考耳电极,mmn波形和时序与文献非常对应。对于耳内参考,无法观察到mmn响应,但是对于耳间参考配置,mmn响应是可观察到的并且具有统计显著性。对于头皮参考耳电极,与眼睛睁眼/闭眼有关的α调制是清晰的并且具有统计显著性。对于耳内参考,调制较低,但仍具有统计显著性。为了深入了解开发的干接触耳-eeg平台的电极-皮肤界面,对所有对象的电极-皮肤阻抗谱进行测量和表征。阻抗谱的分析证实了与耳道中的电极相比,对于耳朵的耳甲区域中的电极的更敏感的电极-皮肤界面的实践经验。此外,测量结果示出,电气仪器必须经过精心设计,以适应干接触电极的高阻抗。基于对eeg和阻抗谱两者的研究,得出干接触电极耳-eeg是一种可行的eeg记录技术的结论。我们相信,因为原型化的干接触耳-eeg平台消除了电极-皮肤界面中的凝胶需求,其在使用者友好性方面代表了该方法的重要技术进步。参考文献[1]a.j.cassonetal.,“wearableelectroencephalography,”ieeeengmedbiolmag,vol.29,no.3,pp.44–56,may/june2010.[2]j.h.leeetal.,“cnt/pdms-basedcanal-typedearelectrodesforinconspicuouseegrecording,”jneuraleng,vol.11,no.4,p.046014,june2014.[3]j.j.s.nortonetal.,“soft,curvedelectrodesystemscapableofintegrationontheauricleasapersistentbraincomputerinterface,”procnatlacadsciusa,vol.112,no.13,p.201424875,march2015.[4]d.looneyetal.,“anin-the-earplatformforrecordingelectroencephalogram,”confprocieeeengmedbiolsoc,pp.6882–6885,2011.[5]s.l.kappelandp.kidmose,“studyofimpedancespectrafordryandweteareegelectrodes,”confprocieeeengmedbiolsoc,pp.3161–3164,2015.[6]y.m.chi,t.p.jung,andg.cauwenberghs,“dry-contactandnoncontactbiopotentialelectrodes:methodologicalreview,”ieeerevbiomedeng,vol.3,pp.106–119,october2010.[7]p.fiedleretal.,“novelmultipinelectrodecapsystemfordryelectroencephalography,”braintopogr,vol.28,no.5,pp.647–656,september2015.[8]c.t.linetal.,“noveldrypolymerfoamelectrodesforlong-termegmeasurement,”ieeetransbiomedeng,vol.58,no.5,pp.1200–1207,may2011.[9]p.fiedleretal.,“multichanneleegwithnovelti/tindryelectrodes,”sensactuatorsaphys,vol.221,no.1,pp.139–147,january2015.[10]y.m.chietal.,“dryandnoncontacteegsensorsformobilebrain-computerinterfaces,”ieeetransneuralsystrehabileng,vol.20,no.2,pp.228–235,march2012.[11]p.kidmoseetal.,“astudyofevokedpotentialsfromear-eeg,”ieeetransbiomedeng,vol.60,no.10,pp.2824–2830,october2013.[12]s.l.kappeletal.,“amethodforquantitativeassessmentofartifactsineeg,andanempiricalstudyofartifacts,”confprocieeeengmedbiolsoc,pp.1686–1690,2014.[13]k.b.mikkelsenetal.,“eegrecordedfromtheear:characterizingtheear-eegmethod,”frontneurosci,vol.9,p.438,november2015.[14]r.d.meyeretal.,“electrodepositediridiumoxideforneuralstimulationandrecordingelectrodes,”ieeetransneuralsystrehabileng,vol.9,no.1,pp.2–11,march2001.[15]s.f.cogan,“neuralstimulationandrecordingelectrodes,”annurevbiomedeng,vol.10,pp.275–309,august2008.[16]n.s.diasetal.,“newdryelectrodesbasedoniridiumoxide(iro)fornon-invasivebiopotentialrecordingsandstimulation,”sensactuatorsaphys,vol.164,no.1-2,pp.28–34,november-december2010.[17]j.augustynskietal.,“escastudyofthestateofiridiumandoxygeninelectrochemicallyandthermallyformediridiumoxidefilms,”jelectroanalcheminterfacialelectrochem,vol.160,no.1-2,pp.233–248,january1984.[18]s.a.m.marzouk,“improvedelectrodepositediridiumoxidephsensorfabricatedonetchedtitaniumsubstrates,”analchem,vol.75,no.6,pp.1258–1266,march2003.[19]s.l.kappeletal.,“physiologicalartifactsinscalpeegandear-eeg,”biomedengonline,vol.16,no.1,p.103,aug2017.[20]a.delormeands.makeig,“eeglab:anopensourcetoolboxforanalysisofsingle-trialeegdynamicsincludingindependentcomponentanalysis,”jneuroscimethods,vol.134,no.1,pp.9–21,march2004.[21]s.l.kappeletal.,“referenceconfigurationsforear-eegsteady-stateresponses,”confprocieeeengmedbiolsoc,pp.5689–5692,2016.[22]o.n.markand,“alpharhythms,”jclinneurophysiol,vol.7,no.2,pp.163–189,1990.[23]c.b.christensenetal.,“ear-eegbasedobjectivehearingthresholdestimationevaluatedonnormalhearingsubjects,”ieeetransbiomedeng,august2017.[24]r.andr.takegata,“themismatchnegativity(mmn),”intheoxfordhandbookofevent-relatedpotentialcomponents,1sted.,s.j.luckande.s.kappenman,eds.oxford,greatbritain:oxforduniversitypress,2011,ch.6,pp.143–157.[25]r.al.,“themismatchnegativity(mmn):towardstheoptimalparadigm,”clinneurophysiol,vol.115,no.1,pp.140–144,january2004.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1