载小分子药物的碳酸酯聚合物囊泡及其制备方法与应用与流程
本发明属于药物技术,涉及载药囊泡技术,具体涉及载小分子药物的碳酸酯聚合物囊泡及其制备方法与应用。
背景技术:
小分子亲水性药物培美曲赛二钠在水溶条件下带负电,对于培美曲赛的包载,现有载药粒子具有载药量较低、容易泄露和暴释等问题。同时,脂质体包载药物粒径较大,被动靶向效果相对于聚合物囊泡纳米药物而言更差。现有主要装载阿霉素的梯度法(即柠檬酸梯度法,phin<phout)无法对此类药物进行有效的装载。
技术实现要素:
本发明公开了一种新的载药囊泡,为载小分子药物的碳酸酯聚合物囊泡及其制备方法与应用,可用于解决目前带负电亲水性小分子药物的体内循环时间短、生物利用度不高,有时会造成肾脏的毒副作用等问题,可以有效的提高药效,相比起临床用药具有剂量更低,肿瘤部位富集更强,毒副作用更小,循环时间更长等优势。同时采用聚合物囊泡纳米药物可以在其表面修饰多肽、叶酸、单抗等一系列靶向分子,在其所具有被动靶向效果的基础上再赋予其主动靶向的效果,增强抗肿瘤作用。此外,与目前的梯度装载法不同,本发明创造性在聚合物囊泡内腔增加钙离子,将对其药物的包封率和缓释以及解决泄露等方面产生有利的作用。
本发明采用如下技术方案:
载小分子药物的碳酸酯聚合物囊泡,其制备方法包括以下步骤,将碳酸酯聚合物溶液加入含有钙盐的弱碱性缓冲液中,搅拌后加入酸性缓冲液,得到弱酸性混合液;然后加入带负电的小分子药物,再经过震荡、透析,得到载小分子药物的碳酸酯聚合物囊泡。
本发明中,带负电的小分子药物为培美曲塞二钠。
本发明中,碳酸酯聚合物为非靶向碳酸酯聚合物,或者非靶向碳酸酯聚合物/靶向碳酸酯聚合物,即非靶向碳酸酯聚合物、靶向碳酸酯聚合物的混合物。这些聚合物及制备方法为现有技术。比如:
非靶向碳酸酯聚合物为peg-p(tmc-dtc),以tmc、dtc为原料,peg为引发剂,聚合得到,具体制备方法包括如下步骤,在氮气手套箱内,依次称取meo-peg-oh、tmc和dtc,并溶解在二氯甲烷中,搅拌加入催化剂磷酸二苯酯(dpp,dpp/oh摩尔比为10/1);密封好放置40℃油浴中磁力搅拌下反应2天;三乙胺终止,冰乙醚中沉淀两次,抽滤,真空干燥后得到peg-p(dtc-tmc)。
靶向碳酸酯聚合物为ge11-peg-p(tmc-dtc),在手套箱氮气环境中,先将大分子引发剂nhs-peg-oh(75mg,10μmol)、二硫戊烷三亚甲基碳酸酯(dtc,20mg,0.1mmol)和三亚甲基碳酸酯(tmc,230mg,2.25mmol)充分溶解于1.6ml的二氯甲烷(dcm)中,然后在搅拌的条件下加入dpp(25mg,100μmol,0.2ml)。密封密闭反应器,移出手套箱置于30℃油浴锅中反72h。反应结束后在冰乙醚中沉淀两次、过滤以后、常温真空干燥得到nhs-peg-p(tmc-dtc)。将nhs-peg-p(tmc-dtc)(100mg,3.1μmol)的dmf溶液缓慢滴加到1.5ml搅拌着的ge11多肽(13.8mg,9.0μmol)dmf溶液中,室温下反应48h。反应结束后,装入透析袋(mwco3500da),在20mldmf中透析平衡2小时后取透析液,用tnbsa法测定其中多肽的浓度。然后透析袋中样品继续用3´50mldmf溶液透析16小时,再用2´50mldcm透析4小时以除去未反应多肽。随后在冰乙醚中沉淀、过滤、真空干燥得到最终产物ge11-peg-p(tmc-dtc)。
meo-peg-oh的化学结构式如下:
tmc的化学结构式如下:
dtc的化学结构式如下:
nhs-peg-oh的化学结构式如下:
ge11的化学结构式如下:
本发明中,钙盐为醋酸钙。
本发明中,弱碱性缓冲液为hepes缓冲液,ph为7.0~9.6,优选8.0~9.0,最优选8.0。
本发明中,酸性缓冲液为醋酸-醋酸钠缓冲溶液、柠檬酸或者盐酸,优选为醋酸-醋酸钠缓冲溶液;酸性缓冲液的ph为3.5~5.0,优选为4.0~4.5。
本发明中,含有钙盐的弱碱性缓冲液中,钙盐的浓度为0mm~150mm,优选为10~50mm。
本发明中,采用注射泵将碳酸酯聚合物溶液加入含有钙盐的弱碱性缓冲液中,优选的注射泵的泵推速度为20ml/min~50ml/min,优选为20ml/min~30ml/min。
本发明中,搅拌为磁力搅拌,优选的,搅拌速为200rpm~1000rpm。
本发明中,碳酸酯聚合物溶液中,溶剂为dmso,碳酸酯聚合物的浓度为10mg/ml。
本发明中,碳酸酯聚合物为非靶向碳酸酯聚合物和靶向碳酸酯聚合物时,靶向碳酸酯聚合物的用量为非靶向碳酸酯聚合物质量的10%~25%。
本发明中,弱酸性混合液的ph为4.0~5.5。
本发明中,震荡为在37℃摇床中震荡12h;透析袋截留分子量为3500da,时间为8小时,除去有机溶剂和游离小分子药物。
本发明还公开了碳酸酯聚合物在制备小分子药物的载体中的应用;所述小分子药物为培美曲塞二钠,碳酸酯聚合物为非靶向碳酸酯聚合物,或者非靶向碳酸酯聚合物和靶向碳酸酯聚合物。
本发明还公开了上述载小分子药物的碳酸酯聚合物囊泡在制备抗肿瘤药物中的应用,优选的,所述肿瘤为恶性胸膜间皮瘤。
与现有技术相比,本发明具有如下优点:
1.在本发明公开装载pem的抗肿瘤纳米药物的研究中,首先合成了三嵌段聚合物peg-p(tmc-dtc),在聚合物自组装、交联后得到具有不对称膜结构的交联的聚合物囊泡,囊泡膜的内腔用于包裹生理环境带负电荷的小分子药物;囊泡膜为可逆交联的生物可降解且生物相容性好的ptmc,侧链的二硫戊环类似人体天然抗氧化剂硫辛酸,可提供还原敏感的可逆交联,不但支持纳米药物在血液中长循环,还可保证在细胞内快速解交联,释放药物到靶细胞细胞内;外壳以peg为背景同时具有靶向分子,对癌细胞可高特异性结合。
2.本发明公开方法装载的抗肿瘤药物通过对具有不对称膜结构的交联聚合物囊泡来装载生理环境带负电荷的小分子药物,其体内外抗肿瘤效果、体内血液循环及生物分布、治疗荷皮下恶性胸膜间皮瘤小鼠的情况和毒副作用研究,表明该囊泡装载药物拥有多种独特优点,包括制备的简易操控性、杰出的生物相容性、对药物极好的控制释放性(生理条件泄漏量低/肿瘤细胞内快速释放)、超强的体内循环稳定性、对癌细胞的优越靶向性、卓越的抑制肿瘤生长和转移的能力;因此,本发明公开方法所装载的囊泡体系有望成为集便捷、稳定、多功能等优点于一身的纳米系统平台,用于高效、主动靶向输送带负电的小分子亲水药物至肿瘤。
3.本发明公开方法装载的抗肿瘤药物中具有不对称膜结构的、还原敏感可逆交联、细胞内可解交联的生物可降解聚合物囊泡具有较大的内腔,可用于高效装载带负电荷的小分子药物等,交联的囊泡膜可保护药物不被降解,并可在体内长循环,囊泡的纳米尺寸以及肿瘤特异性靶向使得囊泡可输送药物高效进入肿瘤细胞,在细胞内的还原环境下,囊泡解交联,药物解离释放进入细胞质;本发明的聚合物囊泡纳米药物相较于目前已有的脂质体载体的主动载药法具有载体粒径更小的优势,有利于纳米药物在肿瘤部位的内吞,其次本发明的药物装载方法形成的纳米药物可以减小载体包裹过程中药物的泄露问题,且可以有效的解决负电的小分子药物在体内代谢快,生物利用率低的缺点。
4.本发明公开方法装载的抗肿瘤药物的具有不对称膜结构的聚合物囊泡为交联囊泡,小分子药物通过ph梯度法进入聚合物囊泡内腔,由于内腔中的较高ph以及醋酸钙的存在,使得药物与钙离子形成微沉淀形式而被留在内腔,从而具有稳定的结构,在体内循环良好。可用于解决目前亲水性小分子药物的体内循环时间短、生物利用度不高,有时会造成肾脏的毒副作用等问题,可以有效的提高药效,相比起临床用药具有剂量更低,肿瘤部位富集更强,毒副作用更小,循环时间更长等优势。
附图说明
图1为载药囊泡的粒径;
图2为自由药细胞毒性;
图3为载药囊泡细胞毒性;
图4为不同药物的细胞毒性;
图5为不同醋酸钙初始浓度制备的囊泡的细胞毒性;
图6为空囊泡细胞毒性;
图7为肿瘤体积变化;
图8为小鼠体重变化。
具体实施方式
下面结合实施例和附图对本发明作进一步描述:
本发明载小分子药物的碳酸酯聚合物囊泡的制备方法,包括以下步骤,将碳酸酯聚合物溶液加入含有钙盐的弱碱性缓冲液中,搅拌后加入酸性缓冲液,得到弱酸性混合液;然后加入带负电的小分子药物,再经过震荡、透析,得到载小分子药物的碳酸酯聚合物囊泡。
制备例
根据现有技术制备聚合物。
在氮气手套箱内,依次称取meo-peg-oh(mn=5.0kg/mol,0.50g,100μmol),tmc(1.52g,14.55mmol)和dtc(0.23g,1.18mmol)并溶解在二氯甲烷(dcm,7.0ml)中,搅拌加入催化剂磷酸二苯酯(dpp,dpp/oh摩尔比为10/1)。密闭反应器密封好放置40℃油浴中磁力搅拌下反应2天;三乙胺终止,冰乙醚中沉淀两次,抽滤,真空干燥后得到peg5k-p(dtc2k-tmc15k)。
靶向碳酸酯聚合物为ge11-peg-p(tmc-dtc),在手套箱氮气环境中,先将大分子引发剂nhs-peg-oh(75mg,10μmol)、二硫戊烷三亚甲基碳酸酯(dtc,20mg,0.1mmol)和三亚甲基碳酸酯(tmc,230mg,2.25mmol)充分溶解于1.6ml的二氯甲烷(dcm)中,然后在搅拌的条件下快速加速dpp(25mg,100μmol,0.2ml)。密封密闭反应器,移出手套箱置于30℃油浴锅中反72h。反应结束后在冰乙醚中沉淀两次、然后再离心,过滤以后、常温真空干燥得到nhs-peg-p(tmc-dtc)。将nhs-peg-p(tmc-dtc)(100mg,3.1μmol)的dmf溶液缓慢滴加到1.5ml搅拌着的ge11多肽(13.8mg,9.0μmol)dmf溶液中,室温下反应48h。反应结束后,装入透析袋(mwco3500da),在20mldmf中透析平衡2小时后取透析液,用tnbsa法测定其中多肽的浓度。然后透析袋中样品继续用3´50mldmf溶液透析16小时,再用2´50mldcm透析4小时以除去未反应多肽。随后在冰乙醚中沉淀、过滤、真空干燥得到最终产物ge11-peg7.5k-p(tmc15k-dtc2k)。
实施例一
室温下向900μl含有20mm醋酸钙的hepes弱碱性缓冲液(5mm,ph:8.0)中使用注射泵在25ml/min泵推速率下推入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,然后两项混合采用磁力搅拌(280rpm),形成空囊泡以后,再加入酸性缓冲液(0.4mph为4.0的hac/naac)调节至酸性条件(ph为4.5),再加入带负电的小分子药物20μl浓度为5mg/ml的pem(溶解于纯化水中),混匀后在37℃摇床中震荡12h充分交联。然后使用磷酸盐pb缓冲液(10mm,ph7.4)透析(mwco:3500)8h除去有机溶剂和游离小分子药物,期间换5次介质,由此得到载药可逆核交联的囊泡。
更改醋酸钙,其余不变,作对比实验:往hepes8.0中分别加入碱式碳酸铝、柠檬酸三钙、六水合氯化铁;发现其中的碱式碳酸铝和柠檬酸三钙不溶,形成沉淀而析出;六水合氯化铁溶解性较好,但是载药效率较差,在加入pem后,溶液由澄清变浑浊,粒径约为800nm,粒径分布pdi为0.36,pem的载药包封率<5%。
更改泵推速率,其余不变可以得到不同的载药囊泡。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见表1。从表1可以看到使用注射泵制备囊泡可以得到重现性较好,分布较窄的纳米粒子。
更改磁力搅拌速率,其余不变可以得到不同的载药囊泡。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见下表:
更改初始ph(称为ph1),其余不变可以得到不同的载药囊泡。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见下表:
更改酸性缓冲液,其余不变可以得到不同的载药囊泡。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见下表:
更改醋酸钙浓度,其余不变可以得到不同的载药囊泡。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见下表:
对比例一
室温下向900μl含有20mm醋酸钙的hepes弱碱性缓冲液(ph:8.0)中用注射器直接推入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,其余与实施例一一样,由此得到可逆交联的囊泡。同样的条件重复四次,用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见表2,由表2发现,使用注射器注射方法形成的囊泡纳米粒子在所有制备条件均相同的条件下粒径大小各不相同,表明注射器制备的纳米粒重现性不高,表2中1-4表示平行组。
本发明采用注射泵将碳酸酯聚合物溶液加入含有钙盐的弱碱性缓冲液中,以实施例一25ml/min泵推速率的制备方法为基础,重复四次,得到的载药囊泡粒径变化率小于1.5%,载药量变化率小于1%,说明重现性非常好。
对比例二冷热交替置换溶剂醋酸钙梯度法载药
本例中方法为文献方法,室温下向900μl含有20mmca(ac)2的hepes(5mm,ph:8.0)弱碱性缓冲液中使用注射泵在25ml/min的速率推入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,此时两项混合采用磁力搅拌(280rpm),待形成空囊泡后,将其移至填料为g-25葡聚糖使用120mm硫酸钠为流动相的柱子中,再加入dmso:120mm硫酸钠=1:9的混合溶液进行过柱处理,收集流出的纳米囊泡,再加入盐酸调节过柱后的囊泡溶液ph至4左右,再加入带负电的小分子药物20μl浓度为5mg/ml的pem(溶解于纯化水中)。随后放入37℃摇床6小时,再将其取出置于4℃冰箱中过夜。第二天将纳米囊泡用10mmph:7.4的磷酸盐缓冲液透析(mwco:3500)8h除去有机溶剂和游离小分子药物,期间换5次介质。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,结果见表3,可见用此法装载的囊泡在与本发明形成的囊泡相比,其载药量更低,且粒径更大。因此,对比用文献记录中的方法来包载培美曲塞二钠对此并不适用。
对比例三ph梯度法包载小分子甲氨蝶呤二钠
在实施例一的基础上,将pem更换为mtx,其余不变;制备方法详述为:室温下分别向900μl含有不同醋酸钙浓度(0mm,20mm,50mm)的hepes(5mm,ph:8.0)弱碱性缓冲液中使用注射泵推入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,此时两项混合采用磁力搅拌(280rpm),形成空囊泡以后,再加入酸性缓冲液(0.4mph为4.0的hac/naac)调节至酸性条件(ph为4.5),再加入带负电的小分子药物20μl浓度为5mg/ml的甲氨蝶呤mtx(溶解于纯化水中),混匀后在37℃摇床中震荡12h充分交联。然后使用磷酸盐pb缓冲液(10mm,ph7.4)透析(mwco:3500)8h除去有机溶剂和游离小分子药物,期间换5次介质。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定mtx的包裹效率和纳米药物的载药量。经测量发现,几乎测定不到mtx,因此,其可能不适用于本发明所述方法。
对比例四
室温下向900μl含小分子药物20μl浓度为5mg/ml的pem(溶解于纯化水中)的hepes缓冲溶液(5mm,ph8.0)中加入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,室温静置2h,缓慢转动混合液,使之逐渐分散均匀后,氮气下,加入相当于dtc摩尔量的20%的dtt溶液(最终0.1mm),37℃摇床中震荡(200rpm)12h,使之充分交联。然后转入透析袋(mwco:3500da)透析24h除去有机溶剂和游离的药物,透析介质为hepes缓冲溶液(5mm,ph8.0),期间换5次介质;得到的载pem的囊泡载药量<0.2%。
另外,现有装载阿霉素的梯度法(即柠檬酸梯度法,phin<phout)无法应用于peg5k-p(tmc15k-dtc2k)对pem药物的装载,囊泡几乎测定不到药物。
实施例二载小分子培美曲塞二钠的交联靶向囊泡pem-ge11-ps及体外释放
先按重量比9:1和4:1把peg5k-p(tmc15k-dtc2k)和ge11-peg7.5k-p(tmc15k-dtc2k)混合溶于dmso(10mg/ml)得到两组靶向/非靶向混合聚合物溶液,再将peg5k-p(tmc15k-dtc2k)溶于dmso(10mg/ml),得到一组非靶向混合聚合物溶液。
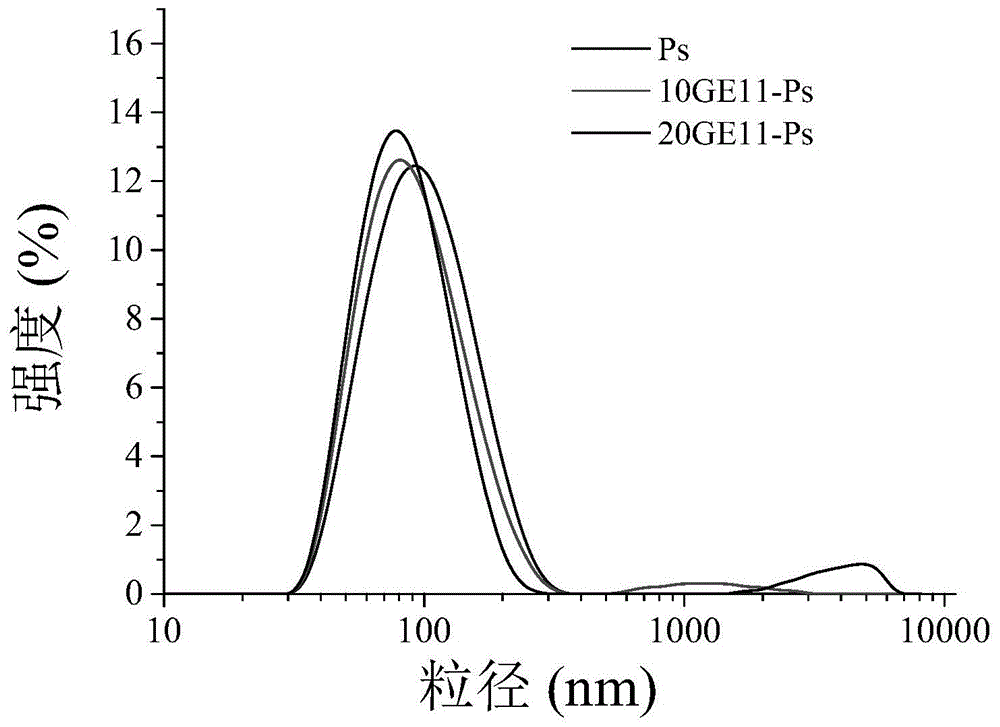
参考实施例一的制备方法,室温下分别向三组900μl含有20mmca(ac)2的hepes(5mm,ph:8.0)弱碱性缓冲液中使用注射泵在25ml/min泵推速率下推入100μl浓度为10mg/ml的两组靶向/非靶向混合聚合物溶液、一组非靶向混合聚合物溶液;然后两项混合采用磁力搅拌(280rpm),形成空囊泡以后,再加入酸性缓冲液(0.4mph为4.0的hac/naac)调节至酸性条件(ph为4.5),再加入带负电的小分子药物20μl浓度为5mg/ml的pem(溶解于纯化水中),混匀后在37℃摇床中震荡12h充分交联。然后使用磷酸盐pb缓冲液(10mm,ph7.4)透析(mwco:3500)8h除去有机溶剂和游离小分子药物,期间换5次介质,由此得到载药可逆核交联的囊泡;得到靶向载药交联囊泡分别称为10%ge11-ps、20%ge11-ps以及非靶向ps。用dls测定其粒径和分布,再用紫外光谱仪(uv)测定pem的包裹效率和纳米药物的载药量,见表4,图1为其粒径分布图。
根据以上方法,不加入药物,得到10%ge11-ps空囊泡、20%ge11-ps空囊泡以及非靶向ps空囊泡。
实施例三mtt法测试载药聚合物囊泡的细胞毒性
mtt法测试自由药pem.2na对人恶性胸膜间皮瘤细胞(msto211h、h2052)和人肺癌细胞(a549)的毒性。三种细胞均以3×103个细胞/孔种于96孔板,每孔80μl,24小时后培养至细胞贴壁70%左右。然后,加入浓度在0.01-50μg/ml的自由药pem.2na,另设pbs细胞对照孔和培养基空白孔(复6孔)。持续培养48小时,加入mtt(5.0mg/ml)10μl,继续培养4小时后加入150μldmso溶解生成的结晶子,用酶标仪于570nm处测吸光度值(a),以培养基空白孔调零,pbs组细胞为100%,计算细胞存活率。由图2结果可知,自由的pem.2na对于msto-211h细胞具有较好的杀伤效果,而a549和h2052细胞对自由的pem.2na不敏感。
mtt法使用人恶性胸膜间皮瘤细胞(msto211h),以3×103个/孔将细胞种于96孔板,每孔80μl,24小时后培养至细胞贴壁70%左右。然后,加入非靶向ps载药囊泡、10%ge11-ps载药囊泡和20%ge11-ps的载药囊泡(实施例二制备的载药囊泡)(pem.2na浓度0.001-10μg/ml),另设细胞空白对照孔和培养基空白孔(复6孔)。培养4小时后,吸去每孔中的培养基以及样品,再加入新鲜培养基继续培养48小时,加入mtt(5.0mg/ml)10μl,继续培养4小时后加入150μldmso溶解生成的结晶子,用酶标仪于570nm处测吸光度值(a),以只加培养基的空白孔调零,加了pbs的细胞为100%,计算细胞存活率。由图3结果可知,载pem.2na的含10%ge11靶向交联聚合物囊泡对msto211h细胞的半致死浓度(ic50)为0.57μg/ml,无靶向囊泡的半致死浓度约为2.1μg/ml,比无靶向组小3.68倍;载药囊泡的杀伤效果足以说明药物被顺利包裹在其中,实验结果也说明本发明的囊泡能很好的将药物传送到细胞内,并有效的释放,最终杀死癌细胞,同时靶向纳米粒的效果要更好。
实施例四mtt法测试载药聚合物囊泡对skov-3的细胞毒性
mtt法使用卵巢癌细胞(sk-ov-3),以4×103个/孔将细胞种于96孔板,每孔80μl,24小时后培养至细胞贴壁70%左右。然后,用自由药pem.2na、非靶向ps载药囊泡(实施例二)和用醋酸钙处理过的pem(详述为用摩尔比为2:1的pem和醋酸钙水溶液混合液)对sk-ov-3细胞的毒性实验,设置不同pem浓度,细胞的培养和实施例三相同,共同培养4小时后,吸出样品换上新鲜培养基继续孵育48h后,而后的mtt加入、处理和测定吸光度同实施例三,结果见图4。
实施例五mtt法测试不同醋酸钙浓度制备出的载药聚合物囊泡的细胞毒性
参见实施例一:室温下向900μl含有不同醋酸钙浓度(0mm,20mm,150mm)的hepes(5mm,ph:8.0)弱碱性缓冲液中使用注射泵推入100μl浓度为10mg/ml的peg5k-p(tmc15k-dtc2k)的dmso溶液,调节ph、加药物等其余步骤都与实施例一一样。得到不同醋酸钙浓度下制备的ps。
mtt法使用人恶性胸膜间皮瘤细胞(msto211h),以3×103个/孔将细胞种于96孔板,每孔80μl,24小时后培养至细胞贴壁70%左右。然后,用内腔含有不同的醋酸钙浓度的上述载药囊泡对msto211h细胞的毒性实验,pem浓度设置为浓度为0.5μg/ml、1μg/ml和2μg/ml,细胞的培养和实施例三相同,共同培养4小时后,吸出样品换上新鲜培养基继续孵育68h后,而后的mtt加入、处理和测定吸光度同实施例三。由图5结果可知,三种浓度装载的纳米药物在此三个浓度下均可对细胞有明显的杀伤效果,相较于无醋酸钙和高浓度醋酸钙,中等浓度似乎杀伤效果更好。此结果也可以说明本发明公开方法制备的纳米药物可以有效的包载pem并进入msto211h细胞顺利释放以达到对该细胞的毒性。
实施例六mtt法测试空聚合物囊泡的细胞毒性
以实施例二制备的10%ge11-ps空囊泡、20%ge11-ps空囊泡以及非靶向ps空囊泡为测试对象,其中非靶向ps空囊泡为两种,分别对应醋酸钙浓度(0mm,20mm)。
按照实施例五公开的mtt法,结果如图6所示说明本发明的交联囊泡空载体毒性很小,具有良好的生物相容性。
实施例七纳米药物ps和靶向纳米药物ge11-ps在荷msto211h皮下恶性胸膜间皮瘤的小鼠中的抑瘤效果和体重变化
实验选用体重为15~18克左右,4~6周龄的balb/c裸鼠(符合苏州大学动物实验规范),在皮下注射1×107个msto211h人肺癌细胞,大约3周后,肿瘤大小为100~200mm3时建模成功,开始实验。通过尾静脉注射的方式将载药囊泡ps、载药囊泡10%ge11-ps、现有药物alimta以及pbs分别在0、3、6、12天通过尾静脉注射小鼠体内(载药囊泡中,pem:6.25mg/kg,alimta:25mg/kg),其中,所使用载药囊泡为实施例二中所制备的载药囊泡。
在0~26天,每两天称量小鼠的体重,游标卡尺测量肿瘤体积,肿瘤体积计算方法为:v=(l×w×h)/2,(其中l、w和h分别为肿瘤的长度、宽度、厚度)。持续观察小鼠直至给完最后一针过8天。由图5、6可知,其中a为肿瘤生长曲线,b为体重变化,ps和ge11-ps组治疗26天内,肿瘤得到明显抑制,而alimta组肿瘤有明显的增长,且在给药的第0-12天,纳米药物组别抑瘤效果也明显强于alimta组和pbs组。小鼠的体重几乎没有改变,说明载药交联囊泡对小鼠没有毒副作用。因此,本发明的靶向交联囊泡载药后在相对于自由药更低的剂量下,也可有效抑制肿瘤的增长,且对小鼠没有毒副作用,说明了本方法可以有效的装载pem并且对小鼠的肿瘤有更明显的抑制作用。
现有技术通过末端修饰含有pei或者精胺的小分子的聚合物形成的囊泡,通过其内腔中氨基所带正电荷与小分子药物上的负电通过静电作用结合物理包埋药物,然而由于本发明针对聚合物囊泡内膜不含有正电性小分子研发了新的载药方法,取得良好的载药量与包封率,克服了现有技术需要聚合物带修饰基团才能够有效包覆带电性药物的技术偏见。
- 还没有人留言评论。精彩留言会获得点赞!