一种具有可控性的磷酸铁制备方法与流程
本发明合成过程控制技术领域,具体涉及一种具有可控性的磷酸铁制备方法。
背景技术:
磷酸铁,又名磷酸高铁、正磷酸铁,分子式为fepo4,是一种白色、灰白色单斜晶体粉末,是铁盐溶液和磷酸或磷酸盐作用得到的盐,其中的铁为正三价,磷酸铁中的铁离子为三价铁离子,通常制备的磷酸铁以二水合物居多,即fepo4·2h2o,振实密度为1.13~1.59g/cm3,松装密度0.75~0.97g/cm3,加热时易溶于盐酸,但难溶于其它酸,几乎不溶于水、醋酸或醇。
磷酸铁是有机农业中批准使用的为数不多几种灭螺剂之一,与以前使用的四聚乙醛不同,它对宠物和野生动物无毒。在钢和金属制造工艺中有使用这种材料。将磷酸铁粘合到金属表面,可以防止金属被进一步氧化。它的存在可以部分解释德里铁柱的耐腐蚀性,也可用作催化剂及制造陶瓷等。随着磷酸铁锂电池的快速发展和日益普及,而且fepo4对热稳定,普遍较易循环利用,磷酸铁最重要的应用在于制造磷酸铁锂电池材料,也是电动汽车电池的理想电极材料。
高纯度的二水磷酸铁的颜色为近白色或浅(淡)黄白色粉末,随着结晶水的丢失,颜色逐渐变黄,纯无水物呈黄白色粉末。二水物磷酸铁中磷(p)超标时外观呈灰白色或暗灰白色,如铁超标时呈暗黄色。磷酸铁中如存在大量的二价铁时,二水磷酸铁则呈暗黑色或灰白色。当前制备磷酸铁的方法很多,依其用途不同,对其活性的要求也不同,但在锂电池材料行业中,由于磷酸铁是制备锂电池正极材料磷酸铁锂的前驱体,杂质的存在可大幅度降低磷酸铁锂的活性,同时还会对电池的安全、寿命等产生不良影响,故对其杂质的要求也十分严格。
虽然现在制备锂电池正极材料所用的磷酸铁工艺方法有很多,但制备出高活性的磷酸铁,即纯度高杂质少的磷酸铁却不易,其主要原因是产物磷酸铁中含有杂质,这导致当前磷酸铁锂的生产不得不采用多种方法来做最终处理以提高磷酸铁锂的品质。但到目前为止,反应进程低、可控性差仍是造成 杂质存在并严重影响磷酸铁锂品质的重要原因。此外,一些复杂的生产工艺虽然能够在一定程度上提高磷酸铁的品质,但又会导致生产成本高昂,废水难以处理等诸多弊病。
因此,如何得到一种具有可控性的磷酸铁制备方法,从而减少最终产物中杂质的含量,同时又适于大批量工业化生产,已成为行业内具有前瞻性的科研人员亟待解决的主要问题。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种具有可控性的磷酸铁制备方法,本发明提供的制备方法,即一种控制氧化进程的磷酸铁制备方法,能够有效的控制最终产品中fe2o3杂质的含量,而且反应条件温和,工艺简单,易于实现规模化生产。
本发明提供了一种具有可控性的磷酸铁制备方法,包括以下步骤:
a)将二价铁盐、磷源和水混合后,得到反应体系;
b)向上述步骤得到的反应体系中间歇性加入氧化剂进行反应,通过检测加入氧化剂后的反应体系中铁离子的浓度值,动态控制后续氧化剂的加入量和/或加入时间,直至反应完成,得到磷酸铁;
所述铁离子包括二价铁离子和/或三价铁离子。
优选的,所述二价铁盐包括氯化亚铁;所述磷源包括磷酸、磷酸二氢钠、磷酸二氢钾、磷酸氢二钠、磷酸氢二钾、磷酸三钠和磷酸三钾中的一种或多种;所述氧化剂包括空气、氧气和过氧化氢中的一种或多种。
优选的,所述二价铁盐与磷源的摩尔比为1∶(1~2);所述反应体系中二价铁盐的摩尔浓度为1.0~2.0mol/l。
优选的,所述步骤b)具体为:
b1)向上述步骤得到的反应体系中第一次持续加入氧化剂进行反应,得到第一反应体系,同时实时检测第一反应体系中三价铁离子的浓度值,当所述第一反应体系中三价铁离子的浓度值为第一浓度值时,停止加入氧化剂;
b2)当所述第一反应体系中三价铁离子的浓度值降至第二浓度值时,向上述第一反应体系中第二次持续加入氧化剂进行反应,得到第二反应体系,同时实时检测上述第二反应体系中三价铁离子的浓度值,当所述第二反应体系中三价铁离子的浓度值为第三浓度值时,停止加入氧化剂;
b3)n-3次重复步骤b2)后,当第n-1反应体系中三价铁离子的浓度值降至第2n-2浓度值时,向上述第n-1反应体系中第n次持续加入氧化剂进行反应,得到第n反应体系,同时实时检测上述第n反应体系中三价铁离子的浓度值,当所述第n反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂,得到磷酸铁;
所述n为大于等于3的正整数,所述第2n-2浓度值与第2n-1浓度值的比值大于等于0.95。
优选的,所述第n次持续加入氧化剂的时间为大于等于8分钟。
优选的,当第m反应体系中,二价铁离子的浓度为所述反应体系中二价铁盐的摩尔浓度的40%~60%时,停止加入氧化剂,搅拌20~60分钟后,继续进行步骤b3);
所述m为小于等于n-1的正整数。
优选的,所述第一浓度值为15~19mg/l;所述第二浓度值为9~13mg/l;所述第三浓度值为11~15mg/l;所述第2n-2浓度值为11~13mg/l;所述第2n-1浓度值为12~14mg/l。
优选的,当所述第n反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂后,再进行继续混合和后处理,得到磷酸铁;
所述继续混合的时间为30~120分钟。
优选的,所述步骤b)具体为:
b1`)向上述步骤得到的反应体系中第一次持续加入空气和/或氧气进行反应,得到第一反应体系,同时实时检测第一反应体系中三价铁离子的浓度值,当所述第一反应体系中三价铁离子的浓度值为第一浓度值时,停止加入空气和/或氧气;所述第一浓度值为15~19mg/l;
b2`)当所述第一反应体系中三价铁离子的浓度值降至第二浓度值时,向上述第一反应体系中第二次持续加入空气和/或氧气进行反应,得到第二反应体系,同时实时检测上述第二反应体系中三价铁离子的浓度值,当所述第二反应体系中三价铁离子的浓度值为第三浓度值时,停止加入空气和/或氧气;所述第二浓度值为9~13mg/l;所述第三浓度值为11~15mg/l;
b3`)x-2次重复步骤b2)后,当第x反应体系中,二价铁离子的浓度为所述反应体系中二价铁盐的摩尔浓度的40%~60%时,搅拌20~60分钟;
所述x为大于等于2的正整数;
b4`)向上述第x反应体系中持续加入过氧化氢进行反应,得到第x+1反应体系,同时实时检测上述第x+1反应体系中三价铁离子的浓度值,当所述第x+1反应体系中三价铁离子的浓度值为第x+2浓度值时,停止加入过氧化氢;
b5`)y-4次重复步骤b4)后,当所述第y-1反应体系中三价铁离子的浓度值降至第2y-2浓度值时,向上述第y-1反应体系中第y次持续加入过氧化氢进行反应,得到第y反应体系,同时实时检测上述第y反应体系中三价铁离子的浓度值,当所述第y反应体系中三价铁离子的浓度值为第2y-1浓度值时,停止加入过氧化氢,继续搅拌混合30~120分钟,再后处理后得到磷酸铁;所述第2y-2浓度值为11~13mg/l;所述第2y-1浓度值为12~14mg/l;
所述第y次持续加入过氧化氢的时间为大于等于8分钟;
所述y为大于等于4的正整数,所述y≥x+2;所述第2y-2浓度值与第2y-1浓度值的比值大于等于0.95。
优选的,所述反应体系的温度为60~90℃;所述制备过程的时间为4~10小时。
本发明提供了一种具有可控性的磷酸铁制备方法,包括以下步骤,首先将二价铁盐、磷源和水混合后,得到反应体系;然后向上述步骤得到的反应体系中间歇性加入氧化剂进行反应,通过检测加入氧化剂后的反应体系中铁离子的浓度值,动态控制后续氧化剂的加入量和/或加入时间,直至反应完成,得到磷酸铁;所述铁离子包括二价铁离子和/或三价铁离子。与现有技术相比,本发明提出采用控制氧化法来制备得到一种具有高活性的磷酸铁产品,控制氧化法主要是通过监测反应液中铁离子浓度,而且还可以绘制fe3+浓度曲线图,从而控制反应过程中氧化剂的加入量和/或加入时间,从而可实现有效的控制铁离子与磷酸根的整个反应进程,可大幅度提高反应进行的程度,提高反应效率,降低杂质fe2o3的含量。而且本发明提供的制备方法,反应条件温和,工艺简单,产品磷酸铁为大颗粒球形体,易于分离和清洗,适合大批量工业化生产。实验结果表明,本发明反应终止时,溶液中铁离子含量小于0.002mol,即铁离子与磷酸根的反应进程接近100%,且产品中未检测出fe2o3杂质。以本发明制备的磷酸铁产品为前驱体制备的磷酸铁锂的电化学比容量能 够达到165mah/g。
附图说明
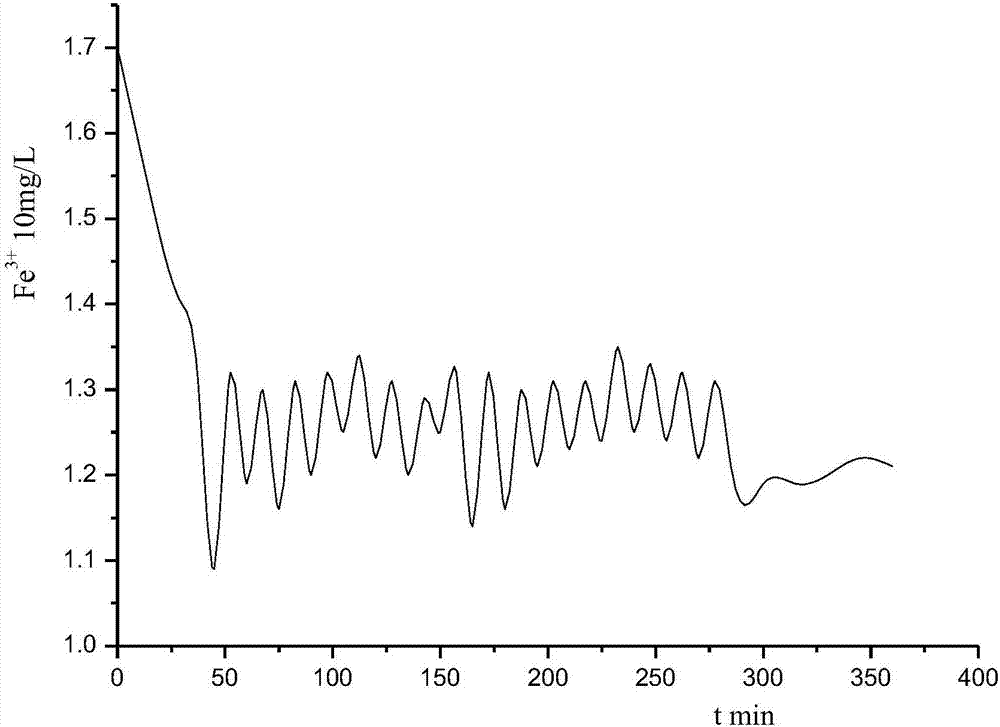
图1为本发明实施例1实时监测的三价铁离子浓度变化曲线图;
图2为本发明实施例1所制备的磷酸铁产品的sem电镜图;
图3为本发明实施例1所制备的磷酸铁产品的外观图;
图4为本发明实施例1制备的锂离子电池的电化学活性曲线图。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对发明权利要求的限制。
本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。
本发明所有原料,对其纯度没有特别限制,本发明优选采用分析纯。
本发明提供了一种具有可控性的磷酸铁制备方法,包括以下步骤:
a)将二价铁盐、磷源和水混合后,得到反应体系;
b)向上述步骤得到的反应体系中间歇性加入氧化剂进行反应,通过检测加入氧化剂后的反应体系中铁离子的浓度值,动态控制后续氧化剂的加入量和/或加入时间,直至反应完成,得到磷酸铁;
所述铁离子包括三价铁离子和/或二价铁离子。
本发明首先将二价铁盐、磷源和水混合后,得到反应体系。
本发明对所述二价铁盐没有特别限制,以本领域技术人员熟知的用于制备磷酸铁的二价铁盐即可,本发明优选包括氯化亚铁;本发明对所述磷源没有特别限制,以本领域技术人员熟知的用于制备磷酸铁的磷源即可,本发明优选包括磷酸、磷酸二氢钠、磷酸二氢钾、磷酸氢二钠、磷酸氢二钾、磷酸三钠和磷酸三钾中的一种或多种,更优选为磷酸、磷酸二氢钠、磷酸二氢钾、磷酸氢二钠、磷酸氢二钾、磷酸三钠或磷酸三钾,更优选为磷酸、磷酸二氢钠、磷酸氢二钾或磷酸三钠,最优选为磷酸或磷酸二氢钠;本发明对所述氧化剂没有特别限制,以本领域技术人员熟知的用于制备磷酸铁的氧化剂即可,本发明所述氧化剂包括空气、氧气和过氧化氢中的一种或多种,更优选为空气、氧气和过氧化氢中任意两种的混合物,最优选为空气、空气与氧气的混 合物或过氧化氢。本发明对所述磷酸铁没有特别限制,以本领域技术人员熟知的磷酸铁即可,本发明制备的磷酸铁优选是指二水合磷酸铁。
本发明对所述二价铁盐与磷源的比例没有特别限制,以本领域技术人员熟知的制备磷酸铁过程中二价铁盐与磷源的比例即可,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整,本发明所述二价铁盐与磷源的摩尔比优选为1∶(1~2),更优选为1∶(1.1~1.9),更优选为1∶(1.3~1.7),最优选为1∶(1.4~1.6);本发明对所述反应体系中二价铁盐的摩尔浓度没有特别限制,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整,本发明所述反应体系中二价铁盐的摩尔浓度优选为1.0~2.0mol/l,更优选为1.0~1.8mol/l,更优选为1.0~1.6mol/l,最优选为1.0~1.4mol/l。
本发明对所述混合没有特别限制,以本领域技术人员熟知的混合方式即可,本发明优选为搅拌混合。本发明对所述反应体系的条件没有特别限制,以本领域技术人员熟知的类似反应的反应条件即可,本发明所述反应体系的温度优选为60~90℃,更优选为65~85℃,最优选为70~80℃。本发明对所述制备过程的条件没有特别限制,以本领域技术人员熟知的磷酸铁制备过程的条件即可,本发明所述制备过程的整体时间优选为4~10小时,更优选为5~9小时,最优选6~8小时。本发明所述制备过程中,如无特别注明,均优选在搅拌混合条件下进行。
本发明然后向上述步骤得到的反应体系中间歇性加入氧化剂进行反应,通过检测加入氧化剂后的反应体系中铁离子的浓度值,动态控制后续氧化剂的加入量和/或加入时间,直至反应完成,得到磷酸铁。
本发明对所述铁离子没有特别限制,以本领域技术人员熟知的常规价态的铁离子即可,本发明优选包括三价铁离子和/或二价铁离子,更优选为三价铁离子和二价铁离子,最优选为三价铁离子。本发明所述间歇性加入氧化剂优选是指,阶段性或间断性的加入氧化剂,而并非一次性将全部用量的氧化剂均加入反应体系中。本发明对所述检测的方法没有特别限制,以本领域技术人员熟知的检测反应体系中铁离子的浓度值的方法即可,本发明优选采用长效银电极电化学电位法动态测定铁离子含量。本发明对所述动态控制的定义没有特别限制,以本领域技术人员熟知的动态控制的定义即可,本发明优 选是指通过实时监测反应体系中铁离子的浓度值的变化,然后确定之后的氧化剂的加入量和/或加入时间;本发明更优选实时监测反应体系中三价铁离子的浓度值的变化,并依据监测值绘制三价铁离子浓度的变化曲线,然后根据变化曲线随时调整之后的氧化剂的加入量和/或加入时间。
本发明经研究发现,磷酸铁制备过程中容易存在fe2o3杂质,即使微量便可大幅度降低磷酸铁锂的活性,而且还会使磷铁比这种衡量磷酸铁品质的关键指标失实。同时还会对电池的安全、寿命等产生不良影响。现有的磷酸铁制备工艺中,制备出的磷酸铁活性低主要原因为产物磷酸铁中含有一定量的fe2o3杂质,fe2o3杂质来源于反应液中残留的fe3+,由于不同的现有工艺方法其反应进程的程度不尽相同,但反应液中均会不同程度的残留fe3+,反应进程低控制性差是造成fe2o3杂质存在并严重影响磷酸铁锂品质的重要原因。
本发明采用上述方法,即控制氧化法,优选是指将空气或氧气或富氧空气或过氧化氢等氧化剂与反应液充分混合,并控制进气量或过氧化氢量以控制反应液中fe3+含量,进而控制反应速度。本发明所公开的控制氧化法并非简单的将空气与反应液混合,其关键之处在于需根据反应浓度和反应速度控制空气进入量或混入过氧化氢的量,从而达到控制fe3+含量的目的,并实现进一步控制反应进程的目的。
本发明采用二价铁离子为铁源,当反应物中含有一定量的fe3+后,引起共水解,并生成絮状水解产物,这种水解产物是最终形成磷酸铁的中间产物。由于三价铁与磷酸根的反应需要一定时间,因此,在这个过程中,大量增加fe3+含量,将会破坏絮状水解产物结构,最终难以形成高活性的磷酸铁,所以控制fe3+含量在适当的范围是本发明的关键。本发明采用的是动态监测反应液的铁离子浓度值,由于磷酸根与三价铁形成磷酸铁后,会不断消耗fe3+,导致三价铁离子浓度变化,可根据所监测到的三价铁离子浓度绘制三价铁离子浓度变化曲线进行比较。
本发明对所述步骤b),即控制氧化反应的具体步骤没有特别限制,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整,本发明所述步骤b)具体优选为:
b1)向上述步骤得到的反应体系中第一次持续加入氧化剂进行反应,得到第一反应体系,同时实时检测第一反应体系中三价铁离子的浓度值,当所 述第一反应体系中三价铁离子的浓度值为第一浓度值时,停止加入氧化剂;
b2)当所述第一反应体系中三价铁离子的浓度值降至第二浓度值时,向上述第一反应体系中第二次持续加入氧化剂进行反应,得到第二反应体系,同时实时检测上述第二反应体系中三价铁离子的浓度值,当所述第二反应体系中三价铁离子的浓度值为第三浓度值时,停止加入氧化剂;
b3)n-3次重复步骤b2)后,当第n-1反应体系中三价铁离子的浓度值降至第2n-2浓度值时,向上述第n-1反应体系中第n次持续加入氧化剂进行反应,得到第n反应体系,同时实时检测上述第n反应体系中三价铁离子的浓度值,当所述第n反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂,得到磷酸铁;
所述n为大于等于3的正整数,所述第2n-2浓度值与第2n-1浓度值的比值大于等于0.95。
本发明所述反应过程中,优选一直开启搅拌混合,以保证反应均匀,以及较高的反应效率,本领域技术人员也可以根据实际生产情况、质量要求以及产品要求进行选择和调整,采用其他混合方式,如超声、溶液循环等。
本发明首先向上述步骤得到的反应体系中第一次持续加入氧化剂进行反应,得到第一反应体系,同时实时检测第一反应体系中三价铁离子的浓度值,当所述第一反应体系中三价铁离子的浓度值为第一浓度值时,停止加入氧化剂。
本发明对持续加入氧化剂的时间没有特别限制,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整。本发明对持续加入氧化剂的方式没有特别限制,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整,本发明优选直接将氧化剂通入反应体系中,保持一定的流量,在反应体系发生反应的同时,多余的氧化剂(如空气或氧气)会直接溢出反应体系。
本发明对所述实时检测的方法没有特别限制,以本领域技术人员熟知的检测反应体系中铁离子的浓度值的方法即可,本发明优选采用长效银电极电化学电位法动态测定铁离子含量,可以测定三价铁离子含量,也可以测定二价铁离子含量。本发明对所述浓度值没有特别限制,以本领域技术人员熟知的浓度值概念即可,本发明优选为质量体积浓度。本发明所述停止加入氧化 剂后,反应体系优选持续进行搅拌混合,内部的反应并未停止,依然在进行。
本发明当所述第一反应体系中三价铁离子的浓度值降至第二浓度值时,向上述第一反应体系中第二次持续加入氧化剂进行反应,得到第二反应体系,同时实时检测上述第二反应体系中三价铁离子的浓度值,当所述第二反应体系中三价铁离子的浓度值为第三浓度值时,停止加入氧化剂。
本发明上述步骤即为间歇性加入氧化剂,通过检测加入氧化剂后的反应体系中三价铁离子的浓度值,动态控制后续氧化剂的加入量和/或加入时间,直至反应完成。
本发明n-3次重复步骤b2)后,当第n-1反应体系中三价铁离子的浓度值降至第2n-2浓度值时,向上述第n-1反应体系中第n次持续加入氧化剂进行反应,得到第n反应体系,同时实时检测上述第n反应体系中三价铁离子的浓度值,当所述第n反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂,得到磷酸铁。
本发明对所述重复步骤b2)优选是指当第二反应体系中三价铁离子的浓度值为第三浓度值,停止加入氧化剂,当第二反应体系中三价铁离子的浓度值为第四浓度值时,继续持续加入氧化剂,然后根据三价铁离子的浓度值的变化情况,依次循环,直至n-3次循环后,当第n-1反应体系中三价铁离子的浓度值降至第2n-2浓度值时,向上述第n-1反应体系中第n次持续加入氧化剂进行反应,得到第n反应体系,同时实时检测上述第n反应体系中三价铁离子的浓度值,当所述第n反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂,得到磷酸铁。
本发明所述n优选为大于等于3的正整数,更优选为大于等于4的正整数,更优选为大于等于5的正整数。本发明所述第n次持续加入氧化剂的时间为大于等于8分钟,更优选为大于等于9分钟,更优选为大于等于10分钟,最优选为10~30分钟。本发明第n次,即最后一次持续加入氧化剂过程中,测量浓度值,即第2n-1浓度值,若与前一次的浓度值,即第2n-2浓度值,相近时,表明反应物耗尽(也可通过观察溶液颜色辅助判定,溶液颜色由初始时的墨绿逐步变为清亮无色透明,表示反应物已耗尽),可以停止循环,即间歇性加入氧化剂的过程结束。本发明所述第2n-2浓度值与第2n-1浓度值的比值优选为大于等于0.95,更优选为大于等于0.97,最优选大于等于0.99。
本发明对所述浓度值的具体选择范围没有特别限制,本领域技术人员可以根据实际生产情况、质量要求以及产品要求进行选择和调整,本发明所述第一浓度值优选为15~19mg/l,更优选为15.5~18.5mg/l,更优选为16~18mg/l,最优选为16.5~17.5mg/l,具体可以为17mg/l;本发明所述第二浓度值优选为9~13mg/l,更优选为9.5~12.5mg/l,更优选为10~12mg/l,最优选为10.5~11.5mg/l,具体可以为11mg/l;本发明所述第三浓度值优选为11~15mg/l,更优选为11.5~14.5mg/l,更优选为12~14mg/l,最优选为12.5~13.5mg/l,具体可以为13mg/l。本发明对所述第2n-2浓度值优选为11~13mg/l,更优选为11.75~12.75mg/l,更优选为11.5~12.5mg/l,最优选为11.25~12.25mg/l,具体可以为12mg/l;本发明所述第2n-1浓度值优选为12~14mg/l,更优选为12.25~13.75mg/l,更优选为12.5~13.5mg/l,最优选为12.75~13.25mg/l,具体可以为13mg/l。本发明对第四浓度值到第2n-3浓度值没有特别限制,本领域技术人员可以根据上述浓度值范围、实际生产情况以及产品要求进行选择和调整,本发明优选从第一浓度值到第2n-1浓度值的变化曲线接近与类阻尼振荡曲线,即始终在一定的浓度范围内震荡,同时浓度范围逐渐缩小,直至近似恒定。
本发明在上述n次反应体系中,还优选当第m反应体系中,实时监测的二价铁离子的浓度降低至一定比例后,暂停加入氧化剂,持续进行搅拌混合。本发明对一定比例没有特别限制,本领域技术人员可以根据上述浓度值范围、实际生产情况以及产品要求进行选择和调整,本发明优选为实时监测的二价铁离子的浓度为所述反应体系中二价铁盐的摩尔浓度(二价铁离子初始摩尔浓度)的40%~60%时,更优选为45%~55%时,暂时停止加入氧化剂,优选搅拌20~60分钟,更优选为30~50分钟,最优选为35~45分钟后,继续进行步骤b3),即继续进行后续的间歇性加入氧化剂的过程。本发明对所述m的取值范围没有特别限制,本领域技术人员可以实际生产情况以及产品要求进行选择和调整,本发明所述m优选为小于等于n-1的正整数,更优选2≤m≤n-1,且m为正整数;更优选3≤m≤n-1,且m为正整数;更优选4≤m≤n-1,且m为正整数。
本发明当所述第n反应体系,即最后一次加入氧化剂的反应体系中三价铁离子的浓度值为第2n-1浓度值时,停止加入氧化剂后。本发明为给予磷酸 铁的生成、结晶反应足够的时间,还优选再进行继续混合和后处理,得到磷酸铁产品。本发明对所述混合的方式没有特别限制,以本领域技术人员熟知的混合方式即可,本发明优选为搅拌混合;本发明对所述继续混合的时间没有特别限制,本领域技术人员可以实际生产情况以及产品要求进行选择和调整,本发明所述继续混合的时间优选为30~120分钟,更优选为50~100分钟,最优选为80~120分钟。本发明对所述后处理的方式没有特别限制,以本领域技术人员熟知的后处理方式即可,本发明优选为分离、洗涤和烘干;本发明对上述分离、洗涤和烘干的具体步骤没有特别限制,本领域技术人员可以实际生产情况以及产品要求进行选择和调整。
本发明所述步骤b)还优选为:
b1`)向上述步骤得到的反应体系中第一次持续加入空气和/或氧气进行反应,得到第一反应体系,同时实时检测第一反应体系中三价铁离子的浓度值,当所述第一反应体系中三价铁离子的浓度值为第一浓度值时,停止加入空气和/或氧气;所述第一浓度值为15~19mg/l;
b2`)当所述第一反应体系中三价铁离子的浓度值降至第二浓度值时,向上述第一反应体系中第二次持续加入空气和/或氧气进行反应,得到第二反应体系,同时实时检测上述第二反应体系中三价铁离子的浓度值,当所述第二反应体系中三价铁离子的浓度值为第三浓度值时,停止加入空气和/或氧气;所述第二浓度值为9~13mg/l;所述第三浓度值为11~15mg/l;
b3`)x-2次重复步骤b2)后,当第x反应体系中,二价铁离子的浓度为所述反应体系中二价铁盐的摩尔浓度的40%~60%时,搅拌20~60分钟;
所述x为大于等于2的正整数。
b4`)向上述第x反应体系中持续加入过氧化氢进行反应,得到第x+1反应体系,同时实时检测上述第x+1反应体系中三价铁离子的浓度值,当所述第x+1反应体系中三价铁离子的浓度值为第x+2浓度值时,停止加入过氧化氢;
b5`)y-4次重复步骤b4)后,当所述第y-1反应体系中三价铁离子的浓度值降至第2y-2浓度值时,向上述第y-1反应体系中第y次持续加入过氧化氢进行反应,得到第y反应体系,同时实时检测上述第y反应体系中三价铁离子的浓度值,当所述第y反应体系中三价铁离子的浓度值为第2y-1浓度值 时,停止加入过氧化氢,继续混合30~120分钟,再后处理后得到磷酸铁;所述第2y-2浓度值为11~13mg/l;所述第2y-1浓度值为12~14mg/l;
所述第y次持续加入过氧化氢的时间为大于等于8分钟;
所述y为大于等于4的正整数,所述y≥x+2;所述第2y-2浓度值与第2y-1浓度值的比值大于等于0.95。
本发明对上述步骤中与前述步骤b1)~b4)中重合的概念或定义,其优选范围和具体选择均一致,在此不再一一赘述。
本发明所述y的定义和选择与所述n类似,本发明所述y优选为大于等于4的正整数,更优选为大于等于5的正整数,更优选为大于等于6的正整数。本发明所述第y次持续加入氧化剂的时间为大于等于8分钟,更优选为大于等于9分钟,更优选为大于等于10分钟,最优选为10~30分钟。本发明第y次,即最后一次持续加入氧化剂过程中,测量浓度值,即第2y-1浓度值,若与前一次的浓度值,即第2y-2浓度值,相近时,表明反应物耗尽(也可通过观察溶液颜色辅助判定,溶液颜色由初始时的墨绿逐步变为清亮无色透明,表示反应物已耗尽),可以停止循环,即间歇性加入氧化剂的过程结束。本发明所述第2y-2浓度值与第2y-1浓度值的比值优选为大于等于0.95,更优选为大于等于0.97,最优选大于等于0.99。
本发明所述x的定义和选择与所述m类似,本发明对所述x的取值范围没有特别限制,本领域技术人员可以实际生产情况以及产品要求进行选择和调整,本发明所述x优选为大于等于2的正整数,更优选为大于等于2且小于等于y-2的正整数,更优选为大于等于3且小于等于y-2的正整数,更优选为大于等于4且小于等于y-2的正整数。
本发明上述b1`)~b5`)步骤中,优选在第x反应体系之前,所用的氧化剂优选为空气和/或氧气,在第x反应体系及之后,所用的氧化剂优选为过氧化氢。本发明上述b1`)~b5`)步骤,即多氧化剂控制联合控制氧化法。
本发明采用上述具有可控性的制备方法制备得到了二水合磷酸铁,即控制氧化法或多氧化剂控制联合控制氧化法,本发明并非简单的将空气与反应液混合,而是根据反应浓度和反应速度控制空气进入量(加入持续时间)或混入过氧化氢的量(加入持续时间),从而达到控制fe3+含量的目的,并实现进一步控制反应进程的目的。本发明采用动态监测反应液的铁离子浓度值, 由于磷酸根形成磷酸铁后,会不断消耗fe3+,导致三价铁离子浓度变化,关键在于控制fe3+含量在适当的范围,而且可根据所监测到的三价铁离子浓度绘制三价铁离子浓度变化曲线,对后期的氧化剂加入进行指导和修正。
实验结果表明,本发明反应终止时,溶液中铁离子含量小于0.002mol,即铁离子与磷酸根的反应进程能够达到99.8%,且产品采用万分之一高精度天平磁力测试实验和1000倍显微镜目测实验均未检测出fe2o3杂质。最后以本发明制备的磷酸铁产品为前驱体制备的磷酸铁锂的电化学活性能够达到165mah/g。
为了进一步说明本发明,下面结合实施例对本发明提供的一种具有可控性的磷酸铁制备方法,进行详细说明,本发明的保护范围不受以下实施例的限制。
实施例1
(1)将含有1.5mol氯化亚铁溶液置于耐酸反应器中,加入磷酸二氢钠;
(2)调整铁/磷比例为1︰1.2(mol),温度60~90℃,在搅拌条件下进行反应;
(3)连续监测反应液的三价铁离子浓度值,以监控实际反应速度;
(4)根据反应进程确定进气量和进气程序;
具体实施:
第一阶段:初始三价铁离子浓度为0(如初始三价铁离子不为0,可持续搅拌利用反应消耗至0);;然后连续进气至三价铁离子浓度17mg/l,停止进气;待反应消耗三价铁离子浓度至11mg/l,再连续进气至三价铁离子浓度13mg/l,再待反应消耗三价铁离子浓度至12mg/l,再连续进气至三价铁离子浓度13mg/l,重复上述过程,并同时做出离子浓度曲线图。参见图1,图1为本发明实施例1实时监测的三价铁离子浓度变化曲线图。
而且后续每次加入空气氧化剂的时间和加入量,可以依据前面测定的三价铁离子浓度在反应中的变化曲线进行选择和调整。此过程中因反应消耗,二价铁离子浓度也逐渐减小,反应液浓度逐渐变小,当二价铁离子浓度降低至50%时,停止加入空气,保持搅拌状态20~60分钟,给予磷酸铁的生成、结晶反应足够的时间。
第二阶段:连续进气至三价铁离子浓度13mg/l;再待反应消耗三价铁离 子浓度至12mg/l,再连续进气至三价铁离子浓度13mg/l,重复上述过程。当连续进气10分钟,三价铁离子没有明显增加时,停止进气。表明反应物耗尽。经采用分光光度计检测溶液中二价铁离子含量,为0.0018mol/l,小于0.002mol/l,表明反应物耗尽。
(5)继续保持搅拌1小时后结束反应;
(6)分离白色固体,用去离子水洗净氯离子、烘干可得高活性磷酸铁产品。
对上述步骤制备的磷酸铁产品,采用万分之一高精度天平进行磁力测试实验和1000倍显微镜进行目测实验,均未检测出含有fe2o3。
对上述步骤制备的磷酸铁产品进行扫描电镜检测和外观检测,参见图2,图2为本发明实施例1所制备的磷酸铁产品的sem电镜图。由图2可知,本发明技术所获产品磷酸铁是由多个单晶体组成的球形,粒径均匀,尺度在100微米左右,其有利于产品的分离和洗涤。参见图3,图3为本发明实施例1所制备的磷酸铁产品的外观图。由图3可知,本发明技术所获产品磷酸铁宏观上呈浅粉红色,由于是球形,故具有较好的流动性,堆积可成塔尖状。
将本发明实施例1制备的磷酸铁产品制备磷酸铁锂,并制备得到锂离子电池。具体方法如下:
磷酸铁锂制备:采用本技术产品磷酸铁为前驱体,加入葡萄糖、碳酸锂,按mol比1∶1.1∶1.05比例充分研磨均匀,打块(
测试锂电池制备:按照和膏(磷酸铁锂∶pvdf∶导电剂sp=8∶1∶1的比例进行配膏),涂片,干燥,冲片,压片,称重,记录的流程制备正极片,采用锂片为负极片,采用cellgard2300隔膜,采用1mol/llipf6/ec-dmc(体积比1∶1)电解液,然后装成,lir2016扣式电池。
对上述步骤制备的锂离子电池进行性能测试,参见图4,图4为本发明实施例1制备的锂离子电池的电化学活性曲线图。由图4可知,以采用本发明技术制备的磷酸铁为前驱体制备的磷酸铁锂材料,经制备成测试电池后的测试曲线可以看出,放电平台平稳,0.1倍率首次放电即可达到162mah/g的放 电比容量,最大放电比容量165mah/g(理论值170mah/g),这也充分说明了本技术产品磷酸铁材料的杂质含量低微。
实施例2
(1)将含有1.3mol氯化亚铁溶液置于耐酸反应器中,加入磷酸二氢钠;
(2)调整铁/磷比例为1︰1.2(mol),温度60~90℃,在搅拌条件下进行反应;
(3)连续监测反应液的三价铁离子浓度值,以监控实际反应速度;
(4)根据反应进程确定进气量和进气程序;
具体实施:
第一阶段:初始三价铁离子浓度为0(如初始三价铁离子不为0,可持续搅拌,利用反应消耗三价铁离子至0);然后连续进气至三价铁离子浓度15mg/l,停止进气;待反应消耗三价铁离子浓度至10mg/l,再连续进气至三价铁离子浓度13mg/l,再待反应消耗三价铁离子浓度至11mg/l,再连续进气至三价铁离子浓度13mg/l,重复上述过程,并同时做出离子浓度曲线图。
而且后续每次加入空气氧化剂的时间和加入量,可以依据前面测定的三价铁离子浓度在反应中的变化曲线进行选择和调整。此过程中因反应消耗,二价铁离子浓度也逐渐减小,反应液浓度逐渐变小,当二价铁离子浓度降低至50%时,停止加入空气,保持搅拌状态20~60分钟,给予磷酸铁的生成、结晶反应足够的时间。
第二阶段:连续进气至三价铁离子浓度12mg/l;再待反应消耗三价铁离子浓度至10mg/l,再连续进气至三价铁离子浓度12mg/l,重复上述过程。当连续进气10分钟,三价铁离子没有明显增加时,停止进气。表明反应物耗尽。经采用分光光度计检测溶液中二价铁离子含量,为0.0018mol/l,小于0.002mol/l,表明反应物耗尽。
(5)继续保持搅拌1小时后结束反应;
(6)分离白色固体,用去离子水洗净氯离子、烘干可得高活性磷酸铁产品。
对上述步骤制备的磷酸铁产品,采用万分之一高精度天平进行磁力测试实验和1000倍显微镜进行目测实验,均未检测出含有fe2o3。
实施例3
多氧化剂控制联合控制氧化法
(1)将含有1.3mol氯化亚铁溶液置于耐酸反应器中,加入磷酸二氢钠;
(2)调整铁/磷比例为1︰1.2(mol),温度60~90℃,在搅拌条件下进行反应;
(3)连续监测反应液的三价铁离子浓度值,以监控实际反应速度;
(4)根据反应进程确定空气的进气量和进气程序及过氧化氢的量和加入程序;
具体实施:
第一阶段:初始三价铁离子浓度为0(如初始三价铁离子不为0,可持续搅拌,利用反应消耗三价铁离子至0);然后连续进气至三价铁离子浓度15mg/l,停止进气;待反应消耗三价铁离子浓度至10mg/l,再连续进气至三价铁离子浓度13mg/l,再待反应消耗三价铁离子浓度至11mg/l,再连续进气至三价铁离子浓度13mg/l,重复上述过程,并同时做出离子浓度曲线图。参见图1,图1为本发明实施例1实时监测的三价铁离子浓度变化曲线图。
而且后续每次加入空气氧化剂的时间和加入量,可以依据前面测定的三价铁离子浓度在反应中的变化曲线进行选择和调整。此过程中因反应消耗,二价铁离子浓度也逐渐减小,反应液浓度逐渐变小,当二价铁离子浓度降低至50%时,停止加入空气,保持搅拌状态20~60分钟,给予磷酸铁的生成、结晶反应足够的时间。
第二阶段:连续加入过氧化氢(此阶段更换氧化剂为过氧化氢)至三价铁离子浓度10mg/l;再待反应消耗三价铁离子浓度至6mg/l,再连续加入过氧化氢至三价铁离子浓度10mg/l,重复上述过程。当连续加入过氧化氢上次加入量时,三价铁离子没有明显增加时,表明反应物耗尽,停止加入过氧化氢。经采用分光光度计检测溶液中二价铁离子含量,为0.0015mol/l,小于0.002mol/l,表明反应物耗尽。
(5)保持搅拌1小时后结束反应;
(6)分离白色固体,用去离子水洗净氯离子、烘干可得高活性磷酸铁产品。
对上述步骤制备的磷酸铁产品,采用万分之一高精度天平进行磁力测试 实验和1000倍显微镜进行目测实验,均未检测出含有fe2o3。
实施例4
(1)将含有1.0mol氯化亚铁溶液置于耐酸反应器中,加入磷酸二氢钠;
(2)调整铁/磷比例为1︰1.1(mol),温度60~90℃,在搅拌条件下进行反应;
(3)连续监测反应液的三价铁离子浓度值,以监控实际反应速度;
(4)根据反应进程确定加入过氧化氢的量和加入程序;
具体实施:
第一阶段:初始三价铁离子浓度为0(如初始三价铁离子不为0,可持续搅拌,利用反应消耗三价铁离子至0);然后连续缓慢加入过氧化氢至三价铁离子浓度10mg/l,停止加入过氧化氢;待反应消耗三价铁离子浓度至6mg/l,再连续缓慢加入过氧化氢至三价铁离子浓度10mg/l,再待反应消耗三价铁离子浓度至6mg/l,再连续缓慢加入过氧化氢至三价铁离子浓度6mg/l,重复上述过程,并同时做出离子浓度曲线图。
而且后续每次加入过氧化氢氧化剂的加入量,可以依据前面测定的三价铁离子浓度在反应中的变化曲线进行选择和调整。此过程中因反应消耗,二价铁离子浓度也逐渐减小,反应液浓度逐渐变小,当二价铁离子浓度降低至50%时,停止加入过氧化氢氧化剂,保持搅拌状态20~60分钟,给予磷酸铁的生成、结晶反应足够的时间。
第二阶段:连续加入过氧化氢至三价铁离子浓度10mg/l;再待反应消耗三价铁离子浓度至6mg/l,再连续加入过氧化氢至三价铁离子浓度10mg/l,重复上述过程。当连续加入过氧化氢已经达到上次的加入量时,三价铁离子没有明显增加时,表明反应物耗尽,停止加入过氧化氢。经采用分光光度计检测溶液中二价铁离子含量,为0.0018mol/l,小于0.002mol/l,表明反应物耗尽。
(5)继续保持搅拌1小时后结束反应;
(6)分离白色固体,用去离子水洗净氯离子、烘干可得高活性磷酸铁产品。
对上述步骤制备的磷酸铁产品,采用万分之一高精度天平进行磁力测试实验和1000倍显微镜进行目测实验,均未检测出含有fe2o3。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!