一种直接氯化生成含钛氯化物的制备方法与流程
本发明属于材料、化学工程和冶金技术领域,特别涉及一种利用金属氯化物氯化含钛原料直接生成含钛氯化物的方法。
背景技术:
钛是一种密度小、比强度高和耐蚀性好的新型结构材料。在航空航天领域,ti主要用于飞机相关零配件和导弹等相关高科技产品的制造。在工业领域,ti是采矿、化工、纺织、电气、冶金等几乎所有制造业的重要原料之一。高纯钛的制备方法主要有四种,分别是以mg热还原法和na热还原法(即kroll法)为代表的金属热还原法、卤(碘)化盐热裂解法(又称为碘化法),电子束区熔化、熔盐电解精炼等方法(铸造技术,2017,38(01):4-7)。其中,熔盐电解精炼是制备高纯ti及其合金的常用方法,通常以含钛电解质nacl-kcl-ticlx用作精炼电解质以获得钛及钛合金。向含钛氯化物熔盐施加直流电,金属钛阳极在电化学过程中发生熔融,钛离子以ti4+、ti2+等的形式进入熔盐,低价态的钛离子通过在阴极上放电而还原成金属钛或钛合金。其中含钛氯化物ticlx的引入问题一直是熔盐电解精炼过程的重要问题。
钛的氯化物中,ticl4是较常用的氯化物原料之一,通常由富钛的原料氯化形成的。目前,实现大规模生产的主要有以下两种氯化方法:熔盐氯化法和沸腾氯化法(现代矿业,2019,35(05):221-225.)。熔盐氯化是以富钛原料为原料,通过熔盐氯化制备ticl4的方法。这主要是悬浮在混合熔盐和氯气中的钛、铁、钙、镁等的氧化物之间的碳加成反应的过程。在氯气的作用下,富钛原料中的氧化物在熔融盐和还原剂碳的介质中进行氯化反应,生成氯化物。沸腾氯化法是用氯气在流化床氯化炉氯化高钛渣和石油焦的混合物。由于固体和气体的相对运动十分剧烈,传质和传热的速度提高,产率得到了提升,单位面积ticl4的产能达到1-1.7t(m2.h),相对操作更便捷。我国在沸腾氯化法的基础上针对我国原料中钙镁氧化物含量高开发的一种创新的工艺生产路线——无筛板沸腾氯化法,为我国钛工业的发展做出了不小的贡献,但是缺乏对后续工序的研究和开发,我国的无筛板沸腾氯化法存在着四氯化钛泥浆处理比较困难、尾气排放不达标等诸多问题(化工管理,2019(14):52-53)。
现有的沸腾氯化法和无筛板氯化法制备ticl4的工艺均存在制备过程不连续、生产成本高、产品纯度较低等固有缺点(有色金属(冶炼部分),2019(05):24-27+49)。且ticl4本身不稳定,沸点为136.4℃,在受热或遇水均会发生分解放热,发烟生成二氧化钛固体和hcl,在空气中形成液滴混合物,具有较强的毒性和腐蚀性,因此,ticl4这种特殊的性质不但制备、保存和运输困难,而且样品容易发生反应和污染,直接购买用于熔盐电解精炼极其昂贵。另外,液态的ticl4在引入熔盐过程中会造成挥发、分解和浪费,影响了金属钛粉、钛合金等钛材制备领域的发展,限制了其相关领域的应用。因此,本发明提出利用含低熔点金属sn和ni的氯化物nacl-kcl-mclx(m为sn、ni等)直接与ti发生氯化反应制备nacl-kcl-ticlx或nacl-kcl-ticlx-mclx电解质,用以电解精炼制备ti及其ti合金,可简化制备流程,提高制备效率。
技术实现要素:
本发明的目的在于研究低熔点金属sn和ni的氯化物与ti发生氯化反应原位生成含ticlx的熔盐的反应过程,并提出了电化学方法在线监测反应进程的过程。利用生成的含ticlx熔盐直接电解精炼制备钛或者钛合金,可简化制备流程,提高制备效率。
本发明采用以下技术方案:一种直接氯化生成含钛氯化物的制备方法,其中,制备包括以下步骤:
(1)电极的制备与组装:
(a)对电极的制备:首先,将光谱纯石墨棒制备为定长短棒;然后,使用不同砂纸进行多次打磨处理;并在棒的一端钻取小孔,用于连接钢丝;使用去离子水石墨棒进行超声清洗随后烘干;最后将烘干的石墨棒与合金丝相连接,得到实验所用对电极;
(b)参比电极的制备:截取ni丝,使用不同砂纸进行多次打磨处理,用去离水进行超声清洗,随后用无水乙醇清洗并将其干燥,一端缠绕成螺旋状,另一端紧密的缠绕在钢丝上,得到实验所用的参比电极;
(c)工作电极的制备:使用光谱石墨棒,采用和对电极石墨棒相同处理方法,得到石墨工作电极;取mo丝,用去离水进行超声清洗,随后用无水乙醇清洗并将其干燥,将其一段紧紧缠绕在合金丝上,得到mo丝工作电极;
(2)熔盐的处理:称取等摩尔的nacl和kcl,,混合均匀后放入马弗炉,在250℃的温度下烘干,然后向炉中充入惰性气体氩气,升温至750℃,使混合熔盐充分融化得到nacl-kcl混合熔盐体系,后续所有实验温度均在750℃下进行,在2.8v的电压下对nacl-kcl熔盐进行2.0h的预电解消除熔体中可参与氧化还原反应的杂质及残余水的影响。
(3)置换反应物的引入:在熔盐中引入无水nicl2或sncl2的片,并且在熔体稳定后,引入ti单质,投入的过量片状纯ti片。
(4)电化学原位在线测试:采用循环伏安法,方波伏安法测试反应过程中nicl2、sncl2、ticlx在nacl−kcl中的电化学行为。
进一步的所述无水nicl2和无水sncl2均为直接购入后存放在密封的真空干燥中,在熔盐引入过程中,采用将氯化物粉末压片的方式多次引入,每次约引入1.5g片状氯化物进入熔盐中。
进一步的所述ti片及电极使用不同砂纸进行多次打磨处理为使用400#、600#和1500#砂纸进行打磨和抛光。
本发明的有益效果:
在nacl-kcl-nicl2和nacl-kcl-sncl2熔盐中添加过量ti片发生氯化反应,氯化反应均能顺利进行,且氯化过程均会有金属间化合物生成,且最终得到了性质稳定的nacl-kcl-nicl2-ticl2及nacl-kcl-sncl2-ticl2熔盐,可以用来进一步制备ni-ti及sn-ti合金,是一种较好的制备含ti熔盐的方法,简化了制备流程,较好的提高了制备效率。
附图说明
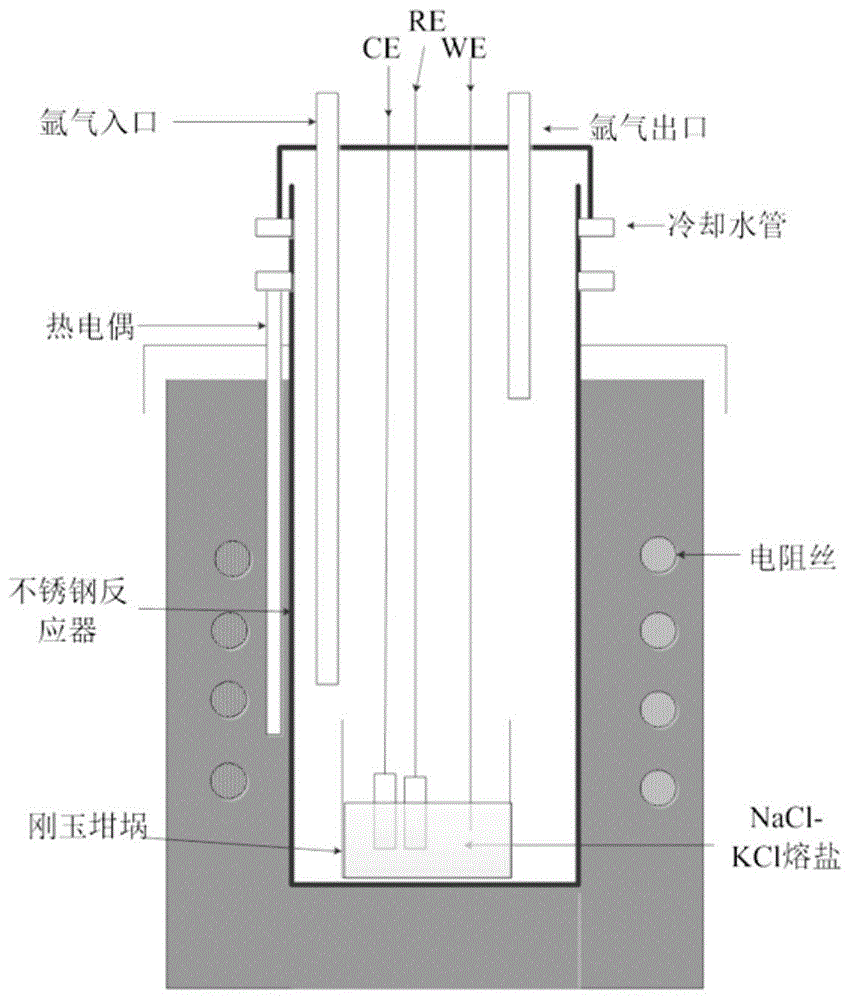
图1:电阻炉及三电极体系示意图;
图2:750℃石墨电极在nacl-kcl-nicl2(2.0wt%)熔盐中投入ti片后的循环伏安曲线,扫速:0.1v/s;
图3:750℃下在nacl-kcl-sncl2(2.0wt%)熔盐中投入ti片后置换过程在石墨电极循环伏安测试曲线图,扫速:0.1v/s;
图4:ti-sn二元合金相图;
图5:750℃下在nacl-kcl-sncl2(2.0wt%)熔盐中投入ti片后置换过程在石墨电极方波伏安测试曲线图。
具体实施方式
一种直接氯化生成含钛氯化物的制备方法具体实施包括电极的制备和组装、熔盐的预处理、置换反应物的引入、电化学原位在线测试。
(1)电极的制备与组装:本实验所有电化学实验中的对电极均采用石墨棒制作;镍丝作参比电极;工作电极包括钼丝电极和石墨电极。具体制备过程如下:
(a)对电极的制备:首先,将直径φ10mm的光谱纯石墨棒切割为长6cm的短棒;然后,依次经400#、600#和1500#砂纸进行三遍打磨处理;并在棒的一端用手钻钻取φ2mm的小孔,用于连接钢丝;使用去离子水石墨棒进行超声清洗随后烘干;最后将烘干的石墨棒与合金丝相连接,得到实验所用对电极。
(b)参比电极的制备:截取长度约为30cm的ni丝,使用400#、600#和1500#砂纸进行打磨和抛光,用去离水进行超声清洗,随后用无水乙醇清洗并将其干燥,一端缠绕成约10cm的螺旋状,另一端紧密的缠绕在钢丝上,得到实验所用的参比电极。
(c)工作电极的制备:使用直径为6mm的光谱石墨棒,采用和对电极石墨棒相同处理方法,得到石墨工作电极;取长度约为20cm的mo丝,用去离水进行超声清洗,随后用无水乙醇清洗并将其干燥,将其一段紧紧缠绕在合金丝上,得到mo丝工作电极。
(2)熔盐的处理:所采用的电解质为nacl-kcl的共晶,其具体比值通过相图确定。当nacl、kcl摩尔比为1:1时,在657℃条件下存在共晶点,因此根据此配比条件制备熔盐电解质,以获取稳定的共晶熔盐。称取等摩尔的nacl和kcl(质量比约为4:5),混合均匀后300g,放入马弗炉,在250℃的温度下烘干72h。然后向炉中充入惰性气体氩气,升温至750℃,使混合熔盐充分融化得到nacl-kcl混合熔盐体系,后续所有实验温度均在750℃下进行。为了消除熔体中可参与氧化还原反应的杂质及残余水的影响,在2.8v的电压下对nacl-kcl熔盐进行2.0h的预电解。由于nicl2和sncl2的吸水性强且不易脱水制备,本发明所用无水nicl2和无水sncl2均为直接购入后存放在密封的真空干燥中。在熔盐引入过程中,采用将氯化物粉末压片的方式多次引入,每次约引入1.5g片状氯化物进入熔盐中。
(3)置换反应物的引入:在熔盐中引入无水nicl2或sncl2的片,并且在熔体稳定后,引入ti单质。
(4)电化学原位在线测试:采用循环伏安法,方波伏安法测试反应过程中nicl2、sncl2、ticlx在nacl−kcl中的电化学行为。本发明所采用的实验装置为电阻炉,三电极体系如图1所示。电阻炉包括电阻炉由炉体、不锈钢反应器、电阻丝、热电偶、气路系统(氩气进出口)、冷却水系统、三电极体系(工作电极、对电极、参比电极)、刚玉坩埚(内放熔盐)。电化学实验采用的测量仪器为普林斯顿versastat4电化学工作站,数据的采集和记录通过计算机来进行。
实验数据分析
实验分别采用低熔点金属ni和sn的氯化物nicl2和sncl2,使其与ti发生氯化反应原位生成含ticlx的熔盐,且还原后的sn和ni将返回到坩埚底部,而不引入杂质。利用生成的含ticlx熔盐直接电解精炼制备钛或者钛合金。
1ti和nicl2氯化反应的热力学计算
氯化反应主要利用镍和钛之间的电负性差异,ti和nicl2之间发生取代反应。然而,钛有许多价态。以下对ti和ni之间可能发生的置换反应进行了热力学计算。钛和氯化镍在750℃时的主要反应类型如下:
ti+nicl2=ticl2+ni△g=-198.748kj/mol(1)
2/3ti+nicl2=2/3ticl3+ni△g=-181.578kj/mol(2)
0.5ti+nicl2=0.5ticl4+ni△g=-130.820kj/mol(3)
比较(1)-(3)中反应的吉布斯自由能,可以看出它们的吉布斯自由能都是负的,但ticl2的吉布斯自由能最负,即ticl2理论上占优势,更稳定。另外,ticl不能稳定存在,ticl3和ticl4可能存在,但不如ticl2稳定。
2含2.0wt%nicl2熔盐与ti氯化过程研究
由于基础熔盐kcl-nacl的质量为300g,因而含2.0wt%nicl2的熔盐中nicl2的加入量为6g,待kcl-nacl熔盐熔融后,nicl2压制成1.5g/片,分成4片引入熔盐中。然后在熔盐中引入纯ti片5g,采用电化学循环伏安法监测nicl2与ti反应前(0min)与反应后(30min及以后)电化学信号曲线,如图2所示。
由图2可知,加入ti片之前(0min)曲线只有在0.4v左右有一对氧化还原峰t/t’,对应着ni2+/ni的氧化还原峰。随着反应时间进行,t/t’氧化峰与还原峰的峰电流都在逐渐变小。并且,随着峰电流的减小,峰电位发生了轻微移动,氧化峰和还原峰均向左移动。这是由于反应中ni2+离子在阴极附近的活度不断变化,析出电位也在不断变化,可以用能斯特方程来解释这种现象。此外,反应至90min时,在0.39v和-0.085v处出现的氧化还原峰k/k’应为ni-ti金属间化合物的峰,120min时在-0.48v和-0.6v处出现了ti离子的氧化还原峰h/h’。
随反应进行,k/k’和h/h’均不断增大,t/t’逐渐下降,至180min时,金属间化合物的峰k/k’达到最大,随后不断降低,对应着ni-ti金属间化合物的溶解,这与熔盐中两种离子的浓度变化有关,随着反应的进行,ti离子浓度逐渐增加,ni2+离子浓度逐渐降低,说明氯化反应持续进行。但当反应进行至240min后,几种离子的峰几乎不发生变化,说明反应到达稳定阶段。由图2所经历反应可知,随着反应时间的不同,熔盐中ni2+、ti2+离子的浓度不断发生变化,可以利用不同反应时间的离子浓度来制备ni-ti合金。
3ti与sncl2氯化反应热力学计算
同理,氯化反应的原理是利用sn和ti间的电负性差异,使ti与sncl2之间发生置换反应。ti由+2、+3、+4等多种价态,式(4)~(6)对它们可能存在的反应进行了热力学计算。下列各式为750℃下ti与sncl2的主要反应。
ti+sncl2=sn+ticl2△g=-139.950kj/mol(4)
2/3ti+sncl2=sn+2/3ticl3△g=-122.780kj/mol(5)
0.5ti+sncl2=sn+0.5ticl4△g=-72.022kj/mol(6)
对比几个反应的吉布斯自由能可知,虽然它们的吉布斯自由能均为负,理论上均可发生反应。但生成ticl2的吉布斯自由能最负,说明它相比起来最稳定。此外ticl不能稳定存在,在熔盐中无法生成。因而熔体中最终产物理论应以ticl2为主。
4含2.0wt%sncl2熔盐与ti氯化过程研究
由于基础熔盐kcl-nacl的质量为300g,因而含2.0wt%sncl2的熔盐中sncl2的加入量为6g,待kcl-nacl熔盐熔融后,sncl2压制成1.5g/片,分成4片引入熔盐中。然后在熔盐中引入纯ti片5g,采用电化学循环伏安法监测sncl2与ti反应前(0min)与反应后(10min及以后)电化学信号曲线,如图3所示。
图3是sncl2浓度为2.0wt%,同时增加ti片的投入量至5g后在石墨电极上的循环伏安测试曲线。在石墨电极上,ti加入反应体系之前,熔盐中有两对氧化还原峰,分别是sn2+/sn的氧化还原的a5/c5,和代表sn4+/sn2+的氧化还原的a6/c6。反应开始10min后,在-0.6v处出现了新的氧化峰a9,在-0.9v处出现了与之相对应的还原峰c9,此后a9/c9峰的峰电流和峰宽随时间不断增加,由ti-sn合金相图4可知a7/c7为tixsny金属间氧化物的氧化还原峰。反应至30min时,代表sn2+/sn、sn4+/sn2+的峰降低,可知随反应进行,sn离子逐渐参与氯化反应,浓度减少。同时ti-sn的氧化峰持续升高,由相图可知ti-sn金属间氧化物的组成种类复杂,随着氯化反应过程的进行,熔盐中ti、sn含量的变化,tixsny金属间氧化物的种类也在发生变化,且由相图可知,反应到最终时刻70min时,仍以tixsny金属间氧化物的形式存在。由于tixsny金属间氧化物种类复杂,a5/c5、a6/c6位置处的峰也可能代表某种tixsny金属间氧化物的峰。
如图5所示,反应开始时,方波伏安中只有sn(iv)和sn(ii)共同的氧化峰c8,反应10min时,在-0.7v处出现了新的还原峰c9,根据循环伏安曲线的判断可知c9为tixsny金属间氧化物的还原峰。反应至30min时,c9峰达到最大,随后峰电流不断减小,且在10min~70min之间,tixsny的还原峰峰电流不断正移,这可能是熔盐中的tixsny金属间氧化物的种类可能发生了变化。反应后期至70min时,与循环伏安测试类似,c8处可能存在tixsny金属间氧化物的峰。
综上:在nicl2和sncl2熔盐中添加ti进行氯化反应,采用循环伏安法、方波伏安法实施原位在线监测,实验结果表明,在nacl-kcl-nicl2和nacl-kcl-sncl2熔盐中添加过量ti片发生氯化反应,氯化反应均能顺利进行,且氯化过程均会有金属间化合物生成,且最终得到了性质稳定的nacl-kcl-nicl2-ticl2及nacl-kcl-sncl2-ticl2熔盐,可以用来进一步制备ni-ti及sn-ti合金,是一种较好的制备含ti熔盐的方法,简化了制备流程,较好的提高了制备效率。
- 还没有人留言评论。精彩留言会获得点赞!