一种细毛羊毛囊干细胞分离培养方法与流程
本发明属于生物技术领域,涉及一种细毛羊毛囊干细胞分离培养方法。
背景技术:
体外培养细毛羊毛囊干细胞,对于探讨与其生长相关的因子、激素等作用机理,改善羊毛品质,提高产毛量具有重要的经济意义和价值。毛囊干细胞(hairfolliclestemcells,FSC)被认为是慢循环细胞(slowcyclingcell)或极少循环细胞(rarelycyclingcell),具有干细胞的一般特点,即自我复制性(self-renew)和多项潜能性(multi-potent),可分化成毛囊、皮脂腺和表皮,对毛发的再生以及毛色的影响起着重要的作用(Wakayamat等,2001)。目前多数研究认为毛囊干细胞位于毛囊的隆突部和外根鞘的最外层。毛囊隆突部的细胞具有干细胞的特征,在培养状态下毛囊隆突部位的细胞克隆形成能力强。国内外学者运用细胞培养技术,将毛囊隆突部分离出来,并成功培养毛囊隆突部干细胞(Taylor等,2000;Zhang等,2006;Honda等,2006)。毛囊(Hairfollicle)是表皮向真皮凹陷后形成的能控制毛发生长的皮肤附属器官,是由胚胎期神经外胚层与间充质相互作用,最终发育形成的由多层细胞组成的、具有合成多种特异角质蛋白功能的复杂的动态器官,具有独特的结构和周期性再生的能力。毛囊在形成和分化过程中至少涉及到20余种不同的细胞群,主要由毛乳头、毛母质、内根鞘和外根鞘等细胞组成。其中,外根鞘细胞(Outerrootsheathcell,ORSC)作为一种重要的毛囊上皮细胞,因具有高度增生的潜能,在毛发再生、伤口愈合、初级毛囊和次级毛囊分化等生理过程中均起着重要作用,因而越来越受到高度关注。毛囊是控制毛发周期性生长的重要结构,它是一个多层细胞组成的特殊器官,而细毛羊的羊毛品质及产量都取决于绵羊皮肤组织结构和毛囊性状。但是如何在体外培养中大量获得毛囊隆突部干细胞,且尽量减少其分化,仍是有待解决的问题。体外分离培养细毛羊毛囊干细胞,建立良好的培养体系,对于阐明细毛羊毛囊干细胞生物学特性和探讨毛囊的生长调节机制具有重大意义,在畜牧生产上也有着广阔的应用前景。毛发的周期性自我更新以及生长依赖于毛囊干细胞的周期性增殖和分化(Paus等,2004)。Taylor等(2000)通过3H-TdR等一系列标记细胞试验提出假设:毛囊隆突部可能是干细胞贮存处。Morris等(1994)通过放射性BrdU标记技术,发现约10%左右标记滞留细胞(labelretainingcells,LRCs)存在于表皮基底细胞层中,而其他绝大多数阳性细胞存在于毛囊外根鞘隆突部位。Oshima等(2001)通过转基因鼠证实每个毛发周期中毛母质细胞是隆突部HFSCs来源的,此后不断有研究证实HFSCs定位于隆突部(Ohyama,2007;Waters等,2007)。Levy等(2005)利用显微解剖、组织切片以及皮片异种移植模型研究发现,鼠毛囊隆突部为其外根鞘一系列不连续隆起,人毛囊隆突部位于其外根鞘最外层靠近立毛肌插入点处。研究者将毛囊经胰酶消化后,利用胶原包被法培养外根鞘细胞获得成功。Jones等(1996)利用干细胞对细胞外基质的粘附性进行了体外分离、纯化表皮干细胞的实验,采用快速粘附于VI型胶原的方法成功的富集了表皮干细胞(Bickenbach等,1999)。Zhang等(2006)利用中性分散酶分离毛囊隆突区,培养获得了毛囊隆突区干细胞。到目前为止,体外外根鞘细胞培养技术较成熟,应用最广的是显微分离培养法。但是,由于毛囊干细胞存在部位隐蔽,获得的外根鞘细胞中毛囊干细胞数量十分有限,限制了毛囊干细胞的研究。
技术实现要素:
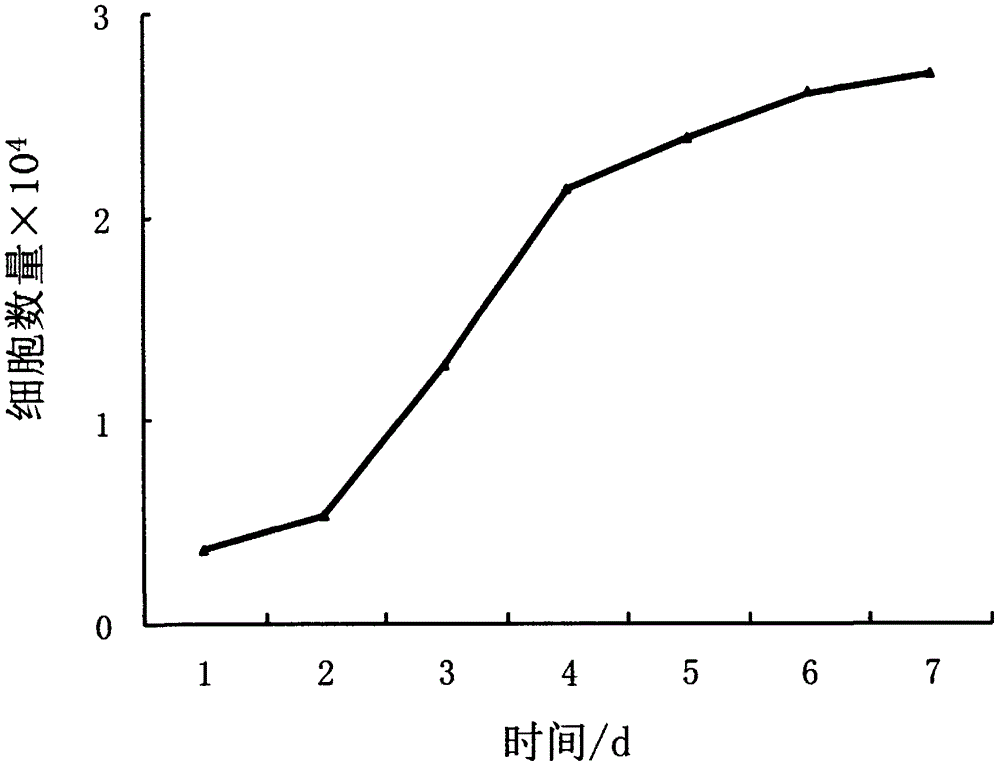
本发明的目的是克服现有技术存在的缺陷,提供一种细毛羊毛囊干细胞分离培养方法,建立与完善细毛羊体外培养细毛羊毛囊干细胞系(Finewoolsheephairfolliclestemcellline)的构建方法,不仅可为阐明毛囊的生长发育规律、影响因素及其调控机制提供研究模型;为提高细毛羊毛产量和羊毛品质的育种改良奠定基础;还可以为提高羊毛品质、数量和毛皮花纹品质乃至医学领域的人类毛发再生研究等奠定基础。其技术方案如下:一种细毛羊毛囊干细胞分离培养方法,包括如下步骤:(1)活体采集皮肤样品:无菌操作切取细毛羊耳部皮肤0.5cm×0.5cm大小的含完整毛囊的皮肤组织样品,将样品用碘酒消毒,浓度为75%酒精消毒2次,再用生理盐水反复清洗,然后用含有青霉素-链霉素的D-Hank’s平衡盐溶液快速冲洗3~5次,迅速将样品放入无血清的DMEM/F12培养液中,于冰盒内带回实验室,在12h内进行分离培养;(2)在玻璃培养皿中,将软骨与皮肤剥离,在体式显微镜下用解剖针固定皮肤,在不损伤毛囊的前提下将毛囊周围组织尽量剔除,将皮肤标品在无菌条件下用眼科剪剪成小条,加入2.4U/mL的I型胶原酶,4℃消化12h后,终止消化,用眼科镊夹住毛囊远端从脂肪端拉出,收集形态完好且处于生长期的毛囊,分别在皮脂腺的下方和竖毛肌的上方横切获得中间毛囊隆突区;(3)分离获得毛囊隆突区后,再置于0.25%胰酶中37℃消化30min,终止反应,1200r/min离心收集细胞后接种于100μg/mL的IV型胶原包被的培养皿中,30min后吸出上层未贴附的角质形成细胞和毛囊真皮成纤维细胞;(4)将培养皿中添加10ng/ml表皮生长因子、10ng/ml类胰岛素生长因子-I、0.5μg/ml氢化可的松的DMEM/F12工作培养液,置于37℃,饱和湿度,5%CO2培养箱中培养;(5)当毛囊干细胞HFSC生长至会合状态后,进行传代培养,首先弃掉旧培养液,D-Hank’s液冲洗细胞一次,加入1ml浓度为0.25%的胰蛋白酶浸润细胞数秒,弃去后,再加入4ml浓度为0.25%的胰蛋白酶,常温下消化处理5min,加入含10ng/mlEGF、10ng/mlIGF-I、0.5μg/ml氢化可的松和2%FBS的DMEM/F12维持培养液,置于37℃,饱和湿度,5%CO2培养箱中培养;(6)选择对数生长期细胞,利用传代培养的方法制成细胞悬液,然后加入含10%DMSO和30%FBS的DMEM/F12冻存培养液并分装入无菌冻存管中,封口,标记;将冻存管依次置于4℃1h,-20℃1h,-70℃12h,最后移入液氮中长期保存细胞;复苏细胞时,用40℃温水快速解冻细胞,按5×105个/ml的细胞密度接种于培养瓶。本发明的有益效果:(1)本发明利用细毛羊皮肤毛囊干细胞的机械分离与酶消化相结合的方法,成功启动了细毛羊毛囊干细胞的原代培养,添加多种生长因子,成功建立了细毛羊毛囊干细胞系。(2)本细胞系已稳定传至5代以上,其生长分裂状态良好,细胞群体倍增时间约为86.4h。结果表明,所建细毛羊毛囊干细胞系特征明显,可为研究毛囊生长与分化机制,尤其是毛囊主要细胞间的相互作用机制研究提供良好的实用模型。附图说明图1为体外培养的细毛羊原代毛囊干细胞,其中图1a为切取的细毛羊毛囊隆突区,图1b为贴壁后的细毛羊毛囊干细胞呈典型的铺路石状排列;图2为细毛羊毛囊干细胞生长曲线。具体实施方式下面结合具体实施例对本发明的技术方案作进一步详细地说明。本发明涉及的细毛羊的遗传资源名称为甘肃高山细毛羊,采集于中国甘肃省。一种细毛羊毛囊干细胞分离培养方法,首先利用中性蛋白酶(Dispase)分离皮肤的表皮部分和真皮部分,以利于纯化培养毛囊干细胞。为了获得更纯净的细毛羊毛囊干细胞,采用机械分离与酶消化相结合的方法,分离完整毛囊及纯一的毛囊干细胞:即先利用I型胶原酶分离皮肤表、真皮层后拨出毛囊,再对毛囊进行胰蛋白酶消化处理,随即将毛囊培养于含有表皮生长因子(Epidermalgrowthfactor,EGF)、类胰岛素生长因子-I(Insulin-likegrowthfactor-I,IGF-I)、氢化可的松(Hydrocortisone)和10%FBS的DMEM/F12培养液中,置5%CO2的37℃饱和湿度培养箱中进行培养。当培养板中的毛囊迁移出大量细胞时,换为含EGF、IGF-I和氢化可的松的无血清角质细胞培养液(Keratinocyte-SerumFreeMedium,K-SFM)中启动原代培养。待原代毛囊干细胞生长至汇合时,进行传代,将稳定生长至3~5代的细胞更换含EGF、IGF-I、氢化可的松和2%FBS的DMEM/F12培养液中培养,以利于毛囊干细胞在体外长期传代培养。采用该方法本细胞系已经稳定传至5代以上,其生长分裂状态良好。(一)材料与方法(1)主要试剂与药品DMEM/F12(Dulbecco’sModifiedEagle’sMedium/Ham’sNutrientMixtureF12,1:1)培养基为Gibco公司产品;K-SFM(Keratinocyte-SerumFreeMedium,K-SFM)培养基为Gibco公司产品;胎牛血清(FetalBovineSerum,FBS)为Gibco公司产品;IV型胶原(CollagenTypeIV)为Sigma公司产品;I型胶原酶(CollagenaseTypeI)为Sigma公司产品;D-Hank′s平衡盐溶液(D-Hank’sbalancedsaltsolution)为Sigma公司产品;胰岛素(Insulin)为Sigma公司产品;氢化可的松(Hydrcortisne)为Sigma公司产品;青霉素-链霉素(Penicillin-Streptomycin)为Gibco公司产品;胰酶(Pancreatic)为Gibco公司产品;表皮生长因子(EpidermalGrowthFactor,EGF)为Sigma公司产品;胰岛素样生长因子-I(Insulin-likeGrowthFactor-I,IGF-I)为Sigma公司产品。完全培养液:10ng/mlEGF、10ng/mlIGF-I、0.5μg/ml氢化可的松和10%FBS的DMEM/F12培养液;工作培养液:10ng/mlEGF、10ng/mlIGF-I、0.5μg/ml氢化可的松的K-SFM培养液;维持培养液:10ng/mlEGF、10ng/mlIGF-I、0.5μg/ml氢化可的松和2%FBS的DMEM/F12培养液;PBS:由8g/LNaCl、0.2g/LKCL、1.56g/LNa2HPO4·H2O和0.2g/LKH2PO4组成;冻存培养液:含10%DMSO和30%FBS的DMEM/F12培养液。(2)实验动物与样品采集怀孕母羊购自甘肃省绵羊繁育技术推广站,饲养于国家绒毛用羊产业技术体系张掖综合试验站。运用外科手术的方法,随机活体采集出生1~3日龄的羔羊耳部约0.5cm×0.5cm的皮肤组织样,将皮肤组织样在生理盐水中反复清洗后,75%酒精消毒2次,然后用含有青霉素-链霉素的D-Hank’s平衡盐溶液冲洗,洗净酒精后迅速放入无血清DMEM/F12培养液,于冰盒中带回实验室。在12h内进行分离培养。(3)细毛羊毛囊干细胞原代培养将步骤(2)中采集的皮肤组织样品经70%酒精浸洗,D-Hank’s液快速冲洗后,在玻璃培养皿中,将软骨与皮肤剥离,在体式显微镜下用解剖针固定皮肤,在不损伤毛囊的前提下将毛囊周围组织尽量剔除。将消毒好的皮肤样品在无菌条件下用眼科剪剪成小条,吸弃D-Hank’s液,加入约10ml2.4U/ml的I型胶原酶,4℃消化12h后,采用无血清DMEM/F12培养液终止消化。体视镜下,用眼科镊夹住毛囊远端从脂肪端拉出,收集形态完好且处于生长期的毛囊,分别在皮脂腺的下方和竖毛肌的上方横切获得中间毛囊隆突区,如图1a所示。将毛囊隆突区浸入0.25%胰蛋白酶中37℃消化30min,采用无血清DMEM/F12培养液终止消化。1200r/min离心收集细胞后接种于100μg/mL的IV型胶原包被的培养皿中。30min后吸出上层未贴附的角质形成细胞和毛囊真皮成纤维细胞。在培养皿中加入3ml完全培养液,37℃,5%CO2浓度的饱和湿度条件下进行原代培养。(4)细胞的传代培养当毛囊干细胞(HFSC)生长至会合状态后,进行传代培养。首先弃掉旧培养液,D-Hank’s液冲洗细胞一次,加入1ml浓度为0.25%的胰蛋白酶浸润细胞数秒。弃去后,再加入3ml浓度为0.25%的胰蛋白酶,常温下消化处理约5min。当观察到有细胞贴附的瓶壁逐渐变白,且轻轻晃动有微小细胞团块脱落后,便可加入5ml工作培养液洗净残余消化液,1000r/min下离心5min后收集细胞,分瓶后按每瓶5ml量加入维持培养液放回培养箱中继续培养,此后每3天更换工作培养液1次。待毛囊干细胞稳定生长至3~5代时,更换等量的维持培养液进行培养,以利于毛囊干细胞在体外长期传代。挑选可稳定遗传的对数期毛囊干细胞进行形态学观察并测定生长曲线。(5)毛囊干细胞形态观察倒置显微镜下观察细毛羊毛囊干细胞,待基本长满培养皿底部时,吸出旧培养液,用D-Hank’s平衡液轻轻漂洗1~2次,洗去残余血清后弃去平衡液。在培养皿中加入0.25%胰酶,室温下消化2~5min,显微镜下观察细胞突起缩回近似圆形,细胞之间的间隙增大时终止消化。吸弃消化液后用DMEM培养液漂洗后加入维持培养液,置于37℃,饱和湿度,5%CO2培养箱中培养。观察传代后毛囊干细胞的生长状态,每日拍照。待细胞贴壁并完全舒展以后,记录细胞长满培养皿底部表面的时间,重复3次。(6)细胞生长曲线的测定收获生长状态良好的对数期毛囊干细胞,采用细胞传代的方法制成细胞悬液。经计数后,将密度为每ml含1×104个细胞的细胞悬液接种于24孔细胞培养板中,每孔1ml。每隔24h取出3个孔的细胞分别进行计数,计算平均值,连续计数7d。以培养时间为横轴,每天的细胞数平均值为纵轴,作图,即得到体外培养毛囊干细胞的生长曲线。(7)细毛羊毛囊干细胞的冷冻保存与复苏选择对数生长期细胞,利用传代培养的方法制成细胞悬液,然后加入冻存培养液,以每毫升5×106个毛囊干细胞的细胞密度,分装入5ml无菌冻存管中,封口,标记。将冻存管依次置于4℃1h、-20℃1h、-70℃12h,最后移入液氮中长期保存细胞。复苏细胞时,用40℃温水快速解冻细胞,然后逐滴加入30ml维持培养液缓慢稀释冻存液,混匀后低速离心,去上清。再用维持培养液适当稀释后,按5×105个/ml的细胞密度接种于培养瓶。(二)结果与分析(1)毛囊干细胞的形态观察利用贴壁法分离毛囊干细胞,在含完全培养液中,结果发现获得的原代细毛羊毛囊干细胞接种于IV型胶原包被的培养皿中,2h后,可见一部分细胞贴壁,刚贴壁的细胞体积小,呈原形,胞体透亮,折光性强。随着培养时间的延长,细毛羊毛囊干细胞呈典型的铺路石状排列,为上皮细胞的典型特征如图1b所示。(2)传代培养的毛囊干细胞的生长特性传代培养的毛囊干细胞与其原代细胞在形态及生长速度上均无明显差异,细胞生长与分裂依然十分旺盛。单层细胞传代约一周后便可重新长成单层,其对于胰蛋白酶消化的敏感性也较原代培养细胞明显增强。参见图2,从体外培养的细毛羊毛囊干细胞生长曲线可以看出,细胞在贴壁后前2天生长较缓慢,第3~5天,进入倍增期,进入后仍然保持增殖态势,从第5天开始出现接触抑制,生长速度减慢,进入平台期。细胞群体倍增时间为86.4h,说明毛囊干细胞经传代培养后其生长与分裂能力依然旺盛。(3)细胞活率与贴壁率的测定结果利用细胞计数板测定细胞冻存前24h的平均活率及细胞复苏后24h的平均活率与贴壁率,统计分析结果表明,细毛羊毛囊干细胞冻存前和复苏后平均活率分别为93.6%和91.2%,复苏24h后约有85%细胞贴附瓶底生长。由此可见,冻存和复苏对传代细胞活力状况的损害较小,细胞生长状态良好。以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,通过技术方案的简单变化或等效替换均落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1