异丁醇生产的酶促方法与流程
发明背景。
本发明涉及生物技术领域。具体地说,本发明涉及一种生产异丁醇的方法,其中乳酸催化转化为异丁醇。
背景
4-碳醇化合物例如正丁醇和异丁醇是重要的工业化学品,可用作燃料添加剂、塑料工业中的原料以及作为食品级提取的试剂。由于需求增加,石化行业每年都会生产更多量的这类醇。
通常,这些醇通过化学合成或通过生物方法生产。正丁醇和异丁醇二者可以通过丙烯的加氢甲酰化以化学方式生产,在该方法中丙烯与包含铑的催化剂接触,导致丙烯的加氢甲酰化,形成丁醛和异丁醛。之后,醛被氢化,形成相应的醇(丁醇或异丁醇),如欧洲专利ep1733003b1(其内容通过整体引用并入本文)所述。此外,正丁醇可以通过称作abe发酵的众所周知的代谢途径以生物学方式生产(jonesandwoods,1986;berezina等人,2012)。这种使用丙酮丁醇梭菌(clostridiumacetobutylicum)(一种广泛使用的微生物)的发酵广泛应用于工业中。
关于异丁醇,不存在能够为工业过程生产足够量的该化合物的遗传未修饰的微生物。尽管已知,当氮源为缬氨酸时,酿酒酵母(saccharomycescerevisiae)能够生产异丁醇(dickinson等人,1998),使用该氨基酸作为氮源的培养基在经济上是不可行的。
因此,异丁醇已经常规地通过使用遗传修饰过的生物体发酵来生产。通常已知遗传修饰过的生物体例如酿酒酵母(saccharomycescerevisiae)和大肠杆菌(escherichiacoli)增加异丁醇的生产,如专利us7851188、us7910342、us7993889、us8017375、us8017376、us8071358、us8097440、us8133715、us8153415、us8158404、us8178328、us8232089、us8241878、us8273558、us8273565和us8283144中所述(其内容通过整体引用并入本文)。这些专利中描述的原料通常是糖,例如葡萄糖、蔗糖或果糖,如专利us7851188、us8017375、us8178328和us8283144所强调。虽然这种技术已经有进展,但重要的是,请注意,存在与使用遗传修饰过的生物体生产异丁醇有关的各种缺点,例如:
1.必须存在大量的活细胞以有效地进行该过程。如果存在少量细胞,则发酵过程变得非常缓慢。这个事实在本领域是众所周知的。
2.将外源代谢途径引入生物体意味着其自身代谢途径之间竞争的增加,因为碳流在微生物生长和异丁醇生产之间分配。它阻止了过程达到接近理论产率的值(例如,对于葡萄糖的情况,从1g葡萄糖获得0.411克异丁醇)。因此,为了达到可接受的产率,表达生产异丁醇的代谢途径是不够的;还需要从代谢途径除去基因以减少与异丁醇生产的竞争。例如,专利us7993889、us8017375、us8133715、us8153415、us8178328和us8273565中描述了已经去除了编码丙酮酸脱羧酶的基因。此外,如在专利us8071358、us8097440、us8133715、us8153415和us8273565中所述,已经去除了编码甘油醛-3-磷酸脱氢酶的基因。类似地,如专利us8158404中所述,已经去除了编码醛脱氢酶的基因。
3.此外,为了增加异丁醇的产率,还需要过表达内源和/或外源基因以建立异丁醇生产的生物化学途径。例如,如专利us8017376、us8071358和us8273565中所述,aft基因的过表达增加了参与异丁醇合成的酶的活性。
4.本领域中通常已知的是,如上述2和3中所述的去除基因和/或过表达基因常常使生物体代谢不稳定。
因此,期望有不发生各种底物的相互作用或竞争并且不发生与该方法相关联的微生物生长的方法。
鉴于这种需要,欧洲专利ep2204453描述了一种酶促异丁醇生产(其内容通过引用整体并入本文)。然而,为了进行该方法,使用葡萄糖作为原料,其需要至少5种酶转化为丙酮酸。除了使用若干酶来生产丙酮酸之外,专利ep2204453b1还描述了体系的操作温度高于50℃。这是由于在较低温度下催化从葡萄糖产生丙酮酸的酶的效率降低。另一方面,催化丙酮酸转化为异丁醇的一些酶在20℃至37℃的温度下有效地工作。因此,如专利ep2204453的实施例特别是实施例10所提到,由于酶体系的不相容性,这些酶中的一些可能在短时间内丧失其催化活性。
另一方面,专利申请公开ep2700714a1(其内容通过整体引用并入本文)描述了与专利ep2204453b1非常相似的方案,但是使用至少13种酶来进行该方法。
除了与常规生产异丁醇的方法相关联的上述缺点之外,还应当注意,在现有技术中不存在其中由乳酸生产异丁醇且异丁醇的生产酶促进行的方法。此外,在现有技术中不存在其中那些酶的作用以连续和稳定的方式长时间再生电子受体和供体分子的方法。
概述
因此,本发明的一个目的是提供由乳酸生产异丁醇的酶促方法,其中将异丁醇的生产与nad+/nadh和/或nadp+/nadph再生相关联并且其中该方法可不与微生物的生长相关联。
本发明的另一个目的是将由乳酸生产异丁醇与nad+/nadh再生体系相关联。
本发明的另一个目的是将由乳酸生产异丁醇与nadp+/nadph再生体系相关联。
同时,本发明的另一个目的是将由乳酸生产异丁醇与nad+/nadh和nadp+/nadph的混合物的再生体系相关联。
类似地,本发明的一个目的是提供一种方法,其中将由乳酸生产异丁醇与nad+/nadh和/或nadp+/nadph再生体系相关联,并且其中可以在受控环境中进行,其中反应混合物中的任一种成分可以再循环到该方法中。
本发明的另一个目的是开发一种方法,其中在间歇过程中将nad+/nadh和/或nadp+/nadph再生体系与由乳酸生产异丁醇相关联。
本发明的另一个目的是开发一种方法,其中在半连续过程中将nad+/nadh和/或nadp+/nadph再生体系与由乳酸生产异丁醇相关联。
本发明的另一个目的是开发一种方法,其中在连续过程中将nad+/nadh和/或nadp+/nadph再生体系与由乳酸生产异丁醇相关联。
已经通过发现生产异丁醇的方法来满足单独或组合的这些和其它目的,所述方法包括:混合水、乳酸、酶混合物以制备反应混合物,所述酶混合物包含至少一种酶、至少一种辅因子和至少一种辅酶;让乳酸在反应混合物中催化转化足够量的时间以生产异丁醇;并从b)中通过催化转化得到的反应物中分离异丁醇。将b)中乳酸转化为异丁醇与nad+/nadh和/或nadp+/nadph再生体系相关联。
附图简述
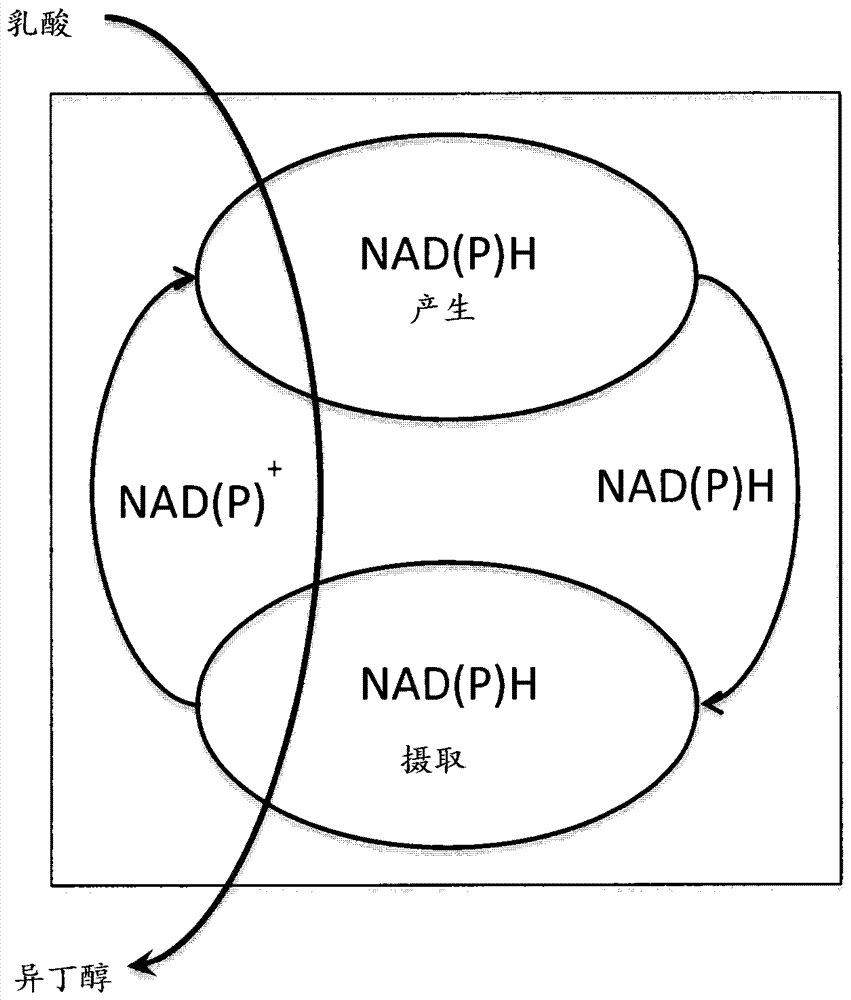
图1显示了与由乳酸生产异丁醇相关联的nad+/nadh和/或nadp+/nadph再生体系的方案。
图2显示了说明间歇生产异丁醇的方法的行为模式的图表。
图3显示了说明在cstr反应器中连续生产异丁醇的方法的行为模式的图表。
图4显示了说明沿着pbr反应器的z轴连续生产异丁醇的方法的行为模式的图表。
详述
为了理解本发明的目的,提供以下定义和缩写:
术语“乳酸(lacticacid)”、“乳酸(lactate)”、“2-羟基丙酸”和“α-羟基丙酸”是指相同的分子,其中该分子具有三个碳并具有以下分子式:h3c-choh-cooh(c3h6o3)。为了本发明的目的,术语“乳酸”是指在国际数据库中记录的标识号为cas50-21-5、79-33-4、10326-41-7、598-82-3的任何异构体或异构体混合物,其可以是l-乳酸或d-乳酸或两者的任何比例的混合物。此外,为了本发明的目的,术语“乳酸(乳酸根)(lactate)”等同于“乳酸(lacticacid)”,因为在溶液中并且根据ph,“乳酸”可以以其离子形式存在。“乳酸”可以以不同的方式获得,无论是生物学方式还是化学方式。在生物学方式中,“乳酸”可以例如通过有机化合物的发酵来获得。一些产“乳酸”生物体包括大肠杆菌(escherichiacoli)、干酪乳杆菌(lactobacilluscasei)、德氏乳酸杆菌(lactobacillusdelbrueckii)、乳酸乳球菌(lactococcuslactis)等。在化学方式中,“乳酸”可以从乙醇、氰化钠和硫酸得到;用氰化物对醛羰基的亲核攻击终止该过程以形成外消旋形式的乳酸的腈。该腈在水和过量的硫酸存在下水解以得到游离的“乳酸”。
术语“丙酮酸(pyruvate)”、“丙酮酸(pyruvicacid)”、“2-氧代丙酸”、“α-酮基丙酸(ketopropionicacid)”、“丙酮酸(pyroracemicacid)”和“乙酰甲酸”是指相同的分子;该分子具有三个碳,并具有以下分子式:ch3cocooh(c3h4o3,cas:127-17-3)。
术语“2-乙酰乳酸(acetolacticacid)”、“2-乙酰乳酸(acetolactate)”、“2-羟基-2-甲基-3-氧代丁酸”和“2-乙酰基乳酸”是指相同的分子;这种分子具有五个碳,并具有以下分子式:ch3coc(ch3)ohcooh(c5h8o4,cas:未得到)。
术语“2,3-二羟基戊酸(dihydroxyvalerate)”、“2,3-二羟基-3-甲基丁酸(methylbutanoate)”、“2,3-二羟基-异戊酸(isovalerate)”、“2,3-二羟基-异戊酸(isovalericacid)”是指相同的分子;该分子具有五个碳,并具有以下分子式(ch3)2cohchohcooh(c5h10o4,cas:1756-18-9)。
术语“酮异戊酸”、“酮异戊酸”、“3-甲基-2-氧代丁酸”、“2-氧代异戊酸(2-oxoisovalerate)”、“2-氧代异戊酸(2-oxoisopentanoate)”和“2-酮基缬氨酸(2-ketovaline)”是指相同的分子;这种分子具有五个碳,并具有以下分子式(ch3)2chcocooh(c5h8o3,cas:759-05-7)。
术语“异丁醛”、“2-甲基丙醛(2-methylpropanal)”和“2-甲基丙醛(2-methylpropionaldehyde)”是指相同的分子;这种分子具有四个碳,并具有以下分子式(ch3)2chcho(c4h8o,cas:78-84-2)。
术语“异丁醇(isobutanol)”、“异丁醇(isobutylalcohol)”和“2-甲基-1-丙醇”是指相同的分子;这种分子具有四个碳,并具有以下分子式(ch3)2chch2oh(c4h10o,cas:78-83-1)。
术语“还原型烟酰胺腺嘌呤二核苷酸(nadh)”和“烟酰胺腺嘌呤二核苷酸(nad+)”是指将电子从一个分子传输到另一个分子并进行氧化-还原反应或氧化还原反应的细胞代谢的分子。
术语“还原型烟酰胺腺嘌呤二核苷酸磷酸(nadph)”和“烟酰胺腺嘌呤二核苷酸磷酸(nadp+)”是指将电子从一个分子传输到另一个分子并进行氧化-还原反应或氧化还原反应的细胞代谢的分子。
为了本发明的目的,术语“nad(p)+”等同于术语“nad+”和/或“nadp+”,并且术语“nad(p)h”的使用等同于术语“nadh”和/或“nadph”。
术语“理论产率”是指通过反应可以获得的产物的最大量,并且通过化学计量方程计算。理论产率可以与通过基于反应的化学计量计算的实验反应获得的产物的理论量进行比较。
术语“实验产率”是指相对于消耗的底物量而言通过化学反应实验上获得的产物的量。
术语“转化效率”是指从实验产率和理论产率之间的比率获得的百分比,其值可以在0至100%之间变化。
术语“氧化还原反应”和“多个氧化还原反应”是指由酶作用介导的生物化学反应,其中一种化合物被还原,另一种被氧化。由于nadh或nadph(氧化剂)和nad+或nadp+(还原剂)的存在,这些反应可能在细胞中发生。
术语“多肽”和“酶”是指能够进行从起始化合物到最终化合物的转化反应的包括氨基酸残基的有机分子,其中起始和最终化合物可以在分子上和/或空间上不同。
术语“基因”或“多个基因”是指生物分子,其由现有技术中已知的作为腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶的氮化合物或碱基组成。这些基因是在细胞中传递用于合成生物酶的信息的分子。
术语“反应器”是指由合适的材料构建的物理容器,其中可以以受控的方式发生化学、生物化学、生物反应或其组合。在现有技术中可以找到不同类型的反应器。作为实例,提及连续搅拌罐反应器(cstr)、活塞流反应器、流化床反应器和填充床反应器(pbr)。反应器的一些特性可以包括:a)耐归因于反应的腐蚀性;b)监测和控制例如温度、搅拌、ph、溶解气体的浓度、压力等操作变量的能力;c)其操作模式,可以是连续的、半连续的或间歇的(反应器可以操作的各种操作模式在本领域中可能是已知的);d)其使用不同类型催化剂进行反应的能力;例如,催化剂可以被溶解,或可被捕获或固定(催化剂可以催化反应的各种模式可能在本领域中是已知的)。
术语“辅因子”是指酶的作用所需的无机化合物,例如mg2+、fe2+、zn2+、na+、k+、co2+、ni2+、mn2+等。
术语“底物”是指酶在其上反应的分子。酶对于底物可以是特异性的和选择性的。
术语“酶混合物”和“酶的混合物”是指在相同溶液中发现的一组酶,其能够确保由乳酸生产异丁醇。酶混合物和酶的混合物可以在与本发明方法中使用的乳酸或其它组分混合之前制备。在一个方面,在与乳酸或其它组分混合之前,酶可以在诸如管、罐或反应器的容器中混合。
酶混合物中酶的浓度可以大于0.001g/l、大于0.01g/l或优选大于0.1g/l。
当酶如下定义固定时,酶混合物中的酶的浓度可以大于0.001g/g载体、大于0.01g/g载体或优选大于0.1g/g载体。
在本发明的一个方面,酶混合物可包括以下酶中的至少一种:乳酸脱氢酶(ec1.1.1.27和/或ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.1y/oec1.1.1.2)及其类似物。在本发明的一个优选方面,酶混合物可包括乳酸脱氢酶(ec1.1.1.27和/或ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1y/oec1.1.1.2)。
术语“辅酶”是指对于一些酶的活性必需的有机和非蛋白化合物。辅酶的实例包括“黄素腺嘌呤二核苷酸(fad)”、“焦磷酸硫胺素(thpp)”、“黄素单核苷酸(fmn)”等。
术语“反应混合物”是指在水相、油相、气相或固相中的化合物集合,其可以经历多肽或多肽混合物的催化反应。反应混合物可以包括酶混合物、辅因子、辅酶、nad+/nadh和/或nadp+/nadph和乳酸,或可以由这些组成。反应混合物可以通过将化合物在适于制备混合物的容器中混合来制备。例如,可以使用管、罐或反应器来制备反应混合物。反应混合物可以通过用合适的方法混合化合物来促进一酶和底物之间的相互作用来制备。
当反应混合物包括乳酸时,反应混合物中乳酸的浓度可以至少为1g/l、20g/l、100g/l、200g/l,或优选300g/l。
术语“顺次”是指以下有序转化:通过乳酸脱氢酶(ec1.1.1.27和/或ec1.1.1.28)将乳酸转化为丙酮酸,通过乙酰乳酸合成酶(ec2.2.1.6)将丙酮酸转化为2-乙酰乳酸,通过酮酸还原异构酶(ec1.1.1.86)将2-乙酰乳酸转化为2,3-二羟基戊酸,通过二羟基酸脱水酶(ec4.2.1.9)将2,3-二羟基戊酸转化为酮异戊酸,通过酮酸脱羧酶(ec4.1.1.72)将酮异戊酸转化为异丁醛,通过醇脱氢酶(ec1.1.1.1和/或ec1.1.1.2)将异丁醛转化为异丁醇。
术语“多酶体系”是指将乳酸顺次转化为异丁醇的一组酶。
术语“基因删除”是指删除编码蛋白的dna区的过程。
术语“外源基因”是指生物体外编码蛋白的dna区域。
术语“内源基因”是指编码生物体内天然蛋白的dna区域。
术语“过表达”是指由内源或外源基因编码的蛋白的增加的表达水平。
术语“nad+/nadh和/或nadp+/nadph的再生”是指:由可能催化这些转化的任何酶的作用产生的nad+和/或nadp+分子向nadh和/或nadph分子的转化;以及由可能催化这些转化的任何酶的作用产生的nadh和/或nadph分子向nad+和/或nadp+的转化。这些转换可以在相同的反应体系中找到。
术语“游离酶”是指分布在溶液中的酶。
术语“多种游离酶”是指分布在溶液中的一组酶。
术语“载体”是指固体或半固体的惰性基质,其优选不改变其蛋白结构。载体可以是可适合于固定酶的任何种类的载体。载体的实例可包括但不限于沸石、活性炭、丙烯酰胺、二氧化硅凝胶、琼脂糖、藻酸盐、砂或其任何组合。
术语“固定化的酶”是指通过任何物理或化学方法在“载体”上或在“载体”中附着的、捕获的、包埋的、粘附的、吸附的、结合的、固着等的酶。
术语“多种固定化的酶”是指通过任何物理或化学方法在“载体”中或在“载体”上附着的、捕获的、包埋的、粘附的、吸附的、结合的、固着等的一组酶。
术语“l-乳酸脱氢酶”、“l(+)-nldh”、“l-(+)-乳酸脱氢酶”、“l-乳酸脱氢酶(l-lacticdehydrogenase)”、“l-乳酸脱氢酶(l-lacticaciddehydrogenase)”、“nad+-依赖性l-乳酸脱氢酶”和“l-乳酸脱氢酶(l-lacticdehydrogenase)”(ec1.1.1.27)是指具有催化活性的多肽,其中催化活性包括将化合物l-乳酸转化为丙酮酸。然而,可能存在不被分类在这组酶中的催化l-乳酸转化为丙酮酸的转化反应的其它酶。这样的酶将被认为是l-乳酸脱氢酶的类似物。可以催化l-乳酸转化为丙酮酸的酶的实例描述于表1中。表1中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表1.可用于将l-乳酸转化为丙酮酸的l-乳酸脱氢酶的实例
术语“d-乳酸脱氢酶”、“d-特异性乳酸脱氢酶”、“d-(-)-乳酸脱氢酶(nad+)”、“d-乳酸脱氢酶(lacticaciddehydrogenase)”、“d-乳酸脱氢酶(d-lacticdehydrogenase)”(ec1.1.1.28)是指具有催化活性的多肽,其中催化活性包括将化合物d-乳酸转化为丙酮酸。然而,可能存在不被分类在这组酶中的催化d-乳酸转化为丙酮酸的转化反应的其它酶。这样的酶将被认为是d-乳酸脱氢酶的类似物。可以催化d-乳酸转化为丙酮酸的酶的实例描述于表2中。表2中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表2.可用于将d-乳酸转化为丙酮酸的d-乳酸脱氢酶的实例
术语“乙酰乳酸合成酶(acetolactatesynthase)”、“乙酰乳酸合成酶(acetolactatesynthase)”、“α-乙酰羟基酸合成酶(alpha-acetohydroxyacidsynthetase)”、“α-乙酰羟基酸合成酶(alpha-acetohydroxyacidsynthase)”、“α-乙酰乳酸合成酶(α-acetolactatesynthase)”、“α-乙酰乳酸合成酶(α-acetolactatesynthetase)”、“乙酰羟基酸合成酶(acetohydroxyacidsynthase)”、“乙酰羟基酸合成酶(acetohydroxyacidsynthase)”、“乙酰乳酸丙酮酸裂解酶(羧化)”、“乙酰乳酸合成酶(acetolacticsynthetase)”(ec2.2.1.6)是指具有催化活性的多肽,其中催化活性包括将化合物丙酮酸转化为2-乙酰乳酸。然而,可能存在不被分类在这组酶中的催化丙酮酸转化为2-乙酰乳酸的转化反应的其它酶。这样的酶将被认为是乙酰乳酸合成酶的类似物。可以催化丙酮酸转化为2-乙酰乳酸的酶的实例描述于表3中。表3中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表3.可用于将丙酮酸转化为2-乙酰乳酸的乙酰乳酸合成酶的实例
术语“酮酸还原异构酶(ketoacidreductoisomerase)”、“酮酸还原异构酶(ketolacidreductoisomerase)”、“二羟基异戊酸脱氢酶(异构化)”、“乙酰羟基酸异构还原酶”、“α-酮基-β-羟基酰基还原异构酶”、“2-羟基-3-酮酸还原异构酶”、“乙酰羟基酸还原异构酶”、“乙酰乳酸还原异构酶”和“二羟基异戊酸(异构化)脱氢酶”(ec1.1.1.86)是指具有催化活性的多肽,其中催化活性包括将2-乙酰乳酸转化为2,3-二羟基戊酸。然而,可能存在不被分类在这组酶中的催化将2-乙酰乳酸转化为2,3-二羟基戊酸的转化反应的其它酶。这样的酶将被认为是酮酸还原异构酶的类似物。可以催化2-乙酰乳酸转化为2,3-二羟基戊酸的酶的实例描述于表4中。表4中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表4.可用于将2-乙酰乳酸转化为2,3-二羟基戊酸的酮酸还原异构酶的实例
术语“二羟基酸脱水酶(dihydroxyaciddehydratase)”、“二羟基酸脱水酶(dihydroxy-aciddehydratase)”、“乙酰羟基酸脱水酶”、“α,β-二羟基酸脱水酶”、“dhad”、“2,3-二羟基异戊酸脱水酶”、“α,β-二羟基异戊酸脱水酶”和“2,3-二羟基酸水解酶(hydro-lyase)”(ec4.2.1.9)是指具有催化活性的多肽,其中催化活性包括将2,3-二羟基戊酸转化为酮异戊酸。然而,可能存在不被分类在这组酶中的催化将2,3-二羟基戊酸转化为酮异戊酸的转化反应的其它酶。这样的酶将被认为是二羟基酸脱水酶的类似物。可以催化2,3-二羟基戊酸转化为酮异戊酸的酶的实例描述于表5中。表5中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表5.可用于将2,3-二羟基戊酸转化为酮异戊酸的二羟基酸脱水酶的实例
术语“酮酸脱羧酶”、“支链2-氧代酸脱羧酶”、“支链氧代酸脱羧酶”、“支链α-酮酸脱羧酶”、“支链酮酸脱羧酶”(ec4.1.1.72)是指具有催化活性的多肽,其中催化活性包括将酮异戊酸转化为异丁醛。然而,可能存在不被分类在这组酶中的催化将酮异戊酸转化为异丁醛的转化反应的其它酶。这样的酶将被认为是酮酸脱羧酶的类似物。可以催化酮异戊酸转化为异丁醛的酶的实例描述于表6中。表6中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表6.可用于将酮异戊酸转化为异丁醛的酮酸脱羧酶的实例
术语“醇脱氢酶”、“醛还原酶”、“adh”、“醇脱氢酶(nad)”、“脂族醇脱氢酶”、“nad-依赖性醇脱氢酶”、“nadh-醇脱氢酶”和“nadh-醛脱氢酶”(ec1.1.1.1)是指具有催化活性的多肽,其中催化活性包括使用nadh将化合物异丁醛转化为异丁醇。然而,可能存在不被分类在这组酶中的催化将异丁醛转化为异丁醇的转化反应的其它酶。这样的酶将被认为是醇脱氢酶的类似物。可以催化异丁醛转化为异丁醇的酶的实例描述于表7中。表7中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表7.可用于使用nadh将异丁醛转化为异丁醇的醇脱氢酶的实例
术语“醇脱氢酶”、“醇脱氢酶(nadp+)”、“醛还原酶(nadph)”、“nadp-醇脱氢酶”、“nadp+-醛还原酶”、“nadp+-依赖性醛还原酶”、“nadph-醛还原酶”、“nadph-依赖性醛还原酶”和“醇脱氢酶(nadp)”(ec1.1.1.2)也指具有催化活性的多肽,其中催化活性包括使用nadh将化合物异丁醛转化为异丁醇。然而,可能存在不被分类在这组酶中的催化将异丁醛转化为异丁醇的转化反应的其它酶。这样的酶将被认为是醇脱氢酶的类似物。可以使用nadh催化异丁醛转化为异丁醇的酶的实例描述于表8中。表8中描述的酶仅用于参考,因为存在许多数据库,在这些数据库中可以发现这些酶的更多实例,例如genebank(http://www.ncbi.nlm.nih.gov)、kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)、braunschweigenzymedatabase(http://www.brenda-enzymes.org)等。
表8.可用于使用nadph将异丁醛转化为异丁醇的醇脱氢酶的实例
本发明的一个方面涉及一种方法,在该方法中多酶体系顺次地从乳酸产生异丁醇,并且在该方法中将异丁醇的产生与nad+/nadh和/或nadp+/nadph再生体系相关联(图1)。这种转化可以在容器或反应器中进行,在此整个过程可以连续、半连续或以间歇方式进行。
此外,优选地,本发明通过提供将乳酸顺次地转化为异丁醇的多肽来克服现有技术的缺陷,实验产率小于或等于理论产率。
此外,本发明可能不需要由nad+和/或nadp+和nadh和/或nadph的化学计量反应确定的量来执行上述方法;因为本发明的方法可以在将乳酸转化为丙酮酸和将乙酰乳酸转化为2,3-二羟基戊酸以及将异丁醛转化为异丁醇期间允许nad+/nadh和/或nadp+/nadph的再生。
类似地,本发明的方法可以采用使nad+、nadp+、nadh和/或nadph体系再循环的单元操作,使得可能需要比通过化学计量确定的化合物更少量的那些化合物来将更高的量的乳酸转化为异丁醇。
本发明可以使用以下酶:l-乳酸脱氢酶(ec1.1.1.27)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1)及其类似物将l-乳酸转化为异丁醇,其中加入到体系中的nad+的量可以小于由l-乳酸转化为异丁醇的化学计量反应确定的量。在l-乳酸转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克l-乳酸0.411克异丁醇)。
在另一方面,本发明可以使用以下酶:d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.1)及其类似物将d-乳酸转化为异丁醇,其中加入到体系中的nad+的量可以小于由d-乳酸转化为异丁醇的化学计量反应确定的量。在d-乳酸转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克d-乳酸0.411克异丁醇)。
在另一方面,本发明可以使用以下酶:l-乳酸脱氢酶(ec1.1.1.27)、d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1)和/或其类似物以将l-乳酸和d-乳酸的混合物转化为异丁醇,其中加入到体系中的nad+的量可以小于由l-乳酸和d-乳酸的混合溶液转化为异丁醇的化学计量反应确定的量。在l-乳酸和d-乳酸的混合物转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克l-乳酸和d-乳酸的混合物0.411克异丁醇)。
此外,本发明可以使用以下酶:l-乳酸脱氢酶(ec1.1.1.27)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.2)和/或其类似物将l-乳酸转化为异丁醇,其中加入到体系中的nadp+的量可以小于由l-乳酸转化为异丁醇的化学计量反应确定的量。在l-乳酸转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克l-乳酸0.411克异丁醇)。
类似地,本发明可以使用以下酶:d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.2)和/或其类似物将d-乳酸转化为异丁醇,其中加入到体系中的nadp+的量可以小于通过由d-乳酸转化为异丁醇的化学计量反应确定的量。在d-乳酸转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克d-乳酸0.411克异丁醇)。
另一方面,本发明可以使用以下酶:l-乳酸脱氢酶(ec1.1.1.27)、d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.2)和/或其类似物以将l-乳酸和d-乳酸的混合物转化为异丁醇,其中加入到体系中的nadp+的量可以小于通过由l-乳酸和d-乳酸的混合物转化为异丁醇的化学计量反应确定的量。在l-乳酸和d-乳酸的混合物转化为异丁醇中获得的实验产率可以小于或等于理论产率(每克l-乳酸和d-乳酸的混合物0.411克异丁醇)。
本发明的其它方面涉及顺次地进行一系列反应从乳酸生产异丁醇的酶的混合物。继而,用于将乳酸转化为异丁醇的优选的酶混合物如下:
a)当起始底物是l-乳酸并且氧化还原反应使用nad+/nadh以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1)和/或其任何类似物;
b)当起始底物是d-乳酸并且氧化还原反应使用nad+/nadh以获得作为最终产物的异丁醇时,酶混合物可包括d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1)和/或其任何类似物;
c)当起始底物是l-乳酸和d-乳酸的混合物并且氧化还原反应使用nad+/nadh以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.1)和/或其任何类似物;
d)当起始底物是l-乳酸并且氧化还原反应使用nadp+/nadph以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物;
e)当起始底物是d-乳酸并且氧化还原反应使用nadp+/nadph以获得作为最终产物的异丁醇时,酶混合物可包括d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物;
f)当起始底物是l-乳酸和d-乳酸的混合物并且氧化还原反应使用nadp+/nadph以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物;
g)当起始底物是l-乳酸并且氧化还原反应使用nad+/nadh和nadp+/nadph的混合物以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.1)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物;
h)当起始底物是d-乳酸并且氧化还原反应使用nad+/nadh和nadp+/nadph以获得作为最终产物的异丁醇时,酶混合物可包括d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.1)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物;和
i)当起始底物是l-乳酸和d-乳酸的混合物并且氧化还原反应使用nad+/nadh和nadp+/nadph以获得作为最终产物的异丁醇时,酶混合物可包括l-乳酸脱氢酶(ec1.1.1.27)、d-乳酸脱氢酶(ec1.1.1.28)、乙酰乳酸合成酶(ec2.2.1.6)、酮酸还原异构酶(ec1.1.1.86)、二羟基酸脱水酶(ec4.2.1.9)、酮酸脱羧酶(ec4.1.1.72)、醇脱氢酶(ec1.1.1.1)和醇脱氢酶(ec1.1.1.2)和/或其任何类似物。
在本发明的另一方面中,提供了与nad(p)+/nad(p)h再生体系相关联的使用游离酶由乳酸生产异丁醇的方法,其中操作模式优选以连续方式进行。酶的混合物可以是上述那些中的任何一种。
在本发明的一个优选方面中,所述方法可以包括以下描述的几个阶段:
i.在混合罐中,水、乳酸、酶的混合物、nad(p)+/nad(p)h、被酶用于进行催化的辅因子和辅酶混合在一起。被每种酶用于进行催化的所述辅助因子和辅酶可能与每种酶的性质有关。表9显示了优选用在本发明中的一些辅因子和不同的酶。表9中所示的辅因子和辅酶仅用于示例性的目的,并且不排除本领域技术人员发现的其它辅因子或辅酶。
上述成分可以在管、反应器或适合混合成分的任何其它容器中混合。
可以通过任何促进酶和底物之间的相互作用的适当方法将成分混合。此外,混合可以机械地、气动地或液力地进行。可以使用单一的混合方法,或者可以组合两种或更多种不同的混合方法来混合成分。
ii.使在i中制备的混合物进行催化反应。混合罐的流出物流连续地通过反应器,使得反应条件包括催化反应条件保持稳定,ph在2和12之间、4和10之间、优选6和8之间,温度在5℃和50℃之间,优选在15℃至40℃之间,更优选在25℃至37℃之间。当流出物流进入反应器时,可以由乳酸生产异丁醇,转化效率等于或小于100%。优选地,催化反应的持续时间足够长以将乳酸转化为异丁醇。
在本发明的一个方面中,在这样的过程期间,乳酸可以催化转化为异丁醇。乳酸的催化转化可以在适于进行该催化转化的容器中进行。例如,可以单独或组合地使用搅拌罐反应器、活塞流反应器、流化床反应器或填充床反应器。
iii.异丁醇从ii中得到的反应物中分离。可以富含异丁醇并且贫乳酸的反应器出口物流通过分离体系,其中辅因子、辅酶和酶可以与异丁醇和水中分离。酶、辅酶和辅因子可以形成浓缩物流,浓缩物流可以再循环到i中的混合罐或ii中的反应器。可以通过适合于基于例如其物理化学性质分离分子的任何方法进行分离。
iv.另一方面,水-异丁醇混合物可以被另一体系分离。可以使用适合于分离分子的任何分离方法。分离可以基于分子的大小进行。分离体系可以是:膜体系(反渗透、渗透蒸发、纳滤、超滤等)、蒸馏、蒸发或允许通过尺寸或其任何物理化学性质分离分子的任何其它体系。
当分离异丁醇时,通过催化转化获得的反应物可以分离成包含异丁醇和水的物流,以及包含非异丁醇和水的成分的物流。包含异丁醇和水的物流可进一步分离成包含异丁醇的物流和包含水的物流。包含非异丁醇和水的成分的物流可以通过混合到混合罐或反应器中进行再循环。
表9.构成酶混合物的被酶使用的辅因子和辅酶
在本发明的一个不同的方面,提供了由乳酸生产异丁醇的方法,其中将异丙醇的生产与nad(p)+/nad(p)h的再生体系相关联。优选地,操作模式以连续方式,并使用固定化的酶的混合物。固定化的酶的混合物可以包括上述那些中的任何一种。可以通过本领域通常已知的不同方法进行固定。表10示出了可用于固定化酶的一些载体。表10中列出的载体仅出于示例目的,并不排除本领域技术人员找到的任何其他载体(即使未在表10中提到)。
表10.用于固定化的酶的载体
所述方法可以包括如下所述的几个阶段:
i.在罐中,将酶固定在载体中/载体上。一种或多种酶可以固定在相同或不同的载体中/载体上。此外,载体可以是具有不同数量的酶的相同类型的,或者载体可以是不同类型的,具有不同的大小,或具有不同的化学组成。每种载体可以包含一种或多种酶。辅酶和辅因子可能或可能不存在于载体中/载体上。一旦酶被固定,将这些酶加入反应器中。
ii.在单独的混合罐中,混合水、乳酸和nad(p)+/nad(p)h。每种酶可以使用辅因子和辅酶以进行催化,取决于酶的性质。表9显示了在本发明中优选与各种酶一起使用的一些辅酶和辅因子。表9中描述的辅因子和辅酶仅用于示例性目的,并且不排除本领域技术人员发现的其它辅因子和辅酶。
上述成分可以在管、反应器或适于混合成分的任何其它容器中混合。
可以通过任何促进酶和底物之间的相互作用的适当方法将成分混合。此外,混合可以机械地、气动地或液力地进行。可以使用单一的混合方法,或者可以组合两种或更多种不同的混合方法来混合成分。
iii.离开阶段ii的物流连续地流过包含固定化的酶的反应器。反应器保持稳定的反应条件,ph值在2和12之间、4和10之间、优选在6和8之间,温度在5℃和50℃之间、优选在15℃和40℃之间、更优选在25℃和37℃之间。当物流进入反应器时,异丁醇可以由乳酸产生,转化效率等于或小于100%。优选地,载体应保持在反应器内。然而,载体可以从反应器中除去并且可以再循环用于进一步的使用。
iv.来自阶段iii的富含异丁醇且贫乳酸的输出物可以通过分离体系,其中辅酶和辅因子与异丁醇和水分离。辅酶和辅因子可能会导致浓缩的物流,可以将该物流再循环到混合罐或酶反应器。
v.离开iv中描述的分离体系的异丁醇-水混合物可以用其它分离体系分离。该体系可以产生两个物流,一方面是异丁醇流,另一方面是水流。
iv和v中提到的分离体系可以包括:膜体系(反渗透、渗透蒸发、纳滤、超滤等)、蒸馏、蒸发或允许通过尺寸或通过其任一物理化学性质分离的任何其它体系。
本发明的一个方面涉及通过上述方法制备的生物燃料或生物燃料前体。生物燃料或生物燃料前体优选满足astmd7862的要求。
本发明的另一方面涉及通过共混烃的混合物和上述生物燃料前体制备的汽车燃料。
实施例
以下实施例旨在阐明本发明的新颖性。应当理解,以下实施例不限制本发明的范围。根据本发明的描述和以下实施例,本领域技术人员可以进行一些修改,这些修改认为在权利要求中描述的本发明的范围和精神内。
实施例1.酶活性的定量
为了确定各种酶的酶活性,通过遵循greenandsambrook,2010中所述的方案,将不同的酶基因克隆到市售表达载体如duet(merck,usa)系列中。随后,根据greenandsambrook,2010中描述的方案将酶纯化。被测酶的列表显示在表11中。
表11.用于说明本发明的酶
酶测定和结果如下所述:
a)l-乳酸脱氢酶(ec1.1.1.27):
使用nad+和/或nadp+,l-乳酸脱氢酶将l-乳酸转化为丙酮酸,因此遵循在文献(cetinel等,2013)中所述的方案通过改变l-乳酸、nad+和/或nadp+的初始浓度、ph和温度来进行测定。以来自不同微生物的三种酶为例。通过使用rezex-roa有机酸h+柱用带折光指数检测器的hplc监测l-乳酸消耗动力学。使用具有温度控制的cary-60分光光度计在波长340nm下监测nadh和/或nadph的产生。测试条件如表12中所示。
表12.测定l-乳酸脱氢酶(ec1.1.1.27)的反应条件
在所有测定中,均观察到l-乳酸转化为丙酮酸以及nadh和/或nadph的产生。表13中显示的结果表示在1小时反应时间之后获得的转化效率,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表13.通过l-乳酸脱氢酶(ec1.1.1.27)将l-乳酸转化为丙酮酸
b)d-乳酸脱氢酶(ec1.1.1.28)
使用nad+和/或nadp+,d-乳酸脱氢酶将d-乳酸转化为丙酮酸,因此通过遵循在文献(kim等人,2014)中所述的方案改变d-乳酸、nad+和/或nadp+的初始浓度、ph和温度来进行测定。以来自不同微生物的三种酶为例。通过使用rezex-roa有机酸h+柱用带折光指数检测器的hplc监测d-乳酸消耗动力学。使用具有温度控制的cary-60分光光度计在波长340nm下监测nadh和/或nadph的产生。测试条件如表14中所示。
表14.测定d-乳酸脱氢酶(ec1.1.1.28)的反应条件
在所有进行的测定中,观察到d-乳酸向丙酮酸的转化以及nadh和/或nadph的产生。表15显示的结果表示在1小时反应时间之后获得的转化效率,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表15.通过d-乳酸脱氢酶(ec1.1.1.28)将d-乳酸转化为丙酮酸
c)乙酰乳酸合成酶(ec2.2.1.6)
乙酰乳酸合成酶将丙酮酸转化为2-乙酰乳酸,因此通过遵循在文献(holtzclaw和chapman,1975;barak等人,1987;atsumi等人,2009)中所述的方案改变丙酮酸的初始浓度、ph和温度来进行测定。以来自不同微生物的三种酶为例。通过使用acclaim有机酸柱用带uv检测器的uhplc在210nm的波长下监测丙酮酸消耗动力学,还使用波长320nm的具有温度控制的cary-60分光光度计。测试条件如表16中所示。
表16.测定乙酰乳酸合成酶(ec2.2.1.6)的反应条件
表17显示了在1小时反应时间之后获得的转化效率的结果,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表17.通过乙酰乳酸合成酶(ec2.2.1.6)将丙酮酸转化为乙酰乳酸
d)酮酸还原异构酶(ec1.1.1.86)和二羟基酸脱水酶(ec4.2.1.9)
一方面,酮酸还原异构酶将2-乙酰乳酸转化为2,3-二羟基戊酸,而二羟基酸脱水酶将2,3-二羟基戊酸转化为酮异戊酸。由于2-乙酰乳酸的非商业可得性和2,3-二羟基戊酸的不稳定性,这两种酶的活性通过其中将乙酰乳酸合成酶与酮酸还原异构酶和二羟基酸脱水酶联用的测定来间接测定。这通过使用文献(flint等人,1993;bastian等人,2011;li等人,2011)中描述的方案改变丙酮酸、nadh和/或nadph的初始浓度,例如ph和温度来完成。使用来自不同微生物的两种还原异构酶和两种二羟基酮酸脱水酶的组合作为实例。使用acclaim有机酸柱用带有uv检测器的uhplc在波长210nm下监测丙酮酸消耗动力学和酮异戊酸产生(二羟基脱水酶活性);使用具有温度控制的cary-60分光光度计在波长340nm下监测nadh和/或nadph消耗(酮酸还原异构酶的底物)。测定条件示于表18。
表18.测定酮酸还原异构酶(ec1.1.1.86)和二羟基酸脱水酶(ec4.2.1.9)的反应条件
表19显示了在1小时反应时间之后获得的转化效率的结果,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表19.通过酮酸还原异构酶(ec1.1.1.86)和二羟基酸脱水酶(ec4.2.1.9)将丙酮酸转化为酮异戊酸
e)酮酸脱羧酶(ec4.1.1.72)
酮酸脱羧酶将酮异戊酸转化为异丁醛,因此通过遵循文献(plaza等人,2004)中描述的方案改变酮异戊酸的初始浓度、ph和温度来进行测定。以来自不同微生物的三种酶为例。使用acclaim有机酸柱用带有紫外检测器的uhplc在波长210nm下监测酮异戊酸消耗动力学,并使用波长318nm的具有温度控制的cary-60分光光度计。测定条件示于表20中。
表20.测定酮酸脱羧酶(ec4.1.1.72)的反应条件
表21显示了在1小时反应时间之后获得的转化效率的结果,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表21.通过酮酸脱羧酶(ec4.1.1.72)将酮异戊酸转化为异丁醛
f)醇脱氢酶(ec1.1.1.1)
使用nadh,该醇脱氢酶将异丁醛转化为异丁醇,因此通过遵循文献(atsumi等人,2010)中描述的方案改变异丁醛和nadh的初始浓度、ph和温度来进行测定。以来自不同微生物的三种酶为例。使用rezex-roa有机酸h+柱用带有折光指数检测器的hplc监测异丁醇产生动力学,使用具有温度控制的cary-60分光光度计在340nm波长下监测nadh的消耗。测定条件示于表22。
表22.测定醇脱氢酶(ec1.1.1.1)的反应条件
在所有进行的测定中,观察到异丁醛转化为异丁醇以及nadhd消耗。表23所示的结果表示在1小时反应时间之后获得的转化效率,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表23.通过醇脱氢酶(ec1.1.1.1)将异丁醛转化为异丁醇
g)醇脱氢酶(ec1.1.1.2)
使用nadph,醇脱氢酶将异丁醛转化为异丁醇,因此通过遵循文献(atsumi等人,2010)中描述的方案改变异丁醛和nadph的初始浓度、ph和温度进行测定。以来自不同微生物的三种酶为例。使用rezex-roa有机酸h+柱用带有折光指数检测器的hplc监测异丁醇产生动力学,使用具有温度控制的cary-60分光光度计在340nm波长下监测nadh的消耗。测试条件如表24所示。
表24.测定醇脱氢酶(ec1.1.1.2)的反应条件
在所有进行的测定中,观察到异丁醛转化为异丁醇以及nadhd消耗。表25所示的结果表示在1小时反应时间之后获得的转化效率,考虑了不同的国际数据库(例如kyotoencyclopediaofgenesandgenomes(http://www.kegg.jp)和braunschweigenzymedatabase(http://www.brenda-enzymes.org)报道的反应的化学计量。
表25.通过醇脱氢酶(ec1.1.1.1)将异丁醛转化为异丁醇
实施例2.在一个间歇过程中结合nad+/nadh和/或nadp+/nadph再生体系由乳酸酶促生产异丁醇
本实施例旨在说明nad+/nadh和/或nadp+/nadph再生概念:
a)nad+/nadh,根据以下反应通过结合催化nadh产生的一种酶和催化nad+产生的两种酶:
-乳酸转化为丙酮酸。在该反应中,从两个nad+分子获得两个nadh分子,以及将两个乳酸分子转化为两个丙酮酸分子。该反应可以通过l-乳酸脱氢酶(ec1.1.1.27)和/或通过d-乳酸脱氢酶(ec1.1.1.28)进行:
-丙酮酸转化为2-乙酰乳酸。在该反应中,从两个丙酮酸分子获得一个2-乙酰乳酸分子。该反应可以通过乙酰乳酸合成酶(ec2.2.1.6)进行:
-2-乙酰乳酸转化为2,3-二羟基戊酸。在该反应中,从一个2-乙酰乳酸分子获得一个2,3-二羟基戊酸分子,以及从一个nadh分子形成一个nad+分子。该反应可以通过酮酸还原异构酶(ec1.1.1.86)催化。天然酶对nadh具有非常低的亲和力。然而,可能存在可在文献(rane等,1997)中已知的使用nadh作为底物的突变体。那些突变体可以进行以下反应:
-2,3-二羟基戊酸转化为酮异戊酸。在该反应中,从一个2,3-二羟基戊酸分子获得一个酮异戊酸分子。该反应可以通过二羟基酸脱水酶(ec4.2.1.9)催化:
-酮异戊酸转化为异丁醛。在该反应中,从一个酮异戊酸分子获得一个异丁醛分子。该反应可以通过酮酸脱羧酶(ec4.1.1.72)催化:
-异丁醛转化为异丁醇。在该反应中,从一个异丁醛分子获得一个异丁醇分子,以及从一个nadh分子形成一个nad+分子。该反应可以通过醇脱氢酶(ec1.1.1.1)催化:
从上述化学方程式,多酶体系的总化学计量在理论上没有nad+或nadh的损失或增加。根据以下反应,总反应导致使用两个乳酸分子来产生一个异丁醇分子,获得100%的转化效率:
b)nadp+/nadph,根据以下反应通过结合产生nadph的一种酶和产生nadp+的两种酶:
-乳酸转化为丙酮酸。在该反应中,从两个nadp+分子获得两个nadph分子,并将两个乳酸分子转化为两个丙酮酸分子。该反应可以通过l-乳酸脱氢酶(ec1.1.1.27)和/或d-乳酸脱氢酶(ec1.1.1.28)催化:
-丙酮酸转化为2-乙酰乳酸。在该反应中,从两个丙酮酸分子获得一个2-乙酰乳酸分子。该反应可以通过乙酰乳酸合成酶(ec2.2.1.6)催化:
-2-乙酰乳酸转化为2,3-二羟基戊酸。在该反应中,从2-乙酰乳酸分子得到2,3-二羟基戊酸分子,以及从一个nadph分子形成一个nadp+分子。该反应可以通过酮酸还原异构酶(ec1.1.1.86)催化:
-2,3-二羟基戊酸转化为酮异戊酸。在该反应中,从2,3-二羟基戊酸分子获得酮异戊酸分子。该反应可以通过二羟基酸脱水酶(ec4.2.1.9)催化:
-酮异戊酸转化为异丁醛。在该反应中,从酮异戊酸分子获得异丁醛分子。该反应可以通过酮酸脱羧酶(ec4.1.1.72)催化:
-异丁醛转化为异丁醇。在该反应中,从异丁醛分子获得异丁醇分子,以及从一个nadph分子产生一个nadp+分子。该反应可以通过醇脱氢酶(ec1.1.1.2)催化:
从上述化学方程式,多酶体系的总化学计量在理论上没有nadp+或nadph的损失或增加。根据以下反应,总反应导致使用两个乳酸分子来产生一个异丁醇分子,获得100%的转化效率:
c)nad(p)+/nad(p)h的混合物,根据以下反应通过结合产生nad(p)h的酶和产生nad(p)+的酶:
-乳酸转化为丙酮酸。在该反应中,从两个nad(p)+分子获得两个nad(p)h分子,以及将两个乳酸分子转化为两个丙酮酸分子。该反应可以通过l-乳酸脱氢酶(ec1.1.1.27)和/或d-乳酸脱氢酶(ec1.1.1.28)催化:
-丙酮酸转化为2-乙酰乳酸。在该反应中,从两个丙酮酸分子获得一个2-乙酰乳酸分子。该反应可以通过乙酰乳酸合成酶(ec2.2.1.6)催化:
-2-乙酰乳酸转化为2,3-二羟基戊酸。在该反应中,一个2,3-二羟基戊酸分子从一个2-乙酰乳酸分子形成,以及从一个nad(p)h分子产生一个nad(p)+分子。该反应可以通过酮酸还原异构酶(ec1.1.1.86)催化:
-2,3-二羟基戊酸转化为酮异戊酸。在该反应中,从2,3-二羟基戊酸分子获得酮异戊酸分子。该反应可以通过二羟基酸脱水酶(ec4.2.1.9)催化:
-酮异戊酸转化为异丁醛。在该反应中,从一个酮异戊酸分子获得一个异丁醛分子。该反应可以通过酮酸脱羧酶(ec4.1.1.72)催化:
-异丁醛转化为异丁醇。在该反应中,从一个异丁醛分子获得一个异丁醇分子,以及从一个nad(p)h分子产生一个nad(p)+分子。该反应可以通过醇脱氢酶(ec1.1.1.1和ec1.1.1.2)催化:
从上述化学方程式,多酶体系的总化学计量在理论上没有nad(p)+或nad(p)h的损失或增加。根据以下反应,总反应导致使用两个乳酸分子来产生一个异丁醇分子,获得100%的转化效率:
开发了间歇体系,以将nad+/nadh和/或nadp+/nadph再生体系与由乳酸生产异丁醇相关联,以在不同的操作条件下使用(表26)。反应混合物用酶(表27)、辅因子和辅酶(以现有技术中描述的浓度)、乳酸和nad+和/或nadp+配制。在图2中,示出了在间歇过程中进行的条件之一的结果。在该特定条件下,使用1l体积的物料,l-乳酸的初始浓度为20g/l,nad+的初始浓度为0.1g/l。将反应混合物中每种酶(ec1.1.1.27、ec2.2.1.6、ec1.1.1.86、ec4.2.1.9、ec4.1.1.72和ec1.1.1.1)的浓度调节至1g/l。应该强调的是,如表26和27所示对于不同条件获得了类似的行为。
在所有情况下,通过加入乳酸引发反应。从反应开始,对反应混合物连续取样以确定反应进程。在cary-60分光光度计上在340nm的波长下测量nadh和/或nadph浓度。使用rezexroa-有机酸h+柱用带有折光指数检测器的hplc监测乳酸和异丁醇。
表26.从乳酸间歇生产异丁醇的反应条件
表27.用于配制酶混合物以由乳酸生产异丁醇的酶
在没有nadh再生的体系中,理论化学计量平衡表明,需要147.8gnadh将19.55g丙酮酸(相当于20g乳酸)转化为8.22g异丁醇。然而,通过结合nad+/nadh再生体系,如本发明所提出的,并且与通过l-乳酸脱氢酶作用的乳酸氧化相关联,仅需要0.1gnad+将20g乳酸转化为8.22g异丁醇。
当用0.1g/l的nadp+进行该过程时以及当以0.1g/l的浓度使用nad+和nadp+的混合物时,获得与前面段落中描述的相似结果。
前面提到的评述证明,在与nad+/nadh和/或nadp+/nadph再生体系结合的间歇过程中由乳酸生产异丁醇是可能的。
实施例3.在连续过程中结合nad+/nadh和/或nadp+/nadph再生体系从乳酸酶促生产异丁醇
为了证明通过使用游离酶在连续过程中将从乳酸酶促生产异丁醇与nad+/nadh和/或nadp+/nadph再生体系结合的可能性,进行以下程序:
在反应器中使用游离酶将乳酸连续地转化为异丁醇。使用酶混合物(表27)、辅因子和辅酶(以本领域通常使用的浓度)、乳酸和nad+和/或nadp+配制反应混合物。反应器的操作条件示于表28中。反应器的入口流和出口流是相同的,以便执行连续方法。
图3显示了在cstr中进行的数个条件下获得的一些结果,该条件对应于d-乳酸的初始浓度为20g/l和nadp+的初始浓度为0.1g/l。将反应混合物中每种酶(ec1.1.1.28、ec2.2.1.6、ec1.1.1.86、ec4.2.1.9、ec4.1.1.72和ec1.1.1.2)的浓度调节至1g/l。对于所有这些条件,通过改变流动条件使用50l的操作体积。
表28.由乳酸生产异丁醇的反应器操作条件
以与间歇过程相同的方式引发反应(参见实施例2);随后,反应介质的添加和除去以连续方式进行。
将来自反应器的输出物流连接到反渗透体系,该反渗透体系将酶、辅因子和辅酶与异丁醇分离。将酶、辅因子和辅酶流再循环到反应器中。
对于表27和28中列出的所有条件,监测反应器出口流中的反应中间体的演变。在cary-60分光光度计上在340nm波长下测量nadh和/或nadph的演变。乳酸和异丁醇使用rezex-roa有机酸h+柱用带有折光指数检测器的hplc测量。
从图3看出,转换效率相对于流动条件没有波动,并且接近100%。以与实施例2相同的方式。这样的结果证明了将从乳酸酶促生产异丁醇与nad+/nadh和/或nadp+/nadph再生体系结合的可能性,在连续过程中仅使用0.1g/lnadp+来转化20g/l乳酸。
应当强调,如表27和28所示,对于其他条件获得了非常相似的转化效率。
实施例4.使用固定化的酶在连续过程中结合nad+/nadh和/或nadp+/nadph再生体系从乳酸酶促生产异丁醇
为了证明在使用固定化的酶的连续过程中将从乳酸酶促生产异丁醇与nad+/nadh和/或nadp+/nadph再生体系结合的可能性,进行以下操作:
在其中每种酶或酶混合物(表27)固定在不同载体中/载体上(表10)的反应器中从乳酸连续生产异丁醇,固定化的蛋白的量变化。操作条件示于表29中。使用固定化的酶混合物(表27)、辅因子和辅酶(以本领域通常使用的浓度)、乳酸和nad+和/或nadp+配制反应混合物。
表29.使用固定化的酶将乳酸转化为异丁醇的连续反应器的操作条件
将反应器的输出物流连接到反渗透体系,反渗透体系将辅因子和辅酶的混合物再循环到反应器和/或混合罐。nad+和/或nadp+的初始浓度为0.1g/l,而反应器入口处的乳酸浓度根据表29而变化。在表27和29中提及的所有条件下,沿着管式反应器监测反应中间体的演变。在cary-60分光光度计上在340nm的波长下测量nadh和/或nadph的变化。使用rezex-roa有机酸h+柱用具有折光指数检测器的hplc测量乳酸和异丁醇浓度。
图4显示了使用装填在管式反应器中的固定化的酶在不同条件下进行连续过程的性能的一些结果。对于所有这些操作条件,使用50l的操作体积,具有不同的进料流动条件,l-乳酸的输入浓度为264g/l和nad+的输入浓度为0.1g/l。将每种酶(ec1.1.1.27、ec2.2.1.6、ec1.1.1.86、ec4.2.1.9、ec4.1.1.72和ec1.1.1.1)的量调节至0.01克/克载体。
对于该特定情况,当辅因子、辅酶、l-乳酸和nad+的混合物进入填充反应器时,反应开始。
如图4所示,l-乳酸酯转化为异丁醇,同时使混合物移位通过填充管反应器以达到100%的转化效率。在表27和29中列出的不同操作条件下发生相同的情况。以与实施例2和3相同的方式,证明可以将从乳酸酶促生产异丁醇与nad+/nadh和/或nadp+/nadph再生体系相关联,仅使用0.1g/l的nad+将264g/l的乳酸转化为108g/l的异丁醇。
在本发明的一个方面中,用于将2摩尔乳酸转化为1摩尔异丁醇的nad+和nadh的总量小于1摩尔、小于0.1摩尔或优选小于0.01摩尔。
在本发明的一个方面中,用于将2摩尔乳酸转化为1摩尔异丁醇的nadp+和nadph的总量小于1摩尔、小于0.1摩尔或优选小于0.01摩尔。
在本发明的一个方面中,用于将2摩尔乳酸转化为1摩尔异丁醇的nadp+/nad+和nadph/nadh的总量小于1摩尔、小于0.1摩尔或优选小于0.01摩尔。
参考文献
以下参考文献的内容通过整体引用并入本文。
-atsumis,liz,liaojc.(2009).acetolactatesynthasefrombacillussubtilisservesasa2-ketoisovaleratedecarboxylaseforisobutanolbiosynthesisinescherichiacoli(来自枯草芽孢杆菌的乙酰乳酸合成酶用作在大肠杆菌中进行异丁醇生物合成的2-酮异戊酸脱羧酶)。applenvironmicrobiol.75(19):6306-6311。
-atsumis,wuty,ecklem,hawkinssd,bueltert,liaojc.(2010)engineeringtheisobutanolbiosyntheticpathwayinescherichiacolibycomparisonofthreealdehydereductase/alcoholdehydrogenasegenes(通过比较三种醛还原酶/醇脱氢酶基因在大肠杆菌中工程化异丁醇生物合成途径)。applmicrobiolbiotechnol.85(3):651-657。
-barakz,chipmandm,gollopn.(1987).physiologicalimplicationsofthespecificityofacetohydroxyacidsynthaseisozymesofentericbacteria(肠细菌的乙酰羟基酸合成酶同功型的特异性的生理学意义)。jbacteriol.169(8):3750-3756。
-bastians,liux,meyerowitzjt,snowcd,chenmm,arnoldfh.(2011).engineeredketol-acidreductoisomeraseandalcoholdehydrogenaseenableanaerobic2-methylpropan-1-olproductionattheoreticalyieldinescherichiacoli.(工程化酮酸还原异构酶和醇脱氢酶能够在大肠杆菌中以理论产率生产厌氧2-甲基丙-1-醇)。metabeng.13(3):345-352。
-berezinaov,zakharovanv,yarotskycv,zverlovvv.(2012).microbialproducersofbutanol(丁醇的微生物生产商)。appl.biochem.microbiol.48(7):625-638。
-cetinels,caliskanhb,yucesoydt,donatanas,yucae,urgenm,karagulerng,tamerlerc.(2013)addressableself-immobilizationoflactatedehydrogenaseacrossmultiplelengthscales(跨多个长度等级的乳酸脱氢酶的可寻址的自固定)。biotechnolj.8(2):262-272。
-delaplazam,fernándezdepalenciap,peláezc,requenat.biochemicalandmolecularcharacterizationofalpha-ketoisovaleratedecarboxylase,anenzymeinvolvedintheformationofaldehydesfromaminoacidsbylactococcuslactis(α-酮异戊酸脱羧酶—一种通过lactococcuslactis参与由氨基酸形成醛的酶的生物化学和分子表征)。(2004).femsmicrobiollett.238(2):367-74。
-dickinsonjr,harrisonsj,hewlinsmj.(1998)aninvestigationofthemetabolismofvalinetoisobutylalcoholinsaccharomycescerevisiae(在saccharomycescerevisiae中将缬氨酸代谢为异丁醇的研究)。j.biol.chem.273(40):25751-25756。
-flintdh,emptagemh,finneganmg,fuw,johnsonmk.(1993).theroleandpropertiesoftheiron-sulfurclusterinescherichiacolidihydroxy-aciddehydratase(铁硫簇在大肠杆菌二羟基酸脱水酶中的作用和性质)。jbiolchem.268(20):14732-14742。
-greenmichaelr.,sambrookjoseph.(2012).molecularcloning:alaboratorymanual(分子克隆:实验室手册),coldspringharborlaboratorypress;第4版。
-holtzclawwd,chapmanlf.(1975).degradativeacetolactatesynthaseofbacillussubtilis:purificationandproperties(枯草芽孢杆菌的降解性乙酰乳酸合成酶:纯化和性质),jbacteriol.121(3):917-922。
-jonesdt,woodsdr.(1986).acetone-butanolfermentationrevisited(丙酮-丁醇发酵再述).microbiol.rev.50(4):484-524。
-kims,gusa,kimyh,kimkj.(2014)crystalstructureandthermodynamicpropertiesofd-乳酸dehydrogenasefromlactobacillusjensenii(来自lactobacillusjensenii的d-乳酸脱氢酶的晶体结构和热动力学性质)。intjbiolmacromol.68:151-7。
-lis,wenj,jiax.(2011)engineeringbacillussubtilisforisobutanolproductionbyheterologousehrlichpathwayconstructionandthebiosynthetic2-ketoisovalerateprecursorpathwayoverexpression(通过异源ehrlich途径构建体的用于异丁醇生产的工程化枯草芽孢杆菌和生物合成的2-酮异戊酸前体途径过表达)。applmicrobiolbiotechnol.91(3):577-589。
-liaj,tanasn,geh.(1996).silicasol-gelimmobilizedamperometricbiosensorforhydrogenperoxide(用于过氧化氢的二氧化硅溶胶-凝胶固定的电流生物传感器)analyticachimicaacta335(1-2):137-145。
-liub,hur,dengj.(1997).characterizationofimmobilizationofanenzymeinamodifiedyzeolitematrixanditsapplicationtoanamperometricglucosebiosensor(酶在修饰的y沸石基质中的固定化的表征及其在电流葡萄糖生物传感器中的应用)。analchem.69(13):2343-8。
-ranemj,calvokc.(1997).reversalofthenucleotidespecificityofketolacidreductoisomerasebysite-directedmutagenesisidentifiesthenadphbindingsite(通过定点突变逆转酮酸酸还原异构酶的核苷酸特异性,鉴定出nadph结合位点)。archbiochembiophys.338(1):83-89。
-torabisf,khajehk,ghasempurs,ghaemin,siadatso.(2007).covalentattachmentofcholesteroloxidaseandhorseradishperoxidaseonperlitethroughsilanization:activity,stabilityandco-immobilization(胆固醇氧化酶和辣根过氧化物酶通过硅烷化共价连接珍珠岩:活性,稳定性和共同固定化)。jbiotechnol.131(2):111-20。
-wonak,kimas,kimakj,parkhw,moonasj.(2005).optimizationoflipaseentrapmentinca-alginategelbeads(藻酸钙凝胶珠中脂肪酶捕获的优化)。processbiochem.40:2149-2154。
- 还没有人留言评论。精彩留言会获得点赞!