一种用于弓形虫感染预防的DNA鸡尾酒疫苗及应用的制作方法
本发明涉及分子、细胞生物学研究领域,具体涉及一种疫苗,尤其涉及一种用于弓形虫感染预防的核苷酸序列、疫苗及应用。
背景技术:
刚地弓形虫(Toxoplasma gondii)是一种呈世界性分布的机会性致病原虫,往往成为导致免疫功能受损或抑制人群如艾滋病、器官移植、恶性肿瘤等患者死亡的原因。弓形虫病的危害还表现在孕妇感染造成流产、死胎、畸胎以及先天性患儿脑、眼疾病等严重后果。由于该病一直没有有效且副作用小的治疗药物,并且在体外实验中弓形虫对许多药物都显示出抗药性[Ricketts AP1,Pfefferkorn ER.Toxoplasma gondii:susceptibility and development of resistance to anticoccidial drugs in vitro.Antimicrob Agents Chemother.1993,37(11):2358-2363.]。所以研制安全有效的疫苗来防治弓形虫病就成为了近年来研究的重点。
过去的几十年中弓形虫疫苗的研究经历了从全虫疫苗或减毒活疫苗到基因工程疫苗的过程,由于前者存在不稳定等危险性因素,基因工程疫苗就成为了研究的趋势,其中单基因疫苗的免疫效果不理想,而多基因联合重组可能会引起基因表达蛋白的空间构象改变,从而失去天然蛋白的特性[魏庆宽.弓形虫多基因核酸疫苗构建及其免疫保护性研究.中国血吸虫病防治杂志.2012;24(2):173-182.],因此多个蛋白亚基或基因的鸡尾酒疫苗便由于其能同时克服上述疫苗的缺点而备受关注[Jongert E1,Roberts CW,Gargano N,et al.Vaccines against Toxoplasma gondii:challenges and opportunities.Mem Inst Oswaldo Cruz.2009;104(2):252-266.]。
技术实现要素:
本发明要解决的技术问题是提供一种用于弓形虫感染预防的疫苗及其应用。
弓形虫表面抗原(surface antigens,SAG)、微线体蛋白(microneme,MIC)和棒状体蛋白(Rhoptry protein,ROP)都是已经被证实有疫苗前途的虫体抗原,本发明分别用3种不同荧光的真核表达载体构建了SAGl、MIC3、ROP2鸡尾酒DNA疫苗并初步观察了其在小鼠体内及体外的表达及免疫保护作用。
为了解决上述技术问题,本发明通过如下技术方案实现:
本发明第一个方面是提供一种用于弓形虫感染预防的核苷酸序列,其含有选自以下的核苷酸序列:
1)SEQ ID NO.1所示的弓形虫表面抗原SAG1的核苷酸序列,和/或SEQ ID NO.2所示 弓形虫微线体蛋白MIC3的核苷酸序列,和/或SEQ ID NO.3所示棒状体蛋白ROP2的核苷酸序列;
2)与1)中核苷酸序列互补的核苷酸序列;
3)对上述1)或2)所示的核苷酸序列进行一个或多个碱基的取代、缺失或添加修饰的核苷酸序列。
在本发明的第二方面,提供一种载体,其包括上述核苷酸序列。
在本发明的第三方面,提供一种重组质粒,其为SEQ ID NO.1所示的弓形虫表面抗原SAG1的核苷酸序列,和/或SEQ ID NO.2所示弓形虫微线体蛋白MIC3的核苷酸序列,和/或SEQ ID NO.3所示棒状体蛋白ROP2的核苷酸序列。
在本发明的第四方面,提供一种蛋白,其氨基酸序列由上述重组质粒编码。
在本发明的第五方面,提供一种用于弓形虫感染预防的DNA鸡尾酒疫苗,其包括上述核苷酸序列,以及医学上可接受的载体。
在本发明的第六方面,提供上述核苷酸序列,载体,重组质粒,蛋白,疫苗在制备用于弓形虫感染预防的产品中的应用。
本发明分别用3种不同荧光的真核表达载体构建了SAGl、MIC3、ROP2鸡尾酒DNA疫苗并初步观察了其在小鼠体内及体外的表达及免疫保护作用。经ELISA试验的验证,本发明的鸡尾酒疫苗具有良好的免疫原性,免疫接种后能在体内高效、正确表达并能诱发机体产生较强的体液免疫反应。
附图说明
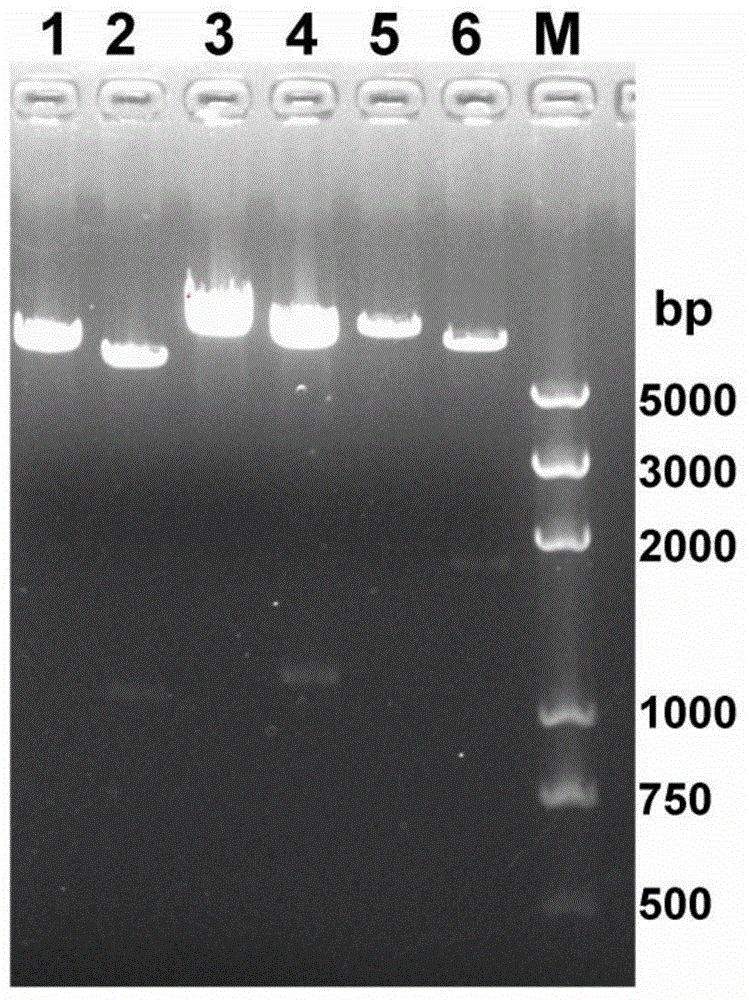
图1是实施例1中弓形虫SAG1、MIC3和ROP2基因的PCR扩增产物示意图,其中,M为DNA marker;1为SAG1扩增产物;2为MIC3扩增产物;3为ROP2扩增产物。
图2是实施例1中弓形虫SAG1、MIC3和ROP2基因的克隆和鉴定示意图,其中,M代表DNA marker;1代表pShuttle-SAG1经EcoRI单酶切;2代表pShuttle-SAG1经EcoRI和XhoI双酶切;3代表PLVX-MIC3经NotI单酶切;4代表PLVX-MIC3经NotI和XbaI双酶切;5代表pLVX-ROP2经EcoRI单酶切;6代表pLVX-ROP2经EcoRI和NotI双酶切。
具体实施方式
以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1
1材料
1.1质粒、菌株及主要试剂
弓形虫RH株基因组DNA、速殖子裂解抗原和小鼠阳性感染血清由浙江省医学科学院楼涤惠赠。慢病毒荧光表达载体PLVX-IRES-ZsGreen(8.2Kb),pLVX-IRES-RFP(8.2Kb)由上海百续生物科技有限公司购买。pShuttle-CMV-MCS-EF1α-AmCyan(5.7Kb)由重庆优宝生物技术有限公司购买。FreeStyleTM 293-F细胞(Invitrogen),293Freestyle培养基(GIBCO),聚乙二醇(polyethyleneglycol,PEI)(Polysciences.Inc),pMD18-T Simple Vector(Takara),E.coli JM109(Takara),TaqDNA聚合酶(Takara),限制性内切酶(New England Biolabs),T4DNA连接酶(Takara)。
1.2引物设计及合成
分别从基因库获取SAG1、MIC3和ROP2的基因序列(X14080、AJ132530、Z36906),设计对应的3对引物(见表1),并根据克隆需要,在引物的5′端分别引入酶切位点及Kozak序列,引物由上海桑尼生物科技有限公司合成。
1.3实验动物
6~8周龄SPF级C57BL/6雄性小鼠,体重20±2g,购自上海斯莱克实验动物有限责任公司。
2方法
2.1PCR扩增扩增片段反应体系参照公司Taq酶说明,反应条件均为:94℃预变性5min,94℃1min,55℃,1min,72℃2min,共35个循环,最后72℃延伸10min。PCR产物用1.0%的琼脂糖凝胶电泳鉴定。
2.2 PCR产物的纯化、克隆胶回收3个PCR产物分别与pMD18-T载体连接构成重组质粒pMD18-SAG1,pMD18-MIC3,pMD18-ROP2,再分别将质粒转化至E.coli JM109中,PCR鉴定后选阳性克隆测序。
2.3真核表达载体的构建分别用对应酶对上述3个质粒双酶切,将3个基因片段分别亚克隆到同样经对应酶类酶切过的真核表达载体上,构建真核荧光表达载体pShuttle-SAG1,PLVX-MIC3和pLVX-ROP2,再分别转化至E.coli JM109中,提取质粒进行双酶切鉴定,再次筛选阳性克隆测序鉴定。
2.4 PEI转染293F细胞
提前复苏1支293F细胞,加入到6mL新鲜培养基中混匀,1000rpm离心5分钟,弃上清,以3×105细胞/mL接种至293表达培养基中。实验前1000rpm离心5分钟收集培养细胞,弃培养基,用PBS将细胞洗两次后,用5mL新鲜293培养基重悬细胞,细胞密度调整 至1.5×106细胞/mL。取6μg混合的质粒DNA,用培养基稀释至100μL,取18μL PEI同样用稀释至100μL,将以上两溶液用枪头轻轻混匀,室温孵育15分钟。孵育结束后,将DNA-PEI逐滴加入细胞中,转染后24和48小时在荧光显微镜下镜检荧光表达水平,同时设未经转染的等量293细胞作为空白对照。
2.5动物肌肉注射
将C57BL/6小鼠随机分成3组,每组10只,第1组为生理盐水组,第2组为pShuttle及pVAX空质粒组;第3组为pShuttle-SAG1+PLVX-MIC3+pLVX-ROP2质粒免疫组。将提取纯化的重组质粒用生理盐水稀释至2μg/μl,用注射器从左后腿胫后肌下端,以平行于肌肉纵轴的方向进针,第1组注射生理盐水50μl,第2组注射3种空质粒各17μl,第3组注射pShuttle-SAG1,PLVX-MIC3,pLVX-ROP2各17μl。
2.6 ELISA检测血清抗体水平
各组小鼠在初次免疫后的第28日,摘眼球取血,室温放置lh后,3500rpm离心10min,吸取血清备用。将弓形虫RH株速殖子裂解抗原用包被缓冲液稀释至2μg/m1,包被96孔酶联板,4℃过夜。3%BSA,37℃封闭2h。加待测血清100μl,(1:10稀释于PBS),37℃孵育2h。加入100μl辣根过氧化酶标记的羊抗小鼠IgG(1:500),37℃孵育2h。TMB显色,450nm测定OD值。
表1SAGl、MIC3、ROP2基因的PCR引物序列
Table 1.Primer sequences of SAGl、MIC3、ROP2genes
3、实验结果
3.1.SAG1、MIC3和ROP2基因的体外扩增
SAG1、MIC3和ROP23个基因片段在体外以弓形虫基因组DNA为模板进行PCR扩增,扩增结果经电泳检测,在约1、1.1及1.7kb处出现特异的扩增条带(图1),符合预期大小。
3.2.目的基因的克隆和鉴定
扩增回收后的基因片段分别连接到T载体送测序,经测序鉴定,pMD18-MIC3、pMD18-ROP2的序列结果与GenBank报道的相应基因完全一致。pMD18-SAG1同CDS(Coding sequence)有2个位点的差异,其中1个位点为同义突变,另一个位点与重复测序的结果一致。构建的真核载体pShuttle-SAG1,PLVX-MIC3和pLVX-ROP2的测序结果也同本次结果保持一致。对pShuttle-SAG1,PLVX-MIC3和pLVX-ROP2进行的双酶切结果显示3个基因片段均在正确位置插入,所构建质粒均正确。
3.3.免疫小鼠的抗体检测
以弓形虫抗原包被酶标板,ELISA方法测得生理盐水组IgG的OD值为0.613±0.053,pShuttle及pVAX空质粒组IgG的OD值为0.771±0.063,pShuttle-SAG1+PLVX-MIC3+pLVX-ROP2质粒免疫组IgG的OD值为1.561±0.113,显著高于前两组(P<0.01)。
3.4.讨论
刚地弓形虫的致病是因为其具有侵入几乎所有有核细胞并在其内增殖的能力,侵入过程的第一步是识别并吸附靶细胞。在弓形虫对宿主细胞吸附的起始过程中,其表面蛋白、微线体蛋白和棒状体蛋白都起到了重要作用,其中SAG1、MIC3和ROP2都是目前研究较多的弓形虫入侵相关蛋白,也是目前疫苗研究的热点。本研究利用双基因共表达的荧光真核表达载体分别构建了不同荧光的真核表达载体pShuttle-SAG1,PLVX-MIC3和pLVX-ROP2来观察3个蛋白在体内外细胞中的表达以及免疫后血清抗体的水平,结果发现该鸡尾酒疫苗具有良好的免疫原性,免疫接种后能在体内高效、正确表达并能诱发机体产生较强的体液免疫反应。
弓形虫病是人兽共患寄生虫病,而且人畜感染弓形虫是同一虫种,所以制备出的疫苗无论是对人类还是牲畜等动物防治都具有广阔的应用前景和极大的社会需求,尤其是目前作为弓形虫中间宿主的犬和终末宿主的猫作为宠物与人类关系越来越密切,研制动物用疫苗显得尤为重要,目前疫苗研究面临的问题之一是免疫保护率,所以进一步研究可以通过使用并或添加合适的佐剂的方法来提高。
- 还没有人留言评论。精彩留言会获得点赞!