一种遗传性视网膜色素变性疾病的致病突变及其检测试剂的制作方法
本发明属于生物医药领域,涉及一种遗传性视网膜色素变性疾病的致病突变及其检测试剂。
背景技术:
视网膜色素变性(retinitis pigmentosa;RP)是一组由遗传缺陷引起的进行性视网膜退行性疾病,这类疾病以光感受器细胞和视网膜色素上皮细胞(RPE)的不可逆性凋亡为主要病理特征。RP患者的发病年龄在不同患者中有较大差异,从几岁到几十岁不等,但其首发临床表现多为夜盲,伴有视野的缩窄,以及中心视力的进行性下降,严重者可致盲。RP是临床上常见且危害较为严重的一类遗传性致盲疾病,是严重危害世界范围内工作年龄人群的一大类致盲眼病,RP在我国乃至世界范围内均有较高的发病率。我国是RP遗传资源大国,但目前RP相关的遗传学信息多来自西方国家,因此对我国RP患者进行深入的遗传学研究,探寻潜在的RP相关的新致病基因及致病突变显得尤为重要。
RP为单基因遗传病,具有显著的临床及遗传异质性。RP的遗传异质性表现在众多基因缺陷均可致病,其常见的遗传模式有常染色体显性遗传、常染色体隐性遗传及X连锁隐性遗传。迄今,全世界已鉴定出75个RP相关致病基因和82个连锁位点(www.RetNet.org),且随着研究深入,该数目正逐年递增。与此同时,携带有相同致病基因突变甚至是相同致病突变的患者,其临床表现亦可能存在较大差异,即显著的临床异质性。目前仍有40%到50%(西方国家统计结果,我国比率更高)RP患者的致病基因尚未找到,提示存在大量RP的新致病基因有待挖掘。
针对RP的分子遗传学研究必须建立在一定的分子生物学技术的基础上。研究RP致病基因的一个重要目的是进行RP的分子诊断,鉴于其显著的遗传异质性,如何检测众多致病基因突变是目前的难题之一。基于连锁分析的定位克隆策略是鉴定单基因遗传病致病基因的经典方法,但是同时也面临一些困难:①通常需要多代家系,难以分析小家系和散发病例。②有时多代家系也不能定位致病位点。③难以在连锁区域内筛选出正确的致病基因。因此,鉴于RP疾病本身的性质及传统分析技术的局限性,寻求一种全新的RP致病基因的研究方法显得尤为迫切。
Secreted phosphoprotein 2(SPP2;MIM 602637)基因位于2号染色体长臂2q37.1位置,该 基因含有8个外显子,其编码的Spp-24蛋白是一种含有211个氨基酸的分泌性蛋白,是cystatin蛋白家族的一员,目前有关Spp-24蛋白功能的研究较少,SPP2基因突变与疾病,尤其是与视网膜疾病间的关系国内外均未见任何报道。
技术实现要素:
本发明的目的是针对上述缺陷,提供一种遗传性视网膜色素变性疾病的致病突变。
本发明的另一目的是提供该致病突变的应用。
本发明的又一目的是提供该致病突变的检测试剂。
本发明的目的可通过如下技术方案实现:
一种用于检测遗传性视网膜色素变性疾病的突变的SPP2基因,突变的SPP2基因为杂合突变SPP2 p.Gly97Arg或者SPP2 p.Gly29Asp。
野生型SPP2基因在Ensemble数据库中的基因编号为:ENSG00000072080,所述的突变的SPP2基因SPP2 p.Gly97Arg在物理位置为234967558的碱基由G突变为C,其他部分与野生型相同;所述的突变的SPP2基因SPP2 p.Gly29Asp在物理位置为234959515的碱基由G突变为A,其他部分与野生型相同。
一种突变的Spp-24蛋白,野生型Spp-24蛋白在Ensemble数据库中的基因转录本编号为:ENST00000168148,突变的Spp-24蛋白在该野生型蛋白的第97位氨基酸由甘氨酸突变为精氨酸,或者第29位氨基酸由甘氨酸变为天冬氨酸,其他部分与野生型相同。
本发明所述的突变的SPP2基因或者所述的突变的Spp-24蛋白在制备遗传性视网膜色素变性疾病检测试剂或检测设备中的应用。
其中所述的检测试剂优选自:引物或引物对、探针、抗体、或核酸芯片中的一种或多种。
所述的检测设备优选包括含有检测突变的SPP2基因的基因芯片的检测平台。
一种检测遗传性视锥细胞营养不良疾病的试剂盒,所述的试剂盒包括:
(a)检测SPP2基因物理位置为234967558和234959515核苷酸位点的试剂;或检测Spp-24蛋白第29位或第97位氨基酸位点的试剂;
(b)说明书。
其中,所述的试剂优选选自引物或引物对、探针、抗体、或核酸芯片中的一种或多种。
作为本发明的一种优选,所述的试剂为基于深度测序为平台的基因芯片杂交探针。
检测234959515核苷酸位点的杂交探针序列优选为chr2|234959442-234959561,序列如SEQ ID NO.1所示;检测234967558核苷酸位点的杂交探针序列优选为chr2|234967464-234967583,序列如SEQ ID NO.4所示。
作为本发明的另一种优选,所述的试剂为检测234959515核苷酸位点和234967558核苷酸位点的引物对。
检测234967558核苷酸位点的正向引物序列为SEQ ID NO.14,反向引物序列为SEQ ID NO.15;检测234959515核苷酸位点的正向引物序列为SEQ ID NO.16,反向引物序列为SEQ ID NO.17。
一种以深度测序为平台筛查RP患者中SPP2基因突变的方法,包括以下步骤:
(1)建立RP患者家系临床与遗传资源库,收集RP家系的临床资料及血液标本,提取基因组DNA;
(2)设计SEQ ID NO.1~SEQ ID NO.13所示的用于检测SPP2基因突变的杂交探针,并将其整合到基因芯片上;
(3)利用制备的基因芯片捕获目标区域并进行深度测序;
(4)对测序结果进行优化的生物信息学分析,筛选到一个新的RP新的致病突变为杂合突变SPP2 p.Gly97Arg。突变SPP2 p.Gly97Arg位于2号染色体,物理位置为234967558(Ensemble数据库)的碱基由G突变为C;RNA水平:SPP2基因编码RNA第289位碱基由G突变为C;蛋白水平:SPP2基因编码蛋白第97位氨基酸由甘氨酸突变为精氨酸。
步骤(2)所述的基因芯片优选Agilent公司生产的基因芯片。
步骤(3)所述的利用制备的基因芯片捕获目标区域并进行深度测序优选利用美国Illumina公司的Hi-seq2000仪器完成。
步骤(3)所述的利用制备的基因芯片捕获目标区域并进行深度测序优选流程为:将基因组DNA片段化,在DNA末端标记“A”并与Illumina PE接头-寡核苷酸混合物相连接;连接产物经PCR富集,获得DNA文库,并将DNA文库与已知致病基因捕获芯片杂交、洗脱、纯化,获得编码序列;创建配对末端,在Illumina HiSeqTM 2000平台上对目标序列进行测序。
有益效果
目前并没有研究指出SPP2基因突变与眼部疾病间的关系,因此,针对SPP2基因与RP的相关研究显得尤为必要。本专利的选择SPP2基因作为RP的候选基因,是由申请人在多年从事临床医疗、遗传学研究的基础上所筛选出的,通过本发明方法进一步明确了SPP2基因与 RP的关系。
一个基因可以对应多个不同的转录本,且不同转录本所编码的RNA及蛋白有所不同。本专利中申请人根据长期从事遗传学研究的经验,筛选出SPP2基因的最优转录本,并根据不同的转录本设计相应的探针,从而使筛查效益达到最高,最终获得遗传性视网膜色素变性疾病的致病突变SPP2 p.Gly97Arg。
RP具有显著的遗传异质性,目前已知致病基因75个,已连锁位点82个,且仍存在大量未知的致病基因。本发明提供了新的致病基因的致病位点,为该疾病的诊断提供了新的分子生物学基础。
附图说明
图1家系图
图2先证者眼底照
图3先证者双眼光学相干断层成像
图4 SPP2突变及野生型序列测序图
图5保守性分析
图6野生型及携带有突变的LCA5蛋白晶体结构
图7小鼠各组织、ARPE19及293T细胞系SPP2基因表达分析(PCR)
图8斑马鱼胚胎6-96小时个时间点SPP2基因表达分析(原位杂交)
图9小鼠视网膜各层Spp-24蛋白表达分析(免疫荧光)
图10 293T细胞转染野生/突变型质粒后Flag及Spp-24蛋白细胞内定位分析(免疫荧光)
图11 293T细胞转染野生/突变型质粒后Flag及内质网细胞内定位分析(免疫荧光)
图12 293T细胞转染野生/突变型质粒后内质网应激相关蛋白表达分析(免疫印迹)
图13野生/突变型mRNA注射后斑马鱼致畸致死率比较
图14野生/突变型mRNA注射后斑马鱼眼球切片PNA/RHO染色(免疫荧光)
图15野生/突变型mRNA注射后斑马鱼眼球切片ZPR-2染色(免疫荧光)
具体实施方式
实施例1
对一个四代的患有视网膜色素变性(retinitis pigmentosa;RP)的家系的SPP2基因突变进行检测。
实验方法:
1.该家系临床资源的采集及遗传资源库的建立:
收集该家系中各成员的临床资料及血液样本,家系图见图1。临床资料主要包括个人病史、家族史、最佳矫正视力(best corrected visual acuities;BCVAs)、裂隙灯检查、眼底照、色觉检查、视野检查(Humphrey视野计)、视觉诱发电位检测(visual-evoked potentials;VEP)、全视野电生理检查(electroretinography;ERG)、眼底荧光血管造影检查(fundus fluorescein angiography;FFA)及光学相干断层成像检查(optical coherence tomography;OCT)等。并用血液基因组DNA提取试剂盒(Qiagen,Hilden,Germany)对家系各成员的血液基因组DNA进行提取。
2.借助于高通量二代测序挖掘该家系的致病突变:
2.1设计并订制捕获芯片:
2.1.1 SPP2基因及转录本序列信息:
该基因捕获芯片为全外显子组捕获芯片,可对目前所有已知基因进行检测,其中包括全部目前已知的RP相关的致病基因。我们所参照的SPP2基因在Ensemble数据库中的基因编号为:ENSG00000072080(注:该编号来自Ensemble数据库,www.ensembl.org,可输入基因编码检索基因详细信息及基因序列)。
2.1.2转录本的选择:
针对不同基因选择特定的转录本,每个基因均含有多个转录本,在选择转录本时,我们的原则是:首先考虑拥有CCDS编码蛋白的转录本,若一个基因有多个转录本均编码蛋白,则首选含氨基酸数最多的蛋白相对应的转录本,若多个转录本氨基酸含量相同,则进一步选择含碱基数最多的转录本。据以上原则,我们所筛选出的SPP2基因转录本编号为:ENST00000168148(注:该编号来自Ensemble数据库,www.ensembl.org,可输入转录本编码检索转录本详细信息及转录本序列)。
2.1.2杂交探针的设计:
杂交探针的设计标准为:(1)探针覆盖所有候选基因的目标区域,即外显子区域以及外显子和内含子拼接处(外显子上下游各100个bp);(2)去除重复序列:对于在基因组出现的高度重复序列以及在人类基因组中出现2-5倍的较低频率的重复片段,我们予以去除,避免捕获其他同源基因,增加假阳性,从而降低检测效率。申请人将所有候选基因的目标区域与人类基因组DNA序列进行比对,共移除了2.5%的重复序列;(3)在探针设计过程中,我们对临近的外显子进行了特定的整合,其相邻探针整合标准为:当相邻外显子的综合目标区域(即前个外显子的 上游100bp起至后一个外显子的下游100bp止)总和小于600bp,即将其整合为一个探针,以求通过一对探针完成多对外显子区域的捕获;(4)当所设计探针序列小于250bp时,在其两端各包含上下游100bp的内含子的基础上,各继续增加相同bp数的内含子,使探针大小达到250bp。根据以上设计原则,我们针对SPP2基因所设计的探针序列如下:
用于筛选RP致病基因SPP2的杂交探针序列共13条,序列如SEQ ID NO.1~SEQ ID NO.13所示;
2.2目标区域捕获及深度测序:
首先将基因组DNA片段化,并在DNA末端标记“A”,与Illumina PE接头-寡核苷酸混合物相连接,连接产物经PCR富集,获得DNA文库。然后将DNA文库与已知致病基因捕获芯片杂交、洗脱、纯化,获得编码序列。最后创建配对末端,在HiSeqTM 2000(Illumina,Inc.,San Diego,CA,USA)平台上对目标序列进行测序。
2.3对测序数据进行生物信息学分析,筛选出候选致病基因:
2.3.1采用Mosaik软件(http://bioinformatics.bc.edu/marthlab/Mosaik)处理Illumina原始测序数据(配对末端数据),产生.bam类型文件。将.bam文件输入GATK,利用GATK检测单核苷酸变异体(single nucleotide variant)和小的插入或缺失(insertion/deletions),同时进行质量评估,便于下游的生物信息学分析,最后产生.vcf类型文件。
2.3.2将患者的测序结果在包括dbSNP132
(http://hgdownload.cse.ucsc.edu/goldenPath/hg19/database/snp132.txt.gz.),HapMap计划(ftp://ftp.ncbi.nlm.nih.gov/hapmap),1000Genome Project(ftp://ftp.1000genomes.ebi.ac.uk/vol1/ftp),炎黄数据库(http://yh.genomics.org.cn/)以及Exome Variant Server(http://evs.gs.washington.edu/EVS/)在内的五个单核苷酸多态性(SNP)数据库中筛查,滤过所有已知的SNP位点;
2.3.3将患者的测序结果所对应的基因序列进行比较和分析,优先分析插入/缺失突变、无义突变和错义突变,结果可分为三类,包括已知突变、已知基因的新突变和新基因的突变。
2.4经Sanger测序验证,鉴定致病基因:
PCR法分别针对筛选出的突变位点及邻近DNA序列在相应家系中进行扩增,所用引物序列采用Primer 3(http://frodo.wi.mit.edu/)引物设计软件设计。所用PCR的反应体系(20μL体系)为:5*buffer 4μL,25mM MgCl22μL,DNA 1μL,正向引物F 1μL,反向引物R 1μL,10mM dNTP0.4μL,Taq酶0.1μL,ddH2O 10.5μL。PCR反应程序:98℃5min,35个循环(98℃10s,60℃15s,72℃1min),72℃7min,4℃5min。1%琼脂糖凝胶电泳检测,与紫外线切胶仪下切 取PCR产物凝胶并纯化。对所有的PCR产物分别以正、反向引物测序,并对测序结果进行进一步分析,使用NCBI在线对比工具BLAST(http://blast.ncbi.nlm.nih.gov/),排除假阳性结果,并筛选出在家族中共分离的突变位点。其中检测234967558核苷酸位点的正向引物序列为SEQ ID NO.14,反向引物序列为SEQ ID NO.15。
实验结果:
1.家系临床资料:
眼科临床专家对该家系中的四名患者II:3、III:2、III:3和IV:1进行了详细全面的临床检查后,对该两名患者作出“视网膜色素变性”的临床诊断,下面以先证者为例,对其详细临床资料进行说明:
1)BCVAs:右眼0.6,左眼0.5;
2)裂隙灯检查:双眼人工晶体在位,双眼轻度后发障;
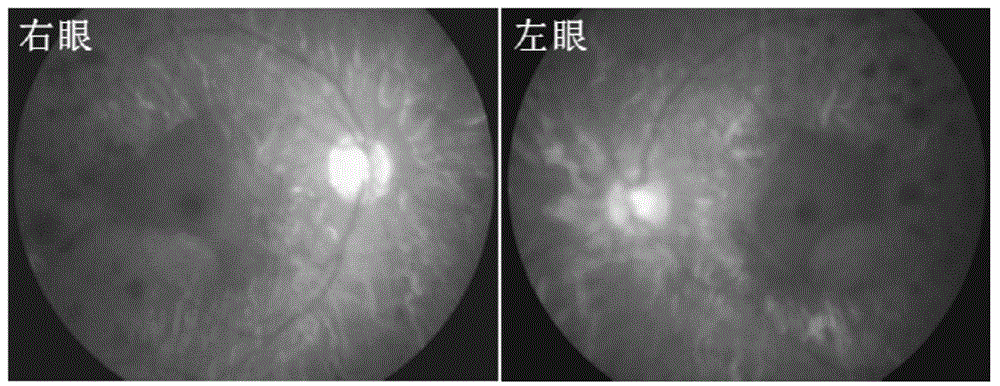
3)眼底照:双眼骨细胞样色素沉积,视盘苍白,视网膜血管变细以及周边部视网膜变性(图2);
4)视野检查:双眼管状视野;
5)ERG:双眼视锥、视杆细胞反应均消失,呈熄灭波;
9)OCT:双眼黄斑周边部内、外节盘层均消失,视网膜色素上皮层萎缩(图3)。
2.该家系遗传检测结果:
通过对家族中的两名患者II:3、IV:1及一名正常人III:5进行了全外显子组测序及生物信息学分析后,我们发现了两位患者均携带有可疑的杂合突变SPP2 p.Gly97Arg,其对应核苷酸改变为SPP2 c.G289C,未发现其他可疑的致病基因突变位点。检测该位点的杂交探针序列为chr2|234967464‐234967583,序列如SEQ ID NO.4所示。经Sanger测序验证证实该突变位点在该家族中表现为共分离,测序结果见图4。突变SPP2 p.Gly97Arg位于2号染色体,物理位置为234967558(Ensemble数据库)的碱基由G突变为C;RNA水平:SPP2基因编码RNA第289位碱基由G突变为C;蛋白水平:SPP2基因编码蛋白第97位氨基酸由甘氨酸突变为精氨酸,该基因相关的突变从未在RP患者中发现。
根据我们所设计的筛选流程,借助我们所设计的基因芯片及深度测序技术,我们成功证实所检测到的该SPP2基因杂合突变为RP新致病基因,p.Gly97Arg为该疾病的新致病位点。
实施例2:
针对实施例1中所检测出的致病基因进行功能学研究,此处以上述检测到的SPP2基因新 突变p.Gly97Arg为例。此外,我们在前期研究的基础上,选择并构建了SPP2基因的另外一个高度怀疑可能致病的突变,p.Gly29Asp,我们的实验结果证实了这个突变与p.Gly97Arg突变类似的致病性。
实验方法:
1.保守性分析:
采用NCBI HomoloGene数据库(http://www.ncbi.nlm.nih.gov/homologene)对所筛选得到突变在多个物种中进行保守性评估及预测。
2.根据SIFT和PROVEN值预测突变的致病能力:
采用两款主流在线预测软件:SIFT Human Protein DB(http://sift.bii.a-star.edu.sg/)及PROVEAN(v.1.1.3;http://provean.jcvi.org/index.php),预测错义突变对蛋白水平的影响,从而预测突变的致病能力。
3.蛋白晶体结构改变研究:
采用SWISS MODEL(http://swissmodel.expasy.org/)预测软件对LCA5野生型蛋白及携带有p.Ala212Pro突变的突变蛋白结构分别进行预测,评估突变所引起的蛋白结构改变。
4.基因表达谱检测:
4.1小鼠各组织及两株细胞系cDNA文库的构建与SPP2基因表达检测:
我们分离得到了C57BL/6小鼠的以下组织用于小鼠cDNA文库的构建:心脏、肝脏、大脑、肺脏、肾脏、小肠、胃、脾脏、肌肉、神经视网膜、视网膜色素上皮层及视神经,我们还获得了ARPE19(购自ATCC细胞库,ATCC编号:CRL-2302)和HEK293T(购自ATCC细胞库,ATCC编号:CRL-3216)两株细胞系来用于细胞系cDNA文库的构建。我们首先利用Trizol法分别提取上述12种小鼠组织及两株细胞系的RNA,并逆转录得到相应的cDNA,再利用PCR法对SPP2基因的cDNA序列片段进行扩增,并用1%琼脂糖凝胶电泳检测。所用PCR的反应体系与实例1中所采用的体系一致,检测小鼠组织SPP2表达所用正向引物序列F1为:ATGGAGCAGGCAATGCTGAA,反向引物序列R1为:TCACTCAAAGCCAGAATTTACTCTTG;检测小鼠组织β-actin表达所用正向引物序列F2为:GAGACCTTCAACACCCCAGC,反向引物序列R2为:ATGTCACGCACGATTTCCC;检测细胞系SPP2表达所用正向引物序列F3为:ATGATTTCCAGAATGGAGAAGATGAC,反向引物序列R3为:TTACTCAAAGTCAGTATTTATTCTTGCTCTG;检测细胞系β-actin表达所用正向引物序列F4为:GCTCGTCGTCGACAACGGCTC,反向引物序列R4为:CAAACATGATCTGGGTCATCTTCTC。
4.2 SPP2探针合成及斑马鱼整胚原位杂交:
按照4.1中的方法构建斑马鱼胚胎全身组织的cDNA文库,利用PCR的方法扩增得到斑马SPP2全长cDNA,利用Roche试剂盒合成斑马鱼SPP2原位杂交检测探针。收集不同时间点,包括6小时、12小时、24小时、48小时、72小时和96小时的斑马鱼胚胎,利用上述合成的探针。对斑马鱼进行整胚原位杂交,并用Leica显微镜对其进行观察。
4.3小鼠眼球切片及免疫荧光染色:
取成年C57BL/6小鼠的完整眼球组织,固定、脱水后分离得到眼杯,OCT包埋冰冻后进行冰冻切片(Leica冰冻切片机),对冰冻切片进行免疫荧光染色,一抗为Spp-24抗体,漂洗后再加入荧光二抗和DAPI,封片后用Olympus激光共聚焦显微镜对其进行观察。
5.细胞实验:
分别合成野生型和突变型人源SPP2基因全长cDNA并将其克隆至pCMV-C-Flag载体(碧云天),构建Flag标签的Spp-24WT、Spp-24Gly29Asp和Spp-24Gly97Arg质粒。将上述质粒分别转染HEK293T细胞,转染24小时候对细胞进行固定,对细胞爬片免疫荧光染色,一抗为Flag抗体与Spp-24/内质网抗体的组合,漂洗后再加入荧光二抗和DAPI,封片后用Olympus激光共聚焦显微镜对其进行观察。
6.斑马鱼实验:
分别合成野生型和突变型人源SPP2基因全长cDNA并将其克隆至pxT7载体,构建pxT7标签的Spp-24WT、Spp-24Gly29Asp和Spp-24Gly97Arg质粒,利用这些质粒合成相应的SPP2mRNA,包括Spp-24Anti、Spp-24WT、Spp-24Gly29Asp以及Spp-24Gly97Arg mRNA。将上述合成的mRNA分别进行显微注射到斑马鱼胚胎中,观察斑马鱼整体形态结构改变,统计和比较不同注射组斑马鱼的致畸致死率。对注射后4天的斑马鱼进行固定、脱水和OCT包埋,对其眼球组织进行冰冻切片,对冰冻切片进行免疫荧光染色,一抗为PNA/RHO/ZPR-2抗体,漂洗后再加入荧光二抗和DAPI,封片后用Olympus激光共聚焦显微镜对其进行观察。
实验结果:
1.保守性分析:
SPP2 p.Gly29Asp及p.Gly97Arg这两个位点在鼠、猪、狼、猩猩及人类等多个物种中均高度保守,即这两个位点在进化过程中高度保守,从而进一步证明该位点的突变可能会引起较为严重的病理现象(图5)。
2.SIFT和PROVEN值预测:
SPP2 p.Gly29Asp和p.Gly97Arg的SIFT结果均为破坏性(damaging),PROVEN结果均为有害的(deleterious),高度提示这两个突变位点均拥有较大的致病可能性。
3.蛋白晶体结构改变研究:
蛋白晶体结构预测结果显示,SPP2 p.Gly29Asp和p.Gly97Arg突变均可导致氨基酸结构的改变(图6),从而改变蛋白结构,对蛋白功能产生影响。值得提出的是,SPP2 p.Gly29Asp可以导致相应区段的蛋白空间结构发生扭转,进一步影响蛋白功能。
4.基因表达谱:
半定量PCR研究结果显示,SPP2基因在小鼠的各个组织中均有表达,但表达量在不同组织中差异较大,该基因在我们所关注的眼组织,包括神经视网膜层、视网膜色素上皮层和视神经中均有较为显著的表达(图7)。与此同时,SPP2基因在两个人源的细胞系ARPE19和293T中也均有表达(图7)。斑马鱼原位杂交结果显示,在斑马鱼胚胎发育的各个不同阶段(从6小时至96小时),SPP2基因在斑马鱼眼组织均有较为显著的持续表达(图8)。小鼠眼球切片免疫荧光染色结果显示,Spp-24蛋白在小鼠视网膜的各层均有表达,在外节盘层和视网膜色素上皮层的表达尤为丰富(图9)。综上,我们的结果从多角度证明了SPP2基因和Spp-24蛋白在神经视网膜层,尤其是外节盘层和视网膜色素上皮层的表达。
5.细胞实验结果:
不同转染组的细胞核为DAPI标记,外源性Spp-24蛋白为Flag标记,外源性和内源性Spp-24蛋白总和为Spp-24标记。转染野生型Spp-24质粒的HEK293T细胞中外源性Spp-24蛋白均匀的分布在细胞膜周围,内源性的Spp-24蛋白则均匀分布在细胞内,而转染两种突变型Spp-24Gly29Asp和Spp-24Gly97Arg质粒的HEK293T细胞中内源性和外源性Spp-24蛋白均出现了胞内的积聚,提示转染突变型Spp-24Gly29Asp和Spp-24Gly97Arg质粒的HEK293T细胞内外源性的Spp-24蛋白出现了分泌障碍,且这些突变的外源性的Spp-24蛋白会与细胞内内源性的Spp-24蛋白相互作用,进一步影响到内源性的Spp-24蛋白的正常分泌(图10)。
为了进一步研究转染突变型Spp-24质粒后这些Spp-24蛋白发生异常积聚的具体环节,我们将外源性的Spp-24蛋白和细胞的内质网共染。研究发现,这些突变的Spp-24蛋白均出现了在细胞内质网内的积聚(图11)。于是,我们进一步研究这些突变的Spp-24蛋白在内质网内的异常积聚是否会引起内质网功能的破坏(ER stress),我们进一步分别提取了转染野生型和两种突变型Spp-24质粒的细胞的总蛋白,利用蛋白印迹的方法对内质网功能相关的蛋白进行了检测,我们的研究结果表明,转染突变型Spp-24质粒的HEK293T细胞中PDI、BIP、IRE1α、 Ero1-Lα的表达量均较野生型明显上升,提示转染突变型Spp-24质粒的HEK293T细胞中存在内质网功能的破坏(图12)。
6.斑马鱼实验结果:
我们进一步利用在体实验比较注射不同SPP2mRNA组的斑马鱼整体形态结构的改变以及眼部组织结构特异性的改变。我们的研究结果显示,注射野生型mRNA的斑马鱼其致死率和致畸率与注射无义mRNA的斑马鱼并无明显差距,而注射突变型Spp-24Gly29Asp或Spp-24Gly97Arg mRNA的斑马鱼其致死率和致畸率较野生型注射组均出现了明显的上升(图13)。与此同时,我们针对这一部分注射后的斑马鱼进行了眼组织切片免疫荧光染色,用RHO标记了斑马鱼的视杆细胞,用PNA标记了斑马鱼的视锥细胞,用ZPR-2标记了斑马鱼的视网膜色素上皮层,结果显示,注射突变型mRNA的斑马鱼的视杆细胞层(RHO标记)和视网膜色素上皮层(RPE标记)缺失,但视锥细胞层(PNA标记)相对完整,而注射野生型mRNA的斑马鱼各细胞层均较完整(图14、15)。综上,斑马鱼实验结果表明,突变型SPP2mRNA会引起斑马鱼视杆细胞和RPE细胞的特异性损害,这一结果与病人中得到的结果类似。
综上,我们通过遗传学、细胞实验学和动物实验学的实验结论从多方面证实了SPP2基因p.Gly29Asp和p.Gly97Arg突变的危害。
- 还没有人留言评论。精彩留言会获得点赞!