抑制Nur77的siRNA分子及其抗血管再狭窄的应用的制作方法
本发明属于生物医药领域,具体涉及一种用于抑制孤儿核受体Nur77的双链siRNA分子、及其在抗血管再狭窄方面的应用。
背景技术:
冠状动脉旁路移植术(Coronary artery bypass grafting,CABG)是目前治疗冠状动脉硬化等严重心血管疾病的重要方法,其中自体静脉如大隐静脉等由于解剖表浅、来源较多等因素,往往成为首选移植物。然而术后移植静脉内膜的增生,管腔的再狭窄甚至闭塞都严重影响了手术的远期疗效。大量临床和实验表明:静脉桥移植物1年和5年的通畅率分别为85%、78%,而10年后的通畅率仅为50%。因此,如何抑制移植血管内膜的增生,减少血管再狭窄是目前CABG急需解决的问题。
近些年的研究表明,移植静脉桥再狭窄的机制主要是以内膜异常增厚为病理基础的,而血管内膜的增厚往往与多种因素有关,比如:手术中对移植血管的机械损伤、牵拉;术后血管平滑肌细胞(VSMC)的异常增殖、迁移;动脉血流冲击引起的血管张力的改变;巨噬细胞以及各类生长因子、化学因子等刺激,均会导致移植血管内膜及中膜的增厚。这些因素几乎都会刺激血管平滑肌细胞由静止表型转化为活动的增殖性表型,因此平滑肌细胞对于影响自体静脉移植远期的效果有着举足轻重的作用。
研究表明,细胞核受体(Nuclear receptor,NR)是在生物中广泛分布的一类受体超家族,其主要包括类固醇激素受体、维生素D受体、甲状腺激素、维甲酸受体以及孤儿核受体(orphan nuclear receptor,ONR)。其中,NR4A家族是近些年来发现的孤儿核受体中的一类,其属于立刻早期基因并且尚未发现明确的配体,主要通过蛋白表达和翻译后修饰对其活性进行调控,NR4A家族主要包括三个亚家族:Nur77(TR3、NGFI-B),NOR-1以及Nurr-1。大量实验结果显示,Nur77在动脉粥样病变、移植血管内膜和中膜的平滑肌细胞、巨噬细胞以及内皮细胞中均有较高的表达。
孤儿核受体Nur77/TR3是1988年Milbrandt等人通过神经生长因子诱导大鼠的嗜铬细胞瘤细胞系PC12所发现的,其参与体内众多因子的转录调控。Nur77可以与反应元件序列TGATATTTX6AAATTGCCA结合为二聚体,又可以与AAAGGTCA直接结合为单体。国外早些年的研究发现,Nur77可能参与了众多细胞凋亡的过程,例如,在鼠胸腺细胞发育过程中,Nur77似乎参与了对未成熟T细胞阴性选择的过程。同样,在人的肿瘤细胞中亦发现,Nur77/TR3参与诱导处理后的细胞凋亡。近些年来的实验发现,血清、LPS、TNF-α以及PDGF等均可诱导平滑肌细细胞和巨噬细胞中Nur77的表达,分别结扎野生型和过表达Nur77小鼠的颈总动脉4周,结果发现前者血管内膜增生显著低于后者,同时在粥样硬化的患者血管中发现高表达Nur77的巨噬细胞和平滑肌细胞,因此,部分学者认为Nur77参与了巨噬细胞的脂质沉积并且抑制了巨噬细胞向泡沫细胞的转变。
与巨噬细胞一样,血管平滑肌细胞亦参与了血管狭窄的病变。平滑肌细胞具有两种表型:静止型以及活动型。生理情况下,平滑肌细胞处于静止状态,而当局部炎症或是各种化学炎症因子或者血管损伤刺激后,平滑肌细胞表型发生转变,传统的观点认为平滑肌细胞的增殖和迁移以及细胞外基质的合成是血管再狭窄的重要机制。
上述研究预示,抑制Nur77表达或许能够防止血管再狭窄的发生。因此,开发出能够抑制Nur77基因表达的药物对于冠状动脉旁路移植术具有重要意义。
RNA干扰(RNA interference,RNAi)技术开辟了一个全新的治疗领域,RNAi在医药领域有广阔的应用前景,如抗病毒、抗肿瘤和抗炎症等。RNA干扰(RNA interference,RNAi)是1998年首次报道的一种转录后的基因沉默效应,是指在生物体细胞内,外源性或内源性的双链RNA识别有同源序列的mRNA,对其特异性切割,从而阻断其翻译的过程(Nature.1998,391:806-811)。RNAi发挥基因沉默作用的机制是:长dsRNA进入细胞后,被Dicer酶结合并切割。Dicer酶的切割产物通常是长度为20-25bp,且在每个链的3’末端有2个核苷酸悬垂的小干扰RNA(small interfering RNA,siRNA)。siRNA双链中的一条,一般是反义链掺入到RNA-诱导的沉默复合物中(RISC),与互补的序列配对。RISC首先介导siRNA双链解旋,与RISC耦合的单链的siRNA以序列特异的方式与靶mRNA结合,之后由RISC的催化组分切割靶mRNA。切割靶mRNA可以抑制其翻译,最终抑制转录该mRNA的基因的表达。与传统的抑制基因表达的反义寡核苷酸技术和核酶技术相比,siRNA沉默基因表达的效果要强大数十倍至数百倍,现已被证实在多种病毒感染性疾病和肿瘤的治疗中具有极大的潜力,是理想的阻断基因表达的治疗手段。目前国际上已有数十种siRNA药物进入临床阶段。
因为孤儿核受体Nur77与血管再狭窄相关,可以以Nur77基因作为标靶,开发出相应的siRNA药物,用于抑制或降低血管再狭窄的发生,达到治疗疾病的目的。
技术实现要素:
因此,本发明的目的在于提供一种特异性靶向孤儿核受体Nur77基因的siRNA分子,其可以阻断Nur77基因的mRNA转录,阻止基因的翻译,从而根本上抑制Nur77的表达,最终达到抑制发生血管再狭窄的目的。
本发明的技术方案包括:
一种靶向孤儿核受体Nur77基因的siRNA分子,其为双链分子,由如下序列的正义链和反义链组成:
正义链:5’-GGUGAAGGAAGUUGUCCGANn-3’(SEQ ID NO:1),
反义链:5’-UCGGACAACUUCCUUCACCNn-3’(SEQ ID NO:2)。
其中,正义链和反义链中的N相同或者不同,并且各自独立地是胞嘧啶C、尿嘧啶U、鸟嘌呤G、腺嘌呤A、脱氧胞嘧啶dC、脱氧鸟嘌呤dG、脱氧腺嘌呤dA或脱氧胸腺嘧啶dT;n代表N的个数,n是0、1或2。
对于上述双链RNA分子而言,优选所述N为dT,且优选n为0或2。
换言之,上述双链RNA分子的主干序列为:
正义链:5’-GGUGAAGGAAGUUGUCCGA-3’(SEQ ID NO:3),
反义链:5’-UCGGACAACUUCCUUCACC-3’(SEQ ID NO:4)。
优选上述双链RNA分子由如下序列的正义链和反义链组成:
正义链:5’-GGUGAAGGAAGUUGUCCGAdTdT-3’(SEQ ID NO:5),
反义链:5’-UCGGACAACUUCCUUCACCdTdT-3’(SEQ ID NO:6)。
本发明的另一目的在于提供上述双链RNA分子在制备抗血管再狭窄药物中的用途。
上述的抗血管再狭窄药物尤其用于抑制移植血管内膜增生。
相对应地,本发明的再一目的在于提供一种抗血管再狭窄、尤其是用于移植血管内膜增生的药物,其包含本发明的双链RNA分子。
优选地,上述药物是适用于注射的剂型或凝胶剂。
优选地,上述药物还包含必要的佐剂。
体外实验证明,本发明的双链RNA分子可特异性地下调孤儿核受体Nur77基因表达,达到抑制移植血管再狭窄发生的目的。所述的移植血管再狭窄尤其是指冠状动脉旁路移植术(CABG)或经皮冠状动脉介入治疗(PCI)后的血管再狭窄。
附图说明
图1是用实时定量PCR方法检测的本发明的siRNA1、siRNA2和siRNA3抑制靶基因Nur77基因的mRNA表达水平的柱状图。其中,靶向Nur77的siRNA1、siRNA2和siRNA3显著抑制了Nur77基因的mRNA表达水平,正常组和阴性对照NC siRNA组无显著差异。其中*P<0.05。
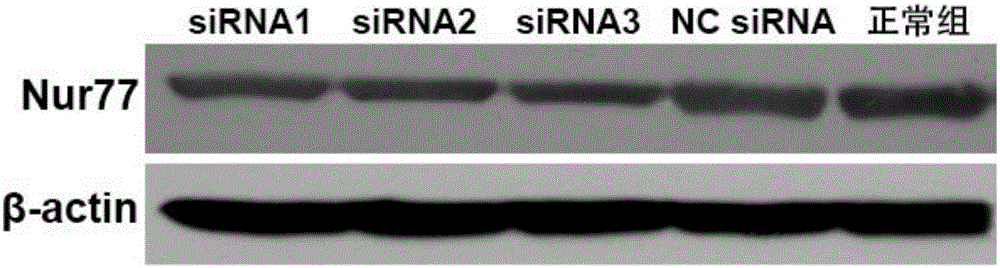
图2是用蛋白印迹(Western blot)的方法检测本发明siRNA1、siRNA2和siRNA3抑制靶基因Nur77基因的蛋白质表达水平的凝胶电泳图。
图3是显示根据图2所示蛋白印迹图的灰度值计算的蛋白表达量的柱状图。靶向Nur77的siRNA1、siRNA2和siRNA3显著抑制了Nur77蛋白质表达水平,正常组和阴性对照NC siRNA组无显著差异。其中*P<0.05。
图4是用CCK8的方法检测的细胞生长曲线。生长曲线反映了细胞的增殖情况,靶向Nur77的siRNA1、siRNA2和siRNA3显著抑制了细胞的生长,正常组和阴性对照NC siRNA组无显著差异。
图5是显示用体内实验检测本发明siRNA1、siRNA2和siRNA3对靶基因Nur77的抑制水平的柱状图。第14天及第28天,靶向Nur77的siRNA1、siRNA2和siRNA3显著抑制了组织内Nur77基因mRNA表达,正常组和NC siRNA组无显著差异。其中*P<0.05。
图6是显示体内实验检测本发明siRNA1、siRNA2和siRNA3处理14天后对移植静脉内膜厚度的影响的柱状图。siRNA1、siRNA2和siRNA3组内膜厚度低于其它各组,正常组和阴性对照NC siRNA组无显著差异。其中*P<0.05。
图7是显示体内实验检测本发明siRNA1、siRNA2和siRNA3处理28天后对移植静脉内膜厚度的影响的柱状图。siRNA1、siRNA2和siRNA3组内膜厚度均小于其它各组,正常组和阴性对照NC siRNA组无显著差异。其中*P<0.05。
具体实施方式
对本发明进行详细描述。应理解,下述实施例仅用于阐明本发明,并非是对本发明进行限制。
为方便起见,在下文中,术语“RNA”、“RNA序列”、“RNA分子”、“双链RNA”、“双链RNA分子”或“dsRNA”可以互换,它们表示的意思和范围相同。
其中,RNA是正义链和反义链退火形成的双链结构。
为了制备能够特异性靶向孤儿核受体Nur77基因、从而抑制其表达的siRNA分子,发明人设计了从一系列siRNA序列,经过筛选和碱基修饰,得到如下三组不同的siRNA:
第一组siRNA分子,为双链分子,由如下序列的正义链和反义链组成:
正义链:5’-GGUGAAGGAAGUUGUCCGANn-3’(SEQ ID NO:1),
反义链:5’-UCGGACAACUUCCUUCACCNn-3’(SEQ ID NO:2)。
其中,正义链和反义链中的N相同或者不同,并且各自独立地是胞嘧啶C、尿嘧啶U、鸟嘌呤G、腺嘌呤A、脱氧胞嘧啶dC、脱氧鸟嘌呤dG、脱氧腺嘌呤dA或脱氧胸腺嘧啶dT;n代表N的个数,n是0、1或2。
上述双链RNA分子的主干序列为:
正义链:5’-GGUGAAGGAAGUUGUCCGA-3’(SEQ ID NO:3),
反义链:5’-UCGGACAACUUCCUUCACC-3’(SEQ ID NO:4)。
当N为dT、n为2时,上述双链RNA分子抑制Nur77基因效果突出,命名为siRNA1,即
正义链:5’-GGUGAAGGAAGUUGUCCGAdTdT-3’(SEQ ID NO:5),
反义链:5’-UCGGACAACUUCCUUCACCdTdT-3’(SEQ ID NO:6)。
第二组siRNA分子,为双链分子,由如下序列的正义链和反义链组成:
正义链:5’-GGGUGGAGGAGCUGCAGAANn-3’(SEQ ID NO:7),
反义链:5’-UUCUGCAGCUCCUCCACCCNn-3’(SEQ ID NO:8)。
其中,正义链和反义链中的N相同或者不同,并且各自独立地是胞嘧啶C、尿嘧啶U、鸟嘌呤G、腺嘌呤A、脱氧胞嘧啶dC、脱氧鸟嘌呤dG、脱氧腺嘌呤dA或脱氧胸腺嘧啶dT;n代表N的个数,n是0、1或2。
上述双链RNA分子的主干序列为:
正义链:5’-GGGUGGAGGAGCUGCAGAA-3’(SEQ ID NO:9),
反义链:5’-UUCUGCAGCUCCUCCACCC-3’(SEQ ID NO:10)。
当N为dT、n为2时,上述双链RNA分子抑制Nur77基因效果突出,命名为siRNA2,即
正义链:5’-GGGUGGAGGAGCUGCAGAAdTdT-3’(SEQ ID NO:11),
反义链:5’-UUCUGCAGCUCCUCCACCCdTdT-3’(SEQ ID NO:12)。
第三组siRNA分子,为双链分子,由如下序列的正义链和反义链组成:
正义链:5’-GCUCAGGCCUGGUGCUACANn-3’(SEQ ID NO:13),
反义链:5’-UGUAGCACCAGGCCUGAGCNn-3’(SEQ ID NO:14)。
其中,正义链和反义链中的N相同或者不同,并且各自独立地是胞嘧啶C、尿嘧啶U、鸟嘌呤G、腺嘌呤A、脱氧胞嘧啶dC、脱氧鸟嘌呤dG、脱氧腺嘌呤dA或脱氧胸腺嘧啶dT;n代表N的个数,n是0、1或2。
上述双链RNA分子的主干序列为:
正义链:5’-GCUCAGGCCUGGUGCUACA-3’(SEQ ID NO:15),
反义链:5’-UGUAGCACCAGGCCUGAGC-3’(SEQ ID NO:16)。
当N为dT、n为2时,上述双链RNA分子抑制Nur77基因效果突出,命名为siRNA3,即
正义链:5’-GCUCAGGCCUGGUGCUACAdTdT-3’(SEQ ID NO:17),
反义链:5’-UGUAGCACCAGGCCUGAGCdTdT-3’(SEQ ID NO:18)。
RNA的制备可采用多种方法,比如:化学合成法、体外转录、酶切长链dsRNA、载体表达RNA、PCR合成RNA表达元件等,这些方法的出现为研究者提供了可选择的空间,可以更好地获得基因沉默效率。
本发明的RNA分子可以作为用于抑制血管再狭窄的药物的有效成分,尤其是作为抗移植血管再狭窄药物的有效成分。
出于应用目的,可将RNA分子作为药物直接给药于受药者身上特定部位,比如移植血管处。
本发明的药物的剂型可以为多种形式,只要适合于相应疾病的给药、并且恰当地保持RNA分子的活性。比如,对于注射用给药系统,剂型可以是冻干粉。该药物也可以是凝胶剂。
任选地,上述药物剂型中可以包含任何药学上可接受的载体及佐剂,只要其适合于相应的给药体系、并且恰当地保持RNA分子的活性。
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
下述实施例仅用于阐明本发明,并非是对本发明进行限制。
实施例
本文中的siRNA和PCR引物由百奥迈科生物技术有限公司合成。
实施例1
1.细胞培养
人主动脉平滑肌细胞HA-VSMC(南通大学附属医院保藏)在含10%FBS的DMEM/F12培养基(美国Thermo Fisher Scientific公司)中,于37℃、5%CO2培养箱(美国Thermo Fisher Scientific公司)中培养。
2.siRNA设计与合成
设计并合成靶向Nur77基因的siRNA序列,分别为:siRNA1,具有正义链SEQ ID NO:5和反义链SEQ ID NO:6;siRNA2,具有正义链SEQ ID NO:11和反义链SEQ ID NO:12;siRNA3,具有正义链SEQ ID NO:17和反义链SEQ ID NO:18。分别将正义链和对应的反义链退火成siRNA双链,转染前配置成浓度为20μM。
另外,设计并合成了与人基因不同源的siRNA作为阴性对照的NC siRNA(Negetive control siRNA),其序列为:
正义链:5’-UUCUCCGAACGUGUCACGUdTdT-3’(SEQ ID NO:19);
反义链:5’-ACGUGACACGUUCGGAGAAdTdT-3’(SEQ ID NO:20)。
3.siRNA转染细胞
细胞铺板并转染:将步骤1所得细胞按1×105/孔接种到96孔细胞培养板中,在无抗生素、含10%FBS的DMEM/F12培养基中,于37℃、5%CO2培养箱中培养过夜。用细胞转染试剂2000(美国Thermo Fisher Scientific公司),按其说明书进行siRNA转染。
4.细胞RNA的提取
细胞转染48h后,收集细胞,用RNA提取试剂Trizol(美国Thermo Fisher Scientific公司)提取RNA,按其说明书进行RNA提取,所得RNA沉淀用50μL无RNase水溶解,并取2μL进行1.5%琼脂糖凝胶电泳检测。结果表明,提纯的细胞总RNA的纯度和完整性较好,符合实验要求。
5.实时定量PCR
用基因特异性引物检测样本中Nur77基因mRNA的表达水平,同时扩增看家基因β-actin作为内参对照。每个样本同时扩增Nur77基因和内参基因β-actin,每个反应做3个平行。用2×Master Mix(美国Thermo Fisher Scientific公司)进行定量反应,建立如下反应体系:2μL RNA模板,12.5μL的2×Master Mix,上游引物(10μM)和下游引物(10μM)各0.5μL,0.5μL的50×SYBR Green Solution,用无RNase的水补足体系至25μL。混合均匀后,置实时定量PCR检测系统反应。
检测Nur77基因的实时定量PCR引物:
上游引物为:5’-TGGACGGCTACACAGGAGAG-3’(SEQ ID NO:21);
下游引物为:5’-CGAGGAGGAGGCTGAGGAG-3’(SEQ ID NO:22)。
检测看家基因β-actin的实时定量PCR引物:
上游引物为:5’-TTGCCGACAGGATGCAGAAGGA-3’(SEQ ID NO:23);
下游引物为:5’-AGGTGGACAGCGAGGCCAGGAT-3’(SEQ ID NO:24)。
反应条件:42℃反转录30min,95℃预变性5min,95℃变性20sec,58℃退火30sec,72℃延伸30sec,循环45次。并做溶解曲线反应:95℃/5min,58℃/5min,以0.5℃/5sec升温至95℃。
用2-ΔΔCt法分析实验结果,并作柱状图,如图1所示,靶向Nur77的siRNA1、siRNA2、siRNA3均显著抑制了其mRNA表达水平,正常组和NC siRNA组无显著差异。
实施例2
蛋白印迹检测基因蛋白表达水平
按实施例1的方法进行细胞培养和siRNA转染。
将细胞按1×106个/孔铺到6孔板中,24h后生长至70-80%的汇合度,细胞分成5组,分别为siRNA1处理组、siRNA2处理组、siRNA3处理组、阴性对照组、正常组。
处理48h后,用预冷的1×SDS buffer(50mM Tris-HCl,pH7.6;1%SDS;150mM NaCl;0.5%Triton-X 100;5mM EDTA;5%β-mercaptoethanol(BME);1mM PMSF)蛋白裂解液裂解细胞,置于4℃中,10,000rpm离心20min,取上清稀释后进行聚丙烯酰胺凝胶电泳,并转膜到聚偏氟乙烯(polyvinylidinedifluoride filter,PVDF)膜上(美国Millipore公司),并用5%脱脂牛奶室温进行封闭2h,然后用兔抗人Nur77单克隆抗体(美国Abcam公司,1:500稀释),鼠抗人β-actin单克隆抗体(美国Abcam公司,1:500稀释)作为内参。TBST洗涤后,再用辣根过氧化物酶(horseradish peroxidase,HRP)偶联的二抗孵育(Nur77用羊抗兔IgG-HRP,1:1000稀释;β-actin用羊抗鼠IgG-HRP,1:2000稀释),用TBST洗涤3次(5min/次)。用BeyoECL Plus试剂盒(碧云天公司)检测。
如图2和图3所示,靶向Nur77的siRNA1、siRNA2、siRNA3均显著抑制了Nur77蛋白质表达水平(P<0.05),正常组和NC siRNA组无显著差异。
实施例3
细胞增殖检测
按实施例1的方法进行细胞培养和siRNA转染。
转染前待细胞汇合度达到60-80%时,将对数生长期的细胞铺到96孔细胞培养板中,重复3个孔,作为未转染的样本(即转染0h的样本)。
分别取转染24h、48h、72h和96h后的各实验组的细胞进行CCK8细胞增殖测定,所述测定方法为:将混合的100μL DMEM(美国Gibco公司)和10μL CCK8(Cell Counting Kit-8,日本Dojingo公司)加入到每个孔中,培养箱孵育4h,在波长490nm处用酶标仪(Bio-Rad公司)测定OD值,制作生长曲线。
如图4所示,靶向Nur77的siRNA1、siRNA2、siRNA3均显著抑制了细胞生长,正常组和NC siRNA组无显著差异。
实施例4
体内实验验证:大鼠颈外静脉-颈总动脉移植模型
1.动物模型建立
1)SD大鼠用10%水合氯醛按0.3mL/100g体重腹腔注射麻醉,固定,腹腔注射青霉素1.6万单位(Unit,U)。
2)平颈部剪去表面毛发,碘伏、酒精擦拭两遍消毒。
3)取左侧颈部胸锁乳突肌前切口,长约4cm,切开皮肤及皮下组织,钝性分离颌下腺以及胸锁乳突肌、胸骨舌骨肌,并游离出内外静脉及颈内静脉。
4)结扎颈外静脉小分支,上下两端结扎后取1cm静脉,浸泡于20U/ml浓度肝素钠溶液中备用。
5)拉钩牵开左侧胸锁乳突肌,显露颈动脉鞘,游离同侧颈总动脉约2cm。
6)无创血管夹夹闭颈总动脉近段和远端,切除与颈外静脉相应长度血管。
7)采用11-0血管缝合线以显微外科技术,将切取得到的颈外静脉倒置,端端吻合于颈总动脉近心端和远心端。
8)移植物不能扭曲。注意吻合血管壁全层,全程间断缝合,每个吻合口各六针,若吻合口出血可轻压止血,效果不佳时可在出血出酌情补针,每个吻合口最多八针。
9)松开血管夹,观察移植静脉充盈以及随动脉血流搏动情况,动脉远心端搏动良好证明吻合口通畅。
10)关闭缝合颈部切口,结束手术。
2.实验分组
25只SD大鼠按每组5只随机分为5组:
1)正常组:仅静脉移植,移植成功后不做其它处理。
2)阴性对照siRNA(NC siRNA)处理组:移植静脉外膜涂抹包含50μg NC siRNA的凝胶200μL。
3)Nur77 siRNA1处理组:移植静脉外膜涂抹溶解50μg Nur77 siRNA1的凝胶200μL。
4)Nur77 siRNA2处理组:移植静脉外膜涂抹溶解50μg Nur77 siRNA2的凝胶200μL。
5)Nur77 siRNA3处理组:移植静脉外膜涂抹溶解50μg Nur77 siRNA3的凝胶200μL。
上述凝胶均为25%的Pluronic F-127凝胶(美国Sigma公司),凝胶在4℃条件下用0.9%NaCl溶液溶解。
3.实验取材
1)术后分别于第二周、第四周切取标本,第14天为早期移植静脉、第28天为晚期移植静脉。
2)同模型建立时,SD大鼠用水合氯醛腹腔注射麻醉,固定,切开皮肤。
3)分离颈总动脉,游离出移植静脉,各组在切断取材前确认通畅,心脏放血后处死,切取标本。
4)取部分标本,放入生理盐水中剥离干净后,用10%的中性福尔马林固定液固定。
5)取部分标本,PBS冲洗后置于EP管中,-70℃冰冻保存,即刻Western blot检测组织中Nur77蛋白的表达情况。
6)取部分标本,提取RNA后用实时定量PCR检测血管组织中Nur77mRNA的表达情况(方法同实施例1)。
检测大鼠模型中Nur77基因的实时定量PCR引物:
上游引物为:5’-TGCCCCGCTTTGGAAAG-3’(SEQ ID NO:25);
下游引物为:5’-CCAGAGAGCAAGTCATAAAATTGC-3’(SEQ ID NO:26)。
检测看家基因β-actin的实时定量PCR引物:
上游引物为:5’-GGGAAATCGTGCGTGACATT-3’(SEQ ID NO:27);
下游引物为:5’-GCGGCAGTGGCCATCTC-3’(SEQ ID NO:28)。
反应条件:42℃反转录30min,95℃预变性5min,95℃变性20sec,58℃退火30sec,72℃延伸30sec,循环45次。并做溶解曲线反应:95℃/5min,58℃/5min,以0.5℃/5sec升温至95℃。
用2-ΔΔCt法分析实验结果,并作柱状图,如图5所示,第14天及第28天,靶向Nur77的siRNA1、siRNA2、siRNA3均显著抑制了组织内Nur77基因mRNA表达(P<0.05),正常组和NC siRNA组无显著差异。
实施例5
Nur77siRNA对移植静脉内膜厚度的影响
对于实施例4中所取的静脉移植物,将其进行甲醛固定,石蜡包埋后切片(4μm厚),进行标准流程的HE染色:石蜡切片经二甲苯脱去切片中的石蜡,再经由高浓度到低浓度乙醇,最后入蒸馏水。将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟。盐酸及氨水中分色,各数秒钟。流水冲洗1h后入蒸馏水片刻。入70%和90%乙醇中脱水各10min。入乙醇伊红染色液染色2-3min。染色后的切片经纯乙醇脱水,再经二甲苯使切片透明,中性树胶封片。在光学显微镜下观察染色结果,测量各组内膜/中膜膜厚度。
如图6和图7显示,第14天及第28天,Nur77siRNA组内膜厚度均低于其它各组(P<0.05),正常组和NC siRNA组无显著差异。
- 还没有人留言评论。精彩留言会获得点赞!