特异性靶向骨肉瘤细胞的适配子及其制备方法和应用与流程
本发明涉及生物技术领域,具体涉及一种特异性靶向骨肉瘤细胞的适配子及其制备方法和应用。
背景技术:
骨肉瘤是骨恶性肿瘤中最多见的一种,是从间质细胞系发展而来,肿瘤迅速生长是由于肿瘤经软骨阶段直接或间接形成肿瘤骨样组织和骨组织。骨肉瘤病理确诊后需要即刻进行放化治疗,截肢手术则作为传统切除肿瘤组织的重要方法。该方式对病情起到了较好的控制效果,但对患者的身心伤害较大,严重影响术后生存质量。虽然通过新辅助化疗结合手术治疗,其预后有较大改善,5年生存率由20世纪70年代末的10%左右上升到如今的60%左右,但近30多年间,骨肉瘤经手术治疗3年后有30-40%的复发率,尽管进行了多种努力,一直未能取得较大进展。
而肿瘤靶向治疗由于其良好的靶向性以及抗肿瘤活性已成为当今肿瘤研究领域的热点,其中靶向分子和毒性药物偶联物则是靶向药物研究的前沿。
适配子出现十多年来,已应用于酶联寡核苷酸实验、流式细胞仪、适配子芯片(aptamer chip)、蛋白定量及蛋白纯化等体外实验,同时具有可在体内抑制生长因子和受体的相互作用或抑制酶活性等功能,还可进行体内成像等。适配子可以作为诊断和治疗试剂,用于诊断时可识别与结合特定靶分子,用于治疗疾病时可作为靶向输送、功能阻断物质或者直接阻断疾病进程。
设计靶向药物和毒性药物偶联物,首先要做的是选择一个合适的靶向 分子。靶向肿瘤细胞表面特异性蛋白的核酸适配子具有良好的水溶性和显著的肿瘤靶向性,相对于抗体而言,具有化学稳定性高、免疫原性和毒性低、分子量小易于进入细胞、易于合成和修饰等特点。
SELEX(systematic evolution of ligands by exponential enrichment)技术是九十年代发展起来的一种新的体外筛选技术,它运用大容量的随机寡核苷酸文库,并结合体外PCR扩增技术,以指数富集与靶分子特异结合的寡核苷酸,经过多轮筛选,获得高亲合力、特异性强的寡核苷酸适配子(aptamers),已成功运用于许多靶分子的筛选,包括金属离子、有机染料、蛋白质、药物、氨基酸以及各种细胞因子等,甚至可用于完整的细胞、病毒、孢子和朊病毒等。陈孜等人介绍了SELEX筛选骨肉瘤HER2适配体方法的建立(西安交通大学学报)2014年05期),该方法以HER2蛋白作为靶标进行了适配子筛选,但HER2蛋白不仅仅在骨肉瘤高表达,同时也在其他肿瘤细胞中高表达。
目前,寻找新的特异性靶向骨肉瘤细胞的适配子本领域技术人员研究的重点。
技术实现要素:
针对以上技术情况,本发明提供一种仅以骨肉瘤细胞作为靶标的,特异性针对骨肉瘤细胞的靶向适配子,从而在可以治疗应用中实现更好治疗效果。具体地,本发明提供一种能够靶向骨肉瘤的适配子及其制备方法和应用,本发明适配子不仅可以用于诊断骨肉瘤疾病,还可以与已知具有治疗骨肉瘤的药物特异性地结合,将该药物靶向骨肉瘤细胞从而实现对骨肉瘤疾病的靶向治疗。
本发明所述适配子具有SEQ ID NO.1、SEQ ID NO.2或SEQ ID NO.3所示的核苷酸序列:
本发明通过以骨肉瘤细胞为靶的指数富集配体系统进化技术筛选得到的适配子是一种单链的寡核苷酸序列,可以特异性地与靶细胞结合。
本发明适配子作为靶向配体应用在药物的细胞靶向递送过程中,本发明适配子与抗骨肉瘤药物结合后可以特异性靶向骨肉瘤细胞,为提高治疗效果,并为降低肝脏毒性提供了解决途径。
本发明提供一种特异性靶向骨肉瘤细胞的适配子的筛选、制备、分离方法,本发明所述方法包括:
1)适配子的筛选
准备上述随机ssDNA文库、FITC标记的正向引物和Biotin标记的反向引物;
选择大鼠成骨细胞为靶细胞,大鼠肝细胞系和外周血单核细胞为非靶细胞,采用无酶的细胞消化液处理生长良好的细胞,接种于培养皿中,过夜培养,当细胞长至95%时即可用于文库筛选;
将靶细胞消化,并与随机文库用孵育缓冲液孵育;
孵育结束后将细胞离心,加入双蒸水,收集上清液,上清液中含有第一轮筛选与靶细胞结合的单链DNA,用于PCR扩增,制备下一轮筛选亚文库;
PCR产物dsDNA经浓缩管浓缩后,与链亲合素-磁珠进行孵育,加入碱性溶液进行碱变性,使得Biotin-ssDNA与链亲合素结合后固定在磁珠上,游离的FITC-ssDNA亚文库则被分离出来;然后取上清液,加入酸溶液进行中和;
将上述FITC-ssDNA亚文库进行高分辨率的琼脂糖电泳,再次分离FITC-ssDNA及其中的污染序列(dsDNA);
溴化乙锭染色10分钟,紫外灯下切取FITC-ssDNA的目标条带,通过小分子量DNA纯化回收试剂盒进行回收;
2)适配子的富集
仅在第一轮筛选中对靶细胞进行孵育,从第二轮开始,正筛以后引入 非靶细胞负筛过程;最后离心收集上清液,弃去与非靶细胞结合的序列,重复上述过程5-20个循环;
3)适配子的测序:
将最后富集到的文库PCR扩增成双链DNA,使用克隆试剂盒进行克隆,经蓝白斑筛选,挑选克隆进行测序;根据测序结果使用RNA structure软件和DNAMAN软件进行一级序列和二级结构的分析,即得。
作为本发明实施方案之一,所述方法步骤1)中的孵育缓冲液可以本领域常用的适于本发明的各种缓冲溶液,本发明优选为含有1.0mM MgCl2,0.1mg/ml酵母tRNA和0.1mg/ml鲑鱼精DNA的磷酸缓冲溶液;
作为本发明实施方案之一,所述方法步骤1)中PCR的反应条件可以有本领域技术人员结合本发明和本领域技术人员进行确定,作为实施方案之一,本发明优选PCR反应条件为:94度预变性3min,94度变性30s,56度退火30s,72度延伸30s,最后72度延伸5min。
作为本发明实施方案之一,所述方法步骤1)中的碱溶液可以选用本领域常用的碱性溶液,本发明包括但不限于碱溶液为200mM的NaOH溶液;
作为本发明实施方案之一,所述方法步骤1)中的酸溶液可以选用本领域常用的酸性溶液,本发明包括但不限于酸溶液为100mM盐酸。
作为本发明实施方案之一,所述方法步骤1)中的电泳条件为:琼脂糖电泳,电压设定为180V,电泳时间为40分钟。
作为本发明实施方案之一,所述特异性靶向骨肉瘤细胞的适配子的制备方法进一步包括:
1)适配子的筛选
准备上述随机ssDNA文库、FITC标记的正向引物和Biotin标记的反向引物;
选择大鼠成骨细胞ROS17/2.8(ATCC)为靶细胞,大鼠肝细胞系BRL-3A(ATCC)和外周血单核细胞为非靶细胞,采用无酶的细胞消化液处理生长良好的细胞,按照5×106接种于培养皿中,过夜培养,当细胞长至95%时即可用于文库筛选;
将靶细胞消化下来,与随机文库在37度条件下孵育1小时,孵育缓冲 液为含有1.0mM MgCl2,0.1mg/ml酵母tRNA和0.1mg/ml鲑鱼精DNA的PBS;
孵育结束后将细胞离心下来,加入双蒸水,100度水浴加热10分钟,收集上清液,上清液中含有第一轮筛选与靶细胞结合的单链DNA,用于PCR扩增,制备下一轮筛选亚文库;
PCR反应条件为:94度预变性3min,94度变性30s,56度退火30s,72度延伸30s,最后72度延伸5min;
PCR产物dsDNA经浓缩管浓缩后,与链亲合素-磁珠在37度孵育1小时,加入200mM NaOH溶液进行碱变性7分钟,打破dsDNA之间的氢键,使得Biotin-ssDNA与链亲合素结合后固定在磁珠上,游离的FITC-ssDNA亚文库则被分离出来;取上清液,加入适量100mM盐酸溶液进行中和;
将上述FITC-ssDNA亚文库进行高分辨率的琼脂糖电泳,电压设定为180V,电泳时间为40分钟,再次分离FITC-ssDNA及其中的污染序列;
溴化乙锭染色10分钟,紫外灯下切取FITC-ssDNA的目标条带,通过小分子量DNA纯化回收试剂盒进行回收;
2)适配子的富集
为了减少ssDNA文库的损失,第一轮筛选中仅对靶细胞进行孵育;从第二轮开始,正筛以后引入非靶细胞负筛过程;正筛孵育过程与上述一致,负筛过程中,37度环境下孵育1小时以后,离心收集上清液,弃去与非靶细胞结合的序列;
重复上述过程5-20个循环,为了获得较高亲和力和特异性的适配子,随着筛选轮数的增加,逐渐增加洗涤力度,洗涤次数也从3次增加到5次,洗涤时间从3分钟增加到5分钟。
筛选过程中每隔几个循环使用流式细胞仪对富集情况进行分析;将靶细胞和非靶细胞消化下来,用富集文库与其进行37度孵育1小时,PBS洗三次后,加入400ul PBS重悬细胞,流式细胞仪分析荧光强度;待荧光强度达到一定程度时,终止筛选;
3)适配子的测序:
将最后富集到的文库PCR扩增成双链DNA,使用克隆试剂盒进行克隆, 经蓝白斑筛选,挑选多个克隆并进行测序,然后使用RNA structure软件和DNAMAN软件进行一级序列和二级结构的分析;根据分析结果进行截断和鉴定,即得一级序列为:
作为实施方案之一,本发明提供一种所述适配子用于制备识别骨肉瘤细胞的生物探针的应用;
作为实施方案之一,本发明提供一种所述适配子作为特异性靶向骨肉瘤细胞的药物的载体的应用,其中可以以本发明所述适配子作为特异性靶向骨肉瘤细胞的载体的药物包括但不限于雷公藤甲素。
本发明所述适配子能够特异性靶向骨肉瘤细胞并对肝细胞及外周血细胞不亲和。
本发明实验中,以SEQ ID NO.3(以下简称“LC6”)的适配子作为雷公藤甲素(以下简称“TP”)特异性靶向骨肉瘤细胞的载体的示例进行了相关的实验,LC6适配子成功实现了TP特异性靶向骨肉瘤细胞,提高了抗骨肉瘤的活性,并降低了肝脏毒性。
附图说明
图1:骨肉瘤适配子的筛选;
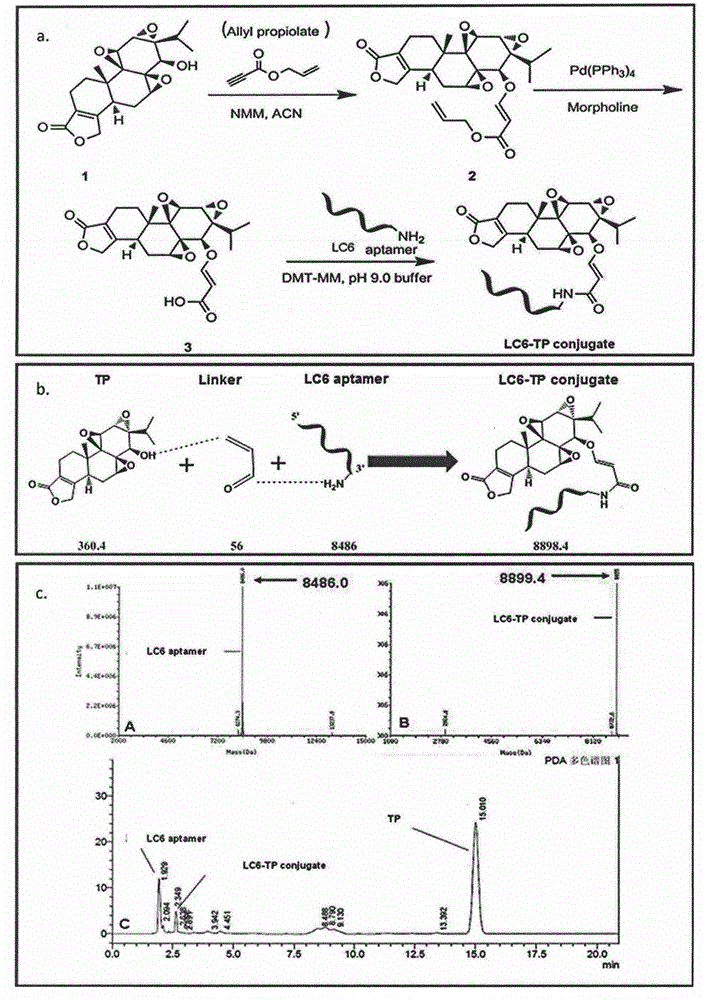
图2a:LC6-TP偶联物的化学合成流程图;
图2b:TP、Linker、LC6和LC6-TP偶联物的理论分子量;
图2c:LC6和LC6-TP偶联物的质谱分析;
图3a:LC6-TP偶联物在血浆和不同pH的PBS中的稳定性;
图3b:LC6-TP偶联物与OS细胞、正常成骨细胞和肝脏细胞的结合能力;
图3c:MTT测试不同浓度LC6-TP偶联物和Dox对OS细胞的生存能力的影响。
具体实施方式
以下实施例仅用于进一步阐述本发明,但不以任何的方式限制本发明的有效范围。
实施例1适配子的筛选、制备
1.实验材料:
1.1 ssDNA文库、FITC标记的正向引物和Biotin标记的反向引物:ssDNA文库:
5’-ATCCAGAGTGACGCAGCA-55nt-TGGACACGGTGGCTTAGT-3’
5’引物:5’-FITC-ATCCAGAGTGACGCAGCA-3’;
3’引物:5’-biotin-ACTAAGCCACCGTGTCCA-3’;均由上海生工生物工程公司提供。
1.2大鼠成骨细胞:ROS17/2.8,购自中科院细胞库,培养液为10%胎牛血清的DMEM培养基。
1.3大鼠肝细胞:BRL-3A,购自中科院细胞库,培养液为10%胎牛血清的DMEM培养基。
大鼠外周血细胞:PBMCs,直接从大鼠外周血中分离。
1.4培养液:DMEM培养基和胎牛血清购自Gbico公司
1.5流式细胞仪:购自BD Immunocytometry Systems
1.6 CH倒置光学显微镜:购自日本奥林巴斯公司
1.7 PCR试剂盒(货号:R011)、DNA Marker(20bp DNA ladder(Dye plus),货号:3420A)和琼脂糖凝胶(Agarose MS-6,货号:D615)购自大连Takara公司
1.8小分子量DNA纯化回收试剂盒(货号:ZP205)购自Beijing Zoman Biotechnology,Co.,LTD
1.9链亲合素的磁珠(货号:Z5482)购自Promega公司
1.10噻唑蓝(MTT,货号:M2128)购自Sigma公司
1.11 PCR仪购自美国Perkin Elmer公司。
1.12紫外凝胶成像系统购自Rio-Rad公司。
1.13浓缩管(Amicon Ultra-15 centrifugal Filter-10k)购自Merck Milipore公司。
2.实验方法:
2.1适配子的筛选
准备上述随机ssDNA文库、FITC标记的正向引物和Biotin标记的反向引物。
选择大鼠成骨细胞ROS17/2.8(ATCC)为靶细胞,大鼠肝细胞系BRL-3A(ATCC)和外周血单核细胞为非靶细胞,采用无酶的细胞消化液处理生长良好的细胞,按照5×106接种于培养皿中,过夜培养,当细胞长至95%时即可用于文库筛选。
将靶细胞消化下来,与随机文库在37度条件下孵育1小时,孵育缓冲液为含有1.0mM MgCl2,0.1mg/ml酵母tRNA和0.1mg/ml鲑鱼精DNA的磷酸缓冲溶液(PBS)。
孵育结束后将细胞离心下来,加入双蒸水,100度水浴加热10分钟,收集上清液,上清液中含有第一轮筛选与靶细胞结合的单链DNA,用于PCR扩增,制备下一轮筛选亚文库。
PCR反应条件为:94度预变性3min,94度变性30s,56度退火30s,72度延伸30s,最后72度延伸5min。
PCR产物dsDNA经浓缩管(Amicon Ultra-15 centrifugal Filter-10k)浓缩后,与链亲合素-磁珠(Z5482,Promega)在37度孵育1小时,加入200mM NaOH溶液进行碱变性7分钟,打破dsDNA之间的氢键,使得Biotin-ssDNA与链亲合素结合后固定在磁珠上,游离的FITC-ssDNA亚文库则被分离出来。取上清液,加入适量100mM盐酸溶液进行中和。
将上述FITC-ssDNA亚文库进行高分辨率的琼脂糖电泳(D615,Takara),电压设定为180V,电泳时间为40分钟,再次分离FITC-ssDNA及其中的污染序列(dsDNA)。
溴化乙锭染色10分钟,紫外灯下切取FITC-ssDNA的目标条带,通过小分子量DNA纯化回收试剂盒(ZP205,Beijing Zoman Biotechnology,Co.,LTD)进行回收。
2.2适配子的富集
为了减少ssDNA文库的损失,第一轮筛选中仅对靶细胞进行孵育。从第二轮开始,正筛以后引入非靶细胞负筛过程。正筛孵育过程与上述一致,负筛过程中,37度环境下孵育1小时以后,离心收集上清液,弃去与非靶细胞结合的序列。
重复上述过程5-20个循环,为了获得较高亲和力和特异性的适配子,随着筛选轮数的增加,逐渐增加洗涤力度,洗涤次数也从3次增加到5次,洗涤时间从3分钟增加到5分钟。
筛选过程中每隔几个循环使用流式细胞仪对富集情况进行分析。将靶细胞和非靶细胞消化下来,用富集文库与其进行37度孵育1小时。PBS洗三次后,加入400ul PBS重悬细胞,流式细胞仪分析荧光强度。待荧光强度达到一定程度时,终止筛选。
2.3适配子的测序:
将最后富集到的文库PCR扩增成双链DNA,使用克隆试剂盒(Invitrogen,cat.no.K4500-01)进行克隆,经蓝白斑筛选,随机挑选多个克隆进行测序。
根据测序结果使用RNA structure软件和DNAMAN软件进行一级序列和二级结构的分析。根据分析结果进行截断和鉴定。最后挑选出三条候选适配子,一级序列为:
2.4 HPLC分析
将细胞裂解,取0.2mL细胞裂解液,加入50ul I.S.(2ug/ml),和1.2mL乙酸乙酯溶液,震荡后离心5分钟。取有机溶液1mL水浴干燥,0.1mL甲醇复溶,4度离心10分钟。取上清液(10ul)进样分析。
色谱条件:Zorbax Extend-C18色谱柱(Agilent Technologies,U.S.A.),ODS预柱(Security Guard,U.S.A.),柱温30度,流动相为甲醇/乙腈/水(15/20/65,v/v/v%),流速1.0ml/min,检测波长218nm。
实验例1适配子、雷公甲素-适配子耦合物的靶向骨肉瘤细胞的实验
1.1适配子的靶向骨肉瘤细胞的实验
1.1.1实验方法
取本发明实施例1制备的适配子LC4、LC5、LC6,浓度为200nM,与骨肉瘤细胞、肝脏细胞和外周血单核细胞于37度环境下孵育1小时以后,流失细胞仪检测荧光强度,细胞数为20,000。
1.1.2实验结果
本发明所述LC4、LC5、LC6的适配子流失细胞仪数据显示所述三条序列都可以特异性结合大鼠骨肉瘤细胞,同时与大鼠肝细胞和外周血单核细胞没有明显结合(图1)。
1.2 LC6-雷公藤甲素(以下简称“LC6-TP”)靶向骨肉瘤实验
1.2.1 LC6-雷公藤甲素(以下简称“LC6-TP”)的制备
LC6-TP制备方法按照图2a所示的方法进行制备,且TP、Linker、LC6和LC6-TP偶联物的理论分子量如图2b所示;(c)LC6和LC6-TP偶联物的质谱分析如图2c所示。
1.2.2实验方法及结果
LC6-TP偶联物的pH敏感性:为了检测LC6-TP偶联物在体外的pH敏感性,LC6-TP偶联物分别与血浆(pH 7.4)和不同pH值的磷酸缓冲溶液(PBS)孵育,HPLC分析不同时间点游离TP单体在血浆和PBS中的含量。 结果显示,在孵育的过程中,血浆中没有检测到明显的游离TP单体。然而,在不通pH的PBS中,随着孵育时间的延长,越来越多的TP可以被检测到。而且,在同一时间点,随着pH值的降低,TP的含量逐渐增加(如图3所示)
LC6-TP偶联物的体外细胞选择性实验
为了研究LC6-TP偶联物的体外细胞选择性,Cy3荧光标记的LC6-TP偶联物和阴性对照CRO-TP偶联物(CRO为非特异核酸序列,作为LC6的对照)分别与骨肉瘤细胞、正常成骨细胞和肝脏细胞孵育,流式细胞仪分析荧光强度。结果显示在骨肉瘤细胞中,LC6-TP的荧光强度明显高于正常成骨细胞和肝脏细胞中的荧光强度。而CRO-TP偶联物在三种细胞中均没有明显荧光(图3)。
LC6-TP偶联物的体外抗肿瘤活性实验
为了检验LC6-TP偶联物的体外抗肿瘤活性,化疗药物抵抗的骨肉瘤细胞分别与Dox和LC6-TP偶联物孵育,MTT测试分析细胞生存能力。结果显示,与Dox和LC6-TP偶联物孵育的成骨细胞生存能力随着浓度增加而下降。而且,在相同浓度,LC6-TP偶联物可以更有效杀死骨肉瘤细胞。LC6-TP偶联物的IC50比Dox低大约100倍。该结果表明LC6-TP偶联物的抗肿瘤能力明显强于Dox(图3)。
1.2.3实验结论
实验结果显示本发明适配子及其与雷公藤甲素耦联物均能够成功地靶向骨肉瘤细胞,而且LC6-TP偶联物在生理pH条件下维持稳定而在骨肉瘤酸性环境下发生断裂,从而释放TP。在相同浓度下、LC6-TP偶联物可以更有效杀死骨肉瘤细胞。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺