一组特异性识别H1N1、H3N2型甲型流感病毒的寡核苷酸适配体的序列和应用的制作方法
本发明属于分子生物医学技术领域,具体涉及特异识别甲型流感病毒H1N1型和H3N2型的寡核苷酸配基A8、A20与其所有截短后的序列和修饰,以及修饰后的序列在识别甲型流感病毒H1N1型和H3N2型方面的应用。本发明涉及A8、A20与其所有截短序列在生物医药方面的应用。A8、A20与其所有截短序列作为试剂盒的组成部分或者检测指标,用于感染甲流病毒患者或者的辅助诊断和甲型流感病毒H1N1,H3N2型的检测。A8、A20与其所有截短序列结合纳米金技术作为H1N1、H3N2型甲型流感快速可视化检测方法及检测试剂盒。
背景技术:
指数富集的配基系统进化技术,简称SELEX(Systematic Evolution of Ligands by EXponential Enrichment)技术,是近十几年兴起并迅速得到发展的高通量生物文库筛选技术。应用大容量的随机寡核苷酸文库(ssDNA文库和RNA文库),结合PCR体外扩增技术,以指数级富集与靶分子特异结合的寡核苷酸,经过反复的体外筛选、扩增,最终获得的寡核苷酸配基(aptamer)基于空间结构与靶分子呈高特异性和高亲和力的结合。由于aptamer具有精确识别、无免疫原性、易体外合成与修饰等优点,又称为“人工替代抗体”,在基础医学、临床诊断与新药研发等方面具有广阔的应用前景。尤其是近年来兴起的复合靶SELEX技术,使得对未知靶分子进行筛选成为可能,并且通过引入消减筛选步骤,能够获得特异识别两组复合靶子中差异存在分子的aptamer,并能利用该配基反过来对差异靶分子进行研究,这就为开发新型分子探针以及鉴定生物标志物,尤其是肿瘤标志物分子开辟了新的途径。
流感病毒根据其核蛋白的抗原性可以分为三类:甲乙丙,或ABC型。H1N1、 H3N2型甲流病毒为比较常见的人类感染的流感病毒,分别曾经在西班牙与香港造成流感疫情爆发。甲型流感病毒表面的糖蛋白∶血凝素(HA)和神经氨酸酶(NA)常发生抗原漂移以及抗原装换,使流感疫苗的作用失效,从而再次引发流感疫情的爆发。因此,研究能够区分甲型病毒的适配体,可以为甲型流感病毒的检测和治疗提供帮助。
本发明是通过SELEX技术获得了寡核苷酸配基A8、A20。经鉴定,两条序列都能够特异识别H1N1,H3N2型甲流病毒,而不结合其他相关病毒,对照核酸序列与上述病毒均无结合。在此基础上将其截短,发现截短序列A8S、A8S8、A8SSS、A20S和A20S8序列和A8、A20特性一致,并且结合力更高。
通过结合胶体金技术,实现了对于检测H1N1、H3N2型的快速可视化检测。此标记方法,使得寡核苷酸配基标记胶体金具有速度更快,检测靶标耗时更短的优势。在一分钟内即可实现对H1N1、H3N2型甲流病毒的有效检测。
技术实现要素:
本发明的目的在于提供寡核苷酸A8、A20以及其所有截短序列作为H1N1、H3N2型甲流病毒的特异性适配体,并作为检测H1N1、H3N2型甲流病毒的分子标志物。
本发明的目的还在于提供一种非诊断目的H1N1、H3N2型甲流病毒检测方法(ELISA法)。还包括A8、A20以及其所有截短序列作为试剂盒的组成部分或者检测指标用于适配体结合胶体金对H1N1、H3N2型甲流病毒的快速可视化检测。
寡核苷酸序列A8、A20以及其截短序列A8S、A8S8、A8SSS、A20S和A20S8序列如序列表中SEQ ID No.1,SEQ ID No.2,SEQ ID No.3,SEQ ID No.4,SEQ ID No.5,SEQ ID No.6,SEQ ID No.7所示。
附图说明
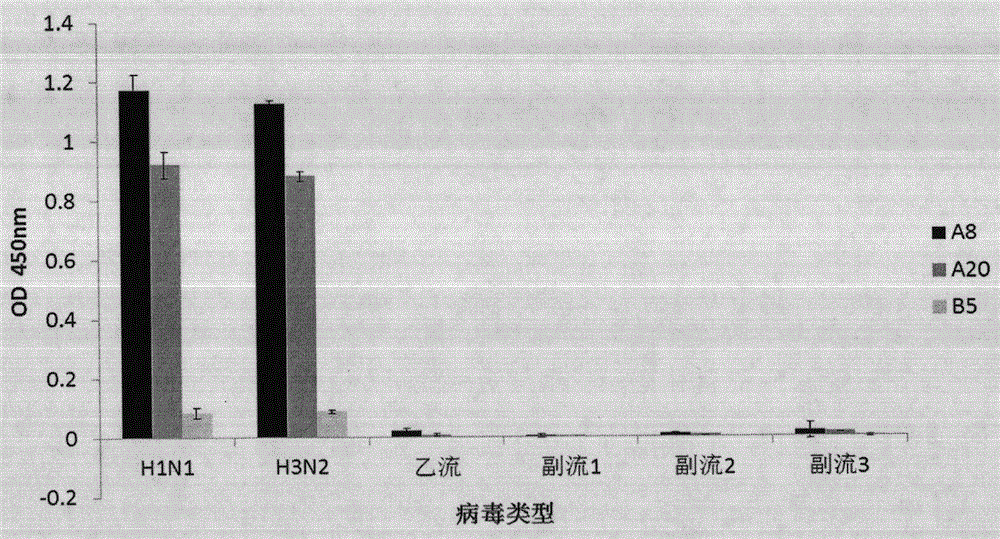
图1是经过SELEX筛选后得到的A8、A20寡核苷酸序列与H1N1、H3N2型甲流病毒,以及乙流、副流感123型的结合力对比图。
图2是寡核苷酸序列A8、A20以及其截短序列A8S、A8S8、A20S和A20S8序列与H1N1、H3N2型甲流病毒的结合力对比结果。
图3是寡核苷酸序列A8、A20以及其截短序列A8S8、A20S和A20S8序列与H1N1、H3N2型甲流病毒的KD值测定曲线结果。
图4是结合胶体金快速可视化检测H1N1、H3N2型甲流病毒的结果。
具体实施方式
下面结合附图和具体实施例对本发明做进一步说明。
以下实施例未说明的实验步骤参照《分子克隆实验指南》第三版。
实施例1 A8、A20寡核苷酸序列与H1N1、H3N2型甲流病毒,以及乙流、副流感123型的结合力对比
(1)合成生物素标记的Bio-A8、Bio-A20序列。
(2)将流感病毒分别混合于pH 9.7的碳酸盐缓冲液中,按照100μl/孔加入到酶联条中,4℃包被过夜。
(3)弃包被液,每孔加入100μl的封闭液,37℃温箱封闭30min。
(4)将Bio-A8、Bio-A20序列溶解于孵育缓冲液中(1×PBS-5mmolMgCl2),于100℃变性5min后立即置于冰上充分冷却。
(5)经过变性处理后的序列加入酶联条中,使核酸序列与包被的病毒共同孵育37℃,30min。
(6)弃去孔内液体,每孔用200μl的洗涤液洗涤,重复洗涤5次,最后一次洗涤后要把孔内液体完全吸干。
(7)每孔加入100μl按照1∶300稀释好的HRP酶,37℃孵育30min,弃去孔内液体,洗板5次,方法同上。
(8)每孔加入100μl TMB显色底物,37℃避光显色,当有明显颜色变化时,加100μl终止液,酶联仪OD450nm波长读数。
截短序列的结合力对比以及KD值的计算实施方法与此法相同。
图1结果显示,A8、A20序列与H1N1、H3N2型甲流病毒有特异性结合,并且与乙流,副流感1、2、3型无结合。(B5序列为阴性对照)
图2结果显示,A8序列的截短序列A8S、A8S8和A20序列的截短序列A20S、A20S8均与H1N1、H3N2型甲流病毒有特异性结合。(B5序列为阴性对照)
图3结果显示,不同寡核苷酸序列的投入与H1N1、H3N2型甲流病毒的结合力关系图,经计算得到A8序列与H1N1、H3N2型甲流病毒结合的平衡解离常数KD值,约为23.98±6.387nmol/L、21.08±5.112nmol/L;A8S8与H1N1、H3N2型甲流病毒结合的平衡解离常数KD值,约为4.746±2.860nmol/L、11.34±7.686nmol/L;A20序列与H1N1、H3N2型甲流病毒结合的平衡解离常数KD值,约为42.44±15.36nmol/L、30.65±11.32nmol/L;A20S与H1N1、H3N2型甲流病毒结合的平衡解离常数KD值,约为5.559±4.141nmol/L、5.838±3.937nmol/L;A20S8与H1N1、H3N2型甲流病毒结合的平衡解离常数KD值,约为7.657±3.397nmol/L、6.175±3.018nmol/L。
实施例2 结合胶体金快速可视化检测H1N1、H3N2甲流病毒
(1)将25μL胶体金溶液与75μL水溶液混合,调到适合的pH。
(2)将截短的寡核苷酸序列A8SSS变性处理,随后加入到胶体金溶液中进行标记。
(3)加入靶标H1N1、H3N2型甲流病毒以及H7N9,乙流和无关蛋白。
(4)孵育1min中后,加入显色剂,肉眼对比颜色变化即可得到检测结果。图4结果显示,A为对照孔,B为H1N1型甲流病毒孔,C为H3N2型甲流病毒孔,D为H7N9型甲流病毒孔,E为乙流病毒孔,F为无关蛋白孔。寡核苷酸序列标记的胶体金溶液能够有效检测出H1N1、H3N2型甲流病毒,而对其他靶标无交叉反应。
- 还没有人留言评论。精彩留言会获得点赞!