一种新的天花粉融合蛋白及其应用的制作方法
本发明涉及生物医药领域,更具体地,涉及一种新的天花粉融合蛋白。
背景技术:
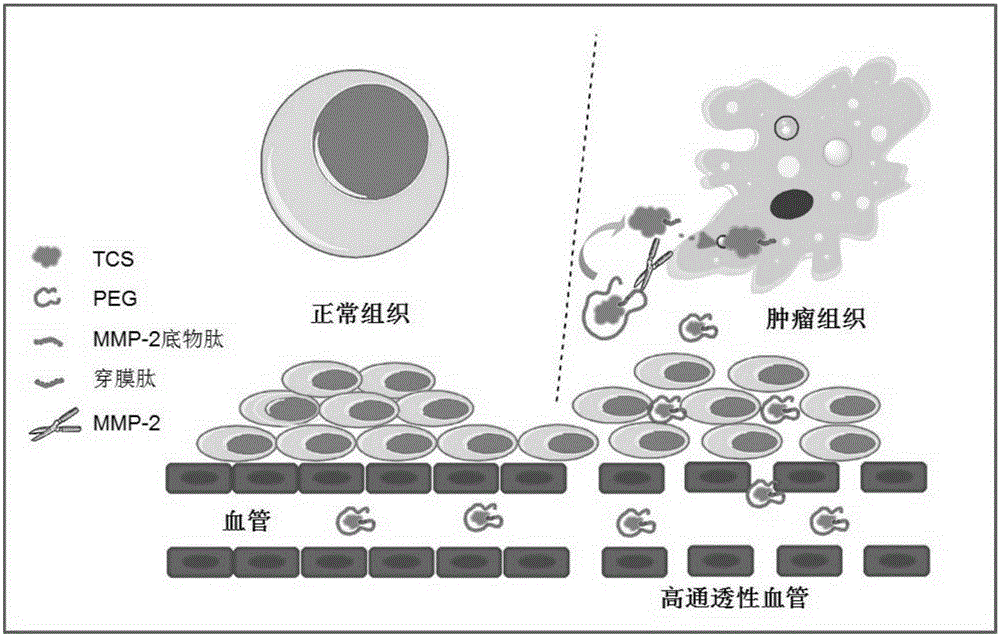
:恶性肿瘤是人类生命安全的最大威胁之一。据世界卫生组织报道,癌症的发病率逐年升高,并且呈现年轻化趋势。目前针对恶性肿瘤的治疗手段,仍然以手术切除结合化疗与放疗为主。小分子化疗药物由于易产生耐药性,且毒副作用巨大,故无法有效杀伤肿瘤细胞,同时给病人带来极大的痛苦。随着生物技术的发展,生物大分子药物,尤其是蛋白类药物,由于其生物活性强、生物相容性好而受到越来越多的关注。蛋白药物已经成为21世纪新药研发最前沿的方向之一。天花粉蛋白(TCS)是从葫芦科植物栝蒌的根——天花粉中提取到的一种蛋白质,在传统中医中被用作终止中期妊娠的引产药已有几个世纪的历史。TCS是分子量为27kDa的I型核糖体失活蛋白,它具有N-糖苷酶活性,能够识别哺乳动物细胞的核糖体大亚基并使其脱嘌呤,从而抑制细胞的蛋白质合成,导致细胞死亡。同时,也有研究表明,TCS能够通过多种途径诱导细胞凋亡。正是由于TCS的这些生物活性,它被证实具有广谱的抗肿瘤活性。然而,TCS在体内不具备肿瘤靶向性,同时缺乏一定的入胞能力,另外,据报道,TCS还有较强的免疫原性。这些都成为了制约TCS作为抗肿瘤药物的临床应用。目前,化学修饰成为了改善天花粉蛋白成药性的重要方法。对蛋白药物的传统化学修饰位点主要局限于蛋白中赖氨酸残基的侧链氨基,以及通过基因工程的手段引入的半胱氨酸的侧链巯基。这两种修饰方法的缺点明显。前者由于蛋白中赖氨酸残基较多,会导致修饰产物不均一,增加了修饰产物分离纯化的难度和成本。而后者虽然能够实现蛋白质的定点修饰,但是由于游离巯基的不稳定性,蛋白药物在制备及纯化的过程中易导致巯基的氧化,形成分子间二聚体。因此,本领域迫切需要开发一种新型的蛋白质修饰方法来实现蛋白药物的 高效、专一、定点修饰,从而获得低毒、高效的具有肿瘤抑制活性的天花粉蛋白。技术实现要素:本发明的目的是提供一种新的天花粉融合蛋白,具体地,为肿瘤靶向性的基于重组天花粉蛋白的给药系统。在本发明的第一方面,提供了一种融合蛋白,所述的融合蛋白具有式Ia或式Ib所示的结构:A-L1-B-L2-C式Ia或B-L1-A-L2-C式Ib其中,A为天花粉蛋白元件,B为穿膜元件,C为基质金属蛋白酶2底物肽元件,L1、L2各自为无或连接肽元件,“-”为连接各元件的肽键,且所述的融合蛋白具有肿瘤抑制活性。在另一优选例中,所述融合蛋白的氨基酸序列如SEQIDNO.:3所示。在另一优选例中,所述的天花粉蛋白元件包括野生型或突变型天花粉蛋白,优选地,所述的天花粉蛋白包括其蛋白全长或其片段。在另一优选例中,所述的天花粉蛋白不含Cys。在另一优选例中,所述的野生型天花粉蛋白的氨基酸序列如SEQIDNO.:1所示,编码其的多核苷酸如SEQIDNO.:2所示。在另一优选例中,所述的穿膜元件包括如SEQIDNO.:5-7所示的任一多肽(VSRRRRRRGGRRRR、YGRKKRRGGQRRR、RRRRRRRR)。在另一优选例中,所述基质金属蛋白酶2底物肽元件包括如SEQIDNO.:8-9所示的任一多肽(PLGLAG、PLGVR)。在另一优选例中,所述的连接肽元件包括0-10个相同或不同的氨基酸残基,优选为3-5个。在另一优选例中,所述的连接肽元件为3个Gly。在另一优选例中,所述的肿瘤包括实体肿瘤,较佳地,为基质金属蛋白酶2MMP-2阳性肿瘤。在另一优选例中,所述的肿瘤包括纤维肉瘤、脑胶质瘤、或肝癌肿瘤。本发明第二方面,提供了本发明第一方面所述融合蛋白的前体蛋白,其特征在于,所述的前体蛋白具有式IIa或式IIb所示的结构:A-L1-B-L2-C-D-E式IIa或B-L1-A-L2-C-D-E式IIb;其中,A为天花粉蛋白元件,B为穿膜元件,C为基质金属蛋白酶2(MMP-2)底物肽元件,D为无或1-3个Cys,E为内含肽元件,L1、L2各自为无或连接肽元件,“-”为连接各元件的肽键,所述前体蛋白经含巯基试剂切割后产生本发明第一方面所述的融合蛋白。在另一优选例中,所述的内含肽元件还在其C端含有标签序列。在另一优选例中,所述的标签序列包括几丁质结合域(CBD)标签序列、6His标签序列、GST标签序列、或MBP标签序列。在另一优选例中,所述含巯基的试剂包括L-半胱氨酸、DTT、巯基乙醇或2-巯基乙烷磺酸钠。本发明第三方面,提供了一种多核苷酸序列,所述的多核苷酸序列编码本发明第一方面所述的融合蛋白或编码本发明第二方面所述的前体蛋白。在另一优选例中,所述的多核苷酸序列如SEQIDNO.:4所示。本发明第四方面,提供了一种载体,所述的载体含有本发明第三方面所述的多核苷酸。本发明第五方面,提供了一种宿主细胞,所述的宿主细胞含有本发明第四方面所述的载体或所述的宿主细胞的基因中整合由本发明第二方面所述的多核苷酸。本发明第六方面,提供了本发明第一方面所述融合蛋白的修饰物,所述的 修饰物由本发明第一方面所述的融合蛋白经定点PEG化而形成融合蛋白修饰物。在另一优选例中,所述的定点PEG化为在所述融合蛋白的C端进行PEG修饰。在另一优选例中,所述融合蛋白修饰物含有分子量为3-40KD,优选5KD的PEG。本发明第七方面,提供了本发明第一方面所述融合蛋白或本发明第六方面所述修饰物的用途,用于制备治疗肿瘤的药物组合物。本发明第八方面,提供了一种药物组合物,所述的药物组合物含有本发明第一方面所述的融合蛋白或本发明第六方面所述修饰物,和药学上可接受的载体。本发明第九方面,提供了一种生产本发明第一方面所述的融合蛋白或其前体蛋白的方法,包括步骤:(i)在合适的条件下,培养本发明第五方面所述的宿主细胞,从而获得表达所述的融合蛋白或其前体蛋白。在另一优选例中,所述的方法还可包括步骤:(ii)对获得的融合蛋白或其前体蛋白进行分离和纯化。在另一优选例中,所述的分离和纯化包括直接采用内含肽介导的分离和纯化。本发明第十方面,提供了一种体外非治疗性抑制肿瘤细胞的方法,包括步骤:向肿瘤细胞培养物中加入本发明第一方面所述的融合蛋白、本发明第六方面所述修饰物或本发明第八方面所述的药物组合物,从而抑制肿瘤细胞。本发明第十一方面,提供了一种治疗肿瘤的方法,包括步骤:向所需要的对象施用安全有量的本发明第一方面所述的融合蛋白、本发明第六方面所述修饰物或本发明第八方面所述的药物组合物,从而治疗肿瘤。在另一优选例中,所述所需要的对象为哺乳动物,包括小鼠、大鼠、或人,优选为人。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为根据本发明制备实施例1和制备实施例2中由内含肽介导的TCS-穿膜肽和TCS-穿膜肽-MMP-2底物肽-PEG连接物的合成路线图。图2为根据本发明的TCS-穿膜肽-MMP-2底物肽-PEG连接物的抗肿瘤机理图。图3为根据本发明制备实施例1中内含肽介导的重组TCS蛋白的原核表达与纯化电泳图。图4为根据本发明制备实施例2中内含肽介导的重组TCS-穿膜肽-MMP-2底物肽融合蛋白的原核表达与纯化电泳图。图5为根据本发明制备实施例1中内含肽介导的TCS-穿膜肽连接物的合成电泳图。图6为根据本发明制备实施例1中TCS-穿膜肽连接物的纯化色谱图。图7为根据本发明制备实施例2中内含肽介导的TCS-穿膜肽-MMP-2底物肽-PEG连接物的合成电泳图。图8为根据本发明制备实施例2中TCS-穿膜肽-MMP-2底物肽-PEG连接物的纯化色谱图。图9为根据本发明制备实施例1和制备实施例2中制备所得纯化后的TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物的电泳图。图10为根据本发明实验实施例1中的HT1080与HUVEC细胞及其培养基中MMP-2酶含量检测的WesternBlot图。图11为根据本发明实验实施例2中的TCS-穿膜肽-MMP-2底物肽-PEG连接物被MMP-2酶切前后的电泳图。图12为根据本发明实验实施例3中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物对MMP-2酶高表达的肿瘤细胞HT1080细胞增殖的抑制效果。图13为根据本发明实验实施例3中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物对MMP-2酶低表达的正常细胞HUVEC细胞增殖的抑制效果。图14为根据本发明实验实施例4中TCS-穿膜肽-MMP-2底物肽-PEG连接物在HT1080荷瘤裸鼠中肿瘤靶向性和组织分布的活体成像图。图15为根据本发明实验实施例5中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物对HT1080荷瘤裸鼠的肿瘤抑制情况。图16为根据本发明实验实施例5中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物治疗后的肿瘤照片。图17为根据本发明实验实施例5中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物给药过程中各组动物的生存率曲线图。图18为根据本发明实验实施例5中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物给药过程中各组动物的体重变化。图19为根据本发明实验实施例5中TCS、TCS-穿膜肽连接物和TCS-穿膜肽-MMP-2底物肽-PEG连接物治疗后各组动物脏器(肺、脾、肾)的病理切片。图20为根据本发明实验实施例6中TCS和TCS-穿膜肽-MMP-2底物肽-PEG连接物的免疫原性测定。具体实施方式本发明人经过广泛而深入的研究,首次意外地制备获得了一种新的融合蛋白,该融合蛋白将入胞性能较差的天花粉蛋白进行了修饰,在融合了穿膜蛋白以及基质金属蛋白酶底物结构域,并利用内含肽介导的自剪切,获得了较易PEG化并非常有助于入胞的高特异性低免疫原型肿瘤抑制性天花粉融合蛋白。本发明不仅提供了一种新的介导天花粉蛋白入胞的方法,更为传统中药老药新用开辟了新的思路。在此基础上,完成了本发明。融合蛋白及其制备在本发明中,“重组融合蛋白”、“本发明蛋白”、“本发明融合蛋白”、“融合蛋白”可互换使用,指具有式Ia或式Ib所述结构,即含有包括天花粉蛋白元件、穿膜元件、和基质金属蛋白酶2底物肽元件的融合蛋白。本发明蛋白可以是单体或由单体形成的多聚体(如二聚体)。此外,应理解,所述术语还包括融合蛋白的活性片段和衍生物。本发明还包括根据本发明融合蛋白的活性片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持人天花粉蛋白肿瘤抑制功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或几个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的 多肽,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)融合蛋白与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6His等标签序列融合而形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。一类优选的活性衍生物指与式Ia或式Ib的氨基酸序列相比,有至多3个,较佳地至多2个,更佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生,优选地,所述的衍生物不含有Cys。表1最初的残基代表性的取代优选的取代Ala(A)Val;Leu;IleValArg(R)Lys;Gln;AsnLysAsn(N)Gln;His;Lys;ArgGlnAsp(D)GluGluCys(C)SerSerGln(Q)AsnAsnGlu(E)AspAspGly(G)Pro;AlaAlaHis(H)Asn;Gln;Lys;ArgArgIle(I)Leu;Val;Met;Ala;PheLeuLeu(L)Ile;Val;Met;Ala;PheIleLys(K)Arg;Gln;AsnArgMet(M)Leu;Phe;IleLeuPhe(F)Leu;Val;Ile;Ala;TyrLeuPro(P)AlaAlaSer(S)ThrThrThr(T)SerSerTrp(W)Tyr;PheTyrTyr(Y)Trp;Phe;Thr;SerPheVal(V)Ile;Leu;Met;Phe;AlaLeu本发明还提供本发明融合蛋白的类似物。这些类似物与SEQIDNO:.3所示的多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然L-氨基酸的残基(如D-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性的多肽。修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。本发明多肽还可以以由药学上或生理学可接受的酸或碱衍生的盐形式使用。这些盐包括(但不限于)与如下酸形成的盐:氢氯酸、氢溴酸、硫酸、柠檬酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、琥珀酸、草酸、富马酸、马来酸、草酰乙酸、甲磺酸、乙磺酸、苯磺酸、或羟乙磺酸。其他盐包括:与碱金属或碱土金属(如钠、钾、钙或镁)形成的盐,以及以酯、氨基甲酸酯或其他常规的“前体药物”的形式。如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多核苷酸和多肽是没有分离纯化的,但同样的多核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。如本文所用,“分离的重组融合蛋白”是指重组融合蛋白基本上不含天然与其相关的其它蛋白、脂类、糖类或其它物质。本领域的技术人员能用标准的蛋白质纯化技术纯化重组融合蛋白。基本上纯的蛋白在非还原聚丙烯酰胺凝胶上能产生单一的主带。本发明的多核苷酸可以是DNA形式或RNA形式。DNA形式包括cDNA、基因组DNA或人工合成的DNA。DNA可以是单链的或是双链的。DNA可以是编码链或非编码链。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的蛋白质片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码多肽的功能。如本文所用,术语“引物”指的是在与模板配对,在DNA聚合酶的作用下能以其为起点进行合成与模板互补的DNA链的寡居核苷酸的总称。引物可以是 天然的RNA、DNA,也可以是任何形式的天然核苷酸。引物甚至可以是非天然的核苷酸如LNA或ZNA等。引物“大致上”(或“基本上”)与模板上一条链上的一个特殊的序列互补。引物必须与模板上的一条链充分互补才能开始延伸,但引物的序列不必与模板的序列完全互补。比如,在一个3'端与模板互补的引物的5'端加上一段与模板不互补的序列,这样的引物仍大致上与模板互补。只要有足够长的引物能与模板充分的结合,非完全互补的引物也可以与模板形成引物-模板复合物,从而进行扩增。本发明融合蛋白或其元件的核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据已公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。应用PCR技术扩增DNA/RNA的方法被优选用于获得本发明的基因。用于PCR的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的DNA/RNA片段。本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或融合蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述蛋白质的方法。通过常规的重组DNA技术,可利用本发明的多核苷酸序列可用来表达或生产重组蛋白。一般来说有以下步骤:(1).用本发明的编码本发明蛋白的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;(2).在合适的培养基中培养的宿主细胞;(3).从培养基或细胞中分离、纯化蛋白质。本领域的技术人员熟知的方法能用于构建含本发明蛋白的编码DNA序列和 合适的转录/翻译控制信号的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的DNA序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(GFP),或用于大肠杆菌的四环素或氨苄青霉素抗性。包含上述的适当DNA序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属的细菌细胞;真菌细胞如酵母;植物细胞;果蝇S2或Sf9的昆虫细胞;CHO、NS0、COS7、或293细胞的动物细胞等。用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl2法处理,所用的步骤在本领域众所周知。另一种方法是使用MgCl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。在上面的方法中的蛋白质可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(HPLC)和其它各种液相层析技术及这些方法的结合。本发明还提供了所述融合蛋白的前体蛋白,所述前体蛋白利用了内含肽介导的融合蛋白获得方式,在融合蛋白的基因构建物中加入了内含肽的编码基 因,并在表达蛋白后通过标签剪切,直接获得了高纯度的融合蛋白,从而无需进一步采用其它分离或纯化步骤。穿膜肽本发明提供的融合蛋白中,优选含有穿膜肽。天花粉蛋白TCS属于I型核糖体失活蛋白,只含具有N-糖苷酶活性的A链,比II型核糖体失活蛋白缺少介导入胞的凝集素样B链,因此,该类蛋白毒素入胞效率低下,抗肿瘤细胞毒性远不如II型核糖体失活蛋白。穿膜肽是从自然中发现或通过人工筛选得到的一类具有穿透细胞膜活性的多肽。可用于本发明的穿膜肽没有特殊限制,可以为任何富含碱性氨基酸的穿膜肽和具有两亲性的穿膜肽,只要可以促进细胞对本身缺乏入胞能力的TCS摄取。优选地,本发明的穿膜肽包括低分子量鱼精蛋白LMWP(VSRRRRRRGGRRRR(SEQIDNO.:5))、TAT(YGRKKRRQRRR(SEQIDNO.:6))、R8(RRRRRRRR(SEQIDNO.:7))本发明穿膜肽不仅能够自己入胞,还能携带本发明TCS进入细胞。此外,本发明穿膜肽可通过在表达融合蛋白的表达载体中导入穿膜肽的基因直接获得含穿膜肽的融合蛋白,或也可以通过内含肽介导而获得有穿膜肽修饰的方法,优选的方法包括:(a)将重组质粒转化大肠杆菌BL21(DE3)感受态细胞;(b)将含有重组质粒的菌株用LB培养基培养至对数生长期,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导目的蛋白表达;(c)离心收集菌体并超声破碎;(d)将含有C端融合内含肽intein与CBD标签的目的蛋白的上清液用几丁质柱亲和纯化,洗去杂蛋白后,用含有2-巯基乙烷磺酸纳(MESNA)的缓冲液进行柱上切割过夜,收集洗脱液;(e)超滤浓缩后,加入上述穿膜肽,反应过夜,形成TCS-穿膜肽连接物,其中蛋白与多肽的摩尔比为1:20;用脱盐柱除去溶液中多余的多肽,从步骤(e)中得到的TCS-穿膜肽连接物产率为90%-95%。内含肽内含肽(Intein)介导的蛋白质原核表达、纯化及修饰方法是一种新型的蛋白质定点修饰技术。Intein是一种具有自我剪切功能的多肽。在目的蛋白的C端融合intein序列以及几丁质结合域(CBD)亲和标签。该技术用大肠杆菌 原核表达系统进行外源蛋白的表达,在用几丁质柱对目的蛋白进行亲和纯化时,用含有巯基的试剂进行柱上切割,在intein的介导下,能将目的蛋白从intein上切下,同时在蛋白的C末端引入响应的活性基团,用于下游的蛋白修饰。可用于本发明的亲和标签没有特别限制,可以为任何适用于内含肽自剪切的亲和标签,例如6His等。此外,可用于本发明内含介导的自剪切切割试剂也没有特别限制,优选为含巯基的切割试剂。在一个优选实施例中,选择2-巯基乙烷磺酸钠进行切割,蛋白的末端会引入一个硫酯键,此时,蛋白能与N端为半胱氨酸的多肽进行高效的反应;而如果用L-半胱氨酸作为切割试剂,此时蛋白的末端会额外引入一个半胱氨酸,能够与马来酰亚胺为端基的PEG进行反应,从而实现对蛋白的定点PEG修饰。PEG定点修饰PEG修饰为将带有官能团的聚乙二醇用于蛋白质药物修饰,通常有随机修饰和定点修饰。本发明优选为PEG定点修饰,例如,将末端融合了内含肽和CBD标签的融合蛋白用几丁质亲和柱进行纯化,并用L-半胱氨酸对目的蛋白进行柱上切割。在内含肽的介导下,将目的蛋白从内含肽、CBD标签以及几丁质亲和柱上切下,同时在目的蛋白的C末端引入一个半胱氨酸残基。利用该半胱氨酸残基的侧链巯基,能够与末端马来酰亚胺的PEG进行反应,实现蛋白质C末端定点PEG化修饰。一种优选的PEG定点修饰的方法如下:(a)将重组质粒转化大肠杆菌BL21(DE3)感受态细胞;(b)将含有重组质粒的菌株用LB培养基培养至对数生长期,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导目的蛋白表达;(c)离心收集菌体并超声破碎;(d)将含有C端融合内含肽intein与CBD标签的目的蛋白的上清液用几丁质柱亲和纯化,洗去杂蛋白后,用含有L-半胱氨酸的缓冲液进行柱上切割过夜,收集洗脱液;(e)超滤浓缩并除去溶液中的游离半胱氨酸,加入马来酰亚胺-PEG(Mal-PEG),反应过夜,形成融合蛋白-PEG连接物,其中蛋白与Mal-PEG的 摩尔比为1:10;(f)用阳离子交换柱来分离纯化从步骤(e)中得到的融合蛋白-PEG连接物。连接肽本发明提供了一种融合蛋白,它可任选地含有连接肽(肽接头)。连接肽大小和复杂性可能会影响蛋白的活性。通常,连接肽应当具有足够的长度和柔韧性,以保证连接的两个蛋白在空间上有足够的自由度以发挥其功能。同时避免连接肽中形成α螺旋或β折叠等对融合蛋白的稳定性的影响。连接肽的长度一般为0-10个氨基酸,较佳地1-5个氨基酸。药物组合物及施用方法本发明还提供了一种组合物,它含有有效量的本发明的融合蛋白,以及药学上可接受的载体。通常,可将本发明的融合蛋白配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中pH通常约为5-8,较佳地,pH约为6-8。如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量,如0.001-99wt%;较佳的0.01-95wt%;更佳的,0.1-90wt%。如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。本发明的药物组合物含有安全有效量的本发明的融合蛋白以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。本发明融合蛋白的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:本发明融合蛋白的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、 患者的体重、患者的免疫状况、给药的途径等。针对肿瘤患者,通常,当本发明的融合蛋白每天以约0.5mg-5mg/kg动物体重(较佳的2mg-4mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。本发明有益效果本发明通过对野生天花粉蛋白的结构修饰和改造,获得了较易PEG化并非常有助于入胞的高特异性低免疫原型肿瘤抑制性天花粉融合蛋白。本发明不仅提供了一种新的介导天花粉蛋白入胞的方法,更为传统中药老药新用开辟了新的思路。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。试剂和药品原核表达载体pTXB1、几丁质亲和柱购自NEB。TCS与TCS-穿膜肽-MMP-2底物肽融合蛋白的重组表达质粒由上海捷瑞生物科技有限公司代为构建。酵母粉、蛋白胨购于Oas。氨苄青霉素(Amp)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购于Amresco。HEPES和噻唑蓝(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT),于Sigma-Aldrich购得。L-半胱氨酸、氯化钠(NaCl)、吐温20、EDTA购于国药集团(上海)化学试剂公司。马来酰亚胺聚乙二醇(Mal-PEG)购于北京键凯科技有限公司。2-巯基乙烷磺酸钠(MENSA)自百灵威科技集团购得。多肽购自上海丽昂化学有限公司。琥珀酰亚胺酯Cy5染料购于大连美仑生物科技有限公司。Bradford、BCA蛋白浓度测定试剂盒购自上海碧云天生物科技有限公司。人纤维肉瘤细胞(HT1080)和人脐静脉上皮细胞(HUVEC)购自中国科学院细胞库。DMEM细胞培养基干粉,胰蛋白酶(Trypsin),胎牛血清(FBS),双抗(penicillin-streptomycin) 分别从Gibco和Invitrogen购得。制备实施例1TCS-穿膜肽的合成重组TCS蛋白的原核表达和纯化a:将TCS重组表达质粒(TCS基因序列SEQIDNO.:2所示)转化大肠杆菌BL21(DE3)感受态细胞。b:将含有重组质粒的菌株用含有100μg/mlAmp的LB培养基,与37℃恒温摇床中250rpm培养至对数生长期(600nm吸光值为0.6-0.8),加入终浓度为1mM的IPTG,于25℃,150rpm表达过夜(14h)。c:用离心机6,000rpm,4℃离心20min收集菌体。d:用HEPES缓冲液(含20mMHEPES,150mMNaCl,1mMEDTA,0.5‰吐温20,pH8.5)将菌体重悬。e:用探头超声破碎仪以400W功率超声破碎细胞30min。f:12,000rpm,4℃离心20min,收集上清液。g:将含有目的蛋白的上清液过用HEPES缓冲液预平衡的几丁质柱,流速为1ml/min。上样完成后,用25倍柱体积的HEPES缓冲液洗去非特异性结合的杂蛋白。h:用3倍柱体积的含有50mMMESNA的HEPES缓冲液流经柱子,并保留少量缓冲液,关闭柱子出口,在柱上切割过夜(16h)。i:打开柱子出口,收集流出的含有目的蛋白的缓冲液,并继续加入3倍柱体积的HEPES缓冲液,继续将目的蛋白洗脱下来。TCS-穿膜肽的合成将收集到的蛋白洗脱液用截留分子量为10,000的超滤管进行浓缩,并用Bradford蛋白浓度测定试剂盒进行蛋白浓度测定。用HEPES缓冲液稀释至100μM,加入穿膜肽(CVSRRRRRRGGRRRR(C+SEQIDNO.:6))至终浓度为2mM,于4℃平板摇床中反应过夜(16h)。反应完成后用12%浓度的聚丙烯酰胺(SDS-PAGE)电泳检测反应效率,达到90%-95%(图5)。用脱盐柱除去溶液中多余的穿膜肽,得到TCS-穿膜肽连接物(图6)。制备实施例2PEG化TCS-穿膜肽-MMP-2底物肽的合成TCS-穿膜肽-MMP-2底物肽融合蛋白的表达和纯化a:将所述融合蛋白的重组表达质粒(SEQIDNO.:5)转化大肠杆菌BL21(DE3)感受态细胞。b:将含有重组质粒的菌株用含有100μg/mlAmp的LB培养基,与37℃恒温摇床中250rpm培养至对数生长期(600nm吸光值为0.6-0.8),加入终浓度为1mM的IPTG,于25℃,150rpm表达过夜(14h)。c:用离心机6,000rpm,4℃离心20min收集菌体。d:用HEPES缓冲液(含20mMHEPES,150mMNaCl,1mMEDTA,0.5‰吐温20,pH8.5)将菌体重悬。e:用探头超声破碎仪以400W功率超声破碎细胞30min。f:12,000rpm,4℃离心20min,收集上清液。g:将含有目的蛋白的上清液过用HEPES缓冲液预平衡的几丁质柱,流速为1ml/min。上样完成后,用25倍柱体积的HEPES缓冲液洗去非特异性结合的杂蛋白。h:用3倍柱体积的含有50mML-半胱氨酸的HEPES缓冲液流经柱子,并保留少量缓冲液,关闭柱子出口,在柱上切割过夜(16h)。i:打开柱子出口,收集流出的含有目的蛋白的缓冲液,并继续加入3倍柱体积的HEPES缓冲液,继续将目的蛋白洗脱下来。TCS-穿膜肽-MMP-2底物肽融合蛋白的PEG化修饰将收集到的蛋白洗脱液用截留分子量为10,000的超滤管进行浓缩,用脱盐柱除去溶液中游离的L-半胱氨酸,用BCA法测定蛋白浓度,以摩尔比1:10加入Mal-PEG,于4℃反应过夜(16h)。用12%浓度的SDS-PAGE电泳检测反应效率,达到80%-85%(图7)。用阳离子交换柱SPFF以及快速蛋白纯化色谱仪FPLC对反应产物进行分离纯化,将样品用进样器推入柱子中,用含有0.15-1M的NaCl的pH7.2磷酸盐缓冲液以0.02M/min的流速进行梯度洗脱,收集第一个洗脱峰,得到融合蛋白-PEG连接产物(图8)。实验实施例1HT1080与HUVEC细胞及其培养基中MMP-2酶含量测定用本领域常规的WesternBlot来检测HT1080与HUVEC细胞及其培养基中的MMP-2酶含量。具体方法如下:将对数生长期的HT1080和HUVEC细胞用胰酶消化后稀释成1.5×105个细胞/ml的细胞悬液,转移到Nunc的6孔细胞培养板中,每孔加入2ml细胞悬液,用含10%小牛血清的DMEM完全培养基培养 4h(37℃,5%CO2)。待细胞贴壁后,将培养基弃去,细胞用PBS洗两次,更换为无血清的DMEM培养基,每孔1ml,继续培养24h。收集培养基上清,并将细胞用细胞裂解液裂解30min,于4℃离心15min,收集上清,用BCA法测定蛋白浓度,用缓冲液稀释至相同浓度。在培养基与细胞裂解液样品中加入上样缓冲液于沸水中煮5min。用10%聚丙烯酰胺凝胶跑胶,并电转至0.45μmPVDF膜上,用5%脱脂奶粉封闭2小时。用封闭液配置1,000倍稀释的抗MMP-2兔抗(购自CellSignalingTechnology)以及20,000倍稀释的抗β-actin鼠抗(购自Sigma)4℃孵育过夜。将一抗洗涤三次后孵育相应种属来源的1,000倍稀释的二抗(购自碧云天生物技术有限公司),于室温孵育1小时。将二抗洗涤三次后,在膜上滴加ECL显色底物(购自ThermoPeirce),在多功能凝胶成像仪中成像(Biorad)。结果如下:从图10中可以看出,无论是HT1080细胞的细胞内还是细胞培养基中都相较于HUVEC细胞有着显著的MMP-2酶过表达。这说明HT1080细胞可以用作后续MMP-2酶敏感性实验的细胞模型。实验实施例2TCS-穿膜肽-MMP-2底物肽-PEG的体外酶切实验(1)酶切介质制备将对数生长期的HT1080细胞用胰酶消化后稀释成1.5×105个细胞/ml的细胞悬液,转移到Nunc的6孔细胞培养板中,每孔加入2ml细胞悬液,用含10%小牛血清的DMEM完全培养基培养4h(37℃,5%CO2)。待细胞贴壁后,将培养基弃去,细胞用PBS洗两次,更换为无血清的DMEM培养基,每孔1ml,继续培养24h。吸取培养基,以12,000rpm4℃离心10min除去细胞碎片,将上清用于体外酶切实验。(2)体外酶切实验将TCS-穿膜肽-MMP-2底物肽-PEG连接物用上述方法制备的酶切介质稀释至终浓度为0.1mg/ml,同时加入0.2‰的NaN3,于37℃恒温摇床内250rpm酶切48h。酶切效率用SDS-PAGE电泳检测。结果如图所示。酶切产物为30kDa左右的条带,比PEG修饰前的蛋白条带略小(图11)。实验实施例3MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴蓝,商品 名:噻唑蓝)法分别测定TCS,TCS-穿膜肽连接物,以及TCS-穿膜肽-MMP-2底物肽-PEG连接物的体外抗肿瘤效应将对数生长期的HT1080,HUVEC细胞分别消化后稀释成密度为l.5×104个细胞/mL的细胞悬液,转移到Nunc的96细胞培养孔板中,每孔加入200μL细胞悬液,用含10%小牛血清的DMEM完全培养基培养24h(37℃,5%CO2)。通过预实验确定最佳药物浓度范围,加入不同浓度的溶液,每个浓度做6个复孔。培养48小时,加入MTT(5mg/mL,购自美国Sigma-Aldrich公司)20μL,培养4h,加DMSO200μL,震荡使结晶物充分溶解混匀。用酶标仪(型号:51119300FI,Fisher)测定各组OD值,主波长为570nm,参考波长为490nm。计算各组的细胞增殖抑制率:增殖抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。结果如下:(1)TCS-穿膜肽对普通细胞HUVEC以及肿瘤细胞HT1080增殖率的影响:相对于TCS,TCS-穿膜肽对两种细胞的毒性都有明显的增加(图12、图13)。这应当是由于单独的TCS蛋白入胞能力有限,难以进入细胞发挥其毒性。而穿膜肽修饰后增加了TCS的入胞能力,说明穿膜肽能够携带TCS进入细胞,发挥其细胞毒作用。同时说明,穿膜肽能够携带TCS进入细胞的能力没有细胞选择性。(2)TCS-穿膜肽-MMP-2底物肽-PEG连接物对普通细胞HUVEC以及肿瘤细胞HT1080增值率的影响:在MMP-2高表达的肿瘤细胞HT1080中,该连接物相较于TCS细胞毒性明显增加,与TCS-穿膜肽连接物相当(图12);而在MMP-2低表达的普通细胞HUVEC中,相对于TCS-穿膜肽连接物明显较弱(图13)。这应当是由于HT1080分泌表达的MMP-2酶特异性切开了上述连接物中的PEG链,从而使穿膜肽暴露,进而介导TCS入胞,发挥其细胞毒性;而HUVEC缺乏MMP-2的表达,无法将PEG切下,导致PEG遮挡住了穿膜肽,使其丧失了入胞能力。这进一步证明了所述TCS-穿膜肽-MMP-2底物肽-PEG连接物的MMP-2肿瘤酶响应性。实验实施例4TCS-穿膜肽-MMP-2底物肽-PEG连接物的体内肿瘤靶向性及组织分布实验(1)TCS-穿膜肽-MMP-2底物肽-PEG连接物的Cy5荧光标记将NHS-Cy5以摩尔比3倍过量标记按制备实例2制备得到的TCS-穿膜肽-MMP-2底物肽-PEG连接物,4℃避光反应过夜。用脱盐柱除去多余的Cy5染料。(2)HT1080人源纤维肉瘤荷瘤裸鼠模型的建立将对数生长期的HT1080细胞经0.25%胰酶消化分散后,细胞计数调整浓度制备5×106个细胞/m1的细胞悬液。取体质量为18-22g的Balb/c裸鼠(购自上海斯莱科实验动物有限公司)4只,在裸鼠背部皮下注射细胞悬液100μl/只。观察HT1080细胞在Balb/c体内的生长和成瘤情况。(3)所述连接物的体内肿瘤靶向性及组织分布实验当肿瘤体积为400mm3左右时,将Cy5标记的连接物以尾静脉的方式注射,100μl/只。注射后的第1、2、4、8、12、24小时将裸鼠置于小动物活体成像仪中进行观察与拍照。注射24小时后,将动物脱臼处死,取出主要脏器(心、肝、脾、肺、肾)与肿瘤,在活体成像仪中观察与拍照。结果如下:从图14a中可以看出,TCS-穿膜肽-MMP-2底物肽-PEG连接物在尾静脉注射后能够迅速到达肿瘤部位,并在12小时内在肿瘤部位有明显蓄积。而24小时后,随着药物的代谢,肿瘤部位的蓄积明显下降。然而,从组织分布图(图14b)中可以看到,肿瘤部位仍有较多的药物蓄积,多余心脏和脾,而PEG化蛋白药物的主要代谢器官——肝脏和肾脏有着最多的药物分布。实验实施例5TCS、TCS-穿膜肽连接物以及TCS-穿膜肽-MMP-2底物肽-PEG连接物的体内抗肿瘤实验(1)HT1080人源纤维肉瘤荷瘤裸鼠模型的建立将对数生长期的HT1080细胞经0.25%胰酶消化分散后,细胞计数调整浓度制备5×106个细胞/m1的细胞悬液。取体质量为18-22g的Balb/c裸鼠(购自上海斯莱科实验动物有限公司)24只,在裸鼠背部皮下注射细胞悬液100μl/只。观察HT1080细胞在Balb/c体内的生长和成瘤情况。(2)荷瘤裸鼠的抗肿瘤效应当肿瘤体积为100mm3左右时将其随机分成4组:TCS组、TCS-穿膜肽组、TCS-穿膜肽-MMP-2底物肽-PEG组,以生理盐水组为阴性对照。各组均采用尾静脉注射方式给药,给药剂量为2.5mg/kg,每两天给药一次。给药期间每天监视裸鼠体重变化,并测定瘤的长径(L)、短径(S),计算肿瘤体积:V=L ×S2/2。给药18天后,将裸鼠脱臼处死,取下肿瘤,小心去除瘤表面的血迹及包膜,称重。图15为给药过程中的肿瘤体积增长图。从图中可以看到,相对于生理盐水组,TCS组对肿瘤的生长几乎没有抑制作用。而TCS-穿膜肽组与TCS-穿膜肽-MMP-2底物肽-PEG组都有较为显著的抑瘤效果。抑瘤效果为:TCS-穿膜肽-MMP-2底物肽-PEG组大于TCS-穿膜肽组大于TCS组。图16则直观地显示了给药完成后各组的肿瘤照片,从图中可以看出,注射生理盐水和TCS的小鼠肿瘤明显较大,而注射TCS-穿膜肽和TCS-穿膜肽-MMP-2底物肽-PEG的小鼠肿瘤有不同程度的明显减小。图17和图18为给药过程中各组别小鼠的生存曲线图以及小鼠的体重变化图。从图中可以看出,TCS组与TCS-穿膜肽组在给药过程中,小鼠的体重出现了不同程度的明显下降,并且在临近实验终点时出现了实验小鼠死亡的现象。而TCS-穿膜肽-MMP-2底物肽-PEG组的小鼠体重相对于生理盐水对照组并无明显下降,也没有出现动物死亡。这一定程度上反应了TCS与TCS-穿膜肽的全身毒性较大,而TCS-穿膜肽-MMP-2底物肽-PEG的毒性较低。图19为实验终点时将各组小鼠的脏器取出进行病理切片分析的结果。从图中可以看出,TCS与TCS-穿膜肽对小鼠的肺、脾和肾脏造成了一定的毒性,具体表现为:肺泡壁增厚,间质出血,上皮排列紊乱;脾脏滤泡结构被破坏,巨细胞增生;肾小球与肾曲管肿胀、畸形,包氏囊腔消失。而TCS-穿膜肽-MMP-2底物肽-PEG对各脏器的毒性则轻微许多。实验实施例6TCS、TCS-穿膜肽-MMP-2底物肽-PEG的免疫原性实验(1)小鼠免疫实验取体质量为18-22g的Balb/c小白鼠(购自上海斯莱科实验动物有限公司)10只,随机分为两组,TCS组与TCS-穿膜肽-MMP-2底物肽-PEG组。两组均采用皮下注射的给药方式进行免疫,注射剂量为10μg/只,每7天免疫一次,连续免疫三次。第一次免疫前与第三次免疫7天后分别以眼眶采血的方式采集血样,离心获得血清。(2)抗TCS小鼠IgG滴度测定用本领域常规的ELISA方法测定所收集血清样品中的抗TCS小鼠IgG滴度。具体方法如下:将TCS蛋白用包被缓冲液(50mM碳酸钠pH9.6)稀释成10μl/ml浓度的溶液,在96孔ELISA微孔板内每孔加入100μl上述溶液,将微孔板置于4℃放置过夜。每孔加入300μlPBST洗三次后,用含1%山羊封闭血清的PBST于37℃封闭1.5小时。将血清样品分别用含0.01%山羊封闭血清的PBST稀释1,000-1,000,000倍,在孔内加入100μl稀释后的血清样品,同时以免疫前的阴性血清为阴性对照,以鼠源抗TCSIgG抗体(购自SantaCruz公司)为阳性对照,以一抗稀释液为空白对照。在37℃孵育2小时。用PBST洗三次之后,每孔加入1,000倍稀释的HRP标记羊抗小鼠二抗100μl,于37℃孵育1小时。在用PBST洗三次后,每孔加入200μlTMB显色底物,于37℃反应15分钟,每孔加入50μl20%硫酸终止反应,用酶标仪(型号:51119300FI,Fisher)测定各组OD值,波长为450nm。绘制滴度曲线。结果如下:从图20中可以看出,未经修饰的TCS蛋白具有较强的免疫原性,而TCS-穿膜肽-MMP-2底物肽-PEG免疫原性相较于TCS有着明显的下降。这说明,PEG修饰后能够显著降低TCS的免疫原性,增加了其临床用药的安全性。综上所述,本发明的TCS-穿膜肽-MMP-2底物肽-PEG连接物能够通过EPR效应在肿瘤部位蓄积,具有较高的生物利用度。同时,它能够被肿瘤及其微环境高表达的MMP-2酶切激活,进而介导TCS入胞杀伤肿瘤细胞,具有显著的肿瘤靶向性以及肿瘤酶敏感性,对肿瘤细胞的体内体外都表现出明显的生长抑制作用。同时,本发明的TCS-穿膜肽-MMP-2底物肽-PEG连接物的毒性与免疫原性也显著降低。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1