抗肿瘤蛋白内皮抑素的衍生物及应用的制作方法
本发明涉及一种抗肿瘤蛋白内皮抑素的衍生物及应用,属于生物医药抗肿瘤药物领域。
背景技术:
肿瘤生长依赖血管的形成,而血管的形成又受到血管生长因子和抑制因子的调节,抑制肿瘤血管的生长是治疗肿瘤的有效方法。内皮抑素(Endostatin)具有抑制血管生成的功能,所以在肿瘤的抗新生血管治疗中受到了重视。内皮抑素是胶原蛋白XVIII的水解而产生的C端184个氨基酸片断,它能有效抑制多种不同种类肿瘤,生物学作用呈广谱性,也无耐药性,是迄今发现的最好的血管生成抑制因子(Exp Cell Res,312,594-607,2006)。
但是,在猴子实验和人的临床试验中发现内皮抑素的半衰期很短,呈现指数级降解,10小时前后内皮抑素的体内含量递减百倍甚至接近为零(Acta Pharmacol Sin,26,124-128,2005;J Clin Oncol,20,3792-3803,2002),表明它在动物体内很不稳定,这将大大影响内皮抑素的抗肿瘤治疗效果。
技术实现要素:
本发明的目的是克服现有技术中的不足,提供半衰期长、抗肿瘤生物活性高的抗肿瘤蛋白内皮抑素的衍生物。
本发明的第二个目的是提供抗肿瘤蛋白内皮抑素的衍生物在制备抗癌药物的应用。
本发明的第三个目的是提供编码上述内皮抑素的衍生物的DNA片断在制备抗肿瘤药物的应用。
一种抗肿瘤蛋白内皮抑素的衍生物,所述内皮抑素的氨基酸序列用SEQ.ID.NO4所示;所述衍生物包括:内皮抑素与抗体IgG不变区连接;或在内皮抑素的N端前面引入Arg;或在内皮抑素的N端前面、或C端后面、或N端前面和C端后面引入糖基化位点的氨基酸短肽;或内皮抑素的氨基酸序列的Arg62Arg63其中一个Arg发生点突变、或Arg128Arg129其中一个Arg发生点突变、或Arg62Arg63其中一个Arg发生点突变的同时Arg128Arg129其中一个Arg发生点突变。或内皮抑素与抗体IgG不变区连接,在内皮抑素的N端前面引入Arg,在内皮抑素的N端前面、或C端后面、或N端前面和C端后面引入糖基化位点的氨基酸短肽,内皮抑素的氨基酸序列的Arg62Arg63其中一个Arg发生点突变、或Arg128Arg129其中一个Arg发生点突变、或Arg62Arg63其中一个Arg发生点突变的同时Arg128Arg129其中一个Arg发生点突变。
IgG不变区为CH1、CH1CH2或CH1CH2CH3,所述内皮抑素与CH1连接的氨基酸序列为SEQ.ID.NO8;所述内皮抑素与CH1CH2连接的氨基酸序列为SEQ.ID.NO10;内皮抑素与CH1CH2CH3连接的氨基酸序列为SEQ.ID.NO12。
内皮抑素的N端前面引入Arg为在内皮抑素的N端前面连接一个短肽,所述短肽中含有一个以上的Arg。
糖基化位点为Asn-X-Ser或Asn-X-Thr,其中X为其它氨基酸。
Arg发生点突变为His。
抗肿瘤蛋白内皮抑素的衍生物的氨基酸序列最好是SEQ.ID.NO20所示。
编码权利要求6所述的抗肿瘤蛋白内皮抑素的衍生物的核酸序列是SEQ.ID.NO19所示。
上述抗肿瘤蛋白内皮抑素的衍生物在制备抗癌药物的应用。
编码上述抗肿瘤蛋白内皮抑素的衍生物的DNA片断在制备抗癌药物的应用。
本发明的优点
本发明的抗肿瘤蛋白内皮抑素衍生物在体内稳定,半衰期长、抗肿瘤生物活性高。
附图说明
图1是实施例1的前置序列-内皮抑素分别连接抗体IgG不变区CH1、不变区CH1CH2、不变区CH1CH2CH3所构建的融合蛋白的抗肿瘤活性的实验。图中1:生理盐水;2:前置序列-内皮抑素;3:前置序列-内皮抑素-抗体IgG部分不变区CH1融合蛋白;4:前置序列-内皮抑素-抗体IgG部分不变区CH1CH2融合蛋白;5:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白。
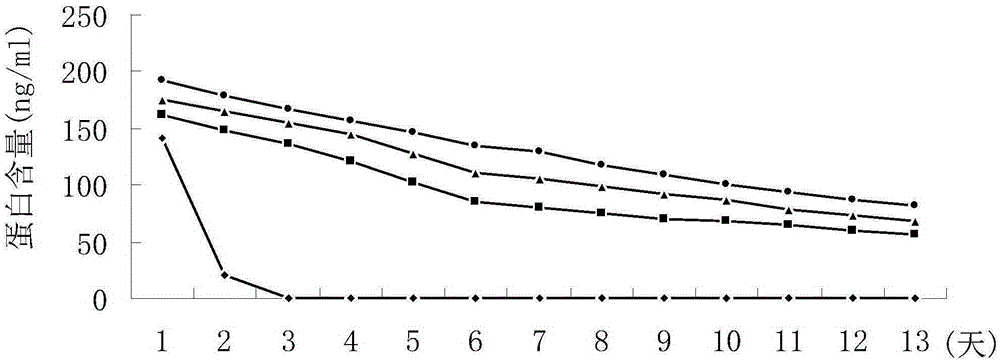
图2是实施例1的前置序列-内皮抑素分别连接抗体IgG不变区CH1、不变区CH1CH2、不变区CH1CH2CH3所构建的融合蛋白以及内皮抑素在小鼠体内半衰期的实验。图中样品(从上到下),●前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白;▲前置序列-内皮抑素-抗体IgG部分不变区CH1CH2融合蛋白;■前置序列-内皮抑素-抗体IgG部分不变区CH1融合蛋白;◆前置序列-内皮抑素
图3是实施例2的前置序列-内皮抑素-抗体IgG不变区融合蛋白中的内皮抑素N端前面短肽中的Arg的点突变的实验。图中:样品1:前置序列-内皮抑素-抗体IgG不变区融合蛋白;样品2:前置序列-内皮抑素-抗体IgG不变区融合蛋白N端的点突变体1;样品3:前置序列-内皮抑素-抗体IgG不变区融合蛋白N端的点突变体2;样品4:前置序列-内皮抑素-抗体IgG不变区融合蛋白N端的点突变体3;样品5:生理盐水(对照)。
图4是实施例3的引入糖基化位点短肽的前置序列-内皮抑素-抗体IgG不变区融合蛋白的抗肿瘤活性的实验。样品1:前置序列-内皮抑素-抗体IgG不变区融合蛋白(SEQ ID NO.12);样品2:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体1(SEQ ID NO.14);样品3:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.16);样品4:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体3(SEQ ID NO.18)
图5是实施例3的引入糖基化短肽的前置序列-内皮抑素-抗体IgG不变区融合蛋白在小鼠体内半衰期的实验。样品(从上到下):●前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体3(SEQ ID NO.18);▲前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.16);■前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体1(SEQ ID NO.14);◆前置序列-内皮抑素-抗体IgG不变区融合蛋白(SEQ ID NO.12)。
图6是实施例4的前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.15和SEQ ID NO.16)在引入的糖基化位点(Asn210-Ser211-Thr212)上再进行点突变的各种点突变体的抗肿瘤活性的实验。样品1:点突变体Asn210-Ser211-Thr212;样品2:点突变体Asn210-Ala211-Thr212;样品3:点突变体Asn210-Tyr211-Thr212;样品4:点突变体Asn210-Ser211-Ser212;样品5:点突变体Asn210-Ala211-Ser212;样品6:没有引入糖基化位点的前置序列-内皮抑素-抗体IgG不变区融合蛋白。
图7是实施例4的图6中的各种点突变体融合蛋白在小鼠体内半衰期的实验。样品(从上到下)x点突变体(Asn210-Tyr211-Thr212);+点突变体(Asn210-Ser211-Ser212);■点 突变体(Asn210-Ser211-Thr212);▲点突变体(Asn210-Ala211-Thr212);●点突变体(Asn210-Ala211-Ser212);◆没有引入糖基化位点的前置序列-内皮抑素-抗体IgG不变区融合蛋白。
图8是实施例5的以前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料,对于Arg85-Arg86位置进行点突变的各种点突变体的抗肿瘤活性的实验。1:点突变体1(Ala85-Arg86);2:点突变体2(Ser85-Arg86);3:点突变体3(His85-Arg86);4:点突变体4(Arg85-Ala86);5:点突变体5(Arg85-Ser86);6:点突变体6(Arg85-His86);7:没有突变融合蛋白(SEQ ID NO.12)。
图9是实施例5的图8中的各种点突变体融合蛋白在小鼠体内半衰期的实验。样品(从上到下),+点突变体6(Arg85-His86);x点突变体3(His85-Arg86);▲点突变体2(Ser85-Arg86);●点突变体5(Arg85-Ser86);■点突变体1(Ala85-Arg86);*点突变体2(Ser85-Arg86);◆没有突变融合蛋白(SEQ ID NO.12)。
图10是实施例5的以前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料,对于Arg151-Arg152位置进行点突变的各种点突变体的抗肿瘤活性的实验。1:点突变体7(Ala151-Arg152);2:点突变体8(Ser151-Arg152);3:点突变体9(His151-Arg152);4:点突变体10(Arg151-Ala152);5:点突变体11(Arg151-Ser152);6:点突变体12(Arg151-His152);7:没有突变融合蛋白(SEQ ID NO.12)。
图11是实施例5的图10中的各种点突变体融合蛋白在小鼠体内半衰期的实验。样品(从上到下),x点突变体9(His151-Arg152);+点突变体12(Arg151-His152);*点突变体10(Arg151-Ala152);■点突变体7(Ala151-Arg152);▲点突变体8(Ser151-Arg152);●点突变体11(Arg151-Ser152);◆没有突变融合蛋白(SEQ ID NO.12)。
图12是实施例6的内皮抑素的N端前面和C端后面的各加入糖基化位点以及内皮抑素内的2组ArgArg的改造的融合蛋白的抗肿瘤活性的实验。样品1:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋(SEQ ID NO.12);样品2:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体1(His85-Arg86和His151-Arg152);样品3:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体2(Arg85-His86和Arg151-His152);样品4:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.18);样品5:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白点突变体1(Arg94His95和Arg160His161);样品6:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20)。
图13是实施例6的图12中的各种突变体的融合蛋白在小鼠体内半衰期的实验。样品(从上到下),●内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20);+内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白点突变体1(Arg94His95和Arg160His161);■前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体1(His85-Arg86和His151-Arg152);x内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白(SEQ ID NO.18);▲前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体2(Arg85-His86和Arg151-His152);◆前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋(SEQ ID NO.12)。
图14是肿瘤模型的小鼠解剖的照片,图中1:实施例1中的作为对照的注射生理盐水的小鼠;2:实施例6中的注射样品6融合蛋白(内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白点突变体2)(SEQ ID NO.20)的小鼠;箭头所指的是肿瘤。
图15是实施例7的内皮抑素及各种内皮抑素衍生物抗肿瘤的实验。1:内皮抑素;2:前置序列-内皮抑素蛋白(内皮抑素的N端前面有2个Arg);3:糖基化位点短肽-内皮抑素-糖基化位点短肽蛋白;4:发生点突变(His62Arg63和His128Arg129)的内皮抑素;5:内皮抑素-抗体IgG不变区融合蛋白;6:前置序列-内皮抑素(N端前面和C端后面各加入糖基化位点)-抗体IgG不变区融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20);7:生理盐水。
图16是实施例7的图15中的内皮抑素及各种内皮抑素衍生物在小鼠体内半衰期的实验。样品(从上到下),●前置序列-内皮抑素(N端前面和C端后面各加入糖基化位点)-抗体IgG不变区融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20);+内皮抑素-抗体IgG不变区融合蛋白;▲糖基化位点短肽-内皮抑素-糖基化位点短肽蛋白;x发生点突变(His62Arg63和His128Arg129)的内皮抑素;■前置序列-内皮抑素蛋白(内皮抑素的N端前面有2个Arg);◆内皮抑素。
具体实施方式
下面通过具体实施例对本发明作进一步的说明。
改造方法一:内皮抑素衍生物包括内皮抑素与抗体不变区连接而构建的融合蛋白,本发明把内皮抑素与抗体不变区连接,特别是IgG抗体的不变区CH1、CH1CH2或CH1CH2CH3。同时在内皮抑素的前面连接一个前置序列,它是由人白蛋白的信号肽和成熟后白蛋白的N端的5个氨基酸短肽组成,信号肽是为了让表达的融合蛋白能够分泌到动物细胞外。这样,通过增加蛋白的分子量来提高内皮抑素衍生物的半衰期。
改造方法二:内皮抑素衍生物是以前置序列-内皮抑素-IgG抗体不变区CH1CH2CH3融合蛋白为实验材料,在内皮抑素的N端前面引入精氨酸(Arg),通过额外的Arg来加强内皮抑素的抗肿瘤的生物活性。
改造方法三:内皮抑素衍生物是以前置序列-内皮抑素-IgG抗体不变区CH1CH2CH3融合蛋白为实验材料,在内皮抑素的前面或后面引入糖基化位点。包括动物在内的真核生物的蛋白的糖链发生在Asn-X-Ser/Thr位置上,其中X是除了Pro、Asp或Glu以外的氨基酸,糖链是连接在Asn上。为了提高前置序列-内皮抑素-IgG抗体不变区CH1CH2CH3融合蛋白的半衰期,本发明在前置序列-内皮抑素-IgG抗体不变区CH1CH2CH3融合蛋白中的内皮抑素的N端前面或C端后面引入糖基化位点或N端前面和C端后面同时引入糖基化位点,选择的糖基化位点的氨基酸是AsnSerThr,在这个位点的前后再加入额外的短肽GlyAlaSer,这样最后的结构是GlyAlaSerAsnSerThrGlyAlaSer,其中AsnSerThr是糖基化位置。
改造方法四:内皮抑素衍生物是以前置序列-内皮抑素-IgG抗体不变区CH1CH2CH3融合蛋白为实验材料,改造内皮抑素(SEQ ID NO.4)中的2组ArgArg,即Arg62Arg63和Arg128Arg129。碱性氨基酸常常是蛋白酶的底物,本发明是在这2组ArgArg中只保留一个Arg,以提高内皮抑素的稳定性。虽然Arg被认为对于肝素结合很重要,但是为了降低内皮抑素被蛋白酶水解的数量,这样的改造还是有助于提高内皮抑素的生物活性。
各种蛋白的核酸和氨基酸序列的基本信息
SEQ ID NO.2是人白蛋白的信号肽和成熟后人白蛋白的N端5个氨基酸的序列,其中1-18 是信号肽,19-23是成熟后人白蛋白的N端5个氨基酸,SEQ ID NO.1是SEQ ID NO.2的核酸编码序列,GenBank数据库中的信息是NP_000468.1和NM_000477.5,SEQ ID NO.2这个序列称为前置序列。
SEQ ID NO.4是人来源的内皮抑素的氨基酸序列,SEQ ID NO.3是它的核酸编码序列,GenBank数据库中的信息是NP_569712.2和NM_130445.3,这里的内皮抑素共有183个氨基酸。
SEQ ID NO.6是人抗体IgG不变区的氨基酸序列,SEQ ID NO.5是它的核酸编码序列,GenBank数据库中的信息是M87789.1,其中,根据氨基酸序列,1-118是CH1片断,119-225是CH2片断,226-330是CH3片断。
实验材料和方法
动物表达载体采用宝生物公司(Takara)的pHEK293 Ultra Expression Vector II,含有外源基因片断插入位置即限制内切酶位点SmaI-XhoI-BamHI-XbaI-SalI-PstI-SphI-HindIII,这里选择的插入切酶位点是XhoI-BamHI-XbaI和SphI-HindIII,即基因片断的前端含有XhoI-BamHI-XbaI,后端含有SphI-HindIII,另外在SphI-HindIII前面增加一个His-tag以及终止信号tag,即catcatcatcatcatcattag。表达载体的构建在大肠杆菌中筛选完成,然后可转染到HEK293细胞进行各种蛋白的瞬时表达。这些载体中的基因片断的合成是由宝生物公司和上海生物工程公司等完成的。
HEK293细胞的培养基是10%胎牛血清的DMEM培养基。
关于蛋白的分离纯化,由于蛋白拥有信号肽,所以表达是分泌型的,蛋白的分离纯化是利用His-tag方法,即将培养基离心,除去细胞,然后利用His·Bind Purification Kit试剂盒(Novagen公司)对于上清液进行纯化,上柱前先加入Binding Buffer,然后将蛋白样品上柱,用Wash Buffer漂洗,再用Elute Buffer洗脱。如果融合蛋白含有抗体IgG不变区,就可以采用ProteinA柱,即使用GE Healthcare公司的HiTrap Protein A HP或HiTrap rProtein A FF,漂洗液是PBS,洗脱液是0.1M柠檬酸(pH2.7)。用His-tag或ProteinA柱方法得到的蛋白都用蛋白电泳进行鉴定,将纯度为一条带的蛋白用于以后的实验。
关于肿瘤模型,小鼠是C57BL/6,约20-24克,每次实验的小鼠数为30只,肿瘤细胞是小鼠肺癌Lewis lung carcinoma(LLC)细胞株,先将LLC细胞进行体外培养,然后注射到C57BL/6小鼠腹腔进行大规模培养,最后取出腹腔内的LLC肿瘤细胞,将2x106肿瘤细胞接种于小鼠的右腋下。
蛋白的生物活性是用小鼠肿瘤生长抑制率和小鼠体内半衰期等来评价,蛋白剂量都是50pmol。
实施例1 一种抗肿瘤蛋白内皮抑素的衍生物,衍生物包括内皮抑素与抗体IgG不变区连接的融合蛋白,其抗肿瘤活性以及该融合蛋白在小鼠体内的半衰期。
蛋白样品
样品1:前置序列-内皮抑素;SEQ ID NO.4所示的内皮抑素前面连接SEQ ID NO.2所示的前置序列,前置序列中的信号肽是为了让表达的内皮抑素能够分泌到细胞外。
样品2:前置序列-内皮抑素-抗体IgG部分不变区CH1的融合蛋白(SEQ ID NO.8所示,编码SEQ ID NO.8的核酸序列是SEQ ID NO.7所示)。
样品3:前置序列-内皮抑素-抗体IgG部分不变区CH1CH2融合蛋白(SEQ ID NO.10所示,编码SEQ ID NO.10的核酸序列是SEQ ID NO.9所示)。
样品4:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.12所示,编码SEQ ID NO.12的核酸序列是SEQ ID NO.11所示)。
将上面的基因合成片断插入pHEK293 Ultra Expression Vector II质粒,
样品1和样品2用His-tag方法纯化,样品3和样品4用ProteinA柱方法纯化。
对照样品是注射生理盐水。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及对照样品生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。图1是抗肿瘤的实验结果,表明随着融合蛋白的分子量增加,肿瘤抑制效果越好。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素或内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图2是各种蛋白在小鼠体内13天的含量变化,结果显示,分子量越大则体内含量越高。
由于前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白在体内更稳定,所以抑制肿瘤的效果最好。
实施例2 内皮抑素衍生物即内皮抑素N端前面的新引入的Arg的评估
选择实施例1样品4的前置序列-内皮抑素-抗体IgG不变区融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料,用氨基酸序列(SEQ ID NO.12)来说明,1-23氨基酸来源于白蛋白,1-18是白蛋白的信号肽,19-23是成熟后的白蛋白的N端的5个氨基酸,其中有两个Arg,24-206是内皮抑素,207-536是抗体IgG不变区,它由CH1、CH2和CH3组成。各种实验蛋白:
样品1:前置序列-内皮抑素-抗体IgG不变区融合蛋白,由SEQ ID NO.12所示,其中19-23是Arg-Gly-Val-Phe-Arg。
样品2:前置序列-内皮抑素-抗体IgG不变区融合蛋白点突变体1,其中19-23是Ala-Gly-Val-Phe-Arg,将第19的Arg的agg点突变成gcg;
样品3:前置序列-内皮抑素-抗体IgG不变区融合蛋白点突变体2,其中19-23是Arg-Gly-Val-Phe-Ala,将第23的Arg的cgt点突变成gct;
样品4:前置序列-内皮抑素-抗体IgG不变区融合蛋白点突变体3,其中19-23是Ala-Gly-Val-Phe-Ala,将第19的Arg的agg点突变成gcg及将第23的Arg的cgt点突变成gct。
注射生理盐水作为对照。
选择实施例1中表达前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.12所示,编码SEQ ID NO.12的核酸序列SEQ ID NO.11)的质粒(pHEK293 Ultra Expression Vector II)进行各种点突变就得到上面各种内皮抑素-抗体IgG不变区融合蛋白突变体。
各种融合蛋白用ProteinA柱方法纯化。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol),各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。图3是抗肿瘤的实验结果,N端有2个Arg的前置序列-内皮抑素-抗体IgG不变区融合蛋白抑制肿瘤的效果最好。
实施例3 检查糖基化位点对于内皮抑素融合蛋白活性的影响
以实施例1的前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料构建衍生物,即在内皮抑素的N端前面或C端后面加入糖基化的氨基酸短肽Gly-Ala-Ser-Asn-Ser-Thr-Gly-Ala-Ser,其中Asn-Ser-Thr是糖基化的位置,糖链是连接在Asn上。选择实施例1中表达前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.12所示,编码SEQ ID NO.12的核酸序列SEQ ID NO.11)的质粒(pHEK293Ultra Expression Vector II)进行各种基因操作,也可以直接合成这些突变体的基因片断,然后插入质粒(pHEK293 Ultra Expression Vector II)进行各种蛋白的表达。
样品1:前置序列-内皮抑素-抗体IgG不变区融合蛋白(SEQ ID NO.12),内皮抑素的N端前面或C端后面没有糖基化的氨基酸短肽;
样品2:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体1(SEQ ID NO.13和SEQ ID NO.14),内皮抑素N端前面加入一个糖基化位点的氨基酸短肽;
样品3:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.15和SEQ ID NO.16),内皮抑素C端后面加入一个糖基化位点的氨基酸短肽;
样品4:前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体3(SEQ ID NO.17和SEQ ID NO.18),内皮抑素的N端前面和C端后面各加入一个糖基化位点的氨基酸短肽。
各种融合蛋白用ProteinA柱方法纯化。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。图4是抗肿瘤的实验结果,表明内皮抑素前后都有糖基化位点的氨基酸短肽的融合蛋白的抑制肿瘤的效果最好。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图5是各种蛋白在小鼠体内13天的含量变化,结果显示,内皮抑素前后都有糖基化位点的融合蛋白在小鼠体内含量最高。
这里的实验表明由于内皮抑素衍生物即前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体3(内皮抑素N端前面和C端后面都有糖基化位点)在体内更稳定,所以抑制肿瘤的效果最好。
实施例4 对于同一糖基化位点的氨基酸再进行点突变
包括动物在内的真核生物的蛋白的糖链发生在Asn-X-Ser/Thr位置上,其中X是除了Pro、Asp或Glu以为的氨基酸,糖链是连接在Asn上。这里,以实施例3中的前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.15和SEQ ID NO.16)即内皮抑素后面加入一个糖基化位点的氨基酸短肽的融合蛋白为材料进行新的点突变,它的糖基化位点是Asn210-Ser211-Thr212,核酸序列是aacagcacg(628-636),新增加的点突变体作为实验样品。
样品1:点突变体Asn210-Ser211-Thr212(SEQ ID NO.16)
样品2:点突变体Asn210-Ala211-Thr212(将编码Ser211的agc点突变为gcc)
样品3:点突变体Asn210-Tyr211-Thr212(将编码Ser211的agc点突变为tac)
样品4:点突变体Asn210-Ser211-Ser212(将编码Thr212的acg点突变为tcg)
样品5:点突变体Asn210-Ala211-Ser212(将编码Ser211的agc点突变为gcc以及将编码Thr212的acg点突变为tcg)
样品6:没有引入糖基化位点的前置序列-内皮抑素-抗体IgG不变区融合蛋白(SEQ ID NO.12)
以含有实施例3中的前置序列-内皮抑素-抗体IgG不变区融合蛋白糖基化位点突变体2(SEQ ID NO.15和SEQ ID NO.16)即内皮抑素后面加入一个糖基化的氨基酸短肽的融合蛋白的表达质粒(pHEK293 Ultra Expression Vector I I)进行各种突变体点的基因操作。各种融合蛋白用ProteinA柱方法纯化。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。
图6是抗肿瘤的实验结果,显示在同一位置上进行糖基化位点改造的融合蛋白都有很好的抑制肿瘤的效果。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图7是各种蛋白在小鼠体内13天的含量变化,结果显示,经过糖基化位点改造的融合蛋白在小鼠体内的含量都很高,这表明只要引入Asn-X-Ser/Thr特征的糖基化的修饰就可以提高融合蛋白的抑制肿瘤活性和蛋白在体内的稳定性。
实施例5内皮抑素衍生物即改造内皮抑素中的2组ArgArg
以实施例1的前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料,然后对内皮抑素内部的2组ArgArg进行点突变。
前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)中的内皮抑素内部的2组ArgArg在内皮抑素的氨基酸序列(SEQ ID NO.4)中分别位于Arg62-Arg63和Arg128-Arg129,在前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白的氨基酸序列(SEQ ID NO.12)中分别位于Arg85-Arg86和Arg151-Arg152,在编码它的核酸序列(SEQ ID NO.11)中的位置是253-258(cgccgt)和451-456(cgcagg)。
首先对于第1组Arg85-Arg86,核酸位置253-258(cgccgt)进行点突变。
点突变体1:Ala85-Arg86(将编码前面Arg的cgc点突变为gcc)
点突变体2:Ser85-Arg86(将编码前面Arg的cgc点突变为agc)
点突变体3:His85-Arg86(将编码前面Arg的cgc点突变为cac)
点突变体4:Arg85-Ala86(将编码后面Arg的cgt点突变为gct)
点突变体5:Arg85-Ser86(将编码后面Arg的cgt点突变为agt)
点突变体6:Arg85-His86(将编码后面Arg的cgt点突变为cat)
然后对于第2组Arg151-Arg152,核酸位置451-456(cgcagg)进行点突变。
点突变体7:Ala151-Arg152(将编码前面Arg的cgc点突变为gcc)
点突变体8:Ser151-Arg152(将编码前面Arg的cgc点突变为agc)
点突变体9:His151-Arg152(将编码前面Arg的cgc点突变为cac)
点突变体10:Arg151-Ala152(将编码后面Arg的agg点突变为gcg)
点突变体11:Arg151-Ser152(将编码后面Arg的agg点突变为agc)
点突变体12:Arg151-His152(将编码后面Arg的agg点突变为cac)
选择实施例1中的前置序列-表达内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)的质粒(pHEK293 Ultra Expression Vector II)进行各种突变体点的基因操作。
各种融合蛋白用ProteinA柱方法纯化。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。
第1个实验是针对第1组Arg85-Arg86,核酸位置253-258(cgccgt)的基因片断(SEQ ID NO.11)进行,样品有点突变体1-6以及没有突变的融合蛋白(SEQ ID NO.12)作为对照样品。
图8是抗肿瘤的实验结果,表明点突变体3(His85-Arg86)和点突变体6(Arg85-His86)的融合蛋白的抑制肿瘤的效果很好。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图9是各种蛋白在小鼠体内13天的含量变化,结果显示,各种点突变体在体内的含量的差别不大,但比没有点突变的融合蛋白的体内含量都高。
这里的实验表明由于内皮抑素第1组Arg85-Arg86发生了改变,保持了蛋白的稳定性即不容易被蛋白酶降解,所以有了较高的抗肿瘤活性,点突变体3(His85-Arg86)和点突变体6(Arg85-His86)中,His代替了Arg,但仍然保持了碱性氨基酸的性质,所以体现了很高的抑制肿瘤的活性和很高的蛋白含量。
现在按照上面第1个实验方法开展针对第2组Arg151-Arg152,核酸位置451-456(cgcagg)的基因片断(SEQ ID NO.11)进行点突变,样品有点突变体7-12以及没有突变的融合蛋白(SEQ ID NO.12)作为对照样品。
图10是抗肿瘤的实验结果,表明点突变体9(His151-Arg152)和点突变体12(Arg151-His152)的融合蛋白的抑制肿瘤的效果很好。
图11是各种蛋白在小鼠体内13天的含量变化,结果显示,各种点突变体在体内的含量的差别不大,但比没有点突变的融合蛋白的体内含量都高。
再一次说明:以前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.12)作为实验材料,融合蛋白中的内皮抑素内部的Arg85-Arg86和Arg151-Arg152分别对应于以SEQ ID NO.4所示内皮抑素序列中的Arg62-Arg63和Arg128-Arg129。
实施例6对于内皮抑素的N端前面和C端后面的各加入糖基化位点以及内皮抑素内的2组ArgArg的改造的再评估
根据实施例5的实验结果,以前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.11和SEQ ID NO.12)作为实验材料,再构建2种点突变体:
点突变体1:His85-Arg86和His151-Arg152
将编码Arg85的cgc点突变为cac
将编码Arg151的cgc点突变为cac
点突变体2:Arg85-His86和Arg151-His152
将编码Arg86的cgt点突变为cat
将编码Arg152的agg点突变为cac
说明:以SEQ ID NO.12序列为实验材料融合蛋白中的内皮抑素内部的第85、第86、第151、第152的氨基酸位置分别对应于SEQ ID NO.4所示内皮抑素序列中的第62、第63、第128、第129。
根据实施例3的实验结果,以内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白(SEQ ID NO.17和SEQ ID NO.18)作为实验材料,对它的2组ArgArg进行改造,
第1组ArgArg的氨基酸位置是Arg94Arg95(SEQ ID NO.18),核酸位置(SEQ ID NO.17)是280-285(cgccgt);第2组ArgArg的氨基酸位置是Arg160Arg161(SEQ ID NO.18),核酸位置(SEQ ID NO.17)是478-483(cgcagg)。
另外构建2种点突变体:
点突变体1:Arg94His95和Arg160His161
将编码Arg95的cgt点突变为cat
将编码Arg161的agg点突变为cac
点突变体2:His94Arg95和His160Arg161
将编码Arg94的cgc点突变为cac
将编码Arg160的cgc点突变为cac
(核酸序列SEQ ID NO.19和氨基酸序列SEQ ID NO.20)
说明:以SEQ ID NO.18序列为实验材料融合蛋白中的内皮抑素内部的第94、第95、第160、第161的氨基酸位置分别对应于SEQ ID NO.4所示内皮抑素序列中的第62、第63、第128、第129。
现在实验所采用的样品:
样品1:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋(SEQ ID NO.12)
样品2:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体1(His85-Arg86和His151-Arg152)
样品3:前置序列-内皮抑素-抗体IgG不变区CH1CH2CH3融合蛋点突变体2(Arg85-His86和Arg151-His152)
样品4:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白(SEQ ID NO.18)
样品5:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白点突变体1(Arg94His95和Arg160His161)
样品6:前置序列-内皮抑素(N端前面和C端后面的各加入糖基化位点)-抗体IgG不变区CH1CH2CH3融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20)
第1天接种LLC肿瘤细胞,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。
图12是抗肿瘤的实验结果,表明同时引入2个糖基化位点以及对2组2组ArgArg改造的样品5和样品6有着很好的抑制肿瘤效果。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图13是各种蛋白在小鼠体内13天的含量变化,结果显示,同时引入2个糖基化 位点以及对2组ArgArg改造的样品5和样品6在体内的含量都很高。
图14是实施例1中的作为对照的注射生理盐水的小鼠和实施例6中的注射样品6融合蛋白(内皮抑素的N端前面和C端后面的各加入糖基化位点的融合蛋白点突变体2)(SEQ ID NO.20)的小鼠的解剖照片。
实施例7对于内皮抑素及各种内皮抑素衍生物的生物活性进行比较
对于所有插入质粒pHEK293 Ultra Expression Vector II的DNA合成片断,片断前端含有XhoI-BamHI-XbaI,后端含有SphI-HindIII,另外在SphI-HindIII前面增加一个His-tag以及终止信号tag,即catcatcatcatcatcattag。
样品1:内皮抑素
即把SEQ ID NO.1所示的核酸序列中编码信号肽的1-54的DNA片断的后面连接SEQ ID NO.3所示的编码内皮抑素的核酸序列,合成这样的DNA片断,然后把这个DNA片断插入到质粒pHEK293 Ultra Expression Vector II,得到内皮抑素。
样品2:前置序列-内皮抑素蛋白(内皮抑素的N端前面有2个Arg)
即把SEQ ID NO.1所示的编码前置序列的核酸序列后面连接上SEQ ID NO.3所示的编码内皮抑素的核酸序列,合成这样的DNA片断,然后把这个DNA片断插入到质粒pHEK293 Ultra Expression Vector II,得到前置序列-内皮抑素蛋白,在这个前置序列-内皮抑素蛋白中,内皮抑素的N端前面有2个Arg。
样品3:糖基化位点短肽-内皮抑素-糖基化位点短肽蛋白
首先设计下面的DNA片断:
片断1:SEQ ID NO.1所示的核酸序列中编码信号肽的1-54的DNA片断
片断2:ggggcctccaacagcacgggggcctcc(编码包含糖基化位点的短肽GlyAlaSerAsnSerThrGlyAlaSer)
片断3:SEQ ID NO.3所示的编码内皮抑素的核酸序列
合成这样的DNA序列:片断1-片断2-片断3-片断2,然后把这个DNA片断插入到质粒pHEK293 Ultra Expression Vector II,得到糖基化位点短肽-内皮抑素-糖基化位点短肽蛋白。
样品4:发生点突变(His62Arg63和His128Arg129)的内皮抑素
SEQ ID NO.3所示是编码内皮抑素的核酸序列,第184-189是cgccgt,它所对应的氨基酸是Arg62Arg63,将第185的g突变为a,这样,第184-189变成caccgt,从而产生了His62Arg63;同样,第382-387是cgcagg,它所对应的氨基酸是Arg128Arg129,将第383g突变为a,这样,第382-387变成cacagg,从而产生了His128Arg129。把这个编码发生点突变内皮抑素的DNA片断的前面连接信号肽(SEQ ID NO.1所示的核酸序列中编码信号肽的1-54的DNA片断),得到了发生点突变(His62Arg63和His128Arg129)内皮抑素的DNA片断,合成这个片断并插入到质粒pHEK293 Ultra Expression Vector II,得到发生点突变(His62Arg63和His128Arg129)的内皮抑素蛋白。
样品5:内皮抑素-抗体IgG不变区融合蛋白
首先设计下面的DNA片断:
片断1:SEQ ID NO.1所示的核酸序列中编码信号肽的1-54的DNA片断
片断2:SEQ ID NO.3所示的编码内皮抑素的核酸序列
片断3:SEQ ID NO.5所示的编码抗体IgG不变区的核酸序列
合成这样的DNA序列:片断1-片断2-片断3,然后把这个DNA片断插入到质粒pHEK293Ultra Expression Vector II,得到内皮抑素-抗体IgG不变区融合蛋白。
样品6:前置序列-内皮抑素(N端前面和C端后面各加入糖基化位点)-抗体IgG不变区融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20)。
对照样品是注射生理盐水。
样品1-4用His-tag方法纯化,样品5和样品6用ProteinA柱方法纯化。
第1天将2x106LLC肿瘤细胞接种于小鼠的右腋下,第2天、第5天、第8天分别静脉注射各种蛋白(剂量都是50pmol)以及生理盐水,各组小鼠的数量是30只,第10天杀死小鼠,取出肿瘤并称重。
图15是内皮抑素及各种内皮抑素衍生物抗肿瘤的实验。结果显示内皮抑素及各种内皮抑素衍生物都有抗肿瘤的生物活性,样品6即前置序列-内皮抑素(N端前面和C端后面各加入糖基化位点)-抗体IgG不变区融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20)抗肿瘤的效果最好。
对于蛋白的小鼠体内的半衰期实验,给小鼠一次注射各种蛋白(100ug/0.2ml),用抗内皮抑素抗血清来检测内皮抑素融合蛋白的含量,第1天的检测是在注射后2小时内进行,连续检测13天。图16是各种蛋白在小鼠体内13天的含量变化,结果显示,含有糖基化位点的内皮抑素(样品3)和发生点突变(His62Arg63和His128Arg129)的内皮抑素(样品4)始终保留较低的体内含量,内皮抑素-抗体IgG不变区融合蛋白(样品5)具有相当高的体内含量,而前置序列-内皮抑素(N端前面和C端后面各加入糖基化位点)-抗体IgG不变区融合蛋白点突变体2(His94Arg95和His160Arg161)(SEQ ID NO.20)(样品6)的体内含量最高。
可见,同时拥有这些特点:内皮抑素的N端前面有2个Arg、内皮抑素的N端前面和C端后面各加入糖基化位点、发生点突变(His62Arg63和His128Arg129)的内皮抑素、内皮抑素与抗体IgG不变区连接而形成的融合蛋白,这样的内皮抑素衍生物例如SEQ ID NO.20序列所示的蛋白的抗肿瘤和半衰期的生物活性最好。
通过上面一系列实施例,内皮抑素衍生物的稳定性包括半衰期以及抗肿瘤的效果都得到了很大的提高,这些改造手段是:
内皮抑素衍生物一、前置序列-内皮抑素与抗体IgG不变区连接而形成的融合蛋白,增加了内皮抑素的分子量。值得指出的是,通过这里的案例,内皮抑素与白蛋白等大分子糖蛋白连接而构建的融合蛋白也可以得到类似的结果。
内皮抑素衍生物二、在内皮抑素的N端前面引入Arg,由于内皮抑素的Arg对于它的生物活性很重要,所以新增加的Arg可以提高内皮抑素的抗肿瘤活性。
内皮抑素衍生物三、在内皮抑素的N端前面和C端后面各引入糖基化位点的氨基酸短肽,这里是GlyAlaSerAsnSerThrGlyAlaSer,其中包含AsnSerThr,具有Asn-X-Ser/Thr特征,同时进行了点突变,表明有Asn-X-Ser/Thr特征的突变体具有很高的抗肿瘤活性和稳定性。
内皮抑素衍生物四、对于SEQ ID NO.4序列所示的内皮抑素中的2组ArgArg(Arg62Arg63和Arg128Arg129)进行点突变,可以避免蛋白酶的水解,这里的实验表明把ArgArg中的一个Arg点突变成其它氨基酸,就提高了内皮抑素融合蛋白的抗肿瘤活性以及稳定性,显然,正是由于提高了内皮抑素融融合蛋白的稳定性,也就是提高了体内内皮抑素融融合蛋白的含 量,导致了内皮抑素融融合蛋白抗肿瘤效果的提高,同时实验显示了ArgHis或HisArg的组合拥有更好的抗肿瘤活性。
内皮抑素衍生物五、实施例6选择了一个最佳组合,构建一类内皮抑素衍生物,同时拥有:
(1)在内皮抑素N端前面和C端后面引入糖基化位点
(2)将内皮抑素中的2组ArgArg点突变成ArgHis或HisArg
具有上面2种特征的前置序列-内皮抑素-抗体IgG不变区融合蛋白显示了相当高的抗肿瘤活性以及在体内相当高的含量。
根据融合蛋白序列(SEQ ID No.11和SEQ ID No.12)为基础可以进行下面各种改造:
a)在内皮抑素N端前面和C端后面引入糖基化位点;
b)针对内皮抑素的内部ArgArg的点突变
c)在内皮抑素的N端前面引入新的Arg
SEQ ID NO.19和SEQ ID NO.20所示序列只是描述了具有上面各种优点的融合蛋白的一种。
这里还提供了一种制备方法:
a)表达的宿主细胞是动物细胞;
b)一种表达系统可以对于药物蛋白进行糖基化位点修饰;
c)由于是分泌型表达,可以从培养基中收集融合蛋白;
d)利用Protein A柱进行融合蛋白的分离纯化。
上面所述的内皮抑素融合蛋白以及它的一系列改造的突变体都可以应用于肿瘤癌症的治疗。
上面的各种内皮抑素融合蛋白的编码DNA序列都可以应用于抗肿瘤的基因治疗。
作为药物其剂型可以是乳化剂、脂质体、分散剂、稳定剂等一起制成各种注射、口服、敷贴以及手术处理等药物的给药形式。除了融合蛋白质本身可以作为药物外,编码融合蛋白质的核苷酸片断或载体还可以作为基因治疗形式来应用。
以上实施例和优选实施方式的描述属于对权利要求限定的本发明的示意性说明,而不是限制本发明。需要特别指出的是,只要不脱离本发明的宗旨,所有显而易见的改变以及具有等价代换的相似发明,均包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法