棉花酪氨酸蛋白磷酸酶GhPTP1及其编码基因和应用的制作方法
本发明属于生物技术领域,具体涉及棉花酪氨酸蛋白磷酸酶GhPTP1及其编码基因和应用。
背景技术:
棉花是世界上最重要的天然纤维经济作物,在我国国民经济中占有十分重要的地位。目前,干旱、盐碱是全球面临的严重问题之一,也是制约我国农业生产的主要因素。多年来,人们采用传统常规选育等方法解决棉花品种干旱和盐渍问题,但往往耗资大、工作量大和选择效率不高。随着分子生物学的不断发展,利用生物技术手段,培育抗旱、耐盐棉花品种正成为可能。当前棉花的基因克隆工作虽然已经取得了一定的成果,但棉花的基因克隆工作远远落后于水稻、玉米、小麦等粮食作物,尤其是对棉花耐盐机理的研究特别是在分子水平上的研究还不是很多。
病毒诱导的基因沉默(Virus—induced gene silencing,VIGS)作为一种有效的反向遗传学技术广泛的用于植物基因组功能的鉴定,病毒诱导的基因沉默可以在植株的不同部位成功沉默内源基因,为研究不同生长时期的基因功能提供了切实可行的手段。
在真核生物中,蛋白质的“可逆磷酸化”作为一项普遍而重要的调控机制,几乎参与调控着生命活动的每个过程,细胞的生长和分化、基因复制和转录调控、蛋白质的修饰和代谢调控、分子识别和信号转导等都与蛋白质的可逆磷酸化密切相关(Gupta and Luan,2003;Boudsocq and Lauriere,2005)。作为广泛参与生物细胞内信号传递的一类分子事件,蛋白磷酸酶既存在于低等的原核生物中,也存在于高等生物体内。蛋白质的可逆磷酸化过程由蛋白激酶(Protein kinases)和蛋白磷酸酶(Protein phosphatases)共同催化完成。蛋白激酶通过对其底物上特定的氨基酸残基进行磷酸化修饰而激活蛋白活性,使微弱的信号得以放大;反之,蛋白磷酸酶使磷酸化的蛋白质去磷酸化,以终止信号或进行逆向调控。蛋白质的可逆磷酸化过程存在多种多样的调节途径,同时蛋白磷酸酶和蛋白激酶有多种底物并可在单个或多个位点发挥作用,这些特性为细胞的信号转导等提供了一种分子开关(Switch on and off)的作用,使细胞能有效而经济的调控对内外信息的反应(Luan,2002)。
技术实现要素:
本发明的一个目的是提供一种蛋白质。
本发明提供的蛋白质是如下a)或b)或c)的蛋白质:
a)氨基酸序列是序列表中序列2所示的蛋白质;
b)在序列表中序列2所示的蛋白质的N端和/或C端连接标签得到的融合蛋白质;
c)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。
本发明的另一个目的是提供与上述蛋白质相关的生物材料。
本发明提供的与上述蛋白质相关的生物材料为下述A1)至A12)中的任一种:
A1)编码上述蛋白质的核酸分子;
A2)含有A1)所述核酸分子的表达盒;
A3)含有A1)所述核酸分子的重组载体;
A4)含有A2)所述表达盒的重组载体;
A5)含有A1)所述核酸分子的重组微生物;
A6)含有A2)所述表达盒的重组微生物;
A7)含有A3)所述重组载体的重组微生物;
A8)含有A4)所述重组载体的重组微生物;
A9)含有A1)所述核酸分子的转基因植物细胞系;
A10)含有A2)所述表达盒的转基因植物细胞系;
A11)含有A3)所述重组载体的转基因植物细胞系;
A12)含有A4)所述重组载体的转基因植物细胞系。
上述相关生物材料中,A1)所述核酸分子为如下1)或2)或3)所示的基因:
1)其编码序列是序列表中序列1的cDNA分子或DNA分子;
2)与1)限定的核苷酸序列具有75%或75%以上同一性,且编码上述蛋白质的cDNA分子或基因组DNA分子;
3)在严格条件下与1)或2)限定的核苷酸序列杂交,且编码上述蛋白质的cDNA分子或基因组DNA分子。
本发明还有一个目的是提供上述蛋白质或上述相关生物材料的新用途。
本发明提供了上述蛋白质或上述相关生物材料在调控植物抗逆性中的应用。
上述应用中,所述调控为降低。
本发明还提供了上述蛋白质或上述相关生物材料在培育抗逆性提高的转基因植物中的应用。
上述应用中,所述抗逆性为抗盐性和/或抗旱性和/或渗透胁迫抗性和/或ABA胁迫抗性。
本发明还有一个目的是提供一种培育抗逆性提高的转基因植物的方法。
本发明提供的培育抗逆性提高的转基因植物的方法包括将抑制上述蛋白质的编码基因表达的物质导入受体植物中,得到转基因植物的步骤;所述转基因植物的抗逆性高于所述受体植物。
上述方法中,所述抑制上述蛋白质的编码基因表达的物质为含有序列1所示的DNA分子的pTRV-RNA2载体和pTRV-RNA1载体。
上述方法中,所述抗逆性为抗盐性和/或抗旱性和/或渗透胁迫抗性和/或ABA胁迫抗性。
上述方法中,所述转基因植物的抗逆性高于所述受体植物具体体现在:在100mM、200mM、250mM、300mM或400mM NaCl胁迫下,转基因植物的地上部与地下部干物重和存活率高于受体植物,或在5%PEG干旱胁迫下,转基因植物的含水量高于受体植物,转基因植物的失水率低于受体植物。
上述方法中,所述受体植物为单子叶植物或双子叶植物;所述双子叶植物具体为棉花。
本发明的最后一个目的是提供抑制上述蛋白质的编码基因表达的物质。
本发明提供的抑制上述蛋白质的编码基因表达的物质为含有序列1所示的DNA分子的pTRV-RNA2载体和pTRV-RNA1载体。
本发明克隆了棉花GhPTP1基因,并通过构建转GhPTP1拟南芥和利用VIGS技术构建GhPTP1沉默植株,对GhPTP1基因的功能进行了功能验证。通过试验证明:说明GhPTP1蛋白可以降低植物的抗逆性,尤其降低了拟南芥的抗盐性、抗旱性、渗透胁迫抗性和ABA胁迫抗性,更深入的研究了植物对盐、旱等胁迫信号的响应机制,为有效提高植物耐盐抗旱性奠定良好的分子基础。
附图说明
图1为棉花GhPTP1基因组织特异性表达分析及亚细胞定位。图1A为棉花GhPTP1基因组织特异性表达分析;图1B为棉花GhPTP1基因质壁分离前的亚细胞定位;图1C为棉花GhPTP1基因质壁分离后的亚细胞定位。
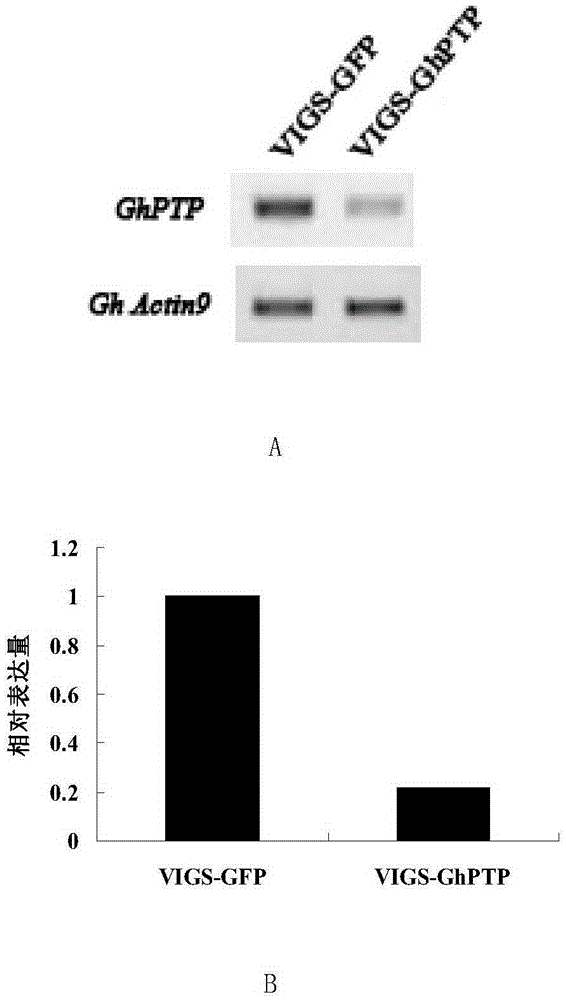
图2为棉花GhPTP1基因沉默效率鉴定。图2A为GhPTP1基因半定量PCR沉默效率检测;图2B为GhPTP1基因q-PCR沉默效率检测。
图3为VIGS-GhPTP1沉默植株抗盐表型及生物量比较。图3A为VIGS-GhPTP1沉默植株抗盐表型;图3B为VIGS-GhPTP1沉默植株盐胁迫下干物质积累量。
图4为VIGS-GhPTP1沉默植株在不同盐胁迫下表型分析及存活率比较。图4A为VIGS-GhPTP1沉默植株不同盐浓度胁迫表型;图4B为VIGS-GhPTP1沉默植株不同盐浓度胁迫下存活率比较。
图5为沉默不同品种GhPTP1基因在盐胁迫下的抗盐表型。
图6为VIGS-GhPTP1沉默植株抗旱表型。图6A为VIGS-GhPTP1沉默植株PEG渗透胁迫下表型;图6B为VIGS-GhPTP1沉默植株失水率;图6C为VIGS-GhPTP1沉默植株含水量。
图7为T2代转GhPTP1拟南芥纯合株系在不同盐胁迫下的萌发率比较。图7A为T2代转GhPTP1拟南芥不同盐浓度下萌发表型;图7B为T2代转GhPTP1拟南芥不同盐浓度下萌发率统计。
图8为T2代转GhPTP1拟南芥纯合株系在100mM NaCl下生长比较。
图9为T2代转GhPTP1拟南芥纯合株系在150mM甘露醇及0.5μM ABA胁迫下萌发率比较。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的棉花品种“国欣3号”在文献“王宁,田晓莉,段留生,等.缩节胺浸种提高棉花幼苗根系活力中的活性氧代谢[J].作物学报,2014,40(7):1220-1226.”中公开过,公众可从中国农业大学获得。
下述实施例中的Super1300-GFP载体在文献“Xu J,Tian X,Eneji A E,et al.Functional characterization of GhAKT1,a novel Shaker-like K+channel gene involved in K+uptake from cotton(Gossypium hirsutum)[J].Gene,2014,545(1):61-71”中公开过,公众可从中国农业大学获得。
下述实施例中的pTRV-RNA2载体在文献“Gao X,Wheeler T,Li Z,et al.Silencing GhNDR1and GhMKK2compromises cotton resistance to Verticillium wilt[J].The Plant Journal,2011,66(2):293-305.”中公开过,公众可从中国农业大学获得。
下述实施例中的pTRV-RNA1载体在“Gao X,Wheeler T,Li Z,et al.Silencing GhNDR1and GhMKK2compromises cotton resistance to Verticillium wilt[J].The Plant Journal,2011,66(2):293-305.”中公开过,公众可从中国农业大学获得。
实施例1、GhPTP1蛋白及其编码基因的发现、克隆及定位
一、GhPTP1基因的克隆
1、引物的设计
根据棉花数据库得到的GhPTP1基因序列,设计两条特异性引物:上游引物:ATGAAGATCGAGGATTTGG和下游引物:GCAAGCACGTGCTTCA。
2、RNA的提取
使用华越洋试剂盒抽提棉花(棉花品种“国欣3号”)叶片的RNA(试剂盒购自北京久康源生物科技有限公司,抽提按照提供的说明书操作)。
3、cDNA的获得
以步骤2获得的RNA为模板,用M-MLV反转录试剂盒(购自Promega公司, 按照试剂盒说明书操作)合成第一链cDNA。
4、PCR扩增
以步骤3获得的cDNA为模板,采用步骤1设计的引物进行PCR扩增,得到PCR产物,即为GhPTP1基因全长。
PCR反应体系(20μL):模板10×Buffer 2μL、10mmol/L dNTPs 2μL、MgSO41.4μL、cDNA 1.2μL、KOD-Plus酶0.4μL、上引物0.3μL、下引物0.3μL、ddH2O 12.4μL;
PCR扩增程序为:94℃,2min;30个循环的程序为94℃,15s;56℃,30s;68℃,3min;最后68℃延伸10min。
5、电泳
取PCR产物在1%琼脂糖凝胶上电泳。电泳完毕在紫外灯下切下目的条带,用琼脂糖凝胶DNA回收试剂盒(购自天根生化科技有限公司)纯化,操作步骤参照该试剂盒的使用说明书。并对其进行测序(测序工作由上海invitrogen公司完成)。
6、GhPTP1基因的获得
测序结果表明:PCR扩增得到大小为852bp的DNA片段,其核苷酸序列如序列表中序列1所示,将序列1所示的基因命名为GhPTP1基因,自5’端第1-849位为ORF,由849个核苷酸组成,GhPTP1基因编码的蛋白为GhPTP1蛋白,其氨基酸序列如序列表中序列2所示,由283个氨基酸残基组成。
二、GhPTP1基因的组织特异性定位
通过荧光实时定量PCR对棉花品种“国欣3”中GhPTP1基因的表达部位进行了分析,具体步骤如下:
1、cDNA的获得
分别提取正常营养水平下三叶期棉花的根、茎、叶的总RNA,反转录得到的cDNA。
2、荧光实时定量PCR
分别以步骤1获得的cDNA为模板,采用引物5’-TTCAGATGGTGGGACGAA-3’和引物5’-ATTGAGAGTGATGACGCCG-3’进行荧光实时定量PCR(荧光实时定量PCR所用的仪器为ABI 7500Fast(Applied Biosystem))。以棉花Actin9基因作为对照(用于鉴定棉花Actin9基因的引物对为:5’-GCCTTGGACTATGAGCAGGA-3’和5’-AAGAGATGGCTGGAAGAGGA-3’)。PCR程序:94℃变性30s;94℃变性5s、60℃退火35s、40个循环;相对表达量采用2-ΔΔCt方法进行计算。
结果如图1所示:正常营养水平下三叶期棉花各部位GhPTP1基因的相对表达量的检测结果如图1A所示:GhPTP1基因在棉花不同组织中均有一定的表达量,而在叶和根中的表达量相对较高。
三、GhPTP1基因的亚细胞定位
将序列表中序列1所示的GhPTP1基因插入Super1300-GFP载体的Xba1和Kpn1酶切位点间,且保持super1300载体的其他序列不变,得到pCAMBIA1300-GhPTP1-GFP重组载体。将pCAMBIA3300-GhPTP1-GFP重组载体转入农杆菌GV3101,得到重组菌。将重组菌转化野生型拟南芥的根部,得到转基因拟南芥,并用Olympus FV1000型显微镜观察报告基因。
结果如图1B所示:转基因拟南芥根部细胞荧光定位在细胞膜上或者细胞壁上。为了排除GhPTP1-GFP在细胞壁上表达的可能性,将根尖利用500mM甘露醇处理10min后质壁分离,如图1C所示,在根尖质壁分离细胞中,荧光信号在细胞壁上极其微弱。由此可见,PTP1-GFP融合蛋白定位于细胞膜上,而不是细胞壁上。
实施例2、GhPTP1沉默植株的获得及其抗盐耐旱表型
一、VIGS-GhPTP1沉默载体的构建
1、提取棉花品种“国欣3号”叶片的总RNA并反转录为cDNA。
2、以步骤1得到的cDNA为模板,用F1和R1组成的引物对进行PCR扩增,得到PCR扩增产物。
F1:5’-CTCTAGAATGAAGATCGAGGATTTGGG-3’;
R1:5’-GGGTACCGCAAGCACGTGCTTCATGAA-3’。
3、用限制性内切酶XbaI和Kpn1双酶切步骤2得到的PCR扩增产物,回收酶切产物。
4、用限制性内切酶XbaI和Kpn1双酶切pTRV-RNA2载体,回收载体骨架。
5、将步骤3的酶切产物和步骤4的载体骨架连接,得到重组质粒pTRV2-GhPTP1。
对重组质粒pTRV2-GhPTP1进行测序验证,结果表明:重组质粒pTRV2-GhPTP1为将序列表中序列1所示的DNA片段替换pTRV-RNA2载体的XbaI和Kpn1酶切位点间的DNA片段,且保持pTRV-RNA2载体的其他序列不变得到的载体。
二、GhPTP1沉默植株的获得
1、将pTRV2-GhPTP1电击转化农杆菌GV3101(上海迈其实业有限公司,产品目录号CH5002A1),得到重组菌pTRV2-GhPTP1/GV3101,于28℃摇培;
将pTRV-RNA1电击转化农杆菌GV3101,得到重组菌pTRV-RNA1/GV3101,于28℃摇培;
将pTRV2-GFP(pTRV2-GFP为将序列表中序列3所示的GFP替换pTRV-RNA2载体的EcoR1和Kpn1酶切位点间的DNA片段,且保持pTRV-RNA2载体的其他序列不变得到的载体)电击转化农杆菌GV3101,得到重组菌pTRV2-GFP/GV3101,于28℃摇培;
2、收集菌液,用VIGS溶液(10mmol L-1的MES、200μm L-1的乙酰丁香酮及10mmol L-1的MgCl2)把菌液浓度调整到OD600=1.5,将重组菌pTRV2-GhPTP1/GV3101与重组菌pTRV-RNA1/GV3101按照1:1(体积比)的比例混合,得到待注射菌液1;将重组菌pTRV2-GFP/GV3101与重组菌pTRV-RNA1/GV3101按照1:1(体积比)的比例混合,得到待注射菌液2;
3、用1ml无针头注射器将待注射菌液1打满棉花(“国欣3号”)子叶的下表面,待植株出现白化表型约两周后,得到GhPTP1沉默植株(VIGS-GhPTP1)。
用1ml无针头注射器将待注射菌液1打满棉花(中07)子叶的下表面,待植株出现白化表型约两周后,得到GhPTP1沉默植株(中07)。
用1ml无针头注射器将待注射菌液1打满棉花(中G5)子叶的下表面,待植株出现白化表型约两周后,得到GhPTP1沉默植株(中G5)。
用1ml无针头注射器将待注射菌液2打满棉花(“国欣3号”)子叶的下表面,得到对照植株(VIGS-GFP)。
4、GhPTP1沉默植株的检测
对GhPTP1沉默植株(VIGS-GhPTP1)和对照植株(VIGS-GFP)进行鉴定。
提取GhPTP1沉默植株(VIGS-GhPTP1)和对照植株(VIGS-GFP)叶片RNA,反转录得到cDNA。
(1)半定量RT-PCR
以上述cDNA为模板,采用引物5’-ATGAAGATCGAGGATTTGG-3’和引物:5’-GCAAGCACGTGCTTCA-3’进行半定量PCR,。
PCR反应体系(20μL):模板10×Buffer 2μL、10mmol/L dNTPs 2μL、MgSO41.4μL、cDNA 1.2μL、KOD-Plus酶0.4μL、上引物0.3μL、下引物0.3μL、ddH2O 12.4μL;
PCR扩增程序为:94℃,2min;30个循环的程序为94℃,15s;56℃,30s;68℃,3min;最后68℃延伸10min。
(2)荧光定量PCR
以上述cDNA为模板,采用引物5’-TTCAGATGGTGGGACGAA-3’和引物5’-ATTGAGAGTGATGACGCCG-3’进行荧光实时定量PCR(荧光实时定量PCR所用的仪器为ABI 7500Fast(Applied Biosystem))。以棉花Actin9基因作为对照(用于鉴定棉花Actin9基因的引物对为:5’-GCCTTGGACTATGAGCAGGA-3’和5’-AAGAGATGGCTGGAAGAGGA-3’)。PCR程序:94℃变性30s;94℃变性5s、60℃退火35s、40个循环;相对表达量采用2-ΔΔCt方法进行计算。
半定量RT-PCR的检测结果如图2A:GhPTP1沉默植株的GhPTP1电泳条带明显弱于对照植株,说明GhPTP1基因表达受到了明显抑制。
荧光定量的检测结果如图2B:GhPTP1沉默植株的GhPTP1表达了显著低于对照植株,说明GhPTP1基因表达受到了明显抑制。
GhPTP1沉默植株(中07)和GhPTP1沉默植株(中G5)的鉴定结果和GhPTP1沉默植株(VIGS-GhPTP1)无显著性差异。
三、VIGS-GhPTP1沉默植株的抗盐表型
1、不同浓度胁迫处理
分别在100mM、200mM、250mM、300mM、400mM NaCl胁迫下,对GhPTP1沉默植株(VIGS-GhPTP1)、对照植株(VIGS-GFP)和野生型棉花(“国欣3号”)进行盐胁迫处理,处理两周后,观察植株的表型并统计单株地上部与地下部干物重及存活率。
200mM NaCl胁迫处理的结果如图3所示:与对照植株相比,GhPTP1沉默植株(VIGS-GhPTP1)有较好的抗盐性,且单株地上部与地下部干物重显著高于对照植株。
不同盐浓度胁迫处理的结果如图4所示:与对照植株相比,GhPTP1沉默植株(VIGS-GhPTP1)表现出较好的抗盐性,并且存活率也高于对照。GhPTP1沉默后能够提高植物的存活率,说明GhPTP1基因具有调控植物抗盐性的功能。
野生型棉花的表型和存活率和对照植株的表型无显著差异。
2、不同品种的抗盐性
在200mM NaCl胁迫下,对GhPTP1沉默植株(中07)和GhPTP1沉默植株(中G5)、GhPTP1沉默植株(VIGS-GhPTP1)和对照植株(VIGS-GFP)进行盐胁迫处理,处理两周后,观察植株的表型。
结果如图5所示:GhPTP1沉默植株(中07)和GhPTP1沉默植株(中G5)、GhPTP1沉默植株(VIGS-GhPTP1)的长势均明显好于对照植株。说明GhPTP1基因在不同棉花品种中均具有调控植物抗盐性的功能。
野生型棉花的表型和对照植株的表型无显著差异。
四、VIGS-GhPTP1沉默植株的抗旱表型
对GhPTP1沉默植株(VIGS-GhPTP1)、对照植株(VIGS-GFP)进行5%PEG干旱胁迫处理,处理3天后,观察植株的表型,并统计GhPTP1沉默植株(VIGS-GhPTP1)、对照植株(VIGS-GFP)干旱处理前的单株含水量和失水率。
结果如图6所示:在5%PEG胁迫下,和对照植株相比,GhPTP1沉默植株(VIGS-GhPTP1)表现出明显的抗旱表型,且含水量明显高于对照植株,失水率明显低于对照植株。GhPTP1沉默后能够提高植物的含水量,并降低植物失水率,说明GhPTP1基因具有调控植物抗旱性的功能。
实施例3、转GhPTP1拟南芥的获得及抗逆性分析
一、重组质粒的构建
1、提取棉花品种“国欣3号”叶片的总RNA并反转录为cDNA。
2、以步骤1得到的cDNA为模板,用F1和R1组成的引物对进行PCR扩增,得到PCR扩增产物。
正向引物:F1:5’-CTCTAGAATGAAGATCGAGGATTTGGG-3’;
反向引物:R1:5’-GGGTACCGCAAGCACGTGCTTCATGAA-3’。
3、用限制性内切酶XbaI和Kpn1双酶切步骤2得到的PCR扩增产物,回收酶切产物。
4、用限制性内切酶XbaI和Kpn1双酶切Super1300-GFP载体,回收载体骨架。
5、将步骤3的酶切产物和步骤4的载体骨架连接,得到重组质粒Super1300-GFP-GhPTP1。
对重组质粒Super1300-GFP-GhPTP1进行测序验证,结果表明:重组质粒Super1300-GFP-GhPTP1为将序列表中序列1所示的DNA片段替换Super1300-GFP载体的XbaI和Kpn1酶切位点间的DNA片段,且保持Super1300-GFP载体的其他序列不变得到的载体。
二、转GhPTP1拟南芥的获得
1、将重组质粒Super1300-GFP-GhPTP1导入农杆菌GV3101,得到重组农杆菌。
2、待拟南芥植株(哥伦比亚生态型)开花后,剪去主枝顶端,促进侧枝发展;在剪枝后的6天内,将步骤1得到的重组农杆菌的菌悬液蘸湿拟南芥未露白的花序上,然后将拟南芥用充满气的黑色塑料袋包住,平放,暗培养24h后去掉塑料袋,恢复光照、按常规方法培养植株至结实,收获成熟T1代转GhPTP1拟南芥种子。
3、采用含有50mg/L卡那霉素的MS培养基培养T1代转GhPTP1拟南芥种子并从中挑选阳性植株(阳性植株表现为:真叶健康呈深绿色,根伸长至培养基中)。
4、将步骤3获得的阳性植株自交获得T2代转GhPTP1拟南芥种子。
5、采用含有50mg/L卡那霉素的MS培养基培养T2代转GhPTP1拟南芥种子并从中挑选阳性植株(筛选标准同上)。
对于某一T1代转GhPTP1拟南芥植株,如果其T2代转GhPTP1拟南芥植株均为阳性植株,该T1代转GhPTP1拟南芥植株及其自交后代为一个纯合的转基因株系。
5、培育T2代转GhPTP1拟南芥植株并自交获得T3代转GhPTP1拟南芥种子。培育T3代转GhPTP1拟南芥种子,得到T3代转GhPTP1拟南芥植株(OE1-OE14)。
6、提取T3代转GhPTP1拟南芥植株的基因组DNA(CTAB法),用特异性引物扩增进行分子鉴定。引物序列如下:
正向引物:F1:5’-CTCTAGAATGAAGATCGAGGATTTGGG-3’;
反向引物:R1:5’-GGGTACCGCAAGCACGTGCTTCATGAA-3’。
鉴定结果表明:T3代转GhPTP1拟南芥植株(OE1-OE14)均可以扩增得到大小为849bp的目的条带,而野生型拟南芥扩增不到大小为849bp的目的条带。选取T3代转GhPTP1拟南芥株系OE1、T3代转GhPTP1拟南芥株系OE2和T3代转GhPTP1拟南芥株系OE3进行下一步抗逆性的研究。
三、转GhPTP1拟南芥的逆境敏感反应
1、盐胁迫下萌发率分析
将T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE2)和T3代转GhPTP1拟南芥株系OE3(OE3)和野生型拟南芥(wt)的种子分别种在正常MS培养基、含有100mM NaCl的MS培养基和含有150mM NaCl的MS培养基中,4℃春化72小时后,移入20℃温室中,16h光/8h暗,光强为60μmol/m2/s,湿度60%~70%的培养室培养10天,分别统计存活率。
结果如图7所示:在100mM NaCl和150mM NaCl条件下,T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE3)和T3代转GhPTP1拟南芥株系OE3(OE3)的萌发率均极显著低于野生型拟南芥(wt)。
2、盐胁迫下根长分析
将T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE2)和T3代转GhPTP1拟南芥株系OE3(OE3)和野生型拟南芥(wt)的种子分别种在正常MS培养基中,4℃春化72小时后,移入20℃温室中,16h光/8h暗,光强为60μmol/m2/s,湿度60%~70%的培养室培养5天后移入100mM NaCl培养基,继续生长3天后,统计根长。
结果如图8所示:T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE2)和T3代转GhPTP1拟南芥株系OE3(OE3)的根长均极显著短于野生型拟南芥(wt)。
3、其他逆境胁迫下萌发率分析
将T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE2)和T3代转GhPTP1拟南芥株系OE3(OE3)和野生型拟南芥(WT)的种子分别种在正常MS培养基、含有150mM甘露醇的MS培养基、含有0.5μM ABA(脱落酸)的MS培养基中,4℃春化72小时后,移入20℃温室中,16h光/8h暗,光强为60μmol/m2/s,湿度60%~70%的培养室培养10天后,统计萌发率。
结果如图9所示:在150mM甘露醇、0.5μM ABA条件胁迫,T3代转GhPTP1拟南芥株系OE1(OE1)、T3代转GhPTP1拟南芥株系OE2(OE2)和T3代转GhPTP1拟南芥株系OE3(OE3)的萌发率均极显著低于野生型拟南芥(WT)。
以上各指标的变化说明GhPTP1蛋白可以降低植物的抗逆性,尤其降低了拟南芥的抗盐性、抗旱性和渗透胁迫抗性,并提高了对ABA的敏感性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人蛋白磷酸酶1调节因子亚基10-9.79和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶13.64和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶4调节亚基9.46和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶12.98和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶11.66和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶24.53和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶8.8和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶1调控蛋白13和编码这种多肽的多核苷酸的制作方法
- 蛋白质酪氨酸磷酸酶的调节物的制作方法
- 一种新的多肽——人蛋白磷酸酶1调控蛋白68和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶1调节因子亚基10-9.79和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶13.64和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶4调节亚基9.46和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶12.98和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶11.66和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶24.53和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶8.8和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶1调控蛋白13和编码这种多肽的多核苷酸的制作方法
- 蛋白质酪氨酸磷酸酶的调节物的制作方法
- 一种新的多肽——人蛋白磷酸酶1调控蛋白68和编码这种多肽的多核苷酸的制作方法
- 一种多肽——酪氨酸特异性蛋白磷酸酶-18.26和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶1调控蛋白17.71和编码这种多肽的多核苷酸的制作方法
- 酰基硫脲嘧啶衍生物及其制备方法和用途的制作方法
- 一种新的多肽——人蛋白酪氨酸磷酸酶15.62和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——蛋白磷酸酶2c-27.83和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——酪氨酸特异性蛋白磷酸酶24.97和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶2Aalpha亚基22.66和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶1调节因子亚基10-9.79和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白磷酸酶13.64和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人蛋白酪氨酸磷酸化酶10.01和编码这种多肽的多核苷酸的制作方法