增加微生物中生物质和脂质含量的方法及展现增强的自噬的基因修饰微生物与流程
本发明涉及增加微生物中的生物质和脂质含量的方法和展现出增强的自噬的基因修饰微生物(genetically modified micro-organism)。
背景技术:
在应激条件之中,不同的生物体本身通过各种方式经历胞内降解来对抗应激并促进正常细胞功能的存留。在真核生物中,主要存在两种胞内降解的模式,蛋白酶体降解路径和自噬(autophagy)。在前者的路径中,称为蛋白酶体的蛋白复合物起酶分解不必要的或受损的蛋白质的作用。另一方面,自噬是用于分解细胞质物质,包括细胞器的途径,并且因此得到各种的降解产物。真核生物中其他抵抗应激的技术通常包括不同的基因修饰,以应对单独的应激因素,如pH、温度等的不利变化。但是,自噬是,生物体可以通过其同时且累积地应对不同的应激的模式。
具体地,自噬是介导细胞的胞内组分,特别是无效组分的翻转(turnover)的分解代谢过程,并且在细胞生长、生存和自我平衡(homeostasis)中起重要作用。自噬是由隔离膜(isolation membrane)的形成引发的,其延伸以吞没(engulf)部分的细胞质以形成自噬小体(autophagosome),然后其与溶酶体融合以形成自溶酶体(autolysosome)。然后由酶如溶酶体水解酶降解捕获在自溶酶体内的物质和内膜。
生物体使用多种抵抗应激的技术,包括解决应激因素如pH、温度、氧/氮/二氧化碳水平、盐度、阳光或水的可利用性、暴露于紫外(UV)辐射等的变化的遗传改变(genetic modification)。然而,这样的对抗应激的技术起消除单独的特定应激因素的效果的作用。另一方面,自噬路径具有通过单一的协同的过程来累积地消除许多应激因素的影响的潜力。
自噬是响应于多种刺激和应激因素如饥饿和感染而调整细胞生物质和功能,以使细胞能够在有害环境中生存的分解代谢过程。因此自噬涉及为了对抗应激的目的,在细胞内重复利用营养物。
各种生物体,如植物、藻类等具有参与自噬的细胞机能。最近的研究示出了小球藻中自噬基因的存在(Jiang et al.,Analysis of autophagy genes in microalgae:Chlorella as a potential model to study mechanism of autophagy(2012))。真核的微藻类具有一些独特的涉及生物燃料产生的新陈代谢特征,包括大量的三酰甘油的积聚;贮存淀粉(支链淀粉和直链淀粉)的合成,其与高等植物中发现的相似;以及高效地将光合电子传递结合至H2产生的能力(Radakovits,R.,et al.,Genetic engineering of algae for enhanced biofuel production;Eukaryotic Cell Vol 9,486-501(2010))。
然而,并没有完全理解对于调节,并且特别是增强细胞的生产力,以更高效的方式调节用于生长、生存和对抗应激状态的自噬的需要。特别是,对于具有用于各种工业应用的潜力的生物体,还有待于理解在目标生物体中用于调节自噬的机制。这种生物体的适合的实例包括但不限于光合生物。因此,存在对于用于在生物体中增强自噬,用于生长和对抗应激的有效方法,和在基因水平上修饰的生物体,用于展现出增强的自噬以从这种生物体得到高产率的感兴趣的产物的需要。
技术实现要素:
根据本发明的实施方式,提供在微生物中增加生物质和脂质含量的方法,包括:
a.在载体中克隆选自包括Atg1基因、Atg6基因和Atg8基因序列的组的外源基因序列,其中该序列是与Atg1基因、Atg6基因和Atg8基因至少50%同源的,对所述微生物密码子优化,用于诱导自噬;
b.将含有该基因的载体引入微生物的基因组中以得到基因修饰微生物;以及
c.在适合的培养基中培养该基因修饰微生物。
根据本发明的另一实施方式,提供增加暴露于应激(stress)的微生物中的生物质和脂质含量的方法,包括用自噬诱导剂处理该微生物。
根据本发明的又一实施方式,提供展现出增强的自噬的基因修饰微生物,该微生物包含携带选自包括Atg1基因、Atg6基因和Atg8基因序列的组的外源基因序列的载体,其中该序列是与Atg1基因、Atg6基因和Atg8基因至少50%同源的,其对于所述微生物密码子优化,已知诱导自噬。一种根据本发明的实施方式制备的基因修饰微生物,即莱茵衣藻(Chlamydomonas reinhardtii)CC 125,已经在2014年12月18日保藏于英国藻类和原生物动物保藏中心(Culture Collection of Algae and Protozoa(CCAP)),SAMS Limited,Scottish Marine Institute,Dunbeg,Oban,Argyll,PA37 1QA,UK并且具有CCAP登录号CCAP 11/171。
根据本发明的另一实施方式,提供展现出增强的自噬的基因修饰的真核微生物(genetically modified eukaryotic micro-organism),包含SEQ ID No.1的核酸序列。
根据本发明的又一实施方式,提供展现出增强的自噬的基因修饰微生物,包含编码SEQ ID No.2的蛋白激酶结构域的核酸序列。
根据本发明的又一实施方式,提供载体,包含可操作地结合至SEQ ID No.1的核酸序列的调控核酸片段。
根据本发明的又一实施方式,提供载体,包含可操作地结合至编码包含SEQ ID No.2的氨基酸序列的多肽的核酸序列的调控核酸片段。
根据本发明的又一实施方式,提供包含SEQ ID No.1的核酸序列。
根据本发明的又一实施方式,提供编码包含SEQ ID No.2的氨基酸序列的多肽的核酸序列。
根据本发明的又一实施方式,提供包含SEQ ID No.2的氨基酸序列的多肽。
附图说明
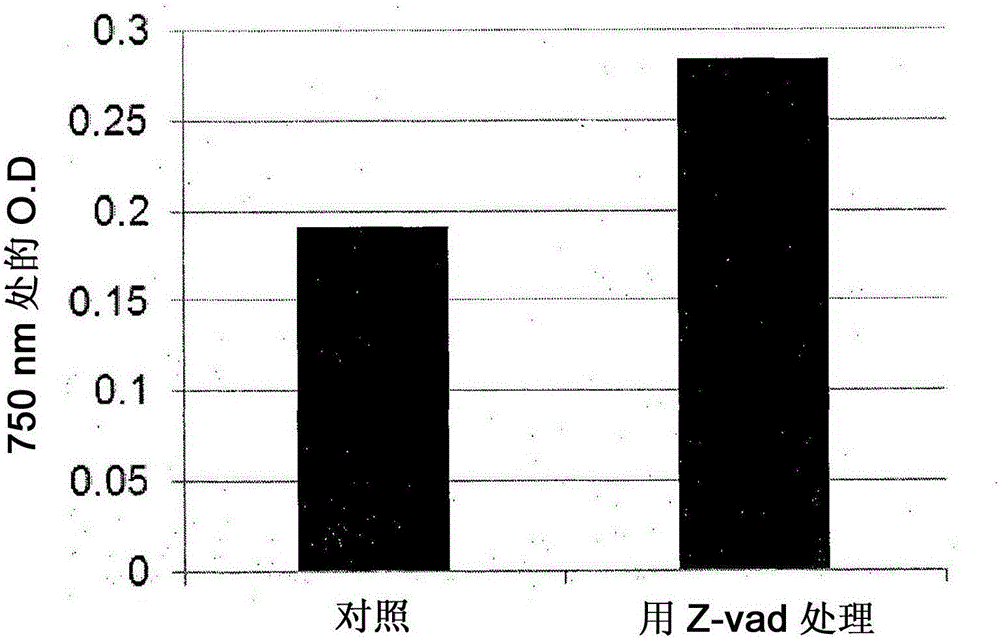
图1A是在13天的UV暴露之后对照板与z-vad-fmk处理的板的比较。
图1B图解地表示了在UV暴露之后第13天对照培养物在750nm的光密度相对于用z-vad-fmk处理的培养物的光密度。
图2示出了盐应激暴露4天之后的对照板和一式两份的LiCl处理的板。
图3是UV处理之后在30分钟和2天的LysoTracker平均荧光强度(MFI)相对于未处理样品的图解比较。
图4A和图4B示出了UV暴露后随后分别30分钟和2天的恢复的流式细胞仪分析数据。
图5是带有使用Kpn1和Nde I克隆的ATG1的pChlamy_1的载体图(vector map)。
图6是确认莱茵衣藻中的Atg1(自噬蛋白)转化体的菌落PCR(聚合酶链式反应)图像。
图7A和图7B是分别在≈75KDa和≈13KDa处示出带的Western印迹膜,显示转化体3和5中升高的Atg8蛋白水平。
图8A是在UV暴露后第2天、第4天、第6天、第8天和第10天在FACS中分析的UV处理的样品中叶绿素阳性细胞的百分比的图解比较。
图8B是在第2天、第4天、第6天、第8天和第10天在FACS中分析的未处理的样品中叶绿素阳性细胞的百分比的图解比较。
图8C是样品的尼罗红试验,在UV处理4天后检查其MFI。
图8D是野生型和转化体中的溶酶体活性的比较。
图9A是未处理的野生型相对于转化体的叶绿素A自发荧光的图解比较。
图9B是UV处理的野生型相对于转化体的叶绿素A自发荧光的图解比较。
图9C是未处理的野生型和转化体在750nm处的OD的图解比较。
图9D是UV处理的野生型和转化体在750nm处的OD的图解比较。
图10A和图10B图解地示出了转化体相比野生型在盐应激耐受性上具有明显的优势。
图11A和图11B图解地示出了转化体相比野生型在温度应激耐受性上具有明显的优势。
图12A图解地比较了转化体5相比野生型在盐应激下的生长优势。
图12B图解地比较了转化体5相比野生型在高温应激下的生长优势。
图12C图解地比较了转化体5相比野生型在高光应激下的生长优势。
具体实施方式
为了简洁和说明的目的,通过主要参考其示例性的实施方式描述本发明。在以下描述中,提出许多具体细节以提供对本发明深入的了解。然而,对于本领域普通技术人员显而易见的是,可以实施本发明而不限于这些细节。在其他实例中,没有详细地描述众所周知的方法/技术,以免不必要地使本发明不清楚。
在整个说明书中,词语“包含”或变化形式如“包括”或“含有”应理解为意指包括所指明的要素,或步骤,或要素或步骤的组,但是不排除任何其它要素,或步骤,或要素或步骤的组。
表达“至少”或“至少一种”的使用表明使用一种或多种要素或成分或数量,因为该使用可以是在本公开的实施方式中,以得到一个或多个期望的目的或结果。
可选地,根据本发明的实施方式制备的基因修饰微生物暴露于非生物应激如紫外辐射(UV)、盐度、光、不利的温度、碱度、营养限制、氧化应激、衰老、硫缺乏、碳缺乏、低氮利用率、由于生物原因的应激如病毒、细菌、真菌或其他引起应激的病原体。可选地,还用LiCl化学处理根据本发明的实施方式制备的基因修饰微生物以进一步诱导自噬。
可以通过基因修饰或通过自噬的化学诱导或这些的组合来在微生物中诱导自噬。
优选地,增加微生物中的生物质和脂质含量的方法包括载体pChlamy_1的使用。可选地,外源基因具有与酵母的Atg1基因至少52%的同源性。可选地,具有与酵母的Atg1基因至少52%的同源性的外源基因是由小球藻获得的。
优选地,该微生物是光合微生物。
应激可以是非生物应激如紫外辐射(UV)、盐度、光、不利的温度、碱度、营养限制、氧化应激、衰老、硫缺乏、碳缺乏、低氮利用率、由于生物原因的应激如病毒、细菌、真菌或其他引起应激的病原体。优选地,当应激是UV时,UV暴露不大于6小时。优选地,当应激是UV时自噬诱导剂是z-vad-fmk。更加优选地,用1mM至1M的z-vad-fmk处理微生物1分钟至5天。优选地,将微生物在UV暴露之后保持在黑暗中24小时随后暴露于光。
优选地,当应激是盐度时,盐度暴露不大于10天。优选地,当应激是盐度时自噬诱导剂是LiCl。
在本发明的优选实施方式中,展现出增强的自噬的基因修饰光合微生物包含载体pChlamy_1。优选地,由载体携带的外源基因具有与酵母的Atg1基因至少52%的同源性。优选地,具有与酵母的Atg1基因至少52%的同源性的外源基因是由小球藻获得的。
根据本发明的实施方式,提供用于通过基因工程化生物体以在生物体中诱导增强的自噬的方法,以在应激条件中展现出增强的自噬并获得一种或多种感兴趣的产物。优选地通过流式细胞计测量自噬。
优选地,感兴趣的产物是生物燃料和高价值的化学品。在本发明优选的实施方式中,使至少一种内源的自噬基因在生物体中过表达以导致增强的自噬。在本发明的又一优选实施方式中,将至少一种外源的自噬基因引入生物体的遗传物质并过表达以导致增强的自噬。内源或外源的自噬基因优选地是藻类的自噬基因。更优选地,通过对Atg1基因或其重组体衍生物的表达的基因操作实现过表达。可替换地,通过对Atg6基因或其重组体衍生物的表达的基因操作实现过表达。在另一实施方式中,外源的自噬基因可以是自然存在的基因和/或来自相同或其他生物体的其衍生物。
更优选地,由基因操作转化的光合微生物是藻类,更加优选衣藻和小球藻。在特定生物体中用于遗传工程的常规实施的方法可以用于所述生物体中自噬基因的过表达。可以在适当的DNA运载体(carrier)(如载体(vector))中克隆自噬基因用于生物体中的转化和表达,并且可以通过常规分析技术,包括但不限于聚合酶链式反应(PCR)或Southern印迹法(Southern Blotting)来分析稳定的转化体,并且最终可以通过电子显微术或其他基于报告物的或生物化学的方法如标记基因来筛选基因修饰生物体。优选地,报告物试验包括使用Atg8蛋白质切割法,其可以通过融合绿色荧光蛋白(GFP)或通过基于抗体的技术来使用。
可替换地,可以使用LysoTracker试验。
优选地,在本发明中涉及的自噬包括但不限于线粒体自噬和核糖体自噬。在另一实施方式中自噬可以是选择性的自噬。
通常,应激可以是,但不限于环境的和人为的应激。
通常应激的类型可以是,但不限于足以触发自噬的轻微且温和的应激。
根据本发明的另一方面,提供展现出增强的自噬,包含至少一种自噬基因的基因修饰微生物。优选地,该基因是Atg1或Atg6或它们的重组体衍生物。基因可以是外源引入的或内源基因可以是遗传工程化的,用于它们的过表达。可选地,至少一种调节自噬的基因是过表达的。在本发明优选的实施方式中,生物体是真核的微生物。优选地,该真核生物是藻类并且更加优选衣藻和小球藻。藻类已用于通过生物技术操作生产生物柴油和高价值的化学品,与自噬无关。因此,目前,调控自噬并由藻类获得期望的生物柴油和高价值的化学品是高度感兴趣的。
根据本发明的另一实施方式,提供用于在真核生物中表达增强的自噬的基因构建体,该构建体包括至少一种基因修饰的(genetically modified)自噬基因。优选地,该基因构建体进一步包括启动子、增强子、激活子(activator)和终止序列中的至少一种。优选地,自噬基因是Atg1或Atg6。这种自噬基因可以是自然存在的基因和/或来自相同或其他生物体的其衍生物。优选地,启动子是病毒启动子,更优选小球藻病毒启动子。优选地,增强子是由植物来源获得的。可以使用DNA载体,包括但不限于病毒载体和非病毒载体如质粒来克隆基因构建体。此外,为了该描述的目的,可以将一种或多种这种基因构建体整合至目标生物体的基因组中。
根据本发明的另一实施方式,提供用于在真核生物中表达增强的自噬的基因构建体,该构建体包含至少一种基因修饰的基因调节序列。优选地,该调节序列是启动子或增强子。优选地,增强子是由植物来源获得的。将基因修饰的基因调节序列配置为过表达至少一种自噬基因。这种自噬基因可以是自然存在的基因和/或来自相同或其他生物体的其衍生物。
可以使用DNA载体,包括但不限于病毒载体和非病毒载体如质粒来克隆基因构建体。此外,为了该描述的目的,可以将一种或多种这种基因构建体整合至目标生物体的基因组中。
优选地,感兴趣的产物是生物燃料和高价值的化学品。在本发明优选的实施方式中,使至少一种内源的自噬基因在生物体中过表达以导致增强的自噬。在本发明的又一优选实施方式中,将至少一种外源的自噬基因引入生物体的遗传物质并过表达以导致增强的自噬。内源或外源的自噬基因优选地是藻类的自噬基因。更优选地,通过对Atg1基因或Atg6基因或它们的重组体衍生物的基因操作实现过度表达。更优选地,由基因操作转化的生物体是藻类,更加优选衣藻和小球藻。在特定生物体中用于遗传工程的常规实施的方法可以用于所述生物体中自噬基因的过表达。可以将自噬基因克隆在适当的载体中用于在微生物中的表达,并且可以通过常规分析技术,包括但不限于聚合酶链式反应(PCR)或Southern印迹法来分析稳定的转化体,并且最后可以通过电子显微术或其他基于报告物的或生物化学的方法如标记基因来筛选基因修饰微生物。优选地,报告物试验包括使用Atg8蛋白质切割法,其可以通过融合绿色荧光蛋白(GFP)或通过基于抗体的技术来使用。
根据本发明的又一实施方式,提供用于由上文中描述的基因修饰微生物生产一种或多种感兴趣的产物的方法。优选地,感兴趣的产物是生物燃料和高价值的化学品。更优选地,高价值的化学品包括但不限于药物、ω脂肪酸和营养品。
基因修饰微生物是根据本发明的实施方式制备的并且然后经受特定的环境应激以调控外源/内源基因的表达用于响应于应激如生物或非生物应激调节自噬,并进一步评估它们对所述应激增加的耐受性并且由其生产化学品,包括但不限于高价值的化学品。
涉及制备根据本发明的实施方式的基因修饰微生物的步骤的总览如下:
1)分离自然存在的微生物如藻类;
2)设计用于分子克隆的适当的载体;
3)在适当的载体中克隆自噬基因;
4)在藻类中转化含有自噬基因的适当的载体;并且
5)筛选存在过表达自噬基因的转化体。
通过使用包括但不限于质粒的DNA载体来遗传改造微生物将过表达自噬基因的构建体整合入生物体的基因组。使用分子技术如PCR或Southern印迹法完成对阳性转化体的选择。
应理解的是,上文对本发明的实施方式的概述旨在提供对理解本发明的本质和特性的总览或框架。
任何包括在本说明书中的文献、行动、材料等的讨论仅是为了提供本公开的上下文的目的。不应将其视为承认任何或所有的这些内容,因其在本申请的优先权日之前存在于任何地方,形成现有技术基础的一部分或是本公开相关的领域的公知常识。
为了本领域技术人员能够更好的实施本公开,通过说明的方式而非限制的方式给出以下实施例。
实施例1:
将1×106细胞/ml的小球藻(Chlorella sorokiniana)在Tris-乙酸盐-磷酸盐(TAP)培养基中生长三天并且然后使用CL-1000UV交联剂以250000μJ/cm2暴露于UV一分钟。在UV暴露之后立即将25μΜ的Z-vad-fmk加入TAP培养基。将该培养物保持在黑暗中24小时。然后使培养物暴露于2000lux的光12小时随后12小时的黑暗。首先使培养物白化(bleach)并且然后在10天之后仅z-vad-fmk处理的培养物看出了复苏(revive)。
图1A示出了在13天的UV暴露之后对照板与一式三份的z-vad-fmk处理的板。明显的是仅z-vad-fmk处理的板示出了活的培养物。图1B图解地表示了在UV暴露之后第13天对照培养物在750nm的光密度相对于用z-vad-fmk处理的培养物的光密度。在这些图中明显的是z-vad-fmk诱导小球藻细胞中的自噬,帮助细胞从UV暴露恢复。自噬在微藻类中是由z-vad-fmk化学诱导的,其防止暴露于UV的培养物中的细胞死亡。灰白的(pale)对照板示出暴露于UV的细胞在没有z-vad-fmk的情况下死亡,看来其会在z-vad-fmk处理的细胞中诱导自噬。因此,可以得出结论,即使在环境应激条件如暴露于UV下,用z-vad-fmk处理藻类细胞防止细胞死亡,增加藻类细胞的生物质和脂质含量,并且伴随得到增加量的有商业价值的产物,如已知由藻类细胞产生的油。
实施例2:
将2×106细胞/ml的小球藻在Tris-乙酸盐-磷酸盐(TAP)培养基中生长三天并且然后通过向培养基添加1.2%的盐度并使细胞在所述培养基中生长4天来在细胞中引起应激。在实验板中而不在对照中将5mM的LiCl加入TAP培养基。在第0天,即将培养物暴露于1.2%的盐应激之日和此后的第4天进行细胞计数,如下表1中所示:
表1
图2示出了盐应激暴露4天之后的对照板和一式两份的LiCl处理的板。明显的是LiCl处理的板示出了更高的细胞计数,意味着比对照更大的细胞存活(viability)。明显的是自噬是在微藻类中由LiCl化学诱导的,其在暴露于盐应激的培养物中增加了细胞生长。因此,可以得出结论,即使在环境应激条件如暴露于盐度下,用LiCl处理藻类细胞防止细胞死亡,增加藻类细胞的生物质和脂质含量,并且伴随得到增加量的有商业价值的产物,如已知由藻类细胞产生的油。
实施例3:
将2×106细胞/ml的小球藻在Tris-乙酸盐-磷酸盐(TAP)培养基中生长三天并且然后使用CL-1000UV交联剂以250000μJ/cm2暴露于UV一分钟。在30分钟检查细胞的恢复,之后将细胞保持在黑暗中24小时,并且然后将培养物暴露于2000lux的光12小时随后12小时的黑暗。在暴露后2天使用荧光活化细胞分选(FACS),藻红蛋白通道检查恢复。使用LysoTracker红染料(1μΜ)将细胞中的溶酶体在室温下染色五分钟并且然后测量细胞的平均荧光强度(MFI)并相对于没有暴露于UV的,同样细胞龄和菌株类型的细胞的MFI进行比较。在藻红蛋白(PE)通道中使用BD FACS ARIA III流式细胞仪分析荧光标记的细胞(使用的荧光探针:LysoTracker RED DND-99;Ex/Em:577/590nm)。图3图解地示出了该比较,由其明显的是在UV处理之后,由细胞吸收的染料的MFI加倍,其进而表明由于增加的细胞的自噬活性而增加溶酶体数目。
由图3明显的是在UV处理之后存在LysoTracker平均荧光强度(MFI)的增加,并且该增加在UV处理之后2天更加明显。图4A和图4B示出了UV暴露后随后分别30分钟和2天的恢复的流式细胞仪分析数据。流式细胞计标记并追踪活细胞中的酸性细胞器如溶酶体。当在细胞中诱导自噬时溶酶体数目增加。因此,明显的是按照上述方法给出的UV处理导致细胞中自噬增加。
实施例4:
通过以下步骤基因修饰衣藻的细胞以在它们中诱导自噬:
1.使用标准计算方法以确定小球藻(Chlorella variabilis)基因组的基因,其具有与酵母,即酿酒酵母(Saccharomyces cerevesiae)的Atg1基因52%的同源性。所述小球藻中的基因在本文中称作“小球藻Atg1基因”。
2.小球藻Atg1基因(理解其假设地产生称为CHLNCDRAFT_26970的蛋白质)是使用已知的基因合成方法合成的。
3.然后,在如图5中示出的位点,通过已知的方法将小球藻Atg1基因插入Life Technologies的pChlamy_1载体的KpnI和NdeI限制位点。
4.将大肠杆菌细胞用重组质粒转化并使用已知的技术扩大转化的细胞培养物。此后分离并线性化大肠杆菌DNA质粒。
5.然后使用电穿孔将重组体线性化的质粒用于转化衣藻并在含有潮霉素的培养基上选择。使用PCR以确认莱茵衣藻中的Atg1(自噬蛋白)转化体,如图6所示。在图6中,孔1至5对应菌落1至5,其中4在染色后示出了带。所以,可以得出结论,分析的五个菌落中的四个已经确认是转化的并且含有Atg1基因,因使用Atg1基因特异性引物对其验证。在图6中,孔6是阳性对照,孔7是无模板对照,孔8对应使用野生型生物体的PCR,孔9示出了1kb梯(ladder)同时孔10示出了100bp梯。
6.完成对含有小球藻Atg1基因的核酸构建体的基因测序并且获得的基因序列在序列表的SEQ ID No.1中示出。
使用Western印迹法表征蛋白质的表达。提取并SDS-PAGE迁移总可溶蛋白。将蛋白质电转移至PVDF膜上。使用预吸收的一级抗体(primary antibody),即抗Atg8和二级抗体(secondary antibody),即山羊抗兔IgGH&L(HRP)进行Western印迹法。通过ECL试剂盒完成照相膜(photographic film)上的探测。
如果Atg1的表达较高,Atg8也会示出升高水平的表达。Western印迹在≈75KDa和≈13KDa处检测出两条带,分别如图7A和7B所示。转化体3(对应图6 PCR的孔3)和转化体5(对应图6PCR的孔5)示出了相比野生型升高水平的Atg8蛋白。这使用抗Atg8抗体确认了衣藻中Atg1转化体的存在。
实施例5:
然后使用CL-1000UV交联剂将实施例4的基因修饰莱茵衣藻细胞(即转化体1、2、3和5,对应图6PCR的孔1、2、3和5)和单独地野生型菌株以250000μJ/cm2暴露于UV一分钟,随后将细胞保持在黑暗中24小时,并且然后在暴露后的多个时间点使用荧光活化细胞分选(FACS),藻红蛋白通道来检查恢复。使用LysoTracker红染料(1μΜ)将细胞中的溶酶体在室温下染色五分钟并且然后测量细胞的平均荧光强度(MFI)并相对于没有暴露于UV的,同样细胞龄和菌株类型的细胞以及根据实施例4在UV暴露之前基因修饰的细胞的MFI进行比较。在藻红蛋白(PE)通道中使用BD FACS ARIA III流式细胞仪分析荧光标记的细胞(使用的荧光探针:LysoTracker RED DND-99;Ex/Em:577/590nm)。
在UV暴露之后第3天发现细胞开始经受失绿(chlorosis)。在UV暴露之后第7天发现几乎所有的细胞白化。在UV暴露之后第14天发现转化体恢复优于野生型菌株。
图8A是在UV暴露后第2天、第4天、第6天、第8天和第10天在FACS中分析的UV处理的样品中叶绿素阳性细胞的百分比的图解比较。图8B是在第2天、第4天、第6天、第8天和第10天在FACS中分析的未处理的样品中叶绿素阳性细胞的百分比的图解比较。图8C是在UV处理后4天对其检查MFI的样品的尼罗红试验而图8D是野生型和转化体中的溶酶体活性的比较。在图8A、8B、8C和8D中,WT=野生型;T=转化体;-=没有UV处理;+=UV处理的。由8A、8B、8C和8D,明显的是UV处理的转化体相比UV处理的野生型细胞具有更高的MFI并且因此示出了更多的自噬活性,同时未处理的转化体相比未处理的野生型细胞也具有更高的MFI,并且因此示出了更多的自噬活性。UV处理的野生型细胞相比未处理的野生型细胞也示出了更高的MFI,同样UV处理的转化体相比未处理的转化体示出了更高的MFI。特别是图8C中的转化体更高的MFI,其中进行了尼罗红试验以测定脂质的量,也表明了转化体中增加的脂质含量。因此,转化体不仅具有增加的生物质,而且还具有增加的脂质含量。
实施例6:
将1×107细胞/ml的实施例4的基因修饰莱茵衣藻(即转化体1、2、3和5,对应图6PCR的孔1、2、3和5)和1×107细胞/ml的单独的野生型菌株使用CL-1000UV交联剂以250000μJ/cm2暴露于UV一分钟,随后将细胞保持在黑暗中24小时。然后使培养物暴露于2000lux的光12小时随后12小时的黑暗。通过在Tecan酶标仪中测量750nm处的光密度和叶绿素A在Ex/Em:432/675nm处的自发荧光在暴露后每日检查恢复。
图9A是未处理的野生型对比转化体的叶绿素A自发荧光的图解比较而图9B是UV处理的野生型对比转化体的叶绿素A自发荧光的图解比较。在UV暴露之后,培养物几乎白化。明显的是从第7天向后,在研究的UV处理的和未处理的样品中,Atg1转化体第1、3、5号相比野生型恢复得更好。图9C是未处理的野生型和转化体在在750nm处的OD的图解比较而图9D是UV处理的野生型和转化体在750nm处的OD、的图解比较。
由上图明显的是在未处理的样本中转化体的生长是更好的或与野生型几乎相当的。在UV处理的样本中,从第9天向后转化体1、3和5的OD高于野生型。因此,在UV应激之后,Atg1转化体恢复得优于野生型。
实施例7:
使实施例4的基因修饰莱茵衣藻细胞(即转化体1、2、3和5,对应图6PCR的孔1、2、3和5)经受盐应激,即2%的盐度。发现在去除盐应激之后4天,转化体在转移至正常条件下时恢复而WT几乎没有恢复。由图10A和图10B明显的是转化体相比野生型在盐应激耐受性上具有明显的优势。
实施例8:
使实施例4的基因修饰莱茵衣藻细胞(即转化体1、2、3和5,对应图6PCR的孔1、2、3和5)经受温度应激(temperature stress),即37℃的温度。发现在持续暴露至温度应激之后6天,转化体在较高的温度下生长更好而野生型看上去较灰白。由图11A和图11B明显的是转化体相比野生型在温度应激耐受性上具有明显的优势。
总之,图12A、图12B和图12C图解地比较了转化体5相对野生型分别在不同的应激,即盐应激、高温应激和高光应激下的生长优势。由图12A明显的是转化体由盐应激恢复并达到生长周期的停滞期(stationary phase)需要约3天更少的时间。此外,根据图12B,转化体在高温下达到生长周期的停滞期需要约3天更少的时间。并且,根据图12C,高光应激在培养物的生长上示出了极少的差异。
由以上实施例,明显的是可以在盐应激下使用LiCl并在UV应激下使用z-vad-fmk用于诱导延长时间段的自噬活性,在微藻类,包括但不限于小球藻和衣藻中诱导自噬。并且,也示出了通过将小球藻Atg1基因克隆入衣藻并通过UV处理短期诱导自噬的自噬诱导。还使用FACS示出,由于其中诱导自噬的细胞的自噬活性增加,溶酶体的数目增加。如在本发明的背景技术中论述的,这种微藻类,在自然条件下已知产生商业感兴趣的产物,并且在应激下在这种微藻类中诱导自噬,特别是延长时间的自噬,得到较高的生物质和脂质含量、脂质、各种生物燃料原料、贮存淀粉、三酰甘油、用于药物的产物,用于营养品的产物、ω脂肪酸等。在本发明中公开的,用于在微藻类暴露于应激下,通过延长微藻类自噬活性更长的时间,诱导自噬和和增强自噬的方法,对于获得在工业规模上在经济上有用的产物是有意义的。
在本文中描述和说明的是本发明的优选实施方式以及它们的一些变化。在本文中使用的术语和描述仅以说明的方式给出而不意味着限制。本领域技术人员应认识到许多变化可以是在本发明的精神和范围内的,其旨在由随附的权利要求和它们的等同物定义,其中除非另外说明,所有的术语意味着它们最广泛的合理含义。
- 还没有人留言评论。精彩留言会获得点赞!