在微生物中产生油的方法与流程
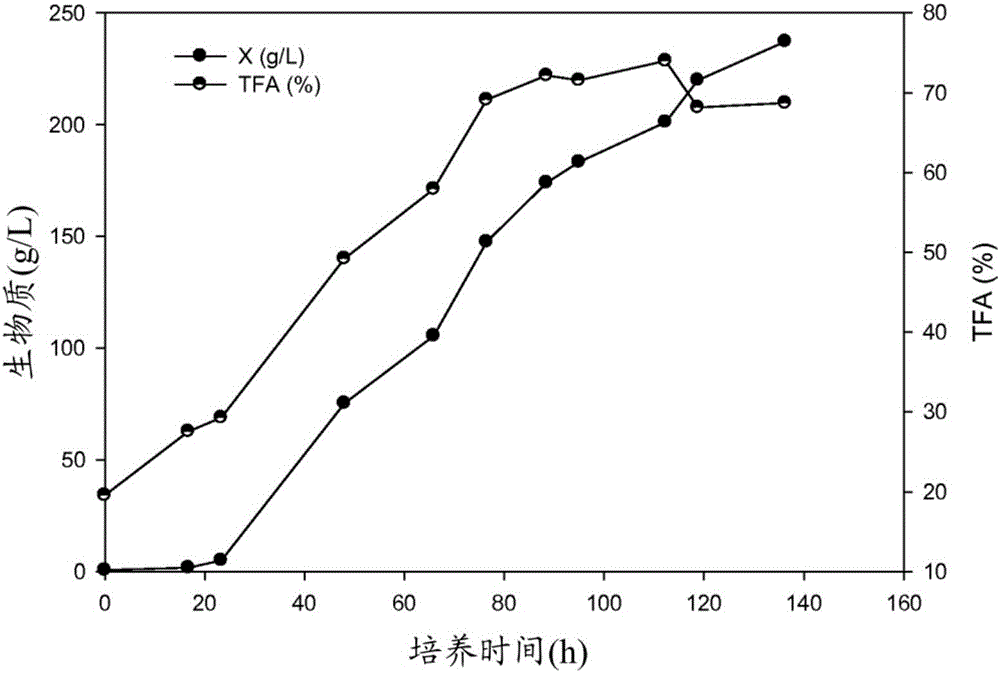
本申请要求2014年5月22日提交的美国临时申请号62/001,912的优先权,所述申请以引用的方式整体并入本文。背景在通过真核微生物的发酵产生油的领域中,某些策略已经被建立并被广泛接受。避免营养物质抑制并实现高细胞浓度的一个这种策略为使用补料分批发酵,其中以增量添加主要底物(主要为碳源),以维持连续供给,同时避免发酵培养基中底物的高浓度。然而,补料分批发酵通常需要底物补料方案的仔细计划以及集中的实时发酵监测和控制,这要求广泛的人力并且可能导致发酵操作的高失败率。与工业规模的发酵相关的另一个显著成本包括与灭菌相关的程序。这些成本包括昂贵的压力容器发酵罐和在线蒸汽灭菌(steam-in-place)系统以及用于产生蒸汽的相关操作成本。概述本文提供了用于产生一种或多种多不饱和脂肪酸的方法。所述方法包括以下步骤:提供能够产生多不饱和脂肪酸的微生物、提供包含高浓度的一种或多种碳源、低pH或两者的培养基以及在所述培养基中在足以产生所述一种或多种多不饱和脂肪酸的条件下培养所述微生物。还提供了减少一种或多种微生物的非无菌培养物的污染的方法。所述方法包括在以下条件下培养所述微生物:(i)在高浓度的一种或多种碳源存在下,(ii)在低pH条件下或(iii)其组合,其中所述培养减少了包含所述微生物的所述非无菌培养物的污染。提供了培养一种或多种微生物的方法。所述方法包括在以第一浓度水平包含第一量的一种或多种碳源的培养基中培养所述微生物、监测碳源浓度,直至所述碳源浓度减小至低于所述第一浓度水平,以及向所述培养基添加第二量的一种或多种碳源以将所述碳源浓度增加至第二浓度水平。附图简述图1为示出在2升(L)发酵期间的ONC-T18细胞浓度(生物量(“X”))和总脂肪酸含量(TFA%)的时间分布的图。图2为示出在5L发酵期间的ONC-T18细胞浓度(生物质(“X”))和总脂肪酸含量(TFA%)的时间分布的图。图3为示出在30L发酵期间的ONC-T18细胞浓度(生物质(“X”))和总脂肪酸含量(TFA%)的时间分布的图。图4为示出在使用相同发酵培养基配方(ONC配方)的平行高葡萄糖发酵期间的ONC-T18和ATCC20888细胞浓度的时间分布的图。图5为示出在使用针对ONC-T18的ONC发酵培养基配方和针对ATCC20888的不同发酵培养基配方的平行高葡萄糖发酵期间的ONC-T18和ATCC20888细胞浓度的时间分布的图。图6为示出在30L高葡萄糖多批次发酵期间的ONC-T18细胞浓度(生物质(“X”))和葡萄糖浓度的时间分布的图。图6和图3示出来自相同的30L发酵的数据。图7为示出pH对ONC-T18在高葡萄糖多批次发酵条件下生长的影响的图。图8为示出在不同pH条件下和使用高葡萄糖多批次发酵生长的ONC-T18的脂肪酸分布的图。图9为示出在低pH条件下的ONC-T18培养物的污染减少的图。详述本文提供了用于产生一种或多种多不饱和脂肪酸的方法。所述方法包括提供能够产生多不饱和脂肪酸的微生物、提供包含高浓度的一种或多种碳源、低pH或两者的培养基以及在所述培养基中在足以产生所述一种或多种多不饱和脂肪酸的条件下培养所述微生物。任选地,所述培养基具有低pH。任选地,所述培养基具有高浓度的一种或多种碳源。任选地,所述培养基具有低pH和高浓度的一种或多种碳源。本文还提供了一种减少包含一种或多种微生物的非无菌培养物的污染的方法。所述方法包括在以下条件下培养所述微生物:(i)在高浓度的一种或多种碳源存在下,(ii)在低pH条件下或(iii)其组合,其中所述培养减少了包含所述微生物的所述非无菌培养物的污染。任选地,所述方法包括在开放容器中培养所述微生物。任选地,所述培养包括在高浓度的一种或多种碳源的存在下培养所述微生物。任选地,所述培养包括在低pH的条件下培养所述微生物。任选地,所述培养包括在高浓度的一种或多种碳源的存在下和在低pH的条件下培养所述微生物。如本文所用,术语“低pH”和“减小的pH”是指低于中性pH的pH值。术语“低pH”通常是指低于4.5的pH值。任选地,低pH是指2至4.5的值(包括端值在内)或在2与4.5之间的任何值。任选地,所述pH为3至3.5。应理解,培养物的pH可随时间改变,即,随发酵过程的进程改变。如本文所用,在低pH的条件下培养所述微生物意味着随时间监测并调整所述培养物或所述培养基的pH,以将所述培养物的pH维持在低pH。如本文所用,短语“高浓度的碳源”是指一定量的至少200g/L的碳源。例如,所述一种或多种碳源的浓度可为至少200g/L或大于200g/L。任选地,所述一种或多种碳源的浓度为200至300g/L。任选地,所述一种或多种碳源的浓度为200至250g/L。应理解,碳源的浓度可随时间改变,即,随发酵过程的进程改变。如本文所用,包含高浓度的碳源的培养基意味着所述培养基包含至少200g/L的碳源。如本文所用,在高浓度的碳源中培养所述微生物意味着在所述培养物或所述培养基中的所述碳源的初始浓度为至少200g/L。如以下更详细地描述,可随时间一次或多次监测所述碳源浓度,并且一旦它达到一定的阈值,就可向所述培养物或所述培养基添加附加量的碳源。在所述情况下,所述附加量的碳源为高浓度的碳源,即,至少200g/L的碳源。因此,提供了一种培养一种或多种微生物的方法。所述方法包括在以第一浓度水平包含第一量的一种或多种碳源的培养基中培养所述微生物、监测碳源浓度,直至所述碳源浓度减小至低于所述第一浓度水平,以及向所述培养基添加第二量的一种或多种碳源以将所述碳源浓度增加至第二浓度水平。任选地,所述一种或多种碳源的所述第一浓度水平和/或所述第二浓度水平大于200g/L。任选地,当所述碳源浓度水平减小至0至20g/L时,向所述培养基添加所述第二量的所述一种或多种碳源。所提供的方法可包括根据需要重复多轮监测和添加碳源。因此,所提供的方法可包括在添加所述第二量的所述一种或多种碳源之后,(a)培养所述微生物,直至所述一种或多种碳源的碳源浓度减小至低于所述第二浓度水平,以及(b)向所述培养基添加第三量的一种或多种碳源,以将所述碳源浓度增加至第三浓度水平。任选地,所述一种或多种碳源的所述第三浓度水平大于200g/L。任选地,当所述碳源浓度减小至0至20g/L时,向所述培养基添加所述第三量的所述一种或多种碳源。任选地,所述方法包括在添加所述第三量的所述一种或多种碳源之后,(a)培养所述微生物,直至所述一种或多种碳源的碳源浓度减小至低于所述第三浓度水平,以及(b)向所述培养基添加第四量的一种或多种碳源,以将所述碳源浓度增加至第四浓度水平。任选地,所述一种或多种碳源的所述第四浓度水平大于200g/L。任选地,当所述碳源浓度减小至0至20g/L时,向所述培养基添加所述第四量的所述一种或多种碳源。任选地,所述第一量、所述第二量、所述第三量和所述第四量的所述一种或多种碳源为相同的。在所提供的方法中,可一次或多次监测所述碳源浓度。任选地,可连续地(例如,使用连续监测培养基中的碳源(例如,葡萄糖)浓度的设备)或周期性地(例如,通过移除培养基的样品并且测试所述样品中的碳源浓度)监测所述碳源浓度。任选地,在添加一定量的所述一种或多种碳源之前和/或之后监测或确定所述碳源浓度。因此,例如,所提供的方法可包括在所述量的所述一种或多种碳源的添加之间一次或多次监测所述碳源浓度。任选地,所提供的方法包括在添加一定量的一种或多种碳源之前、在添加一定量的一种或多种碳源之后监测或确定所述碳源浓度并且在添加另外量的一种或多种碳源之前一次或多次监测或确定所述碳源浓度。通过举例的方式,所提供的方法可包括在添加第一量的所述一种或多种碳源之后监测所述碳源浓度并且任选地,在添加第二量的所述一种或多种碳源之前一次或多次监测所述碳源浓度。所提供的方法可包括在添加所述第二量的所述一种或多种碳源之后监测所述碳源浓度并且任选地,在添加第三量的所述一种或多种碳源之前一次或多次监测所述碳源浓度。所提供的方法可包括在添加所述第三量的所述一种或多种碳源之后监测所述碳源浓度并且任选地,在添加第四量的所述一种或多种碳源之前一次或多次监测所述碳源浓度。任选地,在所提供的方法中,在所述量的所述一种或多种碳源的每个添加之间,监测所述碳源浓度一次。通过举例的方式,在添加所述第一量的所述一种或多种碳源之后并且在添加所述第二量的所述一种或多种碳源之前,监测所述碳源浓度一次。类似地,可在添加所述第二量的所述一种或多种碳源之后并且在添加所述第三量的所述一种或多种碳源之前,监测所述碳源浓度一次。任选地,在添加所述第二量的所述一种或多种碳源之前监测所述碳源浓度一次,不论一定量的所述一种或多种碳源的另外添加数量如何。可通过本领域技术人员已知的任何手段直接或间接监测碳源浓度或水平。任选地,通过测量例如,在所述培养基中的或来自所述培养基的样品中的溶解氧水平来监测所述碳源浓度。任选地,所述监测包括获得所述培养基的样品以及确定所述样品中的所述碳源浓度。任选地,确定所述碳源浓度的步骤包括比色测定、基于酶的测定或荧光测定。任选地,确定碳源浓度的步骤包括高压液相色谱法(HPLC)。I.微生物本文所描述的方法包括从微生物群体中提取脂质。本文所描述的微生物群体可为藻类(例如,微藻)、真菌(包括酵母)、细菌或原生生物。任选地,所述微生物包括破囊壶菌目(orderThraustochytriales)的破囊壶菌(Thraustochytrids),更具体地说,破囊壶菌属(genusThraustochytrium)的破囊壶菌(Thraustochytriales)。任选地,所述微生物群体包括如美国专利号5,340,594和5,340,742中所描述的破囊壶菌(Thraustochytriales),所述专利以引用的方式整体并入本文。所述微生物可为破囊壶菌(Thraustochytrium)种,诸如美国专利号8,163,515中所描述的以ATCC保藏号PTA-6245(即,ONC-T18)保藏的破囊壶菌(Thraustochytrium)种,所述专利以引用的方式整体并入本文。因此,所述微生物可具有与SEQIDNO:1至少95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或更高(例如,包括100%)相同的18srRNA序列。在本文所描述的方法中使用的所述微生物可产生多种脂质化合物。如本文所用,术语脂质包括磷脂、游离脂肪酸、脂肪酸的酯、三酰基甘油、固醇和固醇酯、类胡萝卜素、叶黄素(例如,含氧类胡萝卜素(oxycarotenoids))、碳氢化合物以及本领域普通技术人员已知的其他脂质。任选地,所述脂质化合物包括不饱和脂质。所述不饱和脂质可包括多不饱和脂质(即,包含至少2个不饱和碳-碳键(例如,双键)的脂质)或高度不饱和脂质(即,包含4个或更多个不饱和碳-碳键的脂质)。不饱和脂质的实例包括ω-3和/或ω-6多不饱和脂肪酸,诸如二十二碳六烯酸(即,DHA)、二十碳五烯酸(即,EPA)以及其他天然存在的不饱和、多不饱和以及高度不饱和化合物。II.过程发酵所提供的方法包括根据本领域已知的方法培养微生物的附加步骤或者可与所述步骤结合使用。例如,破囊壶菌(例如,海洋破囊壶菌(Thraustochytriumsp.))可根据美国专利公开US2009/0117194或US2012/0244584中所描述的方法进行培养,所述专利公开以引用的方式整体并入本文。微生物在生长培养基(medium)(也称为“培养基(culturemedium)”)中生长。多种培养基中的任一种可适用于培养本文所描述的微生物。任选地,所述培养基为所述微生物供给各种营养组分,包括碳源和氮源。破囊壶菌培养物的培养基可包含多种碳源中的任一种。碳源的实例包括脂肪酸、脂质、甘油、三甘油、碳水化合物、多元醇、氨基糖以及生物质或废物流中的任一种。脂肪酸包括,例如,油酸。碳水化合物包括但不限于葡萄糖、纤维素、半纤维素、果糖、右旋糖、木糖、乳果糖、半乳糖、麦芽三糖、麦芽糖、乳糖、糖原、明胶、淀粉(玉米或小麦)、醋酸盐、m-肌醇(例如,源自玉米浆)、半乳糖醛酸(例如,源自果胶)、L-岩藻糖(例如,源自半乳糖)、龙胆二糖、葡糖胺、α-D-葡萄糖-1-磷酸(例如,源自葡萄糖)、纤维二糖、糊精、α-环糊精(例如,源自淀粉)以及蔗糖(例如,来自糖蜜)。多元醇包括但不限于麦芽糖醇、赤藓醇以及阿东糖醇。氨基糖包括但不限于N-乙酰基-D-半乳糖胺、N-乙酰基-D-葡糖胺以及N-乙酰基-β-D-甘露糖胺。任选地,所述碳源为葡萄糖。如上所述,在所提供的方法中,所述碳源以高浓度,例如至少200g/L提供。任选地,本文所提供的微生物在增加生物质和/或感兴趣的化合物(例如,油或总脂肪酸(TFA)含量)的产生的条件下进行培养。破囊壶菌,例如,通常在盐水培养基中培养。任选地,可在具有约2.0g/L至约50.0g/L的盐浓度的培养基中培养破囊壶菌。任选地,在具有约2g/L至约35g/L(例如,约18g/L至约35g/L)的盐浓度的培养基中培养破囊壶菌。任选地,本文所描述的破囊壶菌可在低盐条件下生长。例如,可在具有约5g/L至约20g/L(例如,约5g/L至约15g/L)的盐浓度的培养基中培养破囊壶菌。所述培养物培养基任选地包含NaCl。任选地,所述培养基包含天然或人造海盐和/或人造海水。所述培养基可包含含非氯化物的钠盐(例如,硫酸钠)作为钠源。例如,总钠的很大一部分可由非氯化物盐供给,以使得培养基中的总钠的小于约100%、75%、50%或25%由氯化钠供给。任选地,所述培养基具有小于约3g/L、500mg/L、250mg/L或120mg/L的氯化物浓度。例如,在所提供的方法中使用的培养基可具有在约60mg/L与120mg/L之间并且包括约60mg/L和120mg/L的氯化物浓度。适用于根据本发明方法的非氯化物钠盐的实例包括但不限于苏打灰(碳酸钠和氧化钠的混合物)、碳酸钠、碳酸氢钠、硫酸钠及其混合物。参见,例如,美国专利号5,340,742和6,607,900,所述专利的每一个的全部内容以引用的方式并入本文。破囊壶菌培养物的培养基可包含多种氮源中的任一种。示例性氮源包括铵溶液(例如,NH4的H2O溶液)、铵盐或胺盐(例如,(NH4)2SO4、(NH4)3PO4、NH4NO3、NH4OOCH2CH3(NH4Ac))、蛋白胨、胰蛋白胨、酵母提取物、麦芽提取物、鱼粉、谷氨酸钠、大豆提取物、酪蛋白氨基酸以及酒糟。氮源在合适的培养基中的浓度通常在约1g/L与约25g/L之间并且包括约1g/L和约25g/L的范围内。所述培养基任选地包含磷酸盐,诸如磷酸钾或磷酸钠。培养基中的无机盐和微量营养物质可包括硫酸铵、碳酸氢钠、原钒酸钠、铬酸钾、钼酸钠、亚硒酸、硫酸镍、硫酸铜、硫酸锌、氯化钴、氯化铁、氯化锰、氯化钙以及EDTA。可包含维生素,诸如吡哆醇盐酸盐、盐酸硫胺素、泛酸钙、对氨基苯甲酸、核黄素、烟酸、生物素、叶酸以及维生素B12。在适当时,可使用酸或碱和/或使用氮源将培养基的pH调整至在3.0与10.0之间并且包括3.0和10.0的pH。任选地,将所述培养基调整至如上所限定的低pH。可对所述培养基进行灭菌。通常用于培养微生物的培养基为液体培养基。然而,用于培养微生物的培养基可为固体培养基。除如本文所讨论的碳源和氮源之外,固体培养基可包含提供结构支撑并且/或者允许所述培养基呈固体形式的一种或多种组分(例如,琼脂或琼脂糖)。可对细胞进行培养1天至60天的任何时间。任选地,培养进行14天或更少、13天或更少、12天或更少、11天或更少、10天或更少、9天或更少、8天或更少、7天或更少、6天或更少、5天或更少、4天或更少、3天或更少、2天或更少或1天或更少。培养任选地在约4℃至30℃的温度,例如,约18℃至约28℃的温度下进行。培养可包括通气振荡培养、振荡培养、静止培养、分批培养、半连续培养、连续培养、滚动分批培养、波动培养等。可使用常规的搅拌式发酵罐、泡罩塔发酵罐(分批或连续培养)、波动发酵罐等进行培养。可使用多种方法中的一种或多种(包括振荡)对培养物进行通气。任选地,振荡在约100rpm至约1000rpm,例如,约350rpm至约600rpm或约100至约450rpm的范围内。任选地,在生物质产生阶段期间和在脂质产生阶段期间,使用不同的振荡速度对所述培养物进行通气。另选地或除此之外,振荡速度可取决于培养容器的类型(例如,烧瓶的形状或尺寸)而变化。任选地,溶解氧(DO)的水平在生物质产生阶段期间高于其在脂质产生阶段期间的水平。因此,DO水平在脂质产生阶段期间减小(即,DO水平小于溶解氧在生物质产生阶段的量)。任选地,溶解氧的水平减小至低于饱和。例如,溶解氧的水平可减小至非常低或甚至无法检测的水平。可通过根据涉及转变一种或多种培养条件以便获得较高数量的所需化合物的方法培养细胞来提高所需脂质的产生。任选地,首先在使生物质最大化的条件下培养细胞,接着将一个或多个培养条件转变成有利于脂质产生率的条件。所转变的条件可包括氧浓度、C:N比率、温度以及其组合。任选地,进行二阶段培养,其中第一阶段有利于生物质产生(例如使用高氧条件(例如通常或相对于第二阶段)、低C:N比率和环境温度),接着为第二阶段,所述第二阶段有利于脂质产生(例如其中氧被减少,C:N比率增加,并且温度降低)。巴氏灭菌任选地,对所得的生物质进行巴氏灭菌,以使存在于生物质中的不合需要的物质失活。例如,可对生物质进行巴氏灭菌,以使降解化合物的物质失活。生物质可存在于发酵培养基中,或者从发酵培养基中分离用于巴氏灭菌步骤。巴氏灭菌步骤可通过将生物质和/或发酵培养基加热至高温来进行。例如,可将生物质和/或发酵培养基加热至约50℃(并且包括50℃)至约95℃(并且包括95℃)(例如,约55℃(并且包括55℃)至约90℃(并且包括90℃)或约65℃(并且包括65℃)至约80℃(并且包括80℃))的温度。任选地,可对生物质和/或发酵培养基加热约30分钟(并且包括30分钟)至约120分钟(并且包括120分钟)(例如,约45分钟(并且包括45分钟)至约90分钟(并且包括90分钟),或约55分钟(并且包括55分钟)至约75分钟(并且包括75分钟))。可使用本领域技术人员已知的合适的加热手段来进行巴氏灭菌,诸如通过直接蒸汽注入。任选地,不进行巴氏灭菌步骤(即,所述方法缺少巴氏灭菌步骤)。收获和洗涤任选地,可根据本领域技术人员已知的方法来收获生物质。例如,可任选地使用各种常规方法从发酵培养基收集生物质,所述常规方法诸如离心(例如,固体喷射离心机)或过滤(例如,错流过滤),并且还可包括使用沉淀剂(例如,磷酸钠或氯化钙)用于加速细胞生物质的收集。任选地,用水洗涤生物质。任选地,可将生物质浓缩至约20%(并且包括20%)的固体。例如,可将生物质浓缩至约5%(并且包括5%)至约20%(并且包括20%)的固体、约7.5%(并且包括)7.5%至约15%(并且包括15%)的固体或约15%(并且包括15%)的固体至约20%(并且包括20%)的固体,或在所引用范围内的任何百分比。任选地,可将生物质浓缩至约20%固体或更少、约19%固体或更少、约18%固体或更少、约17%固体或更少、约16%固体或更少、约15%固体或更少、约14%固体或更少、约13%固体或更少、约12%固体或更少、约11%固体或更少、约10%固体或更少、约9%固体或更少、约8%固体或更少、约7%固体或更少、约6%固体或更少、约5%固体或更少、约4%固体或更少、约3%固体或更少、约2%固体或更少或约1%固体或更少。分离和提取所提供的方法任选地包括使用本领域技术人员已知的方法从生物质或微生物中分离多不饱和脂肪酸。例如,分离多不饱和脂肪酸的方法在美国专利号8,163,515中进行描述,所述专利以引用的方式整体并入本文。任选地,在分离多不饱和脂肪酸之前,不对培养基进行灭菌。任选地,灭菌包括增加温度。任选地,由微生物产生并且通过所提供的方法分离的多不饱和脂肪酸为中链脂肪酸。任选地,所述一种或多种多不饱和脂肪酸选自由以下组成的组:α亚麻酸、花生四烯酸、二十二碳六烯酸、二十二碳五烯酸、二十碳五烯酸、γ-亚麻酸、亚油酸、亚麻酸以及其组合。III.产品根据本文所描述的方法所产生的多不饱和脂肪酸(PUFA)和其他脂质可用于多种应用中的任一种中,例如,利用其生物或营养性质。任选地,化合物可用于药物、食物补充剂、动物饲料添加剂、化妆品等中。任选地,PUFA和其他脂质用于产生燃料,例如,生物燃料。根据本文所描述的方法所产生的脂质还可用作在产生其他化合物中的中间体。任选地,可将根据本文所描述的方法所产生的脂质掺入到最终产品(例如,食物或饲料补充剂、婴儿代乳品、药物、燃料等)中。用于掺入本文所描述的脂质的合适的食物或饲料补充剂包括饮品诸如牛奶、水、运动饮料、能量饮料、茶、以及果汁;甜食诸如果冻和饼干;包含脂肪的食物和饮品诸如乳制品;经处理的食物产品诸如软米(或粥);婴儿代乳品;早餐谷物等。任选地,可将一种或多种所产生的脂质掺入到膳食补充剂中,例如像复合维生素。任选地,根据本文所描述的方法所产生的脂质可包含在膳食补充剂中,并且任选地可直接掺入到食物或饲料(例如,食物补充剂)的组分中。可将通过本文所描述的方法所产生的脂质掺入到其中的饲料的实例包括宠物食物,诸如猫食物;狗食物等;用于水族箱鱼、养殖鱼或甲壳类动物等的饲料;用于农场饲养动物(包括牲畜和水产养殖的鱼类或甲壳类动物)的饲料。可将根据本文所描述的方法所产生的脂质掺入到其中的食物或饲料材料优选地对于作为预期接受体的生物是可口的。这种食物或饲料材料可具有当前对于食物材料已知的任何物理性质(例如固体、液体、柔软的)。任选地,可将所产生的化合物(例如,PUFA)中的一种或多种掺入到药物中。此类药物的实例包括各种类型的片剂、胶囊、可饮用剂等。任选地,所述药物适于局部施用。剂型可包括例如,胶囊、油、颗粒剂、浓缩细粒剂(granulasubtilae)、散剂(pulveres)、片剂、丸剂、锭剂等。可将根据本文所描述的方法所产生的脂质通过与多种剂中的任一种组合来掺入到本文所描述的产品中。例如,可将此类化合物与一种或多种粘合剂或填充剂组合。在一些实施方案中,产品可包括一种或多种螯合剂、颜料、盐、表面活性剂、保湿剂、粘度调节剂、增稠剂、软化剂、芳香剂、防腐剂等以及其组合。所公开的材料、组合物以及组分可用于所公开的方法和组合物,可与所公开的方法和组合物联用,可用来制备所公开的组合物,或者是所公开的方法和组合物的产品。本文公开了这些材料及其他材料,应理解,若公开了这些材料的组合、分组、相互作用、群组等,而没有明确地具体提及各种个体和集体组合的每一种组合以及这些化合物的排列方式,则每种情况均具体地包括在本发明预想之中并视为得到公开。例如,如果公开并讨论了方法并且讨论了可对包括所述方法的多个分子进行的多种修改,除非明确地相反指示,否则明确涵盖了所述方法的每一种组合和排列以及可能的修改,。同样地,这些分子的任何分组或组合也都具体地包括在本发明的预想之中并视为得到公开。这个概念适用于本公开的所有方面,包括但不限于使用所公开的组合物的方法中的步骤。因此,如果有多种附加步骤可进行,那么应理解,这些附加步骤中的每一个可与所公开的方法的方法步骤的任何具体方法步骤或组合一起实施,并且每种此类组合或组合的子集都在本发明的预想之中并应视为得到公开。本文所引用的出版物以及引用这些出版物所涉及到的材料特此以引用的方式明确地整体并入。以下实施例意图进一步说明本文所描述的方法和组合物的某些方面,并且不意图限制权利要求书的范围。实施例实施例1.用于产生油的微生物的高葡萄糖多批次发酵。在我们的基于ONC-T18的发酵过程开发期间,培养物可在发酵培养基中的极高的葡萄糖浓度(高达250g/L)下存活。所述观察导致了在发酵期间具有有意的高初始葡萄糖浓度和高葡萄糖剂量的发酵过程的开发。因此,如本文所描述,开发了针对微生物的独特的油发酵过程。采用包括在发酵期间的培养基中的高初始葡萄糖浓度(高达250g/L)和高剂量葡萄糖供给的策略,以实现快速的培养物生长和油产生。所述碳源供给策略为由传统的补料分批发酵过程所采用的连续碳补料策略提供更简单但是高效的替代方案。由于高碳底物浓度产生了高渗透压,所以外来生物污染的可能性被极大地减小。所述发酵策略还应用于代表性的藻类油产生菌株裂殖壶菌(Schizochytriumsp)ATCC20888的发酵。然而,在高葡萄糖条件下,无法实现显著的培养物生长。因此,证实了可能是ONC-T18以及一些其他微生物的独特性质适应此类高浓度的碳源。使用相同的培养基组成和葡萄糖供给策略以不同发酵罐尺寸进行ONC-T18的高葡萄糖发酵。所使用的发酵罐为2升(L)、5L和30L,其中工作体积分别为约1.7L、4L和25L。培养基组成和葡萄糖供给策略在以下表1中详细给出。表1.ONC-T18的高葡萄糖多批次发酵期间的培养基组成和葡萄糖供给策略图1至3为示出使用不同发酵罐尺寸的ONC-T18细胞浓度(生物质)和总脂肪酸产生(TFA%)的时间分布的图。与关于在高碳浓度下的各种微生物所报告的相反,ONC-T18能够在这些严苛的生长条件下非常快地生长,并且其生物质可在四至五天的发酵期间增加至230g/L。最终总脂肪含量可达到所测试的发酵的所有规模的70%,满足或超过针对单细胞油发酵的文献中所报告的那些。为了研究在高碳浓度下生长和产生油的能力是否为菌株ONC-T18和高度相关的菌株的独特性质,使用代表性的微藻油产生菌株裂殖壶菌ATCC20888来进行与ONC-T18平行的发酵。在第一个平行发酵实验中,两种菌株在使用与表1中列出的那些培养基配方相同的培养基配方的2L发酵罐中生长,其中ONC-T18发酵罐中的初始葡萄糖浓度为188g/L并且ATCC20888发酵罐中的为193g/L。因为没有发生初始葡萄糖的显著消耗,所以在发酵期间,不向ATCC20888发酵罐中供给附加葡萄糖。如图4所证实,菌株裂殖壶菌ATCC20888不能适应培养基中的如此高的初始葡萄糖浓度,并且因此在总生物质方面几乎没有生长。为了确认ATCC20888不能在高葡萄糖条件下生长不是由于ONC藻类油发酵培养基的特殊组成引起的,在2L发酵罐中进行另一组平行发酵。在此实验期间,仍然使用ONC的培养基配方来培养ONC-T18,同时使用改编自授予Bailey等人的美国专利美国专利号6,607,900的培养基配方来培养ATCC20888,所述专利以引用的方式整体并入本文。由于时间约束,仅提供初始葡萄糖(于ONC-T18发酵罐中的258g/L和于ATCC20888发酵罐中的211g/L),并且在葡萄糖耗尽之前,终止这两种发酵(图5)。尽管使用针对菌株ATCC20888特别研发的培养基配方,但是高初始葡萄糖仍然呈现出对于培养物而言过于严苛的条件而不能显著生长。如由以上发酵已证实,传统补料分批发酵与新开发的发酵过程之间的主要差异在于在发酵开始时以及在发酵进程期间的高葡萄糖浓度。新过程以约200g/L葡萄糖(相比于先前过程的60g/L葡萄糖)和充足量的其他营养物质(例如,呈硫酸铵形式的氮、呈磷酸钾形式的磷)开始。如通过离线样品的快速葡萄糖测定所检测的,一旦葡萄糖耗尽或接近耗尽,就立即添加另一高剂量的葡萄糖,以将发酵培养基中的葡萄糖浓度提高回至约200g/L。因此,在每次高剂量葡萄糖添加之后,在高葡萄糖分批模式下操作发酵。重复葡萄糖添加和分批操作的所述循环,直至油产生达到培养物的生理极限,或者生长/产生被其他发酵条件诸如溶解氧供给限制,所述溶解氧供给由具体发酵系统的设计因素决定。所述碳供给策略极大地简化了藻类油发酵过程的监测和控制。示出对2L至10L的此过程的验证的表2证明了这一点。如表2所示,在一个4至6天的循环情况下,生物质可达到200至230g/L,其中总脂肪酸含量达到约70%。表2.2L至10L培养物的高葡萄糖多批次策略验证。所述高葡萄糖发酵的另一个优点在于由高渗透压所呈现的竞争优势,几乎没有微生物能够承受所述高渗透压,从而产生较少污染。在两种发酵期间,以非无菌形式添加除初始200g/L葡萄糖以外的附加葡萄糖。没有观察到污染。实施例2.用于培养产生油的微生物的非无菌发酵过程。对工业规模发酵的显著成本包括与灭菌相关联的那些。所述成本包括压力容器发酵罐和在线蒸汽灭菌系统的花费以及与产生蒸汽相关联的操作成本。一种减少这些成本的方式为在非无菌条件下发酵培养物。然而,由于培养物污染(例如,由细菌引起),所以非无菌条件对多数微生物是有问题的。为了研究ONC-T18和类似微生物可在其中生长的非无菌条件,制备没有酵母提取物或大豆蛋白胨的培养基。表3列出了培养基组分。使用氢氧化钠(5N)将pH在整个发酵中控制为4.5。在发酵期间不对温度进行控制,并且使用75%的葡萄糖补料。表3.初始培养基组分。除控制pH的NaOH和磷酸之外,不对发酵进行其他添加。成分量(每升)Himedia酵母提取物0g/LHimedia大豆蛋白胨0g/L初始葡萄糖60g/LNaCl9g/L硫酸铵20g/L磷酸二氢钾2g/L硫酸镁4g/L氯化钙(溶液)0.5ml/LFeCl36H2O(溶液)0.5ml/LTES(溶液)1.5ml/L维生素(溶液)3ml/L用没有喷射器的硅胶管供给空气。叶轮为LightninA310式水翼(轴流)。开顶容器为去除顶部的瓶子。用BiostatB(Sartorius公司,Bohemia,NY)上的SartoriusPH控制系统控制pH。没有温度控制。发酵期间内的脂肪积累速率为0.5g/L/h并且DHA积累速率为0.23g/L/h。结果在表4中示出。表4.开顶发酵的最终结果。时间(小时)生物质(g/L)总脂肪酸(g/L)DHA(g/L)161.41397938在500L试验规模运行期间,在第8记录小时检测到细菌污染。通过PCR确定污染为芽孢杆菌属(genusBacillus)。培养基组分在表5中示出。表5.培养基组分。成分量(每升)Himedia大豆蛋白胨10g/L初始葡萄糖60g/LNaCl9g/L硫酸铵10g/L磷酸钾2.2g/L磷酸钾2.4g/L硫酸镁4g/L氯化钙(溶液)0.5ml/LFeCl36H2O(溶液)0.5ml/LTES(溶液)1.5ml/L维生素(溶液)3ml/L使用血细胞计数器对细菌进行计数,并且将其浓度计算成单位为细胞数/ml培养基。当pH下降至3.3时,细菌群体停止增加。然而,甚至在该低pH下,ONC-T18的培养物继续生长,如图9所示。结果在表6中示出。应注意,如果此实验在pH3.3而不是在pH6.5下开始,那么将不会观察到细菌污染。表6来自发酵测定的最终结果。时间(小时)生物质(g/L)总脂肪酸(g/L)DHA(g/L)19814810334然后测试不同pH值对微生物的影响,具体地说,在6.5、4.5和3.2的pH值下。ONC-T18甚至在非常酸性条件下表现很好。结果在图7和8中示出。使用如实施例1所描述的高葡萄糖多批次补料策略进行图7和8的发酵。因此,本文证实了ONC-T18和类似微生物可在高胁迫条件(例如,高葡萄糖(以及因此高渗透压)和/或低pH)下发酵或生长,以便减小油产生的成本并且减少污染。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1