原始肠内胚层细胞及其制作方法与流程
【
技术领域:
】本发明涉及原始肠内胚层细胞及其制作方法,更具体而言,涉及能分化为肝细胞、胰腺细胞及肠细胞的内胚层细胞及其制作方法。
背景技术:
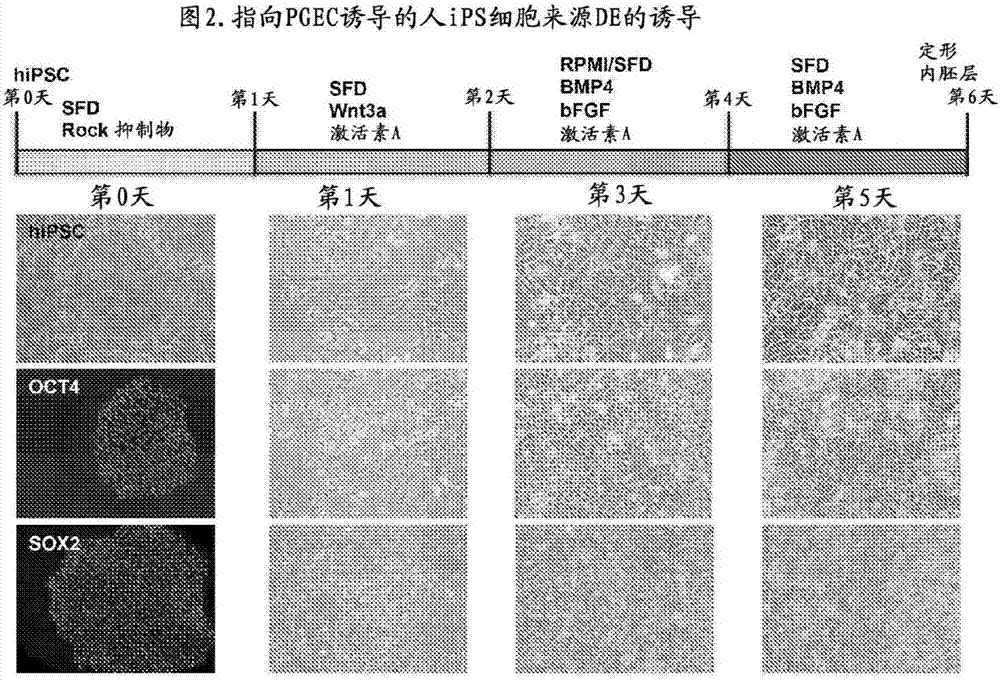
:近年,关注利用自ips/es细胞等的多能性干细胞诱导的组织-器官而开发新的药品的药物开发筛选或补救丧失的器官的功能的再生医疗实现化(takebe,etal.nature,499:481-484,2013(非专利文献1)、wo2013/047639:组织及器官的制作方法(专利文献1))。为了实现对于使用人ips细胞的肝疾病的再生治疗,“超大量”的人肝细胞的gmp等级的制造技术变得必要。例如,为了使人成体肝脏的约30%的功能替代成为可能,对于1名患者,作为肝细胞数,移植6×1010个细胞植活是必须条件。一方面,对于这些超大量的人肝细胞制造,在通过由既有的现有技术的分化诱导流程尝试细胞调制时,如果考虑到移植效率,则1人的肝移植待机患者的治疗需要约95亿日元的莫大的成本,由我们的成本试算确证。【现有技术文献】【非专利文献】非专利文献1:takebe,etal.nature,499:481-484,2013【专利文献】专利文献1:wo2013/047639a1技术实现要素:【发明要解决的技术课题】对于肝疾病的再生治疗费用的大部分是从人ips细胞的分化诱导所要求的细胞因子等的分化诱导因子,所以以大幅的成本削减作为目的,作为在自人ips细胞向器官细胞的分化过程中极重要的中间阶段,设定“原始肠内胚层细胞(pgecs)”被认为是极有利的战略。即,由分化诱导期间大幅缩短,每分化诱导的偏差最小化等,成为用于廉价稳定并且大量地诱导人器官细胞的技术基盘。作为解决这样的技术性障碍的方法,近年,尝试了以下的3个方法。(1)自ips细胞诱导的内胚层前体细胞(cellstemcell.2012apr6;10(4):371-84.、wo2012178215a1)、(2)前肠内胚层细胞(stemcellreport,vol1,293-306,2013)、(3)由直接重编程得到的多能性内胚层细胞(nature508,93-97,2014)。是扩增由各(1)~(3)的方法制作的中间阶段的细胞,在功能细胞的分化诱导中使用的方法。但是,在(1)中,由于以小鼠细胞作为饲养者使用,难以临床应用。从在(2)中,从扩增的细胞诱导的细胞的分化功能显著地低,在(3)的方法中,扩增的细胞的安全性成为课题,即,确认cxcr4等的转移等的与癌的恶性度有关系的标志物表达等的问题来看,在各细胞中,难以在医疗-产业应用中使用是现状。本发明以解决这些现有技术的问题作为目的。【解决课题的技术方案】本发明人经锐意努力的结果,确立在上述(1)、(3)的细胞和(2)的细胞的中间阶段的“原始肠内胚层细胞(原始肠内胚层细胞:pgecs)”的诱导。再者,在使它们的细胞扩增之后,成功向功能细胞分化诱导。本发明的原始肠内胚层细胞(pgecs)能向肝细胞、胰腺细胞及肠细胞的分化(分化功能高)(对于上述(2)的细胞的显著性)、不表达cxcr4等的与癌的恶性度相关的标志物(安全性高)(对于上述(3)的细胞的显著性)、再者,由于可不使用饲养细胞调制,具有临床应用容易(对于上述(1)的细胞的显著性)的显著性。本发明的要点如下。(1)使多能性干细胞分化之后,在实施至少1次以上传代之后诱导的细胞,其中,作为未分化(多能性)细胞标志物的nanog,oct4,myc,lin28a是阴性,作为内胚层细胞标志物的cxcr4,cer1,hhex,gata4是阴性,作为肠内胚层细胞标志物的cdx2,hoxb9是阳性,再者,作为间充质细胞标志物的brachyury(t)是阴性,作为胰腺细胞标志物的pdx1是阴性,所述细胞可至少分化为肝细胞、胰腺细胞及肠细胞。(2)(1)所述的细胞的制作方法,其包括在第1阶段,在rock抑制物的存在下,在第2阶段,在激活素a及wnt3a的存在下,在第3阶段,在bmp4、bfgf、vegf及激活素a的存在下,在第4阶段,在bmp4、bfgf、vegf及激活素a的存在下,将多能性干细胞在饲养细胞非存在下培养而使分化之后,实施至少1次以上传代。(3)(1)所述的细胞的扩增方法,其包括传代后的第1阶段或传代初日在rock抑制物的存在下,其后在sfd、fgf2、vegf、egf、a83-01及chir99021的存在下培养。(4)器官细胞的制作方法,其包括使(1)所述的细胞向器官细胞分化诱导。(5)将(1)所述的细胞在任意的阶段冷冻-保存,构建用于制造器官细胞的工作细胞库的方法。【发明效果】从人ips细胞将与分化中途阶段相当的pgecs在非饲养者环境下分化诱导变得可能。此pgecs能大量调制,可使用此细胞而制造器官原基(takebe,etal.nature,499:481-484,2013)。诱导的pgecs是在以往方法中必须的饲养细胞非存在下,也能进行20次以上传代培养而扩增至1010倍的细胞。再者,被扩增的细胞能由冷冻保存的贮存。再者,有向肝细胞、胰腺细胞、肠道细胞等的各种各样的功能细胞的分化能力的pgecs在重复在以往方法中成为课题的传代之后,也向有高的功能的功能细胞分化诱导。本说明书包含作为本申请的优先权的基础的日本国专利申请、特愿2014-248694的说明书及/或附图中记载的内容。【附图说明】【图1】显示人ips细胞来源原始肠内胚层细胞(pgecs)的诱导-扩增-分化法的概要。由本发明扩增的细胞,相比称为定形内胚层或内胚层祖细胞的细胞,是作为(向肠道系统)分化的更下游的细胞的称为原始肠内胚层细胞(pgec)的细胞。本细胞是能分化为来源于内胚层的全部的细胞的细胞。在细胞名(人ipsc/esc,内胚层祖细胞(ep)/定形内胚层(de)、pgecs)的下或右,记载该细胞表达的标志物的种类。【图2】显示从人ips细胞未夹传代的pgec的初期分化诱导过程和细胞的形态学观察。【图3】显示由rock抑制剂的添加,进行传代时的细胞的粘接-植活大幅地改善。【图4】对于pgec传代后的维持及增殖有效的细胞因子-添加因子组合的探讨。m1~8表示条件的差异。与图5的结果一并,显示m2的条件有效。【图5】左图显示在m1~8中的基因表达量的比较,右图显示细胞增殖数的定量结果。显示在细胞良好地增殖的m2,m4,m6~8的条件之中,作为pgec标志物的cdx2表达增强,cxcr4,cer1的表达降低的条件是m2。【图6】显示对在传代第1~20次、及传代第5次的细胞的形态学变化进行显微镜观察的结果,长期继续传代之后也维持细胞的形态。【图7】在传代第10次中进行长期冷冻保存,解冻而继续细胞培养之后的形态观察的结果。显示解冻后重复传代20次之后也维持细胞的形态。【图8】显示人ips细胞来源pgecs的增殖曲线(图8、左)和细胞倍增时间(图8、右)。【图9】显示在传代前(p0)及传代后(p5,10,15,20)的人ips细胞来源pgec标志物的表达基因的解析的结果。【图10】显示在传代前(p0)及传代后(p5,15)的人ips细胞来源pgecs的facs经时解析的结果。【图11】显示在传代前(p0)及传代后(p1,10,15)的人ips细胞来源pgecs的免疫学解析的结果。【图12】显示在传代后(p5,10,15)的人ips细胞来源pgecs的免疫学解析的结果。【图13】显示人ips细胞来源pgecs的主成分解析的结果。【图14】显示人ips细胞来源pgecs的阶层的聚类解析的结果。【图15-1】显示对扩增的人ips细胞来源pgec(p6)阶段性地进行分化诱导的肝细胞的形态变化(图15-1、上段)和肝细胞分化标志物的表达基因的解析的结果(图15-1、下段)。【图15-2】对扩增的人ips细胞来源pgec(p6)进行分化诱导的肝细胞的弱扩大像。显示诱导广义上示均一的形态的成熟肝细胞。【图16】显示从人ips细胞来源pgecs分化诱导的肝细胞(pgec-mh)的免疫学解析的结果(上段、左)、icg试验、pas染色的结果(上段、右)、肝细胞分化标志物的表达(qpcr)。【图17-1】显示从人ips细胞来源pgecs分化诱导的肝细胞(pgec-mh)的传代后(p2,4,6,9)的形态学观察。【图17-2】显示从人ips细胞来源pgecs分化诱导的肝细胞(pgec-mh)的传代后(p3,5)的微阵列解析的结果(左)及从人ips细胞来源pgecs分化诱导的肝细胞(pgec-mh)的传代前(p0)及传代后(p5,10)的alb分泌能。【图18】显示从人ips细胞来源pgecs阶段性地诱导的胰腺细胞的形态学解析的结果。【图19】显示从人ips细胞来源pgecs分化诱导的胰腺细胞的免疫染色的结果。【图20】显示从人ips细胞来源pgecs分化诱导的胰腺细胞的表达基因的解析的结果。【图21】显示使用pgec的肠组织的阶段性诱导的方法的概要。【图22】显示从pgec诱导的肠组织的照片。【图23】对pgec(p1往后)具有特异性的阳性-阴性标志物基因的提取。显示对人ips细胞来源pgecs第1次传代往后的特异性标志物的表达量进行相对定量。阳性的用红色表示、阴性的用绿色表示。【图24】从各种各样的ips克隆的原始肠内胚层细胞(pgec)的建立。a:诱导的原始肠内胚层细胞(第0代的第5天)的显微镜观察像。作为在诱导中使用的ips细胞,使用1231a3-、1383d2-、1383d6-、ff-01-、ff-06-的5种不同的克隆。b:ips克隆每的增殖曲线。来源于全部的克隆的pgec能进行至少20次以上传代-扩增。【图25】进行移植的pgec的内胚层组织再构建能。a:摘出移植1个月后的组织的结果,确认不到称为明显的奇形肿或癌等的肿瘤的形成。黑虚线:pgec来源的组织。b:免疫组织化学染色的结果,pgec来源的组织形成各种各样的人内胚层来源组织。即,显示形成被肝脏-胰腺-肠道的标志物染色的组织。比例尺=50μm。【图26】pgec来源的肝芽的长期培养后功能表达的探讨。a:体外制成的pgec来源肝芽的显微镜观察。比例尺=50μm。b:pgec来源肝芽的白蛋白分泌能。人白蛋白从由hcm/egm的分化诱导第4天的阶段起检测。再者得知,与用pgec单独进行细胞块培养(仅回收pgec,以5×105个细胞/孔/24孔板的密度向呈细胞在底部集合的形状的低粘接性的培养皿接种细胞之后,培养数天而得到的组织)的组织比较,显示显著地高的白蛋白分泌能力。再者,在培养基条件不是hcm/egm,而是使用ko-dmem/egm时确认不到白蛋白分泌。【图27】进行分化诱导的pgec来源肝芽的氨代谢功能。得知进行分化诱导的pgec来源肝芽有显著的氨代谢功能。【图28】对于剧症肝功能衰竭模型的由pgec来源肝芽移植的治疗效果。在移植pgec来源细胞块或肝芽的组中确证,与非移植组比较生存率改善。【图29】由免疫组织化学染色的向肝细胞-胆管上皮细胞的分化诱导的确认。a:在移植1个月时间点形成的pgec来源肝芽移植组织是血管化的组织。另外,确认不到疑似奇形肿或恶性肿瘤的所见。b:从免疫组织化学染色的结果确证,形成了对人核特异性抗原、人白蛋白(肝细胞)、人ck7(胆管上皮细胞)、人cd31(血管)示染色性的肝组织。比例尺=50μm。【实施方式】以下,详细地说明本发明。本发明提供在使多能性干细胞分化之后,实施至少1次以上传代之后诱导的细胞,其中,作为未分化(多能性)细胞标志物的nanog,oct4,myc,lin28a是阴性,作为内胚层细胞标志物的cxcr4,cer1,hhex,gata4是阴性,作为肠内胚层细胞标志物的hoxb5,hoxb6,hoxb7,hoxb8,cdx2,hoxa9,hoxb9,hoxc9是阳性,再者,作为间充质细胞标志物的brachyury(t)是阴性,作为胰腺细胞标志物的pdx1是阴性,所述细胞可至少分化为肝细胞、胰腺细胞及肠细胞(以下,在本说明书中,也记作原始肠内胚层细胞、原始肠内胚层细胞、pge或pgecs)。本发明的细胞(pgecs)在使多能性干细胞分化之后,实施至少1次以上传代之后诱导。多能性干细胞是指潜在具有分化为生物体的各种各样的组织的能力(分化万能性)的细胞,具体而言,是指能分化为内胚层、中胚层、外胚层的全部的细胞,可例示人工多能性干细胞(ips细胞)、胚胎干细胞(es细胞)等,但不限于这些。多能性干细胞可为人来源的,也可为人以外的动物、例如,小鼠、大鼠、狗、猪、猴、绵羊、牛、鸟等的动物来源的。为使多能性干细胞分化,在第1阶段,在rock抑制物的存在下,在第2阶段,在激活素a及wnt3a的存在下,在第3阶段,在bmp4、bfgf、vegf及激活素a的存在下,在第4阶段,在bmp4、bfgf、vegf及激活素a的存在下,将多能性干细胞在饲养细胞非存在下培养即可,例如,以培养初日作为第0天,在第0天,在rock抑制物的存在下,在第1天,在激活素a及wnt3a的存在下,在第2天-第3天,在bmp4、bfgf、vegf及激活素a的存在下,在第4天-第5天,在bmp4、bfgf、vegf及激活素a的存在下,在饲养细胞非存在下培养多能性干细胞即可,分化的方法不限于此方法。另外,作为培养基,使用sfd培养基、rpmi培养基、其组合等即可。实施至少1次以上传代。传代次数(passagenumber)只要得到本发明的细胞(pgecs),就不特别限定,优选为1~30次,更优选为1~20次。使多能性干细胞分化之后,开始传代的时机在细胞占培养皿的比例(汇合)达80~90%左右的状态之时即可。此状态是用facs进行解析,则如图10一样,称为c-kit、cxcr4的抗原大致(80%以上)阳性的细胞集团。但是,本发明人取c-kit、cxcr4呈阴性的的也进行综合传代的方法(过程单纯-简便)、无进行分离的必要性的点也是本方法的有利的点。传代用向sfd添加a83-01、chir、vegf、egf、fgf2的培养基进行即可,不限于此培养基。传代之后观察到,cdx2、hoxb9等的hox基因组被诱导。细胞的培养用37℃,5%co2的培养用温育器进行即可。作为本发明的实施的实施方式,例如,对向sfd培养基(1.5-2ml、优选为,2ml)添加rock抑制物(1-20μm、优选为,10μm)的培养基接种多能性干细胞(2~6×105个)(第0天)、培养1天之后,用向sfd培养基(1.5-4ml、优选为,2ml)添加wnt3a(1-100ng/ml、优选为,50ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换(第1天)、再者培养1天。接下来,用将sfd培养基和rpmi1640培养基以1:1~1:10(优选为,1:9)的比例混合,向该培养基添加bmp4(0.5-4ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(5-50ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第2天-第3天)。其后还用向sfd培养基(1.5-2ml、优选为,2ml)添加bmp4(0.5-5ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第4天-第5天)。以培养后的细胞作为p0细胞(第0代),进行传代。例如,向pge维持培养基接种p0细胞(500~4×105个、优选为,1×105个),其后,每3~4天进行1次培养基更换。pge维持培养基是向sfd培养基(1.5-2ml、优选为,2ml)添加fgf2(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)、egf(10-40ng/ml、优选为,20ng/ml)、a83-01(0.1-1μm、优选为,0.5μm)、chir99021(1-5μm、优选为,3μm)的培养基。作为本发明的别的实施的实施方式,例如,对向b27(2%)添加rpmi/1640培养基(1.5-2ml、优选为,2ml)添加rock抑制物(1-20μm、优选为,10μm)的培养基接种多能性干细胞(2~6×105个)(第0天)、培养1天之后,用向b27(2%)添加rpmi/1640培养基(1.5-4ml、优选为,2ml)添加wnt3a(1-100ng/ml、优选为,50ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换(第1天)、再者培养1天。接下来,用向添加了b27(2%)的rpmi/1640培养基(1.5-4ml、优选为,2ml)添加bmp4(0.5-4ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(5-50ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第2天-第3天)。其后还用向sfd培养基(1.5-2ml、优选为,2ml)添加bmp4(0.5-5ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第4天-第5天或第4天)。以培养后的细胞作为p0细胞(第0代),进行传代。例如,向pge维持培养基接种p0细胞(500~4×105个、优选为,1×105个),其后,每3~4天进行1次培养基更换。pge维持培养基是向sfd培养基(1.5-2ml、优选为,2ml)添加fgf2(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)、egf(10-40ng/ml、优选为,20ng/ml)、a83-01(0.1-1μm、优选为,0.5μm)、chir99021(1-5μm、优选为,3μm)的培养基。本发明的细胞(pgecs)是,作为未分化(多能性)细胞标志物的nanog,oct4,myc,lin28a是阴性,作为内胚层细胞标志物的cxcr4,cer1,hhex,gata4是阴性,作为肠内胚层细胞标志物的cdx2,hoxb9是阳性,再者,作为间充质细胞标志物的brachyury(t)是阴性,作为胰腺细胞标志物的pdx1是阴性。此外,优选作为肠内胚层细胞标志物的hoxb5、hoxb6、hoxb7、hoxb8、hoxa9及hoxc9是阳性,作为间充质细胞标志物的pdgfra是阴性,作为肝细胞标志物的alb是阴性。本发明的细胞(pgecs)可分化为肝细胞、胰腺细胞、肠细胞等的器官细胞。向肝细胞、胰腺细胞或肠细胞的分化诱导可用后述的实施例中记载的方法实施。器官细胞是肝细胞时,例如,可在fbs、hgf、osm及dex的存在下培养本发明的pgecs而向肝细胞分化诱导(参照后述的实施例)。器官细胞是胰腺细胞时,例如,可在l-谷氨酰胺、葡萄糖、抗坏血酸、sb431542、2-m胰岛素及烟酰胺的存在下培养本发明的pgecs而向胰腺细胞分化诱导(参照后述的实施例)。器官细胞是肠细胞时,例如,可在b27、r-反应蛋白1、头蛋白及egf的存在下培养本发明的pgecs而向肠细胞分化诱导(参照后述的实施例)。本发明的细胞(pgecs)能冷冻保存。冷冻保存的时机无特别限定,优选为,传代次数1~20次之后,更优选为,传代次数2~10次之后。基于一般的细胞冷冻-解冻的方法即可是本细胞的益处,但特别是,迅速地进行在与保存用溶剂混合之后至冷冻的作业、及,融解保存后的冷冻细胞时的操作是重要的。本发明的细胞(pgecs)由于能冷冻保存,在制造在临床-药物开发应用中使用的来源于内胚层的细胞-组织-器官时,能作为工作细胞库的利用。从而,本发明提供将pgecs细胞在任意的阶段冷冻-保存,构建用于制造器官细胞的工作细胞库的方法。为了制作本发明的细胞(pgecs),在第1阶段,在rock抑制物的存在下,在第2阶段,在激活素a及wnt3a的存在下,在第3阶段,在bmp4、bfgf、vegf及激活素a的存在下,在第4阶段,在bmp4、bfgf、vegf及激活素a的存在下,将多能性干细胞在饲养细胞非存在下培养而使分化之后,实施至少1次以上传代即可,例如,以培养初日作为第0天,在第0天,在rock抑制物的存在下,在第1天,在激活素a及wnt3a的存在下,在第2天-第3天,在bmp4、bfgf、vegf及激活素a的存在下,在第4天-第5天,在bmp4、bfgf、vegf及激活素a的存在下,在饲养细胞非存在下培养多能性干细胞而使分化之后,实施至少1次以上传代即可,本发明的细胞(pgecs)的制作方法不限于此方法。另外,作为培养基,使用sfd培养基、rpmi培养基、其组合等即可。对于传代如前所述。细胞的培养用37℃,5%co2的培养用温育器进行即可。作为本发明的实施的实施方式,例如,对向sfd培养基(1.5-2ml、优选为,2ml)添加rock抑制物(1-20μm、优选为,10μm)的培养基接种多能性干细胞(2~6×105个)(第0天)、培养1天之后,用向sfd培养基(1.5-4ml、优选为,2ml)添加wnt3a(1-100ng/ml、优选为,50ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换(第1天)、再者培养1天。接下来,用将sfd培养基和rpmi1640培养基以1:1~1:10(优选为,1:9)的比例混合,向该培养基添加bmp4(0.5-4ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(5-50ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第2天-第3天)。其后还用向sfd培养基(1.5-2ml、优选为,2ml)添加bmp4(0.5-5ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第4天-第5天)。以培养后的细胞作为p0细胞(第0代),进行传代。例如,向pge维持培养基接种p0细胞(500~4×105个、优选为,1×105个),其后,每3~4天进行1次培养基更换。pge维持培养基是向sfd培养基(1.5-2ml、优选为,2ml)添加fgf2(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)、egf(10-40ng/ml、优选为,20ng/ml)、a83-01(0.1-1μm、优选为,0.5μm)、chir99021(1-5μm、优选为,3μm)的培养基。作为本发明的别的实施的实施方式,例如,对向添加了b27(2%)的rpmi/1640培养基(1.5-2ml、优选为,2ml)添加rock抑制物(1-20μm、优选为,10μm)的培养基接种多能性干细胞(2~6×105个)(第0天)、培养1天之后,用向添加了b27(2%)的rpmi/1640培养基(1.5-4ml、优选为,2ml)添加wnt3a(1-100ng/ml、优选为,50ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换(第1天)、再者培养1天。接下来,用向添加了b27(2%)的rpmi/1640培养基(1.5-4ml、优选为,2ml)添加bmp4(0.5-4ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(5-50ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第2天-第3天)。其后还用向sfd培养基(1.5-2ml、优选为,2ml)添加bmp4(0.5-5ng/ml、优选为,2ng/ml)、bfgf(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)及激活素a(50-150ng/ml、优选为,100ng/ml)的培养基进行培养基更换,培养2天(第4天-第5天或第4天)。以培养后的细胞作为p0细胞(第0代),进行传代。例如,向pge维持培养基接种p0细胞(500~4×105个、优选为,1×105个),其后,每3~4天进行1次培养基更换。pge维持培养基是向sfd培养基(1.5-2ml、优选为,2ml)添加fgf2(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)、egf(10-40ng/ml、优选为,20ng/ml)、a83-01(0.1-1μm、优选为,0.5μm)、chir99021(1-5μm、优选为,3μm)的培养基。另外,为了扩增本发明的细胞(pgecs),传代后的第1阶段或传代初日在rock抑制物的存在下,其后在sfd、fgf2、vegf、egf、a83-01及chir99021的存在下培养即可,例如,以传代后的培养初日作为第0天,在第0天,在rock抑制物的存在下,其后通过在sfd、fgf2、vegf、egf、a83-01及chir99021的存在下培养,扩增即可,本发明的细胞(pgecs)的扩增方法不限于此方法。细胞的培养用37℃,5%co2的培养用温育器进行即可。作为本发明的实施的实施方式,例如,以传代后的培养初日或传代初日作为第0天,向添加了rock抑制物(1-100μm、优选为,10μm)的pge维持培养基接种pgec细胞(500~4×105个、优选为,1×105个)(第0天)、次日用pge维持培养基进行培养基更换。每3~4天进行1次培养基更换。pge维持培养基是向sfd培养基(1.5-2ml、优选为,2ml)添加fgf2(5-10ng/ml、优选为,5ng/ml)、vegf(8-20ng/ml、优选为,10ng/ml)、egf(10-40ng/ml、优选为,20ng/ml)、a83-01(0.1-1μm、优选为,0.5μm)、chir99021(1-5μm、优选为,3μm)的培养基。为了制作及/或扩增本发明的细胞(pgecs),在凝胶等的支持体上进行培养即可。作为支持体,优选使用稀释30倍基质胶,但不限于此。作为其他支持体,例如,可例示层粘连蛋白及其衍生物、玻连蛋白、琼脂糖凝胶、丙烯酰胺凝胶、水凝胶、胶原凝胶、氨基甲酸酯凝胶等。另外,本发明也提供使用本发明的细胞(pgecs)制作肝细胞、胰腺细胞、肠细胞等的器官细胞的方法。向肝细胞、胰腺细胞或肠细胞的分化诱导可用后述的实施例中记载的方法实施。器官细胞是肝细胞时,例如,可在fbs、hgf、osm及dex的存在下培养本发明的pgecs而向肝细胞分化诱导(参照后述的实施例)。器官细胞是胰腺细胞时,例如,可在l-谷氨酰胺、葡萄糖、抗坏血酸、sb431542、2-m胰岛素及烟酰胺的存在下培养本发明的pgecs而向胰腺细胞分化诱导(参照后述的实施例)。器官细胞是肠细胞时,例如,可在b27、r-反应蛋白1、头蛋白及egf的存在下培养本发明的pgecs而向肠细胞分化诱导(参照后述的实施例)。本发明的细胞(pgecs)也可向肝细胞、胰腺细胞及肠细胞以外的器官细胞、例如,肺细胞、甲状腺细胞、消化管分泌腺细胞、腹膜细胞、胸膜细胞、喉头细胞、耳管-气管-支气管细胞、尿路细胞分化。为了从本发明的细胞分化诱导器官细胞,将本发明的细胞在凝胶等的支持体上培养即可。作为支持体,在尝试在平面的分化诱导时,优选使用稀释30倍基质胶,在尝试由立体器官原基制作的分化诱导时,优选使用凝胶(例如,原液稀释~4倍基质胶(注册商标)、琼脂糖凝胶、丙烯酰胺凝胶、水凝胶、胶原凝胶、氨基甲酸酯凝胶等),不限于此。从本发明的细胞分化诱导的器官细胞除了功能性高之外,还除了是从以往的多能性干细胞分化诱导的之外,均质性也极高(参照后述的实施例)。可使用从本发明的细胞(pgecs)制作的器官细胞而制作组织或器官。例如,将从本发明的细胞(pgecs)制作的器官细胞与血管内皮细胞及间充质细胞共培养,制作器官芽,通过将其移植到生物体内,可制作组织或器官(takebe,etal.nature,499:481-484,2013(非专利文献1)、wo2013/047639:组织及器官的制作方法(专利文献1))。【实施例】以下,由实施例进一步详细地说明本发明。〔实施例1〕从ips细胞扩增pgec的方法〔实验方法〕将在基质胶包被上培养的ips细胞(从脐带独自建立的ips细胞、及tkda3(由东京大学提供))由accutase剥离回收。使用向sfd培养基添加rock抑制物(10μm)的培养基向进行基质胶包被的6孔板接种2~6×105个细胞/孔,培养1天。培养后,用向sfd培养基添加wnt3a(50ng/ml)及激活素a(100ng/ml)的培养基进行培养基更换,再者培养1天。接下来,用将sfd培养基和rpmi1640培养基以1:9的比例混合,向该培养基添加bmp4(0.5ng/ml)、bfgf(5g/ml)、vegf(10ng/ml)及激活素a(100ng/ml)的培养基进行培养基更换,培养2天。其后还用向sfd培养基添加bmp4(0.5ng/ml)、bfgf(5ng/ml)、vegf(10ng/ml)及激活素a(100ng/ml)的培养基进行培养基更换,培养2天。以培养后的细胞作为pgep0,用pge维持培养基进行传代。用accutase剥离pgep0的细胞,回收p0细胞。将回收的细胞的2/3量的细胞使用添加rock抑制物(10μm)的pge维持培养基接种到基质胶包被的6孔板上。次日,再回收细胞,使用添加rock抑制物(10μm)的pge维持培养基60mm向皿全量接种。次日观察细胞,当细胞在80%汇合以下时,用pge维持培养基进行培养基更换,当细胞在80%汇合以上时,进行传代。传代至p5优选以1/3~1/2的比例进行传代。当增殖快速时,其以下也可。传代时使用向包被基质胶的皿添加rock抑制物(10nm)的pge维持培养基而接种细胞,次日用pge维持培养基进行培养基更换。培养基更换每3~4天进行1次。向100mm皿以3×105个细胞/皿接种,则在3~4天达到汇合。但是,传代的时机则是一边确认此时的细胞的状态,一边使时机最适化。※需要说明的是,上述在pge分化诱导及肝脏分化诱导中使用的试剂示于以下的表1~3。【表1】在pge分化诱导及肝脏分化诱导中使用的试剂一览【2.对于pge分化诱导及维持必要的培养基的调制】调制对于pge分化诱导及pge维持必要的基础培养基(以下sfd培养基)及pge维持培养基。在表2及表3示sfd培养基、pge维持培养基的组成。【表2】sfd培养基试剂容量imdm500mlf12160mlmtg6.6mln23.3mlb273.3mlasp660μl【表3】pge维持培养基(以向sfd培养基添加下述因子的作为pge维持培养基)试剂最终浓度a83-010.5μmchir3μmvegf10ng/mlegf20ng/mlfgf25ng/ml【3.基质胶包被】将基质胶生长因子reduce用rpmi稀释至1/30。根据下述表4向培养皿加必要量的稀释的溶液,全面铺皿。于室温放置约2小时。将稀释溶液回收到管中,加与稀释溶液等量rpmi(以此包被作业作为以下基质胶包被)。稀释液能使用至第3次。接种细胞时进行基质胶包被。【表4】稀释液必要量培养皿稀释液量6孔板2ml60mm皿2ml100mm皿5ml【4.pgec细胞的冷冻保存和解冻法】【冷冻保存】在pgec达到90%汇合的状态下(每100mm皿3~4×106个细胞左右)、每100-mm皿用3ml无菌无ca+/mg+pbs清洗。其后,加1.5mlaccutase,在37℃、5%co2温育器之中进行2~5分钟处理。其后,立即用9ml的dmem-f12中和之后回收到50ml的conical管中。对细胞进行计数之后,以80~90g进行5min离心分离。在废弃上清之后,用调制的cellbanker(cellblanker-1)良好悬浮至成每5×105个细胞1ml,将各1ml的细胞悬浮液移到冷冻保存用管。将管搭载到装满异丙醇的1℃的冷冻用容器(确认盖恰好关闭)、于-80℃的冰箱静置1天。次日,移动到液氮箱,进行保存。在本法中能进行长期的保存,认为2年以上的保存是可能的。【解冻】取出自液氮箱取出的放入pgec的冷冻管,用预先设定于37℃的水浴急速融解。在冷冻细胞即将完全地解冻时(<1分钟以内),从水浴取出,立即在安全柜之中用70%乙醇擦拭周围之后,将细胞与预先温的9ml的dmem-f12一同移到离心用conical管中。由80~90g进行5分钟的离心清洗,用调制成每2×104个细胞1ml的放入10μmrock抑制物的pge维持培养基悬浮、向基质胶(生长因子减少的)(1:30的稀释)包被的100mm皿进行接种至全量达10ml(=2×105个细胞/100mm皿)。用37℃、5%co2温育器进行培养,次日起用pge维持培养基(rock抑制物无)每隔2天进行更换培养基而使增殖。〔实验结果〕(1)显示本实施例中的概要(图1)。由本发明扩增的细胞,相比被称为定形内胚层(d'amour,k.a.etal.efficientdifferentiationofhumanembryonicstemcellstodefinitiveendoderm.naturebiotechnology23,1534-1541(2005).、iwashita,h.etal.secretedcerberus1asamarkerforquantificationofdefinitiveendodermdifferentiationofthepluripotentstemcells.plosone8,e64291(2013).、si-tayeb,k.etal.highlyefficientgenerationofhumanhepatocyte-likecellsfrominducedpluripotentstemcells.hepatology51,297-305(2010).)或内胚层祖细胞(cheng,x.etal.self-renewingendodermalprogenitorlinesgeneratedfromhumanpluripotentstemcells.cellstemcell10,371-384(2012).)的细胞,是作为(向肠道系统)分化的更下游的细胞的称为原始肠内胚层细胞(pgec)的细胞。本细胞是能分化为来源于内胚层的全部细胞的细胞。(2)从人ips细胞未夹传代的pgec的初期分化诱导过程的细胞的形态学观察(图2)。由集落的形态·oct4,sox2的免疫染色确认(第0天)充分地保持人ips细胞的未分化性。接下来,使保持未分化状态的ips细胞依次暴露于激活素a及记载的分化因子,进行向定形内胚层的诱导。在第6天,向多个细胞有肥大化的核的铺路石状的定形内胚层细胞分化诱导。(3)在pgec的传代后立即的rock抑制物的有用性的探讨(图3)。照片(图3上)是对荧光标记的pgec细胞进行传代,进行对在第3天时间点的培养皿的全景摄影。对使用aavs1::egfp-ips细胞(tkda)诱导的pgec进行传代之后,由egfp的荧光实施生存-粘接-增殖的评价。在接种的初日添加rock抑制物而细胞的生存-粘接亢进。一方面,在rock抑制物非存在下,多数细胞无法生存(图3,上)。在接种后第3天对细胞数进行计数的结果,在rock抑制物暴露组中细胞数显著多,认为增殖亢进(图3,下)。横轴示每孔的数据(n)。(4)对于传代后的pgec的扩增有用的液性因子的探讨(图4,5)。将诱导的定形内胚层细胞在组合不同的细胞因子-低分子量化合物的培养基条件下进行培养,探索最适的条件。在第3天得到的细胞的形态示于图4,表达基因的解析的结果示于图5左、细胞数示于图5右。结果,为了细胞良好地增殖,需要chir99021,并且,为了诱导原始肠内胚层(pgec)标志物(cdx2)阳性-定形内胚层标志物(cxcr4·cer1)阴性的细胞,需要fgf2,bmp4,vegf,chir99021及a83-01。从而确证,在pgec的诱导中,fgf2,bmp4,vegf,chir99021及a83-01是必须的。*p1表示第1代、m1-m8表示培养基组成的差异(#1-#8)。各培养基组成如照片下方所示。(5)重复传代培养的pgec的形态学观察(图6)。图6上段示在pgec-p1,p10,p20的时间点传代后第5天的培养细胞的观察结果。在fgf2,bmp4,vegf,chir99021及a83-01的存在下进行扩增的结果确认,即使是重复传代20次以上的状态,增殖继续的同时,保持pgec特征性的上皮状的结构。图6下段示在p5的阶段,在传代后第1天~第5天之间增殖的过程。*p1表示第1代、m1-m8表示培养基组成的差异(#1-#8)。各培养基组成如照片下方所示。另外得知,本细胞能以方法中记载的顺序,在任意的时机冷冻保存,对在p10时间点保存3个月间的细胞进行解冻后,能再传代20次程度的扩增(图7)。图7上段示在p10时间点追加冷冻保存-解冻的pgec,将经1次传代(p1),10次传代(p10),20次传代(p20)的在第0天扩增之后的形态。确认在任何中,也可与未夹冷冻保存的pgec同样的上皮状的细胞增殖。图7下段示在p10时间点将冷冻保存-解冻的pgec经5次传代(p5)的于第1,3,5天扩增之后的形态。确证对于增殖能也良好地保持。(6)人ips细胞来源pgec的增殖曲线(图8、左)和细胞倍增时间(图8、右)。从本结果,能传代至少20次以上,冷冻(stock)之后,这些也能传代20次以上。(7)在传代前(p0)及传代后(p5,10,15,20)的pgec标志物的表达基因的解析。传代后(p5,10,15,20)的细胞是cdx2+/cer1-/cxcr-(图9)。作为内胚层标志物的sox17,foxa2被维持。作为内胚层标志物的gata4不维持。(8)在传代前(p0)及传代后(p1,10,15,20)的细胞的特性解析。facs(flowcytometry)解析的结果,传代前(p0,第5天)的细胞大部分是作为内胚层祖细胞或定形内胚层标志物的c-kit、cxcr4共阳性,与此相对,传代后(p5,15)的细胞是阴性(图10)。作为pgec标志物的cdx2的免疫染色的结果,在传代前(p0)确认不到表达,与此相对,传代后(p1,10,15)维持阳性(图11)。一方面,作为内胚层标志物的foxa2、sox17、hnf4a是阳性。再者,作为多能性干细胞标志物的nanog、oct4是阴性(图12)。(9)在共培养时(huvecs(lonza,cat.no.191027),hmscs(lonza,cat.no.pt-2501)),在作为培养液,不是内皮细胞培养基,而使用肝细胞培养基(xenotech)、或者添加bmp4及fgf2的肝细胞诱导培养基(hepatology,51(1),297-305,2010)时,确认不到肝芽特征性的基因表达的增强(alb、ttr等)。〔实施例2〕由微阵列解析的分化阶段的详细解析〔实验方法〕总rna使用rneasyminikit(qiagen,valencia,ca),从人ipsc-pgec来源细胞(从pgec(p0)、pgec(p1~p16的各种细胞)及pgec分化诱导的肝细胞(pgec-mh)(在后述的实施例3中分化诱导的细胞))调制。作为对照组,解析从人ipsc来源细胞(hipsc,ipsc-de(定形内胚层),ipsc-he(肝内胚层)ipsc-ih(不成熟的肝细胞)、ipsc-mh(成熟的肝细胞),ipsc-lb(肝芽)(各细胞的定义在以下的2个论文中记载:si-tayeb,k.etal.highlyefficientgenerationofhumanhepatocyte-likecellsfrominducedpluripotentstemcells.hepatology51,297-305(2010).、takebe,t.etal.vascularizedandfunctionalhumanliverfromanipsc-derivedorganbudtransplant.nature499,481-484(2013).、takebe,t.etal.generationofavascularizedandfunctionalhumanliverfromanipsc-derivedorganbudtransplant.natureprotocols9,396-409(2014))及人成体肝脏(lotno.:b308121、biochaininstitute、hayward,ca,usa)得到的rna。扩增crna,使用lowinputquickamplabelingkit(agilenttechnologies,paloalto,ca)进行标记,根据生产商的指示杂交于44k的60寡聚体微阵列(人基因表达4×44kv2微阵列试剂盒,agilenttechnologies)。将杂交的微阵列载玻片使用agilenthigh-resolutionmicroarrayscanner扫描。使用featureextractionsoftware版本10.7.3.1(agilenttechnologies)而计算相对杂交强度及背景杂交值。根据agilenttechnologies推荐的顺序使用genespring11.5.1software中的标志基准,将生的信号强度及各探针的标志从杂交强度及斑信息计算。再者,对样品的生信号强度进行log2变换,由变位值算法进行标准化。我们在全部样品上,除“妥协的”(compromised)标志外选择探针,作为检测到的基因,得到34、183个的探针。从得到的表达数据,使用75%shiftile&median修正的数据,由主成分解析、阶层的聚类法分类样品的分化阶段。〔实验结果〕示主成分解析的结果(图13)及阶层性聚类的结果(图14)。确证传代前的pgec(p0)是相当于ipsc-de(定形内胚层或内胚层祖细胞)的细胞。一方面,传代后(p1~p15)的细胞是接近于ipsc-he的分化阶段的细胞,表示它们是进一步分化的ipsc-mh或处于pgec-mh以前的分化状态。从以上知,通过夹哪怕一次传代而扩增的细胞是位于ipsc-de和ipsc-he的中间的分化阶段的细胞。〔实施例3〕从pgec向肝细胞的分化〔实验方法〕将pgec(p6)使用添加rock抑制物(10μm)的pge维持培养基接种到基质胶包被的皿上至次日达60~100%汇合。次日,确认细胞60~100%汇合,用向pge维持培养基添加激活素(100ng/ml)的培养基进行培养基更换,培养2天(pgec-2d)。(60%汇合以下的情况中在pge维持培养基中进行培养基更换,培养至60%汇合以上。)培养后,用向sfd培养基添加dm31898(250nm)、iwp2(4μm)、pd0325901(500nm)及ra(2μm)的培养基进行培养基更换而培养1天。再者,用向sfd培养基添加a-83-01(1μm)、bmp4(10ng/ml)、iwp2(4μm)、及ra(2μm)的培养基进行培养基更换,培养3天(pgec-he)。其后,用向敲除d-mem培养基添加20%ksr、1%dmso、1%neaa、2-me(0.1mm)及l-谷氨酰胺(1mm)的培养基进行培养基更换培养3天。接下来,调制除egf的hcm,用向该培养基添加5%fbs、hgf(20ng/ml)、osm(20ng/ml)及dex(100nm)的培养基培养8天,进行向肝细胞(pgec-mh)终末分化诱导。〔实验结果〕(1)将扩增的pgec(p6)阶段性地分化诱导的肝细胞的形态变化(图15-1、上段)和表达基因的解析(图15-1、下段)。确认进行终末分化的pgec-mh示肝细胞样的形态,肝细胞标志物基因的表达增强。pgec-mh在免疫染色的结果确认肝细胞标志物的表达。再者,从icg试验确证,pas染色的结果也是具有代谢功能的干细胞(图16,上段)。(2)通常,自ipsc诱导的肝细胞难以均质地分化诱导,自pgec分化的细胞能向有均质的形态学特征的肝细胞分化诱导(图15-2)。从而,基因表达解析的结果,得知与由ipsc诱导的mh(ipsc-mh)比较,在pgec-mh中肝细胞标志物显著高表达(图16、下段)。(3)传代后的pgec的肝细胞分化诱导能的探讨(图17)。形态学解析的结果,得知重复传代之后也再现性好,可诱导肝细胞(图17-1)。再者,表达基因的解析及由elisa的蛋白质分泌功能解析的结果确证,重复传代之后也发挥高的肝细胞功能,得知它们即使与ipsc-mh比较也显著地高(图17-2)。令人兴趣深的是,与pgec(p0)比较,pgec(p5,10)的alb分泌能高,认为向肝细胞的分化能高(图17-2、右)。〔实施例4〕从pgec向胰腺细胞的分化〔实验方法〕使用pgec的胰腺细胞的阶段性诱导的方法(图18)。将进行扩增的pgec使用添加rock抑制物(10nm)的pgec维持培养基接种到基质胶包被的皿上至次日接种密度达60~100%左右。次日,确认细胞达60~100%汇合,用向pgec维持培养基添加激活素(100ng/ml)的培养基进行培养基更换,培养2天。(60%汇合以下的情况中在pge维持培养基中进行培养基更换,培养至60%汇合以上。)培养后,用向dmem(high葡萄糖)培养基添加l-谷氨酰胺(2mm)、b27(1%)、抗坏血酸(50μg/ml)、头蛋白(25ng/ml)、a83-01(1μm)、ra(2μm)、环巴胺(0.25μm)的培养基进行培养基更换,培养3天。再者,用向dmem(高葡萄糖)培养基添加l-谷氨酰胺(2mm)、b27(1%)、抗坏血酸(50μg/ml)、头蛋白(25ng/ml)、sb431542(6μm)、胰岛素(800pm)及烟酰胺(10mm)的培养基进行培养基更换,培养1天。其后,用向dmem(高葡萄糖)培养基添加l-谷氨酰胺(2mm)、葡萄糖(20mm)、抗坏血酸(50μg/ml)、sb431542(6μm)、2-m胰岛素(800pm)及烟酰胺(10mm)的培养基培养12天,进行向胰腺细胞终末分化诱导。〔实验结果〕(1)从pgec阶段性地诱导的胰腺细胞的形态学解析(图18)。记载了从pgec向胰腺细胞、特别,胰岛素分泌细胞的分化诱导流程(图18)。通过将pge-2d在头蛋白、kaad-环巴胺、视黄酸(ncr)存在下培养三天,诱导pdx1阳性的胰腺前体细胞。再者,在第6天~第12天,用含b27等记载的因子的h21(high葡萄糖)培养基进行培养,在12天的阶段确认诱导胰腺细胞。(2)免疫染色的结果,pgec由胰腺细胞向作为胰腺前体细胞标志物的pdx1、作为内分泌细胞标志物的胰岛素,glucagon,somatostatin、作为外分泌细胞标志物的amylase阳性的细胞分化诱导(图19)。(3)表达基因的解析的结果,胰岛素、pdx1的表达增强,确认了向β细胞的分化诱导(图20)。〔实施例5〕从pgec向肠组织的分化〔实验方法〕使用pgec的肠组织的阶段性诱导的方法(图21)。将进行扩增的pgec使用添加rock抑制物(10nm)的pgec维持培养基,如图21所示,在预先包被含b271%、r-反应蛋白1(500ng/ml)、头蛋白(100ng/ml)、egf(50ng/ml)的基质胶的皿上进行接种。其后,在细胞接种后,再次添加含b271%、r-反应蛋白1(500ng/ml)、头蛋白(100ng/ml)、egf(50ng/ml)的基质胶,在包埋之上,在第1~22天,用各含有pen/strep、l-谷氨酰胺、b272ml/50ml、hepes(15mm)、r-反应蛋白1(500ng/ml)、头蛋白(100ng/ml)、egf(100ng/ml)的dmem/f12高级培养基进行培养。在第22天,再次、通过将含b271%、r-反应蛋白1(500ng/ml)、头蛋白(100ng/ml)、egf(50ng/ml)的基质胶从上添加-包埋,用同样的培养基培养进行肠组织的诱导。每2天进行1次培养基更换。得到的组织在任意的时机分散,通过以同样的顺序再接种可得到肠组织。再者,为了诱导肠组织必要的pgec的细胞数能从单一乃至多个的任何制作。〔实验结果〕(1)从pgec的肠组织诱导流程(图21)(2)显微镜观察的结果,得知由单一细胞培养的pgec向确认多个铺满积层化的上皮的立体环状结构的肠组织分化诱导(图22)。在实施例1~4中使用的各种的测定方法。·形态学观察方法:图2、4、6、15-1上、15-2、17-1、18由位相差显微镜(olympus)进行观察。·标志物的表达基因的解析:图5、9、15-1下、16-1、20定量实时反转录pcr(qrt-pcr)使用lightcyclera480system(roche)·lightcyclera480sybrgreenimastermix(roche)进行实验。·细胞的增殖曲线:图8左增殖曲线通过传代-接种后立即进行接种至成105个细胞/孔(6孔板)(d0),在3天后重复剥离细胞而对细胞数进行计数的操作制成。·细胞倍化时间:图8右:从在通过由增殖曲线1次近似得到的近似曲线中的斜率,通过集中在任意的2个时机的细胞数,代入以下的计算式求出。((t2-t1)/3.32×(logn2-logn1)其中t是时间,且n是细胞数。)·facs解析:图10facs解析用takebe,t.etal.vascularizedandfunctionalhumanliverfromanipsc-derivedorganbudtransplant.nature499,481-484(2013)所述的方法实施。将剥离的细胞(定形内胚层/pgec)用荧光缀合物单克隆抗体(mabs)于4℃、30分钟、暗室温育之后,用含2%fbs的pbs清洗之后,由moflo(dakocytomation)进行解析。使用的抗体如下:缀合别藻蓝素(apc)的hcd117(hc-kitapc);缀合藻红蛋白(pe)的hcd184(hcxcr4pe)。·标志物的免疫染色:图11、12、16、19对培养的细胞进行甲醇·30分钟-冰上固定,用10%正常山羊血清(ngs)进行60分钟封闭。接下来,添加第1抗体(1:200)之后,进行4℃过夜。由pbs的清洗操作之后,将适宜的第二抗体(缀合alexa-488,-555,或-647的第二抗体(1:500;invitrogen))调制-添加,于室温反应60分钟。进行染色的细胞在进行核染色(dapi)之后,用fa封固液进行封入。照片用zeissaxioimager和显微镜进行摄像。·pas染色:图16右上将giemsa和高碘酸schiff(wako)染色根据附属的说明书的方法进行染色。·icg摄取:图16右下用dmso将贮存的cardiogreen试剂(sigmacat#i2633)稀释至25mg/ml,在细胞培养用培养基(dmem)中稀释至1mg/ml(工作浓度)。将培养中的pgec-mh于在先调制的dmem培养基(1mg/mlcardiogreen(500μl/24孔))中于37℃、温育3~6小时。其后,在更换为通常的细胞培养用培养基之上,由显微镜观察确认icg的提取。·alb分泌能的测定:图17右alb分泌的测定用takebe,t.etal.vascularizedandfunctionalhumanliverfromanipsc-derivedorganbudtransplant.nature499,481-484(2013)所述的方法实施。培养基更换后,回收第1天的培养基,使用人白蛋白elisa定量试剂盒(bethyllaboratories),根据附属的说明书的方法进行测量。〔实施例6〕第1次传代往后的特异性标志物由实施例2记载的方法,从取得的全基因的表达网罗的的解析的结果,对于ipsc,de,pgec(p0)这3者,提取在pgec(p1往后)中特异性地最大表达增加或减少的基因(表5及,图23)。即,显示pgec(p1往后)的全样品共同无高表达,示低表达的标志物基因的列表。【表5】〔实施例7〕从各种各样的ips克隆的原始肠内胚层细胞(pgec)的建立(图24)(方法)由除了tkda3-4(实施例1的tkda3(由东京大学提供)的第4克隆)之外,在1231a3-、1383d2-、1383d6-、ff-01-、ff-06-(imatrix(层粘连蛋白;自株式会社nippi购入)上培养的ips细胞(在京都大学由末梢血建立的ips细胞))等的ips细胞克隆制作pgec。在pgec的制作中,有必要针对每个克隆优化分化诱导期间。对于诱导法,参照表6。【表6】(结果)诱导的原始肠内胚层细胞(第0代的第5天)的显微镜观察像示于图24a。作为在诱导中使用的ips细胞,使用1231a3-、1383d2-、1383d6-、ff-01-、ff-06-的5种不同的克隆。ips克隆每的增殖曲线示于图24b。来源于全部的克隆的pgec能进行至少20次以上传代-扩增。〔实施例8〕进行移植的pgec的内胚层组织再构建能(图25)(方法)将从tkda3-4ips细胞克隆制作的100万个的pgecs在免疫缺陷小鼠(不诱导肝障碍的状态的tknog小鼠、实验动物中央研究所(centralinstituteforexperimentalanimals))肾被膜下进行移植。移植的组织在1个月后摘出,在肉眼观察之后进行组织学解析。(结果)摘出移植1个月后的组织的结果,确认不到称为明显的奇形肿或癌等的肿瘤的形成(图25a)。黑虚线:pgec来源的组织。免疫组织化学染色的结果,pgec来源的组织形成各种各样的人内胚层来源组织(图25b)。即,显示形成被肝脏-胰腺-肠道的标志物染色的组织。比例尺=50μm。〔实施例9〕pgec来源的肝芽的长期培养后功能表达的探讨(图26)(方法)使用低粘接性的培养板,从pgec(第5代的第5天)制作肝芽。在肝芽制作中,在将pgec来源细胞:脐带来源静脉内皮细胞(huvec):间充质干细胞(msc)以10:7:1的比例混合之后,将lonza公司的hcm培养基、egm培养基以1:1混合的培养基中进行分化诱导。在分化诱导后的pgec来源肝芽培养上清中的白蛋白浓度使用酶联免疫吸附测定法(elisa)定量试剂盒(bethyllaboratoriesinc.)评价。(结果)体外制成的pgec来源肝芽的显微镜观察示于图26a。比例尺=50μm。pgec来源肝芽的白蛋白分泌能示于图26b。人白蛋白从由hcm/egm的分化诱导第4天的阶段起检测。再者得知,与用pgec单独进行细胞块培养(仅回收pgec,以5×105个细胞/孔/24孔板的密度向呈细胞在底部集合的形状的低粘接性的培养皿接种细胞之后,培养数天而得到的组织)的组织比较,显示显著地高的白蛋白分泌能。再者,在培养基条件不是hcm/egm,而是使用ko-dmem/egm时确认不到白蛋白分泌。〔实施例10〕进行分化诱导的pgec来源肝芽的氨代谢功能(图27)(方法)进行之后来源于进行15次传代培养的pgec的肝芽的分化诱导,向培养上清添加2mm的nh4cl。其后,在0hr、3hr、6hr、24hr的各时间点对培养上清进行采样,将氨浓度由氨测试(wako)测定。(结果)得知进行分化诱导的pgec来源肝芽有显著的氨代谢功能(图27)。〔实施例11〕对于剧症肝功能衰竭模型的由pgec来源肝芽移植的治疗效果(图28)(方法)在8周龄的alb-treck/scid小鼠(由东京都医学综合研究所:tokyometropolitaninstituteofmedicalscience提供)腹腔内,施用白喉毒素(dt:sigma,st.louis,mo,usa;d0564-1mg)(dtdose:1.5μg/kg)之后,以48小时后的ast值是8000iu/l以上确认发生剧症肝功能衰竭。关于满足此条件的剧症肝功能衰竭的小鼠个体,在麻醉下将来源于pgec细胞块(n=9)及pgec的肝芽(n=8)移植到肾被膜下。移植组与作为非移植组的对照组(sham(n=13))比较而对其生存率的改善效果进行比较。(结果)在移植pgec来源细胞块或肝芽的组中确证,与非移植组比较,生存率改善(图28)。〔实施例12〕由免疫组织化学染色的向肝细胞-胆管上皮细胞的分化诱导的确认(图29)(方法)向alb-treck/scid小鼠(图28的实验的小鼠)的肾被膜下移植pgec来源肝芽后,回收形成的组织,解析肉眼所见及组织学所见。(结果)在移植1个月时间点中形成的pgec来源肝芽移植组织是血管化的组织。另外,确认不到疑似奇形肿或恶性肿瘤的所见(图29a)。从免疫组织化学染色的结果确证形成了对人核特异性抗原、人白蛋白(肝细胞)、人ck7(胆管上皮细胞)、人cd31(血管)示染色性的肝组织(图29b)。比例尺=50μm。以在本说明书中引用的全部刊物、专利及专利申请作为直接参考并入本说明书。【工业实用性】由本发明高品质并且稳定调制成为用于制作组织-器官的材料的器官细胞变得可能。本发明的技术可向药物开发筛选或再生医疗应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1