诱导的肝细胞及其用途的制作方法
交叉引用
本申请要求2014年11月26日提交的美国临时申请号62/085,185的权益,该申请通过引用以其全文并入本文。
援引并入
本文公开的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。在本文公开的术语与并入的参考文献中的术语冲突的情况下,以本文的术语为准。
技术实现要素:
在很多方面中的一个方面,本文公开了在体外诱导滋养层干(ts)细胞分化为诱导的肝细胞的方法,该方法包括:使滋养层干细胞与条件培养基接触(例如,接触足够的时间),以诱导滋养层干细胞分化为诱导的肝细胞,其中所述条件培养基包含成纤维细胞生长因子(fgf)、类固醇和细胞因子。在一些实施方案中,本文公开了在体外诱导滋养层干(ts)细胞分化为诱导的肝细胞的方法,该方法包括(a)使滋养层干细胞与包含成纤维细胞生长因子(fgf)、类固醇和细胞因子的条件培养基接触;以及(b)将所述细胞温育足够的时间,以诱导滋养层干细胞分化为诱导的肝细胞。在一些实施方案中,所述方法进一步包括在将类固醇和细胞因子添加至条件培养基之前,使滋养层干细胞与fgf接触。在一些实施方案中,在将类固醇和细胞因子添加至条件培养基之前,使滋养层干细胞与fgf接触至少2小时、至少4小时、至少6小时、8小时、至少12小时、至少16小时、至少20小时或至少24小时。在一些实施方案中,所述方法进一步包括将滋养层干细胞温育至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少7天。在一些实施方案中,将类固醇和细胞因子同时或顺序添加至条件培养基中。
在一些实施方案中,本文的诱导的肝细胞为肝祖细胞。在一些实施方案中,fgf在ts细胞中上调mirna-124a。在一些实施方案中,在ts细胞中,mirna-124a的升高的水平引发定形内胚层(de)特化(specification)。在一些实施方案中,所述de特化与包括叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)或同源结构域蛋白mixl1的生物标志物相关。在一些实施方案中,所述de特化与sox17、foxa2和gsc的升高的表达水平相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平。在一些实施方案中,所述de特化与mixl1的降低的表达水平相关。在一些实施方案中,降低的表达水平为降低的蛋白质表达水平。在一些实施方案中,sox17、foxa2和gsc的升高的蛋白质表达水平以及mixl1的降低的蛋白质表达水平是相对于未经历de特化的等同ts细胞中的sox17、foxa2、gsc和mixl1的蛋白质表达水平而言的。在一些实施方案中,所述de特化进一步与sox2、nanog和oct4的升高的表达水平相关。在一些实施方案中,sox2、nanog和oct4的升高的表达水平为增加的蛋白质表达水平。在一些实施方案中,sox2、nanog和oct4的升高的表达水平为增加的基因表达水平。在一些实施方案中,sox2、nanog和oct4的升高的表达水平是相对于未经历de特化的等同ts细胞中的sox2、nanog和oct4的表达水平而言的。在一些实施方案中,通过本文的方法诱导的分化包括以下四个阶段中的一个或多个:原条到定形内胚层(de)阶段、肝特化内胚层阶段、肝母细胞阶段以及胎儿和成人肝细胞阶段。在一些实施方案中,选自cxcr4、foxa2、sox17、hhex、ttr、alb、tat、cyp7a1、bsep、serpina1、g6pc、abcc2、c/ebpβ、hnf1α、hnf4α及其任意组合的一种或多种生物标志物在所述四个阶段中的一个或多个中表达。在一些实施方案中,选自cxcr4、foxa2、sox17、hhex及其任意组合的一种或多种生物标志物在所述原条到de阶段表达。在一些实施方案中,相对于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平在所述原条到de阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平增加到约1倍至约10,000倍。在一些实施方案中,相比于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平增加到约10倍至约1000倍。在一些实施方案中,选自sox17、ttr、alb、tat、serpina1、cyp7a1及其任意组合的一种或多种生物标志物在所述肝特化内胚层阶段表达。在一些实施方案中,相对于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平在所述肝特化内胚层阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平增加到约1倍至约1000倍。在一些实施方案中,相比于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平增加到约10倍至约100倍。在一些实施方案中,选自ttr、alb、tat、cyp7a1、serpina1、bsep及其任意组合的一种或多种生物标志物在所述肝母细胞阶段表达。在一些实施方案中,相对于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平在所述肝母细胞阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平增加到约1倍至约1000倍。在一些实施方案中,相比于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平增加到约10倍至约100倍。在一些实施方案中,选自hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α、hnf4α及其任意组合的一种或多种生物标志物在所述胎儿和成人肝细胞样细胞阶段表达。在一些实施方案中,相对于在所述胎儿和成人肝细胞样细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平在所述胎儿和成人肝细胞样细胞阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述胎儿和成人肝细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平增加到约10倍至约1000倍。在一些实施方案中,相比于在所述胎儿和成人肝细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平增加到至少100倍。
在一些实施方案中,本文的滋养层干细胞为人滋养层干细胞。在一些实施方案中,所述类固醇为地塞米松。在一些实施方案中,所述细胞因子为制癌蛋白m。在一些实施方案中,所述制癌蛋白m为人制癌蛋白m。在一些实施方案中,所述人制癌蛋白m为重组人制癌蛋白m。在一些实施方案中,所述条件培养基进一步包含骨形态生成蛋白(bmp)。在一些实施方案中,所述bmp以约1-100ng/ml的浓度存在。在一些实施方案中,所述bmp以约1-50ng/ml,例如约20ng/ml的浓度存在。在一些实施方案中,所述bmp为bmp1、bmp2、bmp3、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10或bmp15。在一些实施方案中,所述bmp为bmp4。在一些实施方案中,所述条件培养基进一步包含肝生长因子(hgf)。在一些实施方案中,所述hgf以约0.1-50ng/ml或0.1-25ng/ml,例如约5ng/ml的浓度存在。
在一些实施方案中,本文公开的肝细胞是免疫豁免的。在一些实施方案中,所述诱导的肝细胞表达tgfβ1。在一些实施方案中,所述诱导的肝细胞在细胞外基质(ecm)中表达tgfβ1、纤连蛋白和胶原iv。在一些实施方案中,所述诱导的肝细胞表达hla-g。在一些实施方案中,所述诱导的肝细胞表达hla-g和stem-121。在一些实施方案中,所述诱导的肝细胞募集cd4+foxp3+treg细胞。在一些实施方案中,所述诱导的肝细胞形成三维结构的组织。在一些实施方案中,所述诱导的肝细胞簇集或聚集。在一些实施方案中,所述诱导的肝细胞形成新月细胞群。在一些实施方案中,所述诱导的肝细胞包含外周室和中央室。在一些实施方案中,所述诱导的肝细胞沿着基膜以外的ecm不规则地分布在外周室中。在一些实施方案中,所述诱导的肝细胞在中央室中从基底区向中央区分布。在一些实施方案中,所述诱导的肝细胞表达选自tgfβ1、hla-g、stem121、c-kit、ck19、ck18、alb、α-afp、β调理素、adh1、apof、cps1、gata4、cyp1a1、cyp2b6、asgr1、cxcr4、bsep、mrp2、cx32及其任意组合的一种或多种标志物。在一些实施方案中,所述诱导的肝细胞表达选自tgfβ1、hla-g、stem121、c-kit、β调理素、adh1、apof、cps1、cyp2b6、asgr1、cxcr4、cx32及其任意组合的一种或多种标志物。在一些实施方案中,所述诱导的肝细胞表达选自cps1、cyp2b6及其组合的一种或多种标志物。
在一个方面,本文提供了通过本文公开的任何方法产生的诱导的肝细胞。在另一个方面,本文提供了衍生自滋养层干细胞的分离的诱导的肝细胞。在另一个方面,本文提供了从滋养层干细胞诱导的分离的肝细胞。在一些实施方案中,所述肝细胞表达选自下组的一种或多种生物标志物:转化生长因子β1(tgfβ1)、人白细胞抗原g(hla-g)、分化簇4(cd4)、叉头框p3(foxp3)、人细胞质标志物stem121(stem121)、肥大细胞/干细胞生长因子受体c-kit(c-kit)、β调理素、载脂蛋白f(apof)、醇脱氢酶-1(adh1)、氨基甲酰-磷酸合成酶1(cps1)、gata转录因子4(gata4)、细胞色素p450家族1亚家族a多肽1(cyp1a1)、细胞色素p4502b6(cyp2b6)、脱唾液酸糖蛋白受体1(asgr1)、c-x-c趋化因子受体4型(cxcr4)、胆汁盐输出泵(bsep)、多药抗性蛋白-2(mrp2)、连接蛋白32(cx32)、叉头框蛋白a2(foxa2)、sry-box17(sox17)、己糖胺酶a,α多肽(hexosaminidaseaalphapolypeptide,hexa)、造血表达同源框(hhex)、运甲状腺素蛋白(ttr)、白蛋白(alb)、酪氨酸氨基转移酶(tat)、细胞色素p4507a1(cyp7a1)、葡萄糖-6-磷酸酶(g6pc)、丝氨酸蛋白酶抑制蛋白肽酶抑制剂进化枝a(α-1抗蛋白酶、抗胰蛋白酶)成员1(serpina1)、atp-结合盒亚家族c(abcc2)、ccaat-增强子-结合蛋白β(c/ebpβ)、肝细胞核因子1-α(hnf1α)、肝细胞核因子4-α(hnf4α)、α-1-胎蛋白(afp)、细胞角蛋白8(ck8)、磷酸烯醇丙酮酸羧激酶2线粒体(pck2)、糖原合成酶2(gys2)、肝细胞核因子6(hnf6)、醇脱氢酶1c(i类)γ多肽(adh1c)、细胞色素p4503a4(cyp3a4)、prospero同源框1(prox1)、色氨酸2,3-双加氧酶(tdo2)、细胞角蛋白18(ck18)以及细胞角蛋白19(ck19)。
在一些实施方案中,本文的肝细胞为肝祖细胞。在一些实施方案中,fgf在ts细胞中上调mirna-124a。在一些实施方案中,在ts细胞中,mirna-124a的升高的水平引发定形内胚层(de)特化。在一些实施方案中,所述de特化与包括叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)或同源结构域蛋白mixl1的生物标志物相关。在一些实施方案中,所述de特化与sox17、foxa2和gsc的升高的表达水平相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平。在一些实施方案中,所述de特化与mixl1的降低的表达水平相关。在一些实施方案中,降低的表达水平为降低的蛋白质表达水平。在一些实施方案中,sox17、foxa2和gsc的升高的蛋白质表达水平以及mixl1的降低的蛋白质表达水平是相对于未经历de特化的等同ts细胞中的sox17、foxa2、gsc和mixl1的蛋白质表达水平而言的。在一些实施方案中,所述de特化进一步与sox2、nanog和oct4的升高的表达水平相关。在一些实施方案中,sox2、nanog和oct4的升高的表达水平为增加的蛋白质表达水平。在一些实施方案中,sox2、nanog和oct4的升高的表达水平为增加的基因表达水平。在一些实施方案中,sox2、nanog和oct4的升高的表达水平是相对于未经历de特化的等同ts细胞中的sox2、nanog和oct4的表达水平而言的。在一些实施方案中,本文公开的肝细胞处于以下四个阶段中的一个:原条到定形内胚层(de)阶段、肝特化内胚层阶段、肝母细胞阶段以及胎儿和成人肝细胞阶段。在一些实施方案中,选自cxcr4、foxa2、sox17、hhex、ttr、alb、tat、cyp7a1、bsep、serpina1、g6pc、abcc2、c/ebpβ、hnf1α、hnf4α及其任意组合的一种或多种生物标志物在所述四个阶段中的一个或多个中表达。在一些实施方案中,选自cxcr4、foxa2、sox17、hhex及其任意组合的一种或多种生物标志物在所述原条到de阶段表达。在一些实施方案中,相对于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平在所述原条到de阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平增加到约1倍至约10,000倍。在一些实施方案中,相比于在所述原条到de阶段之前的表达水平,cxcr4、foxa2、sox17和/或hhex的表达水平增加到约10倍至约1000倍。在一些实施方案中,选自sox17、ttr、alb、tat、serpina1、cyp7a1及其任意组合的一种或多种生物标志物在所述肝特化内胚层阶段表达。在一些实施方案中,相对于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平在所述肝特化内胚层阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平增加到约1倍至约1000倍。在一些实施方案中,相比于在所述肝特化内胚层阶段之前的表达水平,sox17、ttr、alb、tat、serpina1和/或cyp7a1的表达水平增加到约10倍至约100倍。在一些实施方案中,选自ttr、alb、tat、cyp7a1、serpina1、胆汁盐排泄泵(bsep)及其任意组合的一种或多种生物标志物在所述肝母细胞阶段表达。在一些实施方案中,相对于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平在所述肝母细胞阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平增加到约1倍至约1000倍。在一些实施方案中,相比于在所述肝母细胞阶段之前的表达水平,ttr、alb、tat、cyp7a1、serpina1和/或bsep的表达水平增加到约10倍至约100倍。在一些实施方案中,选自hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α、hnf4α及其任意组合的一种或多种生物标志物在所述胎儿和成人肝细胞样细胞阶段表达。在一些实施方案中,相对于在所述胎儿和成人肝细胞样细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平在所述胎儿和成人肝细胞样细胞阶段增加。在一些实施方案中,所述增加的表达水平为增加的基因表达水平。在一些实施方案中,相比于在所述胎儿和成人肝细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平增加到约10倍至约1000倍。在一些实施方案中,相比于在所述胎儿和成人肝细胞阶段之前的表达水平,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和/或hnf4α的表达水平增加到至少100倍。在一些实施方案中,所述滋养层干细胞为人滋养层干细胞。
在一些实施方案中,本文的肝细胞是免疫豁免的。在一些实施方案中,所述肝细胞表达tgfβ1。在一些实施方案中,所述肝细胞在细胞外基质(ecm)中表达tgfβ1、纤连蛋白和胶原iv。在一些实施方案中,所述肝细胞表达hla-g。在一些实施方案中,所述肝细胞表达hla-g和stem-121。在一些实施方案中,所述肝细胞募集cd4+foxp3+treg细胞。在一些实施方案中,所述肝细胞形成三维结构的组织。在一些实施方案中,所述肝细胞簇集或聚集。在一些实施方案中,所述肝细胞形成新月细胞群。在一些实施方案中,所述肝细胞包含外周室和中央室。在一些实施方案中,所述肝细胞沿着基膜以外的ecm不规则地分布在外周室中。在一些实施方案中,所述肝细胞在中央室中从基底区向中央区分布。在一些实施方案中,所述肝细胞表达选自tgfβ1、hla-g、stem121、c-kit、ck19、ck18、alb、α-afp、β调理素、adh1、apof、cps1、gata4、cyp1a1、cyp2b6、asgr1、cxcr4、bsep、mrp2、cx32及其任意组合的一种或多种标志物。在一些实施方案中,所述肝细胞表达选自tgfβ1、hla-g、stem121、c-kit、β调理素、adh1、apof、cps1、cyp2b6、asgr1、cxcr4、cx32及其任意组合的一种或多种标志物。在一些实施方案中,所述肝细胞表达选自cps1、cyp2b6及其组合的一种或多种标志物。在一些实施方案中,所述肝细胞表达选自stem121、c-kit、ck19、ck18及其任意组合的一种或多种标志物。在一些实施方案中,所述肝细胞表达选自alb、afp、β调理素、adh1、apof、cps1、gata4、cyp1a1、cyp2b6及其任意组合的一种或多种标志物。在一些实施方案中,所述肝细胞表达选自asgr1、cxcr4、bsep、mrp2、cx32及其任意组合的一种或多种标志物。
本文还公开了筛选用于治疗或预防病况的治疗性化合物的方法,该方法包括:使本文公开的分离的肝细胞与所述治疗性化合物接触;以及检测所述分离的肝细胞中的生物标志物的表达水平。在一些实施方案中,相比于未与所述治疗性化合物接触的等同的分离的肝细胞,所述分离的肝细胞中的生物标志物的表达水平增加。在一些实施方案中,相比于未与所述治疗性化合物接触的等同的分离的肝细胞,所述分离的肝细胞中的生物标志物的表达水平降低。在一些实施方案中,所述表达水平为基因表达水平。在一些实施方案中,所述生物标志物包括cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4或cyp7a1。在一些实施方案中,所述治疗性化合物为小分子药物、肽或蛋白质。在一些实施方案中,所述治疗性化合物为合成的化学药物。在一些实施方案中,所述病况为肝衰竭。在一些实施方案中,所述病况为肝相关疾病或病症。在一些实施方案中,所述肝相关疾病或病症包括alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(任选地,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、病毒性肝炎、威尔逊病或其任意组合。
在一个方面,本文公开了包含本文公开的任何肝细胞的组合物(例如,药物组合物)。
在另一个方面,本文公开了治疗受试者的病况的方法,该方法包括向受试者施用对于所述肝细胞移入所述受试者(例如,移入所述受试者的肝)中有效的量的包含本文的分离的肝细胞的药物组合物。在一些实施方案中,所述肝细胞在药学上可接受的载体中施用。在一些实施方案中,所述药学上可接受的载体包括磷酸盐缓冲盐水。在一些实施方案中,所述肝细胞在含有约1x106至约100x106个细胞/ml、约1x106至约250x106个细胞/ml、约1x106至约500x106个细胞/ml、或约10x106至约40x106个细胞/ml的悬浮液中施用。在一些实施方案中,所述肝细胞以约:1-5ml、1-10ml、1-50ml、1-100ml或10-150ml的体积施用。在一些实施方案中,所述受试者为人。在一些实施方案中,所述施用包括注射,例如,静脉内注射。在一些实施方案中,所述注射在肝静脉施用。在一些实施方案中,所述注射在肝动脉施用。在一些实施方案中,所述病况为肝相关疾病或病症。在一些实施方案中,所述病况为肝衰竭。在一些实施方案中,所述肝相关疾病或病症包括alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(任选地,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、病毒性肝炎、威尔逊病或其任意组合。
在另一个方面,本文公开了包含本文的肝细胞的组合物用于产生治疗性蛋白的用途。在一些实施方案中,所述治疗性蛋白包括主要的血浆蛋白如人血清白蛋白、可溶性血浆纤连蛋白、甲胎蛋白、c-反应蛋白和几种球蛋白;涉及止血和纤维蛋白溶解的蛋白质如涉及凝血级联的凝血因子、α2-巨球蛋白、α1-抗胰蛋白酶、抗凝血酶iii、蛋白s、蛋白c、血纤维蛋白溶酶原、α2-抗纤溶酶和补体成分3;载体蛋白如白蛋白、血浆铜蓝蛋白、运皮质激素蛋白、触珠蛋白、血红素结合蛋白、igf结合蛋白、主要的尿蛋白、视黄醇结合蛋白、性激素结合球蛋白、运甲状腺素蛋白、运铁蛋白和维生素d结合蛋白;激素如胰岛素样生长因子1、血小板生成素、铁调素和β调理素;激素原如血管紧张素原;或载脂蛋白。
本文还公开了包含本文的肝细胞的组合物用于肝再生的用途。在一些实施方案中,所述肝再生为离体肝再生。在一些实施方案中,所述离体肝再生为生物打印法。在一些实施方案中,所述生物打印法为三维生物打印法。
在一个方面,本文公开了包含本文的肝细胞的组合物用于生物打印的用途。在一些实施方案中,所述生物打印为三维生物打印。
本文还公开了本文的肝细胞用于组织支架生成的用途。在一些实施方案中,所述组织支架为三维组织支架。
在一个方面,本文公开了包含本文的肝细胞的组合物用于基因治疗的用途。在一些实施方案中,所述基因治疗为离体基因治疗。
在另一个方面,本文公开了由本文的肝细胞生成的人工组织。在一些实施方案中,所述组织是三维的。在一些实施方案中,所述组织是血管化的。
本文还公开了由本文的肝细胞生成的人工器官。
在一些实施方案中,本文公开的肝细胞、组织或器官产生afp、alb、α-1-抗胰蛋白酶、葡萄糖或糖原。在一些实施方案中,所述肝细胞、组织或器官代谢脂质、胆固醇或碳水化合物。在一些实施方案中,所述肝细胞、组织或器官代谢药物或毒性物质。在一些实施方案中,所述肝细胞、组织或器官摄取氨或胆汁酸。
在一些实施方案中,本文的肝细胞具有与原代肝细胞相当的表型(例如,免疫表型)特性。在一些实施方案中,本文的肝细胞具有与原代肝细胞相当的形态学特性。在一些实施方案中,本文的肝细胞具有与原代肝细胞相当的功能特性。
在一些实施方案中,本文公开的肝细胞、组织或器官具有以下的一种或多种功能:脂肪酸、甘油三酯、胆固醇、胆汁盐或磷脂的合成;外源性或内源性化合物(例如,药物、杀虫剂、类固醇、氨、重金属或毒素)的解毒、修饰和排泄;碳水化合物代谢;蛋白质(例如,血清白蛋白、纤维蛋白原、脂蛋白、脱辅蛋白质、血浆铜蓝蛋白、运铁蛋白、补体或糖蛋白)的合成;蛋白质储存;或胆汁的形成或分泌。在一些情况下,肝细胞可以是肝祖细胞(例如,肝细胞样细胞)或衍生自干细胞的肝细胞;肝干细胞;或原代肝细胞(例如,为新分离的或未培养的、冷冻保存的从肝获得的肝细胞,或与该肝细胞相当的肝细胞)。
在一些实施方案中,本文公开的滋养层干细胞衍生自异位妊娠物质(ectopicpregnancymass)(例如,输卵管)。在一些实施方案中,本文的分离滋养层干细胞的方法包括以下步骤:从异位妊娠物质(例如,输卵管)获得滋养层绒毛;从滋养层绒毛收集细胞;以及在培养基中培养收集的细胞以获得分离的滋养层干细胞。在一些实施方案中,所述方法进一步包括将滋养层绒毛切成片。在一些实施方案中,所述方法进一步包括用酶处理滋养层绒毛。在一些实施方案中,对人滋养层干细胞进行遗传修饰以将突变引入所述细胞中。在一些实施方案中,所述妊娠物质以未破裂的方式获得。在一些实施方案中,所述妊娠物质处于不大于7或8周的孕龄。在一些实施方案中,所述培养基不含饲养层。在一些实施方案中,所述方法进一步包括以下步骤:在所述培养基中形成胚体(eb);用酶处理eb;以及从酶处理的eb收集细胞以获得分离的人滋养层干细胞。
附图说明
图1a-1f示出了de谱系的免疫反应性标志物。图1a-1d显示了与对照相比,在hts细胞中在bfgf诱导4hr时检测foxa2和sox17(图1a)、gsc(图1b)和mixl1(图1c)的免疫细胞化学。图1d显示了与de相关的转录因子,包括gsc、brachyury、mixl1、sox17和foxa2,在bfgf诱导的最初8hr的时程中的蛋白质印迹。误差条表示平均值的标准差(sd)。n=3,*:p<0.05,为统计显著的。图1e显示了在诱导后第4天与肝细胞相关的标志物的共定位,其显示了afp和白蛋白(上部的图)以及abcc2和bsep(下部的图)。图1f显示了肝细胞样细胞分化的两步方案,其在hts细胞中通过蛋白质印迹测定显示了各种肝细胞特异性标志物。α-微管蛋白作为加载对照。
图2a-2m示出了de特化的调节分子机制。图2a指示鉴定出creb1靶向mir-124amrna的启动子的三个位点的mir-124a分析(chip-qpcr)。共有序列mir-124a结合位点的示意图(上部的图)。c:作为无抗体对照。误差条表示3次重复的sd。图2b示出了根据免疫印迹测定,creb1的敲低(knockdown)降低了bfgf诱导的mir-124a表达。误差条表示3次重复的sd。*:p<0.05。图2c显示了根据qpcr测定,在8hr诱导期间磷光体(p)-creb1和mirna-124a的bfgf诱导的表达。误差条表示4次重复的sd。图2d显示了smad4的chip-qpcr,其通过萤光素酶报告试验鉴定出mir-124a经由靶向启动子的两个位点抑制smad4表达。共有序列mir-124a结合位点的示意图(上部的图)。空载体作为对照;psmad4表示smad4质粒,误差条表示3次重复的sd。*:p<0.05。图2e显示了根据蛋白质印迹,bfgf、mir-124a和抗-mir-124a抗体对de相关转录因子的表达的影响。β-肌动蛋白用作加载对照。图2f显示了根据蛋白质印迹,使用shrna敲低smad4抑制了smad4和mixl1的表达。β-肌动蛋白用作加载对照。图2g和图2h显示了chip-qpcr测定,其通过萤光素酶报告试验在诱导4hr时鉴定出mir-124a抑制gsk3β(图2g);而qpcr测定显示了β-联蛋白抑制foxa2(图2h)。共有序列mir-124a结合位点的示意图(g,上部的图)。空载体作为对照;pgsk3β表示gsk3β质粒,误差条表示3次重复的sd。*:p<0.05。图2i显示了chip-qpcr测定,其通过萤光素酶报告试验鉴定出mir-124a抑制cdx2。共有序列mir-124a结合位点的示意图(上部的图)。空载体作为对照;pcdx2表示cdx2质粒,误差条表示3次重复的sd。*:p<0.05。图2j显示了揭示在hts细胞中在bfgf诱导4hr时cdx2与oct4之间的相互抑制机制的图像。图2k显示了在de分化期间多能性转录因子cdx2和oct4(上部的图)以及nanog和sox2(下部的图)在时间线上的蛋白质印迹。误差条表示3次重复的sd。*:p<0.05。图2l显示了chip-qpcr测定,其鉴定了oct4在sox17基因的启动子的两个位点处的结合。误差条表示3次重复的sd。图2m显示了在hts细胞分化为de谱系的过程中bfgf诱导的示意图。
图3a-3c示出了肝细胞样细胞的形态发生。图3a显示了分化过程中细胞的形态学变化,在诱导的第6-8天形成板状组织结构。图3b显示了电子显微照片,其揭示了以下基础结构:大的细胞质/细胞核比、大量线粒体(m)、高尔基体(gi)、组织良好的内质网(rer)、形成胆小管腔(cn)的连接复合体(白色箭头)以及将空间从其余的细胞外空间密封起来的连接复合体(双箭头)、在细胞质处的层状包含体、以及桥粒连接处(箭头)。图3c显示了肝板状组织的免疫组织化学,其显示了肝细胞的免疫反应性细胞膜标志物:cxcr4、cx32、bsep和mrp2(abcc2)以及细胞质标志物:β调理素、hnf4α、白蛋白、afp、cyp2b6、apof、cps1和adh1。
图4a-4d示出了分化的肝细胞样细胞的肝功能。图4a显示了在通过自动分析仪(hitachi7080;tokyo,japan)测量的在培养基如白蛋白和脲中显示出蛋白质分泌能力的分化的肝细胞样细胞(4天)。误差条表示3次重复的sd。**:p<0.01。图4b和图4c显示了ldl摄取测定,其示出了在分化的肝细胞样细胞中的免疫反应性ldl受体(ldlr,中部的图)和ldl染色(左图)(图4b)以及显示脂肪滴的油-o-红(oil-o-red)测试(图4c)。图4d显示了在肝细胞样细胞(左边3个图)和肝板状组织(右图)中,糖原储存测试通过高碘酸希夫(periodicacid–schiff)(pas)染色鉴定由消化糖原的淀粉酶(上部的图)证明以及由荧光pas染色(下部的图)证实的细胞中糖原的存在。
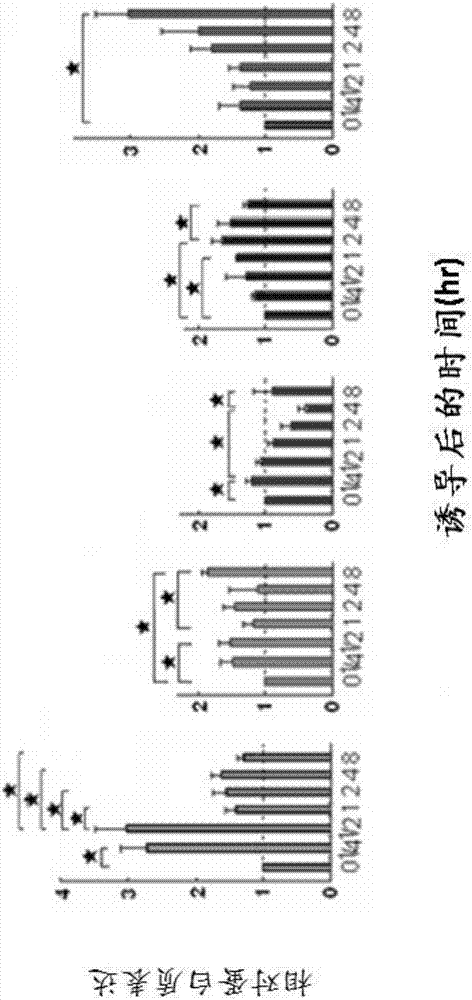
图5a-5i示出了在分化的肝细胞样细胞中的各种cyp450酶活性。通过药物之间的相互作用和解毒测试(诱导物,抑制剂)来估计i-ii期cyp450酶活性,包括cyp1a2(图5a)、cyp2b6(图5b)、cyp2c8(图5c)、cyp2c9(图5d)、cyp2c19(图5e)、cyp2d6(图5f)、cyp2e1(图5g)、cyp3a4(图5h)和cyp7a1(图5i)。(利福平即rif和环丙沙星即cip),(苯巴比妥即phen和cip)、(rif和吉非罗齐即gem)、(rif和gem)、(rif和噻氯匹定即tico)、(仅rif作为诱导物)、(仅rif作为诱导物)、(rif和依曲康唑即itra)以及(tha即2,4,6-三羟基苯乙酮和cdca即鹅去氧胆酸)分别用作诱导物和抑制剂。hts表示hts细胞,hthl表示人滋养层衍生的肝细胞样细胞;并且huh7表示人肝癌huh7细胞。
图6示出了显示在肝细胞分化的不同阶段期间的生物标志物表达(例如,mrna)的表。
图7示出了根据组织fax分析的de形成的细胞过程。bfgf(10ng/ml)用来诱导hts细胞分化为由mixl1的上调(黑色)指示的中内胚层。随后在诱导约4小时时,中内胚层分化为de谱系,表现mixl1的下调(灰色)。n表示计数的细胞的总数。
图8示出了本文所述的生物标志物的表达水平分析。图8a示出了fgfr抑制剂(pd166866)阻断bfgf诱导的pi3k,其中β-肌动蛋白作为加载对照。图8b示出了pi3ksirna抑制pi3k和p-akt的表达。采用非特异性shrna转染的细胞用作对照。β-肌动蛋白用作加载对照。图8c显示针对akt亚基的sirna抑制p-akt和p-creb1的bfgf诱导的表达。采用非特异性shrna转染的细胞用作对照。β-肌动蛋白用作加载对照。图8d显示根据ip测定akt直接与creb1相互作用。
图9示出了根据qpcr分析,在hts细胞中诱导之后的与肝发育相关的31个基因的遗传波动谱。
图10a-10d和图10as-10fs示出了de形成期间的免疫反应性标志物。(10a)原条和de标志物的代表性标志物在最初诱导(8hr)的时程中的蛋白质印迹分析。数据表示平均值±sd,n=3,*:p<0.05,为统计显著的。(10b)在bfgf诱导4hr时foxa2和sox17(左图)、gsc(中部的图)和mixl1(右图)的免疫细胞化学。(10c)在靶向mir-124a中的启动子的三个位点(上部的图)以增加其水平的过程中通过chip-qpcr鉴定creb1。c:作为对照。数据表示平均值±sd,n=3,*:p<0.05,为统计显著的。(10d)根据qpcr测定,bfgf诱导了磷酸化(p)-creb1与mirna-124a之间的平行表达。数据表示平均值±sd,n=4,*:p<0.05,为统计显著的。(10as)根据tissuefax分析,在诱导4hr内细胞中变化的平均mixl1强度。空白区域为对照,蓝色区域为中内胚层阶段,红色区域为de阶段。(10bs)根据蛋白质印迹,fgfr抑制剂(pd166866)阻断bfgf诱导的pi3k。β-肌动蛋白用作加载对照。(10cs)pi3ksirna抑制pi3k和p-akt的表达。采用非特异性shrna转染的细胞用作对照。β-肌动蛋白用作加载对照。(10ds)针对akt亚基的sirna抑制p-akt和p-creb1的bfgf诱导的表达。采用非特异性shrna转染的细胞用作对照。β-肌动蛋白用作加载对照。(10es)根据ip测定,akt直接与creb1相互作用。(10fs)通过使用creb1shrna抑制bfgf诱导的mir-124a。数据表示平均值±sd,n=3,*:p<0.05为统计显著的。
图11a-11i和图11as-11cs示出了de特化的分子机制。(11a、11b、11c)mir-124a的萤光素酶报告试验经由靶向基因的启动子(上部的图)抑制smad4质粒(psmad4)(a)、pgsk3β(b)和pcdx2(c)的表达。空载体:对照,数据表示平均值±sd,n=3,*:p<0.05,为统计显著的。(11d)根据chip-qpcr测定,β-联蛋白与foxa2基因中的启动子的区域(-2.1kb)随时间结合。误差条表示3次重复的sd。(11e)根据chip测定,foxa2靶向β调理素的启动子,其显示在诱导12hr时产生β调理素(箭头)。输入:全细胞作为阳性对照。igg作为阴性对照。(11f)根据蛋白质印迹分析,在bfgf诱导4hr时各种转录因子响应mir-124a和抗-mir-124a抗体的表达。β-肌动蛋白:加载对照。(11g)在bfgf免疫细胞化学诱导4hr时cdx2(绿色)与oct4(红色)之间的相互抑制作用。(11h)根据chip-qpcr测定,在bfgf诱导2hr时oct4与sox17基因中的启动子的两个区域(-1和-1.8kb)结合。误差条表示3次重复的sd。(11i)在hts细胞中的de分化的分子调节的示意图。(11as)根据免疫印迹分析,smad4shrna抑制mixl1的表达。(11bs)在de形成的时程中oct4、cdx2、nanog和sox2的表达。数据表示平均值±sd,n=3,*:p<0.05。(11cs)免疫反应性白蛋白(abl)和afp在肝细胞样细胞中表达。
图12a-12d和12as示出了肝细胞样细胞的生物特征。(12a)新月细胞群的h&e染色(左图,插图)。许多簇集的细胞不规则地分布在含有丰富的具有浓缩细胞核的小胚胎祖细胞样细胞的外周层(右下方)。圆柱形树状ecm以及肝细胞样细胞内层从周围层向中央区伸展(右上方)。(12b)ccl4受损肝组织中的肝细胞样细胞,其显示了免疫反应性stem-121-阳性细胞(左上方)、c-kit阳性细胞(右上方,箭头)、ck19(左下方,箭头)和ck18(右下方,箭头)。(12c)在新月细胞群中组织学上观察到的肝发育期间的各种特异性免疫反应性标志物。细胞表面标志物组成了在小插图中所见的肝细胞的多边形。(12d)代表性电子显微照片显示:上部显微照片中的大的细胞质/细胞核比、大量的线粒体(m)、内质网(rer)、脂质滴、disse间隙(sd)、细胞外基质(ecm)、细胞核(n)和窦状腺(sinusoid),在左下显微照片中具有玫瑰花结形成(红圈)的糖原(gly)储存,以及右下显微照片显示胆小管腔(bc)和连接复合体(上方)和紧密连接处(下方)。(12as)在hts细胞分化为肝细胞样细胞的时程中的形态学变化。
图13a-13b和13as示出了肝细胞样细胞培养基中的分泌组学。(13a)在细胞培养之前(作为对照,左图)和细胞培养5天之后(右图)培养基的蛋白质组学分析揭示了蛋白质的新的形成(标为第413号,圆圈)。(13b)在诱导之前(上部的图)和诱导5天之后在hts细胞中没有表达的免疫反应性tgfβ1、胶原iv(col4)和纤连蛋白(fn),它们的共表达作为圆柱形ecm分布在3-d结构的肝细胞样细胞之间(下部的图)。(13as)mascotms/ms离子检索系统分析20151001_lip_413,转化生长因子-β-诱导的蛋白ig-h3前体[智人]。
图14a-14e示出了肝细胞样细胞的功能特征。(14a)肝细胞样细胞将白蛋白(左)和脲(右;通过5mm氯化铵刺激1天)通过自动分析仪(hitachi7080;tokyo,japan)分泌至培养基中。误差条表示3次重复的sd。**:p<0.01。(14b)ldl摄取测定显示了细胞中的免疫反应性ldl(红色,左)、ldl受体(ldlr,绿色,中)以及它们呈现的图像(右)。(14c)油-o-红测试显示了细胞中的脂肪滴(红色)。(14d)糖原储存测试使用淀粉酶处理通过高碘酸希夫(pas)染色(上部的图),以及还通过荧光pas染色(下部的图)鉴定了糖原(粉红色和红色)的存在。(14e)根据qpcr分析,在肝细胞样细胞中处理24hr时响应诱导物(绿色)和抑制剂(粉红色)的各种i-ii期cyp450酶活性。缩略语:rif,利福平;cip,环丙沙星;itra,依曲康唑;phen,苯巴比妥;gem,吉非罗齐;tha,2,4,6-三羟基苯乙酮;cdca,鹅去氧胆酸;以及tico,噻氯匹定。
图15a-图15f示出了通过肝细胞样细胞的静脉移植的响应性
(15a)。在细胞治疗组(ccl4+细胞;n=8)中的ast和alt的血清水平随着时间高于对照组(仅ccl4;n=8)。数据表示平均值±s.e.m.,n=,student检验:*:p<0.01。(15b)hts细胞中(上部的图)和位于肝组织的肝细胞样细胞中(下部的图)免疫反应性stem-121的表达。(15c)表达细胞变性的特征(插图)的ccl4-受损肝组织中的stem-121-阳性肝细胞。pt表示门脉三联体(portaltriad)。(15d)在植入的肝细胞样细胞中免疫反应性stem-121和hla-g的共表达。比例尺:20μm。(15e,15f)免疫反应性cd4+foxp3+treg细胞在ccl4-受损肝细胞免疫细胞化学中的分布(15e),以及免疫反应性cd4+细胞(红色)在中央静脉免疫组织化学周围的分布(15f)。
具体实施方式
本文公开了用于从滋养层干细胞生成诱导的肝细胞的方法、组合物、细胞、制备工艺和试剂盒。在一些实施方案中,本文描述了在体外诱导滋养层干(ts)细胞分化为诱导的肝细胞的方法,该方法包括(a)使滋养层干细胞与包含成纤维细胞生长因子(fgf)、类固醇和细胞因子的条件培养基接触;以及(b)将该细胞温育足够的时间,以诱导该滋养层干细胞分化为诱导的肝细胞。
本文还描述了衍生自滋养层干细胞的分离的诱导的肝细胞,其中该分离的诱导的肝细胞包含表达水平升高的一种或多种生物标志物,该一种或多种生物标志物包括c-x-c趋化因子受体4型(cxcr4)、叉头框蛋白a2(foxa2)、sry-box17(sox17)、己糖胺酶a(α多肽)(hhex)、胆汁盐输出泵(bsep)、运甲状腺素蛋白(ttr)、白蛋白(alb)、酪氨酸氨基转移酶(tat)、细胞色素p4507a1(cyp7a1)、葡萄糖-6-磷酸酶(g6pc)、丝氨酸蛋白酶抑制蛋白肽酶抑制剂进化枝a(α-1抗蛋白酶,抗胰蛋白酶)成员1(serpina1)、atp-结合盒亚家族c(abcc2)、ccaat-增强子-结合蛋白β(c/ebpβ)、肝细胞核因子1-α(hnf1α)、肝细胞核因子4-α(hnf4α)、α-1-胎蛋白(afp)、角蛋白8(krt8)、磷酸烯醇丙酮酸羧激酶2线粒体(pck2)、细胞色素p4502b6(cyp2b6)、糖原合成酶2(gys2)、肝细胞核因子6(hnf6)、氨基甲酰-磷酸合成酶1线粒体(cps1)、醇脱氢酶1c(i类)γ多肽(adh1c)、连接蛋白32(cx32)、细胞色素p4503a4(cyp3a4)、prospero同源框1(prox1)、色氨酸2,3-双加氧酶(tdo2)、载脂蛋白f(apof)、角蛋白18(krt18)、角蛋白19(krt19)或19号染色体开放阅读框80(血管生成素样蛋白8、肝细胞癌相关基因td26、lipasin)(β调理素)。
本文进一步描述了筛选用于治疗或预防疾病或病症的方法,该方法包括(a)使本文的分离的诱导的肝细胞与所述化合物接触;以及(b)检测该分离的诱导的肝细胞中的生物标志物的表达水平。
另外,本文描述了包含本文公开的分离的诱导的肝细胞的组合物(例如,药物组合物)、用于生成包含本文公开的分离的诱导的肝细胞的组合物(例如,药物组合物)的制备工艺,以及用本文公开的分离的诱导的肝细胞或包含本文公开的分离的诱导的肝细胞的组合物治疗疾病或病症(例如,肝相关疾病或病症)的方法。
在一些方面,本文公开了肝细胞样细胞从异位妊娠衍生的人滋养层(hts)干细胞的高效生成,该肝细胞样细胞表现出与肝发育中的原代肝细胞类似的分子特征、遗传特征和生物学特征。在一些实施方案中,本文公开了microrna-124a在分化期间控制定形内胚层形成的机制。在一些实施方案中,肝细胞样细胞可在细胞培养物中构建3-d肝板状结构,从而表达hla-g并分泌tgfβ1以维持肝组织中的cd4+foxp3+treg细胞用于静脉内植入后的免疫耐受。在一些实施方案中,本文的细胞辅助并促进ccl4诱导的急性肝衰竭大鼠模型中的肝再生。在一些实施方案中,本文的hts细胞衍生的肝细胞样细胞可应用于肝衰竭的紧急处理或应用于再生医学。在一些实施方案中,本文公开了在一周(例如,4-6天)内hts细胞向功能性肝细胞的有效两步分化。在一些实施方案中,mir-124a控制肝生成期间的de形成。在一些实施方案中,本文公开了肝细胞样细胞构建具有模拟原代肝细胞的生物学功能的3-d组织结构。
在一些方面,本文公开了肝细胞样细胞的静脉内输注可归巢至ccl4损伤的肝组织以促进大鼠动物模型中的肝再生。在一些实施方案中,本文公开了hts细胞及其衍生的肝细胞样细胞都表达hla-g以在植入后获得免疫耐受。在一些实施方案中,本文公开了归巢肝细胞样细胞分泌tgfβ1以经由纤连蛋白和胶原的形成辅助损伤后新ecm的构建。在一些实施方案中,肝细胞样细胞分泌的tgfβ1导致骨髓的纤维细胞迁移至肝,激活肝星形细胞以用于肝再生,并维持肝组织中的cd4+foxp3+treg细胞以用于免疫耐受。在一些实施方案中,碱性成纤维细胞生长因子(bfgf)单独诱导microrna(mirna)-124a的活化,从而控制早期分化中的de特化。在一些实施方案中,在某些条件下,de产生肝内胚层,随后产生肝母细胞,并最终分化为胚胎/成人肝细胞样细胞,该胚胎/成人肝细胞样细胞带有与原代人肝细胞类似的遗传特征、分子特征以及生物学特征。
在一些方面,肝细胞样细胞能够体外构建三维(3-d)组织结构,并且这类细胞的静脉内输注导致肝归巢并保护肝免受伤害。在一些实施方案中,本文所用的组织培养基组合物大致包括血清和培养基。在一些实施方案中,该培养基为合成的输卵管液(sof)、改良的eagle培养基(mem)、dulbecco改良的eagle培养基(dmem)、rpmi1640、f-12、imdm、α培养基或mccoy培养基。在一些实施方案中,该血清为同种异体血清、自体血清或异种血清。在一些实施方案中,在de形成(例如,8hr)后,用成纤维细胞生长因子(例如,bfgf)、类固醇(例如,地塞米松)、细胞因子(例如,oncoststinm)、骨形态生成蛋白(例如,bmp4)以及肝生长因子(hgf)的组合培养hts细胞。在一些实施方案中,所得的细胞形成分散的成纤维细胞样细胞。在一些实施方案中,所得的细胞逐渐聚集形成新月细胞群。在一些实施方案中,两个不同的外周室和中央室构成三维(3d)组织结构。在一些实施方案中,在外周部分中,许多簇集的小细胞不规则地分布在基膜以外的细胞外基质(ecm)中。在一些实施方案中,细胞具有经常偏心定位的浓缩细胞核,以及在嗜酸性细胞质中的与胚胎干细胞/祖细胞类似的丰富的颗粒和液泡。在一些实施方案中,在中央部分中,许多独立的柱状ecm通过两侧的细胞内层从基底向中央区分布。这些细胞含有丰富的嗜酸性细胞质,并且分散在具有模拟表型肝细胞的一个或两个主要核仁的单圆细胞核中的染色质中。在一些实施方案中,可形成几个与人肝脏中的肝板类似的双核细胞。
在一些实施方案中,本文的肝细胞或肝细胞样细胞显示出以下特异性标志物:i)针对人细胞的人细胞质标志物stem-121tm、针对肝固有干细胞的肥大细胞/干细胞生长因子受体c-kit、针对胆管细胞的ck19以及针对肝细胞的ck18;以及ii)免疫组织化学地针对肝细胞的白蛋白(alb)、甲胎蛋白(afp)、β调理素、adh1、apof、cps1、gata4、cyp1a1以及细胞质中的cyp2b6。在一些实施方案中,包括asgr1、cxcr4、bsep、mrp2和cx32在内的表面标志物的亚组构建了与原代人肝细胞类似的多边形细胞形状,例如,与原代肝细胞类似的超微结构,包括大的细胞质与细胞核之比、大量线粒体、组织良好的内质网、紧密连接处、许多脂质液泡、糖原储存、具有连接复合体的扩大的胆小管腔以及多重ecm。
在细胞培养基中的9种新上调的分泌蛋白之中,通过mascotms/ms离子检索系统(esi-quad-tof,brukerimpacthd,matrixscience,usa)经由46%的肽序列匹配显著预测蛋白质(no.413)为转化生长因子-β(tgf-β)诱导的蛋白质ig-h3前体(tgfβ1)。tgfβ1为主要的纤维发生多功能细胞因子,其同时以自分泌和旁分泌的方式起作用以增强肝星形细胞(hsc)中的纤连蛋白和胶原形成。在一些实施方案中,tgfβ1在ecm中进行表达。在一些实施方案中,tgfβ1、纤连蛋白和胶原iv在emc中进行共表达。在一些实施方案中,tgfβ1、纤连蛋白和胶原iv至少部分地构成肝细胞样细胞的3-d组织结构中的ecm的支架,该支架可支持肝板中肝细胞的增殖和分化。
在一些方面,可通过一系列细胞过程从多能hts细胞有效地生成肝细胞样细胞,该细胞过程包括原条、de形成、肝内胚层、肝母细胞和最终的肝细胞样细胞。可在最初诱导(例如,30min)时通过gsc、鼠短尾突变体表型(brachyury)和mixl1的上调来验证原条分化的发生。立即降低的mixl1可影响中内胚层祖细胞的内胚层潜力。此外,表达sox7的细胞初始可存在于胚外内胚层处,但不存在于de谱系中。随着发育进行,sox17和foxa2的明显上调以及mixl1的下调可确定de的形成,其中oct4对多能性的保持起到与hes细胞衍生或ips细胞衍生的de的nanog不同的主要作用。
在一些方面,mir-124a的瞬时升高可经由与通常在3’utr中的靶mrna结合而在转录后负调节多种基因表达,从而控制de特化。在早期肝分化中,可能存在功能沉默的mir-124a。其中,在4hr诱导时达到峰值之后,下调的mir-124a与细胞迁移在原肠胚形成中开始以形成hes细胞中的三个胚胎胚层的情景具有相似性。
在一些方面,de特化后肝谱系分化的启动可通过bfgf、地塞米松、oncoststinm、bmp4和hgf的组合来实现。阶段特异性基因谱可指示肝特化内胚层中的关键步骤(表3,第二列)。例如,甲胎蛋白(afp)表达的表达表明肝内胚层的初步分化,并且c/ebpβ和hnf4α都控制脲循环中的初始肝特异性活性。α-1-抗胰蛋白酶(serpina1)的表达可保护细胞免受伤害,并促进酶如cyp7a1、cyp3a4和cyp2b6的代谢活性。这些事实说明,肝内胚层能够在早期分化中代谢胆固醇、药物和毒素。由于sox17直接诱导锌指蛋白202(zfp202)从而抑制主要的肝基因调节因子hnf4α,因此sox17的撤出有利于de阶段后hnf4α表达的启动,这进而有利于表征肝祖细胞的特化,从而控制肝细胞命运。持续的foxa2可导致白蛋白、afp、线粒体蛋白tat和β调理素的表达;而β调理素表达反映了早期肝分化中促进β细胞增殖和脂质代谢的早期能力。
在一些方面,随着分化进行,多种肝标志物开始出现,包括prox1、g6pc、hnf1α、abcc2和tdo2以及细胞角蛋白如ck8、ck18和ck19。例如,prox1是肝母细胞迁移所必需的,并且其在肝母细胞中的消融导致缺陷的干细胞特化并且促进胆管细胞定型。ck8是用于与ck18聚合形成上皮细胞骨架的组分的中间体丝蛋白,并且充当血纤维蛋白溶酶原受体。2至4天分化的肝母细胞可表达胆管细胞标志物ck19和肝祖细胞标志物ck8和ck18(表3),从而模拟分别向胆管上皮细胞和肝细胞分化的双潜能能力。包括foxa2、hnf1α、hnf4α和hnf6在内的肝细胞富集的转录因子簇的表达可代表肝母细胞分化的里程碑,从而将实质肝母细胞引导肝母细胞并促进肝细胞成熟。对于代谢,肝胆管排泄转运蛋白mrp2(abcc2)和肝间隙连接蛋白cx32的表达可促进各种分子跨细胞膜转运。然而,hhex的上调可能暗示肝母细胞中存在造血能力。
在一些方面,在静脉内移植后,植入的hts细胞衍生的肝细胞样细胞可存活至到达受试者的肝脏。在一些实施方案中,本文的细胞具有归巢本能。在一些实施方案中,这些细胞可表达一种非经典的hlai类分子——hla-g,其在膜结合或溶解时强力作用于不同免疫细胞类型(nk细胞、t细胞、b细胞、单核细胞/树突细胞)以通过与在免疫细胞表面表达的抑制受体相互作用而同时抑制先天和适应性免疫力。另外,这些肝细胞样细胞可使得能够在植入后募集cd4+foxp3+调节t(treg)细胞群,从而通过对促炎性t细胞的抑制和采用调节因子对t细胞的诱导而导致免疫抑制性环境的生成。在一些实施方案中,hts细胞衍生的肝细胞样细胞具有免疫豁免。
在一些方面,本文提供了用于向受试者移植肝细胞或肝细胞样细胞的组合物和方法。在一些实施方案中,向受试者注射hts细胞衍生的肝细胞(例如静脉内注射、肌内注射、经皮注射、内窥镜逆行注射或腹膜内注射)。在一些实施方案中,受试者在移植前未采用免疫抑制剂进行治疗。在一些实施方案中,所述方法进一步包括用免疫抑制剂例如fk-506、环孢菌素或gad65抗体治疗患者。
某些术语
除非另有定义,本文使用的所有技术和科学术语都具有与所要求保护的主题所属技术领域中的技术人员通常所理解的含义相同的含义。应当理解,前文的一般性描述和下文的详细描述仅是示例性和说明性的,并不限制所要求保护的任何主题。在本申请中,除非另外特别说明,单数的使用包括复数含义。须注意,除非上下文另外明确规定,如在说明书和所附权利要求中所用的单数形式“一个”、“一种”和“该”包括复数指示物。在本申请中,除非另有说明,“或”的使用意指“和/或”。此外,术语“包括”以及其他形式如“包含”和“含有”的使用是非限制性的。
如本文所用的,范围和量可表示为“约”具体值或范围,例如参考数值的±15%。约还包括确切的量。因此,“约5μl”意指“约5μl”,并且还意指“5μl”。通常,术语“约”包括预期在实验误差内的量。
本文所用的小节标题仅用于组织的目的,而不应被解释为限制所描述的主题。
概述
肝具有动态范围的功能,包括解毒、蛋白质合成、蛋白质储存、以及对于消化必要的生化组分的产生。它包括两种主要类型的细胞,即实质细胞和非实质细胞。实质细胞占肝体积的约80%,也被称为肝细胞。非实质细胞构成肝体积的约6.5%,但构成肝细胞总数的约40%。在一些情况下,非实质细胞包括肝窦内皮细胞、枯否细胞和肝星形细胞。
肝细胞
肝细胞或实质细胞负责肝的功能。在一些情况下,肝细胞参与蛋白质合成,蛋白质储存,胆固醇、胆汁盐和磷脂的合成,胆汁的形成和分泌,碳水化合物代谢,以及外源性和内源性物质的解毒、修饰和排泄。
在一些情况下,从肝细胞合成的蛋白质包括主要的血浆蛋白,如人血清白蛋白、可溶性血浆纤连蛋白、甲胎蛋白、c-反应蛋白和几种球蛋白;参与止血和纤维蛋白溶解的蛋白质,如参与凝血级联的凝血因子、α2-巨球蛋白、α1-抗胰蛋白酶、抗凝血酶iii、蛋白s、蛋白c、血纤维蛋白溶酶原、α2-抗纤溶酶和补体成分3;载体蛋白,如白蛋白、血浆铜蓝蛋白、运皮质激素蛋白、触珠蛋白、血红素结合蛋白、igf结合蛋白、主要的尿蛋白、视黄醇结合蛋白、性激素结合球蛋白、运甲状腺素蛋白、运铁蛋白和维生素d结合蛋白;激素,如胰岛素样生长因子1、血小板生成素、铁调素和β调理素;激素原,如血管紧张素原;以及载脂蛋白。
除了碳水化合物的形成、分解和相互转化之外,在某些情况下,碳水化合物代谢还包括糖异生、糖原分解和糖原生成。糖异生是从某些氨基酸、乳酸或甘油合成葡萄糖。糖原分解是糖原分解成葡萄糖。糖原生成是从葡萄糖形成糖原。
在一些情况下,肝细胞内的脂质代谢包括胆固醇合成和脂肪生成,即甘油三酯或脂肪的产生。
在一些情况下,在损伤如组织受损或组织损失之后,肝细胞可重新进入细胞周期,从而导致损伤部分(如损伤或损失的组织)的增殖和后续再生。在一些情况下,在去除肝组织之后,剩余的肝细胞经历至少一轮、两轮、三轮或更多轮的dna合成,导致损失的组织块的再生。
在一些实施方案中,将肝细胞用于药学研究。在一些实施方案中,这些研究包括药物代谢、酶诱导、肝毒性、肝细胞再生和移植。
术语肝细胞是指具有以下的一种或多种功能的肝细胞或肝祖细胞:脂肪酸、甘油三酯、胆固醇、胆汁盐或磷脂的合成;外源性或内源性化合物(例如,药物、杀虫剂、类固醇、氨、重金属或毒素)的解毒、修饰和排泄;碳水化合物代谢;蛋白质(例如,血清白蛋白、纤维蛋白原、脂蛋白、脱辅蛋白质、血浆铜蓝蛋白、运铁蛋白、补体或糖蛋白)的合成;蛋白质储存;或胆汁的形成或分泌。在一些情况下,肝细胞可为肝祖细胞(例如,肝细胞样细胞)或衍生自干细胞的肝细胞;肝干细胞;或原代肝细胞(例如,为新分离的或未培养的、冷冻保存的从肝获得的肝细胞,或与该肝细胞相当的肝细胞)。
在一些实施方案中,肝干细胞是构成约0.5%-2.5%的肝实质的表达小上皮细胞粘附分子(表达epcam)的细胞。在一些实施方案中,干细胞包括但不限于胚胎干细胞、成体干细胞、诱导型多能干(ips)细胞、孤雌生殖干细胞或滋养层干细胞。在一些实施方案中,干细胞为人干细胞。在一些实施方案中,干细胞为滋养层干细胞。在一些实施方案中,滋养层干细胞为人滋养层干细胞。在一些实施方案中,人滋养层干细胞为异位妊娠衍生的人滋养层干细胞。在一些情况下,衍生自干细胞的肝细胞也称为诱导的肝细胞。在一些实施方案中,诱导的肝细胞衍生自人滋养层干细胞。在一些实施方案中,诱导的肝细胞衍生自异位妊娠衍生的人滋养层干细胞。在一些实施方案中,诱导的肝细胞包括正经历分化为肝细胞的过程的滋养层干细胞,以及分化的滋养层干细胞。在一些实施方案中,正在经历分化为肝细胞的过程的滋养层干细胞也被称为未成熟的诱导的肝细胞。在一些实施方案中,分化的滋养层干细胞也被称为成熟的诱导的肝细胞。
在一些实施方案中,诱导的肝细胞的功能与原代肝细胞类似。在一些实施方案中,诱导的肝细胞包括原代肝细胞所表现出的细胞功能。在一些实施方案中,诱导的肝细胞参与细胞功能,诸如例如,在原代肝细胞中观察到的蛋白质合成,蛋白质储存,胆固醇、胆汁盐和磷脂的合成,胆汁的形成和分泌,碳水化合物代谢,以及外源性和内源性物质的解毒、修饰和排泄。在一些实施方案中,本文的肝细胞表达包括asgr1、cxcr4、bsep、mrp2和cx32在内的表面标志物的亚组,并构建与原代人肝细胞类似的多边形细胞形状,例如,与原代肝细胞类似的超微结构,包括大的细胞质与细胞核之比、大量线粒体、组织良好的内质网、紧密连接处、许多脂质液泡、糖原储存、具有连接复合体的扩大的胆小管腔以及多重ecm。
在一些情况下,从诱导的肝细胞合成的蛋白质包括主要的血浆蛋白,如人血清白蛋白、可溶性血浆纤连蛋白、甲胎蛋白、c-反应蛋白和几种球蛋白;参与止血和纤维蛋白溶解的蛋白质,如参与凝血级联的凝血因子、α2-巨球蛋白、α1-抗胰蛋白酶、抗凝血酶iii、蛋白s、蛋白c、血纤维蛋白溶酶原、α2-抗纤溶酶和补体成分3;载体蛋白,如白蛋白、血浆铜蓝蛋白、运皮质激素蛋白、触珠蛋白、血红素结合蛋白、igf结合蛋白、主要的尿蛋白、视黄醇结合蛋白、性激素结合球蛋白、运甲状腺素蛋白、运铁蛋白和维生素d结合蛋白;激素,如胰岛素样生长因子1、血小板生成素、铁调素和β调理素;激素原,如血管紧张素原;以及载脂蛋白。
在一些实施方案中,在诱导的肝细胞中观察到碳水化合物代谢诸如碳水化合物的形成、分解和相互转化、糖异生、糖原分解、糖原生成,脂质代谢包括胆固醇合成以及脂肪生成即甘油三酯或脂肪的产生。
在一些实施方案中,诱导的肝细胞包含与原代肝细胞类似的超微结构或细胞组成。在一些情况下,这通过基于透射电子显微镜图像的比较来实现。
在一些实施方案中,诱导的肝细胞用于药物研究,如药物代谢、酶诱导、肝毒性、肝细胞再生和移植。
滋养层干细胞(hts细胞)
滋养层干细胞(ts细胞)是分化的胎盘细胞的前体。在一些情况下,ts细胞衍生自胚泡极性滋养外胚层(te)细胞或胚胎外外胚层(exe)细胞。在一些情况下,ts能够在未分化状态下体外无限增殖,并且能够在体外保持潜在的多谱系分化能力。在一些情况下,ts细胞为哺乳动物ts细胞。示例性哺乳动物包括小鼠、大鼠、兔、羊、牛、猫、狗、猴、白鼬、蝙蝠、袋鼠、海豹、海豚和人类。在一些实施方案中,ts细胞为人ts(hts)细胞。
在一些情况下,ts细胞从输卵管获得。输卵管是受精的部位和异位妊娠的常见部位,其中发生生物学事件,如内细胞团(icm)与滋养外胚层之间的区别以及从全能性至具有主要表观遗传变化的多能性的转换。在一些情况下,这些观察为输卵管在植入前阶段作为用于收获胚泡相关干细胞的龛储室(nichereservoir)提供了支持。胚泡是早期的植入前胚胎,并且包括随后形成胚胎的icm,以及产生胎盘的被称为滋养层的外层。
在一些实施方案中,ts细胞为用于生成祖细胞(诸如例如肝细胞)的干细胞。在一些实施方案中,ts细胞来源于异位妊娠。在一些实施方案中,ts细胞为人ts细胞。在一个实施方案中,来源于异位妊娠的人ts细胞不涉及人胚胎的破坏。在另一个实施方案中,来源于异位妊娠的人ts细胞不涉及活的人胚胎的破坏。在另一个实施方案中,人ts细胞衍生自与不能存活的异位妊娠相关的滋养层组织。在另一个实施方案中,该异位妊娠无法挽救。在另一个实施方案中,该异位妊娠将不会导致活的人胚胎。在另一个实施方案中,该异位妊娠危及母亲的生命。在另一个实施方案中,该异位妊娠是输卵管、腹部、卵巢或子宫颈的异位妊娠。
在正常胚泡发育期间,icm接触自身或其衍生的可扩散“诱导物”在极性滋养外胚层中触发高速率的细胞增殖,从而导致细胞在整个胚泡阶段朝向腔壁(mural)区移动,并且甚至可以在滋养外胚层与icm区分后继续。覆盖icm的腔壁滋养外胚层细胞能够保留icm的“细胞记忆”。在植入开始时,由于子宫内膜的机械约束,icm对面的壁细胞停止分裂。然而,在胚胎位于输卵管内的异位妊娠中,输卵管中不存在约束,这导致极性滋养外胚层细胞的继续分裂从而形成在停滞的胚泡中的胚胎外外胚层(exe)。在一些情况下,exe衍生的ts细胞在增殖状态下存在最长20天。因此,直到临床干预发生前,细胞过程可以在植入前胚胎中产生无限数量的hts细胞,并且这样的细胞可保留来自icm的细胞记忆。
在一些情况下,ts细胞具有icm的特异性基因(例如,oct4、nanog、sox2、fgf4)和滋养外胚层的特异性基因(例如,cdx2、fgfr-2、eomes、bmp4),并表达三个主要胚层即中胚层、外胚层和内胚层的组分。在一些情况下,ts细胞表达胚胎干细胞(例如,人胚胎干细胞)相关表面标志物,如特定阶段胚胎抗原(ssea)-1、-3和-4,以及间充质干细胞相关标志物(cd44、cd90、ck7和波形蛋白)。在其他情况下,未表达造血干细胞标志物(cd34、cd45、α6-整合素、e-钙粘蛋白和l-选择蛋白)。
制备诱导的肝细胞的方法
在某些实施方案中,本文公开了在体外诱导滋养层干(ts)细胞分化为诱导的肝细胞的方法,该方法包括使该滋养层干细胞与包含成纤维细胞生长因子(fgf)、类固醇和细胞因子的条件培养基接触;以及将该细胞温育足够的时间以诱导该滋养层干细胞分化为诱导的肝细胞。在一些实施方案中,ts细胞为人ts(hts)细胞。在一些实施方案中,fgf、类固醇和细胞因子为人fgf、人类固醇和人细胞因子。
在一些实施方案中,成纤维细胞生长因子(fgf)是参与血管生成、伤口愈合、胚胎发育和细胞增殖及分化过程的生长因子家族。在一些情况下,fgf为肝素结合蛋白并与硫酸肝素蛋白聚糖相互作用。在一些情况下,fgf家族有22个成员。示例性的fgf包括:fgf1、fgf2(也称为碱性fgf或bfgf或fgf-β)、fgf3、fgf4、fgf5、fgf6、fgf7、fgf8、fgf9、fgf10、fgf11、fgf12、fgf13、fgf14、fgf16、fgf17、fgf18、fgf15/19、fgf20、fgf21、fgf22以及fgf23。在一些实施方案中,成纤维细胞生长因子为碱性成纤维细胞生长因子(bfgf,也称为fgf2或fgf-β)。在一些实施方案中,bfgf为人bfgf。在一些实施方案中,人bfgf为重组人bfgf,或其片段。
在一些实施方案中,fgf以约0.001至约5000ng/ml、约0.01至约500ng/ml、约0.1至约100ng/ml、或约1至约50ng/ml的浓度引入培养基中。
在一些情况下,fgf以至少0.001、0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更高的浓度引入培养基中。在一些实施方案中,fgf以至多0.001、0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更低的浓度引入培养基中。
在一些实施方案中,bfgf以约0.001至约5000ng/ml、约0.01至约500ng/ml、约0.1至约100ng/ml、或约1至约50ng/ml的浓度引入培养基中。
在一些情况下,fgf以至少0.001、0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更高的浓度引入培养基中。在一些实施方案中,bfgf以至多0.001、0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更低的浓度引入培养基中。
在一些实施方案中,将成纤维细胞生长因子引入包含hts细胞的培养基中,以引发hts细胞分化事件。在一些实施方案中,成纤维细胞生长因子为bfgf。在一些实施方案中,在添加fgf(例如,bfgf)后,将类固醇和细胞因子引入培养基中。
在一些实施方案中,类固醇是涉及广泛生理学过程如应激反应、免疫应答、炎症调节、碳水化合物代谢、蛋白质分解代谢、血液电解质水平以及表现的化学物质。在一些情况下,类固醇还包括类固醇激素,如糖皮质激素、盐皮质激素、雄激素、雌激素和孕激素。在一些实施方案中,类固醇包括但不限于,氢化可的松类型,如氢化可的松、醋酸氢化可的松、醋酸可的松、替可的松匹伐酯、泼尼松龙、甲泼尼龙和泼尼松;丙酮化合物,如曲安奈德、曲安奈德醇(triamcinolonealcohol)、莫米松、安西奈德、布地奈德、地奈德、醋酸氟轻松、氟轻松(fluocinoloneacetonide)和哈西奈德;倍他米松类型,如倍他米松、倍他米松磷酸钠、地塞米松、地塞米松磷酸钠和氟可龙;卤代的化合物,如氢化可的松-17-戊酸酯、卤米松、阿氯米松二丙酸酯、倍他米松戊酸酯、倍他米松二丙酸酯、泼尼卡酯、氯倍他松-17-丁酸酯、氯倍他索-17-丙酸酯、己酸氟考龙、特戊酸氟考龙和醋酸氟泼尼定;不稳定的前药酯,如氢化可的松-17-丁酸酯、氢化可的松-17-醋丙酯、氢化可的松-17-丙丁酯、环索奈德和泼尼卡酯。在一些实施方案中,类固醇是天然衍生的或化学改性的类固醇。在一些实施方案中,类固醇为地塞米松、倍他米松、泼尼松龙、甲泼尼龙、曲安奈德、曲安奈德醇或氢化可的松。在一些实施方案中,类固醇为地塞米松。如本文所用的,术语“地塞米松”是指地塞米松及其衍生物。在一些实施方案中,将地塞米松用于引导hts细胞分化为肝谱系。在一些实施方案中,将地塞米松与另一种药剂组合用于引导hts细胞分化为肝谱系。在一些实施方案中,该另一种药剂为细胞因子。
在一些实施方案中,类固醇以约0.001至约100μm、约0.005至约5μm、约0.01至约1μm、或约0.05至约0.5μm的浓度引入培养基中。
在一些情况下,类固醇以至少0.001、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2、0.25、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、3、4、5、6、7、8、9、10μm或更高的浓度引入培养基中。在一些实施方案中,类固醇以至多0.001、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2、0.25、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、3、4、5、6、7、8、9、10μm或更低的浓度引入培养基中。
在一些实施方案中,地塞米松以约0.001至约100μm、约0.005至约5μm、约0.01至约1μm、或约0.05至约0.5μm的浓度引入培养基中。
在一些实施方案中,地塞米松以至少0.001、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2、0.25、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、3、4、5、6、7、8、9、10μm或更高的浓度引入培养基中。在一些实施方案中,地塞米松以至多0.001、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2、0.25、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、3、4、5、6、7、8、9、10μm或更低的浓度引入培养基中。
在一些实施方案中,细胞因子是涉及细胞信号传导的约5-20dka的一类小蛋白质。在一些情况下,细胞因子包括趋化因子、干扰素、白介素和肿瘤坏死因子。趋化因子可作为指导细胞迁移的化学引诱物而发挥作用,并且可分为以下四个亚家族:cxc、cc、cx3c和xc。示例性趋化因子包括来自cc亚家族的趋化因子:ccl1、ccl2(mcp-1)、ccl3、ccl4、ccl5(rantes)、ccl6、ccl7、ccl8、ccl9(或ccl10)、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27以及ccl28;来自cxc亚家族的趋化因子:cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16以及cxcl17;来自xc亚家族的趋化因子:xcl1和xcl2;以及来自cx3c亚家族的趋化因子cx3cl1。
干扰素(ifn)包括i型干扰素(例如,ifn-α、ifn-β、ifn-ε、ifn-κ和ifn-ω)、ii型干扰素(例如ifn-γ)和iii型干扰素。在一些实施方案中,ifn-α被进一步分成约13个亚型,包括ifna1、ifna2、ifna4、ifna5、ifna6、ifna7、ifna8、ifna10、ifna13、ifna14、ifna16、ifna17和ifna21。
白介素由白细胞或白血细胞表达,并且其促进t淋巴细胞和b淋巴细胞以及造血细胞的发育和分化。示例性白介素包括il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8(cxcl8)、il-9、il-10、il-11、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-19、il-20、il-21、il-22、il-23、il-24、il-25、il-26、il-27、il-28、il-29、il-30、il-31、il-32、il-33、il-35和il-36。
肿瘤坏死因子(tnf)是一组调节凋亡的细胞因子。在一些情况下,tnf家族内有约19个成员,包括但不限于tnfα、淋巴毒素-α(lt-α)、淋巴毒素-β(lt-β)、t细胞抗原gp39(cd40l)、cd27l、cd30l、fasl、4-1bbl、ox40l以及tnf相关凋亡诱导配体(trail)。
在一些实施方案中,将地塞米松与细胞因子组合用于引导hts细胞分化为肝谱系。在一些情况下,该细胞因子为趋化因子、干扰素、白介素或肿瘤坏死因子。在一些情况下,该细胞因子为白介素。在一些实施方案中,将地塞米松与白介素组合用于引导hts细胞分化为肝谱系。在一些实施方案中,该白介素为il-6。在一些情况下,基于il-6通过gp130受体亚基的相互作用,进一步将il-6与其他细胞因子分在一组。在一些情况下,该il-6组的其他成员包括制癌蛋白m(osm)、il-11、睫状神经营养因子(cntf)、心肌营养蛋白-1(ct-1)、心肌营养蛋白样细胞因子(clc)和白血病抑制因子(lif)。在一些实施方案中,将地塞米松与il-6组合用于引导hts细胞分化为肝谱系。在一些实施方案中,将地塞米松与il-6组的成员组合用于引导hts细胞分化为肝谱系。在一些实施方案中,将地塞米松与osm、il-11、cntf、ct-1、clc或lif组合用于引导hts细胞分化为肝谱系。在一些实施方案中,将地塞米松与osm组合用于引导hts细胞分化为肝谱系。在一些实施方案中,细胞因子的il-6组为人il-6细胞因子或其片段。在一些实施方案中,osm为人osm。在一些实施方案中,人osm为重组人osm,或其片段。
在一些实施方案中,细胞因子以约0.001至约5000ng/ml、约0.01至约500ng/ml、约0.1至约100ng/ml、或约1至约50ng/ml的浓度引入培养基中。
在一些实施方案中,细胞因子以至少0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更高的浓度引入培养基中。在一些实施方案中,细胞因子以至多0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更低的浓度引入培养基中。
在一些实施方案中,osm以约0.001至约5000ng/ml、约0.01至约500ng/ml、约0.1至约100ng/ml、或约1至约50ng/ml的浓度引入培养基中。
在一些实施方案中,osm以至少0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更高的浓度引入培养基中。在一些实施方案中,osm以至多0.01、0.1、0.5、1、1.5、2、2.5、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200、300、400、500、1000ng/ml或更低的浓度引入培养基中。
在一些实施方案中,成纤维细胞生长因子(例如,bfgf)调节hts细胞内的生物标志物的表达。在一些实施方案中,该生物标志物为微小rna(mir)。在一些实施方案中,该生物标志物为mirna-124a。在一些实施方案中,成纤维细胞生长因子为bfgf。在一些实施方案中,bfgf上调或激活mirna-124a。在一些实施方案中,bfgf下调mirna-124a。
在一些实施方案中,将经bfgf处理的滋养层干细胞中的mirna-124a的表达水平与未处理的滋养层干细胞中的mirna-124a的表达水平进行比较。在一些实施方案中,经bfgf处理的滋养层干细胞中的mirna-124a的表达水平是未处理的滋养层干细胞中的mirna-124a的表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000倍或更多。在一些实施方案中,经bfgf处理的滋养层干细胞中的mirna-124a的表达水平是未处理的滋养层干细胞中的mirna-124a的表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000倍或更少。
在一些实施方案中,mirna-124a的激活或上调引发滋养层干细胞中的定形内胚层(de)特化。在一些实施方案中,de特化在约0.1至约96小时、约0.5至约36小时、约1至约24小时、约2至约18小时、约4至约12小时、或约6至约10小时之间发生。
在一些实施方案中,de特化发生在用bfgf诱导后至少0.1、0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、36、48、72小时或更长的时间。在一些实施方案中,de特化发生在用bfgf诱导后至多0.1、0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、36、48、72小时或更短的时间。在一些实施方案中,de特化发生在用bfgf诱导后约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18小时。在一些实施方案中,de特化发生在用bfgf诱导后约6、7、8、9或10小时。
在一些实施方案中,de特化与一组生物标志物相关。在一些实施方案中,该生物标志物包括叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)、同源结构域蛋白mixl1、sry-box2(sox2)、转录因子nanog和oct4。在一些实施方案中,de特化的特征在于选自以下的生物标志物的表达升高:叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)、同源结构域蛋白mixl1、sry-box2(sox2)、转录因子nanog和oct4。在一些实施方案中,de特化的特征在于选自以下的生物标志物的表达升高:叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)、sry-box2(sox2)、转录因子nanog和oct4。在一些实施方案中,de特化的特征在于选自以下的生物标志物的表达降低:叉头框蛋白a2(foxa2)、sry-box17(sox17)、goosecoid(gsc)、同源结构域蛋白mixl1、sry-box2(sox2)、转录因子nanog和oct4。在一些实施方案中,de特化的特征在于同源结构域蛋白mixl1的表达降低。
在一些实施方案中,将bfgf诱导的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的表达水平与未诱导的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的表达水平进行比较。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平。在一些实施方案中,foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平的约1至约20,000倍、约2至约1000倍、或约10至约100倍。在一些实施方案中,bfgf处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、10,000倍或更高。在一些实施方案中,bfgf处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的蛋白质表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、10,000倍或更低。
在一些实施方案中,升高的表达水平为增加的基因表达水平。在一些实施方案中,foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平的约1至约20,000倍、约2至约1000倍、或约10至约100倍。在一些实施方案中,bfgf处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、10,000倍或更高。在一些实施方案中,bfgf处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平是未处理的滋养层干细胞中的foxa2、sox17、gsc、mixl1、sox2、nanog和oct4的基因表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、10,000倍或更低。
在一些实施方案中,将类固醇与细胞因子的混合物用于引导de分化为肝谱系。在一些实施方案中,该混合物包含地塞米松,并将制癌蛋白m用于引导de分化为肝谱系。在一些实施方案中,在添加bfgf之前、之后或与之同时将该混合物引入包含hts细胞的培养基中。在一些实施方案中,在约0.5至约96小时、约1至约48小时、约2至约36小时、约3至约24小时、约4至约12小时、或约6至约10小时之间,将该混合物引入包含hts细胞的培养基中。
在一些实施方案中,在添加bfgf后至少0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、36、48、60、72小时或更长时间,将该混合物引入包含hts细胞的培养基中。在一些实施方案中,在添加bfgf后至多0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、36、48、60、72小时或更短的时间,将该混合物引入包含hts细胞的培养基中。在一些实施方案中,在添加bfgf后约4、5、6、7、8、9、10、11、12、13、14、15、16、17或18小时,将该混合物引入包含hts细胞的培养基中。在一些实施方案中,在添加bfgf后约6、7、8、9、10、11或12小时,将该混合物引入包含hts细胞的培养基中。
在一些实施方案中,将hts细胞在包含bfgf、地塞米松和制癌蛋白m的培养基中温育约0.5至约100天、约1至约50天、约2至约30天、约3至约15天、或约4至约12天。
在一些实施方案中,将hts细胞在包含bfgf、地塞米松和制癌蛋白m的培养基中温育至少0.51、2、3、4、5、6、7、8、9、10、11、12、13、14天或更长时间。在一些实施方案中,将hts细胞在包含bfgf、地塞米松和制癌蛋白m的培养基中温育至多0.51、2、3、4、5、6、7、8、9、10、11、12、13、14天或更短时间。
在一些实施方案中,将滋养层干细胞分成肝细胞样细胞发育的四个阶段。在一些实施方案中,该四个阶段包括原条到de阶段、肝特化内胚层、肝母细胞阶段以及胎儿和成人肝细胞样细胞阶段。在一些实施方案中,四个阶段中的每一个均与一组生物标志物相关,该组生物标志物包括c-x-c趋化因子受体4型(cxcr4)、叉头框蛋白a2(foxa2)、sry-box17(sox17)、己糖胺酶a(α多肽)(hhex)、胆汁盐输出泵(bsep)、运甲状腺素蛋白(ttr)、白蛋白(alb)、酪氨酸氨基转移酶(tat)、细胞色素p4507a1(cyp7a1)、葡萄糖-6-磷酸酶(g6pc)、丝氨酸蛋白酶抑制蛋白肽酶抑制剂进化枝a(α-1抗蛋白酶,抗胰蛋白酶)成员1(serpina1)、atp-结合盒亚家族c(abcc2)、ccaat-增强子-结合蛋白β(c/ebpβ)、肝细胞核因子1-α(hnf1α)、肝细胞核因子4-α(hnf4α)、α-1-胎蛋白(afp)、角蛋白8(krt8)、磷酸烯醇丙酮酸羧激酶2线粒体(pck2)、细胞色素p4502b6(cyp2b6)、糖原合成酶2(gys2)、肝细胞核因子6(hnf6)、氨基甲酰-磷酸合成酶1线粒体(cps1)、醇脱氢酶1c(i类)γ多肽(adh1c)、连接蛋白32(cx32)、细胞色素p4503a4(cyp3a4)、prospero同源框1(prox1)、色氨酸2,3-双加氧酶(tdo2)、载脂蛋白f(apof)、角蛋白18(krt18)、角蛋白19(krt19)或19号染色体开放阅读框80(血管生成素样蛋白8、肝细胞癌相关基因td26、lipasin)(β调理素)。在一些实施方案中,四个阶段中的每一个均与一组生物标志物相关,该组生物标志物包括cxcr4、foxa2、sox17、hhex、ttr、alb、tat、cyp7a1、bsep、serpina1、g6pc、abcc2、c/ebpβ、hnf1α或hnf4α。
在一些情况下,原条到de阶段是这样的阶段,其中hts细胞尚未进入肝分化阶段或即将进入肝分化阶段。在一些实施方案中,在原条到de阶段的hts细胞经历de特化。在一些情况下,在用fgf(例如,bfgf)诱导后,hts细胞保持在原条到de阶段约0.1至约24小时、约0.5至约18小时、或约1至约12小时。在一些情况下,在用fgf(例如,bfgf)诱导后,hts细胞保持在原条到de阶段至多0.1、0.5、1、2、3、4、5、6、7、8、9、10小时或更短的时间。在一些情况下,在用fgf(例如,bfgf)诱导后,hts细胞保持在原条到de阶段至少0.1、0.5、1、2、3、4、5、6、7、8、9、10小时或更长的时间。
在一些情况下,原条到de阶段中的hts细胞的特征在于选自以下的一组生物标志物:cxcr4、foxa2、sox17、hhex、bsep、ttr、alb、tat、cyp7a1、g6pc、serpina1、abcc2、c/ebpβ、hnf1α、hnf4α、afp、krt8、pck2、cyp2b6、gys2、hnf6、cps1、adh1c、cx32、cyp3a4、prox1、tdo2、apof、krt18、krt19以及β调理素。在一些实施方案中,原条到de阶段与选自cxcr4、foxa2、sox17和hhex的一组生物标志物相关。
在一些实施方案中,原条到de阶段与cxcr4、foxa2、sox17和hhex的升高的表达水平相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平或增加的基因表达水平。在一些实施方案中,升高的表达水平为增加的基因表达水平。在一些实施方案中,cxcr4、foxa2、sox17和hhex的增加的基因表达水平是相对于未进入原条到de阶段的等同滋养层干细胞中的cxcr4、foxa2、sox17和hhex的基因表达水平而言的。在一些实施方案中,cxcr4、foxa2、sox17和hhex的增加的基因表达水平为约0.1至约10,000、约1至约5000、或约2至约1000。在一些实施方案中,cxcr4、foxa2、sox17和hhex的增加的基因表达水平为未进入原条到de阶段的等同hts细胞中的cxcr4、foxa2、sox17和hhex的基因表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更高。在一些实施方案中,cxcr4、foxa2、sox17和hhex的基因表达水平是未进入原条到de阶段的等同hts细胞中的cxcr4、foxa2、sox17和hhex的基因表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更低。
在一些情况下,肝特化内胚层的特征在于肝特化后上皮细胞的首次出现。在一些实施方案中,通过添加类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物来引发肝特化内胚层阶段。在一些情况下,在约1至约48小时、约2至约24小时、约3至约18小时,或约4至约12小时之间向培养基添加类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物。在一些情况下,在fgf(例如,bfgf)诱导后至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16小时或更长的时间向培养基添加类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物。在一些情况下,在fgf(例如,bfgf)诱导后至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16小时或更短的时间,向培养基添加类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物。
在一些情况下,在用类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物诱导后,hts细胞保持在肝特化内胚层阶段约1至约72小时、约2至约36小时、约3至约24小时,或约4至约12小时。在一些情况下,在用类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物诱导后,hts细胞保持在肝特化内胚层阶段至少6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36个小时或更长的时间。在一些情况下,在用类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物诱导后,hts细胞保持在肝特化内胚层阶段至多6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36个小时或更短的时间。
在一些情况下,肝特化内胚层阶段中的hts细胞的特征在于选自以下的一组生物标志物:cxcr4、foxa2、sox17、hhex、bsep、ttr、alb、tat、cyp7a1、g6pc、serpina1、abcc2、c/ebpβ、hnf1α、hnf4α、afp、krt8、pck2、cyp2b6、gys2、hnf6、cps1、adh1c、cx32、cyp3a4、prox1、tdo2、apof、krt18、krt19以及β调理素。在一些实施方案中,肝特化内胚层与选自sox17、ttr、alb、tat和cyp7a1的一组生物标志物相关。
在一些实施方案中,肝特化内胚层与sox17、ttr、alb、tat和cyp7a1的升高的表达水平相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平,或增加的基因表达水平。在一些实施方案中,升高的表达水平为增加的基因表达水平。在一些实施方案中,sox17、ttr、alb、tat和cyp7a1的增加的基因表达水平是相对于未进入肝特化内胚层阶段的等同的滋养层干细胞中的sox17、ttr、alb、tat和cyp7a1的基因表达水平而言的。在一些实施方案中,sox17、ttr、alb、tat和cyp7a1的基因表达水平为约1至约10,000倍、约2至约1000倍,或约2至约100倍。在一些实施方案中,sox17、ttr、alb、tat和cyp7a1的基因表达水平是未进入肝特化内胚层阶段的等同的滋养层干细胞中sox17、ttr、alb、tat和cyp7a1的基因表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更高。在一些实施方案中,sox17、ttr、alb、tat和cyp7a1的基因表达水平是未进入肝特化内胚层阶段的等同的滋养层干细胞中sox17、ttr、alb、tat和cyp7a1的基因表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更低。
在一些实施方案中,hts细胞在类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物添加后约1至约36小时、约3至约24小时,或约6至约12小时后进入肝母细胞阶段。在一些实施方案中,hts细胞在类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物添加后约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时后进入肝母细胞阶段。
在一些实施方案中,hts细胞保持在肝母细胞阶段约1至约30天、约2至约12天,或约3至约7天。在一些实施方案中,hts细胞保持在肝母细胞阶段至多1、2、3、4、5、6、7、8天或更短。在一些实施方案中,hts细胞保持在肝母细胞阶段至少1、2、3、4、5、6、7、8天或更长。
在一些情况下,肝母细胞阶段中的hts细胞的特征在于选自以下的一组生物标志物:cxcr4、foxa2、sox17、hhex、bsep、ttr、alb、tat、cyp7a1、g6pc、serpina1、abcc2、c/ebpβ、hnf1α、hnf4α、afp、krt8、pck2、cyp2b6、gys2、hnf6、cps1、adh1c、cx32、cyp3a4、prox1、tdo2、apof、krt18、krt19以及β调理素。在一些实施方案中,肝母细胞阶段与选自ttr、alb、tat、cyp7a1和bsep的一组生物标志物相关。
在一些实施方案中,肝母细胞阶段与ttr、alb、tat、cyp7a1和bsep的表达水平升高相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平,或增加的基因表达水平。在一些实施方案中,升高的表达水平为增加的基因表达水平。在一些实施方案中,ttr、alb、tat、cyp7a1和bsep的增加的基因表达水平是相对于未进入肝母细胞阶段的等同的hts细胞中的ttr、alb、tat、cyp7a1和bsep的基因表达水平而言的。在一些实施方案中,ttr、alb、tat、cyp7a1和bsep的基因表达水平为约1至约10,000倍、约2至约1000倍,或约2至约100倍。
在一些实施方案中,ttr、alb、tat、cyp7a1和bsep的基因表达水平是未进入肝母细胞阶段的等同的hts细胞中ttr、alb、tat、cyp7a1和bsep的基因表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、200、300、400、500、1000、5000倍或更高。在一些实施方案中,ttr、alb、tat、cyp7a1和bsep的基因表达水平是未进入肝母细胞阶段的等同的hts细胞中ttr、alb、tat、cyp7a1和bsep的基因表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、200、300、400、500、1000、5000倍或更低。
在一些情况下,hts细胞在类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物添加后的约1至约20天、约2至约10天,或约3至约6天进入胎儿和成人肝细胞样阶段。在一些情况下,hts细胞在类固醇(例如,地塞米松)与细胞因子(例如,制癌蛋白m)的混合物添加后的约1、2、3、4、5或6天后进入胎儿和成人肝细胞样阶段。
在一些实施方案中,hts细胞保持在胎儿和成人肝细胞样阶段约1至约100天、约2至约50天、约3至约30天、约4至约12天,或约6至约10天。在一些实施方案中,hts细胞保持在胎儿和成人肝细胞样阶段至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、60天或更短。在一些实施方案中,hts细胞保持在胎儿和成人肝细胞样阶段至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、60天或更长。
在一些情况下,胎儿和成人肝细胞样阶段中的hts细胞的特征在于选自以下的一组生物标志物:cxcr4、foxa2、sox17、hhex、bsep、ttr、alb、tat、cyp7a1、g6pc、serpina1、abcc2、c/ebpβ、hnf1α、hnf4α、afp、krt8、pck2、cyp2b6、gys2、hnf6、cps1、adh1c、cx32、cyp3a4、prox1、tdo2、apof、krt18、krt19以及β调理素。在一些实施方案中,胎儿和成人肝细胞样细胞阶段与选自hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的一组生物标志物相关。
在一些实施方案中,胎儿和成人肝细胞样细胞阶段与hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的升高的表达水平相关。在一些实施方案中,升高的表达水平为增加的蛋白质表达水平,或增加的基因表达水平。在一些实施方案中,升高的表达水平为增加的基因表达水平。在一些实施方案中,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的升高的基因表达水平是相对于未进入胎儿和成人肝细胞样细胞阶段的等同的hts细胞中hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平而言的。在一些实施方案中,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平为约1至约10,000倍、约2至约5000倍,或约2至约1000倍。
在一些实施方案中,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平是未进入胎儿和成人肝细胞样细胞阶段的等同的hts细胞中hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平的至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更高。在一些实施方案中,hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平是未进入胎儿和成人肝细胞样细胞阶段的等同的hts细胞中hhex、bsep、ttr、alb、tat、serpina1、g6pc、abcc2、c/ebpβ、hnf1α和hnf4α的基因表达水平的至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、100、1000、5000倍或更低。
在一些实施方案中,胎儿和成人肝细胞样细胞阶段中的细胞成熟成为诱导的肝细胞。在一些实施方案中,胎儿和成人肝细胞样细胞阶段中的细胞为诱导的肝细胞。在一些实施方案中,诱导的肝细胞不会进一步分化。在一些实施方案中,诱导的肝细胞到达终末分化阶段。在一些实施方案中,诱导的肝细胞作为稳定的细胞保持长达2、3、4、5、6、7、8、9、10、12、15、18、20、25、30、35、40、45、50、55、60、70、80、90、100代或更多代。在一些实施方案中,诱导的肝细胞作为稳定的细胞保持长达7天、10天、14天、21天、30天、60天、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年,或更久。
使用方法
在某些实施方案中,本文描述了利用诱导的肝细胞以用于一种或多种用途的方法。在一些实施方案中,利用诱导的肝细胞筛选用于治疗或预防疾病或病症的化合物。在一些实施方案中,所述筛选过程包括化合物、酶诱导和毒性研究中的一项或多项研究。在一些实施方案中,施用诱导的肝细胞用于治疗肝损伤,如由肝相关疾病或病症引起的肝组织的受损或损失。在其他的实施方案中,诱导的肝细胞用于产生治疗性蛋白(例如,激素)、细胞因子、胆固醇、碳水化合物、胆汁或其组合。在其他的实施方案中,诱导的肝细胞用于肝再生。在另外的实施方案中,诱导的肝细胞用作基因治疗的来源。
用于筛选化合物的诱导的肝细胞
在一些实施方案中,利用诱导的肝细胞筛选用于治疗或预防疾病或病症的化合物。在一些实施方案中,该方法包括使分离的诱导的肝细胞与化合物接触。在一些实施方案中,该方法包括使分离的原代肝细胞与该化合物接触。在其他的实施方案中,该方法进一步包括检测该诱导的肝细胞中至少一种生物标志物(例如,基因、转录物或蛋白质)的活性变化。在其他的实施方案中,该方法进一步包括检测原代肝细胞中至少一种生物标志物(例如,基因、转录物或蛋白质)的水平变化。在一些实施方案中,至少一种生物标志物的水平变化为至少一种生物标志物的基因表达水平变化。在一些实施方案中,该生物标志物包括细胞色素p450超家族的成员。在一些实施方案中,该生物标志物包括细胞色素p450家族:cyp1、cyp2、cyp3、cyp4、cyp5、cyp7、cyp8、cyp11、cyp17、cyp19、cyp20、cyp21、cyp24、cyp26、cyp27、cyp39、cyp46、cyp51及它们各自的亚家族成员。在一些实施方案中,该生物标志物包括cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4或cyp7a1。
在一些实施方案中,化合物(例如,药物)通过肝代谢。在一些情况下,肝代谢该化合物(例如,药物)的主要机制是酶的p450细胞色素系统。在一些情况下,如果代谢该化合物的速率太快,则它可能降低该化合物的功效。或者,如果代谢该化合物的速率太慢,则它可能允许在宿主细胞中产生毒性。因此,在一些情况下,评估化合物的代谢,例如,它的毒性。
在一些情况下,该化合物用作针对酶的细胞色素p450家族的成员的诱导物或抑制剂。在一些情况下,该化合物是针对酶的细胞色素p450家族的成员的诱导物。在一些情况下,诱导物启动或增强酶如酶的细胞色素p450家族的成员的表达水平。在一些情况下,诱导物启动或增强酶的细胞色素p450家族的成员的基因表达水平。在一些情况下,诱导物启动或增强酶的细胞色素p450家族的成员的蛋白质表达水平。在一些情况下,该化合物是针对酶的细胞色素p450家族的成员的抑制剂。在一些情况下,抑制剂抑制、降低或干扰酶如酶的细胞色素p450家族的成员的表达水平。在一些情况下,抑制剂抑制、降低或干扰酶的细胞色素p450家族的成员的基因表达水平。在一些情况下,抑制剂抑制、降低或干扰酶的细胞色素p450家族的成员的蛋白质表达水平。在一些情况下,将酶如酶的细胞色素p450家族的成员的表达水平与该酶的对照表达水平进行比较。在一些实施方案中,该酶的对照表达水平是未经该化合物诱导的酶的表达水平。
在一些情况下,在使分离的诱导的肝细胞与化合物接触之后,检测到细胞色素p450超家族的成员的基因表达变化。在一些情况下,将在已与化合物接触的分离的诱导的肝细胞中来自细胞色素p450超家族的成员的生物标志物的基因表达水平与在未与该化合物接触的等同的分离的诱导的肝细胞中来自细胞色素p450超家族的生物标志物的基因表达水平进行比较,或与原代肝细胞进行比较。
在一些情况下,在使分离的诱导的肝细胞与化合物接触之后,检测到选自细胞色素p450家族:cyp1、cyp2、cyp3、cyp4、cyp5、cyp7、cyp8、cyp11、cyp17、cyp19、cyp20、cyp21、cyp24、cyp26、cyp27、cyp39、cyp46、cyp51及它们各自的亚家族成员的生物标志物的基因表达水平变化。在一些情况下,将在已与化合物接触的分离的诱导的肝细胞中来自细胞色素p450家族:cyp1、cyp2、cyp3、cyp4、cyp5、cyp7、cyp8、cyp11、cyp17、cyp19、cyp20、cyp21、cyp24、cyp26、cyp27、cyp39、cyp46、cyp51及它们各自的亚家族成员的生物标志物的基因表达水平与在未与该化合物接触的等同的分离的诱导的肝细胞中来自细胞色素p450家族:cyp1、cyp2、cyp3、cyp4、cyp5、cyp7、cyp8、cyp11、cyp17、cyp19、cyp20、cyp21、cyp24、cyp26、cyp27、cyp39、cyp46、cyp51及它们各自的亚家族成员的生物标志物的基因表达水平进行比较,或与原代肝细胞进行比较。
在一些情况下,在使分离的诱导的肝细胞与化合物接触之后,检测到选自cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4和cyp7a1的生物标志物的基因表达水平变化。在一些情况下,将在已与化合物接触的分离的诱导的肝细胞中选自cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4和cyp7a1的生物标志物的基因表达水平与在未与该化合物接触的等同的分离的诱导的肝细胞中选自cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4和cyp7a1的生物标志物的基因表达水平进行比较,或与原代肝细胞进行比较。
在一个实施方案中,本文提供了针对诱导细胞变化的能力筛选化合物的方法。在一个实施方案中,该方法包括使分离的诱导的肝细胞与该化合物接触。在另一个实施方案中,该方法包括使分离的原代肝细胞与该化合物接触。在另一个实施方案中,该方法进一步包括,如在再生期间,检测该诱导的肝细胞的变化(例如,增殖)的诱导。在另一个实施方案中,该方法进一步包括,如在再生期间,检测该原代肝细胞的变化(例如,增殖)的诱导。
本文还提供了针对该细胞的细胞毒性或调节筛选化合物的方法,该方法包括使诱导的肝细胞与该化合物接触。在另一个实施方案中,该方法进一步包括测定由接触该化合物导致的细胞的任何表型或代谢变化,以及将所述变化与细胞毒性或细胞功能或生物化学的任何其他变化相关联。在另一个实施方案中,促进了分化的药物、毒素或潜在调节剂的筛选。可将这些物质(例如,药物、毒素或潜在调节剂)添加至培养基。
本文提供的一个实施方案描述了筛选增殖因子、分化因子和药物的方法。在一个实施方案中,诱导的肝细胞或原代肝细胞用来筛选影响培养物中的诱导的肝细胞或原代肝细胞的特征的因子(如小分子药物、肽、多核苷酸等)或条件(如培养条件或操作)。在一个实施方案中,该系统具有不会由于测试化合物对饲养细胞的扰动引起的继发效应而复杂化的优点。在另一个实施方案中,测试了生长影响物质。在另一个实施方案中,从培养物中取出条件培养基并用更简单的培养基代替。在另一个实施方案中,随后用作为替代条件培养基的组分的候选物的可溶性因子的不同混合物处理不同的孔。如果所处理的细胞以令人满意的方式(最佳地以及在条件培养基中)被保持并增殖,则确定各混合物的功效。可以通过根据测试方案处理细胞并随后确定所处理的细胞是否发展出特定谱系的分化细胞的功能或表型特性来测试潜在分化因子或条件。
在一个实施方案中,诱导的肝细胞或原代肝细胞用来筛选细胞分化的潜在调节剂。例如,在一个用于筛选细胞分化的调节剂的测定中,该诱导的肝细胞或原代肝细胞可根据情况需要在不含调节剂或存在调节剂的血清下进行培养,并且可以检测对分化的影响。在另一个实施方案中,本文所述的筛选方法可用来研究与细胞发育相关的病况和筛选该病况的潜在治疗性药物或矫味药或调节剂。例如,在一个实施方案中,将该诱导的肝细胞或原代肝细胞的发育与具有疾病或病况的细胞的发育进行比较。
在一个实施方案中,生物标志物如基因和蛋白质表达可在从诱导的肝细胞或原代肝细胞获得的不同细胞群体之间进行比较,并用来鉴定和表征在增殖过程中上调或下调的因子,并产生受影响基因的核苷酸拷贝。
在一个实施方案中,无饲养细胞的诱导的肝细胞或原代肝细胞培养物还可用于在药物研究中测试药物化合物。候选药物化合物的活性的评估通常包括使诱导的肝细胞或原代肝细胞与该候选化合物组合,测定任何产生的变化,并随后将该化合物的作用与观察到的变化相关联。在另一个实施方案中,所述筛选已完成,例如因为该化合物被设计为对某些细胞类型具有药物作用,或因为化合物被设计为在其他方面具有非预期的副作用。在另一个实施方案中,对两种或更多种药物进行联合测试(通过与细胞同时或顺序地混合),以检测可能的药物之间的相互作用在另一个实施方案中,最初针对潜在的毒性筛选化合物。在另一个实施方案中,通过对细胞活力、存活、形态、某些标志物的表达或释放、受体或酶、dna合成或修复的影响来测定细胞毒性。
术语“治疗”、“处理”等在本文用来意指获得所需的药理学和/或生理学效应。在一些实施方案中,采用本文所述的诱导的肝细胞的制剂对个体(例如,怀疑患有和/或在遗传上易感染肝相关疾病或病症)进行预防性治疗,并且这种预防性治疗完全或部分地预防肝相关疾病或病症或其体征或症状。在一些实施方案中,对个体进行治疗性治疗(例如,当个体患有肝相关疾病或病症时),这种治疗性治疗引起该疾病或病症的部分或完全治愈和/或逆转归因于该疾病或病症的副作用和/或使该疾病或病症稳定和/或延缓该疾病或病症的进展和/或引起该疾病或病症的消退。
将诱导的肝细胞施用(移植)到需要治疗的区域通过,例如且非限制性地,在手术期间局部输注、通过注射、通过导管或通过植入物来实现,所述植入物是多孔的、无孔的或凝胶状的材料,包括膜,如sialastic膜或纤维。
将组合物“移植”到哺乳动物中是指通过本领域建立的任何方法将该组合物引入哺乳动物的体内。引入的组合物为“移植物”且该哺乳动物为“受体”。移植物和受体可以是同基因的、同种异体的或异基因的。此外,该移植可以是自体移植。
“有效量”是足以实现预期目的的治疗剂的量。例如,诱导的肝细胞的有效量是根据情况可足以导致原代肝细胞数增加的量。治疗或减轻肝相关疾病或病症的组合物的有效量是足以降低或消除肝相关疾病或病症的症状的该组合物的量。给定治疗剂的有效量将随着因子如该药剂的性质、施用途径、接受该治疗剂的动物的大小和物种以及施用的目的而变化。
在一个实施方案中,本文进一步提供了遗传修饰的诱导的肝细胞。操作修饰了该细胞的各种性能,例如,使它对某些环境条件更适应或更具抗性,和/或由此诱导一种或多种特定物质的产生,所述物质可以例如改善该细胞的活力。可以进行这种遗传改变以使该细胞更适用于移植,例如,以避免其被受体排斥(关于基因治疗程序的综述,参见anderson,science,256:808;mulligan,science,926;miller,nature,357:455;vanbrunt,biotechnology,6(10):1149;和yu等人,genetherapy,1:13)。
“载体”是指重组dna或rna构建体,如质粒、噬菌体、重组病毒,或在引入至合适的宿主细胞时导致本文所述的祖细胞的修饰的其他载体。合适的表达载体是本领域普通技术人员公知的,并包括在真核细胞和/或原核细胞中可复制的那些载体以及保持游离型的那些载体或整合到宿主细胞基因组内的那些载体。
载体的构建使用在例如如在sambrook等人,1989中描述的技术来实现。在一个实施方案中,分离的质粒或dna片段以所需形式被切割、裁制并再连接以产生质粒。如果需要,使用任何合适的方法进行用以确认构建的质粒中的正确序列的分析。用于构建表达载体、制备体外转录物、将dna引入宿主细胞和进行评价基因表达和功能的分析的合适的方法是已知的。例如,使用可以基于本文提供的序列的适当标记的探针,通过常规的southern印迹法、用于量化mrna的转录的northern印迹法、斑点印迹法(dna或rna分析)或原位杂交,直接在样品中测量基因的存在、扩增和/或表达。
如本文所用的术语如“转染”、“转化”等旨在表示核酸以功能形式向细胞或有机体的转移。此类术语包括将核酸转移至细胞的各种手段,包括用capo4转染、电穿孔法、病毒转导、脂质转染、使用脂质体和/或其他递送媒介物的递送。
用于治疗疾病或病症的诱导的肝细胞
在一些实施方案中,施用诱导的肝细胞以用于治疗肝损伤。在一些实施方案中,肝损伤包括由外部因素引起的肝组织的受损或损失,如对宿主的损伤,例如对个体的损伤,或由于手术引起的肝组织的受损或损失。在一些实施方案中,肝损伤包括由肝相关疾病或病症引起的肝组织的损伤或损失。在一些实施方案中,肝相关疾病或病症是急性肝疾病或病症如急性肝衰竭,或者是慢性肝疾病或病症如肝硬化。在一些实施方案中,肝相关疾病或病症由遗传因素、化学品或病原体感染引起。
示例性的肝相关疾病或病症包括但不限于,alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(例如,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、甲型、乙型、丙型病毒性肝炎以及威尔逊病。
在一些实施方案中,施用诱导的肝细胞以用于治疗急性肝疾病或病症。在其他的实施方案中,施用诱导的肝细胞以用于治疗慢性肝疾病或病症。在一些实施方案中,施用诱导的肝细胞以用于治疗alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(例如,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、甲型、乙型、丙型病毒性肝炎、威尔逊病或其组合。
在一些实施方案中,诱导的肝细胞与附加的治疗剂联合施用以用于治疗肝相关疾病或病症。在一些实施方案中,该附加的治疗剂包括但不限于,姜黄素、白藜芦醇、沙利度胺、考来烯胺(questran)、他克莫司(prograf)、熊去氧胆酸(actigall)、干扰素、利尿剂如髓袢利尿剂和肝移植。
在一些实施方案中,对肝有毒的化学品导致化学品诱导的肝疾病。在一些实施方案中,对肝有毒的化学品包括药物;消耗品如醇、食品添加剂或防腐剂;以及化学和环境毒素。在一些情况下,引起肝损伤的药物包括但不限于,对乙酰氨基酚、别嘌呤醇、合成代谢类固醇、达那唑、丹曲林、丙咪嗪、异烟肼、甲氨蝶呤、甲基多巴、烟酸、呋喃妥因、吩噻嗪、苯妥英、水杨酸酯、他汀类药物、特比萘芬hcl、噻苯达唑、二氧化钍、甲苯磺丁脲、氯丙嗪/丙戊酸和氯磺丙脲/红霉素。
在一些实施方案中,病原体感染引起肝相关疾病或病症。在一些实施方案中,病原体为病毒、细菌、真菌或寄生虫。在一些实施方案中,该病原体为病毒。在一些实施方案中,病毒感染引起肝相关疾病或病症。
在一些实施方案中,病毒为dna病毒或rna病毒。在一些情况下,dna病毒为单链(ss)dna病毒、双链(ds)dna病毒或含有ss和dsdna区的dna病毒。在一些情况下,rna病毒为单链(ss)rna病毒或双链(ds)rna病毒。有时,ssrna病毒被进一步分类为正义rna病毒或负义rna病毒。
在一些情况下,dsdna病毒来自家族:肌病毒科,短尾病毒科,管状病毒科、疱疹病毒科(alloherpesviridae)、疱疹病毒科、疱疹病毒科(malacoherpesviridae)、脂毛病毒科、棒状dna病毒科、腺病毒科、ampullaviridae、鳞翅目昆虫病毒科、asfaviridae、杆状病毒科、bicaudaviridae、clavaviridae、被脂病毒科、福塞尔噬菌体科、globuloviridae、古老病毒科、hytrosaviridae、虹膜病毒科、marseilleviridae、mimiviridae、nimaviridae、pandoraviridae、乳头状瘤病毒科、藻dna病毒科、原生病毒科、多dna病毒、多瘤病毒科、痘病毒科、sphaerolipoviridae和覆盖层病毒科。
在一些情况下,ssdna病毒来自家族:指环病毒科(anelloviridae)、bacillariodnaviridae、bidnaviridae、圆环病毒科、双粒病毒科、丝杆病毒科、微病毒科、矮缩病毒科、微小病毒科和spiraviridae。
在一些情况下,含有ss和dsdna区的dna病毒来自pleolipoviruses组。在一些情况下,pleolipoviruses包括嗜盐古细菌属hispanica多形性病毒1、盐几何菌属多形性病毒1、盐红菌属多形性病毒1、盐红菌属多形性病毒2、盐红菌属多形性病毒3和盐红菌属多形性病毒6。
在一些情况下,dsrna病毒来自家族:双rna病毒科、金色病毒科、囊病毒科、endornaviridae、减毒病毒科、megavirnaviridae、分体病毒科、picobirnaviridae、呼肠孤病毒科、轮状病毒属和全病毒科。
在一些情况下,正义ssrna病毒来自家族:α弯曲病毒科、α四病毒科、alvernaviridae、动脉病毒科、星状病毒科、杆状rna病毒科、β弯曲病毒科、雀麦花叶病毒科、嵌杯病毒科、carmotetraviridae、纺锤病毒科、冠状病毒科、二顺反子病毒科、黄病毒科、γ弯曲病毒科、传染性软腐病病毒科(iflaviridae)、轻病毒科、黄矮病毒科、marnaviridae、mesoniviridae、裸露rna病毒科、野田村病毒科、permutotetraviridae、细小rna病毒科、马铃薯y病毒科、杆状套病毒科、secoviridae、披膜病毒科、蕃茄丛矮病毒科、芜菁黄花叶病毒科和帚状病毒科(virgaviridae)。
有时,负义ssrna病毒来自家族:borna病毒科、纤丝病毒科、副粘病毒科、弹状病毒科、nyamiviridae、砂粒样病毒科、布尼亚病毒科、ophioviridae和正粘病毒科。
示例性的病毒包括但不限于:abelson白血病病毒、艾贝尔逊白血病病毒、艾贝尔逊鼠白血病病毒、艾贝尔逊病毒、急性喉气管支气管炎病毒、阿德莱德河病毒(adelaiderivervirus)、腺相关病毒群、腺病毒、非洲马病病毒、非洲猪瘟病毒、aids病毒、艾刘蒂貂病微病毒、α逆转录病毒、甲病毒属、alv相关病毒、amapari病毒、口蹄疫病毒属、呼肠病毒属、虫媒病毒、虫媒病毒c、虫媒病毒a组、虫媒病毒b组、砂粒样病毒属组、阿根廷出血热病毒、阿根廷出血热病毒、动脉病毒属、星形病毒、ateline疱疹病毒组、假狂犬病病毒、奥拉病毒、ausduk病病毒、澳洲蝙蝠狂犬病病毒、禽腺病毒属、禽幼红细胞增多症病毒、禽传染性支气管炎病毒、禽白血病病毒、禽白血病病毒、禽淋巴瘤病毒、禽成髓细胞瘤病毒、禽副粘病毒、禽肺脑炎病毒、禽网状内皮组织增殖病病毒、禽肉瘤病毒、禽c型逆转录病毒组、禽嗜肝dna病毒属、禽痘病毒属、b病毒、b19病毒、babanki病毒、狒狒疱疹病毒、杆状病毒、barmah森林病毒、比巴鲁病毒、berrimah病毒、β逆转录病毒、双rna病毒、bittner病毒、bk病毒、黑港渠病毒、蓝舌病毒、玻利维亚出血热病毒、boma病病毒、羊边境病病毒、博纳病病毒、牛α-疱疹病毒1、牛α-疱疹病毒2、牛冠状病毒、牛短暂热病毒、牛免疫缺陷病毒、牛白血病病毒、牛白血病病毒、牛乳头炎病毒、牛乳头瘤病毒、牛丘疹性口炎病毒、牛细小病毒、牛合胞病毒、牛c型肿瘤病毒、牛病毒性腹泻病毒、buggycreek病毒、弹状病毒群、木扬委那病毒超群、布尼亚病毒、伯基特淋巴瘤病毒、班姆巴热、ca病毒、杯状病毒、加州脑炎病毒、骆驼痘病毒、金丝雀痘病毒、犬疱疹病毒、犬冠状病毒、犬瘟热病毒、犬疱疹病毒、犬微小病毒、犬细小病毒、canodelgadito病毒、山羊关节炎病毒、山羊脑炎病毒、山羊疱疹病毒、山羊痘病毒属、心病毒属、豚鼠疱疹病毒1、猕猴疱疹病毒1、猕猴疱疹病毒1、猕猴疱疹病毒2、钱迪普拉病毒、changuinola病毒、水道猫鱼病毒、查里维勒河病毒、水痘病毒、屈曲病毒、黑猩猩疱疹病毒、白鲑呼肠弧病毒(chubreovirus)、鲑鱼病毒、cocal病毒、银鲑呼肠孤病毒、性交疹病毒、科罗拉多蜱传热病毒、科蜱病毒属、哥伦比亚sk病毒、感冒病毒、接触性脓疱皮炎病毒、绵羊接触性脓疱皮炎病毒、冠状病毒、科里帕塔病毒、人鼻病毒属、牛痘病毒、柯萨奇病毒、cpv(胞质型多角体病毒)、蟋蟀麻痹病毒、克里米亚-刚果出血热病毒、副流感病毒2型、隐病毒、质型多角体病毒属、巨细胞病毒、巨细胞病毒组、胞质型多角体病毒、鹿乳头瘤病毒、δ逆转录病毒、登革热病毒、浓核病毒、依赖病毒、多理病毒、diploma病毒、果蝇c病毒、鸭乙型肝炎病毒、鸭肝炎病毒1、鸭肝炎病毒2、轮状病毒、杜温哈格病毒、变形翼病毒dwv(deformedwingvirusdwv)、东方马脑炎病毒、东方马脑脊髓炎病毒、eb病毒、埃博拉病毒、埃博拉样病毒、艾柯病毒、艾柯病毒、艾柯病毒10、艾柯病毒28、艾柯病毒9、鼠痘病毒、eee病毒、eia病毒、eia病毒、脑炎病毒、脑心肌炎组病毒、脑心肌炎病毒、肠道病毒、酶升高病毒、酶升高病毒(ldh)、流行性出血热病毒、兽疫出血病病毒、eb病毒、马α疱疹病毒1、马α疱疹病毒4、马疱疹病毒2、马流产病毒、马动脉炎病毒、马脑病病毒、马传染性贫血病毒、马麻疹病毒、马鼻肺炎病毒、马鼻病毒、eubenangu病毒、欧洲麋鹿乳头瘤病毒、欧洲猪瘟病毒、沼泽病毒、eyach病毒、猫疱疹病毒1、猫嵌杯样病毒、猫纤维瘤病毒、猫疱疹病毒、猫免疫缺陷病毒、猫传染性腹膜炎病毒、猫白血病/肉瘤病毒、猫白血病病毒、猫白细胞减少症病毒、猫细小病毒、猫肉瘤病毒、猫合胞病毒、线状病毒、弗兰德尔斯病毒、黄病毒属、口蹄疫病毒、摩根堡病毒、fourcorners汉坦病毒属、鸟腺病毒1、鸡痘病毒、弗林德病毒、γ逆转录病毒、gb肝炎病毒、gb病毒、德国麻疹病毒、盖塔病毒、长臂猿白血病病毒、腺热病毒、山羊痘病毒、goldenshinner病毒、枯叶蛾病毒、鹅细小病毒、颗粒性病毒、gross病毒、地松鼠乙型肝炎病毒、a组虫媒病毒、guanarito病毒、豚鼠巨细胞病毒、豚鼠c型病毒、汉坦病毒属、汉坦病毒属、文蛤呼肠孤病毒、野兔纤维瘤病毒、hcmv(人巨细胞病毒)、血液吸附病毒2型、日本血凝病毒、出血热病毒、hendra病毒、亨尼波病毒、肝脱氧核糖核酸病毒、甲型肝炎病毒、乙型肝炎病毒组、丙型肝炎病毒、丁型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、己型肝炎病毒、庚型肝炎病毒、非甲非乙型肝炎病毒、肝炎病毒、肝炎病毒(非人类)、肝脑脊髓炎呼肠孤病毒3型、肝病毒属、灰苍鹭乙型肝炎病毒、疱疹b病毒、单纯疱疹病毒、单纯疱疹病毒1型、单纯疱疹病毒2型、疱疹病毒、疱疹病毒7型、蜘蛛猴疱疹病毒、人疱疹病毒、疱疹病毒感染、松鼠猴疱疹病毒、猪疱疹病毒、水痘疱疹病毒、高地j病毒、hirame弹状病毒、猪霍乱病毒、人腺病毒2型、人α疱疹病毒1、人α疱疹病毒2、人α疱疹病毒3、人嗜b淋巴细胞病毒、人β疱疹病毒5、人冠状病毒、人巨细胞病毒组、人泡沫病毒、人γ疱疹病毒4、人γ疱疹病毒6、人甲型肝炎病毒、人疱疹病毒1组、人疱疹病毒2组、人疱疹病毒3组、人疱疹病毒4组、人疱疹病毒6、人类疱疹病毒8、人免疫缺陷病毒、人免疫缺陷病毒1型、人免疫缺陷病毒2型、人乳头瘤病毒、人t细胞白血病病毒、人t细胞白血病病毒i型、人t细胞白血病病毒ii型、人t细胞白血病病毒iii型、人t细胞淋巴瘤病毒i型、人t细胞淋巴瘤病毒ii型、人嗜t淋巴细胞病毒1型、人嗜t淋巴细胞病毒2型、人嗜t淋巴细胞病毒i型、人嗜t淋巴细胞病毒ii、人嗜t淋巴细胞病毒iii、姬蜂病毒属、婴儿胃肠炎病毒、牛传染性鼻气管炎病毒、传染性造血组织坏死病毒、传染性胰腺坏死病毒、甲型流感病毒、乙型流感病毒、丙型流感病毒、丁型流感病毒、流感病毒pr8、昆虫虹彩病毒、昆虫病毒、虹彩病毒、日本乙型脑炎病毒、日本脑炎病毒、jc病毒、胡宁病毒、卡波西肉瘤相关的疱疹病毒、克麦罗沃病毒、kilham大鼠病毒、klamath病毒、kolongo病毒、朝鲜出血热病毒、孔巴病毒、科萨努尔森林热病毒、kyzylagach病毒、lacrosse病毒、乳酸脱氢酶升高病毒、乳酸脱氢酶病毒、拉戈斯蝙蝠病毒、langur病毒、兔细小病毒、拉沙热病毒、拉沙病毒、潜伏大鼠病毒、lcm病毒、渗漏病毒、慢病毒属、兔病毒属、白血病病毒、白血病病毒、粗糙皮肤病病毒、淋巴结病相关的病毒、淋巴细胞隐病毒、淋巴细胞性脉络丛脑膜炎病毒、淋巴组织增生病毒组、machupo病毒、假狂犬病病毒、哺乳动物b型肿瘤病毒组、哺乳动物b型逆转录病毒、哺乳动物c型逆转录病毒组、哺乳动物d型逆转录病毒、乳腺瘤病毒、mapuera病毒、马尔堡病毒、马尔堡病毒、mason-pfizer猴病毒、哺乳动物腺病毒属、mayaro病毒、me病毒、麻疹病毒、menangle病毒、门哥病毒、门哥病毒、米德尔堡病毒、副痘苗病毒、貂肠炎病毒、小鼠细小病毒、mlv相关病毒、mm病毒、莫科拉病毒、软疣痘病毒属、传染性软疣病毒、猴b病毒、猴痘病毒、单负病毒目、麻疹病毒属、mountelgon蝙蝠病毒、小鼠巨细胞病毒、小鼠脑脊髓炎病毒、小鼠肝炎病毒、小鼠k病毒、小鼠白血病病毒、小鼠乳房肿瘤病毒、小鼠细小病毒、小鼠肺炎病毒、小鼠脊髓灰质炎病毒、小鼠多瘤病毒、小鼠肉瘤病毒、鼠痘病毒、莫桑比克病毒、mucambo病毒、粘膜病病毒、腮腺炎病毒、鼠β疱疹病毒1、鼠巨细胞病毒2、鼠巨细胞病毒组、鼠脑脊髓炎病毒、鼠肝炎病毒、鼠白血病病毒、鼠诱发结节病毒、鼠多瘤病毒、鼠肉瘤病毒、鼠巨细胞病毒属、墨累河谷脑炎病毒、粘液瘤病毒、粘液病毒、新城疫病毒、腮腺炎粘液病毒、内罗毕绵羊病病毒、内罗毕病毒、nanirnavirus、纳里瓦病毒、ndumo病毒、牛皮肤结节病毒、纳尔逊湾病毒、嗜神经病毒、新世界砂粒病毒属、新生儿肺炎病毒、新城疫病毒、nipah病毒、非致细胞病病毒、诺沃克病毒、核型多角体病毒(npv)、乳头颈病毒(nippleneckvirus)、阿尼昂尼昂病毒、ockelbo病毒、致癌病毒、致癌病毒样颗粒、致癌rna病毒、环状病毒属、羊传染性口疮病毒、奥罗波克病毒、正嗜肝dna病毒属、正粘病毒、正痘病毒、正呼肠孤病毒、orungo、绵羊乳头瘤病毒、绵羊卡他性热病毒、猫头鹰猴疱疹病毒、palyam病毒、乳头瘤病毒、长毛兔乳头瘤病毒、乳多空病毒、副流感病毒、副流感病毒1型、副流感病毒2型、副流感病毒3型、副流感病毒4型、副粘病毒属、副痘病毒属、副痘苗病毒、细小病毒属、细小病毒b19、细小病毒组、瘟病毒属、白蛉病毒属、海豹瘟热病毒、小脱氧核糖核酸病毒、小核糖核酸病毒、猪巨细胞病毒、鸽痘病毒、皮里病毒、皮春纳病毒、小鼠肺炎病毒、肺炎病毒属、脊髓灰质炎病毒、脊髓灰质炎病毒、多dna病毒、多面形病毒、多瘤病毒、多瘤病毒、牛多瘤病毒、长尾猴多瘤病毒、多瘤病毒hominis2、多瘤病毒maccacae1、多瘤病毒muris1、多瘤病毒muris2、多瘤病毒papionis1、多瘤病毒papionis2、多瘤病毒sylvilagi、pongine疱疹病毒1、猪流行性腹泻病毒、猪血液凝集脑脊髓炎病毒、猪细小病毒、猪传播性胃肠炎病毒、猪c型病毒、痘病毒、痘病毒、天花病毒、prospecthill病毒、原病毒、假牛痘病毒、假性狂犬病病毒、鹦鹉痘病毒、鹌鹑痘病毒、兔纤维瘤病毒、兔肾液泡病毒、兔乳头状瘤病毒、狂犬病病毒、浣熊细小病毒、浣熊痘病毒、ranikhet病毒、大鼠巨细胞病毒、大鼠细小病毒、大鼠病毒、rauscher病毒、重组痘苗病毒、重组病毒、呼肠孤病毒、呼肠孤病毒1、呼肠孤病毒2、呼肠孤病毒3、爬行动物c型病毒、呼吸道感染病毒、呼吸道合胞病毒、呼吸道病毒、网状内皮组织增生病病毒、弹状病毒、弹状病毒carpia、棒状病毒属、鼻病毒属、根前毛菌病毒属、riftvalley热病毒、riley病毒、牛瘟病毒、rna肿瘤病毒、罗斯河病毒、轮状病毒属、麻疹病毒、rous肉瘤病毒、风疹病毒、麻疹病毒、风疹病毒属、俄罗斯秋季脑炎病毒、sa11猿猴病毒、sa2病毒、sabia病毒、鹭山病毒、猴疱疹病毒1型、唾液腺病毒、白蛉热病毒组、sandjimba病毒、sars病毒、sdav(唾液泪囊腺炎病毒)、海豹痘病毒、西门利克森林病毒、汉城病毒、绵羊痘病毒、肖普纤维瘤病毒、肖普乳头状瘤病毒、猿猴泡沫病毒、猿猴甲型肝炎病毒、猿猴人免疫缺陷病毒、猿猴免疫缺陷病毒、猿猴副流感病毒、猿猴嗜t淋巴细胞病毒(simiantcelllymphotrophicvirus)、猿猴病毒、猿猴病毒40、单纯疱疹病毒属、辛诺瓦病毒、辛德毕斯病毒、天花病毒、南美出血热病毒、麻雀痘病毒、泡沫病毒属、松鼠纤维瘤兔痘病毒、松鼠猴逆转录病毒、ssv1病毒组、stlv(猿猴嗜t淋巴细胞病毒)i型、stlv(猿猴嗜t淋巴细胞病毒)ii型、stlv(猿猴嗜t淋巴细胞病毒)iii型、牛丘疹口炎病毒、豚鼠唾腺巨细胞病毒、suidα疱疹病毒1、suid疱疹病毒2、猪痘病毒属、沼泽地热病毒、猪痘病毒、瑞士小鼠白血病病毒、tac病毒、tacaribe复合病毒、tacaribe病毒、塔纳痘病毒、taterapox病毒、丁鲷呼肠孤病毒、theiler脑脊髓炎病毒、theiler病毒、索戈托病毒、thottapalayam病毒、蜱传脑炎脑炎病毒、tioman马病毒、囊膜病毒、环曲病毒属、肿瘤病毒、树鼩病毒、火鸡鼻气管炎病毒、禽痘病毒属、c型逆转录病毒、d型肿瘤病毒、d型逆转录病毒组、溃疡性疾病弹状病毒、乌纳病毒、乌孔涅米病毒组、痘苗病毒、液泡病毒、水痘带状疱疹病毒、水痘病毒属、varicola病毒、重型天花病毒、天花病毒、vasingishu病病毒、vee病毒、委内瑞兰马脑炎病毒、委内瑞拉马脑脊髓炎病毒、委内瑞拉出血热病毒、水疱性口炎病毒、水疱病毒属、vilyuisk病毒、蝰蛇逆转录病毒、病毒性出血性败血症病毒、visnamaedi病毒、绵羊髓鞘脱落病毒、田鼠痘病毒、vsv(水疱性口炎病毒)、wallal病毒、warrego病毒、疣病毒、wee病毒、西尼罗病毒、西方马脑炎病毒、西方马脑脊髓炎病毒、沃达罗河病毒、冬季呕吐病毒、旱獭乙型肝炎病毒、毛猴肉瘤病毒、伤瘤病毒、wrsv病毒、亚巴猴肿瘤病毒、亚巴病毒、亚塔痘病毒属、黄热病毒和yugbogdanovac病毒
在一些实施方案中,病毒感染诱导肝相关疾病或病症。在一些实施方案中,病毒感染为肝炎感染。在一些实施方案中,病毒为甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、己型肝炎病毒或庚型肝炎病毒。在一些实施方案中,引起肝相关疾病或病症的病毒感染是由甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、己型肝炎病毒或庚型肝炎病毒导致的。
在一些实施方案中,肝损伤作为对肝内病毒的免疫应答的结果而发生。在一些情况下,肝损伤作为广义的宿主感染的一部分而发生,其中病毒靶向组织而非肝。主要的靶标不是肝的示例性病毒包括疱疹病毒,如eb病毒、巨细胞病毒(cmv)或单纯疱疹病毒;细小病毒属;腺病毒;流感病毒;慢病毒属如人免疫缺陷病毒(hiv);和严重急性呼吸器官综合征(sars)相关的冠状病毒。在一些情况下,本文所述的病毒感染导致肝炎。
在一些实施方案中,该病原体为细菌。在一些实施方案中,细菌感染引起肝相关疾病或病症。细菌的实例包括:幽门螺杆菌(helicobacterpyloris)、布氏疏螺旋体(boreliaburgdorferi)、侵肺军团菌(legionellapneumophilia)、分枝杆菌属的种(mycobacteriaspp.)(例如,副结核分枝杆菌(m.tuberculosis)、鸟分枝杆菌(m.avium)、胞内分枝杆菌(m.intracellulare)、堪萨斯分枝杆菌(m.kansasii)、戈登分枝杆菌(m.gordonae)、金黄色葡萄球菌(staphylococcusaureus)、淋病奈瑟氏球菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏球菌(neisseriameningitidis)、单核细胞增生利斯特氏菌(listeriamonocytogenes)、酿脓链球菌(streptococcuspyogenes)(a组链球菌属)、无乳链球菌(streptococcusagalactiae)(b组链球菌属))、链球菌属(streptococcus)(绿色链球菌组(viridansgroup))、粪链球菌(streptococcusfaecalis)、牛链球菌(streptococcusbovis)、链球菌属(厌氧链球菌的种)、肺炎链球菌(streptococcuspneumoniae)、致病性弯曲杆菌属的种(campylobactersp.)、肠球菌属的种(enterococcussp.)、流感嗜血菌(haemophilusinfluenzae)、炭疽芽孢杆菌(bacillusanthracis)、白喉棒杆菌(corynebacteriumdiphtheriae)、棒杆菌属的种(corynebacteriumsp.)、猪红斑丹毒丝菌(erysipelothrixrhusiopathiae)、产气荚膜梭菌(clostridiumperfringens)、破伤风梭菌(clostridiumtetani)、产气肠杆菌(enterobacteraerogenes)、肺炎克雷伯氏菌(klebsiellapneumoniae)、多杀巴斯德氏菌(pasturellamultocida)、拟杆菌属的种(bacteroidessp.)、具核梭杆菌(fusobacteriumnucleatum)、念珠状链杆菌(streptobacillusmoniliformis)、苍白密螺旋体(treponemapallidum)、极细密螺旋体(treponemapertenue)、钩端螺旋体属(leptospira)和衣氏放线菌(actinomycesisraelli)。
在一些实施方案中,该病原体为真菌。在一些实施方案中,真菌感染引起肝相关疾病或病症。真菌的实例包括:新型隐球菌(cryptococcusneoformans)、荚膜组织胞浆菌(histoplasmacapsulatum)、粗球孢子菌(coccidioidesimmitis)、皮炎芽生菌(blastomycesdermatitidis)、沙眼衣原体(chlamydiatrachomatis)、白假丝酵母(candidaalbicans)。其他传染性生物(即,原生生物)包括:恶性疟原虫(plasmodiumfalciparum)和刚地弓形虫(toxoplasmagondii)。
在一些实施方案中,该病原体为寄生虫。在一些实施方案中,寄生虫感染引起肝相关疾病或病症。寄生虫的实例包括:肉足纲(例如,内阿米巴属(entamoeba))、鞭毛纲(例如,贾第虫属(giardia)、利什曼原虫属(leishmania))、纤毛亚门(例如,小袋虫属(balantidium))和孢子虫纲(例如,疟原虫属(plasmodium)、隐孢子虫属(cryptosporidium))。
在一些实施方案中,诱导的肝细胞用于缺损肝的再生。在一些实施方案中,将诱导的肝细胞引入肝损伤部位。在一些情况下,将诱导的肝细胞作为细胞悬浮液引入或移植到肝损伤部位。在其他情况下,将诱导的肝细胞作为组织块引入或移植到肝损伤部位。在其他情况下,诱导的肝细胞用于缺损肝的离体再生。在其他情况下,诱导的肝细胞用于在移植到肝损伤部位之前的离体肝生成。
在一些实施方案中,诱导的肝细胞被配制为组合物如药物组合物,以用于治疗由外部因素引起的肝损伤,如对宿主的损伤,例如对个体的损伤,或由于手术引起的肝损伤。
在一些实施方案中,诱导的肝细胞被配制为组合物如药物组合物,以用于治疗由肝相关疾病或病症引起的肝损伤。在一些实施方案中,诱导的肝细胞被配制为组合物如药物组合物,以用于治疗alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(例如,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、甲型、乙型、丙型病毒性肝炎、威尔逊病或其组合。
在一些实施方案中,包含诱导的肝细胞的组合物进一步包含附加的治疗剂。在一些实施方案中,该附加的治疗剂是用于治疗肝相关疾病或病症的治疗剂。在一些实施方案中,该附加的治疗剂包括但不限于姜黄素、白藜芦醇、沙利度胺、考来烯胺(questran)、他克莫司(prograf)、熊去氧胆酸(actigall)、干扰素、利尿剂如髓袢利尿剂和肝移植。
在一些实施方案中,在肝损伤部位使用包含诱导的肝细胞的组合物以用于肝再生。在一些实施方案中,将包含诱导的肝细胞的组合物作为细胞悬浮液引入或移植到肝损伤部位。在一些实施方案中,将包含诱导的肝细胞的组合物作为组织块引入或移植到肝损伤部位。在其他的实施方案中,包含诱导的肝细胞的组合物用于缺损肝的离体再生。在其他的实施方案中,包含诱导的肝细胞的组合物用于在移植到肝损伤部位之前的离体肝生成。
本文所述的分离的诱导的肝细胞的施用模式包括但不限于系统性静脉内注射和直接向预期活性部位的注射(例如,内窥镜逆行注射)。所述制剂可以通过任何方便的途径,例如通过输注或团注来施用,并可以与其他生物活性剂一起施用。在一些实施方案中,施用是系统性局部施用。
在一些实施方案中,包含诱导的肝细胞的组合物被配制为用于向包括人在内的哺乳动物静脉内施用的药物组合物。在一些实施方案中,用于静脉内施用的组合物是在无菌等渗水性缓冲液中的溶液。当需要时,所述组合物还包括局部麻醉剂以减轻在注射部位的任何疼痛。当组合物将通过输注施用时,其可以用包含无菌药品级水或盐水的输液瓶来分配。当组合物通过注射施用时,可以提供注射用无菌水或盐水的安瓿以使得成分在施用前混合。
在一些实施方案中,合适的药物组合物包含治疗有效量的诱导的肝细胞和药学上可接受的载体或赋形剂。这样的载体包括但不限于盐水、缓冲盐水、右旋糖、水及其组合。
在一些实施方案中,本文所述的诱导的肝细胞通过适合于将细胞靶向至特定组织的递送系统递送至目标部位(例如,肝的缺损段)。例如,将细胞封装在允许细胞在目标部位缓慢释放的递送媒介物中。修饰递送媒介物使得其特异性地靶向至特定组织。以多种方式修饰靶向递送系统的表面。在脂质体靶向递送系统的情况下,将脂质基团并入脂质体的脂双层中以保持靶向配体与脂质体双层的稳定关联。
在其他的实例中,使用胶态分散体系。胶态分散体系包括大分子复合体、纳米胶囊、微球、珠和基于脂质的系统,包括水包油乳液、胶束、混合胶束和脂质体。
本文描述的诱导的肝细胞的施用任选地通过以下方式针对个体进行调整:(1)增加或减少注射的细胞量;(2)改变注射的次数;或(3)改变递送细胞的方法。
诱导的肝细胞制剂以有效促进细胞在接受者中的植入的量使用。在医师的裁量下,调节施用以满足最佳功效和药理给药。
用于产生治疗性蛋白的诱导的肝细胞
在一些实施方案中,诱导的肝细胞用于产生治疗性蛋白质(例如,激素)、细胞因子、胆固醇、碳水化合物、胆汁或其组合。在一些情况下,诱导的肝细胞用于产生治疗性蛋白。在一些情况下,该治疗性蛋白包括全长蛋白质、其结构域或片段或肽。在一些情况下,该蛋白质、其结构域或片段或肽含有天然和/或非天然的氨基酸残基。在一些情况下,该治疗性蛋白、其片段或肽包括但不限于主要的血浆蛋白如人血清白蛋白、可溶性血浆纤连蛋白、甲胎蛋白、c-反应蛋白和几种球蛋白;参与止血和纤维蛋白溶解的蛋白质如涉及凝血级联的凝血因子、α2-巨球蛋白、α1-抗胰蛋白酶、抗凝血酶iii、蛋白s、蛋白c、血纤维蛋白溶酶原、α2-抗纤溶酶和补体成分3;载体蛋白如白蛋白、血浆铜蓝蛋白、运皮质激素蛋白、触珠蛋白、血红素结合蛋白、igf结合蛋白、主要的尿蛋白、视黄醇结合蛋白、性激素结合球蛋白、运甲状腺素蛋白、运铁蛋白和维生素d结合蛋白;激素如胰岛素样生长因子1、血小板生成素、铁调素和β调理素;激素原如血管紧张素原;以及载脂蛋白。在一些实施方案中,诱导的肝细胞用于产生激素或其片段。在一些实施方案中,诱导的肝细胞用于产生胰岛素样生长因子1、血小板生成素、铁调素、β调理素、血管紧张素原或其片段。
在一些情况下,诱导的肝细胞用于产生细胞因子。如本文别处所述,细胞因子包括趋化因子、干扰素、白介素和肿瘤坏死因子。在一些实施方案中,细胞因子是促炎性细胞因子。在一些实施方案中,该细胞因子包括趋化因子ccl1、ccl2(mcp-1)、ccl3、ccl4、ccl5(rantes)、ccl6、ccl7、ccl8、ccl9(或ccl10)、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16和cxcl17的c-x-c和c-c亚家族。在一些实施方案中,该细胞因子包括生长相关的(gro)-α、gro-β、gro-γ、上皮嗜中性粒细胞激活肽-78(ena-78)、rantes、tnf-α、il-1β、il-6、il-8、mcp-1、m-csf、ifn-α、ifn-β和细胞因子诱导的嗜中性粒细胞化学引诱物(cinc)。在一些情况下,诱导的肝细胞用于产生本文所述的一种或多种细胞因子。在一些实施方案中,诱导的肝细胞用于产生细胞因子,包括但不限于:ccl1、ccl2(mcp-1)、ccl3、ccl4、ccl5(rantes)、ccl6、ccl7、ccl8、ccl9(或ccl10)、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16、cxcl17、生长相关的(gro)-α、gro-β、gro-γ、上皮嗜中性粒细胞激活肽-78(ena-78)、rantes、tnf-α、il-1β、il-6、il-8、mcp-1、m-csf、ifn-α、ifn-β和细胞因子诱导的嗜中性粒细胞化学引诱物(cinc)。
在一些情况下,诱导的肝细胞用于产生或处理胆固醇。如本文所用,术语“胆固醇”包括胆固醇、其立体异构体(例如,nat-胆固醇或ent-胆固醇)、天然存在的胆固醇、遗传修饰的胆固醇或其片段。在一些实施方案中,诱导的肝细胞用于产生或处理nat-胆固醇或其片段。在一些实施方案中,诱导的肝细胞用于产生或处理ent-胆固醇或其片段。
在一些情况下,诱导的肝细胞用于产生或处理碳水化合物。在一些情况下,诱导的肝细胞用于碳水化合物的形成、分解或互换,糖异生,糖原分解,糖原生成,包括如上公开的胆固醇合成的脂质代谢,以及脂肪生成。
在一些情况下,诱导的肝细胞用于产生胆汁。
如本文所用,氨基酸残基可以指既含有氨基基团又含有羧基基团的分子。合适的氨基酸包括而不限于天然存在的氨基酸的d-和l-异构体,以及由其他代谢途径制备的非天然存在的氨基酸。如本文所用,术语氨基酸包括而不限于α-氨基酸、天然氨基酸、非天然氨基酸和氨基酸类似物。
术语“α-氨基酸”可以指含有与指定为α-碳的碳结合的氨基基团和羧基基团的分子。
术语“β-氨基酸”可以指β构型的含有氨基基团和羧基基团的分子。
“天然存在的氨基酸”可以指通常在自然界中合成的肽中发现的二十种氨基酸中的任何一种,并且以单字母缩写a、r、n、c、d、q、e、g、h、i、l、k、m、f、p、s、t、w、y和v而已知。
术语“氨基酸类似物”是指在结构上类似于氨基酸并且可以在拟肽大环化合物的形成中置换氨基酸的分子。氨基酸类似物包括而不限于β-氨基酸以及其中氨基或羧基基团被类似反应性的基团所置换的氨基酸(例如,用仲胺或叔胺置换伯胺,或用酯置换羧基基团)。
术语“非天然存在的氨基酸”是指这样一种氨基酸,该氨基酸不是通常在自然界中合成的肽中发现的二十种氨基酸中的任何一种,并且以单字母缩写a、r、n、c、d、q、e、g、h、i、l、k、m、f、p、s、t、w、y和v而已知。非天然氨基酸包括而不限于对乙酰基苯丙氨酸、间乙酰基苯丙氨酸、对-(3-氧代丁酰基)-1-苯丙氨酸、对-(2-氨基-3-羟乙基)苯丙氨酸、对异丙基硫代羰基苯丙氨酸、对乙基硫代羰基-苯丙氨酸、邻炔丙氧基苯丙氨酸、对叠氮基苯丙氨酸、苯基硒基丙氨酸、对-苯甲酰基-1-苯丙氨酸或对硼基苯丙氨酸。
用于肝再生的诱导的肝细胞
在其他的实施方案中,诱导的肝细胞用于肝再生。在其他的实施方案中,诱导的肝细胞用于离体肝再生。在一些情况下,离体肝再生使用离体灌注系统。在一些情况下,该离体灌注系统包括离体灌注生物反应器系统(例如,3d灌注生物反应器系统)。在一些情况下,离体肝再生使用生物打印系统。在一些情况下,该生物打印系统为三维(3d)生物打印系统。在一些情况下,离体肝再生使用3d生物打印系统。在一些实施方案中,3d生物打印系统包括organovo的novogenmmx生物打印机、envisiontec的
在一些实施方案中,3d生物打印系统包括us8691974、us8691274、us20140052285、us20140012407、us20140099709、us20140093932、us20130304233、us20130004469、us20130017564、us20130164339、us20120089238、us20110250688、us20090208466、ep2679669、wo2014039427、wo2013181375、wo2013040087和wo2012122105中描述的系统。
在一些实施方案中,诱导的肝细胞用于使用灌注系统(例如,离体灌注系统)的肝再生。在一些实施方案中,诱导的肝细胞用于使用离体灌注生物反应器系统(例如,3d灌注生物反应器系统)的肝再生。在一些情况下,诱导的肝细胞用于使用生物打印系统(例如,3d生物打印系统)的肝再生。在一些实施方案中,诱导的肝细胞用于使用organovo的novogenmmx生物打印机、envisiontec的
在一些实施方案中,诱导的肝细胞用于使用us8691974、us8691274、us20140052285、us20140012407、us20140099709、us20140093932、us20130304233、us20130004469、us20130017564、us20130164339、us20120089238、us20110250688、us20090208466、ep2679669、wo2014039427、wo2013181375、wo2013040087或wo2012122105中描述的3d生物打印系统的肝再生。
在一些情况下,诱导的肝细胞用于通过上述一种或多种方法生成组织支架。在一些情况下,该组织支架为二维(2d)组织支架或三维(3d)组织支架。在一些情况下,该组织支架为3d组织支架。在一些情况下,诱导的肝细胞用于生成3d组织支架。在一些实施方案中,该3d支架预先涂覆一种或多种细胞外基质组分,例如,明胶、层粘连蛋白、纤连蛋白、胶原蛋白、聚赖氨酸、玻连蛋白、透明质酸、透明质酸水凝胶、丝素蛋白、壳聚糖或任何前述的复合材料。在一些实施方案中,与2d培养相比,将细胞以更高如三倍或五倍或十倍的密度接种在3d支架上。在一些实施方案中,在细胞存活因子如rockrho激酶抑制剂的存在下接种细胞。
在一些方面,生物相容性基底用来生成本文的组织,例如,在三维生物相容性基底上在培养基下培养细胞。在一些实施方案中,该生物相容性基底包括聚合物基底。在一些实施方案中,该生物相容性基底为可生物降解的。在一些实施方案中,该聚合物基底包含聚(己内酯)(pcl)。在一些实施方案中,该聚合物基底选自聚乳酸(pla)、聚-l-乳酸(plla)、聚-d-乳酸(pdla)、聚乙交酯、聚乙醇酸(pga)、聚丙交酯-乙交酯共聚物(plga)、聚二噁烷酮、聚葡糖酸酯、聚乳酸-聚氧乙烯共聚物、改性纤维素、胶原、聚羟基丁酸酯、聚羟基丙酸、聚磷酸酯、聚(α-羟基酸)、聚碳酸酯、聚酰胺、聚酸酐、聚氨基酸、聚原酸酯、聚缩醛、聚氰基丙烯酸酯、可降解的氨基甲酸酯、脂族聚酯聚丙烯酸酯、聚甲基丙烯酸酯、酰基取代的乙酸纤维素、不可降解的聚氨酯、聚苯乙烯、聚氯乙烯、聚氟乙烯、聚乙烯咪唑,氯磺化聚烯烃(polyolifin)、聚环氧乙烷、聚氧化乙烯、聚乙烯醇、特氟隆rtm、尼龙硅、聚(苯乙烯-嵌段-丁二烯)、聚降冰片烯、水凝胶、合金和寡聚(ε-己内酯)二醇。在一些实施方案中,该生物相容性基底包含合成聚合物。根据本发明的一些实施方案,该生物相容性基底包含天然聚合物。在一些实施方案中,该可生物降解的基底选自聚(己内酯)(pcl)、聚乙醇酸、聚(dl-乳酸-乙醇酸)共聚物、猫肠缝线(catgutsutures)、棉花、纤维素、明胶、葡聚糖、藻酸盐、纤连蛋白、层粘连蛋白、胶原、透明质酸、聚羟基烷酸酯、聚4羟基丁酸酯(p4hb)和聚葡糖酸(pga)。
诱导的肝细胞作为基因治疗的来源
在另外的实施方案中,诱导的肝细胞用作基因治疗的来源。在一些情况下,该基因治疗为离体基因治疗。在一些情况下,诱导的肝细胞用作肝相关疾病或病症的基因疗法治疗的治疗剂。在一些情况下,该基因疗法治疗为基于诱导的肝细胞的基因治疗。在一些情况下,采用该基于诱导的肝细胞的基因治疗,例如代替有缺陷的或缺失的基因产物、防止同种异体移植物排斥、重新定植宿主肝脏、帮助生成异种肝细胞或适用于患者特定的肝治疗或再生。
如本文别处所述,肝相关疾病或病症包括alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(例如,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、甲型、乙型、丙型病毒性肝炎以及威尔逊病。
在一些情况下,诱导的肝细胞作为治疗剂用于基因疗法治疗alagille综合征、α1抗胰蛋白酶缺乏症、自身免疫性肝炎、良性肝肿瘤、胆道闭锁、肝硬化、肝囊性疾病、包括酒精相关肝病和非酒精性脂肪肝病(nafld)的脂肪肝病、半乳糖血症、胆结石、gilbert综合征、血色素沉着病、肝囊肿、肝癌、妊娠期肝病(例如,妊娠期急性脂肪肝、妊娠期肝内胆汁淤积症、先兆子痫或hellp综合征(溶血、升高的肝化验结果、低血小板))、新生儿肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、卟啉病、reye综合征、结节病、中毒性肝炎、1型糖原贮积病、酪氨酸血症、甲型、乙型、丙型病毒性肝炎、威尔逊病或其组合。
在一些情况下,经由病毒或非病毒手段将基因转移到诱导的肝细胞中。在一些情况下,病毒手段包括载体,如来自鼠白血病逆转录病毒和慢病毒、腺相关病毒、t-抗原缺失的sv40病毒、嗜神经病毒如单纯疱疹病毒、游离病毒和杂交病毒如腺相关病毒的载体。在一些情况下,非病毒手段包括脂质体复合体(lipoplexes)、多聚复合体(polyplexes)、树状聚合物、无机纳米粒子或杂合载体如病毒体,它们是脂质体与灭活病毒如hiv或流感病毒的组合。在一些情况下,另外的非病毒手段包括注射裸dna、电穿孔、基因枪、声致穿孔或磁转染。通过病毒或非病毒手段的基因转移方法是本领域公知的且描述在例如guha等人“hepatocyte-basedgenetherapy,”jhepatobillarypancreatsurg.8(1):51-57(2001)中。
如本文所用,基因可含有至少两个连接在一起的核苷酸。在一些情况下,本文所述的核酸可含有磷酸二酯键、天然核酸或非天然核酸。天然核酸包括脱氧核糖核酸(dna)和核糖核酸(rna),并且以单字母缩写a、t、g、c和u而已知。示例性的非天然核酸包括而不限于二氨基嘌呤、异鸟嘌呤、异胞嘧啶、2-氨基-6-(2-噻吩基)嘌呤、吡咯-2-甲醛、2,6-双(乙硫基甲基)吡啶、吡啶-2,6-二甲酰胺、4-甲基苯并咪唑、2,3-二氟甲苯、d5sics和dnam。
诊断方法
用于测定上述生物标志物的表达或存在的方法是本领域公知的,并且可通过对表达这些细胞表面标志物中任一种的细胞进行例如流式细胞术、免疫组织化学、蛋白质印迹法、免疫沉淀、磁珠分选和量化来测量。生物标志物rna表达水平可通过rt-pcr、qt-pcr、微阵列、rna印迹法或其他类似技术来测量。
“检测表达”或检测“表达水平”的目的是测定生物样品中生物标志物蛋白质或基因的表达水平或存在。因此,“检测表达”包括确定生物标志物为不表达、非可检测地表达、低水平表达、正常水平表达或过表达的情况。
在一些实施方案中,使用例如免疫组织化学技术或基于核酸的技术如原位杂交和rt-pcr,在核酸水平上测定本文所述的生物标志物的表达或存在。在一个实施方案中,一种或多种生物标志物的表达或存在的测定通过用于核酸扩增的手段、用于核酸测序的手段、使用核酸微阵列(dna和rna)的手段或用于使用特异性标记探针的原位杂交的手段来进行。
在其他的实施方案中,测定生物标志物的表达或存在通过凝胶电泳来进行。在一个实施方案中,该测定通过转移到膜并与特异性探针杂交来进行。
在其他的实施方案中,测定生物标志物的表达或存在通过诊断成像技术来进行。
在其他的实施方案中,测定生物标志物的表达或存在通过可检测的固体基底来进行。在一个实施方案中,该可检测的固体基底为用抗体功能化的顺磁纳米粒子。
在一些实施方案中,生物标志物的表达或存在在rna(例如,mrna)水平上。在一些实施方案中,检测rna(例如,mrna)水平的技术包括但不限于southern或northern分析、聚合酶链反应分析和探针阵列。
用于检测mrna水平的一种方法包括使分离的mrna与核酸分子(探针)接触,该核酸分子与由所检测的基因编码的mrna杂交。该核酸探针由例如全长cdna或其一部分组成,如由长度至少为7、15、30、50、100、250或500个核苷酸且足以在严格条件下与编码本文所述生物标志物的mrna或基因组dna特异性杂交的寡核苷酸组成。mrna与探针的杂交表明感兴趣的生物标志物或其他靶蛋白正在被表达。
在一个实施方案中,将mrna固定在固体表面上并与探针接触,例如通过在琼脂糖凝胶上运行分离的mrna并将mrna从凝胶转移至膜如硝酸纤维素。在供替代的实施方案中,将探针固定在固体表面上并使mrna与例如在基因芯片阵列中的探针接触。技术人员容易修改已知的mrna检测方法,以用于检测编码感兴趣的生物标志物或其他蛋白质的mrna水平。
用于测定样品中感兴趣的mrna的水平的供替代方法包括核酸扩增的方法,例如,通过rt-pcr(参见,例如美国专利号4,683,202)、连接酶链反应(barany(1991)proc.natl.acad.sci.usa88:189193)、自动维持序列复制(guatelli等人(1990)proc.natl.acad.sci.usa87:1874-1878)、转录扩增系统(kwoh等人(1989)proc.natl.acad.sci.usa86:1173-1177)、qβ复制酶(lizardi等人(1988)bio/technology6:1197)、滚环复制(美国专利号5,854,033)或任何其他核酸扩增方法,然后使用本领域技术人员公知的技术检测扩增的分子。如果核酸分子以极低数目存在,则这些检测方案尤其可用于这些分子的检测。在一些实施方案中,生物标志物表达通过定量荧光rt-pcr(即,taqman0系统)来评估。
使用膜印迹(如杂交分析如northern、斑点等使用的)、或微孔、样品管、凝胶、珠或纤维(或包含结合的核酸的任何固体支持物)监测感兴趣的rna的表达水平。参见美国专利号5,770,722、5,874,219、5,744,305、5,677,195和5,445,934,其通过引用并入本文。表达的检测还包括在溶液中使用核酸探针。
在一些实施方案中,利用微阵列来测定一种或多种生物标志物的表达或存在。核酸微阵列提供了一种用于同时测量大量基因的表达水平的方法。每一种阵列由附接至固体支持物的捕获探针的可再现模式组成。标记的rna或dna与阵列上的互补探针杂交,随后通过激光扫描进行检测。测定阵列上每一个探针的杂交强度并将其转化为表示相对基因表达水平的定量值。参见美国专利号6,040,138、5,800,992和6,020,135、6,033,860和6,344,316,其通过引用并入本文。高强度寡核苷酸阵列特别可用于测定样品中大量rna的基因表达谱。
使用机械合成方法合成这些阵列的技术描述在例如美国专利号5,384,261中,其通过引用以全文并入本文。在一些实施方案中,将阵列制作在几乎任何形状的表面上或甚至多个表面上。在一些实施方案中,阵列为平面阵列表面。在一些实施方案中,阵列包括珠、凝胶、聚合物表面、纤维如光纤、玻璃或任何其他合适的基底上的肽或核酸,参见美国专利号5,770,358、5,789,162、5,708,153、6,040,193和5,800,992,其每一个均通过引用以全文并入于此以用于所有目的。在一些实施方案中,以这样一种方式包装阵列,以允许全包含式设备的诊断或其他操作。
在一些实施方案中,使用例如针对特定生物标志物蛋白质的抗体,在蛋白质水平上测定本文所述的生物标志物的表达或存在。这些抗体用于各种方法,如蛋白质印迹法、elisa、多重技术、免疫沉淀或免疫组织化学技术。在一些实施方案中,生物标志物的检测通过elisa来实现。在一些实施方案中,生物标志物的检测通过电化学发光(ecl)来实现。
考虑了用于特别地鉴定和量化生物样品中的生物标志物的任何手段。因此,在一些实施方案中,生物样品中感兴趣的生物标志物蛋白质的表达水平通过能够与该生物标志物蛋白质或其生物活性变体特异性相互作用的结合蛋白来检测。在一些实施方案中,使用标记的抗体、其结合部分或其他结合配偶体。当在本文使用时,单词“标记”是指与该抗体直接或间接地缀合从而生成“标记的”抗体的可检测化合物或组合物。在一些实施方案中,该标记是自身可检测的(例如,放射性同位素标记或荧光标记),或在酶标记的情况下,催化可检测的基底化合物或组合物的化学改变。
用于检测生物标志物蛋白质的抗体从来源上是单克隆或多克隆的,或是合成或重组产生的。使用本领域技术人员已知的标准蛋白质检测方法来测定复合蛋白质的量,例如与结合蛋白质(例如,与生物标志物蛋白质特异性结合的抗体)缔合的生物标志物蛋白质的量。在本领域的许多文献(参见,例如,ausubel等人编著(1995)currentprotocolsinmolecularbiology)(greenepublishingandwiley-interscience,ny));coligan等人编著(1994)currentprotocolsinimmunology(johnwiley&sons,inc.,newyork,n.y.)中可找到免疫学分析设计、理论和方案的详细综述。
用来标记抗体的标记物的选择将根据应用而变化。然而,标记物的选择对于本领域技术人员来说是可容易确定的。这些标记的抗体用于免疫测定以及组织学应用中,以检测感兴趣的任何标志物或蛋白质的存在。该标记的抗体是多克隆或单克隆的。另外,用放射性原子、酶、发色或荧光部分或如本文别处所述的色度标签来标记用于检测感兴趣的蛋白质的抗体。标签化标记的选择将取决于所需的检测限。酶测定(elisa)通常允许检测通过酶标记的复合体与酶底物的相互作用形成的有色产物。用作可检测标记的放射性核素包括,例如i-131、i-123、i-125、y-90、re-188、re-186、at-211、cu-67、bi-212和pd-109。用作可检测标记的酶的实例包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶和葡萄糖-6-磷酸脱氢酶。发色部分包括但不限于荧光素和罗丹明。抗体通过本领域已知的方法与这些标记缀合。例如,酶和发色分子通过偶联剂如二醛、碳二亚胺、双马来酰亚胺等与抗体缀合。或者,缀合通过配体-受体对发生。合适的配体-受体对的实例为生物素-抗生物素蛋白或生物素-链霉亲和素和抗体-抗原。
在某些实施方案中,生物样品内一种或多种生物标志物或感兴趣的其他蛋白质的表达或存在通过放射免疫测定或酶联免疫测定(elisa)、竞争性结合酶联免疫测定、斑点印迹法(参见,例如,promegaprotocolsandapplicationsguide,promegacorporation(1991))、蛋白质印迹法(参见,例如,sambrook等人(1989)molecularcloning,alaboratorymanual,vol.3,第18章(coldspringharborlaboratorypress,plainview,n.y.)、色谱法如高效液相色谱法(hplc)或本领域已知的其他测定来测定。因此,检测测定包括例如但不限于免疫印迹、免疫扩散、免疫电泳或免疫沉淀的步骤。
试剂盒/制品
在某些实施方案中,本文公开了与本文所述的一种或多种方法和组合物一起使用的试剂盒和制品。这样的试剂盒包括载体、包装或被区室化以容纳一个或多个容器如小瓶、管等的容器,每一个容器包含本文所述的方法中待使用的一种单独元件。合适的容器包括例如瓶子、小瓶、注射器和试管。在一个实施方案中,容器由各种材料如玻璃或塑料制成。
本文提供的制品含有包装材料。药物包装材料的实例包括但不限于泡罩包装、瓶子、管、袋子、容器、瓶子以及适合于所选制剂和预期使用方式的任何包装材料。
例如,容器包含任选地在如本文公开的组合物中的hts细胞。这类试剂盒任选包含关于它在本文所述方法中的使用的标识性描述或标签或说明书。
试剂盒通常包含列出内容物的标签和/或使用说明书以及具有使用说明书的包装插页。通常也包含一组说明书。
在一些实施方案中,标签在容器之上或与之关联。在一个实施方案中,当构成标签的字母、数字或其他字符附着、模制或蚀刻到容器本身中时,标签在容器之上;当标签存在于还容纳容器的接受器(receptacle)或载具内时,例如,作为包装插页,标签与该容器关联。在一个实施方案中,使用标签标示出内容物用于特定的治疗应用。标签还标示出内容物如在本文所述方法中的使用说明。
实施例
提供这些实施例仅用于说明性的目的而非限制本文提供的权利要求的范围。
实施例1
细胞培养和分化
将未分化的hts细胞保持在补充有10%(v/v)胎牛血清(safcbiosciences)的α-mem(gibco)中。每2-3天将培养物以1:3–1:6分割比进行人工传代。通过在37℃、5%co2的孵箱中在包含10%fbs、1mm2-巯基乙醇、10mm烟酰胺和10ng/mlbfgf的条件α-mem培养基中8hr来进行de的分化。对于肝细胞分化,将地塞米松(0.1μm,sigma)和重组人制癌蛋白m(10ng/ml,excel-biomedicalinc.)添加至培养基中并温育另外的4天或6天。
该研究获得了高雄医科大学医院人类受试者研究与伦理委员会机构审查委员会(institutionalreviewboardonhumansubjectsresearchandethicscommittees,kaohsiungmedicaluniversityhospital)的批准。在知情同意的情况下获得hts细胞。
质粒
mir-124a前体和抗-mir-124a购自systembiosciences。简言之,使用transit-lt1转染试剂(mirus,madison,wi)将mir-124a前体(60pmol)或抗-mir-124a(60pmol)转染至12孔培养皿中的hts细胞中。在转染后36hr,使用总rna量化mir-124a。靶向pi3k(sasi_hs01_00233971和sasi_hs01_00127787)、akt1(sasi_hs01_00205545)和akt2(sasi_hs01_00035055)的小干扰rna(sirna)购自sigma。靶向creb1(trcn0000007310、trcn0000226467和trcn0000226468)、smad4(trcn0000010321、trcn0000010323和trcn0000040032)、akt3(trcn0000001615和trcn0000001616)、oct4(trcn0000004879和trcn0000004882)、cdx2(trcn0000013683和trcn0000013686)的短发夹rna(shrna)以及对照shrna(shgfp;trcn0000072178、trcn0000072179和trcn0000072183)购自nationalrnaicore平台,academiasinica,taiwan。采用2μg的sirna或shrna加上4μl转染试剂进行转染。
蛋白质印迹法和免疫沉淀(ip)
对于免疫印迹测定,将细胞收获至补充有蛋白酶和磷酸酶抑制剂(roche)的ripa裂解溶液(millipore,billerica,ma)中。在聚丙烯酰胺凝胶上电泳30μg裂解物后,进行向pdvf膜(millipore)上的电印迹。在室温下用在pbs中的5%脱脂奶粉封闭(1hr)后,通过使用第一抗体检测靶蛋白。所有膜均与化学发光剂(millipore)一起温育,并通过chemidocxrs系统(bio-rad)来捕获图像。所用的抗体列于表1中。通过alphaeasefc(4.0.0版)系统分析数据。对于ip测定,收集bfgf处理的hts细胞的细胞裂解物。通过与蛋白g-琼脂糖(millipore)一起温育30min,用表1中列出的特异性第一抗体处理总蛋白(100μg)过夜。在用蛋白g-琼脂糖珠处理(2hr)后,用ripa裂解缓冲液(millipore)洗涤样品三次,然后添加蛋白质加载染料并煮沸5min。通过8%sds-page解析该样品,并使其经历免疫印迹分析。
mrna、mirna和染色质免疫沉淀(chip)-qpcr测定
对于mrna表达,使用trizol试剂(invitrogen)与dna酶i柱上消化(qiagen,valencia,ca)从一式三份或一式五份的样品中的hts细胞中分离rna。总rna(500ng)用于采用iscriptcdna合成试剂盒(bio-rad)进行逆转录。采用每个反应1/40的cdna以及400nm正向和反向引物,一式两份地进行实时聚合酶链反应(qpcr)。使用7500实时pcr系统(appliedbiosystems),用
对于mirna分析,使用taqmanmicrorna逆转录试剂盒(appliedbiosystems)逆转录25ng的总rna。使用7500实时pcr系统(appliedbiosystems),用taqmanuniversalpcrmastermix(appliedbiosystems)(包括无模板对照),使用针对mir-124a或rnu6b的特异性引物(appliedbiosystems),至少一式三份进行qpcr。u6snrna(rnu6b;appliedbiosystems)用作内源性对照。
对于chip测定,用最终浓度为1%的甲醛固定指定诱导时间的hts细胞样品。在室温下温育(10min)后,通过添加甘氨酸(125mm)终止反应。使用chip测定试剂盒(upstatebiotechnology)所附的方案进行chip测定。经充分洗涤后,将经过chip的dna从珠上洗脱并通过qpcr进行分析。
萤光素酶报告试验
为了制备萤光素酶-3'utr报告基因质粒,扩增来自hts细胞的基因组dna提取物的3'utr片段。通过使用psii和mfei(thermoscientific,rockford,il)将3'utrpcr片段克隆到pgl4.51载体(promega,madison,wi)中萤光素酶基因的下游。用于3'utr报告基因构建体的引物如下列出:对于cdx23’utr区:正向引物,
5’-aaattataagctgtttgggttgttggtct-3’,反向引物,
5’-aaacaattgcccccataatttctgactgc-3;对于smad43’utr区1:正向引物,
5’-aaattataactcccaaagtgctgggatta-3’,反向引物,
5’-aaacaattgctgcactgttcacaggagga-3;对于smad43’utr区2:正向引物,
5’-aaattataacagttgtcccagtgctgcta-3’,反向引物,
5’-aaacaattgatgacttgcccaaaggtcac-3;对于gsk3β3’utr区:正向引物,
5’-aaattataacccacaactggggtaaaaga-3’,反向引物,
5’-aaacaattgctgtggaaggggcaaagata-3。
对于双萤光素酶试验,使用
将具有细胞培养物的载玻片在室温下在95%(v/v)乙醇中固定30min,在pbs中洗涤3次,并与含有0.1%(wt/v)tritonx-100(sigma)和5%(v/v)正常驴血清(millipore)的封闭缓冲液pbs温育60min。将第一和第二抗体在封闭缓冲液中稀释。温育第一抗体。在与pbs中的特异性第一抗体在4℃下温育(24hr)或在室温下温育(2hr)后,在室温下添加合适的异硫氰酸荧光素(fitc,invitrogen)或alexafluor488、594和647(invitrogen)或dylight488和594(biolegend)缀合的第二抗体(1hr)。在对细胞核进行dapi染色(5min)后,在室温下与第二抗体温育(1hr)并洗涤,用50%甘油固定样品。通过共聚焦激光扫描显微术(lsm700;zeissz1或olympusfluoview1000共聚焦激光扫描显微镜)或tissuefaxs系统(tissueqnosticsgmbh,vienna,austria)捕获图像。通过tissuequest软件分析数据。
流式细胞术
用针对cdx2、oct4、sox2和nanog的非特异性shrna或shrna转染后,将细胞(5×106个细胞/ml)与表1列出的特异性第一抗体一起温育30min。随后与稀释度调整的适当的荧光染料缀合的第一抗体在4℃下温育1hr,将样品洗涤并重悬于pbs中。在通过具有细胞过滤器盖的聚苯乙烯圆底管(bdfalcon)之后,使样品经历流式细胞术(facscan,bdbiosciences,sanjose,ca)。采用cell-quest软件(bdbiosciences)分析数据。
电子显微术
对于透射电子显微术,将hts细胞衍生的肝细胞样细胞(诱导第4天)在含有3%wt/vol甲醛、1.5%(wt/vol)戊二醛和2.5%(wt/vol)蔗糖的0.1m二甲胂酸钠缓冲液(ph7.4)中在室温(rt)下固定1hr或在4℃下固定过夜。在4℃下在含有1%(vol/vol)oso4的palade固定剂中进行锇酸(osmication)处理(2hr)之前和之后,用0.1m二甲胂酸钠缓冲液(ph7.4)洗涤该样品。在用鞣酸处理、用1%乙酸铀酰染色并通过一系列分等级的乙醇溶液脱水后,将样品包埋在tabb环氧树脂(agarscientificltd.)中。超薄切片用乙酸铀酰和柠檬酸铅染色,并使用jem-2000exii透射电子显微镜(jeol,tokyo)进行分析。
ldl摄取测定
通过按照制造商的说明使用基于细胞的ldl摄取测定试剂盒
(caymanchemco.annarbor,mi)进行ldl摄取。简言之,将5x104个细胞接种在24孔板的每个孔中的盖玻片处。在5μg/mlldl-dylighttm549探针处理(4hr,37℃)后,将hts细胞(作为对照)和分化的肝细胞样细胞(hhlc)固定,随后通过兔抗-ldl和dylighttm488缀合的山羊抗兔抗体针对ldl受体进行染色。细胞核用dapi进行可视化。通过荧光显微术观察最终的染色。
油-o-红测试
为了检测脂质积累,在室温(rt)下将分化的细胞用4%低聚甲醛固定(20min),并用60%异丙醇洗涤5min。在室温下与新制备的60%油红o溶液(在使用前通过0.22μm过滤器的在100ml异丙醇中的0.5g油红o,sigma)一起温育(20min)后,将细胞用60%异丙醇冲洗并用苏木精i(thermoscientific)复染以供显微镜检查。
糖原储存测试
对于糖原检测,用4%低聚甲醛固定分化的细胞。固定的样品用0.4%tritonx-100进行透化处理。将未分化的对照细胞与淀粉酶(pbs中的1mg/ml;sigma)在37℃下一起温育1hr。将细胞与高碘酸(0.5g,溶解在100ml蒸馏水中)在室温下一起温育5min,用蒸馏水洗涤,并与新制备的希夫试剂一起温育(15min)并经历显微镜检查。
白蛋白和脲测定
在诱导之前和之后,通过自动分析仪(hitachi7080;tokyo,japan)测量hts细胞的培养基中总蛋白质、白蛋白和脲的浓度。
统计学分析
所有实验均一式三份进行,并且如所示地重复两次。通过studentt检验计算从蛋白质印迹、qpcr、萤光素酶报告试验和流式细胞术获得的数据。p值<0.05被认为是统计学显著的。
从hts细胞到de谱系的细胞过程。
人多能干细胞分化为肝细胞样细胞,de形成是细胞过程中需要鉴定的第一步。通过免疫荧光显微术发现,在hts细胞中,bfgf(10ng/ml)能够在诱导8hr时有效产生de,表达特异性生物标志物:叉头框蛋白a2(foxa2)和sry-box17(sox17),goosecoid(gsc)和同源结构域蛋白mixl1(图1a-图1c)。随后,通过免疫印迹分析在bfgf诱导后确立了de相关标志物的时间线表达,包括转录因子:gsc、brachyury(t)、mixl1、sox17和foxa2(图1d)。发现mixl1、brachyury和gsc的水平在最初15min显著升高,这表明原条的转变。然而,这些水平在30min后下降,这暗示从原条到新生中内胚层的迁移。具体地,mixl1水平在4hr时从峰值(15min)降至最低点(比天然水平低约50%),并且此后该水平回到原始水平。该事实得到成像研究(图1c)和tissuefax分析(图7)的支持。这些结果表明细胞过程从中内胚层移至de阶段是因为:i)mixl1mrna表达在内胚层中不存在而限于中胚层,和ii)mixl1的丧失对中内胚层先祖的内胚层潜力有影响,因为mixl1在原条中特异性表达。sox17水平在2hr时上调至峰值(1.5倍),但在8hr时下调;而foxa2在8hr时持续上调至最高水平(3倍)(图1d)。然而,gsc从30min到1hr下调,但仍然维持在略高于原始水平(图1d)。为此,这些数据表明,bfgf(10ng/ml)能够通过在诱导8hr时上调sox17、foxa2和gsc而下调mixl1,以高效的方式诱导hts细胞转分化为de谱系。由此,de产生肺、食管、胃和肠以及内分泌腺如肝、胰和甲状腺的上皮内层。
地塞米松和sox17通过hnf4α表达驱动分化为肝命运
肝细胞核因子4(hnf4)是人肝祖细胞特化所必需的转录因子。因为地塞米松(dexa)诱导hnf4α表达并且细胞因子制癌蛋白m(osm)参与胎儿肝发育。发现通过在诱导8hr时向条件培养基中添加地塞米松(0.1μm)和制癌蛋白m(10ng/ml),导致了肝细胞样细胞的分化,根据免疫染色发现该细胞在4天后表达肝标志物,例如白蛋白、甲胎蛋白(afp)、胆汁转运蛋白mrp2(abcc2)和胆汁盐输出泵(bsep)(图1e)。
随后,时程的免疫印迹分析显示,foxa2和sox17在24hr内均维持在较高水平,随后在第2天突然下降(图1f)。有趣的是,sox17能够直接激活在内胚层分化过程中抑制hnf4α的锌指蛋白202(zfp202)。在de阶段,峰值(2hr)后sox17水平的显著降低(图1d)可能间接降低对hnf4α的抑制作用;从而促进了地塞米松诱导的hnf4α激活。因此,bfgf、地塞米松和sox17撤出的组合效应通过hnf4α表达导致肝特化内胚层的启动。此外,白蛋白在12hr后表达,支持分化为肝内胚层谱系(图1f)。因此,活性hnf4α可以控制肝细胞的形态和功能分化;由此,肝母细胞阶段的开始可以发生在诱导的第2天。在第3天afp的出现指示胎儿未成熟肝细胞的细胞过程。有趣的是,在第3天出现了β调理素的峰值水平,这表明其参与营养和脂质代谢的调节。总之,hts细胞可在一周内有效分化为肝细胞样细胞,这模拟了胚胎发生过程中原代肝细胞的细胞过程。实际上,这些研究结果表明,这种两步法能够由hts细胞生肝母细胞样细胞,这与以前在hes细胞和ips细胞中报道的耗时的方案不同。
de特化中mirna-124a的调节机制
了解bfgf如何诱导de形成的分子机制对进一步肝分化而言是必要和必需的。bfgf能够通过其受体fgfr1来诱导pi3k/akt/creb1信号传导途径(图8a-8d)。因此,creb1的激活使我们能够专注于微小rna(mir)——一种小非编码rna——的参与,原因有两点:i)mir-124a能够调节胰腺β细胞中的foxa2,即de-衍生的肝细胞对应物,以及ii)与creb1基因位点结合的mir-124在哺乳动物creb13'utr中是保守的。通常,mir通过抑制翻译和/或引起rna降解而作为参与包括干细胞分化在内的各种生物过程的关键调节剂。为此,通过chip-qpcr测定发现了活性creb1能够靶向mir-124amrna启动子的三个位点,从而促进mir-124a的表达(图2a)。该作用得到降低mir-124a表达的crpb1敲低(图2b)以及通过qpcr测定发现的表达的平行相关性(图2b)的支持。这些结果一起表明,bfgf能够诱导pi3k/akt/creb1信号传导途径,进而creb1促进mir-124a表达,在de阶段中在4hr诱导时达到峰值。
值得注意的是,4hr诱导时最高mir-14a与最低mixl1之间的相关表达吸引我们检查它们之间是否存在关系。通过序列分析和萤光素酶报告试验,mir-124a能够在两个位点处靶向smad4信使rna(msmad4),从而阻止信号转导蛋白smad4产生,这通过萤光素酶报告试验(图2d)和免疫印迹分析(图2e)而证实。一致地,mir-124抑制smad4引起mixl1的抑制,这得到smad4敲低的支持(图2f)。这些数据解释了在de阶段mixl1的下调,这归因于bfgf诱导的mir-124a的活化。此外,mir-124a还能够发挥其他作用,例如,根据萤光素酶报告试验(图2g),其抑制糖原合酶激酶3β(gsk3β)mrna(图2e),这抑制了gsk3β的产生。这种抑制性gsk3β导致其下游底物β-联蛋白的核易位。根据chip-qpcr测定,在细胞核中,β-联蛋白能够靶向foxa2基因的启动子,从而产生foxa2(图2h)。因此,foxa2的表达突出了de阶段的细胞分化。
oct4对自我更新特征的维持
在另一个方面,mir-124a还能够靶向cdx2mrna(图2i)以抑制减少cdx2产生的cdx2翻译(图2e),cdx2为多能转录因子。共转染的mir-124a-和cdx2质粒的存在支持了这一点(图2i)。然而,抑制性cdx2通过oct4与cdx2之间的相互抑制关系导致多能转录因子oct4的激活(图2e)。该功能通过成像研究(图2j)和免疫印迹测定(图2k)得到反映。根据免疫印迹测定,oct4激活可被抗mir-124a抗体抑制,从而将mir-124a与oct4联系起来(图2e)。多能转录因子nanog和sox2二者在8小时内逐渐升高(图2k)提示其在维持与hes细胞中的多能性相容的de谱系的多能性方面有支持作用。因此,这些数据提示,oct4主要维持de的自我更新特性,这得到其他核心多能转录因子nanog和sox2的支持。此外,根据chip-qpcr测定,活性oct4能够靶向sox17mrna的启动子的两个位点(图2l),其诱导sox17表达,在2hr时达到峰值(图1c)。sox17表达代表de鉴定中的另一个里程碑。总而言之,这些结果在hts细胞中证明,bfgf依赖性mir-124a以与hes细胞中的3天进程不同的高效方式(8hr)诱导de形成。示意性调节分子机制说明de特化通过mir-124a信号传导上调foxa2、sox17和oct4但下调mixl1;其中oct4在维持de谱系的自我更新中起主要作用(图2l)。
遗传谱与肝发育中的阶段特异性表型相对应
为了随后将de分化引导至肝谱系,在8hr时的de阶段完成后添加地塞米松和制癌蛋白m。鉴于qrt-pcr测定的优势,探讨了时程谱中肝发育相关的31个基因的动态表达,以表征可用于跟踪分化过程的mrna指纹。总之,每个基因的遗传谱揭示了在6天诱导期间具有4-5个峰的相似模式。基于小鼠模型中肝发育的细胞过程,将用bfgf以及地塞米松与制癌蛋白m的混合物处理的hts细胞按照其遗传表达谱分类成四个细胞过程阶段:原条至de(<8hr),肝特化的内胚层谱系(8hr至第1天),肝母细胞(第2-4天),以及胎儿和成年肝细胞样细胞(天数≧第4天)(图9a-9f)。
因此,这些结果揭示,i)在原条至de阶段,突出表达(>10倍至1,000倍)的四个基因包括cxcr4、foxa2、sox17和hhex;ii)在肝特化内胚层阶段,突出表达(10倍至100倍)的六个基因包括肝芽形成和脂质代谢的sox17、甲状腺素和视黄醇结合蛋白ttr、蛋白质载体白蛋白(alb)、酪氨酸分解代谢酶tat、serpina1,以及胆汁酸生物合成酶cyp7a1;iii)在肝母细胞阶段,存在6个突出表达(10倍至100倍)的基因,包括ttr、alb、tat、cyp7a1、serpina1和胆汁盐排泄泵bsep;并且iv)在胎儿和成年肝细胞样细胞阶段,存在11个突出表达(>100倍)的基因,包括hhex、bsep、ttr、alb、tat、serpina1、葡萄糖稳态酶g6pc、肝胆排泄转运蛋白mrp2(abcc2)、免疫和正常巨噬细胞调节物c/ebpβ,以及几种肝基因调节物如hnf4α和hnf1α。此外,甲胎蛋白(afp)的表达在胎儿阶段(第4天和第5天)出现,但在成年肝细胞样细胞阶段的第5天后降低(图6)。
肝板状结构表现出肝细胞的特征
在肝脏中,肝板系统构成独特的组织结构,其由胆管和被与glisson囊连续的鞘围绕的血管组成。为表征分化期间hts细胞衍生的肝细胞样细胞的形态变化,发现细胞形态从最初的成纤维细胞样变化成较长的纺锤特征,伴随有形成小叶形状的趋势,表明在第2天和第3天时有大量多边形细胞位于中央区(图3a)。然而,在第4天后,细胞可能聚集以形成板状团块,并且该现象取决于所培养的初始细胞数。然后对细胞群进行进一步的检查。
在组织学上,大多数细胞排列似乎是一个细胞或两个细胞厚的嗜酸性粒细胞细胞质,从而形成板状组织;然而,细胞可聚集在一起以形成细胞群(图3a)。在免疫组织化学上,这些细胞表现出在细胞质隔室中的白蛋白、afp、β调理素、hnf4α、apof、cps1、adh1和cyp2b6的免疫荧光染色;而包括cxcr4、cx32、mrp2和bsep在内的细胞膜标志物亚组使得细胞为类似于原代肝细胞的多边形形状(图3b)。电子显微术显示出与原代肝细胞类似的超微结构,例如,大的细胞质与细胞核之比、大量线粒体、组织良好的内质网、桥粒连接处、完整的高尔基体,以及特别是扩大的小管腔,以及连接复合体(图3c)。此外,免疫细胞荧光成像揭示出afp和白蛋白以及abcc2(mrp2)和bsep的共定位(图1e)。至此,已经证明这些肝细胞样细胞具有类似于原代肝细胞的细胞组分或基础结构的肝特征。
肝细胞样细胞在体外和体内起原代肝细胞的作用
肝脏是负责代谢中的许多特定功能,如白蛋白合成、脲生成、糖原生成和解毒的最重要的器官。为检查这些肝细胞样细胞是否能够起到类似于原代肝细胞的作用,研究了该细胞中白蛋白和脲的分泌能力。收获诱导第4天的培养基,并对其进行elisa分析。结果揭示,白蛋白和脲水平均显著上升,提示其在培养基中产生分泌白蛋白和脲的能力(图4a)。接下来,糖原储存能力测试揭示了在细胞阶段或肝板状组织中淀粉酶消化处理后的阳性高碘酸-希夫(pas)染色(图4b)。进一步通过免疫细胞化学和免疫组织化学的pas荧光发射来确认这种作用(图4b)。此外,ldl摄取测定揭示,细胞的ldl摄取能力从诱导第4天的未成熟肝细胞开始(图4c)。油-o-红染色揭示了脂肪滴的存在,从某种角度提示了脂肪生成的程度(图4d)。此外,通过采用细胞色素p450(cyp)酶作为靶标,通过qpcr分析,检查了肝细胞样细胞在体外是否具有药物代谢和解毒的能力。结果揭示,肝细胞样细胞响应于代谢特异性药物显著地表达cyp1a2、cyp2b6、cyp2c8、cyp2c9、cyp2d6、cyp2e1、cyp3a4和cyp7a1的活性(图5a-5i),提示这些肝细胞样细胞可类似于原代肝细胞用于药物筛选和发现。例如,肝酶诱导剂利福平可促进cyp3a4活性,从而提高药物的代谢率,而cyp3a4的抑制是已广泛应用于临床的药物-药物相互作用(ddi)的主要原因。此外,已经显示,根皮乙酰苯(phloracetophenone)(2,4,6-三羟基苯乙酮,tha)同时促进cyp7a1活性和mrna表达以降低高胆固醇血症仓鼠中的血浆胆固醇和甘油三酯,并且tha拮抗鹅去氧胆酸(cdca)对cyp7a1mrna表达的抑制调节。为此,已经显示,在肝细胞样细胞中,利福平诱导的cyp3a4能够被其抑制剂依曲康唑减少(图5h),而tha诱导的cyp7a1mrna升高被cdca减少(图5i)。从药理学的角度来看,例如,胆汁酸结合树脂被指示用于治疗血浆低密度脂蛋白胆固醇浓度升高,然而,树脂疗法是有危险的。因此,已通过进行cyp7a1的调节以降低血浆胆固醇来设计新药物,并且新药物以确认cyp7a1位置为创新药理学干预的焦点为基础。
碱性fgf诱导hts细胞中pi3k/akt/creb1信号传导途径的激活
用条件培养基中的bfgf(10ng/ml)处理hts细胞,并且通过免疫印迹测定显示,fgf受体(fgfr)抑制剂pd166866能够阻断bfgf诱导的磷脂酰肌醇3-激酶(pi3k)的激活(图8a),提示该抑制效应是通过细胞膜上的fgfr。因此,通过使用pi3ksirna证明了下游效应物akt被磷酸化(图8b)。为明确哪个蛋白激酶b(akt)亚基被激活,通过免疫印迹测定检查了针对以下三个akt亚基的特异性sirna:akt1、akt2和akt3。结果显示,仅akt1磷酸化并激活其下游效应物camp反应元件结合蛋白1(creb1)(图8c)。通过免疫沉淀(ip)测定(图8d)进一步证实了该功能。总而言之,这表明bfgf在4hr诱导时诱导pi3k/akt1/creb1信号传导途径的激活。
实施例2
实验程序
细胞培养和分化
该研究获得了人类受试者研究与伦理委员会机构审查委员会的批准(kmuhirb-20140071)。在如先前所述的知情同意的情况下获得hts细胞(lee等人,2012,plosone7,e52491),并将其在含有5%co2的潮湿空气中在37℃下维持在补充有10%(v/v)胎牛血清(fbs;safcbiosciences)的α-mem(gibco)培养基中。为了de分化,根据实证研究(数据未示出),使细胞处于含有10%fbs、2-巯基乙醇(1mm)、烟酰胺(10mm)和bfgf(10ng/ml)的条件α-mem培养基中8hr。对于在8hr时de形成后的肝细胞分化,将细胞培养物改变为含有bfgf(10ng/ml)、地塞米松(0.1μm,sigma)、重组人制癌蛋白m(10ng/ml,excel-biomedicalinc.)、bmp4(20ng/ml)和hgf(5ng/ml)的培养基。在4-7天时收获细胞以用于所示的测定。谱系的阶段特异性分化的确定依赖于肝发育中的肝细胞相关的标志物。
动物研究
将成年雄性sprague-dawley大鼠(300-350g)以12hr光/12hr暗的循环饲养,随意获取食物和水。实验研究由高雄医科大学机构动物伦理委员会(iaec)批准(iacuc-96009)。对于实验,经由腹膜内注射用25%水合氯醛(500mg/kg)麻醉大鼠。将大鼠分为两组:假操作组作为对照(n=8),另一组作为研究组(n=8)。在实验前获得静脉内血液(0.5ml)作为基线,并在12hr后为两组腹膜内注射ccl4(1ml/kg:玉米油中1:1v/v)。立即从尾静脉向研究组注射hts细胞衍生的肝细胞(1x106个细胞/200μl培养基),而假操作组仅给予pbs溶液。血清样品在基线时、细胞注射时间点、24hr、48hr和72hr取得,并经受肝功能试验,即,天冬氨酸氨基转移酶(ast或之前称为sgot)、丙氨酸氨基转移酶(alt或之前称为sgpt)和碱性磷酸酶(alp)、血清胆红素。在第4天将所有大鼠处死以获得肝脏和肺器官,以供组织病理学研究。
mrna、mirna、染色质免疫沉淀(chip)-qpcr和mrna微阵列
如之前所述(lee等人,2012,plosone7,e52491)实施方法。对于mrna表达,根据制造商的说明,采用trizol试剂(invitrogen)与dna酶i柱上消化(qiagen,valencia,ca)从一式三份或一式五份的样品中的hts细胞中分离rna。总rna(500ng)用于采用iscriptcdna合成试剂盒(bio-rad)进行逆转录。采用每个反应1/40的cdna以及400nm正向引物和反向引物,一式三份地进行实时聚合酶链反应(qpcr)。采用7500实时pcr系统(appliedbiosystems),用power
对于mirna分析,采用taqmanmicrorna逆转录试剂盒(appliedbiosystems)逆转录25ng的总rna。使用针对mir-124a或rnu6b的特异性引物(appliedbiosystems),采用7500实时pcr系统(appliedbiosystems),用taqmanuniversalpcrmastermix(appliedbiosystems)至少一式三份地进行qpcr。u6snrna(rnu6b;appliedbiosystems)充当内源性对照。
对于chip测定,用最终浓度为1%的甲醛固定指定诱导时间的hts细胞样品。在室温下温育(10min)后,通过添加甘氨酸(125mm)来终止反应。采用chip测定试剂盒(upstatebiotechnology)所附的方案进行chip测定。经充分洗涤后,将经过chip的dna从珠上洗脱并通过qpcr进行分析。
萤光素酶报告试验
为了制备萤光素酶-3'utr报告基因质粒,扩增来自hts细胞的基因组dna提取物的3’utr片段。采用psii和mfei(thermoscientific,rockford,il),将3'utrpcr片段克隆至pgl4.51载体(promega,madison,wi)中萤光素酶基因的下游。用于3’utr报告基因构建体的引物如下列出:
对于cdx23’utr区:
正向引物,5’-aaattataagctgtttgggttgttggtct-3’,
反向引物,5’-aaacaattgcccccataatttctgactgc-3;
对于smad43’utr区1:
正向引物,5’-aaattataactcccaaagtgctgggatta-3’,
反向引物,5’-aaacaattgctgcactgttcacaggagga-3;
对于smad43’utr区2:
正向引物,5’-aaattataacagttgtcccagtgctgcta-3’,
反向引物,5’-aaacaattgatgacttgcccaaaggtcac-3;
对于gsk3β3’utr区:
正向引物,5’-aaattataacccacaactggggtaaaaga-3’,
反向引物,5’-aaacaattgctgtggaaggggcaaagata-3。
对于双萤光素酶试验,采用
质粒
mir-124a前体和抗-mir-124a从systembiosciences购得。简言之,采用transit-lt1转染试剂(mirus,madison,wi)将mir-124a前体(60pmol)或抗-mir-124a(60pmol)转染至12孔培养皿中的hts细胞中。在转染后36hr,使用总rna量化mir-124a。靶向pi3k(sasi_hs01_00233971和sasi_hs01_00127787)、akt1(sasi_hs01_00205545)和akt2(sasi_hs01_00035055)的小干扰rna(sirna)从sigma购得。靶向creb1(trcn0000007310、trcn0000226467和trcn0000226468)、smad4(trcn0000010321、trcn0000010323和trcn0000040032)、akt3(trcn0000001615和trcn0000001616)、oct4(trcn0000004879和trcn0000004882)、cdx2(trcn0000013683和trcn0000013686)的短发夹rna(shrna)以及对照shrna(shgfp;trcn0000072178、trcn0000072179和trcn0000072183)从nationalrnaicore平台,academiasinica,taiwan购得。用2μg的sirna或shrna加上4μl转染试剂进行转染。
ldl摄取测定
通过按照制造商的说明使用基于细胞的ldl摄取测定试剂盒(caymanchemco.annarbor,mi)进行ldl摄取。简言之,将5x104个细胞接种在24孔板的每个孔的盖玻片处。在5μg/mlldl-dylighttm549探针处理(4hr,37℃)后将hts细胞(作为对照)和分化的肝细胞样细胞(hhlc)固定,然后通过兔抗-ldl和dylighttm488缀合的山羊抗兔抗体针对ldl受体进行染色。用dapi将细胞核可视化。通过荧光显微术观察最终的染色。.
油-o-红测试
为检测脂质积累,在室温下将分化的细胞用4%低聚甲醛固定(20min),并用60%异丙醇洗涤5min。在室温下与新制备的60%油红o溶液(在用前通过0.22μm过滤器的在100ml异丙醇中的0.5g油红o,sigma)一起温育(20min)后,将细胞用60%异丙醇冲洗并用苏木精i(thermoscientific)复染以供显微镜检查。
糖原储存测试
对于糖原检测,用4%低聚甲醛固定分化的细胞。用0.4%tritonx-100将固定的样品透化。将未分化的对照细胞与淀粉酶(pbs中的1mg/ml;sigma)在37℃下一起温育1hr。将细胞与高碘酸(0.5g,溶于100ml蒸馏水中)在室温下一起温育5min,用蒸馏水洗涤,与新制备的希夫试剂一起温育(15min),并经历显微镜检查。
生化参数检验
包括白蛋白、脲、天冬氨酸氨基转移酶(ast)和丙氨酸氨基转移酶(alt)在内的肝功能的所有生化参数都通过使用自动分析仪(hitachi7080,japan)来测量。
功能性细胞色素p450测定
为检测hts细胞衍生的肝细胞样细胞中的cyp酶诱导活性,用试剂将细胞处理24hr,例如,对于cyp1a2试验,所用的为利福平(25μm)/利福平+环丙沙星(1μm);对于cyp2b6试验,所使用的为苯巴比妥(100μm)/苯巴比妥+氯吡格雷(25μm),对于cyp3a4试验,所使用的为利福平(25μm)/利福平+依曲康唑(25μm),对于cyp7a1试验,所使用的为2,4,6-三羟基苯乙酮(tha,1μm)/tha+cdca(25μm),对于cyp2c8和cyp2c9,所使用的为利福平(25μm)/利福平+吉非罗齐(25μm),而对于cyp2c19,所使用的为利福平(25μm)/利福平+噻氯匹定(25μm)。huh-7细胞用作阳性对照。
免疫细胞化学和免疫组织化学
如之前所述(lee等人,2012,plosone7,e52491)实施方法。简言之,在室温下将具有细胞培养物的载玻片在95%(v/v)乙醇中固定30min,在pbs中洗涤三次,并与含有0.1%(wt/v)tritonx-100(sigma)和5%(v/v)正常驴血清(millipore)的封闭缓冲液pbs温育60min。将第一抗体和第二抗体在封闭缓冲液中稀释。温育第一抗体。在4℃(24hr)或室温(2hr)下与pbs中的特异性第一抗体一起温育后,在室温下添加合适的异硫氰酸荧光素(fitc,invitrogen)或alexafluor488、594和647(invitrogen)或dylight488和594(biolegend)缀合的第二抗体(1hr)。在对细胞核进行dapi染色(5min)、在室温下与第二抗体一起温育(1hr)并洗涤后,用50%甘油固定样品。通过共聚焦激光扫描显微术(lsm700;zeissz1或olympusfluoview1000共聚焦激光扫描显微镜)或tissuefaxs系统(tissueqnosticsgmbh,vienna,austria)捕获图像。通过tissuequest软件分析数据。
电子显微术
对于透射电子显微术,如之前所述(lee等人,2012,plosone7,e52491)实施方法。简言之,将hts细胞衍生的肝细胞样细胞(诱导第4天)在含有3%wt/vol甲醛、1.5%(wt/vol)戊二醛和2.5%(wt/vol)蔗糖的0.1m二甲胂酸钠缓冲液(ph7.4)中于室温下固定1hr,或于4℃下固定过夜。在含有1%(vol/vol)oso4的palade固定剂中于4℃下进行锇酸(osmication)处理(2hr)之前和之后,用0.1m二甲胂酸钠缓冲液(ph7.4)洗涤该样品。在用鞣酸处理、用1%乙酸铀酰染色并通过一系列分等级的乙醇溶液脱水后,将样品包埋在tabb环氧树脂(agarscientificltd.)中。将超薄切片用乙酸铀酰和柠檬酸铅染色,并采用jem-2000exii透射电子显微镜(jeol,tokyo)进行分析。
免疫印迹和免疫沉淀(ip)
如之前所述(lee等人,2012,plosone7,e52491)实施方法。对于免疫印迹测定,将细胞收获在补充有蛋白酶和磷酸酶抑制剂(roche)的ripa裂解溶液(millipore,billerica,ma)中。在聚丙烯酰胺凝胶上电泳30μg裂解物后,进行向pdvf膜(millipore)上的电印迹。在室温下用在pbs中的5%脱脂奶粉封闭(1hr)后,通过使用第一抗体检测靶蛋白。所有膜均与化学发光计(millipore)一起温育,并通过chemidocxrs系统(bio-rad)捕获图像。所用的抗体在表4中列出。通过alphaeasefc(4.0.0版)系统分析数据。对于ip测定,收集bfgf处理的hts细胞的细胞裂解物。通过与蛋白g-琼脂糖(milipore)一起温育30min,用表4中列出的特异性第一抗体处理总蛋白(100μg)过夜。在用蛋白g-琼脂糖珠处理(2hr)后,用ripa裂解缓冲液(milipore)洗涤样品三次,随后添加蛋白质加载染料并煮沸5min。通过8%sds-page解析该样品,并使其经历免疫印迹分析。
针对2-维凝胶电泳(2-de)的样品制备
获得两个样品:细胞培养基(5天,作为研究组)和纯培养基(作为对照组)。如前所述(chou等人,2015)准备样品。简言之,将样品(0.1ml)在-20℃下与含有11%三氯乙酸(tca,w/v)和20mmdtt的1ml冰冷丙酮一起温育30min。在离心(12,000rpm,10min,4℃)后,用含有20mmdtt的1ml冷丙酮洗涤蛋白质沉淀物两次,随后风干以去除丙酮。然后,添加合适的再水化缓冲液(7m脲、2m硫脲、2%chaps、0.5%ipg缓冲液、20mmdtt),并通过bradford法测量浓缩的样品。对于2-de分析,将总共150μg蛋白质与含有5m脲、2m硫脲、3%w/vchaps、具有3–10的非线性ph的1%固定化ph梯度(ipg)、100mmdestreak试剂和痕量溴酚蓝的缓冲液一起温育。在一系列处理过程后,使用ettanipgphor杯上样(cup-loading)(amershambiosciences)将样品杯上样到ipg条带的阳极附近,并且根据制造商的方案采用ief参数实现蛋白质聚焦。在第一维电泳后,将等电聚焦ipg条带在含有1%w/vdtt的条件平衡缓冲液中振荡(15min),随后在含有2.5%w/v碘乙酰胺的同一溶液中振荡(15min)。将条带转移到12%sds-聚丙烯酰胺凝胶(page)上方。通过恒定75v(30min)和100v(16hr)进行第二维分离。对2-de凝胶进行银染色,并用typhoon9410扫描仪(amershambiosciences)进行检测。比较斑点,并通过采用imagemaster2dplatinum系统将其定量(amershambiosciences)。
用于蛋白质鉴别和定量的电喷雾离子化-四极杆-飞行时间串联质谱法(esi–q-tof–ms/ms)
为鉴别所观察到的2d凝胶蛋白质,用胰蛋白酶消化样品,随后如之前所述(chou等人,2015)对其进行用于蛋白质鉴别的纳流液相色谱分析和waters-micromassesi–q-tof(waters,manchester,uk)。为获得相应的峰列表,通过masslynx4.0软件(manchester,uk)处理每种前体的各个片段的ms/ms谱,并将峰列表文件上传至内部mascot服务器以供蛋白质鉴别。
统计学分析
所有实验都一式三份地进行,并且如所示地重复两次。通过studentt检验计算从蛋白质印迹、qpcr、萤光素酶报告试验和流式细胞术获得的数据。在动物研究中,统计学地使用配对anova检验。p-值<0.05被认为是统计学显著的。
结果
1)bfgf单独诱导hts细胞中的de分化
干细胞至肝谱系的路径由一系列渐进的细胞过程组成,特别包括de形成中所需和必要的步骤。最初用bfgf(10ng/ml)处理hts细胞,并通过免疫印迹测定测量de相关标志物随时间的水平。结果显示,在诱导的最初15min,转录因子如goosecoid(gsc)、brachyury(t)、同源结构域蛋白mixl1(mixl1)、sry-box17(sox17)、叉头框蛋白a2(foxa2,也称为hnf3β)以及原始内胚层标志物sox7显著上调,在30min至1hr之间达到峰值(图10a)。这些数据暗示从hts细胞向介导新生中内胚层的原条阶段的快速转变,该原条阶段与早期胚胎发生中的肝脏发育相容。此后,sox17水平持续升高直到4hr,随后降低;而foxa2和brachyury升高到8hr,但sox7表达在诱导15min后变成初期的。值得注意的是,通过tissuefax分析测量,mixl1的强度从峰值(15分钟)下降到4hr时的最低点(比天然水平低约50%),并在8hr时回到原始水平(图10as)。还通过免疫荧光成像证明了其表达的变化(图10b)。这些结果表明,单独的bfgf能够通过模拟胚胎肝发育的原条和中内胚层,使hts细胞快速分化至de阶段。
2)pi3k/akt/creb1信号传导途径促进mir-124a表达
bfgf能够经由其在hts细胞中的受体fgfr1诱导pi3k/akt/creb1信号传导途径。用条件培养基中的bfgf(10ng/ml)处理hts细胞。通过免疫印迹测定显示,fgf受体(fgfr)抑制剂pd166866能够阻断bfgf诱导的磷脂酰肌醇3-激酶(pi3k)的激活(图8a),提示该抑制效应是通过细胞膜上的fgfr。因此,通过使用pi3ksirna证明了下游效应物akt被磷酸化(图10cs)。为明确哪个蛋白激酶b(akt)亚基被激活,通过免疫印迹测定检查了针对以下三个akt亚基的特异性sirna:akt1、akt2和akt3。结果显示,仅akt1磷酸化并激活其下游效应物camp反应元件结合蛋白1(creb1)(图10ds)。通过免疫沉淀(ip)测定(图10es)进一步证实了该功能。总而言之,这表明bfgf在4hr诱导时诱导pi3k/akt1/creb1信号传导途径的激活。
微小rna(mir)-124——一种小非编码rna——参与胰腺β细胞(腹前肠内胚层的衍生物)中的foxa2表达。随后,在细胞核中,通过chip-qpcr测定发现,激活的creb1直接靶向mir-124a的启动子的三个位点以在4hr诱导时诱导mir-124a表达(图10c),并且creb1的敲低降低了其表达(图10fs)。通过qpcr分析显示,creb1和mir-124随时间的表达呈平行相关(图10d)。这些结果表明,bfgf诱导的pi3k/akt/creb1信号传导途径能够在hts细胞分化早期时空相关地上调mir-124a。
3)mir-124a引导de特化
筛选了与肝生成相关的几种基因,并构建了萤光素酶报告试验,通过该试验测量了几种信号转导蛋白质,包括母体抗decapentaplegic同源物4(smad4)(图11a)、糖原合酶激酶3β(gsk3β)(图11b)和同源框转录因子cdx2(图11c)。mir-124a的抑制功能包括:i)靶向smad4信使rna(smad4mrna)的启动子以防止smad4产生(图11a,下部的图)。因此,抑制性smad4导致mixl1的抑制,这通过smad4的敲低得到证实(图11as)。这种机制解释了de阶段中mixl1的下调(图10a)和原肠胚形成过程中移行细胞的命运转变;ii)靶向gsk3βmrna的启动子以抑制其翻译(图11b,下部的图),从而导致下游底物钙粘蛋白相关蛋白β1(β-联蛋白)的核易位。在细胞核中,β-联蛋白靶向foxa2基因的启动子以产生foxa2(图11d),从而突出de阶段的分化。有趣的是,这种增加的foxa2进而诱导c19orf80基因转录,从而编码β调理素蛋白质表达(图11e)。β调理素是肝脏中产生的激素,其控制胰腺β细胞增殖;iii)靶向尾(caudal)相关同源框转录物cdx2mrna以抑制其翻译成多能转录因子cdx2(图11c,下部的图)。所有这些分子事件都在4hr诱导时发生,这通过免疫印迹测定经由使用mir-124a和抗mir-124a抗体得到确认。
随后,根据免疫荧光成像研究,减少的cdx2促进多能转录因子oct4的上调(图11g)。通过免疫印迹测定经由采用抗mir-124a抗体的mir-124a敲低来进一步验证oct4的过表达(图11f)。通过免疫印迹测定证明了cdx2与oct4之间的这种相互抑制关系(图11bs,上部的图)。此外,观察到多能转录因子nanog在8hr诱导时的显著逐渐升高(图2bs,下部的图)。这些结果提示,oct4在维持de谱系的多能性特征中发挥重要作用;而nanog可能具有与hes细胞中一致的支持作用。重要的是,根据chip-qpcr测定,激活的oct4进而靶向sox17基因的启动子(图11h),这促进了sox17表达(图10a)。sox17的表达代表了de分化中的另一个里程碑。总之,图11i是用于描述调节分子机制的示意图,bfgf诱导通过该机制引发介导hts细胞中的mir-124a的de形成。
4)3d组织结构中肝细胞样细胞的生成
随后,在de形成(8hr)后,用bfgf(10ng/ml)、地塞米松(dexa;0.1μm)、制癌蛋白m(osm;10ng/ml)、骨形态发生蛋白4(bmp4;20ng/ml)和肝生长因子(hgf;5ng/ml)的组合对细胞进行培养。出乎意料地,细胞形态可能表现为分散的成纤维细胞样细胞或逐渐聚集以形成新月细胞群,这取决于培养中的接种密度(图12a,插图和图12as)。该细胞群的组织学检查揭示了两种不同的外周和中央室,从而构建出3维(3d)组织结构。在外周部分中,许多簇集的小细胞不规则地分布在基底膜以外的细胞外基质(ecm)之间。细胞具有经常偏心定位的浓缩细胞核,以及在嗜酸性细胞质中的与胚胎干细胞/祖细胞类似的丰富的颗粒和液泡(图12as)。在中央部分中,许多独立的圆柱状ecm通过两侧的细胞内层从基底向中央区分布(图12a)。这些细胞含有丰富的嗜酸性细胞质,并在具有一个或两个主要核仁的单圆细胞核中分散染色质,从而模拟表型肝细胞。可以看到几个双核细胞。这种特征与人类肝脏中所称的肝板类似。
在免疫细胞化学上,这些肝细胞样细胞表现出以下特异性标志物:i)针对人细胞的人细胞质标志物stem-121tm、针对肝固有干细胞的肥大细胞/干细胞生长因子受体c-kit、针对胆管细胞的ck19,以及针对肝细胞的ck18(图12b);以及ii)免疫组织化学地针对肝细胞的白蛋白(alb)、甲胎蛋白(afp)、β调理素、adh1、apof、cps1、gata4、cyp1a1以及细胞质中的cyp2b6(图12c和图12cs)。而包括asgr1、cxcr4、bsep、mrp2和cx32在内的表面标志物亚组构建了与原代人肝细胞类似的多边形细胞形状(图12c)。此外,电子显微术揭示出于原代肝细胞类似的超微结构,包括大的细胞质与细胞核之比、大量线粒体、组织良好的内质网、紧密连接处、许多脂质液泡、糖原储存、具有连接复合体的扩大的胆小管腔以及多重ecm(图12d)。
5)tgfβ1促成肝ecm中纤连蛋白和胶原iv支架的形成
在细胞培养基中的9种新上调的分泌蛋白质之中,蛋白质(第413号)成为有吸引力的靶标,因为通过mascotms/ms离子检索系统(esi-quad-tof,brukerimpacthd,matrixscience,usa)经由46%的肽序列匹配显著地预测它为转化生长因子-β(tgf-β)诱导的蛋白质ig-h3前体(tgfβ1)(图13a,红色箭头;图13as)。tgfβ1是主要的纤维发生多功能细胞因子,其同时以自分泌和旁分泌的方式起作用以增强肝星形细胞(hsc)中的纤连蛋白和胶原形成。因此,为鉴定tgfβ1的存在,利用免疫组织化学通过免疫组织化学证明ecm中免疫反应性tgfβ1、纤连蛋白和胶原iv的共表达(图13b)。这些结果提示,tgfβ1、纤连蛋白和胶原iv至少部分地构成肝细胞样细胞的3-d组织结构中ecm的支架,该支架可支持肝板中肝细胞的增殖和分化。
6)转录表达表征阶段特异性肝分化
分析了四十二种肝发育相关的基因,提示分化中的细胞在细胞过程期间在基因表达上可能共享重叠的模式。如所提到的,观察到从多能hts细胞向原条(15至30min)和中内胚层(<1hr)的转变,表达升高的gsc、brachyury(t)和sox7以及逐渐升高的mixl1、foxa2和sox17(图10a)。sox7在原条、内脏内胚层和顶叶内胚层中突出表达,但不在de中突出表达(kanai-azuma等人,2002)。在de阶段(1至8hr),高转录表达一直持续,包括cxcr4、foxa2、sox17、hhex和sox7,但随后降低(表3)。当细胞过程进入肝内胚层阶段(8hr至1天)时,包括sox17和foxa2在内的一组核心内胚层转录因子进而调节一连串基因,使细胞成为内胚层谱系。在肝特化后不久,上皮开始表达与肝芽基因相关的基因,包括白蛋白、afp和hnf4α。大量肝母细胞相关的基因表达出现,使细胞分化成双能肝母细胞(第2天至第4天)。由此,肝母细胞表达与胎儿肝细胞相关的特定基因(如afp)、与成年肝细胞相关的特定基因(如alb和hnf4α)以及与胆管上皮细胞相关的特定基因(如细胞角蛋白-19),从而使分化到达胎儿/成年肝细胞阶段(>第4天)。总之,如表3中列出的,这些进行性转录表达与肝发育中的细胞过程一致。
7)肝细胞样细胞表现出肝功能
肝功能的保持是多能干细胞衍生的肝细胞的基本要求。为此,收集了细胞培养基,并对其进行酶联免疫吸附测定(elisa)。结果证明了诱导后培养基中白蛋白、nhcl4诱导的脲以及ccl4-诱导的got、gpt和alp的水平提高(图14a)。ldl摄取测定揭示,这些细胞具有ldl摄取的能力(图14b)。油-o-红染色揭示了脂肪滴的存在,提示脂肪生成的能力(图14c)。此外,糖原储存测试揭示了阳性高碘酸-希夫(pas)染色,这在细胞学或组织学上得到淀粉酶消化和pas荧光发射测试的支持(图14d)。接下来,qpcr分析揭示了细胞色素p450(cyp)酶响应于多种代谢特异性药物的能力,这些药物包括cyp3a4、cyp7a1、cyp2b6、cyp1a2、cyp2c8、cyp2c9、cyp2d6和cyp2e1(图14e)。在功能上,例如,利福平诱导的cyp3a4mrna被其抑制剂依曲康唑减少;而2,4,6-三羟基苯乙酮(tha)诱导的胆固醇7α-羟化酶(cyp7a1)mrna被抗鹅去氧胆酸(cdca)减少。这些结果分别提示了在异生素的氧化以及胆汁酸和胆固醇代谢中的能力。
8)功能性肝细胞样细胞具有干细胞归巢的特征
设计动物研究以模拟急性肝衰竭的临床场景,借此向spraguedawley大鼠给予四氯化碳(ccl4)的腹膜内输注,随后静脉内注射(尾静脉)hts细胞衍生的肝细胞样细胞。目标在于检查这些异种移植物是否通过在大鼠肝脏中归巢而存活,以及检查这些细胞起到何种作用。在第0天、第1天、第2天、第4天和第7天收集血清样品以测量ast和alt水平。在第2天、第4天和第7天将大鼠处死以得到肝脏样品以供组织病理学研究。生化研究揭示,细胞疗法组(ccl4+细胞)中的血清ast和alt水平似乎随时间显著高于对照组(仅ccl4)(图15a)。为阐明这种模糊的观察结果,在组织病理学上检查了肝组织。
采用人细胞质标志物stem-121tm(stemcelltechnologies.inc.wa)作为指示剂,鉴别了hts细胞中的阳性免疫反应性stem-121表达(图15b),随后在植入后4天确认肝组织中stem-121-阳性肝细胞样细胞的存在(图15c)。该观察结果表明,肝细胞样细胞的静脉内施用能够归巢至肝组织。有趣的是,这些stem-121阳性肝细胞在免疫组织化学上也经历变性(图15c)。该事实解释了细胞疗法组比仅ccl4处理组高得多的ast和alt水平提高,因为ccl4(血液中24hr半衰期)的额外效果导致所植入的肝细胞样细胞的变性。hts细胞衍生的肝细胞样细胞的静脉内输注可到达ccl4损伤的肝组织并停留于其中。
9)肝细胞样细胞通过表达hla-g和tgfβ1而具有免疫豁免,并且具有cd4+foxp3+treg细胞的募集能力
所植入的肝细胞样细胞表达人白细胞抗原g(hla-g),因为在免疫组织化学上,植入后4天的肝组织中存在stem-121和hla-g的共表达(图15d),这提示免疫豁免特征。膜结合的或可溶的hla-g强力作用于不同免疫细胞类型(nk细胞、t细胞、b细胞、单核细胞/树突细胞)以通过与在免疫细胞表面表达的抑制性受体相互作用而同时抑制先天和适应性免疫力。
此外,肝细胞样细胞能够向ecm中分泌tgfβ1(图13b)。tgfβ1是胸腺t细胞发育的关键调节物,并且是外周t细胞稳态、对自身抗原的耐受性和免疫应答期间的t细胞分化的关键参与者。同时,在免疫细胞化学上,cd4+foxp3+t调节(treg)细胞存在于肝窦状隙中(图15e),提示treg细胞响应于所植入的细胞向肝脏的募集。细胞因子tgfβ1或cd4+foxp3+treg细胞的主动免疫抑制是外周t细胞耐受的关键机制。所植入的肝细胞样细胞通过表达hla-g和tgfβ1而具有免疫豁免,并将cd4+foxp3+treg细胞募集至肝脏以控制外周t细胞耐受。
表1.例如实施例1中使用的抗体。
表2.例如实施例1中使用的引物
表3.肝分化过程中的转录基因谱
符号:na,未获得;(-)表示表达<2倍,(+)>2倍,(++)>10倍,(+++)>100倍,(++++)>1,000倍。
表4.例如实施例2中使用的抗体
表5.例如实施例2中使用的引物
本文所述的实施例和实施方案仅出于说明的目的,并且对本领域技术人员提示的各种修改或变化都将被包括在本申请的精神和范围以及所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!