体外胆汁排泄测定法的制作方法
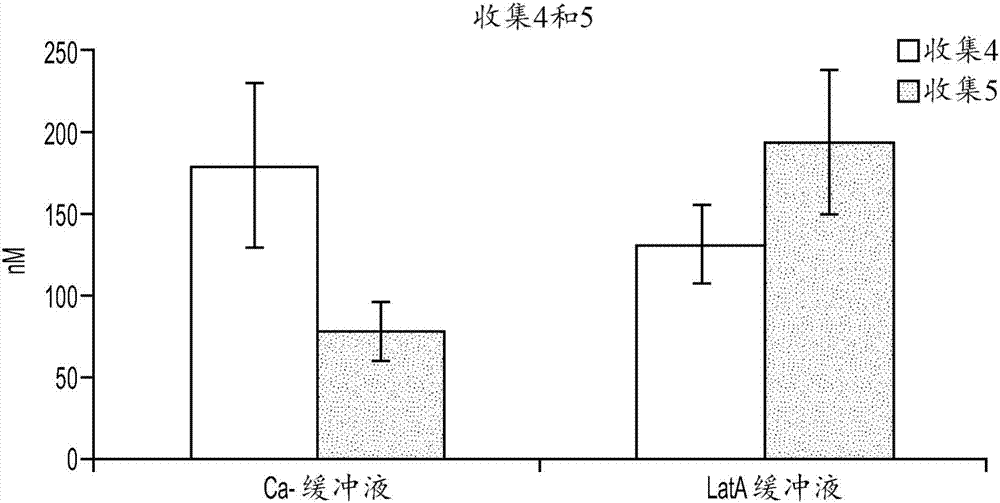
发明背景经常不期望通过肝脏中的首次通过代谢从动物的循环系统中除去治疗性化学实体。如果化学实体被肝细胞摄取并且经由胆小管在胆汁中排泄,则化学实体将永远不会达到其治疗靶标。对于肝细胞而言内源性的转运蛋白负责将底物移动过肝细胞的窦状膜,然后进入胆小管。胆小管是肝组织中的结构,其从肝细胞接收排泄的组分,并将胆汁转运到胆总管以从动物中除去。因此,底物的胆汁排泄是一种复杂的过程,其涉及穿过窦状膜的移位、经由细胞质的运动、和穿过小管膜的转运。母体药物或其代谢物的肝胆排泄经常在药物的总体清除中起重要作用的理解已经迫使制药行业探索更好的体外工具来预测这种清除途径。出于此原因,化学实体用作药物的合适性的重要决定因素是其受胆汁排泄的程度及其对其它化学实体的胆汁排泄的影响两者。本领域已经教导了化学实体的胆汁清除的两种一般类型的体外测定法。第一种测定类型是利用两种平行的肝细胞培养物的双培养测定形式。(bi,yi-an等,“useofcryopreservedhumanhepatocytesinsandwichculturetomeasurehepatobiliarytransport,”drugmetabdispos.,vol.34,no.9,pp.1658-65(2006);ansede,johnh.等,“aninvitroassaytoassesstransporter-basedcholestatichepatotoxicityusingsandwich-culturedrathepatocytes,”drugmetabolismanddisposition,vol.38,pp.276-280(2010).)。在第一培养物中,将肝细胞暴露于正常的培养基并且形成并维持小管。在第二培养物中,将肝细胞暴露于设计用于破坏小管的培养基,如不含钙和镁的培养基。然后,将化学实体暴露于每种培养物,并允许与肝细胞相互作用达一定培养期。然后,清洗培养物,并评估每种培养物中与细胞相关的化学实体的量。在第一培养物中,与细胞相关的化学实体在胆汁排泄后可以定位于细胞细胞质中或存在于小管中。在第二培养物中,没有完整的小管,因此与细胞相关的任何化学实体必须存在于细胞质中。通过从存在于细胞质和小管(第一培养物)中的化学实体的量中扣除存在于细胞质(第二培养物)中的化学实体的量,可以测定在第一细胞培养物的胆汁中排泄的化学实体的量。双培养测定形式具有若干缺点。第一项缺点是简单的现实,即使用这种测定形式创建单一胆汁排泄数据点需要原代肝细胞的两种培养物。原代肝细胞难以获得,因此非常昂贵。因此,本领域需要使用较少的原代肝细胞来表征化学实体的胆汁排泄的方法。显然,一种培养方法将使测定法需要的原代肝细胞数目减少50%,因此是非常期望的。第二项缺点是必然在双培养测定法中通过测量两种不是胆汁积累的值,即总细胞积累(细胞质和胆汁)和细胞质积累,然后计算这些值之间的差来计算化学实体的胆汁积累。利用这种双培养方法做出的测量将比胆汁积累的单一直接测量具有更多的固有变异性。胆汁积累的直接测量在双培养测定形式中是不可能的。本领域还已经教导了化学实体的胆汁清除的单一培养物体外测定法。(美国专利号7,604,934)。然而,先前教导的测定法是间接的。具体地,它依赖于将单一培养物暴露于标志物化合物(如放射性标记的化合物),并且在存在和缺乏测试化学实体的情况下比较放射性标志物的胆汁积累。此类测定法假设在存在测试化学实体的情况下标记物的胆汁积累的下降指示测试化学实体通过与由标志物化合物使用的途径类似的途径排泄。此测定形式具有几项缺点,包括低精确性。出于所有上述原因和其它原因,本领域中需要评估化学实体(如候选治疗剂)的胆汁排泄的新的且有效的方法。本发明提供了满足这些和其它需要的新的且非显而易见的方法。发明概述本发明提供了表征化学实体的胆汁排泄的新的且改善的体外方法。在第一方面,方法包括:a)提供包含形成至少一个胆小管的肝细胞的细胞培养物;b)使所述细胞培养物与第一化学实体接触足以允许由所述培养物中的肝细胞摄取所述化学实体的时间;c)在不裂解所述肝细胞的情况下破坏所述至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);并且d)裂解所述肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量。在一些实施方案中,在步骤a)和b)之间、步骤b)和c)之间、和/或步骤c)和d)之间包括至少一个清洗步骤。所公开的方法的一个特征是化学实体的胆汁积累和化学实体的细胞质积累都使用单一肝细胞培养物(如组织培养板的单孔)测量。令人惊讶的是,如下文讨论并在实施例中证明,此测定形式是高精确且可重现的。在方法的一些实施方案中,细胞培养物是包含布置在固体基底的表面上的肝细胞和基质细胞的肝细胞-基质细胞共培养物。在方法的一些实施方案中,步骤c)中由至少一个胆小管释放的第一化学实体和/或其代谢物的量高于步骤d)中由肝细胞释放的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,步骤c)中由至少一个胆小管释放的第一化学实体和/或其代谢物的量低于步骤d)中由肝细胞释放的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)中第一化学实体和/或其代谢物的量。在方法的一些实施方案中,第一化学实体不包含标记物。在方法的一些实施方案中,通过在包含拉春库林a(latrunculina)(lata)和/或不包含钙的培养基中温育所述培养物而在不裂解所述培养物中的肝细胞的情况下破坏所述至少一个胆小管。在一些实施方案中,所述方法还包括在所述细胞培养物中对所述第一化学实体测定内在胆汁清除(cl胆汁)和/或胆汁排泄指数(bei)。在一些实施方案中,所述方法还包括在细胞培养物中对第一化学实体测定内在胆汁清除(cl胆汁)和/或胆汁排泄指数(bei);并且还包括将所述第一化学实体的cl胆汁和/或bei与对照化学实体的cl胆汁和/或bei进行比较,并且基于所述比较表征所述第一化学实体的胆汁排泄。在方法的一些实施方案中,在肝细胞中抑制至少一种肝细胞转运蛋白的活性。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触;并且所述方法还包括在步骤c)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触;并且所述方法还包括在步骤c)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量;并且所述方法还包括在步骤d)中检测由肝细胞释放的第二化学实体和/或其代谢物的量。在第二方面,所述方法包括a)提供包含形成至少一个胆小管的肝细胞的第一细胞培养物,其中在所述第一细胞培养物的所述肝细胞中抑制至少一种肝细胞转运蛋白的活性;b)使所述第一细胞培养物与第一化学实体接触;c)在不裂解所述第一细胞培养物中的所述肝细胞的情况下破坏所述第一细胞培养物中的至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);d)裂解所述第一细胞培养物中的肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量;e)提供包含形成至少一个胆小管的肝细胞的第二细胞培养物,其中在所述第二细胞培养物的所述肝细胞中不抑制所述至少一种肝细胞转运蛋白的活性;f)使所述第二细胞培养物与所述第一化学实体接触;g)在不裂解所述第二细胞培养物中的所述肝细胞的情况下破坏所述第二细胞培养物中的至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);并且h)裂解所述第二细胞培养物中的肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量。在一些实施方案中,在步骤a)和b)之间、步骤b)和c)之间和/或步骤c)和d)之间包括至少一个清洗步骤。在一些实施方案中,步骤e)和f)之间、步骤f)和g)之间和/或步骤g)和h)之间包括至少一个清洗步骤。在方法的一些实施方案中,第一和第二细胞培养物是肝细胞-基质细胞共培养物,其包含布置在固体基底的表面上的肝细胞和基质细胞。在一些实施方案中,所述方法还包括在第一细胞培养物中对第一化学实体测定cl胆汁和/或bei,并在第二细胞培养物中对第一化学实体测定cl胆汁和/或bei。在一些实施方案中,方法还包括在第一细胞培养物中对第一化学实体测定cl胆汁和/或bei,并在第二细胞培养物中对第一化学实体测定cl胆汁和/或bei;并且第一化学实体的cl胆汁和/或bei在第一细胞培养物中比在第二细胞培养物中低,指示第一化学实体的胆汁清除至少部分地由至少一种肝细胞转运蛋白介导。在一些实施方案中,方法还包括在第一细胞培养物中对第一化学实体测定cl胆汁和/或bei,并在第二细胞培养物中对第一化学实体测定cl胆汁和/或bei;并且第一化学实体的cl胆汁和/或bei在第一细胞培养物中不比在第二细胞培养物中低,指示第一化学实体的胆汁清除至少部分地不由至少一种肝细胞转运蛋白介导。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)和/或e)和/或h)中的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,步骤b)和/或f)中的第一化学实体和/或其代谢物不包含标记物。在方法的一些实施方案中,通过在包含拉春库林a(lata)和/或不包含钙的培养基中温育所述细胞培养物而在不裂解所述细胞培养物中的肝细胞的情况下在所述第一和第二细胞培养物中破坏所述至少一个胆小管。在一些实施方案中,方法还包括在步骤b)和/或f)中使第一和/或第二细胞培养物与第二化学实体接触。在一些实施方案中,方法还包括在步骤b)和/或f)中使第一和/或第二细胞培养物与第二化学实体接触;并且还包括在步骤c)和/或g)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量。在一些实施方案中,方法还包括在步骤b)和/或f)中使第一和/或第二细胞培养物与第二化学实体接触;并且还包括在步骤c)和/或g)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量;并且还包括在步骤d)和/或h)中检测由肝细胞释放的第二化学实体和/或其代谢物的量。在第三方面,方法包括a)提供包含形成至少一个胆小管的肝细胞的细胞培养物;b)同时使所述细胞培养物与标志物化学实体和测试化学实体接触,其中所述标志物化学实体是至少一种具有确定的cl胆汁和/或bei的肝细胞转运蛋白的已知底物;c)在不裂解所述肝细胞的情况下破坏所述至少一个胆小管,并检测由所述至少一个胆小管释放的所述标志物化学实体和/或其代谢物的量;和d)裂解所述肝细胞并检测由所述肝细胞释放的所述标志物化学实体和/或其代谢物的量。在一些实施方案中,在步骤a)和b)之间、在步骤b)和c)之间和/或步骤c)和d)之间包括至少一个清洗步骤。在方法的一些实施方案中,细胞培养物是包含布置在固体基底的表面上的肝细胞和基质细胞的肝细胞-基质细胞共培养物。在一些实施方案中,方法还包括在存在所述测试化学实体的情况下在所述肝细胞-基质细胞共培养中对所述标志物化学实体测定cl胆汁和/或bei。在一些实施方案中,方法还包括在存在所述测试化学实体的情况下在所述肝细胞-基质细胞共培养中对所述标志物化学实体测定cl胆汁和/或bei;并且所述标志物化学实体的cl胆汁和/或bei在存在所述测试化学实体的情况下比在缺乏所述测试化学实体的情况下低,指示所述测试化学实体的胆汁清除至少部分地由至少一种肝细胞转运蛋白介导。在一些实施方案中,方法还包括在存在所述测试化学实体的情况下在所述肝细胞-基质细胞共培养中对所述标志物化学实体测定cl胆汁和/或bei;并且所述标志物化学实体的cl胆汁和/或bei在存在所述测试化学实体的情况下不比在缺乏所述测试化学实体的情况下低,指示所述测试化学实体的胆汁清除至少部分地不由至少一种肝细胞转运蛋白介导。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)中的标志物化学实体和/或其代谢物的量。在方法的一些实施方案中,通过在包含拉春库林a(lata)和/或不包含钙的培养基中温育所述细胞培养物而在不裂解所述细胞培养物中的肝细胞的情况下在所述细胞培养物中破坏所述至少一个胆小管。在方法的一些实施方案中,在细胞培养物的肝细胞中抑制至少一种肝细胞转运蛋白的活性。附图简述图1显示了胆汁中牛磺胆酸盐的积累。图显示了从仅含有分泌到胆汁中的底物的收集4样品获得的牛磺胆酸盐的浓度。柱形表示通过用ca缓冲液或lata缓冲液破坏小管获得的样品。使用lc-ms/ms测定所有浓度。图2显示了细胞中牛磺胆酸盐的积累。图显示了从仅含有在细胞中积累的底物的收集5样品获得的牛磺胆酸盐的浓度。柱形表示在收集4中用ca-缓冲液或lata缓冲液破坏小管后获得的样品。使用lc-ms/ms测定所有浓度。图3显示用csa抑制后胆汁中牛磺胆酸盐的积累。图显示了从仅含有与转运蛋白抑制剂csa温育后胆汁中积累的底物的收集4样品获得的牛磺胆酸盐的浓度。条形代表在收集4中在用ca-缓冲液或lata缓冲液破坏小管或者与csa一起温育并用ca-缓冲液破坏后获得的样品。使用lc-ms/ms测定所有浓度。图4显示了由在肝细胞-基质细胞共培养物中培养的原代人肝细胞对牛磺胆酸盐的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于牛磺胆酸盐,使用测量值计算67%的bei。图5显示了由培养的人肝细胞对雌二醇-葡糖苷酸的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于雌二醇-葡糖苷酸,使用测量值计算40%的bei。图6显示了由培养的人肝细胞对地高辛的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于地高辛,使用测量值计算41%的bei。图7显示了由培养的人肝细胞对瑞舒伐他汀(rosuvastatin)的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于瑞舒伐他汀,使用测量值计算52%的bei。图8显示了由培养的人肝细胞对普伐他汀(pravastatin)的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于普伐他汀,使用测量值计算14%的bei。图9显示了由培养的大鼠肝细胞对牛磺胆酸盐的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于牛磺胆酸盐,使用测量值计算60%的bei。图10显示了由培养的大鼠肝细胞对瑞舒伐他汀的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于瑞舒伐他汀,使用测量值计算72%的bei。图11显示了由培养的大鼠肝细胞对雌二醇-葡糖苷酸的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于雌二醇-葡糖苷酸,使用测量值计算45%的bei。图12显示了由培养的大鼠肝细胞对地高辛的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于地高辛,使用测量值计算67%的bei。图13显示了由培养的大鼠肝细胞对普伐他汀的胆汁摄取。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为图左侧的条形的分开阴影部分,并与图右侧的条形中显示的测量胆汁积累进行比较。对于普伐他汀,使用测量值计算58%的bei。图14显示了环孢菌素a对bsep介导的牛磺胆酸盐转运的抑制。数据指示此系统中ic50值为0.46mm。图15显示了利托那韦(ritonavir)对bcrp介导的瑞舒伐他汀转运的抑制。数据指示此系统中ic50值为0.50mm。图16显示了依托红霉素对bsep介导的牛磺胆酸盐转运和bcrp介导的瑞舒伐他汀转运的抑制。本实验中bsep被完全抑制。图17比较了测量通过在肝细胞-基质细胞共培养物中培养的原代人肝细胞对牛磺胆酸盐的胆汁摄取的三次独立实验的结果。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为单个条形的分开阴影部分。误差棒表示单一标准差。实验的每个成对组合的分析指示结果的变化不是统计学显著的。图18比较了测量通过在肝细胞-基质细胞共培养物中培养的原代人肝细胞对普伐他汀的胆汁摄取的三次独立实验的结果。在共培养板的单孔中分别测量胆汁中的积累和细胞中的积累。胆汁积累和细胞积累的测量值显示为单个条形的分开阴影部分。误差棒表示单一标准差。实验的每个成对组合的分析指示结果的变化不是统计学显著的。发明详述本发明的体外方法利用已经形成至少一个胆小管的培养的肝细胞。方法的一个特征是在本发明的方法中从肝细胞的单一培养物获得两次不同的直接测量。首先,直接测量排泄到培养物的胆小管中的化学实体的量。然后,直接测量输入肝细胞细胞质中但未排泄到胆小管中的化学实体的量。直接测量和使用单一培养物进行这两次测量的特征将本发明的方法与现有技术方法区分开来,并且提供了根据本公开内容对熟练技术人员显而易见的若干优点。a.单一培养物胆汁排泄测定法在某些实施方案中,本发明的方法包括a)提供包含形成至少一个胆小管的肝细胞的细胞培养物;b)使所述细胞培养物与第一化学实体接触足以允许由所述培养物中的肝细胞摄取所述化学实体的时间;c)在不裂解所述肝细胞的情况下破坏所述至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);并且d)裂解所述肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量。在方法的一些实施方案中,步骤a)和b)之间、步骤b)和c)之间和/或步骤c)和d)之间包括至少一个清洗步骤。通常通过在培养基中稀释第一化学实体并用包含稀释的第一化学实体的培养基替换步骤a)中使用的培养基进行步骤b)。在足以允许摄取的时间后,从培养物中除去步骤b)的培养基。由于肝细胞通常粘附到基质,这通常使用标准组织培养抽吸和移液技术或等同方案实现以除去培养基,然后添加新培养基。当然,熟练技术人员应当理解,可以使用任何合适的方法。在方法的此阶段,可以通过不包含第一化学实体的培养基的一个或多个变化,如通过一次清洗、通过两次清洗、或通过三次清洗来清洗肝细胞培养物。在一些实施方案中,在步骤b)后,将包含形成至少一个胆小管的肝细胞的细胞培养物在新鲜培养基中温育一定培养期,然后收集培养基。可以对此培养基分析培养基中第一化学实体的积累。在这种培养条件下积累的第一化学实体将起源于肝细胞的基外侧转运过程,因此在方法的实施方案中包括此步骤允许测量包含形成至少一个胆小管的肝细胞的单细胞培养物中化学实体的基外侧转运、胆汁积累和细胞质积累。在步骤c)中,通过本领域中已知的任何合适技术破坏至少一个胆小管。一种示例性的方法是通过将培养基更换为不含钙或不含钙和镁的培养基。在不含钙或不含钙和镁的培养基中的温育破坏紧密连接,并使胆小管的内容物释放到培养基中。另一个示例性的方法是通过将培养基更换成包含有效浓度的lata的培养基。在包含有效浓度的lata的培养基中温育破坏紧密连接并使胆小管的内容物释放到培养基中。步骤c)中的检测通常通过在破坏小管后收集培养基并且表征收集的培养基中存在的第一化学实体进行。检测可以是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测第一化学实体。在一些实施方案中,使用lc-ms/ms在破坏至少一个胆小管后测量培养基中存在的第一化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、离心和蒸发中的至少一个的步骤处理包含从小管释放的材料的培养基以除去不期望的组分。在步骤d)中,通过本领域中已知的任何合适的技术裂解剩余的细胞。一种示例性的方法是通过暴露于去离子水。步骤d)中的检测通常通过在裂解剩余的细胞后收集培养基并且表征收集的培养基中存在的第一化学实体进行。检测可能是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测第一化学实体。在一些实施方案中,使用lc-ms/ms测量细胞裂解后存在于培养基中的第一化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、离心和蒸发中的至少一种的步骤处理包含从裂解的细胞释放的材料的培养基以除去不期望的组分。包含形成至少一个胆小管的肝细胞的细胞培养物可以是任何合适的肝细胞培养物。通常,包含形成至少一个胆小管的肝细胞的细胞培养物是不包含肝切片的培养构造。包含形成至少一个胆小管的肝细胞的示例性细胞培养物记载于本公开的此发明详述的d部分“包含形成胆小管的肝细胞的培养物”中。可以在本公开的方法中使用包含形成胆小管的肝细胞的任何培养物。在方法的一些实施方案中,细胞培养物是包含布置在固体基底的表面上肝细胞和基质细胞的肝细胞-基质细胞共培养物。在方法的一些实施方案中,步骤c)中由至少一个胆小管释放的第一化学实体和/或其代谢物的量高于在步骤d)中由肝细胞释放的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,步骤c)中由至少一个胆小管释放的第一化学实体和/或其代谢物的量低于在步骤d)中由肝细胞释放的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)中第一化学实体和/或其代谢物的量。在方法的一些实施方案中,使用等同的lc-ms/ms技术检测步骤c)和d)中第一化学实体和/或其代谢物的量。在方法的一些实施方案中,第一化学实体不包含标记物。如本文中使用,“标记物”是发射可以在测定法中检测的信号的部分。示例性标记物是荧光部分和放射性部分。在一些实施方案中,方法不包括检测来自化学实体的标记物部分的信号。在方法的一些实施方案中,通过在包含拉春库林a(lata)和/或不包含钙的培养基中温育培养物而在不裂解培养物中的肝细胞的情况下破坏至少一个胆小管。在一些实施方案中,方法还包括在细胞培养物中对第一化学实体测定内在胆汁清除(cl胆汁)和/或胆汁排泄指数(bei)。在一些实施方案中,方法还包括在细胞培养物中对第一化学实体测定内在胆汁清除(cl胆汁)和/或胆汁排泄指数(bei);并且还包括将第一化学实体的cl胆汁和/或bei与对照化学实体的cl胆汁和/或bei进行比较,并且基于比较来表征第一化学实体的胆汁排泄。在方法的一些实施方案中,在肝细胞中抑制至少一种肝细胞转运蛋白的活性。在一些实施方案中,至少一种肝细胞转运蛋白选自至少一种窦状膜转运蛋白和至少一种胆汁膜转运蛋白。在一些实施方案中,至少一种肝细胞转运蛋白选自ntcp、oatp1a1、oatp1a2、oatp1a4、oatpb2、oatp1b1、oatp1b3、oatp2b1、oat2、oat3、oat4、oct1、oct3、octn1、octn2、bsep、mrp1、mrp2、mrp3、mrp4、mrp5、mrp6、mrp7、mrp8、mrp9、mdr1、mdr1a/b、mdr2、mdr3、bcrp、abcg5、abcg8、和fic-1。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触;并且方法还包括在步骤c)中检测由至少一个胆小管释放的第二化学实体和/或其代谢物的量。在一些实施方案中,方法还包括在步骤b)中使细胞培养物与第二化学实体接触;并且方法还包括在步骤c)中检测由至少一个胆小管释放的第二化学实体和/或其代谢物的量;并且方法还包括在步骤d)中检测由肝细胞释放的第二化学实体和/或其代谢物的量。b.具有肝细胞转运蛋白抑制的单一培养物胆汁排泄测定法在某些实施方案中,本发明的方法包括比较(1)培养的肝细胞中第一化学实体的胆汁排泄,其中在肝细胞中抑制至少一种肝细胞转运蛋白的活性与(2)培养的肝细胞中的第一化学实体的胆汁排泄,其中在肝细胞中不抑制至少一种肝细胞转运蛋白的活性,以表征抑制至少一种肝细胞转运蛋白对第一化学实体的胆汁排泄的作用。例如,此类方法可包括:a)提供包含形成至少一个胆小管的肝细胞的第一细胞培养物,其中在所述第一细胞培养物的所述肝细胞中抑制至少一种肝细胞转运蛋白的活性;b)使所述第一细胞培养物与第一化学实体接触;c)在不裂解所述第一细胞培养物中的所述肝细胞的情况下破坏所述第一细胞培养物中的至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);d)裂解所述第一细胞培养物中的肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量;e)提供包含形成至少一个胆小管的肝细胞的第二细胞培养物,其中在所述第二细胞培养物的所述肝细胞中不抑制所述至少一种肝细胞转运蛋白的活性;f)使所述第二细胞培养物与所述第一化学实体接触;g)在不裂解所述第二细胞培养物中的所述肝细胞的情况下破坏所述第二细胞培养物中的至少一个胆小管,并且检测由所述至少一个胆小管释放的所述第一化学实体和/或其代谢物的量(如果有的话);并且h)裂解所述第二细胞培养物中的肝细胞,并检测由所述肝细胞释放的所述第一化学实体和/或其代谢物的量。在一些实施方案中,在步骤a)和b)之间、步骤b)和c)之间和/或步骤c)和d)之间包括至少一个清洗步骤。在一些实施方案中,步骤e)和f)之间、步骤f)和g)之间、和/或步骤g)和h)之间包括至少一个清洗步骤。通常通过在培养基中稀释第一化学实体并用包含稀释的第一化学实体的培养基替换步骤a)或e)中使用的培养基进行步骤b)和f)。在足以允许摄取的时间后,从培养物中除去步骤b)或f)的培养基。由于肝细胞通常粘附到基底,这通常使用标准的组织培养抽吸和移液技术或等同方案实现以除去培养基,然后添加新的培养基。当然,熟练技术人员应当理解,可以使用任何合适的方法。在方法的此阶段,可通过不包含第一化学实体的培养基的一种或多种变化,如通过一次清洗、通过两次清洗、或通过三次清洗来清洗肝细胞培养物。在一些实施方案中,在步骤b)和/或f)后,在新鲜培养基中将包含形成至少一个胆小管的肝细胞的细胞培养物温育一定培养期,然后收集培养基。可以对此培养基分析培养基中第一化学实体的积累。在此培养条件下积累的第一化学实体将起源于肝细胞的基外侧转运过程,因此在方法的实施方案中包括此步骤允许测量包含形成至少一个胆小管的肝细胞的单细胞培养物中化学实体的基外侧转运、胆汁积累和细胞质积累。在步骤c)和f)中,通过本领域中已知的任何合适技术破坏至少一个胆小管。一种示例性的方法是通过将培养基更换为不含钙或不含钙和镁的培养基。在不含钙或不含钙和镁的培养基中的温育破坏紧密连接,并使胆小管的内容物释放到培养基中。另一个示例性的方法是通过将培养基更换成包含有效浓度的lata的培养基。在包含有效浓度的lata的培养基中温育破坏紧密连接并使胆小管的内容物释放到培养基中。步骤c)和f)中的检测通常通过在破坏小管后收集培养基并且表征收集的培养基中存在的第一化学实体进行。检测可以是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测第一化学实体。在一些实施方案中,使用lc-ms/ms在破坏至少一个胆小管后测量培养基中存在的第一化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、和离心中的至少一个的步骤处理包含从小管释放的材料的培养基以除去不期望的组分。在步骤d)和h)中,通过本领域中已知的任何合适的技术裂解剩余的细胞。一种示例性的方法是通过暴露于去离子水。在步骤d)和h)中的检测通常通过在裂解剩余的细胞后收集培养基并且表征收集的培养基中存在的第一化学实体进行。检测可能是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测第一化学实体。在一些实施方案中,使用lc-ms/ms测量细胞裂解后存在于培养基中的第一化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、和离心中的至少一个的步骤处理包含从裂解的细胞释放的材料的培养基以除去不期望的组分。包含形成至少一个胆小管的肝细胞的细胞培养物可为任何合适的肝细胞培养物。通常,包含形成至少一个胆小管的肝细胞的细胞培养物是构造上不包含肝切片的培养物。包含形成至少一个胆小管的肝细胞的示例性细胞培养物记载于本公开的此发明详述的d部分“包含形成胆小管的肝细胞的培养物”中。可以在本公开的方法中使用包含形成胆小管的肝细胞的任何培养物。在方法的一些实施方案中,第一和第二细胞培养物是包含布置在固体基底的表面上肝细胞和基质细胞的肝细胞-基质细胞共培养物。在一些实施方案中,方法还包括在所述第一细胞培养物中对所述第一化学实体测定cl胆汁和/或bei,并在所述第二细胞培养物中对所述第一化学实体测定cl胆汁和/或bei。在一些实施方案中,方法还包括在所述第一细胞培养物中对所述第一化学实体测定cl胆汁和/或bei,并在所述第二细胞培养物中对所述第一化学实体测定cl胆汁和/或bei;并且所述第一化学实体的cl胆汁和/或bei在所述第一细胞培养物中比在所述第二细胞培养物中低,指示所述第一化学实体的胆汁清除至少部分由所述至少一种肝细胞转运蛋白介导。在一些实施方案中,方法还包括在所述第一细胞培养物中对所述第一化学实体测定cl胆汁和/或bei,并在所述第二细胞培养物中对所述第一化学实体测定cl胆汁和/或bei;并且所述第一化学实体的cl胆汁和/或bei在所述第一细胞培养物中不比在所述第二细胞培养物中低,指示所述第一化学实体的胆汁清除至少部分不由所述至少一种肝细胞转运蛋白介导。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)和/或e)和/或h)中的第一化学实体和/或其代谢物的量。在方法的一些实施方案中,使用等同的lc-ms/ms技术检测步骤c)和d)和g)和h)中第一化学实体和/或其代谢物的量。在方法的一些实施方案中,步骤b)和/或f)中的第一化学实体和/或其代谢物不包含标记物。如本文中使用,“标记物”是发射可以在测定法中检测的信号的部分。示例性标记物是荧光部分和放射性部分。在一些实施方案中,所述方法不包括检测来自化学实体的标记物部分的信号。在方法的一些实施方案中,通过在包含拉春库林a(lata)和/或不包含钙的培养基中温育所述细胞培养物而在不裂解所述细胞培养物中的肝细胞的情况下在所述第一和第二细胞培养物中破坏所述至少一个胆小管。在一些实施方案中,方法还包括在步骤b)和/或f)中使所述第一和/或第二细胞培养物与第二化学实体接触。在一些实施方案中,方法还包括在步骤b)和/或f)中使第一和/或第二细胞培养物与第二化学实体接触;并且还包括在步骤c)和/或g)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量。在一些实施方案中,方法还包括在步骤b)和/或f)中使第一和/或第二细胞培养物与第二化学实体接触;并且还包括在步骤c)和/或g)中检测由所述至少一个胆小管释放的第二化学实体和/或其代谢物的量;并且还包括在步骤d)和/或h)中检测由肝细胞释放的第二化学实体和/或其代谢物的量。在方法的一些实施方案中,至少一种肝细胞转运蛋白选自至少一种窦状膜转运蛋白和至少一种胆汁膜转运蛋白。在一些实施方案中,至少一种肝细胞转运蛋白选自ntcp、oatp1a1、oatp1a2、oatp1a4、oatpb2、oatp1b1、oatp1b3、oatp2b1、oat2、oat3、oat4、oct1、oct3、octn1、octn2、bsep、mrp1、mrp2、mrp3、mrp4、mrp5、mrp6、mrp7、mrp8、mrp9、mdr1、mdr1a/b、mdr2、mdr3、bcrp、abcg5、abcg8、和fic-1。c.用标志物化学实体的单一培养物胆汁排泄测定法在某些实施方案中,本公开的方法包括将包含形成至少一个胆小管的肝细胞的细胞培养物同时暴露于标志物化学实体和测试化学实体,并且在存在测试化学实体的情况下表征标志物化学实体的胆汁排泄以表征测试化学实体的胆汁排泄。特别地,这些方法允许检测通过标志物化学实体和测试化学实体的共同转运蛋白的使用。例如,此类方法可以包括:a)提供包含形成至少一个胆小管的肝细胞的细胞培养物;b)同时使所述细胞培养物与标志物化学实体和测试化学实体接触,其中所述标志物化学实体是至少一种具有确定的cl胆汁和/或bei的肝细胞转运蛋白的已知底物;c)在不裂解所述肝细胞的情况下破坏所述至少一个胆小管,并检测由所述至少一个胆小管释放的所述标志物化学实体和/或其代谢物的量;并且d)裂解所述肝细胞并检测由所述肝细胞释放的标志物化学实体和/或其代谢物的量。在一些实施方案中,在步骤a)和b)之间,步骤b)和c)之间和/或步骤c)和d)之间包括至少一个清洗步骤。通常通过在培养基中稀释标志物化学实体和测试化学实体并用包含稀释的标志物化学实体和测试化学实体的培养基替换步骤a)中使用的培养基进行步骤b)。在足以允许摄取的时间后,从培养物中除去步骤b)的培养基。由于肝细胞通常粘附到基质,这通常使用标准组织培养抽吸和移液技术或等同方案实现以除去培养基,然后添加新培养基。当然,熟练技术人员应当理解,可以使用任何合适的方法。在方法的此阶段,可以通过不包含标志物化学实体和测试化学实体的培养基的一个或多个变化,如通过一次清洗、通过两次清洗、或通过三次清洗来清洗肝细胞培养物。在方法的一些实施方案中,步骤b)前面有通过测试化学实体而不是标志物化学实体接触培养物以允许给转运蛋白预加载测试化学实体的步骤。在步骤c)中,通过本领域中已知的任何合适技术破坏至少一个胆小管。一种示例性的方法是通过将培养基更换为不含钙或不含钙和镁的培养基。在不含钙或不含钙和镁的培养基中的温育破坏紧密连接,并使胆小管的内容物释放到培养基中。另一个示例性的方法是通过将培养基更换成包含有效浓度的lata的培养基。在包含有效浓度的lata的培养基中温育破坏紧密连接并使胆小管的内容物释放到培养基中。步骤c)中的检测通常通过在破坏小管后收集培养基并且表征收集的培养基中存在的标志物化学实体进行。检测可以是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测第一化学实体。在一些实施方案中,使用lc-ms/ms在破坏至少一个胆小管后测量培养基中存在的标志物化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、和离心中的至少一个的步骤处理包含从小管释放的材料的培养基以除去不期望的组分。在步骤d)中,通过本领域中已知的任何合适的技术裂解剩余的细胞。一种示例性的方法是通过暴露于去离子水。步骤d)中的检测通常通过在裂解剩余的细胞后收集培养基并且表征收集的培养基中存在的标志物化学实体进行。检测可能是定性和/或定量的。在优选的实施方案中,检测方法包括使用lc-ms/ms来检测标志物化学实体。在一些实施方案中,使用lc-ms/ms测量细胞裂解后存在于培养基中的标志物化学实体的量。在一些实施方案中,使用可以包括例如过滤、层析、和离心中的至少一个的步骤处理包含从裂解的细胞释放的材料的培养基以除去不期望的组分。包含形成至少一个胆小管的肝细胞的细胞培养物可以是任何合适的肝细胞培养物。通常,包含形成至少一个胆小管的肝细胞的细胞培养物是不包含肝切片的培养构造。包含形成至少一个胆小管的肝细胞的示例性细胞培养物记载于本公开的此发明详述的d部分“包含形成胆小管的肝细胞的培养物”中。可以在本公开的方法中使用包含形成胆小管的肝细胞的任何培养物。在方法的一些实施方案中,细胞培养物是包含布置在固体基底的表面上肝细胞和基质细胞的肝细胞-基质细胞共培养物。在一些实施方案中,所述方法还包括在存在测试化学实体的情况下在肝细胞-基质细胞共培养中测定标志物化学实体的cl胆汁和/或bei。在一些实施方案中,方法还包括在存在测试化学实体的情况下在肝细胞-基质细胞共培养中测定标志物化学实体的cl胆汁和/或bei;并且标志物化学实体的cl胆汁和/或bei在存在测试化学实体的情况下比在缺乏测试化学实体的情况下低,指示测试化学实体的胆汁清除至少部分地由至少一种肝细胞转运蛋白介导。在一些实施方案中,方法还包括在存在测试化学实体的情况下在肝细胞-基质细胞共培养中对标志物化学实体测定cl胆汁和/或bei;并且标志物化学实体的cl胆汁和/或bei在存在测试化学实体的情况下不比在缺乏测试化学实体的情况下低,指示测试化学实体的胆汁清除至少部分地不由至少一种肝细胞转运蛋白介导。在方法的一些实施方案中,使用lc-ms/ms检测步骤c)和/或d)中的标志物化学实体和/或其代谢物的量。在方法的一些实施方案中,使用等同的lc-ms/ms技术检测步骤c)和d)中的标志物化学实体和/或其代谢物的量。在方法的一些实施方案中,标志物化学实体不包含标记物。如本文中使用,“标记物”是发射可以在测定法中检测的信号的部分。示例性标记物是荧光部分和放射性部分。在一些实施方案中,方法不包括检测来自化学实体的标记物部分的信号。在方法的一些实施方案中,通过在包含拉春库林a(lata)和/或不包含钙的培养基中温育培养物而在不裂解细胞培养物中的肝细胞的情况下在细胞培养物中破坏至少一个胆小管。在方法的一些实施方案中,在肝细胞中抑制至少一种肝细胞转运蛋白的活性。在一些实施方案中,至少一种肝细胞转运蛋白选自至少一种窦状膜转运蛋白和至少一种胆汁膜转运蛋白。在一些实施方案中,至少一种肝细胞转运蛋白选自ntcp、oatp1a1、oatp1a2、oatp1a4、oatpb2、oatp1b1、oatp1b3、oatp2b1、oat2、oat3、oat4、oct1、oct3、octn1、octn2、bsep、mrp1、mrp2、mrp3、mrp4、mrp5、mrp6、mrp7、mrp8、mrp9、mdr1、mdr1a/b、mdr2、mdr3、bcrp、abcg5、abcg8、和fic-1。d.包含形成胆小管的肝细胞的培养物胆小管是收集由肝细胞分泌的胆汁的细管。胆小管合并,并形成胆小管(bileductules),其最终变为常见的肝管。肝细胞呈多面体形状,具有面对血窦的表面(称为窦状面)和与其它肝细胞接触的表面(称为侧面)。胆小管由相邻肝细胞的一些侧面上的沟形成。在适当的条件下,培养的肝细胞具有形成小管的能力。本公开的方法利用体外细胞培养物,其包含形成至少一个胆小管的肝细胞。肝细胞可为任何类型的肝细胞,包括但不限于原代肝细胞、肝细胞细胞系和通过将干细胞(如胚胎干细胞、成体干细胞或诱导的多能干细胞)分化成肝细胞而形成的肝细胞。肝细胞可来自任何哺乳动物。在一些实施方案中,肝细胞来自哺乳动物,其选自人、非人灵长类(如食蟹猴)、农场动物(如猪、马、牛和羊)、家养哺乳动物(如狗、猫、豚鼠和兔)、和啮齿类(如小鼠和大鼠)。在一些实施方案中,肝细胞-基质细胞共培养物包含来自多种哺乳动物物种的肝细胞。在优选实施方案中,肝细胞是原代肝细胞。原代肝细胞可能不需要以冷冻保存的形式提供。冷冻保存的人肝细胞可以从lifetechnologiescorporation获得。冷冻保存的非人灵长类肝细胞可以从lifetechnologiescorporation获得。冷冻保存的狗肝细胞可以从ivtbioreclemation获得。冷冻保存的大鼠肝细胞可以从lifetechnologiescorporation获得。在一些实施方案中,培养物包含以三维生物打印的构造存在的肝细胞。在一些实施方案中,培养物包含以球体构造存在的肝细胞。在一些实施方案中,培养物包含以凝胶夹心构造存在的肝细胞。在一些实施方案中,培养物包括毛细管床。在一些实施方案中,通过不包括创建肝切片的方法制备培养物。在一些实施方案中,培养物不包含肝切片。在一些实施方案中,培养物是包含布置在固体基底的表面上的肝细胞和至少一种基质细胞类型的肝细胞-基质细胞共培养物。在肝细胞-基质细胞共培养的一些实施方案中,肝细胞和单基质细胞类型占共培养物中的细胞的至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.9%、或至少约99.99%。通常,肝细胞和基质细胞以1:10至10:1的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以2:10至10:2的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以2:10至4:10的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以4:10至6:10的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以6:10至8:10的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以8:10至1:1的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以1:1至10:8的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以10:8至10:6的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以10:6至10:4的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以10:4至10:2的比率存在于共培养物中。在一些实施方案中,肝细胞和基质细胞以约10:1、10:2、10:3、10:4、10:5、:10:6、10:7、10:8、10:9、1:1、9:10、8:10、7:10、6:10、5:10、4:10、3:10、2:10、或1:10的比率存在于共培养物中。在一些实施方案中,肝细胞-基质细胞共培养物包含至少两种基质细胞类型。在一些实施方案中,肝细胞-基质细胞共培养物包含两种基质细胞类型,其各自占共培养物中的细胞的至少约0.01%、至少约0.1%、至少约0.5%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、或至少约10%。在一些实施方案中,基质细胞类型来自与肝细胞相同类型的哺乳动物。在一些实施方案中,基质细胞类型与肝细胞来自不同类型的哺乳动物。在一些实施方案中,肝细胞-基质细胞共培养物包含第三细胞类型。在一些实施方案中,第三细胞类型是基质细胞。在一些实施方案中,第三细胞类型不是基质细胞。在一些实施方案中,第三细胞类型是实质细胞。在一些实施方案中,第三细胞类型不是非实质细胞。在一些实施方案中,第三细胞类型选自ito细胞、内皮细胞、胆管细胞、免疫介导的细胞、和干细胞。在一些实施方案中,免疫介导细胞选自巨噬细胞、t细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜曙红细胞和嗜碱性粒细胞。在一些实施方案中,第三细胞类型是肝巨噬(kupffer)细胞。在一些实施方案中,肝巨噬细胞占共培养物中的细胞的至少约0.01%、至少约0.1%、至少约0.5%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、或至少约10%。在一些实施方案中,基质细胞类型是内皮细胞。在一些实施方案中,基质细胞类型是成纤维细胞。在一些实施方案中,基质细胞是原代细胞。在一些实施方案中,基质细胞是从细胞系获得的。在一些实施方案中,基质细胞是经转化的细胞。在一些实施方案中,基质细胞是在体外从干细胞(如胚胎干细胞、成体干细胞或诱导多能干细胞)分化的。基质细胞如成纤维细胞的许多来源是本领域中已知的,并且可以在肝细胞-基质细胞共培养物中利用。一个例子是nih3t3-j2细胞系。(参见例如us2013/0266939a1。)技术教导了通过如下改善培养物中肝细胞功能的某些方面,即,将肝细胞和基质细胞布置到固体基底上,使得肝细胞以细胞岛构造在第一步中附着到基底。(参见us2013/0266939a1)。具体地,此类方法依赖于在基底上形成肝细胞的细胞岛、由非实质细胞类型如基质细胞类型围绕的肝细胞岛。通过如下形成肝细胞岛,即,首先将细胞外基质组分或衍生物以岛样式置于固体基底上,然后使肝细胞粘附于细胞外基质组分或衍生物。然后,添加非实质细胞类型,并允许“填充”不含肝细胞的基底部分。此类系统的基本特征是不在基底表面间分散肝细胞。在一些实施方案中,本发明利用包含以细胞岛构造分布的肝细胞的肝细胞-基质细胞共培养物,如us2013/0266939a1中所述。然而,在优选的实施方案中,肝细胞基本上在固体基底的表面间分散。如本文中使用,“在表面间分散”就在肝细胞-基质细胞共培养中在固体支持物上的肝细胞排列而言,指适用于共培养物的至少一种以下标准:1)固体基底表面的至少约20%、至少约30%、至少约40%、或至少约50%覆盖有至少一种肝细胞;2)共培养物中的肝细胞的至少约2%、至少约5%或至少约10%位于与固体基底接触的基质细胞的顶部;和3)不将肝细胞接种到固体基底上,其通过将肝细胞添加到包含至少一种细胞外基质组分的岛的固体基底,以创建附着到固体基底的肝细胞岛。注意,单一肝细胞可以计为满足标准1和标准2。为了用于本发明的方法,共培养物包括至少一个胆小管。在一些实施方案中,共培养物仅包含单一胆小管,而在其它实施方案中,共培养物包含多个小管。在优选的实施方案中,肝细胞-基质细胞共培养物的代谢功能在整个培养期间是持久的。在一些实施方案中,培养期为至少1天、至少2天、至少3天、至少5天、至少7天、至少10天、至少14天、至少21天、或至少28天。在一些实施方案中,通过测量共培养物中肝细胞的选自基因表达、细胞功能、代谢活性、形态及其组合的活性来确定肝细胞-基质细胞共培养物的代谢功能。在一些实施方案中,通过测量至少一种cyp450酶的表达和/或活性水平确定肝细胞-基质细胞共培养物的代谢功能。可以通过测量cyp450酶mrna的表达,通过测量cyp450酶蛋白的表达,或通过cyp450酶活性的功能测定法测量至少一种cyp450酶的表达和/或活性水平。在一些实施方案中,代谢活性是cyp450酶活性。在一些实施方案中,cyp450酶是选自cyp1a2、cyp1b1、cyp2a6、cyp2b6、cyp2c、cyp2d6、cyp2e1、cyp2f1、cyp2j2、cyp3a4、cyp4a、和cyp4b的cyp450酶。如果共培养物的代谢功能在肝细胞-基质细胞共培养物中比对照肝细胞单一培养物的代谢功能持续更长,则认为肝细胞-基质细胞共培养物的代谢功能是长期持久的。在一些实施方案中,共培养物的代谢功能持续至少7天。在一些实施方案中,共培养物的代谢功能持续至少14天。在一些实施方案中,共培养物的代谢功能持续至少21天。在一些实施方案中,共培养物的代谢功能持续至少28天。在一些实施方案中,在无血清或基本上无血清的培养基中培养共培养物。在一些实施方案中,在含有血清的培养基中培养共培养物。在一些实施方案中,培养基包含约0.1%血清、约0.2%血清、约0.3%血清、约0.4%血清、约0.5%血清、约0.6%血清、约0.7%血清、约0.8%血清、约0.9%血清、约1%血清、约2%血清、约3%血清、约4%血清、约5%血清、约6%血清、约7%血清、约8%血清、约9%血清、或约10%血清。在一些实施方案中,培养基包含至少约0.1%血清、至少约0.2%血清、至少约0.3%血清、至少约0.4%血清、至少约0.5%血清、至少约0.6%血清、至少约0.7%血清、至少约0.8%血清、至少约0.9%血清、至少约1%血清、至少约2%血清、至少约3%血清、至少约4%血清、至少约5%血清、至少约6%血清、至少约7%血清、至少约8%血清、至少约9%血清、或至少约10%血清。在一些实施方案中,培养基包含小于或等于约0.1%血清、小于或等于约0.2%血清、小于或等于约0.3%血清、小于或等于约0.4%血清、小于或等于约0.5%血清、小于或等于约0.6%血清、小于或等于约0.7%血清、小于或等于约0.8%血清、小于或等于约0.9%血清、小于或等于约1%血清、小于或等于约2%血清、小于或等于约3%血清、小于或等于约4%血清、小于或等于约5%血清、小于或等于约6%血清、小于或等于约7%血清、小于或等于约8%血清、小于或等于约9%血清、或小于或等于约10%血清。e.转运蛋白在本发明方法的一些实施方案中,抑制至少一种选自窦状膜转运蛋白和小管状转运蛋白的肝细胞转运蛋白。许多转运蛋白是本领域中已知的,并且熟练技术人员将理解,任何已知或随后发现的转运蛋白可以与本发明的方法一起使用。示例性的转运蛋白包括但不限于钠/胆汁酸共转运蛋白,也称为na+-牛磺胆酸盐共转运多肽(ntcp)或肝胆汁酸转运蛋白(lbat),在人类中由slc10a1(溶质载体家族10成员1)基因编码的蛋白质;有机阴离子转运多肽,例如选自oatp1a1、oatp1a2、oatp1a4、oatpb2、oatp1b1、oatp1b3、和oatp2b1的一种;有机阴离子转运蛋白,例如选自oat2、oat3、oat4的有机阴离子转运蛋白;有机阳离子转运蛋白,例如选自oct1、oct3、octn1和octn2的一种;胆汁盐输出泵(bsep)蛋白质,也称为atp结合盒,在人类中由abcb11基因编码的亚家族b成员11(abcb11);多药物抗性相关蛋白,例如选自mrp1、mrp2、mrp3、mrp4、mrp5、mrp6、mrp7、mrp8、和mrp9的一种;p-糖蛋白,如选自mdr1、mdr1a/b、mdr2、和mdr3的一种;atp结合盒亚家族g成员2(abcg2)(也称为bcrp),人类中由abcg2基因编码的蛋白质;选自abcg5和abcg8的abc蛋白;和可能的磷脂转运atp酶ic(atp8b1),也称为fic-1,其是在人类中由atp8b1基因编码的酶。这些转运蛋白的许多抑制剂是本领域中已知的,并且可用于本发明的方法中。pgp蛋白的示例性抑制剂包括但不限于利托那韦(ritonavir)、环孢菌素(cyclosporine)、维拉帕米(verapamil)、红霉素(erythromycin)、ketocoanzole、伊曲康唑(itraconazole)和奎尼丁(quinidine)。bcrp的示例性抑制剂包括但不限于依克立达(elacridar),伊马替尼(imatinib)和烟曲霉毒素c(fumitremorginc)。mate1的示例性抑制剂包括但不限于西咪替丁(cimetidine)。bsep的示例性抑制剂包括但不限于阿托伐他汀(atorvastatin)、西立伐他汀(cerivastatin)、氯法齐明(clofazimine)和格列本脲(glyburide)。mrp2的示例性抑制剂包括但不限于环孢菌素、丙磺舒(probenecid)、呋塞米(furosemide)和拉米夫定(lamivudine)。实施例实施例1:肝细胞-间质细胞共培养物从液氮中取出冷冻保存的人肝细胞并融化。融化后,将细胞重悬于培养基,并使用锥虫蓝排除测定细胞数目和细胞存活力。将基质细胞在co2培养箱中传代,直到用于实验铺板。在铺板日,将细胞与板分离,清洗,并重悬于培养基中。使用锥虫蓝排除测定细胞数目和存活力。将肝细胞和基质细胞以每孔30,000个肝细胞的密度接种到胶原包被的96孔板中。在接种前对基质细胞进行生长停滞。在开始任何胆汁排泄测定法前,将培养物维持7天。在开始实验前,在第7天用cdfda染色细胞以确保小管形成。实施例2:将测试化合物排泄到肝细胞-基质细胞共培养物中的胆小管中在此实验中,评估了根据实施例1制备的肝细胞-基质细胞培养物中胆小管的存在。将共培养物与5μm5-(和-6)-羧基-2’,7’-二氯-二乙酸荧光素(cdfda)一起温育20分钟。由肝细胞摄取的cdfda被肝细胞水解成荧光5-(和-6)-羧基-2’,7’-二氯-荧光素(cda),然后通过mrp2转运蛋白以这种荧光形式分泌到小管中。共培养物包括几个在显微镜下容易明显的小管(数据未显示)。环孢菌素a(csa)是mrp2转运蛋白的已知抑制剂。在随后的实验中,在存在50μmcsa的情况下将共培养物与cdfda一起温育20分钟。在存在csa的情况下与cdfda一起温育后,无荧光小管可见(数据未显示)。此结果证明了,胆小管在根据实施例1制备的共培养物中是存在的,并且证明可以在此系统中评估化学实体进入小管的转运蛋白依赖性排泄。实施例3:小管的破坏评估化学实体对肝细胞-基质细胞共培养物中的胆汁中的排泄需要区分存在于共培养物的小管中的化学实体和可以存在于共培养物中的细胞的细胞质中的化学实体的方法。测试了小管破坏的两种方法。在第一种方法中,将培养物暴露于无钙(ca-)的缓冲液。钙的缺乏抑制细胞形成紧密连接的能力,这允许存在于小管中的胆汁逸出。首先,在具有ca+的hbss缓冲液中将细胞清洗两次。然后,将细胞与在没有ca-的hbss缓冲液中的5μmcdfda一起温育20分钟。然后,将细胞在没有ca-的hbss缓冲液中清洗两次。由于积累的cdf在暴露于ca-缓冲液后逸出小管,无cdf染色是明显的(数据未显示)。在第二种方法中,将培养物暴露于含有拉春库林a(lata)的缓冲液。lata发挥功能以破坏微丝组织(紧密连接形成的关键步骤),这允许小管中存在的胆汁逃逸。首先,在具有ca+的hbss缓冲液中将细胞清洗两次。然后,将细胞与在具有ca+和10umlata的hbss缓冲液中的5μmcdfda一起温育20分钟。然后,将细胞在具有ca+的hbss缓冲液中清洗两次。由于积累的cdf在暴露于含有lata的缓冲液后逸出小管,无cda染色是明显的(数据未显示)。实施例4:胆汁排泄测定法实施例2和3中报告的数据定性证明了肝细胞-基质细胞共培养系统形成功能性小管的能力、破坏小管的能力、以及抑制mrp2和bsep转运蛋白系统的功能的能力。本实施例证明了系统定量测量牛磺胆酸盐的肝胆汁排泄的能力。为了评估一个共培养区室中的肝胆转运,将2um牛磺胆酸盐引入细胞培养基,并允许温育20分钟。然后,取出培养基(收集#1)并且贮存以分析剩余的牛磺胆酸盐。将培养物用缓冲溶液清洗两次(收集#2和#3),并且贮存每种清洗溶液以分析剩余的牛磺胆酸盐。然后,将细胞暴露于ca-缓冲液或lata缓冲液30分钟(收集#4),其发挥功能以破坏培养物中存在的小管,但不裂解共培养物中的细胞。这释放小管的胆汁中积累的牛磺胆酸盐。然后,将细胞暴露于去离子水(收集#5),其发挥功能以破坏细胞膜并释放细胞区室中积累的化合物。由于已经在收集#4中收集存在于小管中的任何牛磺胆酸盐,收集#5含有细胞中存在的任何牛磺胆酸盐,但不包括小管中存在的任何。使用lc-ms/ms测定收集#4(图1)和收集5(图2)中的牛磺胆酸盐的浓度。一式三份运行实验。图1中对lata显示的基础数据为117.6nm、115.4nm和158.6nm。图1中对ca-显示的基础数据为204nm、150.2nm和158nm。图2(收集#5)对lata显示的基础数据为199nm、144.4nm和234nm。图2(收集#5)对ca-数目显示的基础数据141nm、95.4nm和120.8nm。将样品以1000xg离心10分钟,并通过lc-ms/ms分析上清液的等分试样(10ml)。lc-ms/ms系统包含shimadzulc-10advp泵(shimadzu,columbia,md)、htspalctc自动进样器(leaptechnologies,carboro,nc)、和具有turboionspray探针的api4000质谱仪(appliedbiosystems/mdssciex,ontario,canada)。使用反相固定相(synergihydro,phenomenex)实现化合物的分离。流动相为具有水中的0.1%甲酸及0.15gm乙酸铵(a)和乙腈中的0.1%甲酸及0.15g乙酸铵(b)的梯度,流速为0.5ml/min。流动相的初始组成为2%b持续0.3分钟,接着在1.3分钟内以线性梯度至100%b,并且在0.2分钟中回到2%b,并且再将2%b维持0.2分钟。在负离子模式下使用多反应监测(mrm)检测牛磺胆酸。使用analyst1软件v.1.4.1(appliedbiosystems)计算分析物与内部标准品的面积比。随后,使用胆汁中和细胞中的牛磺胆酸盐的浓度以对此系统中的牛磺胆酸盐计算内在胆汁清除(cl胆汁)[方程1]和胆汁排泄指数(bei)[方程2]。使用ca-缓冲液破坏小管的方法的bei为66.9%,并且使用lata缓冲液破坏小管的方法的bei为40.4%。其他人报告了范围为41-63%的牛磺胆酸盐的bei的相似范围。bi,yi-an等,“useofcryopreservedhumanhepatocytesinsandwichculturetomeasurehepatobiliarytransport,”drugmetabdispos.,vol.34,no.9,pp.1658-65(2006)。方程式cl胆汁=胆汁中的积累/[(温育时间)x(培养基中的浓度)](1)bei=胆汁中的积累/(细胞中的积累+胆汁中的积累)(2)然后,使用此方法评估csa对牛磺胆酸盐的胆汁清除的影响。遵循相同的方案,只是在将牛磺胆酸盐添加到细胞培养基中前将共培养物暴露于抑制剂csa。在添加2um牛磺胆酸盐之前,将细胞暴露于具有50um环孢菌素a的hbss缓冲液20分钟。然后,如在实施例3中一样继续实验。在此实验中,使用ca-缓冲液破坏小管。如由图3中所示的数据证明,与csa的温育显著降低了积累在胆汁中的牛磺胆酸盐的浓度。实施例5:人肝细胞共培养中的摄取和胆汁排泄使用根据实施例1的肝细胞-基质细胞共培养物测量5种化合物的摄取率:2um的牛磺胆酸(牛磺胆酸盐)、2um的雌二醇-葡糖苷酸、2um的地高辛、2um的瑞舒伐他汀和5um的普伐他汀。使用本发明的评估胆汁清除的单孔法。将共培养物暴露于指定浓度的培养基中的每种测试化合物达20分钟。然后,取出培养基(收集#1)并贮存以分析剩余的化合物。将培养物用缓冲溶液清洗两次(收集#2和#3),并贮存每种清洗溶液以分析剩余的牛磺胆酸盐。然后,将细胞暴露于含有5μm浓度的拉春库林的hepes缓冲液30分钟,其发挥功能以破坏培养物中存在的小管,但是不裂解共培养物中的细胞。这释放小管胆汁中积累的牛磺胆酸盐。在温育期结束时,收集培养基(收集#4)。然后,将细胞暴露于去离子水,其发挥功能以破坏细胞膜并释放细胞区室中积累的化合物(收集#5)。由于已经在收集#4中收集存在于小管中的任何化合物,收集#5含有细胞中存在的任何化合物,但不包括在小管中存在的任何。与实施例4中一样使用lc-ms/ms测定收集#4和收集5中化合物的浓度。图4-8中呈现了此分析的结果。在教导图中,以图左侧的单一柱形的两个部分一起呈现了胆汁中化合物的测量量和细胞质中化合物的测量量。胆汁的测量值也显示为图的右侧的条形。将右柱形(胆汁)的高度与复合左柱形(细胞质+胆汁的总量)的高度进行比较允许显现在胆汁中积累的化合物的部分。图4中显示了牛磺胆酸(牛磺胆酸盐)的结果,图5中显示了雌二醇-葡糖苷酸的结果,图6中显示了地高辛的结果,图7中显示了瑞舒伐他汀的结果,并且图8中显示了普伐他汀的结果。使用方程2计算此系统中每种化合物的bei。使用数据计算每种测试化合物的胆汁清除(方程1)和bei(方程2)。表1中呈现了数据。对牛磺胆酸(牛磺胆酸盐)、雌二醇-葡糖苷酸、地高辛和瑞舒伐他汀获得的结果在使用双培养方法产生并且由yi-anbi等,“useofcryopreservedhumanhepatocytesinsandwichculturetomeasurehepatobiliarytransport,”drugmetabolismanddisposition,vol.34,no.9,pp.1658-65(2006)报告的公开数据的范围内,如表1中所示。表1实施例6:大鼠肝细胞共培养物中的摄取和胆汁排泄。使用原代大鼠肝细胞制备根据实施例1的肝细胞-基质细胞共培养物,并用于测量五种化合物的摄取速率:牛磺胆酸(牛磺胆酸盐)、雌二醇-葡糖苷酸、地高辛、瑞舒伐他汀和普伐他汀。使用本发明的评估胆汁清除的单孔法。将共培养物暴露于浓度2um的牛磺胆酸(牛磺胆酸盐)、2um的雌二醇-葡糖苷酸、2um的地高辛、2um的瑞舒伐他汀和5um的普伐他汀的培养基中的每种测试化合物达20分钟。然后,取出培养基(收集#1)并贮存以分析剩余的化合物。将培养物用缓冲溶液清洗两次(收集#2和#3),并将每个清洗溶液贮存以分析剩余的牛磺胆酸盐。然后,将细胞暴露于含有5μm浓度的拉春库林的hepes缓冲液30分钟,其发挥功能以破坏培养物中存在的小管,但是不裂解共培养物中的细胞。这释放小管胆汁中积累的牛磺胆酸盐。在温育期结束时,收集培养基(收集#4)。然后,将细胞暴露于去离子水,其发挥功能以破坏细胞膜并释放细胞区室中积累的化合物(收集#5)。由于已经在收集#4中收集存在于小管中的任何化合物,收集#5含有细胞中存在的任何化合物,但不包括在小管中存在的任何。与实施例4中一样使用lc-ms/ms测定收集#4和收集5中化合物的浓度。数据提供于图9-13中,使用与图4-8中所用相同的形式。在图9中显示了牛磺胆酸(牛磺胆酸盐)的结果,在图10中显示了瑞舒伐他汀的结果,在图11中显示了雌二醇-葡糖苷酸的结果,在图12中显示了地高辛的结果,并且在图13中显示了普伐他汀的结果。使用方程2计算此系统中每种化合物的bei。牛磺胆酸(牛磺胆酸盐)的测量bei为60%(图9),瑞舒伐他汀的测量bei为72%(图10),雌二醇-葡糖苷酸的测量bei为40%(图11),地高辛的测量bei为67%(图12),并且普伐他汀的测量bei为58%(图13)。在表2中汇总了这些数据。通过基于200mg蛋白质/g肝脏和40g肝脏/kg(参见seglen,1976)将内在clint,胆汁值转换为ml/min/kg来计算对体外cl胆汁提供的值。令人感兴趣的是,对于体内数据可用的化合物,此实施例的结果在一种化合物的4倍内且在另一种中的2倍内。这对于换算的数字是良好的体内至体外关联,并且证明了方法的体内相关性。表2实施例7:转运蛋白抑制测定法通过导致获得性胆汁淤积和药物诱导的肝损伤(dili)的外源物或药物直接抑制排出转运蛋白是药物开发中的主要障碍。因此,理解基于体外测试的化合物的潜在药物-药物相互作用易感性(liability)是期望的。在此实验中,将根据实施例1制备的人原代肝细胞共培养物用于直接测量本发明的单培养测定形式以表征bsep和bcrp抑制。使用的探针底物是2μm牛磺胆酸(bsep排出转运蛋白)和2μm瑞舒伐他汀(bcrp排出转运蛋白)。环孢菌素a是已知的bsep抑制剂,并且以0-20μm使用。利托那韦是一种已知的bcrp抑制剂,并且以0-100μm使用。依托红霉素是已知的广谱抑制剂,并且以50μm使用。为了评估抑制,首先将培养物在指示的抑制剂中预温育20分钟,然后在存在底物和抑制剂的情况下再温育20分钟。然后将培养物清洗两次以除去过量的底物和抑制剂,并与在实施例5中一样继续方案。图14中显示了环孢菌素a的bsep抑制数据。环孢菌素a以0.46μm的ic50抑制bsep介导的牛磺胆酸盐转运。图15中显示了利托那韦的bcrp抑制数据。利托那韦以0.50μm的ic50抑制bcrp介导的利托那韦转运。以相同的方式进行依托红霉素的抑制,只是将底物牛磺胆酸盐和利托那韦一起添加。如图16中所示,依托红霉素完全抑制bsep介导的牛磺胆酸盐转运,并显著抑制bcrp介导的利托那韦转运。总之,这些数据证明了本发明的直接测量单培养测定形式用于表征外源物或药物对排出转运蛋白的抑制的效用。[en:请添加任何其它结论或澄清。]实施例8:重现性与现有技术方法相比,本发明的方法包括以单培养测定形式直接测量化学实体的胆汁排泄。通过使用根据实施例1的人肝细胞基质细胞共培养物对牛磺胆酸盐和普伐他汀中的每一种进行三次独立测定而证明了此测定形式的准确性和可重复性。在表3和图17中显示了牛磺胆酸的数据。在表4和图18中显示了普伐他汀的数据。表5中呈现的统计学分析指示,每种化合物的重复测定结果的结果中没有统计学显著变化(p<0.05)。表3:牛磺胆酸表4:普伐他汀表5:统计学分析底物底物位置p值数据比较结果牛磺胆酸胆汁0.62实验1对实验2无显著差异胆汁0.98实验1对实验3无显著差异胆汁0.63实验2对实验3无显著差异牛磺胆酸细胞0.31实验1对实验2无显著差异细胞0.26实验1对实验3无显著差异细胞0.06实验2对实验3无显著差异普伐他汀胆汁0.06实验1对实验2无显著差异胆汁0.30实验1对实验3无显著差异胆汁0.14实验2对实验3无显著差异普伐他汀细胞0.50实验1对实验2无显著差异细胞0.50实验1对实验3无显著差异细胞0.25实验2对实验3无显著差异当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1