被工程化为治疗与高氨血症相关的疾病的细菌的制作方法
本申请要求以下的权益:2014年12月5日提交的美国临时申请号62/087,854;2015年6月10日提交的美国临时申请号62/173,706;2015年11月16日提交的美国临时申请号62/256,041;2015年1月14日提交的美国临时申请号62/103,513;2015年4月21日提交的美国临时申请号62/150,508;2015年6月10日提交的美国临时申请号62/173,710;2015年11月16日提交的美国临时申请号62/256,039;2015年6月25日提交的美国临时申请号62/184,811;2015年6月24日提交的美国临时申请号62/183,935;以及于2015年12月4日提交的美国临时申请号62/263,329,其全部内容通过引用并入本文以提供公开内容的连续性。
本公开内容涉及用于降低过量的氨并将氨和/或氮转化为旁路副产物(alternatebyproduct)的组合物和治疗方法。在某些方面,本公开内容涉及能够特别是在低氧条件下,诸如在哺乳动物消化道中降低过量的氨的遗传工程化的细菌。在某些方面,本文公开的组合物和方法可用于调节或治疗与高氨血症相关的紊乱,例如尿素循环障碍(ureacycledisorder)和肝性脑病。
氨是高度毒性的并在所有器官的代谢期间产生(walker,2012)。高氨血症是由于解毒减少和/或氨的产生增加引起的。在哺乳动物中,尿素循环通过将氨酶促地转化为尿素来对氨解毒,尿素然后在尿液中去除。氨解毒减少可能是由于尿素循环障碍(ucd)引起的,其中尿素循环酶是有缺陷的,诸如精氨基琥珀酸尿症、精氨酸酶缺乏症、氨甲酰磷酸合成酶缺乏症、瓜氨酸血症、n-乙酰谷氨酸合成酶缺乏症和鸟氨酸转氨甲酰酶缺乏症(
氨也是氨基酸的氮源,氨基酸是通过各种生物合成途径合成的。例如,精氨酸生物合成将包含一个氮原子的谷氨酸转化为包含四个氮原子的精氨酸。在精氨酸生物合成途径中形成的中间代谢物,诸如瓜氨酸,也掺入氮。因此,精氨酸生物合成的增强可用于将身体中的过量的氮掺入到无毒分子中以调节或治疗与高氨血症相关的状况。类似地,组氨酸生物合成、甲硫氨酸生物合成、赖氨酸生物合成、天冬酰胺生物合成、谷氨酰胺生物合成和色氨酸生物合成也能够掺入过量的氮,并且这些途径的增强可用于调节或治疗与高氨血症相关的状况。
目前用于高氨血症和ucd的疗法旨在降低氨过量,但被广泛认为是次优的(nagamani等,2012;hoffmann等,2013;torres-vega等,2014)。大多数ucd患者需要由蛋白限制组成的基本上改良的饮食。然而,必须谨慎监测低蛋白饮食;当蛋白摄入过于限制时,身体会分解肌肉,并因此产生氨。另外,许多患者需要补充氨清除药物,诸如苯丁酸钠、苯甲酸钠和苯丁酸甘油酯,并且这些药物中的一种或更多种必须每天施用3至4次(leonard,2006;diaz等2013)。这些药物的副作用包括恶心、呕吐、易怒、厌食和女性月经失调(menstrualdisturbance)(leonard,2006)。在儿童中,食物和药物的递送可能需要通过手术在胃内植入的胃造口管或通过鼻子手动插入到胃中的鼻胃管。当这些治疗选项失败时,可能需要肝移植(美国国家尿素循环障碍基金会)。因此,对于与高氨血症相关的疾病(包括尿素循环障碍)的有效、可靠和/或长期的治疗存在显著的未满足的需求。
本发明提供了能够降低过量的氨并将氨和/或氮转化为旁路副产物的遗传工程化的细菌。在某些实施方案中,遗传工程化的细菌降低过量的氨,并在低氧环境(例如消化道)中选择性地将氨和/或氮转化成旁路副产物。在某些实施方案中,遗传工程化的细菌是非病原性的并且可以被引入消化道中,以便降低毒性氨。高氨血症患者中过量的氨的多达70%在胃肠道积累。本发明的另一方面提供了基于增加的氨水平和/或氮消耗或无毒副产物(例如精氨酸或瓜氨酸)的产生来选择或靶向遗传工程化的细菌的方法。本发明还提供了包含遗传工程化的细菌的药物组合物,以及调节和治疗与高氨血症相关的紊乱(例如尿素循环障碍和肝性脑病)的方法。
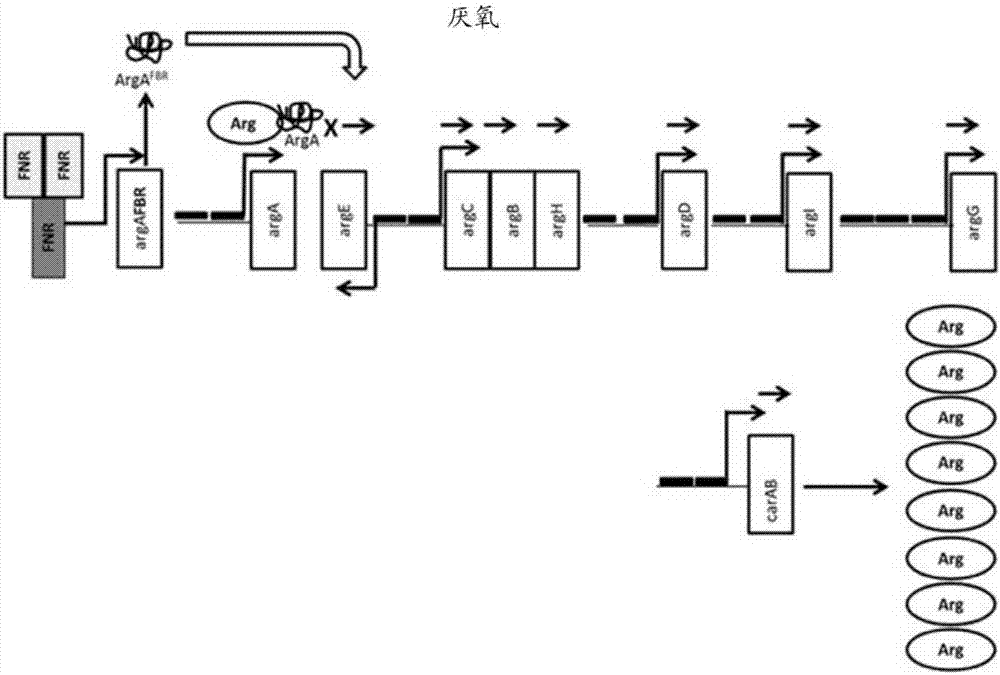
附图简述
图1a和1b描绘了在非诱导(图1a)和诱导(图1b)条件下本发明的argr缺失细菌的一个实施方案中精氨酸调节子的状态。图1a描绘了在需氧条件下由于以下的相对低的精氨酸产生:精氨酸(椭圆形中的“arg”)与arga(波纹
图2a和2b描绘了本发明的替代示例性实施方案。图2a描绘了在需氧条件下的实施方案,其中在氧气的存在下,fnr蛋白(fnr盒)作为单体保留并且不能结合并活化fnr启动子(“fnr”),这驱动精氨酸反馈抗性argafbr基因的表达。野生型arga蛋白是功能性的,但通过与精氨酸结合而易受负反馈抑制,从而保持精氨酸水平处于或低于正常水平。每种精氨酸生物合成基因(arga、arge、argc、argb、argh、argd、argi、argg、cara和carb)的启动子区域中的所有精氨酸阻遏物(argr)结合位点已被突变(黑条;黑色“x“)以降低或消除与argr的结合。图2b描绘了在厌氧条件下的相同实施方案,其中在氧气的不存在下,fnr蛋白(fnr盒)二聚化并结合和活化fnr启动子(“fnr”)。这驱动精氨酸反馈抗性argafbr基因的表达(
图3描绘了本发明的另一个实施方案。在该实施方案中,在驱动tet阻遏物(tetr)由tetr基因的表达的启动子中包含argr结合位点(黑条)的构建体被连接至包含tetr结合位点(tetr和x之间的黑条)、驱动基因x的表达的第二启动子。在低精氨酸浓度下,tetr被表达并抑制基因x的表达。在高精氨酸浓度下,argr与精氨酸缔合并结合argr结合位点,由此抑制tetr由tetr基因的表达。这继而去除了tetr抑制,从而允许基因x表达(黑色波纹
图4描绘了本发明的另一个实施方案。在该实施方案中,在驱动tet阻遏物(tetr)由tetr基因的表达的启动子中包含argr结合位点(黑条)的构建体被连接至包含tetr结合位点(与tetr椭圆形结合的黑条)、驱动绿色荧光蛋白(“gfp”)表达的第二启动子。在低精氨酸浓度下,tetr被表达并抑制gfp的表达。在高精氨酸浓度下,argr与精氨酸缔合并结合argr结合位点,由此抑制tetr由tetr基因的表达。这继而去除了tetr抑制,允许gfp表达。通过突变包含该构建体的宿主,可以使用荧光活化细胞分选(“facs”)基于gfp表达选择高精氨酸生产者。
图5描绘了本发明的另一个实施方案。在该实施方案中,在驱动tet阻遏物(未显示)由tetr基因的表达的启动子中包含argr结合位点(被argr-arg复合物结合的黑条)的构建体被连接至包含tetr结合位点(黑条)、驱动宿主存活所必需的营养缺陷型蛋白的表达(“aux”)的第二启动子。在高精氨酸浓度下,argr-精氨酸复合物与argr结合位点结合,由此抑制tetr由tetr基因的表达。这继而允许表达aux,允许宿主存活。在低精氨酸浓度下,tetr由tetr基因表达并抑制aux的表达,从而杀死宿主。图5中的构建体通过其对aux表达的控制,通过使其对于宿主细胞存活是必需的,迫使高精氨酸(“arg”)产生。
图6描绘了大肠杆菌nissle中每种精氨酸生物合成操纵子(operon)的包含argr结合位点的野生型基因组序列及其突变体。对于每种野生型序列,arg盒以斜体表示,并且每种基因的起始密码子被
图7描绘了包含fnr响应性启动子序列的示例性调节区域序列的核酸序列。加下划线的序列是预测的核糖体结合位点,且加粗的序列是用于克隆的限制性位点。包含fnr启动子的示例性序列包括,但不限于,seqidno:16、seqidno:17、nirb1启动子(seqidno:18)、nirb2启动子(seqidno:19)、nirb3启动子(seqidno:20)、ydfz启动子(seqidno:21)、融合至强核糖体结合位点的nirb启动子(seqidno:22)、融合至强核糖体结合位点的ydfz启动子(seqidno:23)、选自fnrs1(seqidno:24)和fnrs2(seqidno:25)的厌氧诱导的小rna基因fnrs启动子、融合至crp结合位点的nirb启动子(seqidno:26)和融合至crp结合位点的fnrs启动子(seqidno:27)。
图8a描绘了示例性的argafbr序列的核酸序列。图8b描绘了示例性的fnr启动子驱动的argafbr质粒的核酸序列。fnr启动子序列被加粗,且argafbr序列被
图9描绘了示例性fnr启动子驱动的argafbr序列的核酸序列。fnr启动子序列被加粗,且核糖体结合位点被突出显示,并且argafbr序列被
图10描绘了在融合至强核糖体结合位点的示例性fnr启动子(fnrs)的控制下的argafbr基因的示意图。
图11描绘了在融合至强核糖体结合位点的示例性fnr启动子(nirb)的控制下的argafbr基因的另一个示意图。也可存在其他调节元件。
图12描绘了在融合至弱核糖体结合位点的示例性fnr启动子(nirb)的控制下的argafbr基因的示意图。
图13a和13b描绘了融合至crp结合位点的fnr响应性启动子的示例性实施方案。图13a描绘了fnr-crp启动子区域的图谱,其中限制性位点以粗体显示。图13b描绘了在融合至crp结合位点和核糖体结合位点两者的示例性fnr启动子(nirb启动子)的控制下的argafbr基因的示意图。也可存在其他调节元件。
图14a和14b描绘了融合至crp结合位点的fnr响应性启动子的替代示例性实施方案。图14a描绘了fnr-crp启动子区域的图谱,其中限制位点以粗体显示。图14b描绘了在融合至crp结合位点和核糖体结合位点两者的示例性fnr启动子(fnrs启动子)的控制下的argafbr基因的示意图。
图15描绘了大肠杆菌nissle中argg基因的调节区域和5'部分的野生型基因组序列及其组成型突变体。每种序列的启动子区域加被加下划线,并且argg基因的5'部分被
图16描绘了大肠杆菌nissle中组成型表达的argg构建体的示例性实施方案。组成型启动子是bba_j23100,以灰色加框。用于克隆的限制性位点被加粗。
图17描绘了大肠杆菌nissle中的野生型argg操纵子及其组成型表达突变体的图谱。arg盒存在于野生型操纵子中,但不存在于突变体中。argg在bba_j23100启动子的控制下组成型表达。
图18描绘了示例性bad启动子驱动的argafbr构建体的核酸序列。所有加粗的序列为nissle基因组dna。arac基因的一部分被加粗和加下划线,且argafbr基因被
图19描绘了示例性bad启动子驱动的argafbr构建体的示意图。在该实施方案中,将argafbr基因被插入在arac和arad基因之间。argafbr侧翼是核糖体结合位点、frt位点和一个或更多个转录终止子序列。
图20描绘了psc101质粒的图谱。限制性位点以粗体显示。
图21a描绘了psc101质粒的核酸序列。图21b描绘了fnrs启动子驱动的argafbrpsc101质粒的核苷酸序列。argafbr序列被加框,核糖体结合位点被突出显示,并且fnrs启动子被大写并加粗。
图22描绘了大肠杆菌1917nissle染色体内的示例性整合位点的图谱。这些位点表示可以将回路成分(circuitcomponents)插入到染色体而不干扰必需基因表达的区域。反斜杠(/)用于表明,插入将发生在趋异或趋同(divergentlyorconvergently)表达的基因之间。生物合成基因(诸如thya)内的插入可用于产生营养物质营养缺陷型。在一些实施方案中,将单独的回路成分插入到多于一个的指定位点中。
图23描绘了组成型表达红色荧光蛋白(rfp)的三种细菌菌株。在菌株1-3中,rfp基因已被插入细菌染色体内的不同位点,并在荧光下产生不同程度的亮度。未修饰的大肠杆菌nissle(菌株4)是非荧光的。
图24描绘了在诱导(+atc)和非诱导(-atc)条件下由链霉素抗性对照nissle(syn-ucd103)、syn-ucd201、syn-ucd202和syn-ucd203产生的体外精氨酸水平的条形图。syn-ucd201包含δargr和无argafbr。syn-ucd202包含高拷贝质粒上的δargr和四环素诱导型argafbr。syn-ucd203包含低拷贝质粒上的δargr和四环素驱动的argafbr。
图25描绘了在诱导条件下由链霉素抗性对照nissle(syn-ucd103)、syn-ucd104、syn-ucd204和syn-ucd105产生的精氨酸和瓜氨酸的体外水平的条形图。syn-ucd104包含野生型argr、低拷贝质粒上的四环素诱导型argafbr、四环素诱导型argg以及每种精氨酸生物合成操纵子(除了argg)的每种arg盒中的突变。syn-ucd204包含δargr以及在低拷贝质粒上的四环素诱导型启动子控制下表达的argafbr。syn-ucd105包含野生型argr、低拷贝质粒上的四环素诱导型argafbr、组成型表达的argg(bba_j23100组成型启动子)、以及每种精氨酸生物合成操纵子(除了argg)的每种arg盒中的突变。
图26描绘了在氧气的存在(+o2)或不存在(-o2)下,在诱导(+atc)和非诱导(-atc)条件下由链霉素抗性nissle(syn-ucd103)、syn-ucd205和syn-ucd204产生的体外精氨酸水平的条形图。syn-ucd103是对照nissle构建体。syn-ucd205包含δargr以及在低拷贝质粒上的fnr诱导型启动子(fnrs2)的控制下表达的argafbr。syn204包含δargr以及在低拷贝质粒上的四环素诱导型启动子控制下表达的argafbr。
图27描绘了nissle体内停留的图。将链霉素抗性nissle经由口服管饲施用至小鼠而无抗生素预处理。在施用后监测来自总计六只小鼠的粪粒(fecalpellet),以确定施用的nissle仍然停留于小鼠胃肠道内的量。条代表施用至小鼠的细菌数目。线代表连续10天每天从粪便样品回收的nissle的数目。
图28a、28b和28c描绘了高氨血症taa小鼠中氨水平的条形图。图28a描绘了用未修饰的对照nissle或syn-ucd202处理的高氨血症小鼠中的氨水平的条形图,syn-ucd202是遗传工程化的菌株,其中arg阻遏物基因被缺失,并且argafbr基因在高拷贝质粒上的四环素诱导型启动子的控制下。测试了总计96只小鼠,且误差棒代表标准误差。在第4天和第5天,用syn-ucd202处理的小鼠中的氨水平低于用未修饰的对照nissle处理的小鼠中的氨水平。图28b描绘了显示在肝性脑病的taa小鼠模型中syn-ucd204相对于链霉素抗性对照nissle(syn-ucd103)和仅媒介物对照的体内功效(氨消耗)的条形图。图28c描绘了在taa处理后24-48小时之间血氨浓度变化百分比的条形图。
图29描绘了高氨血症spfash小鼠中氨水平的条形图。将56只spfash小鼠分为4组。初始抽血后,组1喂食正常食物,组2-4饲喂70%蛋白食物。各组每天两次用水、链霉素抗性nissle对照(syn-ucd103)或syn-ucd204管饲,并在第一次管饲后4小时抽取血液。包含δargr和在低拷贝质粒上的四环素诱导型启动子控制下表达的argafbr的syn-ucd204,将血氨显著降低至低于高氨血症阈值的水平。
图30描绘尿素循环酶的示例性示意图。
图31描绘了氨消耗动力学和给药的图表。该信息可用于确定ucd患者中为了吸收治疗相关量(therapeuticallyrelevantamount)的氨需要产生的精氨酸的量。可以对瓜氨酸产生进行类似的计算。
图32描绘了经由将氨转化为所需产物诸如瓜氨酸或精氨酸来治疗ucd和以高氨血症为特征的紊乱的合成遗传回路的示例性示意图。
图33a和33b描绘了可用于产生正反馈营养缺陷型(positivefeedbackauxotroph)并选择高精氨酸产生的示例性构建体的图。图33a描绘了驱动thya表达的astc启动子的图谱。图33b描绘了在astc启动子控制下的thya基因的示意图。调节区域包含用于crp、argr和rna聚合酶(rnap)的结合位点,并且还可以包含另外的调节元件。
图34描绘了可被破坏或缺失以产生营养缺陷型菌株的示例细菌基因的表格。这些包括但不限于寡核苷酸合成、氨基酸合成和细胞壁合成所需的基因。
图35描绘了说明如在管饲后24小时和48小时检测到的小鼠消化道中多种氨基酸营养缺陷型存活的表格。这些营养缺陷型使用大肠杆菌的非nissle菌株bw25113产生。
图36描绘了本公开内容的一个非限制性实施方案,其中外源环境条件或一种或更多种环境信号活化异源基因和至少一种重组酶由一种或更多种诱导型启动子的表达。重组酶然后将毒素基因翻转(flip)为活化的构象,并且重组酶的天然动力学产生毒素表达的时间延迟,允许异源基因被完全表达。在毒素表达后,它杀死细胞。
图37描绘了本公开内容的另一个非限制性实施方案,其中外源环境条件或一种或更多种环境信号活化异源基因、抗毒素和至少一种重组酶由一种或更多种诱导型启动子的表达。重组酶然后将毒素基因翻转为活化的构象,但积累的抗毒素的存在抑制毒素的活性。在外源环境条件或信号不再存在后,就会关闭抗毒素的表达。毒素被组成型表达,继续积累,并杀死细菌细胞。
图38描绘了本公开内容的另一个非限制性实施方案,其中外源环境条件或一种或更多种环境信号活化异源基因和至少一种重组酶由一种或更多种诱导型启动子的表达。然后重组酶将至少一种切除酶翻转为活化的构象。然后至少一种切除酶切除一种或更多种必需基因,导致衰老和最终的细胞死亡。重组酶和切除基因的天然动力学引起时间延迟,其动力学可以根据待切除的必需基因的数目和选择进行改变和优化,允许在大约数小时或数天内发生细胞死亡。多种嵌套重组酶(nestedrecombinase)(如图60中示出)的存在可用于进一步控制细胞死亡的时机。
图39描绘了本公开内容的非限制性实施方案,其中抗毒素由组成型启动子表达,且异源基因的表达由外源环境信号活化。在阿拉伯糖的不存在下,arac转录因子采用阻遏转录的构象。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许arac转录因子结合并活化arabad启动子,该arabad启动子诱导tetr的表达,从而阻止毒素的表达。然而,当不存在阿拉伯糖时,tetr不表达,且毒素被表达,最终克服抗毒素并杀死细胞。调节抗毒素表达的组成型启动子应该是比驱动毒素表达的启动子更弱的启动子。arac在该回路中在组成型启动子控制下。
图40描绘了本公开内容的另一个非限制性实施方案,其中异源基因的表达由外源环境信号活化。在阿拉伯糖的不存在下,arac转录因子采用阻遏转录的构象。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许arac转录因子结合并活化arabad启动子,该arabad启动子诱导tetr(tet阻遏物)和抗毒素的表达。抗毒素在重组细菌细胞中形成,同时tetr阻止毒素的表达(其在具有tetr结合位点的启动子控制下)。然而,当不存在阿拉伯糖时,不表达抗毒素和tetr两者。由于阻遏毒素表达的tetr不存在,所以毒素被表达并杀死细胞。arac在该回路中在组成型启动子控制下。
图41描绘了对于argr基因缺失并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株可用于消耗氨和产生精氨酸。
图42描绘了对于argr基因缺失并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株还包含染色体上的一种或更多种营养缺陷型修饰。该菌株可用于消耗氨和产生精氨酸。
图43描绘了对于argr和argg基因缺失并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株可用于消耗氨和产生瓜氨酸。
图44描绘了对于argr和argg基因缺失并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株还包含染色体上的一种或更多种营养缺陷型修饰。该菌株可用于消耗氨和产生瓜氨酸。
图45描绘了缺乏argr结合位点并表达反馈抗性的argafbr基因的工程化细菌菌株的示例性实施方案。该菌株可用于消耗氨和产生精氨酸。
图46描绘了缺乏argr结合位点并表达反馈抗性的argafbr基因的工程化细菌菌株的示例性实施方案。该菌株还包含染色体上的一种或更多种营养缺陷型修饰。该菌株可用于消耗氨和产生精氨酸。
图47描绘了在除了argg以外的所有精氨酸生物合成操纵子中缺乏argr结合位点,并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株可用于消耗氨和产生瓜氨酸。
图48描绘了在除了argg以外的所有精氨酸生物合成操纵子中缺乏argr结合位点,并表达反馈抗性argafbr基因的工程化细菌菌株的示例性实施方案。该菌株还包含染色体上的一种或更多种营养缺陷型修饰。该菌株可用于消耗氨和产生瓜氨酸。
图49a示出了野生型clba构建体的示意图。图49b描绘了clba敲除构建体的示意图。
图50描绘了野生型clba构建体和clba敲除构建体的示例性序列。
图51描绘了在基线、2小时和4小时时来自syn-ucd101、syn-ucd102和空白对照的培养基中的体外氨水平的条形图。syn-ucd101和syn-ucd102两者都能体外消耗氨。
图52描绘了在基线、2小时和4小时时来自syn-ucd201、syn-ucd203和空白对照的培养基中的体外氨水平的条形图。syn-ucd201和syn-ucd203两者都能体外消耗氨。
图53描述了geneguard作为工程化安全性成分的使用。所有工程化dna存在于可以有条件地被破坏的质粒上。参见,例如,wright等,“geneguard:amodularplasmidsystemdesignforbiosafety,“acssyntheticbiology(2015)4:307-316。
图54描绘了示例性l-高丝氨酸和l-甲硫氨酸生物合成途径。圆形表示被metj阻遏的基因,且metj的缺失导致这些基因的组成型表达和途径的活化。
图55描绘了示例性组氨酸生物合成途径。
图56描绘了示例性赖氨酸生物合成途径。
图57描绘了示例性天冬酰胺生物合成途径。
图58描绘了示例性谷氨酰胺生物合成途径。
图59描绘了示例性色氨酸生物合成途径。
图60描绘了本公开内容的一个非限制性实施方案,其中外源环境条件或一种或更多种环境信号活化异源基因和第一重组酶由一种或更多种诱导型启动子的表达。然后,重组酶将第二重组酶从反向取向翻转为活性构象。活化的第二重组酶将毒素基因翻转为活化的构象,并且重组酶的天然动力学产生毒素表达的时间延迟,允许异源基因被完全表达。在毒素表达后,它杀死细胞。
图61描绘了具有图60中描述的杀死开关(kill-switch)实施方案的被工程化为靶向尿素循环障碍(ucd)的合成生物(syntheticbiotic)。在该实例中,将int重组酶和kid-kis毒素-抗毒素系统用于重组细菌细胞中,用于治疗ucd。将重组细菌细胞工程化为消耗过量的氨以产生有益的副产物以改善患者的结果。重组细菌细胞还包含高度可控的杀死开关以确保安全性。响应于低氧环境(例如,诸如消化道中发现的那样),fnr启动子诱导int重组酶的表达,并还诱导kis抗毒素的表达。int重组酶引起kid毒素基因翻转为活化的构象,但积累的kis抗毒素的存在抑制了表达的kid毒素的活性。在氧气的存在下(例如消化道外),抗毒素的表达被关闭。由于毒素被组成型表达,它继续积累和杀死细菌细胞。
图62描绘了本公开内容的另一个非限制性实施方案,其中异源基因的表达由外源环境信号活化。在阿拉伯糖的不存在下,arac转录因子采用阻遏转录的构象。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许arac转录因子结合并活化arabad启动子,该arabad启动子诱导tetr(tet阻遏物)和抗毒素的表达。抗毒素在重组细菌细胞中形成,同时tetr阻止毒素的表达(其在具有tetr结合位点的启动子控制下)。然而,当不存在阿拉伯糖时,不表达抗毒素和tetr两者。由于阻遏毒素表达的tetr不存在,所以毒素被表达并杀死细胞。图62还描绘了本公开内容的另一个非限制性实施方案,其中在重组细菌中未发现的必需基因的表达由外源环境信号活化。在阿拉伯糖的不存在下,arac转录因子采用阻遏在arabad启动子控制下的必需基因的转录的构象,且细菌细胞不能存活。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许arac转录因子结合并活化arabad启动子,该arabad启动子诱导必需基因的表达并保持细菌细胞的存活力。
图63描绘了本公开内容的非限制性实施方案,其中抗毒素由组成型启动子表达,且异源基因的表达由外源环境信号活化。在阿拉伯糖的不存在下,arac转录因子采用阻遏转录的构象。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许arac转录因子结合并活化arabad启动子,该arabad启动子诱导tetr的表达,从而阻止毒素的表达。然而,当不存在阿拉伯糖时,tetr不表达,且毒素被表达,最终克服抗毒素并杀死细胞。调节抗毒素表达的组成型启动子应该是比驱动毒素表达的启动子更弱的启动子。
图64描绘了本公开内容的重组细菌的安全性设计的概述,包括重组细菌的固有安全性以及工程化安全废弃物管理(包括杀死开关和/或营养缺陷型)。
实施方案的描述
本发明包括遗传工程化的细菌、其药物组合物、以及调节或治疗与高氨血症相关的紊乱(例如尿素循环障碍和肝性脑病)的方法。遗传工程化的细菌能够特别是在低氧条件下,诸如哺乳动物消化道中降低过量的氨。在某些实施方案中,遗传工程化的细菌通过将体内过量的氮掺入到无毒分子(例如精氨酸、瓜氨酸、甲硫氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺或色氨酸)来降低过量的氨。
为使本公开内容可更容易地理解,首先定义某些术语。这些定义应根据本公开内容的剩余部分并且如本领域普通技术人员所理解的进行阅读。除非另有限定,本文使用的所有技术和科学术语具有与由本领域的普通技术人员通常所理解的相同的意思。在整个详细描述中陈述另外的定义。
“高氨血症(hyperammonemia)”、“高氨血症(hyperammonemic)”或“过量的氨”用于指增加的体内氨浓度。高氨血症是由于解毒减少和/或氨的产生增加引起的。解毒减少可起因于尿素循环障碍(ucd),诸如精氨基琥珀酸尿症、精氨酸酶缺乏症、氨甲酰磷酸合成酶缺乏症、瓜氨酸血症、n-乙酰谷氨酸合成酶缺乏症和鸟氨酸转氨甲酰酶缺乏症;或起因于肝脏的旁路,例如开放性肝管(openductushepaticus);和/或起因于谷氨酰胺合成酶缺乏症(hoffman等,2013;
“氨”用于指气态氨(nh3)、离子氨(nh4+)或其混合物。在体液中,气态氨和离子铵平衡存在:
一些临床实验室测试分析总氨(nh3+nh4+)(walker,2012)。在本发明的任何实施方案中,除非另有指示,否则“氨”可指气态氨、离子氨和/或总氨。
氨的“解毒”用于指天然或合成的一种或更多种过程,藉此毒性氨被去除和/或转化为一种或更多种无毒分子,包括但不限于:精氨酸、瓜氨酸、甲硫氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺、色氨酸或尿素。例如,尿素循环酶促地将氨转化为尿素以尿液排出体外。由于氨是许多氨基酸的氮源,氨基酸经由许多生物化学途径合成,一种或更多种这些氨基酸生物合成途径的增强可用于将过量的氮掺入到无毒分子中。例如,精氨酸生物合成将包含一个氮原子的谷氨酸转化为包含四个氮原子的精氨酸,由此将过量的氮掺入到无毒分子中。在人类中,精氨酸不被大肠再吸收,且因此大肠中过量的精氨酸不被认为是有害的。同样地,瓜氨酸不被大肠再吸收,且因此大肠中过量的瓜氨酸不被认为是有害的。精氨酸生物合成也可以被修饰以产生瓜氨酸作为最终产物;瓜氨酸包含三个氮原子,且因此修饰的途径也能够将过量的氮掺入到无毒分子中。
“精氨酸调节子”、“精氨酸生物合成调节子”和“arg调节子”可互换使用,指给定细菌物种中的操纵子的集合,所述给定细菌物种包含编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸和/或中间代谢物例如瓜氨酸的酶的基因。精氨酸调节子还包括与这些操纵子相关的操纵基因(operator)、启动子、arg盒和/或调节区域。精氨酸调节子包括但不限于编码精氨酸生物合成酶n-乙酰谷氨酸合成酶、n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、氨甲酰磷酸合酶的操纵子、其操纵基因、其启动子、其arg盒、和/或其调节区域。在一些实施方案中,除了n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶以外或代替n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶,精氨酸调节子包含编码鸟氨酸乙酰转移酶的操纵子和相关的操纵基因、启动子、arg盒和/或调节区域。在一些实施方案中,精氨酸调节子的一种或更多种操纵子或基因可以存在于细菌中的质粒上。在一些实施方案中,细菌可以包含精氨酸调节子中任何基因或操纵子的多个拷贝,其中一个或更多个拷贝可以如本文描述被突变或以其他方式改变。
一种基因可以编码一种酶,例如n-乙酰谷氨酸合成酶(arga)。两种或更多种基因可以编码一种酶的不同亚基,例如氨甲酰磷酸合酶的亚基a和亚基b(cara和carb)。在一些细菌中,两种或更多种基因可以各自独立地编码相同的酶,例如鸟氨酸转氨甲酰酶(argf和argi)。在一些细菌中,精氨酸调节子包含但不限于编码n-乙酰谷氨酸合成酶的arga;编码n-乙酰谷氨酸激酶的argb;编码n-乙酰谷氨酰磷酸还原酶的argc;编码乙酰鸟氨酸氨基转移酶的argd;编码n-乙酰鸟氨酸酶的arge;编码精氨基琥珀酸合酶的argg;编码精氨基琥珀酸裂合酶的argh;argf和argi中的一种或两种,其每一种独立地编码鸟氨酸转氨甲酰酶;编码氨甲酰磷酸合酶的小亚基的cara;编码氨甲酰磷酸合酶的大亚基的carb;其操纵子;其操纵基因;其启动子;其arg盒;和/或调节区域。在一些实施方案中,精氨酸调节子包含编码鸟氨酸乙酰转移酶(除了n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶或代替n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶)的argj、其操纵子、其操纵基因、其启动子、其arg盒和/或其调节区域。
“精氨酸操纵子”、“精氨酸生物合成操纵子”和“arg操纵子”可互换使用,指在包含至少一种启动子和至少一种arg盒的共有的调节区域的控制下编码精氨酸生物合成酶的一种或更多种基因的簇。在一些实施方案中,一种或更多种基因被共转录和/或共翻译。编码负责精氨酸生物合成的酶的基因的任何组合可以天然地或合成地被组织成操纵子。例如,在枯草芽孢杆菌(b.subtilis)中,在包含启动子和arg盒的共有的调节区域的控制下,编码n-乙酰谷氨酰磷酸还原酶、n-乙酰谷氨酸激酶、n-乙酰鸟氨酸酶、n-乙酰谷氨酸激酶、乙酰鸟氨酸氨基转移酶、氨甲酰磷酸合酶和鸟氨酸转氨甲酰酶的基因被组织成单种操纵子argcaebd-carab-argf(参见,例如,表2)。在大肠杆菌k12和nissle中,编码n-乙酰鸟氨酸酶、n-乙酰谷氨酰磷酸还原酶、n-乙酰谷氨酸激酶和精氨基琥珀酸裂合酶的基因被组织成两种双极操纵子argecbh。编码负责精氨酸生物合成的酶的操纵子可以被分布在跨越染色体的不同基因座处。在未修饰的细菌中,每种操纵子可被精氨酸经由argr阻遏。在一些实施方案中,在本发明的遗传工程化的细菌中,精氨酸和/或中间副产物产生可以通过修饰由如本文提供的精氨酸生物合成操纵子编码的酶的表达来改变。每种精氨酸操纵子可以存在于质粒或细菌染色体上。另外,任何精氨酸操纵子或在精氨酸操纵子内的基因或调节区域的多个拷贝可以存在于细菌中,其中操纵子或基因或调节区域的一个或更多个拷贝可以如本文描述被突变或以其他方式改变。在一些实施方案中,将遗传工程化的细菌工程化为包含相同产物(例如,操纵子或基因或调节区域)的多个拷贝以增强拷贝数或以包含进行多种不同功能的操纵子的多种不同成分。
“arg盒共有序列”指arg盒核酸序列,已知其核酸以高频率存在于argr、arga、argb、argc、argd、arge、argf、argg、argh、argi、argj、cara和/或carb的一种或更多种调节区域中。如以上描述的,每种arg操纵子包含调节区域,所述调节区域包含与启动子重叠并且阻遏物蛋白与其结合的至少一个18个核苷酸不完全回文序列(称为arg盒)(tian等,1992)。arg盒的核苷酸序列可以随每种操纵子而变化,并且共有arg盒序列是a/tntgaata/ta/tt/at/aattcant/a(maas,1994)。精氨酸阻遏物结合一种或更多种arg盒以积极抑制与该一种或更多种arg盒可操作地连接的精氨酸生物合成酶的转录。
“突变体精氨酸调节子”或“突变的精氨酸调节子”用于指包含一种或更多种核酸突变的精氨酸调节子,所述一种或更多种核酸突变降低或消除精氨酸介导的对编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸和/或中间副产物例如瓜氨酸的酶的操纵子的每一种的阻遏,使得突变体精氨酸调节子比来自在相同条件下的相同细菌亚型的未修饰的调节子产生更多的精氨酸和/或中间副产物。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体例如argafbr,和在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶和氨基甲酰磷酸合酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,由此使调节子去阻遏并增强精氨酸和/或中间副产物生物合成。在一些实施方案中,遗传工程化的细菌包含突变体精氨酸阻遏物,所述突变体精氨酸阻遏物包含一种或更多种核酸突变,使得精氨酸阻遏物功能减少或失活,或遗传工程化的细菌不具有精氨酸阻遏物(例如,精氨酸阻遏物基因已被缺失),导致调节子的去阻遏和精氨酸和/或中间副产物生物合成的增强。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体例如argafbr,在用于编码精氨酸生物合成酶和/或突变或缺失的精氨酸阻遏物的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体例如argafbr和在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体例如argafbr和突变或缺失的精氨酸阻遏物。在一些实施方案中,突变体精氨酸调节子包含编码野生型n-乙酰谷氨酸合成酶的操纵子和用于所述操纵子的至少一种arg盒中的一种或更多种核酸突变。在一些实施方案中,突变体精氨酸调节子包含编码野生型n-乙酰谷氨酸合成酶和突变或缺失的精氨酸阻遏物的操纵子。在一些实施方案中,突变体精氨酸调节子包含编码鸟氨酸乙酰转移酶(除了n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶以外或代替n-乙酰谷氨酸合成酶和/或n-乙酰鸟氨酸酶)的操纵子和用于所述操纵子的至少一种arg盒中的一种或更多种核酸突变。
arg盒与每种精氨酸生物合成操纵子的调节区域中的启动子重叠。在突变体精氨酸调节子中,一种或更多种精氨酸生物合成操纵子的调节区域被充分突变为破坏回文arg盒序列并降低argr结合,但仍包含与非突变体调节区域的启动子足够高的同源性以作为天然操纵子特异性启动子被识别。操纵子在至少一种arg盒中包含至少一种核酸突变,使得argr与arg盒和操纵子的调节区域的结合被降低或消除。在一些实施方案中,在argr结合期间被保护免受dna甲基化的碱基和被保护免受羟基自由基攻击的碱基是用于破坏argr结合的突变的主要靶(参见,例如,图6)。突变的调节区域的启动子保留与非突变调节区域的启动子足够高的同源性,使得rna聚合酶以足够的亲和力与其结合以促进可操作地连接的精氨酸生物合成酶的转录。在一些实施方案中,突变体的启动子的g/c:a/t比值与野生型启动子的g/c:a/t比值相差不多于10%。
在一些实施方案中,多于一种arg盒可以存在于单种操纵子中。在这些实施方案的一个方面,操纵子中的至少一种arg盒被改变为产生所需的对操纵子的调节区域的降低的argr结合。在这些实施方案的另一方面,操纵子中的arg盒的每一种被改变为产生所需的对操纵子的调节区域的降低的argr结合。
“降低的”argr结合用于指与对在相同条件下的相同亚型的细菌中的未修饰的arg盒和调节区域的阻遏物结合相比,对操纵子中arg盒的阻遏物结合的降低或对所述操纵子的调节区域的总阻遏物结合的降低。在一些实施方案中,比对在相同条件下的相同亚型的细菌中的未修饰的arg盒和调节区域的argr结合,对操纵子的突变体arg盒和调节区域的argr结合至少低约50%、至少低约60%、至少低约70%、至少低约80%、至少低约90%或至少低约95%。在一些实施方案中,对突变体arg盒和调节区域的降低的argr结合导致操纵子中一种或更多种基因的mrna表达增加了至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍或至少约1,500倍。
“argr”或“精氨酸阻遏物”用于指能够通过调节精氨酸调节子中精氨酸生物合成基因的转录而抑制精氨酸生物合成的蛋白。当野生型细菌中编码精氨酸阻遏物蛋白(“argr”)的基因的表达增加时,精氨酸生物合成减少。当野生型细菌中argr的表达减少时,或者如果argr被缺失或突变为失活精氨酸阻遏物功能,则精氨酸生物合成增加。
“缺乏任何功能性argr”的细菌和“argr缺失细菌”用于指与来自在相同条件下的相同亚型的细菌的未修饰的精氨酸阻遏物相比,其中每种精氨酸阻遏物活性被显著降低或消除的细菌。降低或消除的精氨酸阻遏物活性可导致例如增加的精氨酸生物合成基因的转录和/或增加的精氨酸和/或中间副产物例如瓜氨酸的浓度。其中精氨酸阻遏物活性被降低或消除的细菌可以通过修饰细菌argr基因或通过修饰argr基因的转录来产生。例如,染色体argr基因可以被缺失,可以被突变,或者argr基因可以被不表现野生型阻遏物活性的argr基因替代。
“可操作地连接”指核酸序列,例如编码反馈抗性arga的基因,其以允许表达核酸序列的方式(例如以顺式作用)连接至调节区域序列。
“诱导型启动子”指被可操作地连接至一种或更多种基因的调节区域,其中基因的表达在所述调节区域的诱导物存在下被增加。
“外源环境条件”指在其下以上描述的启动子被诱导的设置或情形。在一些实施方案中,外源环境条件对哺乳动物的消化道是特异性的。在一些实施方案中,外源环境条件对哺乳动物的上胃肠道是特异性的。在一些实施方案中,外源环境条件对哺乳动物的下胃肠道是特异性的。在一些实施方案中,外源环境条件对哺乳动物的小肠是特异性的。在一些实施方案中,外源环境条件是低氧、微需氧或厌氧条件,诸如哺乳动物消化道道的环境。在一些实施方案中,外源环境条件是对哺乳动物消化道特异的分子或代谢物,例如丙酸酯。在一些实施方案中,本发明的遗传工程化的细菌包含氧水平依赖性启动子。细菌已经演化出能够感测氧水平的转录因子。不同的信号转导途径可以由不同的氧水平触发并且以不同的动力学发生。“氧水平依赖性启动子”或“氧水平依赖性调节区域”指一种或更多种氧水平感测转录因子能够结合的核酸序列,其中相应转录因子的结合和/或活化活化下游基因表达。
氧水平依赖性转录因子的实例包括但不限于fnr、anr和dnr。相应的fnr响应性启动子、anr响应性启动子和dnr响应性启动子是本领域已知的(参见,例如,castiglione等,2009;eiglmeier等,1989;galimand等,1991;hasegawa等,1998;hoeren等,1993;salmon等,2003),且非限制性实例示于表1中。
表1.转录因子和响应性基因和调节区域的实例
如本文使用的,“非天然”核酸序列指细菌中通常不存在的核酸序列,例如内源序列的额外拷贝,或异源序列,诸如来自不同物种、菌株或细菌的亚株的序列,或与来自相同亚型的细菌的未修饰序列相比被修饰和/或突变的序列。在一些实施方案中,非天然核酸序列是合成的、非天然存在的序列(参见,例如,purcell等,2013)。非天然核酸序列可以是调节区域、启动子、基因和/或基因盒中的一种或更多种基因。在一些实施方案中,“非天然”指在自然界中彼此未以相同关系被发现的两种或更多种核酸序列。非天然核酸序列可以存在于质粒或染色体上。在一些实施方案中,本发明的遗传工程化的细菌包含这样的基因盒,所述基因盒被可操作地连接至在自然界中与所述基因盒不相关的直接或间接诱导型启动子,例如可操作地连接至丁酸源(butyrogenic)基因盒的fnr响应性启动子。
“组成型启动子”指能够促进在其控制下和/或与其可操作地连接的编码序列或基因的连续转录的启动子。组成型启动子和变体是本领域熟知的,且包括但不限于组成型大肠杆菌σs启动子bba_j23100(例如,osmy启动子(国际遗传工程机器(igem)标准生物部件注册表名称bba_j45992;bba_j45993))、组成型大肠杆菌σ32启动子(例如,htpg热休克启动子(bba_j45504))、组成型大肠杆菌σ70启动子(例如,lacq启动子(bba_j54200;bba_j56015)、大肠杆菌creabcd磷酸感测操纵子启动子(bba_j64951)、glnrs启动子(bba_k088007)、lacz启动子(bba_k119000;bba_k119001);m13k07基因i型启动子(bba_m13101);m13k07基因ii型启动子(bba_m13102)、m13k07基因iii型启动子(bba_m13103)、m13k07基因iv型启动子(bba_m13104)、m13k07基因v型启动子(bba_m13105)、m13k07基因vi型启动子(bba_m13106)、m13k07基因viii型启动子(bba_m13108)、m13110(bba_m13110))、组成型枯草芽孢杆菌σa启动子(例如,启动子veg(bba_k143013)、启动子43(bba_k143013)、pliag(bba_k823000)、plepa(bba_k823002)、pveg(bba_k823003))、组成型枯草芽孢杆菌σb启动子(例如,启动子ctc(bba_k143010)、启动子gsib(bba_k143011))、沙门氏菌(salmonella)启动子(例如,来自沙门氏菌的pspv2(bba_k112706)、来自沙门氏菌的pspv(bba_k112707))、噬菌体t7启动子(例如,t7启动子(bba_i712074;bba_i719005;bba_j34814;bba_j64997;bba_k113010;bba_k113011;bba_k113012;bba_r0085;bba_r0180;bba_r0181;bba_r0182;bba_r0183;bba_z0251;bba_z0252;bba_z0253))和噬菌体sp6启动子(例如,sp6启动子(bba_j64998))。
如本文使用的,“过度产生”精氨酸或中间副产物(例如瓜氨酸)的遗传工程化的细菌指包含突变体精氨酸调节子的细菌。例如,工程化的细菌可以包含arga的反馈抗性形式,并且当精氨酸反馈抗性arga被表达时,能够比在相同条件下的相同亚型的未修饰细菌产生更多精氨酸和/或中间副产物。遗传工程化的细菌可以可选地或另外包含突变体精氨酸调节子,所述突变体精氨酸调节子在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变。遗传工程化的细菌可以可选地或另外包含突变或缺失的精氨酸阻遏物。在一些实施方案中,遗传工程化的细菌比在相同条件下的相同亚型的未修饰细菌多产生至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍、或至少约1,500倍的精氨酸。在一些实施方案中,遗传工程化的细菌比在相同条件下的相同亚型的未修饰细菌多产生至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍、或至少约1,500倍的瓜氨酸或其他中间副产物。在一些实施方案中,遗传工程化的细菌中的一种或更多种精氨酸生物合成基因的mrna转录物水平比在相同条件下的相同亚型的未修饰细菌中的mrna转录物水平高至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍、或至少约1,500倍。在某些实施方案中,未修饰的细菌将不具有可检测水平的精氨酸、中间副产物和/或此类操纵子中的基因转录。然而,在具有突变体精氨酸调节子的相应遗传工程化的细菌中,将可检测到精氨酸的蛋白和/或精氨酸的转录水平和/或中间副产物。可通过直接测量基因的mrna水平来检测转录水平。测量精氨酸和/或中间副产物水平以及由精氨酸生物合成基因表达的转录物水平的方法是本领域已知的。例如,精氨酸和瓜氨酸可以通过质谱法测量。
“消化道(gut)”指负责食物转移和消化、吸收营养物质和排泄废弃物的器官、腺体、道和系统。在人类中,消化道包括起于口并终于肛门的胃肠道,并且还包括食道、胃、小肠和大肠。消化道还包括辅助器官(accessoryorgan)和腺体,诸如脾脏、肝脏、胆囊和胰腺。上胃肠道包括食道、胃和小肠的十二指肠。下胃肠道包括小肠的剩余部分,即空肠和回肠,以及所有大肠,即盲肠、结肠、直肠和肛管。细菌可以在整个肠种,例如在胃肠道,特别是在肠中被发现。
“非病原性细菌”指不能在宿主中引起疾病或有害响应的细菌。在一些实施方案中,非病原性细菌是共生细菌。非病原性细菌的实例包括但不限于芽孢杆菌属(bacillus)、拟杆菌属(bacteroides)、双歧杆菌属(bifidobacterium)、短杆菌属(brevibacteria)、梭菌属(clostridium)、肠球菌属(enterococcus)、大肠杆菌(escherichiacoli)、乳杆菌属(lactobacillus)、乳球菌属(lactococcus)、酵母属(saccharomyces)和葡萄球菌属(staphylococcus),例如凝结芽孢杆菌(bacilluscoagulans)、枯草芽孢杆菌(bacillussubtilis)、脆弱拟杆菌(bacteroidesfragilis)、枯草拟杆菌(bacteroidessubtili)、多形拟杆菌(bacteroidesthetaiotaomicron)、两歧双歧杆菌(bifidobacteriumbifidum)、婴儿双歧杆菌(bifidobacteriuminfantis)、乳双歧杆菌(bifidobacteriumlactis)、长双歧杆菌(bifidobacteriumlongum)、丁酸梭菌(clostridiumbutyricum)、屎肠球菌(enterococcusfaecium)、嗜酸乳杆菌(lactobacillusacidophilus)、保加利亚乳杆菌(lactobacillusbulgaricus)、干酪乳杆菌(lactobacilluscasei)、约翰逊氏乳杆菌(lactobacillusjohnsonii)、副干酪乳杆菌(lactobacillusparacasei)、植物乳杆菌(lactobacillusplantarum)、罗伊乳杆菌(lactobacillusreuteri)、鼠李糖乳杆菌(lactobacillusrhamnosus)、乳酸乳球菌(lactococcuslactis)和鲍氏酵母菌(saccharomycesboulardii)(sonnenborn等,2009;dinleyici等,2014;美国专利号6,835,376;美国专利号6,203,797;美国专利号5,589,168;美国专利号7,731,976)。天然病原性细菌可以被遗传工程化为提供降低或消除致病性。
“益生菌”用于指活的、非病原性微生物,例如细菌,其可以对包含适当量该微生物的宿主生物体赋予健康益处。在一些实施方案中,宿主生物体是哺乳动物。在一些实施方案中,宿主生物体是人类。目前,非病原性细菌的一些物种、菌株和/或亚型被认为是益生菌。益生细菌的实例包括但不限于双歧杆菌属、大肠杆菌、乳杆菌属和酵母属,例如双歧双歧杆菌、屎肠球菌、大肠杆菌菌株nissle、嗜酸乳杆菌、保加利亚乳杆菌、副干酪乳杆菌、植物乳杆菌和鲍氏酵母菌(dinleyici等,2014;美国专利号5,589,168;美国专利号6,203,797;美国专利6,835,376)。益生菌可以是细菌的变体或突变菌株(arthur等,2012;cuevas-ramos等,2010;olier等,2012;nougayrede等,2006)。非病原性菌可以被遗传工程化为增强或改善所需的生物学特性,例如存活力(survivability)。非病原性细菌可以被遗传工程化为提供益生菌特性。益生细菌可以被遗传工程化为增强或改善益生菌特性。
如本文使用的,“稳定维持的”或“稳定的”细菌用于指携带非天然遗传物质例如反馈抗性arga基因、突变体精氨酸阻遏物和/或其他突变体精氨酸调节子的细菌宿主细胞,所述非天然遗传物质被掺入到宿主基因组中或在自身复制的染色体外质粒上繁殖,使得非天然遗传物质被保留、表达和繁殖。稳定的细菌能够在体外例如在培养基,和/或在体内例如在消化道中存活和/或生长。例如,稳定的细菌可以是包含argafbr基因的遗传工程化的细菌,其中携带argafbr基因的质粒或染色体稳定地被维持在细菌中,使得argafbr可以在细菌中表达,且细菌能够在体外和/或在体内存活和/或生长。
如本文使用的,术语“治疗”及其同源词指疾病或紊乱或其至少一种可辨别的症状的改善。在另一个实施方案中,“治疗”指至少一个可测量的物理参数的改善(不必由患者可辨别)。在另一个实施方案中,“治疗”指物理地(例如,可辨别症状的稳定)、生理上(例如,物理参数的稳定)或两者抑制疾病或紊乱的进展。在另一个实施方案中,“治疗”指减缓疾病或紊乱的进展或者逆转疾病或紊乱的进展。如本文使用的,“预防”及其同源词指延迟给定疾病或紊乱的发作或降低获得给定疾病或紊乱的风险。
需要治疗的个体可包括已具有特定医学紊乱的个体,以及处于具有该紊乱的风险的个体或可最终获得该紊乱的个体。通过以下评价治疗需要:例如,与紊乱的发展相关的一种或更多种危险因素的存在、紊乱的存在或进展或具有该紊乱的受试者对治疗的可能接受性。原发性高氨血症是由于ucd引起的,这些ucd是常染色体隐性或x连锁的先天的代谢错误,对其没有已知的治愈。高氨血症也可继发于尿素循环的其他破坏,例如毒性代谢物、感染和/或底物缺乏。治疗高氨血症可以包括降低或消除过量的氨和/或相关症状,并不一定包括消除潜在的高氨血症相关紊乱。
如本文使用的,“药物组合物”指本发明的遗传工程化的细菌与其他成分诸如生理上合适的载体和/或赋形剂的制剂。
可互换使用的措辞“生理上可接受的载体”和“药学上可接受的载体”指不会对生物体引起显著刺激并且不会消除所施用的细菌化合物的生物学活性和特性的载体或稀释剂。这些措辞包括佐剂。
术语“赋形剂”指被添加至药物组合物中以进一步促进活性成分施用的惰性物质。实例包括但不限于碳酸氢钙、磷酸钙、多种糖和淀粉类型、纤维素衍生物、明胶、植物油、聚乙二醇和表面活性剂,包括例如聚山梨醇酯20。
术语“治疗有效剂量”和“治疗有效量”用于指导致状况(例如高氨血症)的症状发作的预防、延迟或者状况(例如高氨血症)的症状改善的化合物的量。治疗有效量可以例如足以治疗、预防、降低与升高的氨浓度相关的紊乱的严重程度、延迟与升高的氨浓度相关的紊乱的发作和/或降低发生与升高的氨浓度相关的紊乱的一种或更多种症状的风险。治疗有效量以及治疗有效的施用频率可以通过本领域已知的并在以下讨论的方法来确定。
除非另有明确相反指示,否则如本文使用的冠词“一(a)”和“一(an)”应理解为意指“至少一个”。
当在列表中的要素之间使用时,措辞“和/或”意图意指(1)仅存在单个列出的要素,或(2)存在多于一个的列表的要素。例如,“a、b和/或c”指示,选择可以为单独的a;单独的b;单独的c;a和b;a和c;b和c;或a、b和c。措辞“和/或”可以与列表中的“至少一个”或“一个或更多个”要素互换使用。
细菌
本发明的遗传工程化的细菌能够降低过量的氨并将氨和/或氮转化为旁路副产物。在一些实施方案中,遗传工程化的细菌是非病原性细菌。在一些实施方案中,遗传工程化的细菌是共生细菌。在一些实施方案中,遗传工程化的细菌是益生细菌。在一些实施方案中,遗传工程化的细菌是经修饰或突变为降低或消除致病性的天然病原性细菌。示例性细菌包括但不限于芽孢杆菌属、拟杆菌属、双歧杆菌属、短杆菌属、梭菌属、肠球菌属、大肠杆菌、乳杆菌属、乳球菌属、酵母属和葡萄球菌属,例如凝结芽孢杆菌、枯草芽孢杆菌、脆弱拟杆菌、枯草拟杆菌、多形拟杆菌、两歧双歧杆菌、婴儿双歧杆菌、乳双歧杆菌、长双歧杆菌、丁酸梭菌、屎肠球菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、约翰逊氏乳杆菌、副干酪乳杆菌、植物乳杆菌、罗伊乳杆菌、鼠李糖乳杆菌、乳酸乳球菌和鲍氏酵母菌。在某些实施方案中,遗传工程化的细菌选自以下组成的组:脆弱拟杆菌、多形拟杆菌、枯草芽孢杆菌、两歧双歧杆菌、婴儿双歧杆菌、乳双歧杆菌、丁酸梭菌、大肠杆菌nissle、嗜酸乳杆菌、植物乳杆菌、罗伊乳杆菌、以及乳酸乳球菌。
在一些实施方案中,遗传工程化的细菌是大肠杆菌菌株nissle1917(e.colinissle),一种“已演化为最佳表征的益生菌之一”(ukena等,2007)的肠杆菌科(enterobacteriaceae)的革兰氏阴性细菌。该菌株的特征在于其完全无害(schultz,2008),并且具有gras(遗传上认为是安全的(generallyrecognizedassafe)状态(reister等,2014,加了着重)。基因组测序证实,大肠杆菌nissle缺乏突出的毒力因子(例如,大肠杆菌α-溶血素、p-菌毛粘附素(p-fimbrialadhesin))(schultz,2008)。另外,已经显示大肠杆菌nissle不携带病原性粘附因子,不产生任何肠毒素或细胞毒素,不是侵入性的,而且不是尿道病原性的(uropathogenic)(sonnenborn等,2009)。早在1917年,大肠杆菌nissle被包装为药物胶囊(称为mutaflor)用于治疗用途。从那时起,大肠杆菌nissle已被用于体内治疗人类中的溃疡性结肠炎(rembacken等,1999),用于体内治疗人类炎性肠病、克罗恩病和储袋炎(pouchitis)(schultz,2008),并在体外抑制肠侵入性沙门氏菌属(salmonella)、军团菌属(legionella)、耶尔森氏菌属(yersinia)和志贺氏菌属(shigella)(altenhoefer等,2004)。普遍认为,大肠杆菌nissle的治疗功效和安全性已得到令人信服地证实(ukena等,2007)。
本领域普通技术人员将理解,本文公开的遗传修饰可以被修改并适用于细菌的其他物种、菌株和亚型。例如,已知精氨酸介导的调节在非常趋异的细菌,即革兰氏阴性细菌诸如大肠杆菌、肠道沙门氏菌鼠伤寒血清型(salmonellaentericaserovartyphimurium)、栖热孢菌属(thermotoga)和moritellaprofunda以及革兰氏阳性细菌,诸如枯草芽孢杆菌、嗜热脂肪地芽孢杆菌(geobacillusstearothermophilus)和棒状链霉菌(streptomycesclavuligerus)以及其他细菌中显著良好保守(nicoloff等,2004)。此外,精氨酸阻遏物在细菌基因组中普遍保守,且其识别信号(arg盒)(弱回文序列(palindrome))也在基因组之间保守(makarova等,2001)。
未修饰的大肠杆菌nissle和本发明的遗传工程化的细菌可例如被消化道或血清中的防御因子(sonnenborn等,2009)破坏。细菌在体内的停留时间可以使用实施例19中描述的方法确定。在一些实施方案中,为人类受试者计算停留时间。提供了使用包含野生型argr和野生型精氨酸调节子的链霉素抗性的大肠杆菌nissle的非限制性实例(参见图27)。在一些实施方案中,计算本发明的遗传工程化的细菌的体内停留时间。
降低过量的氨
精氨酸生物合成途径
在诸如大肠杆菌(e.coli)的细菌中,精氨酸生物合成途径能够在包括酶n-乙酰谷氨酸合成酶、n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的八步酶促法中将谷氨酸转化为精氨酸(cunin等,1986)。前五个步骤包括n-乙酰化以产生鸟氨酸前体。在第六步中,鸟氨酸转氨甲酰酶(也称为鸟氨酸氨甲酰转移酶)催化瓜氨酸的形成。最后两个步骤包括氨甲酰磷酸盐利用以由瓜氨酸产生精氨酸。
在一些细菌,例如嗜热脂肪芽孢杆菌(bacillusstearothermophilus)和淋病奈瑟氏菌(neisseriagonorrhoeae)中,精氨酸生物合成中的第一步和第五步可以由双功能性酶鸟氨酸乙酰转移酶催化。最初当大肠杆菌中鸟氨酸乙酰转移酶(argj)被证明补充n-乙酰谷氨酸合成酶(arga)和n-乙酰鸟氨酸酶(arge)两者营养缺陷型基因突变时,鉴定了这种双功能性(mountain等,1984;crabeel等1997)。
arga编码n-乙酰谷氨酸合成酶,argb编码n-乙酰谷氨酸激酶,argc编码n-乙酰谷氨酰磷酸还原酶,argd编码乙酰鸟氨酸氨基转移酶,arge编码n-乙酰鸟氨酸酶,argf编码鸟氨酸转氨甲酰酶,argi也编码鸟氨酸转氨甲酰酶,argg编码精氨基琥珀酸合酶,argh编码精氨基琥珀酸裂合酶,且argj编码鸟氨酸乙酰转移酶。cara编码具有谷氨酰胺酶活性的氨甲酰磷酸合酶的小a亚基,且carb编码氨甲酰磷酸合酶的大b亚基,其催化从氨合成氨甲酰磷酸。这些精氨酸生物合成基因(即arga、argb、argc、argd、arge、argf、argg、argh、argi、argj、cara和carb)中的一种或更多种的不同组合,可以天然地或合成地被组织为一种或更多种操纵子,并且此类组织可以在细菌物种、菌株和亚型之间变化(参见,例如,表2)。每种操纵子的调节区域包含至少一种arg盒,且每调节区域arg盒的数目可以在操纵子和细菌之间变化。
编码这些酶的所有基因经由精氨酸与argr的相互作用以形成与每种基因的调节区域结合并抑制转录的复合物来经历精氨酸的阻遏。n-乙酰谷氨酸合成酶也在蛋白水平上经历单独的精氨酸的变构反馈抑制(tuchman等,1997;caldara等,2006;caldara等,2008;caldovic等,2010)。
调节细菌中精氨酸生物合成的基因跨越染色体散布并被组织为由单种阻遏物控制的多种操纵子,所述阻遏物被maas和clark(1964)称之为“调节子”。每种操纵子由包含与启动子重叠并且阻遏物蛋白与其结合的至少一个18个核苷酸不完全回文序列(称为arg盒)的调节区域调节(tian等,1992;tian等,1994)。argr基因编码阻遏物蛋白,其结合一种或更多种arg盒(lim等,1987)。精氨酸作为活化精氨酸阻遏物的共同阻遏物起作用。调节每种操纵子的arg盒可以不相同,且共有arg盒序列是a/tntgaata/ta/tt/at/aattcant/a(maas,1994)。另外,argr的调节区域包含两种启动子,其中一种启动子与两种arg盒重叠并且被自动调节。
在一些实施方案中,遗传工程化的细菌包含突变体精氨酸调节子并比在相同条件下的相同亚型的未修饰的细菌产生更多的精氨酸和/或中间副产物例如瓜氨酸。突变体精氨酸调节子包含一种或更多种核酸突变,所述一种或更多种核酸突变经由对arg盒的argr结合和/或对n-乙酰谷氨酸合成酶的精氨酸结合降低或阻止精氨酸介导的对编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸的酶的一种或更多种操纵子的阻遏,由此增强精氨酸和/或中间副产物生物合成。
在替代实施方案中,细菌经遗传工程化为经由另一种代谢途径消耗过量的氨,所述另一种代谢途径例如组氨酸生物合成途径、甲硫氨酸生物合成途径、赖氨酸生物合成途径、天冬酰胺生物合成途径、谷氨酰胺生物合成途径和色氨酸生物合成途径。
组氨酸生物合成途径
组氨酸生物合成例如由位于大肠杆菌中的单种操纵子内的8种基因进行。操纵子的八种基因中的三种(hisd、hisb和hisi)编码双功能性酶,且两种(hish和hisf)编码多肽链,其一起形成一种酶以催化单个步骤,总计进行10种酶促反应(alifano等,1996)。hisg基因的产物atp磷酸核糖基转移酶在蛋白水平被组氨酸抑制。在一些实施方案中,本发明的遗传工程化的细菌包含反馈抗性hisg。可以使用本领域已知的技术将细菌诱变和/或筛选用于反馈抗性hisg突变体。被工程化为包含反馈抗性hisg的细菌将具有升高的组氨酸产生水平,从而增加氨消耗并降低高氨血症。可选地,组氨酸生物合成所需的一种或更多种基因可以被置于诱导型启动子诸如fnr诱导型启动子的控制下,并允许增加限速酶的产生。对组氨酸生物合成途径的任何其他合适的修饰可用于增加氨消耗。
甲硫氨酸生物合成途径
细菌甲硫氨酸调节子控制由高丝氨酸三步(即酰化、磺酰化和甲基化)合成甲硫氨酸。metj基因编码调节蛋白,其当与甲硫氨酸或其衍生物组合时,引起在甲硫氨酸调节子内的基因在转录水平的阻遏(saint-girons等,1984;shoeman等,1985)。在一些实施方案中,本发明的遗传工程化的细菌包括缺失的、破坏的或突变的metj。被工程化为缺失、破坏或突变metj的细菌将具有升高的甲硫氨酸产生水平,从而增加氨消耗并降低高氨血症。对甲硫氨酸生物合成途径的任何其他合适的修饰可用于增加氨消耗。
赖氨酸生物合成途径
微生物通过两种途径之一合成赖氨酸。二氨基庚二酸(diaminopimelate)(dap)途径用于由天冬氨酸和丙酮酸合成赖氨酸(dogovski等,2012),且氨基己二酸途径用于由α-酮戊二酸和乙酰辅酶a合成赖氨酸。二氢吡啶二羧酸合酶(dhdps)酶催化dap途径的第一步,并经历赖氨酸的反馈抑制(liu等,2010;reboul等,2012)。在一些实施方案中,本发明的遗传工程化的细菌包含反馈抗性dhdps。被工程化为包含反馈抗性dhdps的细菌将具有升高的赖氨酸产生水平,从而增加氨消耗并降低高氨血症。可选地,可以通过将赖氨酸生物合成所需的一种或更多种基因置于诱导型启动子诸如fnr诱导型启动子的控制下来优化赖氨酸生产。对赖氨酸生物合成途径的任何其他合适的修饰可用于增加氨消耗。
天冬酰胺生物合成途径
天冬酰胺分别经由草酰乙酸转氨酶和天冬酰胺合成酶直接由草酰乙酸和天冬氨酸合成。在该途径的第二步中,l-谷氨酰胺或氨用作氨基基团供体。在一些实施方案中,本发明的遗传工程化的细菌与在相同条件下的相同亚型的未修饰的细菌相比过度产生天门冬酰胺,由此消耗过量的氨并降低高氨血症。可选地,可以通过将这些基因中的一种或两种置于诱导型启动子诸如fnr诱导型启动子的控制下来优化天冬酰胺合成。对天冬酰胺生物合成途径的任何其他合适的修饰可用于增加氨的消耗。
谷氨酰胺生物合成途径
由氨和酮戊二酸合成谷氨酰胺和谷氨酸被三种酶进行严格调节。谷氨酸脱氢酶在单一步骤中催化酮戊二酸的还原胺化产生谷氨酸。谷氨酰胺合成酶催化谷氨酸和氨的atp依赖性缩合形成谷氨酰胺(lodeiro等,2008)。谷氨酰胺合成酶也与谷氨酰胺-酮戊二酸氨基转移酶(也称为谷氨酸合酶)一起在循环反应中起作用由谷氨酰胺和酮戊二酸产生谷氨酸。在一些实施方案中,本发明的遗传工程化的细菌与在相同条件下的相同亚型的未修饰的细菌相比,表达在升高水平的谷氨酰胺合成酶。被工程化为具有增加的谷氨酰胺合成酶表达的细菌将具有升高的谷氨酰胺产生水平,从而增加氨的消耗并降低高氨血症。可选地,可以修饰谷氨酸脱氢酶和/或谷氨酰胺-酮戊二酸氨基转移酶的表达以有利于氨的消耗。由于谷氨酰胺合成酶的产生在转录水平受氮调节(feng等,1992;vanheeswijk等,2013),将谷氨酰胺合成酶基因置于不同诱导型启动子诸如fnr诱导型启动子的控制下,也可用于改善谷氨酰胺产生。对谷氨酰胺和谷氨酸生物合成途径的任何其他合适的修饰可用于增加氨的消耗。
色氨酸生物合成途径
在大多数细菌中,由分支酸前体合成色氨酸所需的基因被组织为单种转录单元,即trp操纵子。当高水平的色氨酸存在时,trp操纵子在由色氨酸阻遏物(trpr)抑制的单种启动子的控制下。在高水平的带电色氨酸trna的存在下,trp操纵子的转录也可被终止。在一些实施方案中,本发明的遗传工程化的细菌包含缺失的、破坏的或突变的trpr基因。trpr基因的缺失、破坏或突变以及随后的trpr功能失活将导致色氨酸产生和氨消耗两者水平升高。可选地,色氨酸生物合成所需的一种或更多种酶可被置于诱导型启动子诸如fnr诱导型启动子的控制下。对色氨酸生物合成途径的任何其他合适的修饰可用于增加氨消耗。
包含突变体精氨酸调节子的工程化细菌
在一些实施方案中,遗传工程化的细菌包含精氨酸生物合成途径并能够降低过量的氨。在更具体的方面,遗传工程化的细菌包含其中编码精氨酸生物合成酶的一种或更多种操纵子被去阻遏的突变体精氨酸调节子以比在相同条件下的相同亚型的未修饰的细菌相比产生更多的精氨酸或中间副产物例如瓜氨酸。在一些实施方案中,遗传工程化的细菌过度产生精氨酸。在一些实施方案中,遗传工程化的细菌过度产生瓜氨酸;这可以是另外有益的,因为瓜氨酸目前用作特定尿素循环障碍的治疗剂(美国国家尿素循环障碍基金会)。在一些实施方案中,遗传工程化的细菌在精氨酸生物合成途径中过度产生旁路中间副产物,诸如本文所述的任何中间体。在一些实施方案中,遗传工程化的细菌通过比在相同条件下的相同细菌亚型的未修饰细菌产生更多的精氨酸、瓜氨酸和/或其他中间副产物来消耗过量的氨。精氨酸和/或中间副产物生物合成的增强可用于将体内过量的氮掺入无毒分子中,以便治疗与高氨血症相关的状况(包括尿素循环障碍和肝性脑病)。
本领域技术人员将理解,操纵子内的精氨酸生物合成基因的组织跨越细菌的物种、菌株和亚型而变化,例如在大肠杆菌k12中的双极argecbh、枯草芽孢杆菌中的argcaebd-carab-argf、以及植物乳杆菌中的双极carab-argcjbdf。来自不同细菌的操纵子组织的非限制性实例示于表2中(在一些情况下,基因是通过与大肠杆菌中的已知序列的序列同源性推定和/或鉴定的;在一些情况下,并非精氨酸调节子中的所有基因是已知的和/或如下示出的)。在某些情况下,精氨酸生物合成酶跨越细菌的物种、菌株和亚型而变化。
表2:arg操纵子组织的实例
每种操纵子由包含至少一种启动子和至少一种arg盒的调节区域调节,所述arg盒控制所述操纵子中精氨酸生物合成基因的阻遏和表达。
在一些实施方案中,本发明的遗传工程化的细菌包含精氨酸调节子,所述精氨酸调节子包含一种或更多种核酸突变,所述一种或更多种核酸突变降低或消除精氨酸介导的对编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸和/或中间副产物的酶的一种或更多种操纵子的阻遏。降低或消除精氨酸介导的阻遏可以通过降低或消除argr阻遏物结合(例如,通过突变或缺失精氨酸阻遏物或通过突变编码精氨酸生物合成酶的每种操纵子的至少一种arg盒)和/或对n-乙酰谷氨酸合成酶的精氨酸结合(例如,通过突变n-乙酰谷氨酸合成酶为产生精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr)来实现。
arg盒
在一些实施方案中,遗传工程化的细菌包含在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶和氨甲酰磷酸合酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,由此使调节子去阻遏并增强精氨酸和/或中间副产物生物合成。在一些实施方案中,遗传工程化的细菌包含突变体精氨酸阻遏物,所述突变体精氨酸阻遏物包含一种或更多种核酸突变,使得精氨酸阻遏物功能被减少或失活,或遗传工程化的细菌不具有精氨酸阻遏物(例如,精氨酸阻遏物基因已被缺失),导致调节子的去阻遏和精氨酸和/或中间副产物生物合成的增强。在这些实施方案中的任一个中,遗传工程化的细菌还可以包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。因此,在一些实施方案中,遗传工程化的细菌包含在用于编码精氨酸生物合成酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。在一些实施方案中,遗传工程化的细菌包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体例如argafbr,在用于编码精氨酸生物合成酶和/或突变或缺失的精氨酸阻遏物的每种操纵子的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子。
在一些实施方案中,遗传工程化的细菌编码精氨酸反馈抗性n-乙酰谷氨酸合酶,并且还包含在用于编码n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、氨甲酰磷酸合酶和野生型n-乙酰谷氨酸合酶的操纵子中的每种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,使得argr结合被降低或消除,由此去阻遏调节子并增强精氨酸和/或中间副产物生物合成。
在一些实施方案中,用于编码精氨基琥珀酸合酶(argg)的操纵子的arg盒维持与argr结合的能力,由此驱动瓜氨酸生物合成。例如,编码精氨基琥珀酸合酶(argg)的操纵子的调节区域可以是组成型,由此驱动精氨酸的生物合成。在替代实施方案中,一种或更多种替代操纵子的调节区域可以是组成型的。然而,在某些细菌中,编码多种酶的基因可被组织在双极操纵子中或在共有的调节区域的控制下;在这些情况下,调节区域可能需要被解卷积(deconvoluted)以构建组成型活跃的调节区域。例如,在大肠杆菌k12和nissle中,arge和argcbh被组织在两个双极操纵子argecbh中,并且可以使那些调节区域解卷积,以便产生arge和/或argcbh的组成型形式。
在一些实施方案中,包含精氨酸生物合成基因的一种或更多种操纵子中的所有arg盒被突变为降低或消除argr结合。在一些实施方案中,编码精氨酸生物合成酶的一种或更多种操纵子中的所有arg盒被突变为降低或消除argr结合。在一些实施方案中,包含精氨酸生物合成基因的每种操纵子中的所有arg盒被突变为降低或消除argr结合。在一些实施方案中,编码精氨酸生物合成酶的每种操纵子中的所有arg盒被突变为降低或消除argr结合。
在一些实施方案中,遗传工程化的细菌编码由argr阻遏型调节区域驱动的精氨酸反馈抗性n-乙酰谷氨酸合酶、精氨基琥珀酸合酶,并且还包含在用于编码n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、氨甲酰磷酸合酶和任选地野生型n-乙酰谷氨酸合成酶的操纵子的每一种的每种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,使得argr结合被降低或消除,由此使调节子去阻遏并增强瓜氨酸生物合成。在一些实施方案中,能够产生瓜氨酸的遗传工程化的细菌是特别有利的,因为瓜氨酸还用作治疗某些尿素循环障碍的治疗有效的补充物(美国国家尿素循环障碍基金会)。
在一些实施方案中,遗传工程化的细菌编码由组成型启动子驱动的精氨酸反馈抗性n-乙酰谷氨酸合酶、精氨基琥珀酸合酶,并且还包含在用于编码n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸裂合酶、氨甲酰磷酸合酶和任选地野生型n-乙酰谷氨酸合成酶的每种操纵子的每种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,使得argr结合被降低或消除,由此使调节子去阻遏并增强精氨酸生物合成。
在一些实施方案中,遗传工程化的细菌包含突变体精氨酸调节子和反馈抗性arga,并且当精氨酸反馈抗性arga被表达时,能够比在相同条件下的相同亚型的未修饰的细菌产生更多精氨酸和/或中间副产物。
精氨酸阻遏物结合位点(arg盒)
在一些实施方案中,遗传工程化的细菌另外包含在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸转氨甲酰酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶和氨甲酰磷酸合酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,使得精氨酸调节子去阻遏,且精氨酸和/或中间副产物例如瓜氨酸的生物合成得到增强。
在一些实施方案中,突变体精氨酸调节子包含编码鸟氨酸乙酰转移酶的操纵子和用于所述操纵子的至少一种arg盒中的一种或更多种核酸突变。一种或更多种核酸突变导致回文arg盒序列的破坏,使得对与在相同条件下的相同亚型的细菌中的未修饰的arg盒和调节区域的argr结合相比,对操纵子的该arg盒和调节区域的argr结合被降低或消除。在一些实施方案中,在argr结合期间被保护免受dna甲基化和羟基自由基攻击的核酸是用于破坏argr结合的突变的主要靶。在一些实施方案中,突变体精氨酸调节子在用于编码以上描述的精氨酸生物合成酶的操纵子的每一种的一种或更多种arg盒中包含至少三种核酸突变。arg盒与启动子重叠,且在突变体精氨酸调节子中,突变体启动子区域的g/c:a/t比值与野生型启动子区域的g/c:a/t比值相差不多于10%(图6)。启动子保留与非突变启动子足够高的同源性,使得rna聚合酶以足够的亲和力结合以促进转录。
在大肠杆菌nissle中,对于每种精氨酸生物合成操纵子,包含arg盒的野生型基因组序列及其突变体示于图6中。对于示例性野生型序列,arg盒以斜体表示,并且每种基因的起始密码子被
在一些实施方案中,多于一种arg盒可以存在于单种操纵子中。在这些实施方案的一个方面,操纵子中的至少一种arg盒被突变为产生所需的对操纵子的调节区域的降低的argr结合。在这些实施方案的另一方面,操纵子中的arg盒的每一种被突变为产生所需的对操纵子的调节区域的降低的argr结合。例如,大肠杆菌nissle中的carab操纵子包含两种arg盒,并且一种或两种arg盒序列可被突变。大肠杆菌nissle中的argg操纵子包含三种arg盒,且一种、两种或三种arg盒序列可被突变、破坏或缺失。在一些实施方案中,所有三种arg盒序列都被突变、破坏或缺失,并且组成型启动子,例如bba_j23100被插入到argg操纵子的调节区域中。本领域技术人员将理解,每调节区域的arg盒的数目可以跨越细菌而变化,并且arg盒的核苷酸序列可以针对每种操纵子而变化。
在一些实施方案中,对操纵子的突变体arg盒和调节区域的argr结合亲和力比对在相同条件下的相同亚型的细菌中的未修饰的arg盒和调节区域的argr结合亲和力至少低约50%、至少低约60%、至少低约70%、至少低约80%、至少低约90%或至少低约95%。在一些实施方案中,对突变体arg盒和调节区域的降低的argr结合将相关操纵子中的基因的mrna表达增加了至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍或至少约1,500倍。
在一些实施方案中,定量pcr(qpcr)用于扩增、检测和/或定量精氨酸生物合成基因的mrna表达水平。对精氨酸生物合成基因(例如arga、argb、argc、argd、arge、argf、argg、argh、argi、argj、cara和carb)特异性的引物可以被设计并用于根据本领域已知的方法检测样品中的mrna(fraga等,2008)。在一些实施方案中,将荧光团添加至可能包含argmrna的样品反应混合物中,并且使用热循环仪以特定波长的光照射样品反应混合物,并检测随后的荧光团发射。将反应混合物加热并冷却至预定温度持续预定的时间段。在某些实施方案中,加热和冷却重复预定的循环数。在一些实施方案中,将反应混合物加热并冷却至90-100℃、60-70℃和30-50℃持续预定的循环数。在某一个实施方案中,将反应混合物加热并冷却至93-97℃、55-65℃和35-45℃持续预定的循环数。在一些实施方案中,在qpcr的每个循环之后定量积累的扩增子。在其荧光超过阈值的循环数是阈值循环(ct)。对每种样品产生至少一种ct结果,且ct结果可用于确定精氨酸生物合成基因的mrna表达水平。
在一些实施方案中,在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶和氨甲酰磷酸合酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变的遗传工程化的细菌还包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。
在一些实施方案中,遗传工程化的细菌包含arga的反馈抗性形式、以及在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、鸟氨酸乙酰转移酶和氨甲酰磷酸合酶的一种或更多种操纵子的每种arg盒中的一种或更多种核酸突变。
在一些实施方案中,遗传工程化的细菌包含由argr阻遏型调节区域驱动的arga的反馈抗性形式、精氨基琥珀酸合酶、以及在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸裂合酶、鸟氨酸乙酰转移酶和氨甲酰磷酸合酶的操纵子的每一种的每种arg盒中的一种或更多种核酸突变。在这些实施方案中,细菌能够产生瓜氨酸。
在一些实施方案中,遗传工程化的细菌包含由组成型启动子表达的arga的反馈抗性形式、精氨基琥珀酸合酶、以及在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、鸟氨酸乙酰转移酶和氨甲酰磷酸合酶的操纵子的每一种的每种arg盒中的一种或更多种核酸突变。在这些实施方案中,细菌能够产生精氨酸。
表3显示其中一种或更多种核酸突变降低或消除精氨酸介导的对精氨酸操纵子的每一种的阻遏的突变构建体的实例。突变构建体包含由氧水平依赖性启动子例如fnr启动子驱动的arga的反馈抗性形式。每种突变体精氨酸调节子在用于编码n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶、氨甲酰磷酸合酶和野生型n-乙酰谷氨酸合成酶的一种或更多种操纵子的至少一种arg盒中包含一种或更多种核酸突变,使得argr结合被降低或消除,由此增强精氨酸和/或中间副产物生物合成。突变体精氨酸调节子构建体的非限制性实例示于表3中。
表3:arg盒突变体构建体的实例
突变可存在于质粒或染色体上。在一些实施方案中,精氨酸调节子由单种阻遏物蛋白调节。在细菌的特殊物种、菌株和/或亚型中,已经提出,精氨酸调节子可以被两个推定的阻遏物调节(nicoloff等,2004)。因此,在某些实施方案中,本发明的精氨酸调节子由多于一种的阻遏物蛋白调节。
在某些实施方案中,突变体精氨酸调节子在遗传工程化的细菌的一种物种、菌株或亚型中表达。在替代实施方案中,突变体精氨酸调节子在遗传工程化的细菌的两种或更多种物种、菌株和/或亚型中表达。
精氨酸阻遏物(argr)
本发明的遗传工程化的细菌包含精氨酸调节子,所述精氨酸调节子包含一种或更多种核酸突变,所述一种或更多种核酸突变降低或消除精氨酸介导的对编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸和/或中间副产物的酶的一种或更多种操纵子的阻遏。在一些实施方案中,精氨酸介导的阻遏的降低或消除可以通过以下来实现:通过降低或消除argr阻遏物结合,例如通过突变用于编码精氨酸生物合成酶的一种或更多种操纵子的至少一种arg盒(如以上所讨论的)或通过突变或缺失精氨酸阻遏物(在此讨论)和/或通过降低或消除对n-乙酰谷氨酸合成酶的精氨酸结合(例如,通过突变n-乙酰谷氨酸合成酶为产生精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如,argafbr)。
因此,在一些实施方案中,遗传工程化的细菌缺乏功能性的argr阻遏物,并因此降低或消除了精氨酸生物合成操纵子的每一种的argr阻遏物介导的转录阻遏。在一些实施方案中,工程化的细菌包含突变体精氨酸阻遏物,所述突变体精氨酸阻遏物包含一种或更多种核酸突变,使得精氨酸阻遏物功能被降低或失活。在一些实施方案中,遗传工程化的细菌不具有精氨酸阻遏物(例如,精氨酸阻遏物基因已被缺失),导致调节子的去阻遏和精氨酸和/或中间副产物生物合成的增强。在一些实施方案中,通常存在于相应野生型细菌中的功能性argr基因的每个拷贝被一个或更多个核苷酸缺失、插入或取代独立地缺失或使其失活。在一些实施方案中,通常存在于相应野生型细菌中的功能性argr基因的每个拷贝被缺失。
在一些实施方案中,精氨酸调节子由单种阻遏物蛋白调节。在细菌的特殊物种、菌株和/或亚型中,已经提出,精氨酸调节子可以被两种不同的推定的阻遏物调节(nicoloff等,2004)。因此,在某些实施方案中,各自包含不同氨基酸序列的两种不同的argr蛋白在遗传工程化的细菌中被突变或缺失。
在一些实施方案中,包含突变或缺失的精氨酸阻遏物的遗传修饰的细菌另外包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。在一些实施方案中,遗传工程化的细菌包含反馈抗性形式的arga,缺乏任何功能性精氨酸阻遏物,并且能够产生精氨酸。在某些实施方案中,遗传工程化的细菌还缺乏功能性argg并且能够产生瓜氨酸。在一些实施方案中,argr基因在遗传工程化的细菌中被缺失。在一些实施方案中,argr基因被突变为失活argr功能。在一些实施方案中,argg基因在遗传工程化的细菌中被缺失。在一些实施方案中,argg基因被突变为失活argr功能。在一些实施方案中,遗传工程化的细菌包含argafbr和缺失的argr。在一些实施方案中,遗传工程化的细菌包含argafbr、缺失的argr和缺失的argg。在一些实施方案中,缺失的argr和/或缺失的argg从细菌基因组中被缺失,并且argafbr存在于质粒中。在一些实施方案中,缺失的argr和/或缺失的argg从细菌基因组中被缺失,并且argafbr被染色体整合。在一个具体实施方案中,遗传修饰的细菌包含染色体整合的argafbr、缺失的基因组argr和缺失的基因组argg。在另一个具体实施方案中,遗传修饰的细菌包含存在于质粒上的argafbr、缺失的基因组argr和缺失的基因组argg。在缺失argg的任何实施方案中,产生瓜氨酸而不是精氨酸。
在一些实施方案中,在表达arga的反馈抗性形式的条件下,本发明的遗传工程化的细菌与在相同条件下的相同亚型的未修饰细菌相比多产生至少约1.5倍、至少约2倍、至少约10倍、至少约15倍、至少约20倍、至少约30倍、至少约50倍、至少约100倍、至少约200倍、至少约300倍、至少约400倍、至少约500倍、至少约600倍、至少约700倍、至少约800倍、至少约900倍、至少约1,000倍或至少约1,500倍更多的精氨酸、瓜氨酸、其他中间副产物和/或操纵子中基因的转录物。
在一些实施方案中,定量pcr(qpcr)用于扩增、检测和/或定量精氨酸生物合成基因的mrna表达水平。对精氨酸生物合成基因(例如arga、argb、argc、argd、arge、argf、argg、argh、argi、argj、cara和carb)特异性的引物可以被设计并用于根据本领域已知的方法检测样品中的mrna(fraga等,2008)。在一些实施方案中,将荧光团添加至可能包含argmrna的样品反应混合物中,并且使用热循环仪以特定波长的光照射样品反应混合物,并检测随后的荧光团发射。将反应混合物加热并冷却至预定温度持续预定的时间段。在某些实施方案中,加热和冷却重复预定的循环数。在一些实施方案中,将反应混合物加热并冷却至90-100℃、60-70℃和30-50℃持续预定的循环数。在某一个实施方案中,将反应混合物加热并冷却至93-97℃、55-65℃和35-45℃持续预定的循环数。在一些实施方案中,在qpcr的每个循环之后定量积累的扩增子。在其荧光超过阈值的循环数是阈值循环(ct)。对每种样品产生至少一种ct结果,且ct结果可用于确定精氨酸生物合成基因的mrna表达水平。
反馈抗性n-乙酰谷氨酸合成酶
在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。在一些实施方案中,遗传工程化的细菌包含突变体精氨酸调节子,所述突变体精氨酸调节子包含精氨酸反馈抗性arga,并且当精氨酸反馈抗性arga被表达时,能够比在相同条件下的相同亚型的未修饰的细菌产生更多的精氨酸和/或中间副产物。精氨酸反馈抗性n-乙酰谷氨酸合成酶蛋白(argafbr)比来自反馈敏感亲本菌株的酶对l-精氨酸的敏感性显著更低(参见,例如,eckhardt等,1975;rajagopal等,1998)。反馈抗性arga基因可以存在于质粒或染色体上。在一些实施方案中,来自质粒的表达可用于增加argafbr表达。在一些实施方案中,来自染色体的表达可用于增加argafbr表达的稳定性。
在一些实施方案中,本公开内容的任何遗传工程化的细菌在一个或更多个整合位点整合到细菌染色体中。例如,编码精氨酸反馈抗性n-乙酰谷氨酸合酶的序列的一个或更多个拷贝可以整合到细菌染色体中。具有整合到染色体中的精氨酸反馈抗性n-乙酰谷氨酸合酶的多个拷贝允许更大量的n-乙酰谷氨酸合酶的产生,并且还允许微调表达水平。可选地,除了精氨酸反馈抗性n-乙酰谷氨酸合酶以外,本文描述的不同回路,诸如任何杀死开关回路可以以一个或更多个不同的整合位点整合到细菌染色体中,以进行多种不同的功能。
多种不同的反馈抗性n-乙酰谷氨酸合成酶蛋白是本领域已知的,并且可以被组合在遗传工程化的细菌中。在一些实施方案中,argafbr基因在组成型启动子的控制下表达。在一些实施方案中,argafbr基因在由外源环境条件诱导的启动子的控制下表达。在一些实施方案中,外源环境条件对哺乳动物的消化道是特异性的。在一些实施方案中,外源环境条件是对哺乳动物消化道特异性的分子或代谢物,例如丙酸酯或胆红素。在一些实施方案中,外源环境条件是低氧或厌氧条件,诸如哺乳动物消化道的环境。
细菌已经演化出能够感测氧水平的转录因子。不同的信号转导途径可以由不同的氧水平触发并且以不同的动力学发生。氧水平依赖性启动子是一种或更多种氧水平感测转录因子能够结合的核酸序列,其中相应转录因子的结合和/或活化活化下游基因表达。在一个实施方案中,argafbr基因在氧水平依赖性启动子的控制下。在更具体的方面,argafbr基因处于在低氧或厌氧环境(诸如哺乳动物消化道的环境)下活化的氧水平依赖性启动子的控制下。
在某些实施方案中,遗传工程化的细菌包含在富马酸盐和硝酸盐还原酶调节物(fnr)启动子的控制下表达的argafbr。在大肠杆菌中,fnr是控制从需氧至厌氧代谢开关的主要转录活化因子(unden等,1997)。在厌氧状态下,fnr二聚化为活性dna结合蛋白,其活化数百个负责适应厌氧生长的基因。在需氧状态下,fnr被氧阻止二聚化并且是失活的。在替代实施方案中,遗传工程化的细菌包含在旁路氧水平依赖性启动子的控制下表达的argafbr,所述启动子例如精氨酸脱亚氨酶(deiminiase)和硝酸盐还原的厌氧调节anr启动子(ray等,1997)、异化硝酸盐呼吸调节物(dissimilatorynitraterespirationregulator)dnr启动子(trunk等,2010)。在这些实施方案中,精氨酸生物合成途径在低氧或厌氧环境(例如在消化道)中被特别活化。
在铜绿假单胞菌(p.aeruginosa)中,精氨酸脱亚氨酶和硝酸盐还原(anr)转录调节物的厌氧调节是“在氧限制或厌氧条件下诱导型的生理功能的表达所必需的”(winteler等,1996;sawers1991)。铜绿假单胞菌anr与大肠杆菌fnr同源,且“共有fnr位点(ttgat----atcaa)被anr和fnr有效识别”(winteler等,1996)。像fnr一样,在厌氧状态下,anr活化许多负责适应厌氧生长的基因。在需氧状态下,anr是失活的。荧光假单胞菌(pseudomonasfluorescens)、恶臭假单胞菌(pseudomonasputida)、丁香假单胞菌(pseudomonassyringae)和门多萨假单胞菌(pseudomonasmendocina)都具有anr的功能类似物(zimmermann等,1991)。由anr调节的启动子是本领域已知的,例如arcdabc操纵子的启动子(参见,例如,hasegawa等,1998)。
fnr家族还包括异化硝酸盐呼吸调节物(dnr)(arai等,1995),即一种与anr联合用于“铜绿假单胞菌厌氧硝酸盐呼吸”所需的转录调节物(hasegawa等,1998)。对于某些基因,fnr结合基序“仅可能被dnr识别”(hasegawa等,1998)。可以使用由外源环境条件和相应的调节区域控制的任何合适的转录调节物。非限制性实例包括arca/b、resd/e、nrea/b/c和airsr,且其他是本领域已知的。
在一些实施方案中,argafbr在诱导型启动子的控制下表达,所述诱导型启动子响应于环境例如哺乳动物的消化道中的特定分子或代谢物。例如,短链脂肪酸丙酸酯是定位于消化道的主要微生物发酵代谢物(hosseini等,2011)。在一个实施方案中,argafbr基因表达在丙酸酯诱导型启动子的控制下。在更具体的实施方案中,argafbr基因表达在丙酸酯诱导型启动子的控制下,所述丙酸酯诱导型启动子被哺乳动物肠中丙酸酯的存在活化。在健康和/或疾病状态下的哺乳动物消化道中发现的任何分子或代谢物可用于诱导argafbr表达。非限制性实例包括丙酸酯、胆红素、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、凝血因子ii、vii、ix和x、碱性磷酸酶、γ谷氨酰转移酶、肝炎抗原和抗体、α甲胎蛋白、抗线粒体、平滑肌和抗核抗体、铁、转铁蛋白、铁蛋白、铜、血浆铜蓝蛋白、氨和锰。在替代实施方案中,argafbr基因表达在pbad启动子的控制下,其在糖阿拉伯糖存在下被活化(参见,例如,图18)。
具有肝性脑病(he)和其他肝脏疾病或紊乱的受试者具有慢性肝损伤,这导致其血液和肠中的氨水平高。除了氨以外,这些患者在其血液和肠中还具有升高水平的胆红素、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、凝血因子ii、vii、ix和x、碱性磷酸酶、γ谷氨酰转移酶、肝炎抗原和抗体、α甲胎蛋白、抗线粒体、平滑肌和抗核抗体、铁、转铁蛋白、铁蛋白、铜、铜血浆蓝蛋白、氨和锰。响应于这些he相关分子之一或其代谢物的启动子可用于工程化将仅在he患者的肠中被诱导表达argafbr的本公开内容的细菌。这些启动子将不被预期在ucd患者中被诱导。
在一些实施方案中,argafbr基因在通过暴露于四环素被诱导的启动子的控制下表达。在一些实施方案中,通过本领域已知的方法进一步优化基因表达,例如通过优化核糖体结合位点,操作转录调节物和/或增加mrna稳定性。
在一些实施方案中,当精氨酸反馈抗性n-乙酰谷氨酸合成酶具有活性时,与来自在相同条件下的相同亚型的细菌的野生型n-乙酰谷氨酸合成酶相比,遗传工程化的细菌中n-乙酰谷氨酸合成酶的精氨酸反馈抑制被降低了至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约95%。
在一些实施方案中,遗传工程化的细菌包含携带argafbr基因的稳定维持的质粒或染色体,使得argafbr可以在宿主细胞中表达,并且宿主细胞能够在体外例如在培养基中和/或在体内例如消化道中存活和/或生长。在一些实施方案中,细菌可以包含反馈抗性arga基因的多个拷贝。在一些实施方案中,反馈抗性arga基因在低拷贝质粒上表达。在一些实施方案中,低拷贝质粒可用于增加表达的稳定性。在一些实施方案中,低拷贝质粒可用于减少在非诱导条件下的渗漏表达(leakyexpression)。在一些实施方案中,反馈抗性arga基因在高拷贝质粒上表达。在一些实施方案中,高拷贝质粒可用于增加argafbr表达。在一些实施方案中,反馈抗性arga基因在染色体上表达。在一些实施方案中,细菌被遗传工程化为包括多种作用机制(moa),例如产生相同产物的多个拷贝的回路或进行多个不同功能的回路。插入位点的实例包括但不限于图22中示出的male/k、insb/i、arac/bad、lacz、dapa、cea、及其他。例如,遗传工程化的细菌可以包括插入在四个不同插入位点例如male/k、insb/i、arac/bad和lacz的argafbr的四个拷贝。可选地,遗传工程化的细菌可以包括插入在三个不同插入位点例如male/k、insb/i和lacz的argafbr的三个拷贝,以及插入在三个不同的插入位点dapa、cea和arac/bad的三个突变体精氨酸调节子,例如两个产生瓜氨酸且一个产生精氨酸。
在一些实施方案中,质粒或染色体还包含野生型argr结合位点,例如arg盒。在一些情况下,功能性argr的存在和/或形成可导致在除arg盒以外的位点的靶外(off-target)结合,这可引起基因表达的靶外变化。还包含功能性arg盒的质粒或染色体可用于降低或消除靶外argr结合,即通过作为argr池(sink)。在一些实施方案中,质粒或染色体不包含功能性argr结合位点,例如质粒或染色体包含修饰的arg盒或不包含arg盒。
在一些实施方案中,反馈抗性arga基因存在于质粒上并且被可操作地连接至在低氧或厌氧条件下诱导的启动子。在一些实施方案中,反馈抗性arga基因存在于染色体中并且被可操作地连接至在低氧或厌氧条件下诱导的启动子。在一些实施方案中,反馈抗性arga基因存在于质粒上并且被可操作地连接至由对哺乳动物消化道特异性的分子或代谢物诱导的启动子。在一些实施方案中,反馈抗性arga基因存在于染色体上并且被可操作地连接至由对哺乳动物消化道特异性的分子或代谢物诱导的启动子。在一些实施方案中,反馈抗性arga基因存在于染色体上并且被可操作地连接至通过暴露于四环素诱导的启动子。在一些实施方案中,反馈抗性arga基因存在于质粒上并且被可操作地连接至通过暴露于四环素诱导的启动子。
在一些实施方案中,遗传工程化的细菌包括多种作用机制(moa),例如产生相同产物的多个拷贝的回路(以增强拷贝数)或进行多个不同功能的回路。插入位点的实例包括但不限于图22中示出的male/k、insb/i、arac/bad、lacz、dapa、cea、及其他。
在一些实施方案中,除了相应的氧水平依赖性启动子以外,遗传工程化的细菌还包含变异或突变的氧水平依赖性转录调节物,例如,fnr、anr或dnr。变异或突变的氧水平依赖性转录调节物增加了在低氧或厌氧环境中被可操作地连接的基因的转录。在一些实施方案中,相应的野生型转录调节物保留野生型活性。在替代实施方案中,相应的野生型转录调节物被缺失或突变为降低或消除野生型活性。在某些实施方案中,突变体氧水平依赖性转录调节物是包含增强二聚化和fnr活性的氨基酸取代的fnr蛋白(参见,例如,moore等,2006)。
在一些实施方案中,遗传工程化的细菌包含来自在低氧或厌氧环境中降低和/或消耗氨的不同细菌物种的氧水平依赖性转录调节物其。在某些实施方案中,突变体氧水平依赖性转录调节物是来自淋病奈瑟氏菌(n.gonorrhoeae)的fnr蛋白(参见,例如,isabella等,2011)。在一些实施方案中,相应的野生型转录调节物保持完整并保留野生型活性。在替代实施方案中,相应的野生型转录调节物被缺失或突变为降低或消除野生型活性。
在一些实施方案中,遗传工程化的细菌包含在氧水平依赖性启动子例如fnr启动子的控制下表达的argafbr,以及在如以上讨论的包含一种或更多种arg盒突变的突变体调节区域的控制下表达的野生型arga。在某些实施方案中,遗传工程化的细菌包含在氧水平依赖性启动子例如fnr启动子的控制下表达的argafbr,并且不包含野生型arga。在又其他实施方案中,突变体精氨酸调节子包含在氧水平依赖性启动子例如fnr启动子的控制下表达的argafbr,并且还包含没有任何arg盒突变的野生型arga。
在一些实施方案中,遗传工程化的细菌由质粒和/或染色体表达argafbr。在一些实施方案中,argafbr基因在组成型启动子的控制下表达。在一些实施方案中,argafbr基因在诱导型启动子的控制下表达。在一个实施方案中,argafbr在低氧或厌氧环境下被活化的氧水平依赖性启动子,例如fnr启动子的控制下表达。fnr启动子驱动的argafbr质粒的核酸序列示于图8中,其中fnr启动子序列被加粗且argafbr序列被
fnr启动子序列是本领域已知的,并且任何合适的fnr启动子序列可用于本发明的遗传工程化的细菌中。任何合适的fnr启动子可以与任何合适的反馈抗性arga(示例性序列seqidno:8a)组合。非限制性fnr启动子序列在图7中提供。在一些实施方案中,本发明的遗传工程化的细菌包含以下一种或更多种:seqidno:16、seqidno:17、nirb1启动子(seqidno:18)、nirb2启动子(seqidno:19)、nirb3启动子(seqidno:20)、ydfz启动子(seqidno:21)、融合至强核糖体结合位点的nirb启动子(seqidno:22)、融合至强核糖体结合位点的ydfz启动子(seqidno:23)、fnrs,一种厌氧诱导的小rna基因(fnrs1启动子seqidno:24或fnrs2启动子seqidno:25)、融合至crp结合位点的nirb启动子(seqidno:26)和融合至crp结合位点的fnrs(seqidno:27)。
在一些实施方案中,遗传工程化的细菌包含seqidno:28的核酸序列或其功能性片段。在一些实施方案中,遗传工程化的细菌包含除了冗余的遗传密码以外,与seqidno:28编码相同的多肽的核酸序列。在一些实施方案中,遗传工程化的细菌包含与seqidno:28的dna序列至少约80%、至少约85%、至少约90%、至少约95%、或至少约99%同源的核酸序列,或者除了冗余的遗传密码以外,与seqidno:28编码相同的多肽的核酸序列。
在其他实施方案中,argafbr在融合至转录活化物例如crp的结合位点的氧水平依赖性启动子的控制下表达。crp(环状amp受体蛋白或分解代谢活化蛋白或cap)通过当存在可快速代谢的碳水化合物诸如葡萄糖时阻遏负责吸收、代谢和同化较不利的碳源的基因,在细菌中起主要的调节作用(wu等,2015)。对葡萄糖的这种偏好被称为葡萄糖阻遏,以及碳分解代谢阻遏(deutscher,2008;
精氨酸分解代谢
在实施本发明时的一个重要考虑是确保氨不会作为精氨酸和/或瓜氨酸分解代谢的副产物过度产生。在尿素循环的最终酶促步骤中,精氨酸酶催化精氨酸水解裂解为鸟氨酸和尿素(cunin等,1986)。可以由消化道细菌产生的尿素酶催化尿素裂解为二氧化碳和氨(summerskill,1966;aoyagi等,1966;cunin等,1986)。因此,尿素酶活性可能产生可能“对人类组织有毒性”的氨(konieczna等,2012)。在包括大肠杆菌nissle的一些细菌中,基因arcd编码精氨酸/鸟氨酸反向转运体,这也可释放氨(vanderwauven等,1984;gamper等,1991;meng等,1992)。
asta是参与释放氨的精氨酸为琥珀酸的转化的酶。spea是参与精氨酸为鲱精胺(agmatine)的转化的酶,鲱精胺可进一步被分解代谢产生氨。因此,在一些情况下,防止精氨酸的分解可能是有利的。在一些实施方案中,包含突变体精氨酸调节子的遗传工程化的细菌另外包含降低或消除精氨酸分解代谢的突变,由此降低或消除进一步的氨生产。在一些实施方案中,遗传工程化的细菌还包含降低或消除arcd活性的突变。在某些实施方案中,arcd被缺失。在一些实施方案中,遗传工程化的细菌还包含降低或消除asta活性的突变。在某些实施方案中,asta被缺失。在一些实施方案中,遗传工程化的细菌还包含降低或消除spea活性的突变。在某些实施方案中,spea被缺失。在一些实施方案中,遗传工程化的化的细菌还包含降低或消除精氨酸酶活性的突变。在某些实施方案中,精氨酸酶被缺失。在一些实施方案中,遗传工程化的细菌还包含降低或消除尿素酶活性的突变。在某些实施方案中,尿素酶被缺失。在一些实施方案中,参与精氨酸分解代谢的一种或更多种其他基因被突变或缺失。
必需基因和营养缺陷型
如本文使用的,术语“必需基因”指对细胞生长和/或存活所必需的基因。细菌必需基因是本领域普通技术人员所熟知的,并且可以通过基因的定向缺失和/或随机诱变和筛选来鉴定(参见,例如,zhang和lin,2009,deg5.0,adatabaseofessentialgenesinbothprokaryotesandeukaryotes,nucl.acidsres.,37:d455-d458和gerdes等,essentialgenesonmetabolicmaps,curr.opin.biotechnol.,17(5):448-456,其各自的全部内容通过引用明确地并入本文)。
“必需基因”可取决于生物体在其内生活的情形和环境。例如,必需基因的突变、修饰或切除可导致本公开内容的重组细菌变为营养缺陷型。营养缺陷型修饰旨在使细菌在对存活或生长所必需的外源添加营养物质的不存在下死亡,因为它们缺乏生产该必需营养物质所需的基因。
营养缺陷型修饰旨在使细菌在对存活或生长所必需的外源添加营养物质的不存在下死亡,因为它们缺乏产生该必需营养物质所需的基因。在一些实施方案中,本文描述的任何遗传工程化的细菌还包含对细胞存活和/或生长所需的基因中的缺失或突变。在一个实施方案中,必需基因是dna合成基因,例如thya。在另一个实施方案中,必需基因是细胞壁合成基因,例如dapa。在又另一个实施方案中,必需基因是氨基酸基因,例如sera或meta。可靶向细胞存活和/或生长所需的任何基因,包括但不限于cyse、glna、ilvd、leub、lysa、sera、meta、glya、hisb、ilva、phea、proa、thrc、trpc、tyra、thya、uraa、dapa、dapb、dapd、dape、dapf、flhd、metb、metc、proab和thi1,只要在细菌中不产生相应的野生型基因产物。例如,胸腺嘧啶是细菌细胞生长所需的核酸;在它的不存在下,细菌经历细胞死亡。thya基因编码胸苷酸(thimidylate)合成酶,一种通过将dump转化为dtmp来催化胸腺嘧啶合成中的第一步的酶(sat等,2003)。在一些实施方案中,本公开内容的细菌细胞是thya营养缺陷型,其中thya基因被缺失和/或被不相关基因替代。仅有当例如通过在体外向生长培养基中添加胸腺嘧啶而存在足够量的胸腺嘧啶时,或者在体内人类消化道中天然存在的高胸腺嘧啶水平存在下,thya营养缺陷型才能生长。在一些实施方案中,本公开内容的细菌细胞是在当细菌存在于哺乳动物消化道中时被补充的基因中的营养缺陷型。在没有足够量的胸腺嘧啶的情况下,thya营养缺陷型死亡。在一些实施方案中,营养缺陷型修饰用于确保,细菌细胞在营养缺陷型基因产物的不存在下(例如,肠外)不能存活。
二氨基庚二酸(dap)是在赖氨酸生物合成途径内合成的氨基酸,并且是细菌细胞壁生长所需的(meadow等,1959;clarkson等,1971)。在一些实施方案中,本文描述的任何遗传工程化的细菌是dapd营养缺陷型,其中dapd被缺失和/或被不相关基因替代。仅有当例如通过在体外向生长培养基中添加dap而存在足够量的dap时,dapd营养缺陷型才能生长。在没有足够量的dap的情况下,dapd营养缺陷型死亡。在一些实施方案中,营养缺陷型修饰用于确保,细菌细胞在营养缺陷型基因产物的不存在下(例如,肠外)不能存活。
在其他实施方案中,本公开内容的遗传工程化的细菌是uraa营养缺陷型,其中uraa被缺失和/或被不相关基因替代。uraa基因编码uraa,一种促进嘧啶尿嘧啶(pyrimidineuracil)吸收和随后代谢的膜结合转运蛋白(andersen等,1995)。仅有当例如通过在体外向生长培养基中添加尿嘧啶而存在足够量的尿嘧啶时,uraa营养缺陷型才能生长。在没有足够量的尿嘧啶的情况下,uraa营养缺陷型死亡。在一些实施方案中,营养缺陷型修饰用于确保,细菌在营养缺陷型基因产物的不存在下(例如,肠外)不能存活。
在复杂的群落中,细菌共有dna是可能的。在非常罕见的情形下,营养缺陷型细菌菌株可以从非营养缺陷型菌株接受dna,这修复基因组缺失并永久拯救营养缺陷型。因此,对具有多于一种营养缺陷型的细菌菌株进行工程化可以大大减少dna转运将发生足够多次来拯救营养缺陷型的可能性。在一些实施方案中,本发明的遗传工程化的细菌包含细胞存活和/或生长所需的两种或更多种基因中的缺失或突变。
必需基因的其他实例包括但不限于yhbv、yagg、hemb、secd、secf、ribd、ribe、thil、dxs、ispa、dnax、adk、hemh、lpxh、cyss、fold、rplt、infc、thrs、nade、gapa、yeaz、asps、args、pgsa、yefm、metg、fole、yejm、gyra、nrda、nrdb、folc、accd、fabb、gltx、liga、zipa、dape、dapa、der、hiss、ispg、suhb、tada、acps、era、rnc、ftsb、eno、pyrg、chpr、lgt、fbaa、pgk、yqgd、metk、yqgf、plsc、ygit、pare、ribb、cca、ygjd、tdcf、yral、yiha、ftsn、muri、murb、bira、sece、nusg、rplj、rpll、rpob、rpoc、ubia、plsb、lexa、dnab、ssb、alsk、gros、psd、orn、yjee、rpsr、chps、ppa、vals、yjgp、yjgq、dnac、ribf、lspa、isph、dapb、fola、imp、yabq、ftsl、ftsi、mure、murf、mray、murd、ftsw、murg、murc、ftsq、ftsa、ftsz、lpxc、secm、seca、can、folk、heml、yadr、dapd、map、rpsb、infb、nusa、ftsh、obge、rpma、rplu、ispb、mura、yrbb、yrbk、yhbn、rpsi、rplm、degs、mred、mrec、mreb、accb、accc、yrdc、def、fmt、rplq、rpoa、rpsd、rpsk、rpsm、entd、mrdb、mrda、nadd、hlepb、rpoe、pssa、yfio、rpls、trmd、rpsp、ffh、grpe、yfjb、csra、ispf、ispd、rplw、rpld、rplc、rpsj、fusa、rpsg、rpsl、trps、yrff、asd、rpoh、ftsx、ftse、ftsy、frr、dxr、ispu、rfak、kdta、coad、rpmb、dfp、dut、gmk、spot、gyrb、dnan、dnaa、rpmh、rnpa、yidc、tnab、glms、glmu、wzye、hemd、hemc、yigp、ubib、ubid、hemg、secy、rplo、rpmd、rpse、rplr、rplf、rpsh、rpsn、rple、rplx、rpln、rpsq、rpmc、rplp、rpsc、rplv、rpss、rplb、cdsa、yael、yaet、lpxd、fabz、lpxa、lpxb、dnae、acca、tils、pros、yaff、tsf、pyrh、ola、rlpb、leus、lnt、glns、flda、cyda、infa、cydc、ftsk、lola、sers、rpsa、msba、lpxk、kdsb、mukf、muke、mukb、asns、faba、mvin、rne、yceq、fabd、fabg、acpp、tmk、holb、lolc、lold、lole、purb、ymfk、mine、mind、pth、rsa、ispe、lolb、hema、prfa、prmc、kdsa、topa、riba、fabi、racr、dica、ydfb、tyrs、ribc、ydil、phet、phes、yhhq、bcsb、glyq、yibj和dgpsa。其他必需基因是本领域普通技术人员已知的。
在一些实施方案中,本公开内容的遗传工程化的细菌是合成的配体依赖性必需基因(slide)细菌细胞。slide细菌细胞是在一种或更多种必需基因中具有突变的合成的营养缺陷型,其仅在特定配体存在下生长(参见lopez和anderson“syntheticauxotrophswithligand-dependentessentialgenesforabl21(de3biosafetystrain,”acssyntheticbiology(2015)doi:10.1021/acssynbio.5b00085,其全部内容通过引用明确地并入本文)。
在一些实施方案中,slide细菌细胞包含必需基因中的突变。在一些实施方案中,必需基因选自由以下组成的组:phes、dnan、tyrs、metg和adk。在一些实施方案中,必需基因是包含一个或更多个以下突变的dnan:h191n、r240c、i317s、f319v、l340t、v347i和s345c。在一些实施方案中,必需基因是包含突变h191n、r240c、i317s、f319v、l340t、v347i和s345c的dnan。在一些实施方案中,必需基因是包含一个或更多个以下突变的phes:f125g、p183t、p184a、r186a和i188l。在一些实施方案中,必需基因是包含突变f125g、p183t、p184a、r186a和i188l的phes。在一些实施方案中,必需基因是包含一个或更多个以下突变的tyrs:l36v、c38a和f40g。在一些实施方案中,必需基因是包含突变l36v、c38a和f40g的tyrs。在一些实施方案中,必需基因是包含一个或更多个以下突变的metg:e45q、n47r、i49g和a51c。在一些实施方案中,必需基因是包含突变e45q、n47r、i49g和a51c的metg。在一些实施方案中,必需基因是包含一个或更多个以下突变的adk:i4l、l5i和l6g。在一些实施方案中,必需基因是包含突变i4l、l5i和l6g的adk。
在一些实施方案中,遗传工程化的细菌被配体补充。在一些实施方案中,配体选自由以下组成的组:苯并噻唑、吲哚、2-氨基苯并噻唑、吲哚-3-丁酸、吲哚-3-乙酸和l-组氨酸甲酯。例如,包含metg中的突变(e45q、n47r、i49g和a51c)的细菌细胞被苯并噻唑、吲哚、2-氨基苯并噻唑、吲哚-3-丁酸、吲哚-3-乙酸或l-组氨酸甲酯补充。包含dnan中的突变(h191n、r240c、i317s、f319v、l340t、v347i和s345c)的细菌细胞被苯并噻唑、吲哚或2-氨基苯并噻唑补充。包含phes中的突变(f125g、p183t、p184a、r186a和i188l)的细菌细胞被苯并噻唑或2-氨基苯并噻唑补充。包含tyrs中的突变(l36v、c38a和f40g)的细菌细胞被苯并噻唑或2-氨基苯并噻唑补充。包含adk中的突变(i4l、l5i和l6g)的细菌细胞被苯并噻唑或吲哚补充。
在一些实施方案中,遗传工程化的细菌包含使其对配体为营养缺陷型的多于一种的突变必需基因。在一些实施方案中,细菌细胞包含两种必需基因中的突变。例如,在一些实施方案中,细菌细胞包含tyrs中的突变(l36v、c38a和f40g)和metg中的突变(e45q、n47r、i49g和a51c)。在其他实施方案中,细菌细胞包括三种必需基因中的突变。例如,在一些实施方案中,细菌细胞包含tyrs中的突变(l36v、c38a和f40g)、metg中的突变(e45q、n47r、i49g和a51c)和phes中的突变(f125g、p183t、p184a、r186a和i188l)。
在一些实施方案中,遗传工程化的细菌是其必需基因使用图39、49、62和63示出的阿拉伯糖系统替代的条件营养缺陷型。
在一些实施方案中,本公开内容的遗传工程化的细菌是营养缺陷型,并且还包含杀死开关回路,诸如本文描述的杀死开关成分和系统中的任何一种。例如,重组细菌可以包含细胞存活和/或生长所需的必需基因中的缺失或突变,所述必需基因例如dna合成基因例如thya,细胞壁合成基因例如dapa和/或氨基酸基因例如sera或meta,并且还可以包含毒素基因,所述毒素基因由响应于环境条件和/或信号(诸如描述的阿拉伯糖系统)表达的一种或更多种转录活化物调节,或所述毒素基因由在感测外源环境条件和/或信号(诸如本文和图39、40和50中描述的重组酶系统)后表达的一种或更多种重组酶调节。其他实施方案被描述于以下中:wright等“geneguard:amodularplasmidsystemdesignforbiosafety,“acssyntheticbiology(2015)4:307-16,其全部内容通过引用明确地并入本文)。在一些实施方案中,本公开内容的遗传工程化的化细菌是营养缺陷型,并且还包含杀死开关回路,诸如本文描述的杀死开关成分和系统中的任何一种、以及另一种生物安全系统,诸如条件性复制起点(conditionaloriginofreplication)(参见wright等,同上)。
在其他实施方案中,营养缺陷型修饰也可用于筛选消耗过量氨的突变细菌。在更具体的方面,营养缺陷型修饰可用于筛选通过过度产生精氨酸而消耗过量的氨的突变细菌。如本文描述的,参与精氨酸代谢的许多基因经由其与argr的相互作用经历精氨酸的阻遏。astc基因启动子是独特的,因为与转录阻遏物不同,精氨酸-argr复合物作为转录活化物起作用。astc编码是产生氨的精氨酸琥珀酰转移酶(ast)途径的第三种酶的琥珀酰鸟氨酸氨基转移酶和大肠杆菌中第一astcadbe操纵子(schneider等,1998)。在某些实施方案中,遗传工程化的细菌对于基因是营养缺陷型的,并且在astc启动子的控制下表达营养缺陷型基因产物。在这些实施方案中,营养缺陷型经历正反馈机制,并用于选择通过过度产生精氨酸消耗过量的氨的突变细菌。正反馈营养缺陷型的非限制性实例示于图33a和图33b中。
遗传调节回路
在一些实施方案中,遗传工程化的细菌包含用于表达本文描述的构建体的多层遗传调节回路(参见,例如,美国临时申请号62/184,811,其通过引用以其整体并入本文)。
在某些实施方案中,本发明提供了用于选择过度产生精氨酸的遗传工程化的细菌的方法。在一些实施方案中,本发明提供了用于选择经由旁路代谢途径(例如,组氨酸生物合成途径、甲硫氨酸生物合成途径、赖氨酸生物合成途径、天冬酰胺生物合成途径、谷氨酰胺生物合成途径和色氨酸生物合成途径)消耗过量的氨的遗传工程化的细菌的方法。在一些实施方案中,本发明提供了包含突变体精氨酸调节子和argr调节的双阻遏物活化遗传调节回路的遗传工程化的细菌。双阻遏物活化遗传调节回路可用于筛选降低氨或拯救营养缺陷型的突变细菌。在一些构建体中,高水平的精氨酸和由精氨酸产生的argr的活化可引起可检测标记物或细胞存活所需的必需基因的表达。
双阻遏物活化调节回路包含第一argr和第二阻遏物,例如tet阻遏物。在这些实施方案的一个方面,argr抑制第二阻遏物的转录,所述第二阻遏物抑制可用于筛选消耗过量的氨的突变体的感兴趣的特定基因的转录(例如,可检测的产物),和/或细胞存活所需的必需基因的转录。可以使用任何可检测的产物,包括但不限于荧光素酶、β-半乳糖苷酶和荧光蛋白诸如gfp。在一些实施方案中,第二阻遏物是tet阻遏物蛋白(tetr)。在该实施方案中,包含野生型arg盒的argr阻遏型启动子驱动tetr的表达,并且tetr阻遏型启动子驱动至少一种感兴趣的基因(例如,gfp)的表达。在argr结合(其在低精氨酸浓度下发生)的不存在下,tetr被转录,并且tetr阻遏gfp表达。在argr结合(其在高精氨酸浓度下发生)的存在下,tetr表达被阻遏,并且产生gfp。可用于这些实施方案中的其他第二阻遏物的实例包括但不限于arsr、ascg、laci、cscr、deor、dgor、frur、galr、gatr、ci、lexa、rafr、qacr和ptxs(us20030166191)。在一些实施方案中,将包含开关的突变体精氨酸调节子经历诱变,并且通过过度产生精氨酸而降低氨的突变体基于可检测产物的水平,例如当可检测产物发荧光时通过流式细胞术荧光活化细胞分选(facs)来选择。
在一些实施方案中,感兴趣的基因是细菌存活和/或生长所需的基因。可以使用任何此类基因,包括但不限于cyse、glna、ilvd、leub、lysa、sera、meta、glya、hisb、ilva、phea、proa、thrc、trpc、tyra、thya、uraa、dapa、dapb、dapd、dape、dapf、flhd、metb、metc、proab和thi1,只要相应的野生型基因已被去除或突变,从而不产生基因产物(除了在argr控制下)。在一些实施方案中,包含野生型arg盒的argr阻遏型启动子驱动tetr蛋白的表达,并且tetr阻遏型启动子驱动细菌的存活和/或生长所需的至少一种基因例如thya、uraa的表达(sat等,2003)。在一些实施方案中,遗传工程化的细菌是当细菌存在于哺乳动物消化道中时不被补充的基因中的营养缺陷型,其中所述基因由存在于细菌中的第二诱导型基因补充;第二基因的转录是argr阻遏型的,并在足够高浓度的精氨酸存在下被诱导(从而补充营养缺陷型基因)。在一些实施方案中,将包含双阻遏物活化回路的突变体精氨酸调节子经历诱变,并且降低过量的氨的突变体通过在存活和/或生长所需的基因产物的不存在下生长来选择。在一些实施方案中,包含双阻遏物活化回路的突变体精氨酸调节子用于确保在高水平精氨酸的不存在下(例如肠外)细菌不能存活。
宿主-质粒相互依赖性
在一些实施方案中,本发明的遗传工程化的细菌还包含已被修饰为产生宿主-质粒相互依赖性的质粒。在某些实施方案中,相互依赖的宿主-质粒平台是geneguard(wright等,2015)。在一些实施方案中,geneguard质粒包含(i)条件性复制起点,其中必需的复制引发蛋白以反式提供;(ii)由宿主经由基因组易位拯救并且还与富集培养基相容的营养缺陷型修饰;和/或(iii)编码广谱毒素的核酸序列。通过使质粒dna本身对不表达抗毒素的菌株(例如,野生型细菌)不利,毒素基因可用于针对质粒扩散选择。在一些实施方案中,geneguard质粒在没有抗生素选择的情况下稳定至少100代。在一些实施方案中,geneguard质粒不破坏宿主的生长。geneguard质粒用于大大降低本发明的遗传工程化的细菌中无意的质粒繁殖。
相互依赖的宿主-质粒平台可以单独使用或与其他生物安全机制诸如本文描述的那些(例如杀死开关、营养缺陷型)组合使用。在一些实施方案中,遗传工程化的细菌包含geneguard质粒。在其他实施方案中,遗传工程化的细菌包含geneguard质粒和/或一种或更多种杀死开关。在其他实施方案中,遗传工程化的细菌包含geneguard质粒和/或一种或更多种营养缺陷型。在又其他实施方案中,遗传工程化的细菌包含geneguard质粒、一种或更多种杀死开关和/或一种或更多种营养缺陷型。
杀死开关
在一些实施方案中,本发明的遗传工程化的细菌还包含杀死开关(参见,例如,美国临时申请号62/183,935和62/263,329,其通过引用以其整体并入本文)。杀死开关旨在响应于外部刺激主动杀死工程化微生物。与营养缺陷型突变不同,在营养缺陷型突变中细菌死亡是因为它们缺乏存活必需的营养物质,杀死开关由环境中诱导微生物内引起细胞死亡的毒性分子产生的特定的因素触发。
被工程化有杀死开关的细菌已被设计用于体外研究目的,例如以限制生物燃料生产微生物在实验室环境外的扩散。为了体内施用以治疗疾病或紊乱而工程化的细菌也可被编程为在一种或更多种异源基因例如治疗基因的表达和递送之后的特定时间死亡,或者在受试者经历了治疗效果之后死亡。例如,在一些实施方案中,杀死开关被活化以在argafbr的氧水平依赖性表达后的一定时间段之后杀死细菌。在一些实施方案中,杀死开关在argafbr的氧水平依赖性表达后,例如在精氨酸或瓜氨酸的产生之后以延迟方式被活化。可选地,细菌可以被工程化为在细菌扩散到疾病部位外之后死亡。具体地,杀死开关可以用于以下:防止微生物长期定殖受试者,防止微生物扩散到受试者内的感兴趣区域外(例如肠外),或防止微生物扩散离开受试者进入环境(例如,通过受试者的粪便扩散到环境中)。可用于杀死开关中的此类毒素的实例包括但不限于细菌素、细胞溶素和通过裂解细胞膜、降解细胞dna或其他机制引起细胞死亡的其他分子。此类毒素可以单独使用或组合使用。控制其生产的开关可以基于例如转录活化(拨动开关(toggleswitch);参见,例如,gardner等,2000)、翻译(核糖核酸调节物(riboregulator))或dna重组(基于重组酶的开关),并且可以感测环境刺激诸如厌氧或活性氧类(reactiveoxygenspecies)。这些开关可以被单环境因素活化,或者可需要以and、or、nand和nor逻辑配置的数种活化物来诱导细胞死亡。例如,通过四环素、异丙基β-d-1-硫代吡喃半乳糖苷(iptg)和阿拉伯糖来活化and核糖核酸调节物开关,以诱导细胞溶素的表达,这使细胞膜透化并杀死细胞。iptg诱导内溶素(endolysin)和穿孔素(holin)mrna的表达,然后通过添加阿拉伯糖和四环素使内溶素和穿孔素去阻遏。所有三种诱导物必须存在才能导致细胞死亡。杀死开关的实例在本领域中是已知的(callura等,2010)。在一些实施方案中,杀死开关被活化,以在argafbr的氧水平依赖性表达后一定时间段之后杀死细菌。在一些实施方案中,杀死开关在氧依赖于argafbr的氧水平依赖性表达后以延迟方式被活化。
杀死开关可以被设计为使得毒素响应于环境条件或外部信号而产生(例如,细菌响应于外部信号而被杀死),或者可选地设计为使得在环境条件不再存在或外部信号停止后产生毒素。
因此,在一些实施方案中,本公开内容的遗传工程化的细菌还被编程为在感测到例如在低氧环境中的外源环境信号之后死亡。在一些实施方案中,本公开内容的遗传工程化的细菌,例如表达argafbr和阻遏物argr的细菌,包含编码一种或更多种重组酶的一种或更多种基因,所述基因的表达响应于环境条件或信号而被诱导,且引起一个或更多个重组事件,这最终导致杀死细胞的毒素的表达。在一些实施方案中,至少一个重组事件是编码细菌毒素的反向异源基因(invertedheterologousgene)的te翻转,然后在所述基因被第一重组酶翻转之后组成型表达。在一个实施方案中,细菌毒素的组成型表达杀死遗传工程化的细菌。在这些类型的杀死开关系统中,在工程化细菌细胞感测到外源环境条件并表达感兴趣的异源基因后,重组细菌细胞不再存活。
在其中本公开内容的遗传工程化的细菌,例如表达argafbr和阻遏物argr的细菌,响应于环境条件或信号表达一种或更多种重组酶,引起至少一个重组事件的另一个实施方案中,遗传工程化的细菌还响应于外源环境条件或信号表达编码抗毒素的异源基因。在一个实施方案中,至少一个重组事件是通过第一重组酶翻转编码细菌毒素的反向异源基因。在一个实施方案中,编码细菌毒素的反向异源基因位于第一正向重组酶识别序列和第一反向重组酶识别序列之间。在一个实施方案中,编码细菌毒素的异源基因在被第一重组酶翻转之后被组成型表达。在一个实施方案中,抗毒素抑制毒素的活性,由此延迟遗传工程化的细菌的死亡。在一个实施方案中,当外源环境条件不再存在时,当编码抗毒素的异源基因不再表达时,遗传工程化的细菌被细菌毒素杀死。
在另一个实施方案中,至少一个重组事件是通过第一重组酶翻转编码第二重组酶的反向异源基因,随后通过第二重组酶翻转编码细菌毒素的反向异源基因。在一个实施方案中,编码第二重组酶的反向异源基因位于第一正向重组酶识别序列和第一反向重组酶识别序列之间。在一个实施方案中,编码细菌毒素的反向异源基因位于第二正向重组酶识别序列和第二反向重组酶识别序列之间。在一个实施方案中,编码第二重组酶的异源基因在其被第一重组酶翻转之后被组成型表达。在一个实施方案中,编码细菌毒素的异源基因在其被第二重组酶翻转之后被组成型表达。在一个实施方案中,遗传工程化的细菌被细菌毒素杀死。在一个实施方案中,遗传工程化细菌还响应于外源环境条件表达编码抗毒素的异源基因。在一个实施方案中,当外源环境条件存在时,抗毒素抑制毒素的活性,由此延迟遗传工程化的细菌的死亡。在一个实施方案中,当外源环境条件不再存在时,当编码抗毒素的异源基因不再表达时,遗传工程化的细菌被细菌毒素杀死。
在一个实施方案中,至少一个重组事件是通过第一重组酶翻转编码第二重组酶的反向异源基因,随后通过第二重组酶翻转编码第三重组酶的反向异源基因,随后通过第三重组酶翻转编码细菌毒素的反向异源基因。
在一个实施方案中,至少一个重组事件是通过第一重组酶翻转编码第一切除酶的反向异源基因。在一个实施方案中,编码第一切除酶的反向异源基因位于第一正向重组酶识别序列和第一反向重组酶识别序列之间。在一个实施方案中,编码第一切除酶的异源基因在其被第一重组酶翻转之后被组成型表达。在一个实施方案中,第一切除酶切除第一必需基因。在一个实施方案中,编程的重组细菌细胞在切除第一必需基因之后是不存活的。
在一个实施方案中,第一重组酶还翻转编码第二切除酶的反向异源基因。在一个实施方案中,其中编码第二切除酶的反向异源基因位于第二正向重组酶识别序列和第二反向重组酶识别序列之间。在一个实施方案中,编码第二切除酶的异源基因在其被第一重组酶翻转之后被组成型表达。在一个实施方案中,当第一必需基因和第二必需基因两者被切除时,遗传工程化的细菌死亡或不再存活。在一个实施方案中,当第一必需基因被切除或第二必需基因被第一重组酶切除时,遗传工程化的细菌死亡或不再存活。
在一个实施方案中,遗传工程化的细菌在至少一个重组事件发生之后死亡。在另一个实施方案中,遗传工程化的细菌在至少一个重组事件发生之后不再存活。
在这些实施方案中的任一个中,重组酶可以是选自由以下组成的组的重组酶:bxbi、phic31、tp901、bxbi、phic31、tp901、hk022、hp1、r4、int1、int2、int3、int4、int5、int6、int7、int8、int9、int10、int11、int12、int13、int14、int15、int16、int17、int18、int19、int20、int21、int22、int23、int24、int25、int26、int27、int28、int29、int30、int31、int32、int33和int34、或其生物学活性片段。
在以上描述的杀死开关回路中,毒素在环境因素或信号的存在下被产生。在杀死开关回路的另一方面,毒素可在环境因素的存在下被阻遏(未产生),且然后在环境条件或外部信号不再存在后被产生。在其中毒素在外部因素或信号的存在下被阻遏(并且在外部信号被去除后被活化)的示例性杀死开关示于图39、40、62和63中。本公开内容提供了重组细菌细胞,所述重组细菌细胞在感测到外源环境中的阿拉伯糖或其他糖后表达一种或更多种异源基因。在这方面,重组细菌细胞包含编码arac转录因子的arac基因、以及在arabad启动子控制下的一种或更多种基因。在阿拉伯糖的不存在下,arac转录因子采用阻遏在arabad启动子控制下的基因转录的构象。在阿拉伯糖的存在下,arac转录因子经历构象变化,这允许其结合并活化arabad启动子,这诱导所需基因的表达。
因此,在其中一种或更多种异源基因在感测到外源环境中的阿拉伯糖后表达的一些实施方案中,一种或更多种异源基因直接或间接在arabad启动子的控制下。在一些实施方案中,表达的异源基因选自以下一种或更多种:异源治疗基因、编码抗毒素的异源基因、编码阻遏物蛋白或多肽例例如tetr阻遏物的异源基因、编码在细菌细胞中未发现的必需蛋白的异源基因、和/或编码调节蛋白或多肽的异源基因。
阿拉伯糖诱导型启动子是本领域已知的,包括para、parab、parac和parabad。在一个实施方案中,阿拉伯糖诱导型启动子来自大肠杆菌。在一些实施方案中,parac启动子和parabad启动子作为双向启动子起作用,其中parabad启动子在一个方向上控制异源基因的表达,并且parac(非常接近于parabad启动子并且在parabad启动子的相对链上)在另一个方向上控制异源基因表达。在阿拉伯糖的存在下,诱导来自两种启动子的两种异源基因的转录。然而,在阿拉伯糖的不存在下,不诱导来自两种启动子的两种异源基因的转录。
在本公开内容的一个示例性实施方案中,本公开内容的工程化细菌包含具有至少以下序列的杀死开关:被可操作地连接至编码四环素阻遏物蛋白(tetr)的异源基因的parabad启动子、被可操作地连接至编码arac转录因子的异源基因的parac启动子、以及被可操作地连接至由四环素阻遏物蛋白阻遏的启动子(ptetr)的编码细菌毒素的异源基因。在阿拉伯糖的存在下,arac转录因子活化parabad启动子,这活化tetr蛋白的转录,tetr蛋白又阻遏毒素的转录。然而,在阿拉伯糖的不存在下,arac抑制由parabad启动子的转录,并且不表达tetr蛋白。在这种情况下,异源毒素基因的表达被活化,并且表达毒素。毒素在重组细菌细胞中形成,且重组细菌细胞被杀死。在一个实施方案中,编码arac转录因子的arac基因在组成型启动子的控制下,并且因此被组成型表达。
在本公开内容的一个实施方案中,重组细菌细胞还包含在组成型启动子控制下的抗毒素。在这种情况下,在阿拉伯糖的存在下,毒素不被表达是由于tetr蛋白的阻遏,且抗毒素蛋白在细胞中形成。然而,在阿拉伯糖的不存在下,tetr蛋白不被表达,并且毒素的表达被诱导。毒素开始在重组细菌细胞内形成。在毒素蛋白以与细胞中抗毒素蛋白相同或比其更高的量存在后,重组细菌细胞不再存活,并且重组细菌细胞将被毒素杀死。
在本公开内容的另一个实施方案中,重组细菌细胞还包含在parabad启动子控制下的抗毒素。在这种情况下,在阿拉伯糖的存在下,tetr和抗毒素被表达,抗毒素在细胞中形成,且毒素不被表达是由于被tetr蛋白阻遏。然而,在阿拉伯糖的不存在下,tetr蛋白和抗毒素两者都不表达,并且毒素的表达被诱导。毒素开始在重组细菌细胞内形成。在毒素蛋白被表达后,重组细菌细胞不再存活,且重组细菌细胞将被毒素杀死。
在本公开内容的另一个示例性实施方案中,本公开内容的工程化细菌包含具有至少以下序列的杀死开关:被可操作地连接至编码重组细菌细胞中未发现(和存活所需)的必需多肽的异源基因的parabad启动子、和被可操作地连接至编码arac转录因子的异源基因的parac启动子。在阿拉伯糖的存在下,arac转录因子活化parabad启动子,这活化编码必需多肽的异源基因的转录,允许重组细菌细胞存活。然而,在阿拉伯糖的不存在下,arac抑制由parabad启动子的转录,并且存活所需的必需蛋白不被表达。在这种情况下,重组细菌细胞在阿拉伯糖的不存在下死亡。在一些实施方案中,被可操作地连接至编码重组细菌细胞中未发现的必需多肽的异源基因的parabad启动子的序列可以与以上紧接着描述的tetr/毒素杀死开关系统联合存在于细菌细胞中。在一些实施方案中,被可操作地连接至编码重组细菌细胞中未发现的必需多肽的异源基因的parabad启动子的序列可以与以上紧接着描述的tetr/毒素/抗毒素杀死开关系统联合存在于细菌细胞中。
在一些实施方案中,本公开内容的工程化细菌,例如表达argafbr和阻遏物argr的细菌,还包含编码任何以上描述杀死开关回路的成分的基因。
在任何以上描述的实施方案中,细菌毒素选自由以下组成的组:细胞溶素、hok、fst、tisb、ldrd、kid、syme、mazf、flma、ibs、xcv2162、dinj、ccdb、mazf、pare、yafo、zeta、hicb、relb、yhav、yoeb、chpbk、hipa、小菌素b、小菌素b17、小菌素c、小菌素c7-c51、小菌素j25、小菌素colv、小菌素24、小菌素l、小菌素d93、小菌素l、小菌素e492、小菌素h47、小菌素i47、小菌素m、大肠杆菌素a、大肠杆菌素e1、大肠杆菌素k、大肠杆菌素n、大肠杆菌素u、大肠杆菌素b、大肠杆菌素ia、大肠杆菌素ib、大肠杆菌素5、大肠杆菌素10、大肠杆菌素s4、大肠杆菌素y、大肠杆菌素e2、大肠杆菌素e7、大肠杆菌素e8、大肠杆菌素e9、大肠杆菌素e3、大肠杆菌素e4、大肠杆菌素e6;大肠杆菌素e5、大肠杆菌素d、大肠杆菌素m和阴沟肠道菌素(cloacin)df13、或其生物学活性片段。
在任何以上描述的实施方案中,抗毒素选自由以下组成的组:抗细胞溶素、sok、rnaii、istr、rdld、kis、symr、maze、flmb、sib、ptarna1、yafq、ccda、maze、pard、yafn、epsilon、hica、rele、prlf、yefm、chpbi、hipb、mcce、mccectd、mccf、cai、imme1、cki、cni、cui、cbi、iia、imm、cfi、im10、csi、cyi、im2、im7、im8、im9、im3、im4、imme6、阴沟肠道菌素免疫蛋白(cim)、imme5、immd和cmi、或其生物学活性片段。
在一个实施方案中,细菌毒素对遗传工程化的细菌是杀细菌的。在一个实施方案中,细菌毒素对遗传工程化的细菌是抑细菌的。
在一些实施方案中,本文提供的工程化细菌具有包含一种或更多种核酸突变的精氨酸调节子,所述一种或更多种核酸突变降低或消除精氨酸介导的对编码负责在精氨酸生物合成途径中将谷氨酸转化为精氨酸和/或中间副产物例如瓜氨酸的酶的每种操纵子的阻遏,使得突变体精氨酸调节子比来自在相同条件下的相同细菌亚型的未修饰的调节子产生更多的精氨酸和/或中间副产物。在一些实施方案中,遗传工程化的细菌包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体,例如argafbr。在一些实施方案中,遗传工程化的细菌包含在用于编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶、精氨基琥珀酸裂合酶和氨甲酰磷酸合酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子,由此使调节子去阻遏并增强精氨酸和/或中间副产物生物合成。在一些实施方案中,遗传工程化的细菌还包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体由氧水平依赖性启动子控制。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体由在低氧或厌氧条件下被诱导的启动子控制。在一些实施方案中,启动子选自富马酸盐和硝酸盐还原酶调节物(fnr)启动子、精氨酸脱亚氨酶和硝酸盐还原(anr)启动子和异化硝酸盐呼吸调节物(dnr)启动子。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体是argafbr。
在一些实施方案中,遗传工程化的细菌包含在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中的一种或更多种核酸突变的突变体精氨酸调节子和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体。在一些实施方案中,遗传工程化的细菌包含突变体精氨酸调节子,其中细菌包含编码被突变为与来自在相同条件下的相同细菌亚型的野生型n-乙酰谷氨酸合成酶相比降低精氨酸反馈抑制的功能性n-乙酰谷氨酸合成酶的基因,其中编码突变的n-乙酰谷氨酸合成酶的基因的表达由在低氧或厌氧条件下被诱导的启动子控制,其中突变体精氨酸调节子包含一种或更多种操纵子,所述一种或更多种操纵子包含编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的基因,以及其中每种操纵子包含一种或更多种突变的arg盒,其特征在于经由argr阻遏物结合降低精氨酸介导的操纵子的阻遏的一种或更多种核酸突变,并保留足够亲和力的rna聚合酶结结合以促进操纵子中的基因的转录。
在一些实施方案中,遗传工程化的细菌是包含在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的营养缺陷型。在一个实施方案中,包含在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的遗传工程化的细菌是选自以下的营养缺陷型:cyse,glna、ilvd、leub、lysa、sera、meta、glya、hisb、ilva、phea、proa、thrc、trpc、tyra、thya、uraa、dapa、dapb、dapd、dape、dapf、flhd、metb、metc、proab和thi1营养缺陷型。在一些实施方案中,工程化化的细菌具有多于一种营养缺陷型,例如,它们可以是δthya和δdapa营养缺陷型。
在一些实施方案中,包含在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的遗传工程化的细菌还包含杀死开关回路,诸如本文提供的任何杀死开关回路。例如,在一些实施方案中,遗传工程化的细菌还包含在诱导型启动子控制下的编码一种或更多种重组酶的一种或更多种基因和反向毒素序列。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。在一些实施方案中,工程化的细菌还包含在诱导型启动子控制下的编码一种或更多种重组酶的一种或更多种基因和一种或更多种反向切除基因,其中切除基因编码缺失必需基因的酶。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。在一些实施方案中,工程化的细菌还包含在具有tetr阻遏物结合位点的启动子控制下的编码毒素的一种或更多种基因和在由阿拉伯糖诱导的诱导型启动子(诸如parabad)控制下的编码tetr的基因。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。
在一些实施方案中,遗传工程化的细菌是包含在用于编码精氨酸生物合成酶的操纵子的每一种的至少一种arg盒中包含一种或更多种核酸突变的突变体精氨酸调节子和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的营养缺陷型,且还包含杀死开关回路,诸如本文描述的任何杀死开关回路。
在以上描述的遗传工程化的细菌的一些实施方案中,编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因存在于细菌中的质粒上,并且在质粒上被可操作地连接至在低氧或厌氧条件下被诱导的启动子。在其他实施方案中,编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因存在于细菌染色体中,并且在染色体中被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
在一些实施方案中,遗传工程化的细菌包含突变体精氨酸阻遏物,所述突变体精氨酸阻遏物包含一种或更多种核酸突变,使得精氨酸阻遏物功能被减少或失活,或者遗传工程化的细菌不具有精氨酸阻遏物(例如,精氨酸阻遏物基因已被缺失),导致调节子的去阻遏和精氨酸和/或中间副产物生物合成的增强。在一些实施方案中,遗传工程化的细菌还包含精氨酸反馈抗性n-乙酰谷氨酸合酶突变体。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体由氧水平依赖性启动子控制。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体由在低氧或厌氧条件下被诱导的启动子控制。在一些实施方案中,启动子选自富马酸盐和硝酸盐还原酶调节物(fnr)启动子、精氨酸脱亚氨酶和硝酸盐还原(anr)启动子和异化硝酸盐呼吸调节物(dnr)启动子。在一些实施方案中,精氨酸反馈抗性n-乙酰谷氨酸合酶突变体是argafbr。
在一些实施方案中,遗传工程化的细菌包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体。在一些实施方案中,遗传工程化的细菌包含精氨酸调节子,其中细菌包含编码具有与来自在相同条件下的相同细菌亚型的野生型n-乙酰谷氨酸合成酶相比降低的精氨酸反馈抑制的功能性n-乙酰谷氨酸合成酶的基因,其中编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因的表达由被外源环境条件诱导的启动子控制,并且其中所述细菌已被遗传工程化为缺乏功能性argr阻遏物。
在一些实施方案中,包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的遗传工程化的细菌是营养缺陷型。在一个实施方案中,包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的遗传工程化的细菌是选自以下的营养缺陷型:cyse、glna、ilvd、leub、lysa、sera、meta、glya、hisb、ilva、phea、proa、thrc、trpc、tyra、thya、uraa、dapa、dapb、dapd、dape、dapf、flhd、metb、metc、proab和thi1营养缺陷型。在一些实施方案中,工程化的细菌具有多于一种营养缺陷型,例如,它们可以是δthya和δdapa营养缺陷型。
在一些实施方案中,包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的遗传工程化的细菌还包含杀死开关回路,诸如本文提供的任何杀死开关回路。例如,在一些实施方案中,遗传工程化的细菌还包含在诱导型启动子控制下的编码一种或更多种重组酶的一种或更多种基因、和反向毒素序列。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。在一些实施方案中,工程化的细菌还包含在诱导型启动子控制下的编码一种或更多种重组酶的一种或更多种基因和一种或更多种反向切除基因,其中切除基因编码缺失必需基因的酶。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。在一些实施方案中,工程化的细菌还包含在具有tetr阻遏物结合位点的启动子下的编码毒素的一种或更多种基因和在由阿拉伯糖诱导的诱导型启动子(诸如parabad)控制下的编码tetr的基因。在一些实施方案中,遗传工程化的细菌还包含编码抗毒素的一种或更多种基因。
在一些实施方案中,遗传工程化的细菌是包含突变或缺失的精氨酸阻遏物和精氨酸反馈抗性n-乙酰谷氨酸合酶突变体的营养缺陷型,且还包括杀死开关回路,诸如本文描述的任何杀死开关回路。
在以上描述的遗传工程化的细菌的一些实施方案中,编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因存在于细菌中的质粒上,并且在质粒上被可操作地连接至在低氧或厌氧条件下被诱导的启动子。在其他实施方案中,编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因存在于细菌染色体中,并且在染色体中被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
氨转运
可以在本发明的遗传工程化的细菌中将氨转运蛋白表达或修饰为增强进入细胞的氨转运。amtb是将氨转运到细菌细胞中的膜转运蛋白。在一些实施方案中,本发明的遗传工程化的细菌还包含天然amtb基因的多个拷贝。在一些实施方案中,本发明的遗传工程化的细菌还包含来自不同细菌物种的amtb基因。在一些实施方案中,本发明的遗传工程化的细菌包含来自不同细菌物种的amtb基因的多个拷贝。在一些实施方案中,本发明的遗传工程化的细菌中的天然amtb基因不被修饰。在一些实施方案中,本发明的遗传工程化的细菌包含由其天然启动子、诱导型启动子或比天然启动子更强的启动子,例如glnrs启动子、p(bla)启动子、或组成型启动子控制的amtb基因。
在一些实施方案中,遗传工程化的细菌中的天然amtb基因不被修饰,并且天然amtb基因的一个或更多个另外的拷贝被插入到基因组中在控制argafbr表达的相同诱导型启动子例如fnr启动子、或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。在替代实施方案中,天然amtb基因不被修饰,并且来自不同细菌物种的非天然amtb基因的拷贝被插入到基因组中在控制argafbr表达的相同诱导型启动子例如fnr启动子、或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。
在一些实施方案中,遗传工程化的细菌中的天然amtb基因不被修饰,并且天然amtb基因的一个或更多个另外的拷贝存在于细菌中的质粒上并在控制argafbr表达的相同诱导型启动子例如fnr启动子、或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。在替代实施方案中,天然amtb基因不被修饰,并且来自不同细菌物种的非天然amtb基因的拷贝存在于细菌中的质粒上并在控制argafbr表达的相同诱导型启动子例如fnr启动子、或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。
在一些实施方案中,诱变天然amtb基因,选择表现出增加的氨转运的突变体,并且将诱变的amtb基因分离并插入到遗传工程化的细菌中。在一些实施方案中,诱变天然amtb基因,选择表现出增加的氨转运的突变体,并且那些突变体用于产生本发明的细菌。本文描述的氨转运蛋白修饰可以存在于质粒或染色体上。
在一些实施方案中,遗传工程化的细菌是大肠杆菌nissle,且大肠杆菌nissle中的天然amtb基因不被修饰;天然大肠杆菌nissleamtb基因的一个或更多个另外的拷贝被插入到大肠杆菌nissle基因组中在控制argafbr表达的相同诱导型启动子例如fnr启动子或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。在替代实施方案中,大肠杆菌nissle中的天然amtb基因不被修饰,并且来自不同细菌例如植物乳杆菌的非天然amtb基因的拷贝被插入到大肠杆菌nissle基因组中在控制argafbr表达的相同诱导型启动子例如fnr启动子或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。
在一些实施方案中,遗传工程化的细菌是大肠杆菌nissle,且大肠杆菌nissle中的天然amtb基因不被修饰;天然大肠杆菌nissleamtb基因的一个或更多个另外的拷贝存在于细菌中的质粒上,并在控制argafbr表达的相同诱导型启动子例如fnr启动子或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。在替代实施方案中,大肠杆菌nissle中的天然amtb基因不被修饰,并且来自不同细菌例如植物乳杆菌的非天然amtb基因的拷贝存在于细菌中的质粒上并在控制argafbr表达的相同诱导型启动子例如fnr启动子或与控制argafbr表达的启动子不同的诱导型启动子或组成型启动子的控制下。
药物组合物和制剂
包含本发明的遗传工程化的细菌的药物组合物可用于治疗、管理、改善和/或预防与高氨血症相关的紊乱或与高氨血症相关的症状。提供了本发明的药物组合物,所述本发明的药物组合物包含单独或与预防剂、治疗剂和/或药学上可接受的载体组合的一种或更多种遗传工程化的细菌。
在某些实施方案中,药物组合物包含被工程化为包含本文描述的遗传修饰例如突变体精氨酸调节子的细菌的一种物种、菌株或亚型。在替代实施方案中,药物组合物包含各自被工程化为包含本文描述的遗传修饰,例如突变体精氨酸调节子的细菌的两种或更多种物种、菌株和/或亚型。
本发明的药物组合物可使用一种或更多种生理学上可接受的载体(包括赋形剂和辅剂)以常规方式来配制,该载体有利于将活性成分加工为用于药物使用的组合物。配制药物组合物的方法是本领域已知的(参见,例如,“remington'spharmaceuticalsciences”,mackpublishingco.,easton,pa)。在一些实施方案中,将药物组合物经历压片、冻干、直接压制、常规混合、溶解、制粒、研磨、乳化、包封、包埋或喷雾干燥以形成片剂、粒剂、纳米颗粒、纳米胶囊、微胶囊、微片剂、小药丸(pellets)、或粉末,其可以是肠溶包衣或未包衣的。适当的制剂取决于施用途径。
本发明的遗传工程化的细菌可以被配制为以任何合适的剂型(例如,用于口服施用的液体、胶囊、小药囊(sachet)、硬胶囊、软胶囊、片剂、肠溶包衣片剂、悬浮粉剂、粒剂或基质持续释放制剂)和任何合适类型的施用(例如,口服、局部、立即释放、脉冲释放、延迟释放或持续释放)的药物组合物。遗传工程化的细菌的合适剂量量可以范围从约105个至1012个细菌。组合物可以每天、每周或每月一次或多次被施用。遗传工程化的细菌可以被配制为包含一种或更多种药学上可接受的载体、增稠剂、稀释剂、缓冲剂、表面活性剂、中性或阳离子脂质、脂质复合物、脂质体、渗透增强剂、载体化合物和其他药学上可接受的载体或剂的药物组合物。
本发明的遗传工程化的细菌可以被局部施用并且被配制为呈软膏、乳膏、经皮贴剂、洗剂、凝胶、洗发剂、喷雾剂、气雾剂、溶液、乳状液的形式或本领域技术人员熟知的其他形式。参见,例如,“remington'spharmaceuticalsciences”,mackpublishingco.,easton,pa。在一个实施方案中,对于不可喷雾的局部剂型,采用包含与局部应用相容并且具有大于水的动态粘度的载体或一种或更多种赋形剂的粘性至半固体或固体形式。合适的制剂包括但不限于可以与用于影响多种特性例如渗透压的辅剂(例如,防腐剂、稳定剂、润湿剂、缓冲液或盐)一起灭菌或混合的溶液、悬浮液、乳状剂、乳膏、软膏剂、粉剂、搽剂(liniments)、油膏(salves)等。其他合适的局部剂型包括可喷雾气雾剂制剂,其中活性成分与固体或液体惰性载体组合,被包装于具有加压的挥发物(例如,气态推进剂诸如氟利昂)的混合物或挤压瓶中。保湿剂或湿润剂也可被添加至药物组合物和剂型中。此类另外的成分的实例是本领域熟知的。
本发明的遗传工程化的细菌可以被口服施用并且被配制为片剂、丸剂、糖衣丸(dragees)、胶囊、液体、凝胶、糖浆剂(syrup)、浆体、悬浮液等。用于口服使用的药物组合物可以使用固体赋形剂制造,任选地研磨所得的混合物,和(如果需要)在添加合适的辅剂之后,加工颗粒的混合物,以获得片剂或糖衣丸芯。适合的赋形剂包括但不限于填充剂诸如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素组合物诸如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠;和/或生理上可接受的聚合物诸如聚乙烯吡咯烷酮(pvp)或聚乙二醇(peg)。还可添加崩解剂,诸如交联的聚乙烯吡咯烷酮、琼脂、海藻酸或其盐诸如藻酸钠。
片剂或胶囊可以与药学上可接受的赋形剂通过常规方法一起制备,所述药学上可接受的赋形剂诸如结合剂(例如,预胶化的玉米淀粉、聚乙烯吡咯烷酮、羟丙基甲基纤维素、羧甲基纤维素、聚乙二醇、蔗糖、葡萄糖、山梨醇、淀粉、树胶、高岭土和黄蓍胶);填充剂(例如,乳糖、微晶纤维素或磷酸氢钙);润滑剂(例如,钙、铝、锌、硬脂酸、聚乙二醇、月桂基硫酸钠、淀粉、苯甲酸钠、l-亮氨酸、硬脂酸镁、滑石或二氧化硅);崩解剂(例如,淀粉、马铃薯淀粉、羟基乙酸淀粉钠、糖类、纤维素衍生物、二氧化硅粉末);或润湿剂(例如,十二烷基硫酸钠)。片剂可通过本领域熟知的方法包衣。可存在包衣壳,且常见的膜包括但不限于,聚丙交酯、聚乙醇酸、聚酸酐、其他可生物降解聚合物、藻酸盐-聚赖氨酸-藻酸盐(alginate-polylysine-alginate)(apa)、藻酸盐-聚亚甲基-共-胍-藻酸盐(a-pmcg-a)、羟基甲基丙烯酸-甲基丙烯酸甲酯(hydroxymethylacrylate-methylmethacrylate)(hema-mma)、多层hema-mma-maa、聚丙烯腈氯乙烯(polyacrylonitrilevinylchloride)(pan-pvc)、丙烯腈/甲代烯丙基磺酸钠(acrylonitrile/sodiummethallylsulfonate)(an-69)、聚乙二醇/聚五甲基环五硅氧烷/聚二甲基硅氧烷(peg/pd5/pdms)、聚n,n-二甲基丙烯酰胺(pdmaam)、硅质包封物、硫酸纤维素/藻酸钠/聚亚甲基-共-胍(cs/a/pmcg)、邻苯二甲酸乙酸纤维素、藻酸钙、k-卡拉胶-槐豆胶凝胶珠、结冷胶(gellan)-黄原胶珠、聚(丙交酯-共-乙交酯)、卡拉胶、淀粉聚酸酐、淀粉聚甲基丙烯酸酯、聚氨基酸和肠溶包衣聚合物。
在一些实施方案中,将遗传工程化的细菌肠溶包衣以释放到消化道或消化道的特定区域,例如大肠。从胃至结肠的典型ph曲线是约1-4(胃)、5.5-6(十二指肠)、7.3-8.0(回肠)和5.5-6.5(结肠)。在一些疾病中,可以修改ph曲线。在一些实施方案中,包衣在特定ph环境中降解以指定释放部位。在一些实施方案中,使用至少两种包衣。在一些实施方案中,外部包衣和内部包衣在不同的ph水平降解。
用于口服施用的液体制剂可以采用溶液、糖浆剂、悬浮液或在使用之前用水或其他合适的媒介物构成的干燥产品的形式。此类液体制剂可以与药学上可接受的剂通过常规方法一起制备:所述药学上可接受的剂诸如悬浮剂(例如,山梨醇糖浆剂、纤维素衍生物或氢化可食用脂肪);乳化剂(例如,卵磷脂或阿拉伯胶);非水性媒介物(例如,杏仁油、油性酯、乙醇或分级的植物油);和防腐剂(例如,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸)。制剂还可以适当地包含缓冲盐、调味剂、着色剂和甜味剂。用于口服施用的制剂可以适当地被配制用于本发明的遗传工程化的细菌的缓慢释放、控制释放或持续释放。
在某些实施方案中,本发明的遗传工程化的细菌可以例如与惰性稀释剂或可同化的可食用载体一起口服施用。化合物也可以被封闭在硬壳或软壳明胶胶囊中,压制为片剂,或直接掺入到受试者的饮食中。对于口服治疗施用,化合物可以与赋形剂混合并以可摄入片剂、含服片剂、锭剂、胶囊、酏剂、悬浮液、糖浆剂、薄饼(wafers)等形式使用。为了通过除了肠胃外施用以外的方式施用本发明的化合物,可能需要将化合物用材料包衣或将化合物与材料共同施用,以防止其失活。
在一些实施方案中,组合物被配制为经由纳米颗粒、纳米胶囊、微胶囊或微片剂(其被肠溶包衣或未包衣)用于肠内施用、空肠内施用、十二指肠内施用、回肠内施用、胃分流施用或结肠内施用。本发明的药物组合物也可以使用例如常规栓剂基质诸如可可脂或其他甘油酯被配制为直肠组合物诸如栓剂或保留灌肠剂。组合物可以是在油性或水性媒介物中的悬浮液、溶液或乳状液,并且可以包含悬浮剂、稳定剂和/或分散剂。
本发明的遗传工程化的细菌可以被鼻内施用,被配制为气雾剂形式、喷雾剂、雾或液滴形式,并且以从加压包装或喷雾器呈现的气雾剂喷雾的形式借助于合适的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)方便地递送。加压气雾剂剂量单位可以通过提供阀来确定递送计量的量。可配制用于在吸入器或吹入器(insufflator)中使用的(例如,明胶的)胶囊和药筒,该胶囊和药筒包含化合物和合适的粉末基质诸如乳糖或淀粉的粉末混合物。
本发明的遗传工程化的细菌可以作为贮库制剂被施用和配制。此类长效制剂可以通过植入或通过注射来施用。例如,可用合适的聚合的或疏水的材料(例如,作为可接受的油中的乳状液)或离子交换树脂配制组合物,或将其配制成微溶的衍生物(例如,作为微溶的盐)。
在一些实施方案中,本发明提供呈单一剂型的药学上可接受的组合物。单一剂型可以呈液体或固体形式。单一剂型可以被直接施用至患者而不经修改,或者可以在施用之前被稀释或重构。在某些实施方案中,单一剂型可以以推注形式被施用,例如单次注射、单次口服剂量,包括包含多个片剂、胶囊、丸剂等的口服剂量。在替代实施方案中,单一剂型可以例如通过输注在一定时间段内被施用。
本发明的药物组合物的单一剂型可以通过以下来制备:将药物组合物分配为较小的等分试样、分配到单剂量容器、分配为单剂量液体形式或单剂量固体形式,诸如片剂、粒剂、纳米颗粒、纳米胶囊、微胶囊、微片剂、小药丸或粉末,其可以是肠溶包衣或未包衣的。呈固体形式的单一剂量可以在施用至患者之前通过加入液体(通常是无菌水或盐水溶液)来重构。
可以调整剂量方案以提供治疗响应。例如,可以在一次施用单次推注,可以在预定时间段内施用几个分开的剂量,或者可以如治疗情况所指示的降低或增加剂量。剂量的规格由活性化合物的独特特征和待实现的具体治疗效果决定。剂量值可以随着待缓解的状况的类型和严重程度而变化。对于任何特定的受试者,可以根据个体需要和治疗临床医师的专业判断随时间调整具体的剂量方案。
在另一个实施方案中,组合物可以在受控释放或持续释放系统中递送。在一个实施方案中,可以使用泵来实现受控或持续释放。在另一个实施方案中,可以使用聚合物材料来实现本公开内容的疗法的受控或持续释放(参见,例如,美国专利号5,989,463)。用于持续释放制剂的聚合物的实例包括但不限于,聚(甲基丙烯酸2-羟基乙酯)、聚(甲基丙烯酸甲酯)、聚(丙烯酸)、聚(乙烯-共-乙酸乙烯酯)、聚(甲基丙烯酸)、聚乙交酯(plg)、聚酸酐、聚(n-乙烯基吡咯烷酮)、聚(乙烯醇)、聚丙烯酰胺、聚(乙二醇)、聚丙交酯(pla)、聚(丙交酯-共-乙交酯)(plga)和聚原酸酯。用于持续释放制剂中的聚合物可以是惰性的,不含可浸出(leachable)的杂质,在储存时是稳定的、无菌的和可生物降解的。在一些实施方案中,控制释放或持续释放系统可以被置于预防或治疗靶附近,因此仅需要全身剂量的一部分。可使用本领域技术人员已知的任何合适的技术。
本发明的遗传工程化的细菌可以作为中性或盐形式被施用和配制。药学上可接受的盐包括由阴离子形成的盐,诸如源自盐酸、磷酸、乙酸、草酸、酒石酸等的那些,以及由阳离子形成的那些,诸如源自钠、钾、铵、钙、铁的氢氧化物(ferrichydroxides)、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的那些。
各成分单独供应或以单位剂型混合在一起供应,例如作为在指示活性剂的量的气密密封容器诸如安瓿或小药囊中的干燥冻干粉末或无水浓缩物。如果施用的方式为通过注射,可以提供安瓿的无菌注射用水或盐水,以便可以在施用之前混合各成分。
本发明的药物组合物可以被包装于指示活性剂的量的气密密封容器,诸如安瓿或小药囊中。在一个实施方案中,本发明的一种或更多种药物组合物作为在气密密封的容器中的干燥灭菌的冻干粉末或无水浓缩物供应,并且可以被重构(例如用水或盐水)为适当的浓度以用于施用至受试者。在一个实施方案中,本发明的一种或更多种预防或治疗剂或药物组合物作为在储存于2℃和8℃之间的气密密封容器中的干燥的无菌冻干粉末供应,并在被重构之后1小时内、3小时内、5小时内、6小时内、12小时内、24小时内、48小时内、72小时内、或1周内施用。冻干剂型可以包括冷冻保护剂,主要是0%-10%的蔗糖(最佳为0.5%-1.0%)。其他合适的冷冻保护剂包括海藻糖和乳糖。其他合适的疏松剂(bulkingagent)包括甘氨酸和精氨酸(其任一种可以以0%-0.05%的浓度被包含)及聚山梨醇酯-80(最佳地以0.005%-0.01%的浓度被包含)。另外的表面活性剂包括但不限于聚山梨醇酯20和brij表面活性剂。药物组合物可以被制备为可注射溶液,并且还可以包含可用作佐剂的剂,诸如用于增加吸收或分散的那些,例如,透明质酸酶。
剂量可以取决于几个因素,包括疾病的严重程度和响应性、施用途径、治疗时间(几天至几个月至几年)、以及到改善疾病的时间。本文提供的化合物的毒性和治疗功效可以通过细胞培养或动物模型中的标准药物程序来确定。例如,可以确定ld50、ed50、ec50和ic50,并且可以计算毒性和治疗效果之间的剂量比值(ld50/ed50)作为治疗指数。可以使用表现出毒性副作用的组合物,其中仔细修改以使潜在的损伤最小化以降低副作用。剂量最初可以从细胞培养测定和动物模型估计。从体外和体内测定和动物研究获得的数据可用于配制在人类中使用的剂量范围。
治疗方法
本发明的另一方面提供了治疗与高氨血症相关的疾病或紊乱的方法。在一些实施方案中,本发明提供了用于降低、改善或消除与这些疾病或紊乱相关的一种或更多种症状的方法。在一些实施方案中,紊乱是尿素循环障碍,诸如精氨基琥珀酸尿症、精氨酸酶缺乏症、氨甲酰磷酸合成酶缺乏症、瓜氨酸血症、n-乙酰谷氨酸合成酶缺乏症和鸟氨酸转氨甲酰酶缺乏症。在替代实施方案中,该紊乱是肝脏疾病,诸如肝性脑病、急性肝衰竭或慢性肝衰竭;有机酸疾病;异戊酸尿症;3-甲基巴豆酰甘氨酸尿症;甲基丙二酸血症;丙酸尿症;脂肪酸氧化缺陷;肉碱循环缺陷;肉碱缺乏症;β-氧化缺乏症;赖氨酸尿性蛋白耐受不良;吡咯啉-5-羧酸合成酶缺乏症;丙酮酸羧化酶缺乏症;鸟氨酸氨基转移酶缺乏症;碳酸酐酶缺乏症;高胰岛素血症-高氨血症综合征;线粒体疾病;丙戊酸疗法;天冬酰胺酶疗法;全肠胃外营养;用含甘氨酸溶液进行膀胱镜检查;肺/骨髓移植后;门体分流;尿路感染;输尿管扩张;多发性骨髓瘤;化学疗法;感染;神经源性膀胱;或肠道细菌过度生长。在一些实施方案中,与其相关的症状包括但不限于癫痫、共济失调、中风样病变、昏迷、精神病、视力损失、急性脑病、脑水肿以及呕吐、呼吸性碱中毒和低体温。
该方法可以包括用本文描述的细菌的至少一种遗传工程化的物种、菌株或亚型制备药物组合物,并将该药物组合物以治疗有效量施用至受试者。在一些实施方案中,本发明的遗传工程化的细菌例如以液体悬浮液口服施用。在一些实施方案中,本发明的遗传工程化的细菌在凝胶帽中冻干并口服施用。在一些实施方案中,本发明的遗传工程化的细菌经由饲管(feedingtube)或胃分流(gastricshunt)施用。在一些实施方案中,本发明的遗传工程化的细菌通过直肠施用,例如通过灌肠施用。在一些实施方案中,本发明的遗传工程化的细菌局部、肠内、空肠内、十二指肠内、回肠内和/或结肠内施用。
在某些实施方案中,将药物组合物施用至受试者降低受试者中的氨浓度。在一些实施方案中,本公开内容的方法可以将受试者中的氨浓度与未治疗或对照受试者的水平相比降低了至少约10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或更多。在一些实施方案中,通过比较在施用药物组合物之前和之后的受试者中的氨浓度来测量降低。在一些实施方案中,治疗或改善高氨血症的方法允许状况或紊乱的一种或更多种症状改善了至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
在药物组合物施用之前、期间和之后,可以在以下中测量受试者中的氨浓度:生物学样品诸如血液、血清、血浆、尿液、粪便物、腹膜液、肠粘膜刮屑,从组织收集的样品和/或从以下一个或更多个的内含物收集的样品:胃、十二指肠、空肠、回肠、盲肠、结肠、直肠和肛管。在一些实施方案中,该方法可包括施用本发明的组合物以将受试者中的氨浓度降低至不可检测的水平,或比治疗之前受试者的氨浓度的小约1%、2%、5%、10%、20%、25%、30%、40%、50%、60%、70%、75%或80%。
在某些实施方案中,包含突变体精氨酸调节子的遗传工程化的细菌是大肠杆菌nissle。遗传工程化的细菌可以在施用之后几小时或几天内被破坏,例如被消化道道或血清中的防御因子(sonnenborn等,2009),或者通过活化杀死开关。因此,包含突变体精氨酸调节子的药物组合物可以以治疗有效剂量和频率被再施用。小鼠体内nissle停留的长度示于图27中。在替代实施方案中,遗传工程化的细菌在施用之后数小时或数天内不被破坏,并且可以在消化道繁殖并定殖。
药物组合物可以单独施用或与一种或更多种另外的治疗剂组合施用,所述一种或更多种另外的治疗剂包括但不限于,苯丁酸钠、苯甲酸钠和苯丁酸甘油酯酯。在选择一种或更多种另外的治疗剂中的重要考虑因素是,该剂应该与本发明的遗传工程化的细菌相容,例如,该剂必须不杀死细菌。在一些实施方案中,药物组合物与食物一起施用。在替代实施方案中,药物组合物在食用食物之前或之后施用。药物组合物可以与一种或更多种膳食改变剂(dietarymodifications)例如低蛋白饮食和氨基酸补充剂组合施用。可以基于紊乱的症状严重程度和进展来选择药物组合物的剂量和施用频率。治疗临床医生可以选择适当的治疗有效剂量和/或施用频率。
体内治疗
本发明的遗传工程化的细菌可以在体内例如在动物模型中进行评价。可以使用与高氨血症相关的疾病或状况的任何合适的动物模型(参见,例如,deignan等,2008;nicaise等,2008),例如急性肝衰竭和高氨血症的小鼠模型。这种急性肝衰竭和高氨血症可以通过用巯基乙酰胺(thiolacetamide)(taa)处理来诱导(nicaise等,2008)。另一个示例性动物模型是spfash(毛皮稀疏伴随皮肤与毛发异常(sparsefurwithabnormalskinandhair))小鼠,其由于鸟氨酸转氨基甲酰酶基因中的错义突变显示升高的血浆氨水平(doolittle等,1974;hodges和rosenberg,1989)。本发明的遗传工程化的细菌可以例如通过口服管饲施用至动物,并且例如通过测量血液样品中的氨和/或粪便样品中的精氨酸、瓜氨酸或其他副产物来确定治疗功效。
示例性实施方案
1.一种遗传工程化的细菌,所述遗传工程化的细菌包含精氨酸调节子,
其中所述细菌包含编码具有与来自在相同条件下的相同细菌亚型的野生型n-乙酰谷氨酸合成酶相比降低的精氨酸反馈抑制的功能性n-乙酰谷氨酸合成酶的基因,其中编码精氨酸反馈抗性n-乙酰谷氨酸合成酶的基因的表达由被外源环境条件诱导的启动子控制;且
其中所述细菌已被遗传工程化为缺乏功能性argr。
2.根据实施方案1所述的细菌,其中控制所述精氨酸反馈抗性n-乙酰谷氨酸合成酶的表达的所述启动子在低氧或厌氧条件下被诱导。
3.根据实施方案1或2中任一项所述的细菌,其中通常存在于相应的野生型细菌中的功能性argr基因的每个拷贝已通过一个或更多个核苷酸缺失、插入或取代独立地缺失或使其失活。
4.根据实施方案3所述的细菌,其中通常存在于相应的野生型细菌中的功能性argr基因的每个拷贝已被缺失。
5.根据实施方案1-4中任一项所述的细菌,其中通常存在于相应的野生型细菌中的功能性argg基因的每个拷贝已通过一个或更多个核苷酸缺失、插入或取代独立地缺失或使其失活。
6.根据实施方案5所述的细菌,其中通常存在于相应野生型细菌中的功能性argg基因的每个拷贝已被缺失。
7.根据实施方案1-7中任一项所述的细菌,其中在诱导控制所述精氨酸反馈抗性n-乙酰谷氨酸合成酶的表达的启动子的条件下,存在于包含功能性arg盒的操纵子中并编码精氨酸生物合成酶的每种基因的转录与在相同条件下的野生型细菌中的相应基因相比被增加。
8.根据实施方案2-7中任一项所述的细菌,其中在低氧或厌氧条件下被诱导的启动子是fnr启动子。
9.根据实施方案2-7中任一项所述的细菌,其中所述精氨酸反馈抗性n-乙酰谷氨酸合成酶基因具有选自以下的dna序列:
a)seqidno:28,
b)除了冗余的遗传密码以外,编码与由seqidno:28编码的多肽相同的多肽的dna序列,以及
c)与a)或b)的dna序列具有至少80%同源性的dna序列。
10.根据实施方案1-9中任一项所述的细菌,其中所述细菌是非病原性细菌。
11.根据实施方案10所述的细菌,其中所述细菌是益生细菌。
12.根据实施方案10所述的细菌,其中所述细菌选自由以下组成的组:拟杆菌属、双歧杆菌属、梭菌属、埃希氏杆菌属、乳杆菌属和乳球菌属。
13.根据实施方案12所述的细菌,其中所述细菌是大肠杆菌菌株nissle。
14.根据实施方案2-13中任一项所述的细菌,其中编码所述精氨酸反馈抗性n-乙酰谷氨酸合成酶的所述基因存在于所述细菌中的质粒上,并且在所述质粒上被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
15.根据实施方案2-13中任一项所述的细菌,其中编码所述精氨酸反馈抗性n-乙酰谷氨酸合成酶的所述基因存在于所述细菌的染色体中,并且在所述染色体中被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
16.根据实施方案1-15中任一项所述的细菌,其中所述细菌是当所述细菌存在于哺乳动物消化道中时被补充的基因中的营养缺陷型。
17.根据实施方案16所述的细菌,其中哺乳动物的消化道是人类的消化道。
18.一种药学上可接受的组合物,所述药学上可接受的组合物包含根据实施方案1-17中任一项所述的细菌;和药学上可接受的载体。
19.根据实施方案18所述的药学上可接受的组合物,其中所述组合物被配制用于口服施用或直肠施用。
20.一种制备根据实施方案19所述的药学上可接受的组合物的方法,所述方法包括以下步骤:
a)使根据实施方案1-17中任一项所述的细菌在不诱导控制所述精氨酸反馈抗性n-乙酰谷氨酸合成酶的表达的所述启动子的条件下在生长培养基培养物中生长;
b)使所得的细菌与生长培养基分离;以及
c)将分离的细菌悬浮于药学上可接受的载体中。
21.一种治疗有相应需要的受试者中的高氨血症相关的紊乱或其症状的方法,所述方法包括将根据实施方案18所述的组合物施用至所述受试者持续足以减轻所述高氨血症相关的紊乱的严重程度的时间段的步骤。
22.根据实施方案21所述的方法,其中所述高氨血症相关的紊乱是尿素循环障碍。
23.根据实施方案22所述的方法,其中所述尿素循环障碍是精氨基琥珀酸尿症、精氨酸酶缺乏症、氨甲酰磷酸合成酶缺乏症、瓜氨酸血症、n-乙酰谷氨酸合成酶缺乏症或鸟氨酸转氨甲酰酶缺乏症。
24.根据实施方案21所述的方法,其中所述高氨血症相关的紊乱是肝脏疾病;有机酸疾病;异戊酸尿症;3-甲基巴豆酰甘氨酸尿症;甲基丙二酸血症;丙酸尿症;脂肪酸氧化缺陷;肉碱循环缺陷;肉碱缺乏症;β-氧化缺乏症;赖氨酸尿性蛋白耐受不良;吡咯啉-5-羧酸合成酶缺乏症;丙酮酸羧化酶缺乏症;鸟氨酸氨基转移酶缺乏症;碳酸酐酶缺乏症;高胰岛素血症-高氨血症综合征;线粒体疾病;丙戊酸疗法;天冬酰胺酶疗法;全肠胃外营养;用含甘氨酸溶液进行膀胱镜检查;肺/骨髓移植后;门体分流;尿路感染;输尿管扩张;多发性骨髓瘤;化学疗法;感染;神经源性膀胱;或肠道细菌过度生长。
25.根据实施方案24所述的方法,其中所述肝脏疾病是肝性脑病、急性肝衰竭或慢性肝衰竭。
26.根据实施方案25所述的方法,其中所述高氨血症相关的紊乱的症状选自由以下组成的组:癫痫、共济失调、中风样病变、昏迷、精神病、视力丧失损失、急性脑病、脑水肿以及呕吐、呼吸性碱中毒和低体温。
27.一种遗传工程化的细菌,所述遗传工程化的细菌包含突变体精氨酸调节子,
其中所述细菌包含编码被突变为与来自在相同条件下的相同细菌亚型的野生型n-乙酰谷氨酸合成酶相比降低精氨酸反馈抑制的功能性n-乙酰谷氨酸合成酶的基因,其中编码突变的n-乙酰谷氨酸合成酶的所述基因的表达由在低氧或厌氧条件下被诱导的启动子控制;
其中所述突变体精氨酸调节子包含一种或更多种操纵子,所述操纵子包含编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的基因,且
其中除了包含编码精氨基琥珀酸合酶的基因的操纵子以外的每种操纵子包含一种或更多种突变的arg盒,其特征在于降低经由argr结合的精氨酸介导的操纵子的阻遏的一种或更多种核酸突变,并保留足够亲和力的rna聚合酶结合以促进所述操纵子中的基因的转录。
28.根据实施方案27所述的遗传工程化的细菌,其中包含编码精氨基琥珀酸合酶的基因的操纵子包含一种或更多种突变的arg盒,其特征降低经由argr结合的精氨酸介导的操纵子的阻遏的一种或更多种核酸突变,并保留足够亲和力的rna聚合酶结合以促进所述精氨基琥珀酸合酶基因的转录。
29.根据实施方案27所述的遗传工程化的细菌,其中包含编码精氨基琥珀酸合酶的基因的操纵子包含调节所述精氨基琥珀酸合酶基因的转录的组成型活性启动子。
30.根据实施方案27-29中任一项所述的细菌,其中编码功能性n-乙酰谷氨酸合成酶的基因被突变为与来自在相同条件下的相同细菌亚型的野生型n-乙酰谷氨酸合成酶相比降低精氨酸反馈抑制。
31.根据实施方案27-30中任一项所述的细菌,其中与来自在相同条件下的包含野生型精氨酸调节子的相同细菌亚型的细菌相比,argr结合被降低。
32.根据实施方案27中任一项所述的细菌,其中与在相同条件下的相应的野生型细菌相比,降低经由argr结合的精氨酸介导的阻遏增加了编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶和精氨基琥珀酸裂合酶的基因的每一种的转录。
33.根据实施方案28所述的细菌,其中与在相同条件下的相应的野生型细菌相比,降低经由argr结合的精氨酸介导的阻遏增加了编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的基因的每一种的转录。
34.根据实施方案27所述的细菌,其中编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶和精氨基琥珀酸裂合酶的操纵子的每一种在所述操纵子的每种arg盒中包含一种或更多种核酸突变。
35.根据实施方案28所述的细菌,其中编码精氨酸生物合成酶n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的操纵子的每一种在所述操纵子中的每种arg盒中包含一种或更多种核酸突变。
36.根据实施方案27-35中任一项所述的细菌,所述细菌还包含编码野生型鸟氨酸乙酰转移酶的一种或更多种操纵子,其中编码野生型鸟氨酸乙酰转移酶的每种操纵子包含一种或更多种突变的arg盒,其特征在于降低经由argr结合的精氨酸介导的操纵子的阻遏的一种或更多种核酸突变,并保留足够亲和力的rna聚合酶结合以促进所述操纵子中的基因的转录。
37.根据实施方案27-36中任一项所述的细菌,其中在低氧或厌氧条件下被诱导的启动子是fnr启动子。
38.根据实施方案27-37中任一项所述的细菌,其中所述细菌另外包含编码野生型n-乙酰谷氨酸合成酶的一种或更多种操纵子,其中编码野生型n-乙酰谷氨酸合成酶的每种操纵子包含一种或更多种突变的arg盒,其特征在于降低经由argr结合的精氨酸介导的操纵子的阻遏的一种或更多种核酸突变,并保留足够亲和力的rna聚合酶结合以促进所述操纵子中的基因的转录;其中所述遗传工程化的细菌不包含野生型n-乙酰谷氨酸合成酶启动子。
39.根据实施方案27-39中任一项所述的细菌,其中编码n-乙酰谷氨酸激酶、n-乙酰谷氨酸磷酸还原酶、乙酰鸟氨酸氨基转移酶、n-乙酰鸟氨酸酶、氨甲酰磷酸合酶、鸟氨酸转氨甲酰酶、精氨基琥珀酸合酶和精氨基琥珀酸裂合酶的基因被分组到存在于大肠杆菌nissle中的操纵子。
40.根据实施方案27-39中任一项所述的细菌,其中每种操纵子包含启动子区域,并且其中所述突变体精氨酸调节子的每种启动子区域具有的g/c:a/t比值与在相应的野生型启动子区域中发现的g/c:a/t比值相差不多于10%。
41.根据实施方案27-40中任一项所述的细菌,其中每种突变的arg盒的特征在于与相应的野生型arg盒相比至少三个核苷酸突变。
42.根据实施方案27-41中任一项所述的细菌,其中所述突变体n-乙酰谷氨酸合成酶基因具有选自以下的dna序列:
a)seqidno:28,
b)其除了冗余的遗传密码以外,与seqidno:28编码相同的多肽的dna序列,以及
c)与a)或b)的dna序列具有至少80%同源性的dna序列。
43.根据实施方案27-42中任一项所述的细菌,所述细菌包含编码n-乙酰谷氨酸激酶、n-乙酰谷氨酰磷酸还原酶和精氨基琥珀酸裂合酶的单种操纵子,其中所述单种操纵子包含seqidno:5的突变的dna序列,其中所述突变在seqidno:5的核苷酸37、38、45、46、47的一个或更多个中;以及在seqidno:5的核苷酸55、56、57、67、68、69的一个或更多个中。
44.根据实施方案43所述的细菌,其中所述单种操纵子包含seqidno:6的dna序列。
45.根据实施方案27-44中任一项所述的细菌,其中编码乙酰鸟氨酸氨基转移酶的所述操纵子包含seqidno:11的突变的dna序列,其中所述突变在seqidno:11的核苷酸20、21、29、30、31的一个或更多个中;以及在seqidno:11的核苷酸41、42、50、52的一个或更多个中。
46.根据实施方案45所述的细菌,其中编码乙酰鸟氨酸氨基转移酶的所述操纵子包含seqidno:12的dna序列。
47.根据实施方案27-46中任一项所述的细菌,其中编码n-乙酰鸟氨酸酶的所述操纵子包含seqidno:7的突变的dna序列,其中所述突变在seqidno:7的核苷酸92、93、94、104、105、106的一个或更多个中;以及在seqidno:7的核苷酸114、115、116、123、124的一个或更多个中。
48.根据实施方案46所述的细菌,其中编码n-乙酰鸟氨酸酶的所述操纵子包含seqidno:8的dna序列。
49.根据实施方案27-48中任一项所述的细菌,其中编码鸟氨酸转氨甲酰酶的所述操纵子包含seqidno:3的突变的dna序列,其中所述突变在seqidno:3的核苷酸12、13、14、18、20的一个或更多个中;以及seqidno:3的核苷酸34、35、36、45、46的一个或更多个中。
50.根据实施方案49所述的细菌,其中编码鸟氨酸转氨甲酰酶的所述操纵子包含seqidno:4的dna序列。
51.根据实施方案27-50中任一项所述的细菌,其中编码氨甲酰磷酸合酶的操纵子的突变的启动子区域包含seqidno:9的突变的dna序列,其中所述突变在seqidno:9的核苷酸33、34、35、43、44、45的一个或更多个中;以及在seqidno:9的核苷酸51、52、53、60、61、62的一个或更多个中。
52.根据实施方案51所述的细菌,其中编码氨甲酰磷酸合酶的所述操纵子包含seqidno:10的dna序列。
53.根据实施方案27-52中任一项所述的细菌,其中编码n-乙酰谷氨酸合成酶的操纵子的突变的启动子区域包含seqidno:1的突变的dna序列,其中所述突变在seqidno:1的核苷酸12、13、14、21、22、23的一个或更多个中以及在seqidno:1的核苷酸33、34、35、42、43、44的一个或更多个中。
54.根据实施方案53所述的细菌,其中编码n-乙酰谷氨酸合成酶的所述操纵子包含seqidno:2的dna序列。
55.根据实施方案28所述的细菌,其中编码精氨基琥珀酸合酶的操纵子的突变的启动子区域包含seqidno:13的突变的dna序列,其中所述突变在seqidno:13的核苷酸9、11、19、21的一个或更多个中;在seqidno:13的核苷酸129、130、131、140、141、142的一个或更多个中;以及在seqidno:13的核苷酸150、151、152、161、162、163的一个或更多个中。
56.根据实施方案27所述的细菌,其中编码精氨基琥珀酸合酶的所述操纵子包含seqidno:31的dna序列。
57.根据实施方案28所述的细菌,其中编码精氨基琥珀酸合酶的所述操纵子包含seqidno:32的dna序列。
58.根据实施方案27-57中任一项所述的细菌,其中所述细菌选自由以下组成的组:拟杆菌属、双歧杆菌属、梭菌属、埃希氏杆菌属、乳杆菌属和乳球菌属。
59.根据实施方案27-58中任一项所述的细菌,其中所述细菌是大肠杆菌nissle。
60.根据实施方案27-59中任一项所述的细菌,其中所述操纵子的至少一种存在于所述细菌中的质粒上;并且其中相应于所述质粒上的精氨酸调节子基因的所述精氨酸调节子基因的所有染色体拷贝不编码活性酶。
61.根据实施方案60所述的细菌,其中编码突变的n-乙酰谷氨酸合成酶的所述基因存在于所述细菌中的质粒上,并且在所述质粒上被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
62.根据实施方案27-59中任一项所述的细菌,其中编码突变的n-乙酰谷氨酸合成酶的所述基因存在于所述细菌的染色体中,并且在所述染色体中被可操作地连接至在低氧或厌氧条件下被诱导的启动子。
63.根据实施方案27-62中任一项所述的细菌,其中所述细菌是当所述细菌存在于哺乳动物消化道道中时被补充的第一基因中的营养缺陷型。
64.根据实施方案63所述的细菌,其中哺乳动物的消化道是人类的消化道。
65.根据实施方案27-64中任一项所述的细菌,其中:
a)所述细菌是当所述细菌存在于哺乳动物消化道中时不被补充的第二基因中的营养缺陷型;
b)所述第二基因由存在于所述细菌中的诱导型的第三基因补充;且
c)所述第三基因的转录在足够高浓度的精氨酸存在下被诱导,从而补充所述第二基因中的营养缺陷型。
66.根据实施方案65所述的细菌,其中:
a)所述第三基因的转录被第二阻遏物阻遏;
b)所述第二阻遏物的转录被精氨酸-精氨酸阻遏物复合物阻遏。
67.根据实施方案66所述的细菌,其中所述第三基因和所述第二阻遏物各存在于质粒上。
68.一种药学上可接受的组合物,所述药学上可接受的组合物包含根据实施方案27-67中任一项所述的细菌;和药学上可接受的载体。
69.一种制备根据实施方案68所述的药学上可接受的组合物的方法,所述方法包括以下步骤:
a)使根据实施方案27-67中任一项所述的细菌在需氧条件下在生长培养基培养物中生长;
b)使所得的细菌与生长培养基分离;以及
c)将分离的细菌悬浮于药学上可接受的载体中。
70.一种治疗有相应需要的受试者中的高氨血症相关的紊乱或其症状的方法,所述方法包括将根据实施方案68所述的组合物施用至所述受试者持续足以减轻所述高氨血症相关的紊乱的严重程度的时间段的步骤。
71.根据实施方案70所述的方法,其中所述高氨血症相关的紊乱是尿素循环障碍。
72.根据实施方案71所述的方法,其中所述尿素循环障碍是精氨基琥珀酸尿症、精氨酸酶缺乏症、氨甲酰磷酸合成酶缺乏症、瓜氨酸血症、n-乙酰谷氨酸合成酶缺乏症或鸟氨酸转氨甲酰酶缺乏症。
73.根据实施方案70所述的方法,其中所述高氨血症相关的紊乱是肝脏疾病;有机酸疾病;异戊酸尿症;3-甲基巴豆酰甘氨酸尿症;甲基丙二酸血症;丙酸尿症;脂肪酸氧化缺陷;肉碱循环缺陷;肉碱缺乏症;β-氧化缺乏症;赖氨酸尿性蛋白耐受不良;吡咯啉-5-羧酸合成酶缺乏症;丙酮酸羧化酶缺乏症;鸟氨酸氨基转移酶缺乏症;碳酸酐酶缺乏症;高胰岛素血症-高氨血症综合征;线粒体疾病;丙戊酸疗法;天冬酰胺酶疗法;全肠胃外营养;用含甘氨酸溶液进行膀胱镜检查;肺/骨髓移植后;门体分流;尿路感染;输尿管扩张;多发性骨髓瘤;化学疗法;感染;神经源性膀胱;或肠道细菌过度生长。
74.根据实施方案73所述的方法,其中所述肝脏疾病是肝性脑病、急性肝衰竭或慢性肝衰竭。
75.根据实施方案70所述的方法,其中所述高氨血症相关的紊乱的症状选自由以下组成的组:癫痫、共济失调、中风样病变、昏迷、精神病、视力损失、急性脑病、脑水肿以及呕吐、呼吸性碱中毒和低体温。
76.根据实施方案27-75中任一项所述的细菌,其中所述细菌另外包含编码可检测产物的dna序列,其中编码所述可检测产物的dna序列的转录在精氨酸存在下被诱导。
77.根据实施方案76所述的细菌,其中:
a)编码所述可检测产物的dna序列的转录被第三阻遏物阻遏;且
b)第三阻遏物的转录被精氨酸-精氨酸阻遏物复合物阻遏。
78.一种选择产生高水平精氨酸的细菌的方法,所述方法包括:
a)提供根据实施方案77所述的细菌;
b)培养所述细菌持续第一时间段;
c)使培养物经历诱变;
d)培养诱变的培养物持续第二时间段;以及
e)选择表达所述可检测产物的细菌,由此选择产生高水平精氨酸的细菌。
79.根据实施方案78所述的方法,其中所述可检测产物是荧光蛋白,且选择包括使用荧光活化细胞分选仪。
整个说明书中引用的参考文献的完整引用包括:
1.altenhoefer等theprobioticescherichiacolistrainnissle1917interfereswithinvasionofhumanintestinalepithelialcellsbydifferententeroinvasivebacterialpathogens.femsimmunolmedmicrobiol.2004apr9;40(3):223-9.pmid:15039098;
2.andersen等uraciluptakeinescherichiacoiik-12:isolationofuraamutantsandcloningofthegene.jbacteriol.1995apr;177(8):2008-13.pmid:7721693;
3.arthur等intestinalinflammationtargetscancer-inducingactivityofthemicrobiota.science.2012oct5;338(6103):120-3.pmid:22903521;
4.aoyagi等gastrointestinalureaseinman.activityofmucosalurease.gut.1966dec;7(6):631-5.pmid:5957514;
5.arai等expressionofthenirandnorgenesfordenitrificationofpseudomonasaeruginosarequiresanovelcrp/fnr-relatedtranscriptionalregulator,dnr,inadditiontoanr.febslett.1995aug28;371(1):73-6.pmid:7664887;
6.caldara等thearginineregulonofescherichiacoli:whole-systemtranscriptomeanalysisdiscoversnewgenesandprovidesanintegratedviewofarginineregulation.microbiology.2006nov;152(pt11):3343-54.pmid:17074904;
7.caldara等argininebiosynthesisinescherichiacoli:experimentalperturbationandmathematicalmodeling.jbiolchem.2008mar7;283(10):6347-58.pmid:18165237;
8.caldovic等n-acetylglutamatesynthase:structure,functionanddefects.molgenetmetab.2010;100suppl1:s13-9.review.pmid:20303810;
9.callura等tracking,tuning,andterminatingmicrobialphysiologyusingsyntheticriboregulators.procnatlacadsciusa.2010sep7;107(36):15898-903.pmid:20713708;
10.castiglione等thetranscriptionfactordnrfrompseudomonasaeruginosaspecificallyrequiresnitricoxideandhaemfortheactivationofatargetpromoterinescherichiacoli.microbiology.2009sep;155(pt9):2838-44.pmid:19477902;
11.charlier等arginineregulonofescherichiacolik-12.astudyofrepressor-operatorinteractionsandofinvitrobindingaffinitiesversusinvivorepression.jmolbiol.1992jul20;226(2):367-86.pmid:1640456;
12.crabeel等characterizationofthesaccharomycescerevisiaearg7geneencodingornithineacetyltransferase,anenzymealsoendowedwithacetylglutamatesynthaseactivity.eurjbiochem.1997dec1;250(2):232-41.pmid:9428669;
13.cuevas-ramos等escherichiacoliinducesdnadamageinvivoandtriggersgenornicinstabilityinmamrmaliancells.procnatlacadsciusa.2010jun22;107(25):11537-42.pmid:20534522;
14.cunin等molecularbasisformodulatedregulationofgeneexpressioninthearginineregulonofescherichiacollk-12.nucleicacidsres.1983aug11;11(15):5007-19.pmid:6348703;
15.cunin等biosynthesisandmetabolismofarginineinbacteria.microbiolrev.1986sep;50(3):314-52.review.erratumin:microbiolrev.1987mar;51(1):178.pmid:3534538;
16.deignan等contrastingfeaturesofureacycledisordersinhumanpatients.molgenetmetab.2008jan;93(1);714.pmid:17933574;
17.deutscher.themechanismsofcarboncataboliterepressioninbacteria.curropinmicrobiol.2008apr;11(2):87-93.pmid:18359269;
18.diaz等ammoniacontrolandneurocognitiveoutcomeamongureacycledisorderpatientstreatedwithglycerolphenylbutyrate.hepatology.2013jun;57(6):2171-9.pmid:22961727;
19.dinleyici等saccharomycesboulardiicncm1-745lndifferentclinicalconditions.expertopinbiolther.2014nov;14(11):1593-609.pmid:24995675;
20.doolittle.anewalleleofthesparsefurgeneinthemouse.jhered.1974may-jun;65(3):194-5.pmid:4603259;
21.eckhardt等isolationandcharacterizationofmutantswithafeedbackresistantn-acetylglutamatesynthaseinescherichiacolik12.molgenngenet,1975jun19;138(3):225-32.pmid:1102931
22.eiglmeier等moleculargeneticanalysisoffnr-dependentpromoters.molmicrobiol.1989jul;3(7):869-78.pmid:2677602;
23.fraga等(2008).real-timepcr.currentprotocolsessentiallaborotorytechniques(10.3.1-10.3.33).johnwiley&sons,lnc.;
24.galimand等positivefnr-likecontrolofanaerobicargininedegradationandnitraterespirationinpseudomonasaeruginosa.jbacteriol.1991mar;173(5):1598-606.pmid:1900277;
25.gamper等anaerobicregulationoftranscriptioninitiationinthearcdabcoperonofpseudomonasaeruginosa.jbacteriol.1991aug;173(15):4742-50.pmid:1906871;
26.gardner等constructionofagenetictoggleswitchinescherichiacoli.nature.2000;403:339-42.pmid:10659857;
27.
28.
29.
30.hasegawa等activationofaconsensusfnr-dependentpromoterbydnrofpseudomonasaeruginosainresponsetonitrite.femsmicrobiollett.1998sep15;166(2):213-7.pmid:9770276;
31.hodges等thespfashmouse:amissensemutationintheornithinetranscarbamylasegenealsocausesaberrantmrnasplicing,procnatlacadsciusa.1989jun;86(11):4142-6.pmid:2471197;
32.hoeren等sequenceandexpressionofthegeneencodingtherespiratorynitrous-oxidereductasefromparacoccusdenitrificans.eurjbiochem.1993nov15;218(1):49-57.pmid:8243476;
33.hoffmann等defectsinaminoacidcatabolismandtheureacycle.handbclinneurol.2013;113:1755-73.review.pmid:23622399;
34.hosseini等proprionateasahealth-promotingmicrobialmetaboliteinthehumangut.nutrrev.2011may;69(5):245-58.pmid:21521227;
35.isabella等deepsequencing-basedanalysisoftheanaerobicstimuloninneisseriagonorrhoeae.bmcgenomics.2011jan20;12:51.pmid:21251255;
36.konieczna等bacterialureaseanditsroleinlong-lastinghumandiseases.currproteinpeptsci.2012dec;13(8):789-806.review.pmid:23305365;
37.lazier等hyperammonemicencephalopathyinanadenocarcinomapatientmanagedwithcarglumicacid.curroncol.2014oct;21(5):e736-9.pmid:25302046;
38.leonard(2006).disordersoftheureacycleandrelatedenzymes.lnbornmetabollicdiseases,第4版(等263-272页).springermedizinverlagheidelberg;
39.lim等nucleotidesequenceoftheargrgeneofescherichiacollk-12andisolationofitsproduct,thearginlnerepressor.procnatlacadsciusa.1987oct;84(19):6697-701.pmid:3116542;
40.makarova等conservationofthebindingsitefortheargininerepressorinallbacteriallineages.genomebiol.2001;2(4).pmid:11305941;
41.maas等studiesonthemechanismofrepressionofargininebiosynthesisinescherichiacoll.dominanceofrepressibilityindiploids.jmolbiol.1964mar;8:365-70.pmid:14168690;
42.maas.theargininerepressorofescherichiacoli.microbiolrev.1994dec;58(4):631-40.pmid:7854250;
43.meng等nucleotidesequenceoftheescherichiacolicadoperon:asystemforneutralizationoflowextracellularph.jbacteriol.1992apr;174(8):2659-69.pmid:1556085;
44.moore等regulationoffnrdimerizationbysubunitchargerepulsion.jbiolchem.2006nov3;281(44):33268-75.pmid:16959764;
45.mountain等cloningofabacillussubtilisrestrictionfragrnentcomplementingauxotrophicmutantsofeightescherichiacoligenesofargininebiosynthesis.molgengenet.1984;197(1):82-9.pmid:6096675;
46.nagamani等optimizingtherapyforargininosuccinicaciduria.molgenetmetab.2012sep;107(1-2):10-4.review.pmid:22841516;
47.nicaise等controlofacute,chronic,andconstitutivehyperammonemiabywild-typeandgeneticallyengineeredlactobacillusplantaruminrodents.hepatology.2008oct;48(4):1184-92.pmid:18697211;
48.nicoloff等twoargininerepressorsregulateargininebiosynthesisinlactobacillusplantarum,jbacteriol.2004sep;186(18):6059-69.pmid:15342575;
49.nougayrede等escherichiacoliinducesdnadouble-strandbreaksineukaryoticcells.science.2006aug11;313(5788):848-51.pmid:16902142;
50,olier等genotoxicityofescherichiacolinissle1917straincannotbedissociatedfromitsprobioticactivity.gutmicrobes.2012nov-dec;3(6):501-9.pmld:22895085;
51.pham等multiplemyeloma-inducedhyperammonemicencephalopathy:anentityassociatedwithhighin-patientmortality.leukres.2013oct;37(10):1229-32.review.pmid:23932549;
52.rajagopal等useofinduciblefeedback-resistantn-acetylgiutamatesynthetase(arga)genesforenhancedargininebiosynthesisbygeneticallyengineeredescherichiacolik-12strains.applenvironmicrobiol.1998may;64(5):1805-11.pmid:9572954;
53.ray等theeffectsofmutationoftheanrgeneontheaerobicrespiratorychainofpseudomonasaeruginosa.femsmicrobiollett.1997nov15;156(2):227-32.pmid:9513270;
54.reister等completegenomesequenceofthegram-negativeprobioticescherichiacolistrainnissle1917.jbiotechnol.2014oct10;187:106-7.pmid:25093936;
55.rembacken等non-pathogenicescherichiacoliversusmesalazineforthetreatmentofulcerativecolitis:aranaomisedtrial.lancet.1999aug21;354(9179):635-9.pmid:10466665;
56.remington′spharmaceuticalsciences,第22版.mackpublishingco.;
57.salmon等globalgeneexpressionprofilinginescherichiacolik12.theeffectsofoxygenavailabilityandfnr.jbiolchem.2003aug8;278(32):29837-55.pmid:12754220;
58.sat等theescherichiacolimazefsuicidemodulemediatesthyminelessdeath.jbacteriol,2003mar;185(6):1g03-7.pmid:12618443;
59.sawers.identificationandmolecularcharacterizationofatranscriptionalregulatorfrompseudomonasaeruginosapao1exhibitingstructuralandfunctionalsimilaritytothefnrproteinofescherichiacoli.molmicrobiol.1991jun;5(6):1469-81.pmid:1787797;
60.schneider等argininecatabolismandtheargininesuccinyltransferasepathwayinescherichiacoli.jbacteriol.1998aug;180(16):4278-86.pmid:9696779;
61.schultz.clinicaluseofe.colinissle1917ininflammatoryboweldisease.inflammboweldis.2008jul;14(7):1012-8.review.pmid:18240278;
62.sonnenborn等thenon-pathogenicescherichiacolistrainnissle1917-featuresofaversatileprobiotic.microbialecologyinhealthanddisease.2009;21:122-58;
63.suiter等fitnessconsequencesofaregulatorypolymorphisminaseasonalenvironment.procnatlacadsciusa.2003oct28;100(22):12782-6.pmid:14555766;
64.summerskill.ontheoriginandtransferofammoniainthehumangastrointestinaltract.medicine(baltimore).1966nov;45(6):491-6.pmid:5925900;
65.szwajkajzer等quantitativeanalysisofdnabindingbytheescherichiacoliargininerepressor.jmolbiol.2001oct5;312(5):949-62.pmid:11580241;
66.tian等bindingoftheargininerepressorofescherichiacolik12toitsoperatorsites.jmolbiol.1992jul20;226(2):387-97.pmid:1640457;
67.tian等explanationfordifferenttypesofregulationofargininebiosynthesisinescherichiacolibandescherichiacolik12causedbyadifferencebetweentheirargininerepressors.jmolbiol.1994jan7;235(1):221-30.fmid:8289243;
68.torres-vega等deliveryofglutaminesynthetasegenebybaculovirusvectors:aproofofconceptforthetreatmentofacutehyperammonemia.genether.2014oct23;22(1):58-64.pmid:25338921;
69.trunk等anaerobicadaptationinpseudomonasaeruginosa:definitionoftheanranddnrregulons.environmicrobiol.2010jun;12(6):1719-33.pmid:20553552;
70.tuchman等enhancedproductionofarginineandureabygeneticallyengineeredescherichiacolik-12strains.applenvironmicrobiol.1997jan;63(1):33-8.pmid:8979336;
71.ukena等probioticescherichiacolinissle1917inhibitsleakygutbyenhancingmucosalintegrity.plosone.2007dec12;2(12):e1308.pmid:18074031;
72.unden等alternativerespiratorypathwaysofescherichiacoli:energeticsandtranscriptionalregulationinresponsetoelectronacceptors.biochimbiophysacta.1997jul4;1320(3):217-34.review.pmid:9230919;
73.vanderwauven等pseudomonasaeruginosamutantsaffectedinanaerobicgrowthonarginine:evidenceforafour-geneclusterencodingtheargininedeirninasepathway.jbacteriol.1984dec;160(3):928-34.pmid:6438064;
74.walker.severehyperammonaemiainadultsnotexplainedbyliverdisease.annclinbiochem.2012may;49(pt3):214-28.review.pmid:22349554;
75.winteler等thehomologousregulatorsanrofpseudomonasaeruginosaandfnrofescherichiacolihaveoverlappingbutdistinctspecificitiesforanaerobicallyinduciblepromoters.microbiology.1996mar;142(pt3):685-93.pmid:8868444;
76.wu等directregulationofthenaturalcompetenceregulatorgenetfoxbycyclicamp(camp)andcampreceptorproteininvibiios.scirep.2015oct7;5:14921.pmid:26442598;
77.zimmermann等anaerobicgrowthandcyanidesynthesisofpseudomonasaeruginosadependonanr,aregulatorygenehomologouswithfnrofescherichiacoli.molmicrobiol.1991jun;5(6):1483-90.pmid:1787798;
78.wrighto,delmansm,stangb,ellist.geneguard:amodularplasmidsystemdesignedforbiosafety.acssynthbiol.2015mar20;4(3):307-16.pmid:24847673;
79.alifano等histidinebiosyntheticpathwayandgenes:structure,regulation,andevolution.microbiolrev.1996mar;60(1):44-69.pmid:8852895;
80.liuy,whiterh,whitmanwb.methanococciusethediaminopimelateaminotransferase(dapl)pathwayforlysinebiosynthesis.jbacteriol.2010jul;192(13):3304-10.pmid:20418392;
81.dogovski等(2012)enzymologyofbacteriallysinebiosynthesis,biochemistry,prof.denizekinci(编著),isbn:978-953-51-0076-8,lntech,从以下可得;http://www.intechopen.com/books/biochemistry/enzymology-of-bacterial-lysine-biosynthesis;
82.feng等roleofphosphorylatedmetabolicintermediatesintheregulationofglutaminesynthetasesynthesisinescherichiacoli.jbacteriol.1992oct;174(19):6061-70.pmid:1356964;
83.lodeiro等robustnessinescherichiacoliglutamateandglutaminesynthesisstudiedbyakineticmodel.jbiolphys.2008apr;34(1-2):91-106.pmid:19669495;
84.reboul等structuralanddynamicrequirementsforoptimalactivityoftheessentialbacterialenzymedihydrodipicolinatesynthase.ploscomputbiol.2012;8(6):e1002537.pmid:22685390;
85.saint-girons等structureandautoregulationofthemetjregulatorygeneinescherichiacoli.jbiolchem.1984nov25;259(22):14282-5.pmid:6094549;
86.shoeman等regulationofmethioninesynthesisinescherichiacoli:effectofmetjgeneproductands-adenosylmethionineontheexpressionofthemetfgene.procnatlacadsciusa.1985jun;82(11):3601-5.pmid:16593564;
87.vanheeswijk等nitrogenassimilationinescherichiacoli:puttingmoleculardataintoasystemsperspective.microbiolmolbiolrev.2013dec;77(4):628-95.pmid:24296575.
实施例
以下实施例提供了本公开内容的说明性实施方案。本领域普通技术人员将认识到可以在不改变本公开内容的精神或范围的情况下进行许多修改和变化。此类修改和变化被涵盖在本公开内容的范围内。这些实施例不以任何方式限制本公开内容。
精氨酸阻遏物结合位点(arg盒)
实施例1.arg盒突变
大肠杆菌nissle中包含每种精氨酸生物合成操纵子的argr结合位点的野生型基因组序列示于图6中。根据以下参数设计对这些序列的修改。对于每种野生型序列,arg盒以斜体显示。精氨酸调节子的arg盒与每种操纵子的启动子区域重叠。被加下划线的序列代表rna聚合酶结合位点,并且那些序列没有被改变。在argr结合期间被保护免受dna甲基化的碱基被突出显示,并且在argr结合期间被保护免受羟基自由基攻击的碱基被加粗。突出显示和加粗的碱基是用于破坏argr结合的突变的主要靶。
实施例2.λred重组
λred重组用于进行染色体修饰,例如arg盒突变。λred是使用来自噬菌体λ的重组酶将一段定制dna插入到大肠杆菌染色体的程序。将pkd46质粒转化到大肠杆菌nissle宿主菌株中。将大肠杆菌nissle细胞在lb培养基中生长过夜。将过夜培养物在5mllb培养基中以1:100稀释,并生长直至使其达到od600为0.4-0.6。将所有管、溶液和比色皿预冷至4℃。将大肠杆菌细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪(electroporator)设置为2.5kv。将1ngpkd46质粒dna添加至大肠杆菌细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在30℃孵育1小时。将细胞分散在选择性培养基板上并在30℃孵育过夜。
图6中示出的包含所需arg盒序列的dna序列从基因合成公司订购。对于arga操纵子,突变体调节区域包含以下核酸序列(seqidno:2):
gcaaaaaaacactttaaaaacttaataatttcctttaatcacttaaagaggtgtaccgtg。
λ酶用于通过同源重组将该构建体插入到大肠杆菌nissle的基因组中。将构建体基于其dna序列插入到大肠杆菌nissle的基因组中的特定位点。为了将构建体插入到特定位点,鉴定了构建体侧翼的同源dna序列。dna的同源序列包括在突变序列的两侧的约50个碱基。同源序列作为合成基因的一部分定购。可选地,可以通过pcr添加同源序列。该构建体用于替代大肠杆菌nissle基因组中arga上游的天然序列。该构建体包含可通过重组去除的抗生素抗性标志。所得的突变体arga构建体包含arga上游约50个碱基的同源性,可通过重组去除的卡那霉素抗性标志,gcaaaaaaacactttaaaaacttaataatttcctttaatcacttaaagaggtgtaccgtg以及与arga约50个碱基的同源性。
在一些实施方案中,将arg盒如以上描述在argg调节区域中突变,并使用λred重组将bba_j23100组成型启动子(syn-ucd105)插入到调节区域。这些细菌能够产生精氨酸。在替代实施方案中,argg调节区域(seqidno:31)保持argr阻遏型(syn-ucd104),且细菌能够产生瓜氨酸。
实施例3.转化大肠杆菌nissle
将突变的arg盒构建体转化到包含pkd46的大肠杆菌nissle中。将所有管、溶液和比色皿预冷至4℃。将过夜培养物在5ml包含氨苄青霉素的lb培养基中以1:100稀释并生长直至使其达到od600为0.1。添加0.05ml100xl-阿拉伯糖储备溶液以诱导pkd46λred表达。将培养物生长直至使其达到od600为0.4-0.6。将大肠杆菌细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪设置为2.5kv。将0.5μg突变的arg盒构建体添加至细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在37℃孵育1小时。将细胞分散在包含卡那霉素的lb板上并孵育过夜。
实施例4.验证突变体
通过菌落pcr验证突变的存在。用移液管吸头挑取菌落,并通过上下移液将其重悬于20μl冷ddh2o中。将3μl悬浮液移液到带有适当的抗生素指示板(indexplate)上以供以后使用。将指示板在37℃生长过夜。使用5μl10xpcr缓冲液、0.6μl10mmdntp、0.4μl50mmmg2so4、6.0μl10x增强剂和3.0μlddh2o制备pcr主混合物(每个pcr反应15μl主混合物)。通过将2μl对arga突变体构建体独特的引物(100μm储备液)混合到16μlddh2o中来制备10μm引物混合物。对于每20μl反应,将15μlpcr主混合物、2.0μl菌落悬浮液(模板)、2.0μl引物混合物2.0μl和1.0μlpfxplatinumdnapol混合在pcr管中。pcr热循环仪编程如下,其中步骤2-4重复34次:1)94℃,5:00min,2)94℃,0:15min,3)55℃,0:30min,4)68℃,2:00min,5)68℃,7:00min,并且然后冷却至4℃。使用10μl每种扩增子和2.5μl5x染料通过凝胶电泳分析pcr产物。仅当突变已插入到基因组时,才能形成pcr产物。
实施例5.去除选择标志
用pcp20去除抗生素抗性基因。将具有突变的arg盒的每种菌株在37℃在包含抗生素的lb培养基中生长,直至使其达到od600为0.4-0.6。将所有管、溶液和比色皿预冷至4℃。将细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪设置为2.5kv。将1ngpcp20质粒dna添加至细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在30℃孵育1-3小时。将细胞分散在包含卡那霉素的lb板上并孵育过夜。过夜未生长至足够的od600的菌落再孵育另外24小时。将200μl细胞分散在氨苄青霉素板上,将200μl细胞分散在卡那霉素板上,并且两者都在37℃生长过夜。氨苄青霉素板包含带有pcp20的细胞。卡那霉素板提供了多少细胞在电穿孔中存活的指示。来自氨苄青霉素板的转化体在43℃非选择性纯化并允许生长过夜。
实施例6.验证转化体
测试纯化的转化体对氨苄青霉素和卡那霉素的敏感性。从在43℃生长的板挑取菌落,并将其重悬在10μl的lb培养基中。将3μl细胞悬浮液移液到三个板中的每一个上:1)在37℃孵育的带有卡那霉素的lb板,其测试宿主菌株基因组中kanr基因的存在或不存在;2)在30℃孵育的带有氨苄青霉素的lb板,其测试来自pcp20质粒的ampr基因的存在或不存在;和3)在37℃孵育的无抗生素的lb板。如果对于特定菌落在卡那霉素或氨苄青霉素板上未观察到生长,则kanr基因和pcp20质粒两者都损失,并且将菌落保留用于进一步分析。将保留的菌落重新划线到lb板上以获得单菌落并在37℃生长过夜。通过测序基因组的arga区域来证实突变的基因组arg盒的存在。
对于图6中示出的arg盒突变和操纵子的每一种,重复λred重组、转化大肠杆菌nissle、验证突变、去除选择标志以及验证/测序转化体的方法。所得细菌在用于编码精氨酸生物合成酶的一种或更多种操纵子的每种arg盒中包含突变,使得对arg盒的argr结合降低,并且对所述操纵子的调节区域的总argr结合降低。
实施例7.精氨酸反馈抗性n-乙酰谷氨酸合成酶(argafbr)
除了以上描述的arg盒突变以外,大肠杆菌nissle细菌还包含在以下每种启动子的控制下表达的精氨酸反馈抗性n-乙酰谷氨酸合成酶(argafbr,seqidno:28)基因:四环素诱导型启动子、选自seqidno:16-27的fnr启动子。如本文讨论的,可以使用其他启动子。
argafbr基因在高拷贝质粒、低拷贝质粒或染色体上表达。syn-ucd101包含质粒上的野生型argr、野生型arga、四环素诱导型argafbr以及用于每种精氨酸生物合成操纵子的每种arg盒中的突变。质粒不包含功能性argr结合位点,即arg盒。syn-ucd101用于产生syn-ucd102,其包含质粒上的野生型argr、野生型arga、四环素诱导型argafbr以及用于每种精氨酸生物合成操纵子的每种arg盒中的突变。该质粒还包含功能性argr结合位点,即arg盒。在一些情况下,功能性argr的存在和/或形成可导致在除arg盒以外的位点的靶外结合。在该质粒中引入功能性arg盒可用于降低或消除靶外argr结合,即通过作为argr池。
syn-ucd104包含在低拷贝质粒上的野生型argr、野生型arga、四环素诱导型argafbr、四环素诱导型argg、以及用于每种精氨酸生物合成操纵子(除了argg以外)的每种arg盒中的突变。syn-ucd105包含在低拷贝质粒上的野生型argr、野生型arga、四环素诱导型argafbr、组成型表达的argg(seqidno:31,其包含bba_j23100组成型启动子)、以及用于每种精氨酸生物合成操纵子的每种arg盒中的突变。syn-ucd103是对照nissle构建体。
将argafbr基因以大肠杆菌nissle中的一个或更多个以下插入位点插入到细菌基因组中:male/k、arac/bad、lacz、thya、malp/t。可以使用任何合适的插入位点,参见,例如,图22。插入位点可以是基因组中的任何地方,例如在存活和/或生长所需的基因中,诸如thya(以产生营养缺陷型);在基因组的活跃区域,诸如基因组复制位点附近;和/或在趋异的启动子之间,以便降低诸如在阿拉伯糖操纵子的arab和arac之间的非预期转录的风险,。在插入位点,设计与插入位点和argafbr构建体同源的dna引物。通过pcr产生包含与靶位点具有同源性的构建体的线性dna片段,并如以上描述进行λred重组。
所得的大肠杆菌nissle细菌被遗传工程化为包含经由对n-乙酰谷氨酸合成酶的argr结合和精氨酸结合来降低精氨酸介导的对一种或更多种编码精氨酸生物合成酶的操纵子的阻遏的核酸突变,由此增强精氨酸和/或瓜氨酸生物合成(图25)。
精氨酸阻遏物(argr)
实施例8.argr序列
大肠杆菌nissle中的野生型argr核苷酸序列和argr缺失后的核苷酸序列如下示出。
实施例9.缺失argr
将pkd46质粒转化到大肠杆菌nissle宿主菌株中。将大肠杆菌nissle细胞在lb培养基中生长过夜。将过夜培养物在5mllb培养基中以1:100稀释,并生长直至使其达到od600为0.4-0.6。将所有管、溶液和比色皿预冷至4℃。将大肠杆菌细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪设置为2.5kv。将1ngpkd46质粒dna添加至大肠杆菌细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在30℃孵育1小时。将细胞分散在选择性培养基板上并在30℃孵育过夜。
通过pcr将argr基因上游和下游约50个碱基的同源性添加至pkd4质粒中的卡那霉素抗性基因中以产生以下kanr构建体:(argr上游~50个碱基)(终止子)(kanr基因侧翼为来自pkd4的frt位点)(argr下游的dna)。
在一些实施方案中,argr和argg基因两者如以上描述使用λred重组缺失,并且细菌能够产生瓜氨酸。
实施例10.转化大肠杆菌nissle
将kanr构建体转化到包含pkd46的大肠杆菌nissle中以缺失argr。将所有管、溶液和比色皿预冷至4℃。将过夜培养物在5ml包含氨苄青霉素的lb培养基中以1:100稀释并生长直至使其达到od600为0.1。添加0.05ml100xl-阿拉伯糖储备溶液以诱导pkd46λred表达。将培养物生长直至使其达到od600为0.4-0.6。将大肠杆菌细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪设置为2.5kv。将0.5μgkanr构建体添加至细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在37℃孵育1小时。将细胞分散在包含卡那霉素的lb板上并孵育过夜。
实施例11.验证突变体
通过菌落pcr验证突变的存在。用移液管吸头挑取菌落,并通过上下移液将其重悬于20μl冷ddh2o中。将3μl悬浮液移液到带有适当的抗生素指示板上以供以后使用。将指示板在37℃生长过夜。使用5μl10xpcr缓冲液、0.6μl10mmdntp、0.4μl50mmmg2so4、6.0μl10x增强剂和3.0μlddh2o制备pcr主混合物(每个pcr反应15μl主混合物)。通过将2μl对kanr基因独特的引物(100μm储备液)混合到16μlddh2o中来制备10μm引物混合物。对于每20μl反应,将15μlpcr主混合物、2.0μl菌落悬浮液(模板)、2.0μl引物混合物2.0μl和1.0μlpfxplatinumdnapol混合在pcr管中。pcr热循环仪编程如下,其中步骤2-4重复34次:1)94℃,5:00min,2)94℃,0:15min,3)55℃,0:30min,4)68℃,2:00min,5)68℃,7:00min,并且然后冷却至4℃。使用10μl每种扩增子和2.5μl5x染料通过凝胶电泳分析pcr产物。仅当kanr基因已插入到基因组时,才能形成pcr产物。
实施例12.去除选择标志
用pcp20去除抗生素抗性基因。将具有缺失的argr的菌株在包含抗生素的lb培养基中在37℃生长直至使其达到od600为0.4-0.6。将所有管、溶液和比色皿预冷至4℃。将细胞在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于1ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.5ml的4℃水中。将大肠杆菌在4℃以2,000rpm离心5min,去除上清液,并将细胞重悬于0.1ml的4℃水中。将电穿孔仪设置为2.5kv。将1ngpcp20质粒dna添加至细胞中,通过移液混合,并移液到无菌、冷的比色皿中。将干燥的比色皿置于样品室中,并施加电脉冲。立即添加1ml室温soc培养基,并且将混合物转移至培养管中,并在30℃孵育1-3小时。将200μl细胞分散在氨苄青霉素板上,将200μl细胞分散在卡那霉素平板上,并且两者都在37℃生长过夜。氨苄青霉素板包含带有pcp20的细胞。将细胞孵育过夜,并且过夜未生长至足够的od600的菌落再孵育另外24小时。卡那霉素板提供了多少细胞在电穿孔中存活的指示。来自氨苄青霉素板的转化体在43℃非选择性纯化并允许生长过夜。
实施例13.验证转化体
测试纯化的转化体对氨苄青霉素和卡那霉素的敏感性。从在43℃生长的板挑取菌落,并将其重悬在10μl的lb培养基中。将3μl细胞悬浮液移液到三个板中的每一个上:1)在37℃孵育的带有卡那霉素的lb板,其测试宿主菌株基因组中kanr基因的存在或不存在;2)在30℃孵育的带有氨苄青霉素的lb板,其测试来自pcp20质粒的ampr基因的存在或不存在;和3)在37℃孵育的无抗生素的lb板。如果对于特定菌落在卡那霉素或氨苄青霉素板上未观察到生长,则kanr基因和pcp20质粒两者都损失,并且将菌落保留用于进一步分析。将保留的菌落重新划线到lb板上以获得单菌落并在37℃下生长过夜。通过测序基因组的argr区域来确认argr的缺失。
实施例14.精氨酸反馈抗性n-乙酰谷氨酸合成酶(argafbr)
除了以上描述的argr缺失以外,大肠杆菌nissle细菌还包含在以下每种启动子的控制下表达的精氨酸反馈抗性n-乙酰谷氨酸合成酶(argafbr,seqidno:28)基因:四环素诱导型启动子、选自seqidno:16-27的fnr启动子。如本文讨论的,可以使用其他启动子。
argafbr基因在高拷贝质粒、低拷贝质粒或染色体上表达。syn-ucd201、syn-ucd202和syn-ucd203的每一个中的argr被缺失(δargr)。syn-ucd201还包含野生型arga,但缺乏诱导型argafbr。syn-ucd202包含δargr和在高拷贝质粒上的四环素诱导型启动子控制下表达的argafbr。syn-ucd203包含δargr和在低拷贝质粒上的四环素诱导型启动子控制下表达的argafbr。syn-ucd204包含δargr和在低拷贝质粒上的四环素诱导型启动子控制下表达的argafbr。syn-ucd205包含δargr和在低拷贝质粒上的fnr诱导型启动子(fnrs2)的控制下表达的argafbr。
将argafbr基因以大肠杆菌nissle中的一个或更多个以下插入位点插入到细菌基因组中:male/k、arac/bad、lacz、thya、malp/t。可以使用任何合适的插入位点,参见,例如,图22。插入位点可以是基因组中的任何地方,例如在存活和/或生长所需的基因中,诸如thya(以产生营养缺陷型);在基因组的活跃区域,诸如基因组复制位点附近;和/或在趋异的启动子之间,以便降低诸如在阿拉伯糖操纵子的arab和arac之间的非预期转录的风险,。在插入位点,设计与插入位点和argafbr构建体同源的dna引物。通过pcr产生包含与靶位点具有同源性的构建体的线性dna片段,并如以上描述进行λred重组。所得的大肠杆菌nissle细菌已经缺失argr并插入反馈抗性n-乙酰谷氨酸合成酶,由此增加精氨酸或瓜氨酸生物合成。
实施例15.定量氨
将以上描述的遗传工程化的细菌在5mllb中生长过夜。第二天,将细胞沉淀并在m9+葡萄糖中洗涤,沉淀,并重悬于3mlm9+葡萄糖中。将细胞培养物伴随振摇(250rpm)孵育4小时,并在37℃在coy厌氧室(供应90%n2、5%co2、5%h2)中需氧或无氧孵育。在基线(t=0)、2小时和4小时,测量每种细胞培养物的od600,以确定每种细胞的相对丰度。
在t=0、2小时和4小时,在novabiomedicalbioprofileanalyzer300上分析每种细胞培养物的1ml等分试样,以确定培养基中氨的浓度。syn-ucd101和syn-ucd102两者都能体外消耗氨。图28a、b和c描绘了使用syn-ucd202、syn-ucd204、syn-ucd103和空白对照的氨浓度条形图。
实施例16.定量精氨酸和瓜氨酸
在一些实施方案中,将以上描述的遗传工程化的细菌在37℃在lb中伴随振摇生长过夜。将细菌在5mllb中以1:100稀释,并在37℃伴随振摇生长1.5小时。细菌培养物如下诱导:(1)在37℃在coy厌氧室的厌氧条件(供应90%n2、5%co2、5%h2和20mm硝酸盐)下,将包含fnr诱导型argafbr的细菌在37℃在lb中诱导多达4小时;(2)将包含四环素诱导型argafbr的细菌用无水四环素(100ng/ml)诱导;(3)将包含阿拉伯糖诱导型argafbr的细菌在缺乏葡萄糖的培养基中用1%阿拉伯糖诱导。在诱导之后,从培养箱中取出细菌细胞,并以最大速度离心5分钟。将细胞重悬于1mlm9葡萄糖中,并测量od600。将细胞稀释直至od600在0.6-0.8之间。将重悬的细胞在37℃在m9葡萄糖培养基中伴随震摇需氧生长。取出100ul细胞重悬浮液,并在时间=0时测量od600。将100ul等分试样在圆底96孔板中冷冻于-20℃用于质谱分析(lc-ms/ms)。在每个随后的时间点,取出100ul的细胞悬浮液并测量od600;将100ul等分试样在圆底96孔板中冷冻于-20℃用于质谱分析。分析样品中的精氨酸和/或瓜氨酸浓度。在每个时间点,如通过质谱法相对于od600确定的归一化浓度用于确定每单位时间的精氨酸和/或瓜氨酸生产速率。
在一些实施方案中,将来自甘油储备液的以上描述的遗传工程化的细菌在琼脂上划线用于单菌落。挑取菌落并使其在3mllb中生长4小时或过夜,然后以2,500rcf离心5min。培养物在具有0.5%葡萄糖的m9培养基中洗涤。将培养物重悬于3ml具有0.5%葡萄糖的m9培养基中,并测量od600。培养物在具有0.5%葡萄糖、具有或不具有atc(100ng/ml)、具有或不具有20mm谷氨酰胺的m9培养基中稀释,使得所有od600在0.4和0.5之间。取出每种样品的0.5ml等分试样,以14,000rpm离心5min,并且将清液取出并保存。将上清液冷冻于-80℃,并且将细胞沉淀冷冻于-80℃(t=0)。将剩余的细胞伴随振摇(250rpm)生长4-6小时,并在37℃在coy厌氧室(供应90%n2、5%co2、5%h2)中需氧或无氧孵育。每两个小时从每种样品中取出一份0.5ml等分试样,并测量od600。将等分试样以14,000rpm离心5min,并取出上清液。将上清液冷冻于-80℃,将细胞沉淀冷冻于-80℃(t=2、4和6小时)。将样品置于冰上,并使用质谱法确定精氨酸和瓜氨酸水平。
对于细菌培养物上清液,在水中制备500、100、20、4和0.8ug/ml精氨酸和瓜氨酸标准品的样品。在圆底96孔板中,将20ul样品(细菌上清液或标准品)添加至80ul具有最终浓度为2μg/ml的l-精氨酸-13c6,15n4(sigma)和l-瓜氨酸-2,3,3,4,4,5,5-d7(cdn同位素)内标的水中。将板用pierceaseal箔热密封并充分混合。在v-底96孔聚丙烯板中,将5μl稀释的样品添加至95μl衍生化混合物(85μl10mmnahco3ph9.7和10μl10mg/ml丹磺酰氯(dansyl-chloride)(稀释在乙腈中)。将该板用thermaseal箔热密封并充分混合。将样品在60℃孵育45min用于衍生化,并以4000rpm离心5min。在圆底96孔板中,将20μl衍生化的样品添加至180μl具有0.1%甲酸的水中。将该板用clearaseal片热密封并充分混合。
使用thermotsqquantummax三重四极杆质谱仪通过与串联质谱偶联的液相色谱(lc-ms/ms)测量精氨酸和瓜氨酸。下表提供了lc-ms/ms方法的总结。
图51描绘了在基线、2小时和4小时时来自syn-ucd101、syn-ucd102和空白对照的培养基中的体外氨水平的条形图。syn-ucd101和syn-ucd102两者都能体外消耗氨。
图52描绘了在诱导(+atc)和非诱导(-atc)条件下由未修饰的nissle、syn-ucd201、syn-ucd202和syn-ucd203产生的体外精氨酸水平的条形图。与未修饰的nissle和syn-ucd201相比,syn-ucd202和syn-ucd203两者都能体外产生精氨酸。与syn-ucd202相比,syn-ucd203在非诱导条件下表现出较低水平的精氨酸产生。
图24描绘了在诱导(+atc)和非诱导(-atc)条件下由syn-ucd103、syn-ucd201、syn-ucd202和syn-ucd203产生的体外精氨酸水平的条形图。syn-ucd201包含δargr和无argafbr。syn-ucd202包含δargr和高拷贝质粒上的四环素诱导型argafbr。syn-ucd203包含δargr和低拷贝质粒上的四环素驱动的argafbr。
图25描绘了在诱导条件下由syn-ucd103、syn-ucd104、syn-ucd204和syn-ucd105产生的精氨酸和瓜氨酸的体外水平的条形图。
图26描绘了在氧气的存在(+o2)或不存在(-o2)下,在诱导(+atc)和非诱导(-atc)条件下由syn-ucd103、syn-ucd205和syn-ucd204产生的体外精氨酸水平的条形图。
图27描绘了nissle体内停留的图。将链霉素抗性nissle经由口服管饲施用至小鼠无需抗生素预处理。在施用后监测来自总计六只小鼠的粪粒,以确定施用的nissle仍然停留于小鼠胃肠道内的量。条代表施用至小鼠的细菌数目。线代表连续10天每天从粪便样品回收的nissle的数目。
图28a描绘了用未修饰的对照nissle或syn-ucd202处理的高氨血症小鼠中的氨水平的条形图,syn-ucd202是遗传工程化的菌株,其中arg阻遏物基因被缺失,并且argafbr基因在高拷贝质粒上的四环素诱导型启动子的控制下。图28b描绘了显示在肝性脑病的taa小鼠模型中syn-ucd204相对于链霉素抗性对照nissle(syn-ucd103)和仅媒介物对照的体内功效(氨消耗)的条形图。图28c描绘了在taa处理后24-48小时之间血氨浓度变化百分比的条形图。
图29描绘了用链霉素抗性nissle对照(syn-ucd103)或syn-ucd204处理的高氨血症spfash小鼠中氨水平的条形图。
测量了在atc或厌氧诱导物的存在或不存在下,遗传工程化的细菌中的细胞内精氨酸和分泌(上清)精氨酸产生,并与在相同条件下的相同菌株的对照细菌进行比较。
测量了在atc或厌氧诱导物的存在或不存在下,遗传工程化的细菌中遗传工程化的细菌中在六个小时内的总精氨酸产生,并与相同条件下的相同菌株的对照细菌进行比较。
实施例17.遗传工程化的细菌在高氨血症和急性肝衰竭小鼠模型中的功效
野生型c57bl6/j小鼠用硫醇乙酰胺(taa)处理,巯基乙酰胺(taa)引起急性肝衰竭和高氨血症(nicaise等,2008)。用未修饰的对照nissle细菌或如以上描述被工程化为产生高水平的精氨酸或瓜氨酸的nissle细菌处理小鼠。
在第1天,将50ml的细菌培养物生长过夜并沉淀。将沉淀以约1011cfu/ml的终浓度重悬于5mlpbs中。通过下颌取血测量小鼠中的血氨水平,且氨水平由pocketchem氨分析仪(arkray)确定。将小鼠用100μl细菌(约1010cfu)管饲。将小鼠饮用水改为包含0.1mg/ml无水四环素(atc)和5%的蔗糖用于适口性。
在第2天,如以上描述制备细菌管饲溶液,并用100μl细菌管饲小鼠。小鼠继续接受包含0.1mg/mlatc和5%蔗糖的饮用水。
在第3天,如以上描述制备细菌管饲溶液,并用100μl细菌管饲小鼠。小鼠继续接受包含0.1mg/mlatc和5%蔗糖的饮用水。小鼠接受100μltaa(在0.5%nacl中,250mg/kg体重)的腹膜内(ip)注射。
在第4天,如以上描述制备细菌管饲溶液,并用100μl细菌管饲小鼠。小鼠继续接受包含0.1mg/mlatc和5%蔗糖的饮用水。小鼠接受100μltaa(在0.5%nacl中,250mg/kg体重)的另一次ip注射。通过下颌取血测量小鼠中的血氨水平,且氨水平由pocketchem氨分析仪(arkray)确定。
在第5天,通过下颌取血测量小鼠中的血氨水平,且氨水平由pocketchem氨分析仪(arkray)确定。从小鼠收集粪粒,以通过液相色谱-质谱(lc-ms)确定精氨酸含量。比较了用遗传工程化的nissle和未修饰对照nissle处理的小鼠中的氨水平。
实施例18.遗传工程化的细菌在高氨血症和ucd的小鼠模型中的功效
鸟氨酸转氨甲酰酶是尿素循环酶,且包含spf-ash突变的小鼠表现出部分鸟氨酸转氨甲酰酶缺乏症,其作为人类ucd的模型。用未修饰的对照nissle细菌或如以上描述被工程化为产生高水平的精氨酸或瓜氨酸的nissle细菌处理小鼠。
用本发明的遗传工程化的细菌(syn-ucd103、syn-ucd204)或以100ulpoqd的h2o对照处理60只spf-ash小鼠:h2o对照,正常食物(n=15);h2o对照,高蛋白食物(n=15);syn-ucd103,高蛋白食物(n=15);syn-ucd204,高蛋白食物(n=15)。在第1天,将小鼠称重并分选为组,以使每笼小鼠重量的变化最小化。将小鼠管饲,并且将具有20mg/latc的水添加至笼中。在第2天,小鼠在早晨和下午被管饲。在第3天,小鼠在早晨被管饲,并称重,并且在给药后4h抽取血液以获得基线氨水平。小鼠在下午被管饲,且食物被更换为70%的蛋白食物。在第4天,小鼠在早晨和下午被管饲。在第5天,小鼠在早晨被管饲,并称重,并在给药后4h抽血以获得氨水平。在第6天和第7天,小鼠在早晨被管饲。在第8天,小鼠在早晨被管饲,并称重,并在给药后4h抽血以获得氨水平。在第9天,小鼠在早晨和下午被管饲。在第10天,小鼠在早晨被管饲,并称重,并在给药后4h抽血以获得氨水平。在第12天,小鼠在早晨和下午被管饲。在第13天,小鼠在早晨被管饲,并称重,并在给药后4h抽血以获得氨水平。分析血氨水平、体重和存活率(图29)。
实施例19.nissle停留
未修饰的大肠杆菌nissle和本发明的遗传工程化的细菌可例如被消化道或血清中的防御因子破坏。可以计算细菌在体内的停留时间。下面描述使用大肠杆菌nissle的链霉素抗性菌株的非限制性实例。在替代实施方案中,计算本发明的遗传工程化的细菌的停留时间。
将c57bl/6小鼠在动物设施中适应1周。在适应一周以后(即第0天),在1-3天将链霉素抗性nissle(syn-ucd103)经由口服管饲施用至小鼠。小鼠未用抗生素预处理。施用的细菌,即接种物的量示于表4中。为了确定接种物的cfu,将接种物连续稀释,并铺板在包含链霉素(300μg/ml)的lb板上。将板在37℃孵育过夜,并计数菌落。
表4:经由口服管饲施用的cfu
在第2-10天,从最多达6只小鼠收集粪粒(id号1-6;表5)。在包含pbs的管中称重粪粒并均质化。为了确定粪粒中nissle的cfu,将均质化的粪粒连续稀释,并铺板于包含链霉素(300μg/ml)的lb板上。将平板在37℃孵育过夜,并计数菌落。
还收集第1天的粪粒,并铺板在包含链霉素(300μg/ml)的lb板上,以确定是否存在小鼠胃肠道天然的为链霉素抗性的任何菌株。施用的nissle仍然停留于小鼠胃肠道内的时间过程和量示于表5中。
图27描绘了nissle体内停留的图。将链霉素抗性nissle经由口服管饲施用至小鼠无需抗生素预处理。在施用后监测来自总计六只小鼠的粪粒,以确定施用的nissle仍然停留于小鼠胃肠道内的量。条代表施用至小鼠的细菌数目。线代表连续10天每天从粪便样品回收的nissle的数目。
表5:nissle体内停留
- 还没有人留言评论。精彩留言会获得点赞!
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法