苹果茎沟病毒侵染性克隆载体的构建方法与流程
本发明属于植物病毒学技术领域,特别是涉及苹果茎沟病毒侵染性克隆的构建方法。
背景技术:
苹果是全世界种植最广泛的重要水果之一。中国无论在苹果种植面积还是产量方面都是世界第一,约占全世界的四分之一。陕西省是中国的苹果种植大省,种植面积约600000公顷,产量约占世界的12%(张雪阳等2005;张党利等2010;徐立等2010)。然而,苹果病毒病的发生却严重影响着苹果的产量和质量(李文慧等2006)。在中国,侵染苹果的主要病毒有苹果茎沟病毒(applestemgroovingvirus,asgv)、苹果茎痘病毒(applestempittingvirus,aspv)和苹果褪绿叶斑病毒(applechloroticleafspotvirus,aclsv)等(李文慧等2006)。其中苹果茎沟病毒分布于各大苹果种植产区,在全世界范围内发生(洪建等2001;vanetal.2000)。早在1989年刘福昌等(1989)研究发现,我国主栽苹果品种上,苹果茎沟病毒的带毒率为33%-100%。1994年王国平等(1994)报道,我国北方15个主栽梨树品种中,苹果茎沟病毒的带毒率为32.8%。苹果主要通过嫁接来繁殖,在嫁接的过程中容易造成病毒的传播。苹果树一旦感染病毒后会终生带毒,持久危害,主要表现为抗性降低生长削弱、器官畸形等,有的导致树体急剧衰退等症状,造成树体生长不良,果实品质和产量下降等严重的经济损失(nemeth1986)。病毒病以其面积大、危害损失严重成为苹果生产上的严重病害。苹果病毒病害的危害严重及防治困难,一直是苹果生产和理论上的一个重要问题。国外自二十世纪40年代以来就开展苹果病毒的研究,提出了有效的病毒脱除、检测技术和鉴定程序(edwardsetal.1985;fuch1980,1982;listeretal.1965)。我国对果树病毒的研究起步较晚,但是我国的果树病毒病危害却较普遍。
由于苹果是重要栽培果树之一,陕西省又是中国的苹果第一大省。目前,包括苹果茎沟病毒在内的一些重要的苹果病毒严重影响着苹果的产量和品质,给苹果的安全生产带来了较大的危害(张雪阳等2005;张党利等2010;徐立等2010;李文慧等2006)。但是,目前对于这些重要苹果病毒的研究还较少,病毒的一些特性还不清楚,病毒的有效预防及控制还比较困难。本研究,针对苹果茎沟病毒开展其基因组测序与侵染性克隆等工作,是国内首次测定其全基因组序列,也是首次构建其侵染性克隆载体。通过测定苹果茎沟病毒的全基因组序列,并与世界上其它国家已报道的全基因组序列进行比较,以期了解其中国分离物的基因组特点。为研究该病毒的进化以及进一步了解该病毒,奠定重要的基础。构建该病毒的侵染性克隆载体,为进一步研究该病毒的基因功能奠定基础。
技术实现要素:
本发明提供了一种苹果茎沟病毒侵染性克隆载体的构建方法,通过基因重组的方式,将苹果茎沟病毒chn分离物的基因组克隆到pcass-rz载体双35s启动子的下游,获得了具有侵染活性的侵染性克隆pcass-asgv。利用pcass-asgv转化农杆菌,浸润接种昆诺藜,可以在昆诺藜植株内检测到苹果茎沟病毒外壳蛋白基因的表达。
本发明的技术方案是:
(1)从感染苹果茎沟病毒的苹果植株中提取病毒rna;
(2)以植物总rna为模板,分别设计特异性扩增苹果茎沟病毒的引物,引物序列如下:
涵盖苹果茎沟病毒的基因组全长;
(3)利用overlap-pcr的方法分别将asgv的8个片段拼接为2个大片段;
(4)利用限制性酶切的方法将2个大片段连接到植物表达载体pcass-rz的双35s启动子下游,获得带有asgv全长基因组的重组表达载体pcass-asgv;
(5)将pcass-asgv转化农杆菌,并浸润接种寄主植物,观察寄主症状并elisa检测。
本发明的优点:
(1)该侵染性克隆载体可以稳定保存;
(2)该侵染性克隆载体具有双35s启动子,无需体外转录,可用农杆菌浸润接种;
(3)苹果茎沟病毒不侵染人和动物,对环境安全;
附图说明
图1:asgv基因组片段扩增示意图;
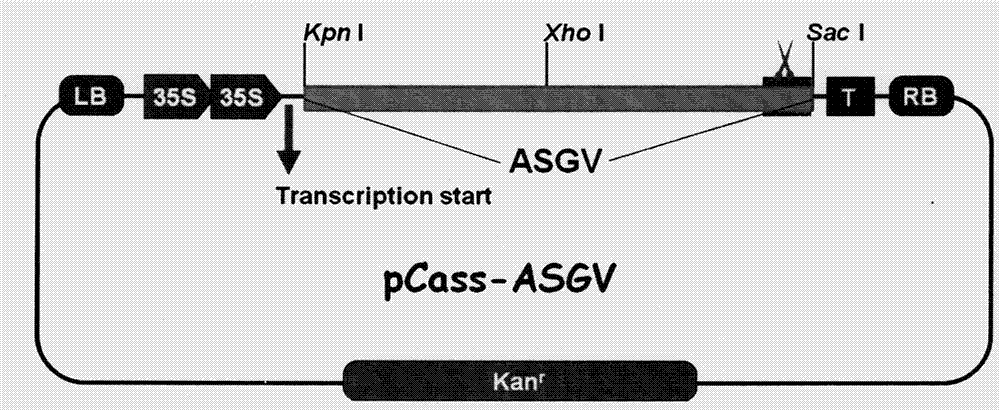
图2:pcass-asgv载体结构示意图;
图3:pcass-asgv阳性克隆载体的筛选检测,a:大片段1的pcr扩增检测,b:大片段2的pcr扩增检测,c:pcass-asgv质粒双酶切检测;
图4:pcass-asgv在昆诺藜植株的转录结果rt-pcr检测;
图5:pcass-asgv在昆诺藜植株的蛋白表达elisa检测。
具体实施方式
为了理解本发明,下面以实施例进一步说明本发明,但下述实施例并不限制本发明。
材料与试剂
感染苹果茎沟病毒的苹果树种植与西北农林科技大学杨凌试验站,采集叶片保存于-80℃冰箱中备用。
主要试剂:
rna提取试剂盒购自杭州博日公司;
m-mlv反转录酶购自promega公司;
taqdna聚合酶购自takara公司;
大肠杆菌(escherichia.coli)dh5α,农杆菌gv3101,dna标准marker1购自voson公司;
胶回收试剂盒购自bioteke公司。
实施步骤:
1.引物设计
首先本发明人从ncbi上下载了苹果茎沟病毒的全基因组序列,使用primer5设计了多组引物,然后根据引物所在序列区域的保守性、引物的发夹结构、二聚体gc含量以及tm值等综合因素选择了引物。引物组有16条引物。所述引物参见seqidno.1-16。引物的信息见表1。
表1引物序列seqidno.1-16的信息:
2.rna抽提
使用多糖多酚植物总rna快速提取试剂盒(离心柱形),按照操作说明,分别提取病株样品和健康样品的总rna,最后溶于30μl洗脱缓冲液中,保存于-80℃冰箱中。
3.rt-pcr扩增
逆转录方法:
(1)取无酶的pcr管子,加入2μl刚提取出来的rna,加入1μl的反转录引物以及1μl的dntps(10mmeach),然后利用depc水补足体积至5μl,离心充分混匀;
(2)70℃条件下水浴5min,然后立即放置于冰上冷却3min;
(3)接着瞬时离心后,加入5×m-mlvbuffer2.5μl,dntps(10mmeach)2.5μl,rna酶抑制剂0.25μl,m-mlv酶0.5μl,depc处理水1.75μl,瞬时离心混匀;
(4)42℃温育60min;
(5)70℃15min,终止反应,得到cdna。
pcr扩增方法:
(1)取pcr反应管,加入试剂如下:
(2)pcr反应程序:
94℃预变性3min,接着30个循环,循环条件如下:94℃变性45s,50℃退火45s,72℃延伸90s。
循环结束后72℃再延伸10min,然后设置pcr仪,保存于10℃。
(3)反应结束后,取4μlpcr产物进行琼脂糖凝胶电泳检测。
4.overlap-pcr方法
上述方法可得到苹果茎沟病毒的8个基因组片段,将临近的片段进行两两组合,分别用第一个片段的上游引物和第二个片段的下游引物进行扩增,分别得到片段a、b、c、d。在a片段的5’端引物加入kpni酶切位点,b片段的3’端引物加入xhoi酶切位点。在c片段的5’端引入xhoi位点,d片段的3’端引入saci酶切位点。并用同样方法再分别将片段a和b,c和d进行拼接,得到片段ab和片段cd。分别将引入酶切位点的片段ab和片段cd连接到pmd19-t载体,转化大肠杆菌,挑取阳性克隆,提取质粒备用。
5.限制性酶切
分别利用kpni、xhoi以及xhoi、saci酶切带有片段ab和cd的质粒。将酶切后的片段割胶纯化,备用。将pcass-rz载体利用kpni和saci进行双酶切,割胶纯化,备用。
6.t4连接、转化及质粒提取
将两个纯化后的片段ab和cd与酶切纯化后的pcass-rz载体同时进行连接,转化大肠杆菌,挑取阳性克隆提取质粒。对质粒再次进行双酶切验证。
7.转化农杆菌并接种昆诺藜
将pcass-asgv阳性质粒转化农杆菌,再次挑取单斑,利用pcr方法进行检测。保存检测为阳性的菌株用于下游实验。同时利用转化pcass-rz空质粒的农杆菌作为对照组,备用。利用含有目标质粒的农杆菌接种昆诺藜。同时以含有空pcass-rz质粒的农杆菌接种组为对照。每组接种15株昆诺藜。接种后,将昆诺藜黑暗过夜处理后,放置于光照温室培养。接种14天之后,对所接种的昆诺藜分别进行rt-pcr和elisa检测。结果接种组可以检测到目标病毒rna,而对照组则没有检测到。接种组elisa试验检测结果为阳性,对照组则为阴性。
- 还没有人留言评论。精彩留言会获得点赞!