卡介菌多糖核酸在促进CIK细胞增殖和提高CIK细胞的杀瘤活性中的应用的制作方法
本发明属于生物医药和生物治疗领域,具体涉及卡介菌多糖核酸提取物促进cik细胞增殖和增强cik细胞杀瘤活性中的应用,以及在制备cik细胞中的应用。
背景技术:
恶性肿瘤严重危害人类健康,目前常规的手术和放化疗治疗方法均不能彻底清除体内的瘤细胞,过继免疫治疗法因具有符合生理、低毒和高效等优点成为重要的肿瘤辅助治疗手段。其中,细胞因子诱导的杀伤细胞(cytokine-inducedkillercells。cik细胞)是近年来发现的一种新型抗瘤细胞,是以cd3+cd56+t细胞为主的异质细胞群,兼有nk细胞和t细胞的特征。在功能上,cik一方面拥有t淋巴细胞强大的抗肿瘤活性,另一方面还拥有nk细胞非mhc限制性的杀伤肿瘤的特点,其增殖迅速、对正常造血影响轻微。cik细胞的增殖和细胞毒活性依赖于多种外源性细胞因子的刺激,但何种因子组合为最佳尚无定论,因此研究如何进一步提高cik的增殖和杀瘤活性已经成为抗肿瘤的过继免疫细胞生物治疗的一个热点。
技术实现要素:
本发明的目的提供卡介菌多糖核酸在促进cik细胞增殖和提高cik细胞的杀瘤活性中的应用,技术方案如下:
卡介菌多糖核酸在促进cik细胞增殖和增强cik细胞杀瘤活性中的应用。
卡介菌多糖核酸在制备肿瘤生物治疗细胞中的应用,所述肿瘤生物治疗细胞为cik细胞。
制备cik细胞的步骤如下:
(1)人外周血单核细胞(pbmc)分离
①采集健康自愿者血液20ml,平衡温度至室温。同时将淋巴细胞分离液、生理盐水、培养基复温至室温。
②样品稀释:取一新的50ml离心管,先加入复温后的生理盐水10ml充分润洗管壁,然后用10ml移液管将血样转移至润洗过的50ml离心管,加生理盐水稀释血样至30ml,用移液管充分吹打均匀。
③梯度离心:取另一50ml离心管加入15ml人血淋巴细胞分离液,用10ml移液管将稀释血样缓缓转移至分离液上方,形成上下两相。22℃,390g离心30min(加速1,刹车0)。
④收集血浆:离心完成后,离心管内液相分为三层,从下往上分别为分离液、白膜层、血浆层,尽可能收集上层血浆至新的离心管,做好标记,-80度冻存备用。
⑤收集白膜层:用10ml移液管或1ml移液器小心收集中间的白膜层至新50ml离心管。
⑥清洗ⅰ:于收集了白膜层的离心管中加rpmi-1640至45ml,混匀,22℃,1000g离心10min(加速9,刹车9)。弃去上清液,加rpmi-1640至45ml重悬,吹打混匀。
⑦清洗ⅱ:22℃,400g离心10min(加速9,刹车9),弃去上清液,加rpmi-1640至45ml重悬,吹打混匀,取20μl细胞悬液进行台盼蓝染色计数,参照《细胞计数sop》。
⑧清洗ⅲ:22℃,201g离心10min(加速9,刹车9)。弃去上清液,按细胞数5×106个/ml加gt-t551培养液重悬,吹打混匀。
(2)pbmc诱导培养成cik
转移gt-t551培养液重悬的细胞至t25细胞培养瓶,加入终浓度为500ng/mlcd3mab及1000u/mlil-2的细胞因子及10%fbs,置于37℃、5%co2、90%相对湿度的细胞培养箱培养。隔天观察cik细胞状态,若细胞培养基颜色发黄,适当补液。每3天进行细胞计数,按1.5-2.0×106/ml的细胞密度补加cik培养液或半量换液。
本发明的有益效果:
(1)本发明中卡介菌多糖核酸促进cik细胞增殖,增加相关细胞毒活性因子granzymeb、perforin、tnf-α、tnf-β、inf-γ、fas的表达,提高cik细胞的杀瘤效果;
(2)通过卡介菌多糖核酸诱导培养的cik细胞能用于肿瘤疾病的细胞治疗。
附图说明
图1:bcg-psn影响cik细胞增殖的量效曲线
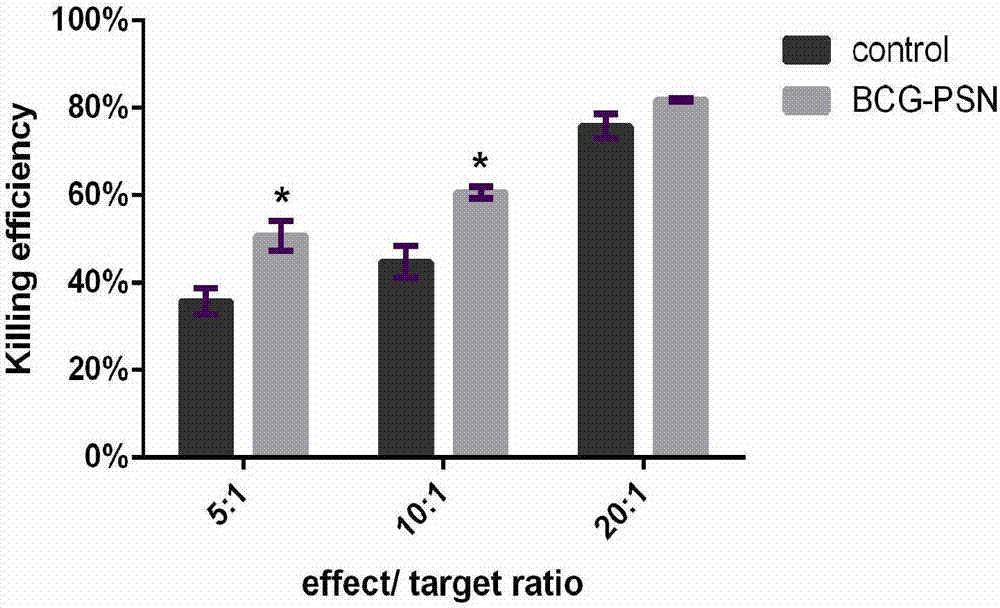
图2:cik细胞杀伤效率统计图。
图3:cik细胞rna电泳图。其中mark为dnastandardmarker;1为对照组cik细胞rna;2为bcg-psn实验组cik细胞rna。
图4:rt-qpcr检测cik细胞毒活性相关因子表达。
具体实施方式:
本发明所述的卡介菌多糖核酸可以为卡介菌多糖核酸原粉(精制的卡介菌多糖核酸提取物),也可以是卡介菌多糖核酸原粉制得的注射液(按照2010版中国药典第二增补版p400-401记载的制备),卡介菌多糖核酸原粉可通过按照2010版中国药典第二增补版p400-401记载的制备,也可以通过如下方法获得,但本领域技术人员可以理解卡介菌多糖核酸的制备包括但并不限于此种方法:
卡介菌多糖核酸原粉的制备详述如下:
1)卡介菌的培养和收获
1.菌体培养:将液体低温保藏的菌种(中国卡介苗制备用卡介菌株d2pb302,中国药品生物制品检定所)室温下溶解,接种于马铃薯苏通培养基,37℃连续培养14-20天;或在37℃连续培养15天后转种于改良的液体苏通培养基,37℃连续培养14-20天。
2.菌体收集:待菌体生长至对数期时,对培养瓶逐瓶检查后,收集菌膜,加入适量去离子蒸馏水洗涤,压干后称重。
2)卡介菌多糖核酸的制备
1.菌体破碎和热酚处理:将收集的菌体按10:1的比例加入纯化水,以组织捣碎匀浆机(12000rpm/min)破碎菌体,3min×3次,将菌体捣碎,然后再加入破碎菌悬液0.5-2.0倍体积量的热苯酚(30~100℃),在低速搅拌中保温30分钟~1小时。
2.卡介菌多糖核酸的提取:将热酚好的混合液自然沉淀1~10天,吸取上清液液,台式离心机高速离心后,取上清液加入等体积酚/氯仿(1:1),涡旋混匀后13000rpm离心2min,取上清液经0.45μm无菌滤器过滤,即为卡介菌多糖核酸混合液。
3)精制卡介菌多糖核酸原粉的制备
采用美国密里博(millipore)公司制造的k-prime40ⅱ凝胶层析过滤系统和gh-25凝胶介质进行卡介菌多糖、核酸、苯酚及卡介菌蛋白的分离。具体的制备过程如下:
(1)打开主机及监控电脑,将系统预热20至30分钟,并检查管道,柱体是否畅通完好,是否存在气泡。
(2)平衡:用0.9%生理盐水以1000ml/分钟经柱正向流动,直至柱前柱后电导、ph一致时结束平衡过程。
(3)上样:将卡介菌多糖核酸提取液经上样系统进行上样,上样速度为600ml/分钟。
(4)洗脱:上样结束后,用0.9%生理盐水以800ml/分钟速度进行洗脱,采用紫外分光仪(波长采用260nm或280nm)检测流出液,收集目的峰,将收集的核酸目的峰通过0.45μm无菌滤器过滤,即为精制卡介菌多糖核酸提取液。
(5)清洗:洗脱后用注射用水对系统进行清洗直至柱前、柱后电导接近于零时为止。
将所收集的精制卡介菌多糖核酸提取液进行醇沉,在精制卡介菌多糖核酸提取液中加入药用乙醇进行醇沉,含醇量为70-75%。自然沉淀4天后,收集沉淀物。沉淀物通过无水乙醇充分搅拌均匀、离心洗涤3次,然后用乙醚洗涤离心3次后,放至干燥器干燥,干燥物即为精制卡介菌多糖核酸原粉。
实施例1
1.1材料
淋巴细胞分离自健康志愿者外周血。smmc-7721肝癌细胞系于上海中科院购买,本实验室长期保存。斯奇康卡介菌多糖核酸注射液(1ml/支)为湖南斯奇生物制药有限公司生产。人血液淋巴细胞分离液购自佳和生物。采血针、采血管、生理盐水购自长沙市第四人民医院。人源cd3单抗购自北京同立源生物科技有限公司、人白介素(il-2)买自江苏金丝利药业有限公司。dmem培养液、rpmi-1640、gt-t551培养液及胎牛血清均为美国gibco公司产品。青霉素-链霉素溶液产自碧云天。
1.2方法
1.2.1cik细胞分离及原代培养
采集健康自愿者血液20ml,平衡温度至室温。取50ml离心管若干,将血样转移至离心管,用生理盐水稀释至30ml,充分吹打均匀。将稀释后的血样缓缓加入另一管装有15ml淋巴细胞分离液的上方,形成上下两相。22℃,390g离心30min(加速1,刹车0)。离心后血浆层与分离液之间有白膜层可见,分别收集上层血浆和中间白膜层至新的离心管。于收集白膜层的离心管中rpmi-1640至45ml,混匀,22℃,1000g离心10min(加速9,刹车9)。重复上一步骤两次,离心速度分别改为400g和201g,最后一次离心之前取20ul混匀的细胞悬液进行台盼蓝染色计数,参照《细胞计数sop》。离心后重悬细胞,按细胞数5×106个/ml加含有500ng/mlcd3mab、1000u/mlil-2和10%fbs的gt-t551培养基诱导培养成cik细胞。
1.2.2肿瘤细胞培养
在37℃,5%co2、90%相对湿度的细胞培养箱中用dmem完全培养液(含10%胎牛血清和100μg/ml青-链霉素溶液)培养smmc-7721细胞。
1.2.3cck-8检测细胞增殖活力
将培养至7天的cik细胞数调整至2×106个/ml,于96孔平底细胞培养板每孔加入细胞悬液50μl,设实验组和对照组,对照组为生理盐水组,实验组分为5组,分别加入卡介菌多糖核酸终浓度为1μl/ml、10μl/ml、50μl/ml、100μl/ml、200μl/ml的培养基各50μl,每个浓度4个平行对照孔,置于细胞培养箱中处理细胞72h,加入10μlcck-8溶液,4h后用酶联免疫检测仪检测od450值(吸光值的大小与活细胞的数量呈正比)。并对数据进行统计学分析。以bcg-psn浓度为横坐标,以吸光值为纵坐标,作细胞增殖曲线。
1.2.4肿瘤杀伤实验
将培养至第9天的cik细胞均分为两组,分别为对照组和实验组,对照组为生理盐水组,实验组为培养基终浓度为10μl/ml的卡介菌多糖核酸,置于细胞培养箱中处理细胞72h(至12d)。另外,在cik细胞培养至第11天的同时,将培养至对数生长期的smmc-7721细胞调整细胞密度为1×105个/ml,于96孔板中铺板每孔100ul细胞悬液,培养箱中培养24h。cik培养至第12天进行cik杀伤肿瘤细胞实验,弃去smmc-7721旧的培养液,分别按效应细胞/靶细胞为5:1、10:1、20:1比例调整两组cik细胞至相应数目加入smmc-7721细胞孔中,每个比例3个复孔,同时设单独靶细胞和单独效应细胞对照组,于细胞培养箱中培养4h。4h后每孔加入10μlcck-8溶液,细胞培养箱中孵育4h,酶标仪测定od450。并按照以下公式计算杀伤率。
杀伤率(%)=[1-(实验组的a值-单独效应细胞组的a值)/单独靶细胞组的a值]×l00%
1.2.5细胞总rna的提取及cdna的合成
(1)卡介菌多糖核酸处理cik细胞
调整培养至第9天的cik细胞数目至2×106个/ml,于6孔平底细胞培养板每孔加入细胞悬液1ml,设实验组和对照组,实验组加入卡介菌多糖核酸终浓度为10μl/ml的培养基1ml,对照组加入生理盐水,置于细胞培养箱中培养72h。
(2)rna提取及反转录
按trizol法提取cik细胞总rna,按照takara反转录试剂盒说明书操作,将rna反转录成cdna。
1.2.6实时定量pcr
(1)引物的设计与合成
根据genbank中基因的序列,查找文献及用primerprimer5软件设计cik相关毒活性因子granzymeb、perforin、tnf-α、tnf-β、inf-γ、fas、actin(内参)基因引物。将设计好的目的引物序列发给上海生工公司合成。
表1:
(2)荧光定量pcr
荧光定量pcr体系如下表,具体操作按照takarasybrrt-qpcr产品说明书进行。
表2:
2.结果
本实施例中数据以均数±标准差表示,采用方差分析,检验水准(p)定为0.05,实验数据以spss19.0统计软件处理。
2.1卡介菌多糖核酸对cik细胞增殖的影响
在cik细胞培养至第7天时,加入不同浓度的卡介菌多糖核酸处理细胞72h,然后用cck-8试剂盒检测cik细胞活性。分析数据见表3,以不同bcg-psn浓度为横坐标,吸光值为纵坐标作量效曲线图,结果如图1所示。结果表明bcg-psn浓度为1-10μl/ml时,能显著促进cik细胞的增殖。
表:3:卡介菌多糖核酸对cik细胞增殖的影响(x±sd)
*p<0.05,与对照组比较。
2.2卡介菌多糖核酸对cik细胞杀瘤活性的影响
培养至第9天的cik细胞加入卡介菌多糖核酸处理72h(至12d),再进行cik杀伤
smmc-7721肿瘤细胞实验。杀伤率统计结果见表4和图2,结果表明实验组cik细胞在效靶比为5:1和10:1时杀伤率有显著提高,统计分析差异有意义(p<0.05)。表明卡介菌多糖核酸对cik细胞杀伤肿瘤细胞的活性有显著增强作用。
表4:卡介菌多糖核酸对cik细胞杀瘤活性的影响(x±sd)
*p<0.05,与对照组比较。
2.3bcg-psn对cik细胞毒活性相关因子rna表达的影响
收集生理盐水和10μl/ml的卡介菌多糖核酸处理72h的两组cik细胞,提取rna反转录成cdna,做荧光定量pcr检测cik细胞毒活性相关因子的表达。琼脂糖凝胶电泳检测cik细胞rna质量,可看到28s、18s两条清晰的带,如图3。rt-qpcr结果见表5和图4,结果显示bcg-psn实验组cik细胞granzymeb、perforin、tnf-α、tnf-β、inf-γ、fas的mrna表达量较对照组明显升高,统计学分析差异有意义(p<0.05)。表明卡介菌多糖核酸能促进cik细胞granzymeb、perforin、tnf-α、tnf-β、inf-γ、fas的mrna的表达。
表5:卡介菌多糖核酸对cik细胞毒活性相关因子rna表达的影响(x±sd)
- 还没有人留言评论。精彩留言会获得点赞!