人脐带间充质干细胞膜颗粒及其制备与应用的制作方法
本发明涉及合成生物学技术,尤其涉及人脐带间充质干细胞膜颗粒及其制备和在传递生物大分子和细胞器中的应用。
背景技术:
近来,一项有争议的线粒体替换疗法获得英国政府的批准。该方法基于核移植技术,用于治疗高龄妇女的不孕问题,也可用于解决卵子携带致死线粒体dna突变所带来的困境。另外,与衰老相关的疾病,如动脉粥样硬化、2型糖尿病、老年滞呆症、和癌症等,通常具有多方面的缺陷。研究表明,脂质的累积、淀粉样蛋白沉淀、错误折叠蛋白在内质网的滞留、和损伤的蛋白酶体、自噬体、和线粒体都可导致衰老疾病的发生与恶化。目前,尚无有效的措施可以对胞浆及细胞器故障直接进行修复的机制与措施。
一种表达融膜蛋白的细胞膜颗粒及其制备和应用(申请号:201510655854.8)报道了一种通过机械挤压制备细胞膜颗粒的技术,除了细胞核,所有细胞膜和胞浆成分,如蛋白、rna及细胞器,都包含在细胞膜颗粒里。简单地说,细胞膜颗粒就如同一个小型化的去核细胞。重要的是,细胞膜颗粒与线粒体缺失型细胞rho0的融合导致细胞增殖能力的恢复。
人脐带间充质干细胞是多潜能的前体细胞,可以很方便地从胎儿脐带中获得并在体外培养扩增。这些细胞表达干细胞的标志物如oct4、nanog和sox2基因的产物,端粒酶的活性也能被检测到。另外,这些细胞不表达免疫辅助刺激分子及ii型hla复合物,i型hla的表达水平也很低,这使得人脐带间充质干细胞成为理想的异源细胞用于再生医学和免疫调控治疗。
有报道干细胞可能产生癌变,因此对干细胞生物安全性的顾虑使得干细胞的临床应用受到严重限制。因此,制备人脐带间充质干细胞膜颗粒,并建立一种高效传递生物大分子和细胞器的方法,对于治疗多种退行性疾病有重大意义。
技术实现要素:
本发明的第一目的在于提供人脐带间充质干细胞膜颗粒,可实现生物大分子和细胞器的有效传递。
为了解决上述技术问题,本发明采用如下的技术方案:
一种人脐带间充质干细胞膜颗粒,所述细胞膜颗粒表面表达人脐带间充质干细胞表面标志物,包裹生物大分子和细胞器;所述大分子包括所述人脐带间充质干细胞干性基因的mrna产物;所述细胞器包括线粒体、蛋白酶体、溶酶体和自噬体;所述细胞膜颗粒不具有细胞核、细胞核dna和核蛋白。能够有效包裹线粒体,并且传递到靶细胞中发挥功能。
进一步的,所述人脐带间充质干细胞细胞膜颗粒大小为1μm~5μm。
本发明的第二目的在于提供人脐带间充质干细胞膜颗粒的制备方法,包括以下步骤:
(1)无菌条件下培养人脐带间充质干细胞;
(2)用胰酶消化脐带间充质干细胞,离心3min,细胞沉淀于底部,用3ml的培养液将沉淀的脐带间充质干细胞重悬起来;
(3)将步骤(2)所得细胞悬液置于针筒,并将针筒安装到已安置聚碳酸酯膜的针头式过滤器中,推动针管使细胞悬液从过滤器一边推出到另外一边,获得脐带间充质干细胞膜颗粒。
步骤(2)采用3ml的体积的培养液较其它体积比如说0.5ml更有利于制备膜颗粒。步骤(2)中的培养液为dmem培养液添加10%的胎牛血清、1%的盘尼西林和链霉素。
胰酶是一种蛋白酶,通过在特定位置上降解蛋白,使细胞间结合处和细胞-培养皿处蛋白降解,这时细胞由于自身内部细胞骨架的张力作用下成为球形,从而使细胞分开。
进一步的,所述步骤(1)包括以下步骤:
(11)用pbs冲洗脐带与羊膜去除红细胞后,将wharton’sjelly切成3-4cm的小块,剔除血管,再切成更小的碎块,并转移至培养板,倒扣培养25-35分钟直至组织可以贴在培养板上;
(12)小心添加高糖dmem培养液,于37℃5%co2湿润培养箱培养,每两天更换培养液,5-7天可以看见纤维状人脐带间充质干细胞出现;
(13)将第5-8代的人脐带间充质干细胞用于后续处理。
进一步的,所述聚碳酸酯膜孔径大小为3μm;所述过滤器为25mm可换膜针头式过滤器。聚碳酸酯膜上面布满直径大小为3μm的圆,有利于形成形态完整、大小均匀的细胞膜颗粒。
本发明的第三目的在于提供人脐带间充质干细胞膜颗粒在传递生物大分子和细胞器中的应用。将目的生物大分子和细胞器传递到生物大分子和细胞器缺陷的细胞中。人脐带间充质干细胞膜颗粒能够有效包裹线粒体,并且传递到靶细胞中发挥功能。可以把目的生物大分子和细胞器传递到生物大分子和细胞器缺陷的细胞中,恢复细胞的正常功能。
进一步的,包括体外对生物大分子及细胞器的递送和对肝脏与脾脏递送生物大分子及细胞器。
与现有技术相比,本发明是在已有发明(一种表达融膜蛋白的细胞膜颗粒及其制备和应用,专利申请号:201510655854.8)上的改进;本发明涉及人脐带间充质干细胞膜颗粒及其制备和应用;人脐带间充质干细胞具有年轻性、免疫豁免性和多潜能性;人脐带间充质干细胞还具有很好的膜融合性。因此本发明制备的人脐带间充质干细胞膜颗粒包含了年轻的物质,包括干性基因的rna及蛋白产物,和完好的细胞器,如线粒体、蛋白酶体、溶酶体和自噬体,对衰老细胞和损伤细胞具有修复作用;人脐带间充质干细胞膜颗粒无需促融性病毒糖蛋白vsv-g,避免了针对病毒蛋白的免疫反应的产生;人脐带间充质干细胞膜颗粒也不含核dna,因此诱导靶细胞癌变的概率几乎不存在。不但在体外实现了生物大分子及细胞器的递送,通过小鼠腹腔注射还实现了对肝脏和脾脏的递送。这不但为研究生物大分子和细胞器缺陷相关的疾病奠定了基础,而且对于研究细胞核质关系有重要意义。
附图说明
图1为本发明人脐带间充质干细胞膜颗粒的制备方法示意图:
图2为本发明人脐带间充质干细胞的表征图;
图3为本发明人脐带间充质干细胞膜颗粒的表征图;
图4为本发明人脐带间充质干细胞膜颗粒和人脐带间充质干细胞所包含的干细胞干性基因的mrna表达图;
图5为本发明人脐带间充质干细胞膜颗粒和人脐带间充质干细胞产生的外泌体(exosome)的大小与体积对比图;
图6为本发明人脐带间充质干细胞膜颗粒包含线粒体、溶酶体和自噬体的荧光显微图;
图7为本发明人脐带间充质干细胞膜颗粒恢复线粒体缺失细胞143b/rho0的普通光学显微镜图及细胞个数统计图;
图8为本发明143b/rho0细胞在人脐带间充质干细胞膜颗粒处理前后的线粒体膜电位对比图;
图9为本发明人脐带间充质干细胞膜颗粒的dii荧光染料标记图;
图10为本发明dii荧光标记人脐带间充质干细胞膜颗粒注射小鼠腹腔12h后,肝脏及脾脏的荧光显微图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1
人脐带间充质干细胞膜颗粒的制备方法,主要包括以下步骤:
(1)剖腹产健康足月脐带与羊膜来自汕头大学医学院第二附属医院妇产科并获得家属同意及学校伦理委员会批准;
(2)用pbs冲洗去除红细胞后,将wharton’sjelly切成3-4cm的小块,剔除血管,再切成更小的碎块,并转移至10cm培养板,倒扣培养30分钟直至组织可以贴在培养板上;
(3)小心添加5ml高糖dmem(10%胎牛血清,100mg/ml青霉素,100mg/ml链霉素)培养液,于37度5%co2湿润培养箱培养,每两天更换培养液,5-7天可以看见纤维状细胞出现;
(4)5-8代的细胞用于实验;
(5)用胰酶消化脐带间充质干细胞,离心3min,细胞沉淀于底部,用3ml的培养液将沉淀的脐带间充质干细胞重悬起来;
(6)将步骤(5)所得细胞悬液置于针筒,并将针筒安装到已安置聚碳酸酯膜的针头式过滤器中,推动针管使细胞悬液从过滤器一边推出到另外一边,获得脐带间充质干细胞膜颗粒,如图1所示。
脐带间充质干细胞经机械挤压通过3μm孔径的滤膜,形成1-5μm的细胞膜颗粒,其中包含rna、蛋白、溶酶体、线粒体、自噬体等细胞器,但无细胞核。
实施例2
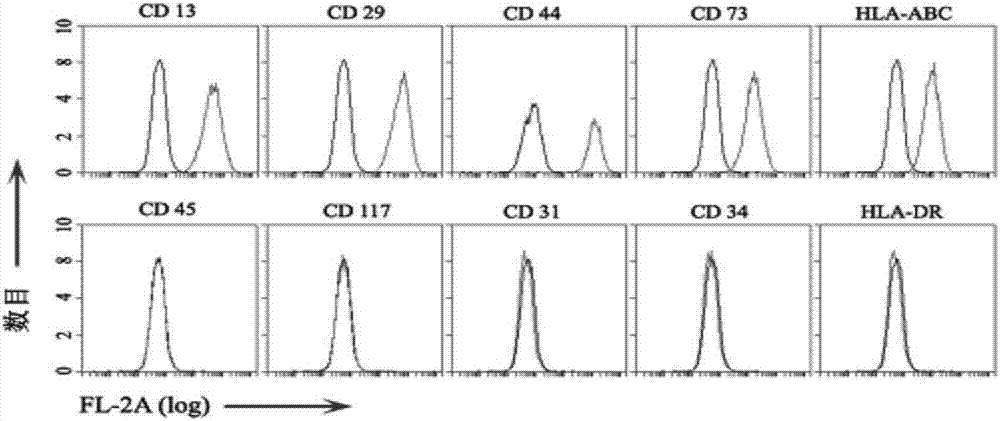
按照实施例1的方法收集2x106的人脐带间充质干细胞,重悬于200μl的培养液,然后添加1:50稀释的pe荧光标记的抗体,包括cd13、cd29、cd44、cd73、hla-abc、cd45、cd117、cd31、cd34和hla-dr的抗体,4℃孵育1-2h,用1%多聚甲醛固定,然后用流式细胞仪进行分析。分析结果如图2所示,实施例1培养的人脐带间充质干细胞表达典型的未分化的细胞表面标记蛋白,如cd13、cd29、cd44、cd73和hla-abc,而不表达细胞分化的编码标记蛋白,如cd45、cd117、cd31、cd34和hla-dr。
实施例3
收集2x106的人脐带间充质干细胞,重悬于200μl的培养液,然后添加1:50稀释的pe荧光标记的抗体,包括cd13、cd29、cd44、cd73、hla-abc、cd45、cd117、cd31、cd34和hla-dr的抗体,4℃孵育2h,清洗3次,然后重悬于3ml培养液。把孔径大小为3μm的聚碳酸酯膜安置在25mm可换膜针头式过滤器中,并将过滤器旋紧,用10ml的注射器吸取细胞悬液,用力把细胞从过滤器一边推到另外一边,用15ml的离心管收集。
收集得到的人脐带间充质干细胞膜颗粒,1000g离心10min,轻轻地吸取上清,留下大概200μl的培养液,并轻轻抖动离心管,得到大小约为1-5μm的人脐带间充质干细胞膜颗粒。将所得人脐带间充质干细胞膜颗粒放置在35-mm的共聚焦培养板,静置30min,然后用激光共聚焦显微镜检测。结果如图3所示,细胞膜颗粒如同人脐带间充质干细胞,表达cd13、cd29、cd44、cd73和hla-abc,不表达cd45、cd117、cd31、cd34和hla-dr。
将收集脐带间充质干细胞和干细胞制备的膜颗粒,用trizol试剂提取总rna,用rt-pcr技术扩增相应的基因。结果如图4所示,干细胞膜颗粒与干细胞类似,都含有干细胞干性基因的mrna产物。
收集干细胞膜颗粒和干细胞分泌的外泌体,然后用激光纳米粒径仪检测。结果如图5所示,干细胞膜颗粒在1-5μm处具有一个显著的峰,而外泌体则无;同时1-5μm直径的膜颗粒所占体积比例超过50%。
实施例4
人脐带间充质干细胞膜颗粒包含的细胞器表征。
人脐带间充质干细胞于37℃用荧光染料标记30min-1h,包括用1μmmitotracker标记线粒体,用1μmlysotracker标记溶酶体,搜集细胞并通过上述实施例1采用的挤膜方式而得到的细胞膜颗粒,在共聚焦显微镜下进行观察。另外,将20μl未标记的人脐带间充质干细胞膜颗粒滴加在盖玻片上,室温下干燥1h,用4%多聚甲醛固定,用1%triton-x穿孔,加入1:100稀释的lc3b抗体,其为自噬体的标志物,室温孵育2h,清洗,然后加入fitc标记的二抗孵育1h,清洗后用共聚焦显微镜检测。结果如图6所示,脐带间充质干细胞膜颗粒内包含线粒体、溶酶体和自噬体。
实施例5
人脐带间充质干细胞膜颗粒传递线粒体的监测和功能验证。
利用上述实施例1挤膜获得人脐带间充质干细胞膜颗粒,并且加入到1.5x105线粒体缺陷的143b/rho0细胞中。每24h换液并重新加入膜颗粒,24h、48h、72h收集细胞并用血球计数板进行细胞数量的统计。143b/rho0是典型的线粒体缺陷型细胞,需要在培养液中额外添加尿苷(uridine,uri.)和丙酮酸。将143b/rho0细胞培养在96孔板,培养液添加鸟苷与丙酮酸,24h后细胞贴壁,设置3中培养条件:不加鸟苷/不加脐带间充质干细胞的细胞膜颗粒(pmvs),加鸟苷但不加pmvs,不加鸟苷但补充pmvs。48h后在显微镜下拍照,然后用胰酶消化,收集细胞,用血细胞皿计数,用台盼蓝排除死亡细胞。从图7可以看出,添加人脐带间充质干细胞膜颗粒后,即便不再添加uridine,143b/rho0细胞仍然可以正常生长,表明人脐带间充质干细胞膜颗粒可以传递线粒体并回复线粒体缺陷型细胞的增殖能力。
添加膜颗粒培养3天后,用5μg/mljc-1线(粒体膜电位染色试剂)进行染色,红色荧光强而绿色荧光弱代表线粒体膜电位高,反之代表线粒体膜电位低。从图8可以看出,添加膜颗粒后,143b/rho0细胞的线粒体膜电位显著升高。实验结果可见膜颗粒能成功进入靶细胞,而且进入细胞后,膜颗粒能成功释放线粒体,线粒体能够在靶细胞中发生复制。上述结果证明了人脐带间充质干细胞膜颗粒能够有效传递线粒体并发挥生物学功能。
实施例6
人脐带间充质干细胞膜颗粒在小鼠肝脏与脾脏的物质递送。
用1μg/ml的cm-dii(标记细胞膜的红色荧光染料)于37℃孵育细胞30min,利用上述实施例1挤膜获得cm-dii标记的人脐带间充质干细胞膜颗粒,如图9所示细胞膜颗粒已经被dii标记成荧光红色,通过腹腔注射至balb/c小鼠,12小时后,处死小鼠,获取肝脏与脾脏,在荧光显微镜下检测,可见大量的膜颗粒被肝脏细胞和脾脏细胞内吞,如图10所示dii标记的pmvs可以很好的与肝脏细胞及脾脏细胞相融合,提示可以将pmvs所包含物质转移到肝脏和脾脏细胞。上述结果证明了人脐带间充质干细胞膜颗粒能够在小鼠体内有效传递生物物质。
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!