一种检测过氧化氢的荧光探针及其应用的制作方法
本发明属于分析化学技术领域,涉及一种检测过氧化氢的荧光探针及其应用。
背景技术:
过氧化氢是一种重要的活性氧物质,在生物机体活动和外界环境中有着极其重要的应用。在自然环境中,过氧化氢可以用来净化自来水,在生物进行生命活动的时候,过氧化氢在细胞代谢过程中发挥着免疫标志的功能。生物新陈代谢过程中产生的过氧化氢(H2O2)是生命活动所必需的,过氧化氢在生理过程中有着重要作用。最近几年的研究表明,过氧化氢可以以信号分子的角色对生理和病理过程进行调节,与细胞的增殖分化以及迁移过程息息相关,除此之外,过氧化氢在很多病理过程中例如炎症、机体防御等方面也发挥着重要作用。但是很多疾病也是由于过量的过氧化氢而引起的,例如:癌症、阿尔察默病等疾病。因此实时定量的检测生物机体和外界环境中的过氧化氢具有非常重要的意义。
目前主要通过比色法、电化学法、滴定法、色谱法等方式来实现对过氧化氢的检测,虽然以上这些方法能够灵敏而且选择性的检测过氧化氢,但是它们大多操作复杂、受干扰因素影响大、耗时又耗力,无法实现对生物体中的过氧化氢实时、迅速、原位定量分析和检测。因此目前急需设计和开发新型的过氧化氢检测方法。近几年来,人们通过荧光探针法与激光共聚焦成像技术的结合,很好的对生物组织和活细胞中的过氧化氢进行了“可见、定量、实时”的检测。研究表明,荧光探针法具有容易操作,高选择性和灵敏度,很好的生物相容性,也能使检测对象免遭破坏等优点,广泛应用在化学、生物、环境和医学等领域中。
检测过氧化氢的荧光探针主要有硼酸及硼酸酯类荧光探针与磺酸酯类荧光探针,2',7'-二氯二氢荧光素(2',7'-dichlorodihydrofluorescein, DCFH)是一种传统的检测ROS的探针,它自身无荧光,当它被氧化性物质氧化成2',7'-二氯荧光素(2',7'-dichlorofluorescein, DCF)时,即发出强烈荧光。然而,这种荧光探针不仅对细胞内活性氧有响应,对其他的氧化物质也有响应,灵敏度和对不同氧化性物质的选择性都较差。通过把硼酸基团或硼酸酯作为探针的反应位点引入到荧光团分子中巧妙的解决了这个烦恼。由于硼酸基团或硼酸酯能淬灭荧光团发出的荧光,因此分子探针本身只发出微弱的荧光或者不发光,而当过氧化氢与硼酸基团或硼酸酯发生反应后,硼酸酯被水解成为羟基,继而发出荧光。所以荧光探针对过氧化氢的选择性可以通过引入硼酸酯作为反应位点得到提高。
Chang小组报道了以荧光素为发光团,以硼酸酯基团作为荧光反应位点的荧光素类的双硼酸酯荧光探针PF1(J Am Chem Soc, 2004, 126: 15392-15393.),该探针对过氧化氢的响应比其他活性氧化合物高500倍以上,可以检测到人体胚肾细胞内微摩尔级的过氧化氢,反应机制如下:
。
唐波课题组合成的新型荧光探针FS-1和FS-2(中国科学 B 辑: 化学, 2009, 39 (6): 473-480.)能与检测超氧阴离子自由基的PNF-1探针(Chem Bio Chem, 2007, 8: 453-458.)联合使用同时去检测活细胞内过氧化氢和超氧阴离子自由基(其中FS-2的发射波长为520 nm)。FS-2与PNF-1分别作为检测过氧化氢与超氧阴离子自由基的探针,其荧光光谱互不干扰,很好的实现了同时检测活细胞内超氧阴离子自由基和过氧化氢的操作。该探针在模拟生理条件下,对过氧化氢有强烈的响应,表现出很好的选择性,而且不会受到等量的其他生物物质和活性氧的干扰。通过细胞成像实验得知,小鼠腹膜巨噬细胞在含不同浓度过氧化氢的培养液中培育或由PMA刺激后加入探针FS-1和FS-2后显现出明亮的绿色荧光,并且灵敏度很高,对细胞中微摩尔级别的过氧化氢浓度变化也能产生响应。以上实验证明了探针FS-1和FS-2都具有高的膜渗透能力以及良好的选择性和灵敏度。该探针为研究过氧化氢介导的信号传导途径提供了一定的分析方法,具体检测机制如下:
。
综上所述,为了进一步的揭示和探究过氧化氢在环境和生物体中作用,设计合成选择性强、灵敏度高的过氧化氢荧光探针具有非常重要的理论和现实意义。
技术实现要素:
本发明针对现有技术上的不足,提供了一种能够检测过氧化氢的荧光探针,并将该探针应用于活细胞中检测过氧化氢的成像应用。
本发明所述的一种检测过氧化氢的荧光探针ACR,其特征在于,所述荧光探针的化学结构式如式()所示:
。
上述检测过氧化氢的荧光探针ACR以如下方法制备:
中间体A-1的合成:向4-二乙氨基酮酸和对氯间苯二酚的三氟乙酸(TFA)悬浮液中,加入分子筛,之后加热至90 ºC,搅拌6小时。反应结束后将混合物冷却至室温并浓缩,得到粗产物,将其在石油醚与乙酸乙酯的混合溶液中重结晶,得到红色固体A-1。
探针ACR的合成:向2-(叠氮甲基)苯甲酸的二氯甲烷溶液中加入EDCI、DMAP和中间体A-1,之后加热至室温并搅拌12小时。反应完成后,将所得溶液倒入水中并用二氯甲烷萃取,合并的有机层,用饱和食盐水洗涤,后用无水MgSO4干燥并浓缩,得到红色油状粗产物。粗品经硅胶色谱柱纯化得无色油状产物ACR。
本发明的合成如下所示:
。
本发明所述的检测过氧化氢的荧光探针在检测活细胞中过氧化氢的应用。
本发明所述荧光探针可以应于检测活细胞内的过氧化氢,具体检测方法为:在Hela细胞中加入10 μM的ACR,在37 ºC下培养15分钟,细胞基本没有荧光。之后将Hela细胞与10 μM的ACR在37 ºC下培养15分钟后,用PBS洗涤三次,更换培养基,再由过氧化氢缓冲溶液(25 μM)培养15分钟,细胞发出强烈的荧光。实验表明,ACR对细胞中的过氧化氢有良好的成像作用,可以很好的用于检测生物体中的过氧化氢,在生物医学等方面具有重要的潜在应用价值。
本发明的有益效果:
本发明所涉及的一种检测过氧化氢的荧光探针,以罗丹明衍生物为母体,以2-叠氮甲基芳基甲酸酯为开关,能过与过氧化氢特异性反应,本发明的荧光探针合成简单,使用方便,可以特异性与过氧化氢发生反应释放荧光,在检测过氧化氢过程中不会受到其他相关氧化物的干扰,对过氧化氢具有良好的选择性,能对活细胞中的过氧化氢进行检测,成像效果好,且对细胞毒性低。
附图说明
图1是荧光探针ACR的1H NMR谱图。
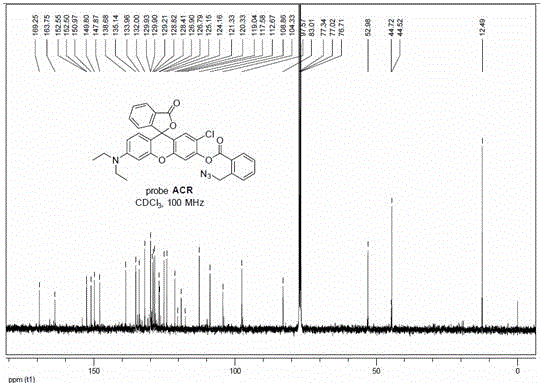
图2是荧光探针ACR的13C NMR谱图。
图3是荧光探针ACR的选择性光谱图。
图4是荧光探针ACR随过氧化氢浓度变化响应光谱图。
图5是荧光探针ACR响应时间光谱图。
图6是荧光探针ACR抗干扰性测试图。
图7是荧光探针ACR对Hela细胞内过氧化氢检测图。
具体实施方式
下面结合附图和实施例对本发明作进一步说明。
实施例1:
中间体A-1的合成:向4-二乙氨基酮酸(6.0 g,19.1 mmol)和对氯间苯二酚15(2.8 g,19.1 mmol)的TFA(20 mL)悬浮液中,加入分子筛(2.0 g),之后加热至90 ºC,搅拌6小时。反应结束后将混合物冷却至室温并浓缩,得到粗产物,将其在石油醚:乙酸乙酯为1:1的混合溶液中重结晶,得到红色固体A-1(7.0 g,95%)。
探针ACR的合成:向2-(叠氮甲基)苯甲酸(252.25 mg,1.43 mmol)的二氯甲烷(5 mL)溶液中加入EDCI(341.50 mg,1.78 mmol),DMAP(72.54 mg,0.59 mmol)和4-二乙氨基酮酸(500.0 mg,1.19 mmol),之后加热至室温并搅拌12小时。反应完成后,将所得溶液倒入水(30 mL)中并用二氯甲烷(3 × 20 mL)萃取,合并的有机层,用饱和食盐水洗涤,后用无水MgSO4干燥并浓缩,得到红色油状粗产物。粗品经硅胶色谱柱纯化(石油醚:乙酸乙酯 = 5:1)得无色油状产物ACR(358.81 mg,52%)。1H NMR (400 MHz, CDCl3) δ 8.36 (dt, J = 9.2, 4.6 Hz, 1H), 8.07 (d, J = 7.5 Hz, 1H), 7.74 (tt, J = 4.1, 2.0 Hz, 1H), 7.71 - 7.69 (m, 1H), 7.69 - 7.65 (m, 1H), 7.63 (d, J = 7.2 Hz, 1H), 7.60 - 7.52 (m, 1H), 7.28 (d, J = 3.4 Hz, 2H), 6.90 (s, 1H), 6.60 (d, J = 8.9 Hz, 1H), 6.47 (d, J = 2.5 Hz, 1H), 6.41 (dd, J = 9.0, 2.6 Hz, 1H), 4.99 - 4.75 (m, 2H), 3.46 - 3.18 (m, 3H), 1.24 - 1.10 (m, 6H). 13C NMR (101 MHz, CDCl3) δ169.25, 163.75, 152.55, 150.97, 149.80, 147.87, 138.68, 135.14, 133.96, 132.00, 129.93, 129.90, 129.21, 128.82, 128.41, 126.84, 126.79, 125.15, 124.16, 121.33, 119.04, 112.67, 108.86, 104.33, 97.57, 83.01, 52.98, 44.52, 12.49. HRMS-ESI (m / z) [M + H]+ calcd for: C32H26ClN4O5+, 581.1513, found: 581.1523. FTIR (KBr, cm-1): 3450, 2918, 2113, 1751,1419, 1343, 1143, 1049, 811, 745.
本发明对实施例1得到的探针ACR进行了效果测试:
1. ACR选择性分析
在5 μM的ACR中加入80当量过氧化氢的CH3OH / PBS缓冲液(其中过氧化氢的浓度为10 mM, pH = 7.4,CH3OH:PBS缓冲液 = 5:95),检测结果如图3,当λex = 470 nm, λem = 560 nm 时,ACR对过氧化氢有强烈的荧光响应,而且ACR对其他氧化性物质几乎没有响应,说明ACR对过氧化氢具有优异的选择性。
2. ACR对过氧化氢浓度变化响应分析
在5 μM ACR中加入0 - 200个当量(50 - 400 μM)的过氧化氢时,荧光响应强度随过氧化氢加入量的增加呈规律性增加,检测结果如图4,结果说明ACR对过氧化氢浓度检测范围广且灵敏度高。
3. ACR对过氧化氢响应时间分析
在5 μM的ACR中加入80当量过氧化氢的CH3OH / PBS缓冲液,对ACR与过氧化氢的响应时间进行了检测,检测结果如图5,结果显示,在加入过氧化氢后0 - 120分钟内,ACR对过氧化氢的荧光响应强度随时间的增加呈线性增强,在较短的时间内就能达到良好的荧光强度。结果表明,ACR对过氧化氢的响应快速,可有效的应用于过氧化氢的检测。
4. ACR抗干扰性分析
探针ACR在各种氧化性物质和硫醇等其它干扰分子存在的情况下进行了竞争实验,来检测ACR的抗干扰性。检测结果如图6,在过氧化氢与其他生物硫醇或其他氧化性物质共存的情况下ACR仍然能对其产生稳定的荧光响应。上述结果表明ACR对过氧化氢有着优异的抗干扰性,可以在其它氧化性物质及生物硫醇存在的情况下高效的检测过氧化氢。
5. ACR在细胞检测中的应用
在Hela细胞中加入10 μM的ACR在37 ºC下培养15分钟,检测结果如图7,由图7中B所示,细胞基本没有荧光。我们将Hela细胞与10 μM的ACR在37 ºC下培养15分钟后,用PBS洗涤三次,更换培养基,再由过氧化氢缓冲溶液(25 μM)培养15分钟,由图7中E所示,细胞发出强烈的荧光。实验表明,ACR对细胞中的过氧化氢有良好的成像作用,可以很好的用于检测生物体中的过氧化氢,在生物医学等方面具有重要的潜在应用价值。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对发明范围的限制,所述领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!