基于平行分离模式制备色谱分离棘豆中化学对照品的方法与流程
本发明涉及化学对照品的制备方法,尤其涉及基于平行分离模式制备色谱分离棘豆中化学对照品的方法。
背景技术:
棘豆属(Oxytropis D.C.)植物属于豆科蝶形花亚科,该属植物为多年生草本,半灌木或灌木,全世界约为300多种,而我国有棘豆属植物131种(药用植物为20余种),分别分布于甘肃、青海、内蒙古、四川、西藏等地。棘豆属药用植物曾被收载于1977年版中国药典,其在我国分布广泛,且民间常用于藏药和蒙药的复方之中。
藏药棘豆(Oxytropis falcate Bunge)(藏药名为莪达夏)是豆科(Leguminosae)棘豆属(Oxytropis D.C.)多年生草本植物,生长在2700~4300 m的河滩、沙地、山坡、草甸,产于青藏高原。棘豆主要具有抗炎止疼、清热解毒、止血等功效,用于利便、除毒、清肿、止血,可治疗麻风病、流感及扁桃体炎等多种病症。由于其突出的疗效,具有“草药之王”的美誉。棘豆是藏医常用的三大抗炎药之一,藏医在临床上使用广泛,它是六味棘豆散、九味青鹏散、奇正藏贴、奇正消痛贴膏的多种藏药复方或藏成药的主要药物,是一味非常具有研究和开发价值的天然药物。
甘肃棘豆(Oxytropis kansuensis Bunge)是棘豆属有毒植物品种之一,同时具有较强的药理活性,尤其在藏药中使用较多,具有解毒医疮,止血利尿,治疗各种内出血症。
多叶棘豆(Oxytropis myriophylla (Pall) DC.)在蒙药中使用较多,主要用于瘟疫、炎症、丹毒、腮腺炎、麻疹、痛风、各种刺疼和出血等症。
目前,各国学者对棘豆属20多种药用植物分离得到了140多个化合物,其中多以黄酮类、三萜类和生物碱类化学成分居多,没有系统深入地研究棘豆中活性物质的作用机制,仅对其进行了初步的药理活性研究。同时,也无法稳定获得纯度为98%以上的化学对照品,不能满足棘豆新药创制及相关制剂的质量控制要求,从而制约了棘豆药材的药用开发研究。
技术实现要素:
本发明所要解决的技术问题是提供一种工艺简单、重复性高、回收率高的基于平行分离模式制备色谱分离棘豆中化学对照品的方法。
为解决上述问题,本发明所述的基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将棘豆用体积浓度为5~95%的乙醇或体积浓度为5~100%的甲醇进行超声提取,得到提取液;所述提取液经减压浓缩后得到棘豆提取物浸膏;
⑵萃取:
将所述棘豆提取物浸膏用其质量1~10倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位;
⑶将所述水部位干燥至恒重后,得到水部位干燥粉末;
⑷将所述水部位干燥粉末用其质量的1~30倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为0%~20%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分,该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为5%~20%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷和色氨酸 。
所述步骤⑴中棘豆为镰形棘豆、甘肃棘豆、多叶棘豆中一种。
所述步骤⑴中超声提取的条件是指料液比为1 g:5 mL ~30 mL,提取温度为50~95℃,提取次数1~4次,每次1~4 h,超声功率为1~100KW。
所述步骤⑷中一级制备色谱柱的分离条件是指流速为10~60mL/min,检测波长为200~400nm。
所述步骤⑷中一级制备色谱柱中的色谱填料为大孔树脂,型号为AB-8,D101,X-5其中的一种。
所述步骤⑷中捕集设备吸附填料为聚苯乙烯或甲基丙烯酸-二乙烯基苯聚合物。
所述步骤⑷中二级制备色谱柱中的色谱填料为C18或C8。
所述步骤⑷中二级制备色谱柱的分离条件是指流速为5~60mL/min,检测波长为200~400nm。
如上所述的基于平行分离模式制备色谱分离棘豆中化学对照品的方法所制得的化合物麦芽酚-3-o-β-D-葡萄糖苷和色氨酸在制备抗炎、止疼、清热解毒、止血、利便、清肿、细胞凋亡诱导剂以及预防和/或治疗骨质增生、炭疽病、麻风病、扁桃体炎、流感、慢性支气管炎、癌症药物中的应用,其特征在于:该两种化合物作为有效组分按常规方法与药学上可接受的任何载体制成各类药用制剂。
本发明与现有技术相比具有以下优点:
1、本发明采用具有平行分离模式的制备色谱装置分离制备两种化学对照品,不但工艺简单,实用性高,而且实现了样品的快速分离制备;同时,在保证高效分离的前提下,提高了样品的化学品产量,可以获得克级纯度在98%以上的化学对照品(色谱图参见图3、图4)。
2、采用本发明方法获得的两种化合物具有较好抗癌活性,为以后的药物研发提供了理论依据。
本发明药物组合物及单体化合物的活性试验
活性试验的方法名称MTT法,活性试验中所用的细胞株为SGC-7901。
实验步骤:
⑴配药:药物均由培养基配制,适当超声溶解,0.22微米滤器过滤,-20℃冰箱保存备用。
⑵收集对数期细胞,调整细胞悬液浓度3×104/ml,每孔加入100ul(边缘孔用无菌PBS填充)。待细胞贴壁后,分别加入8个浓度梯度的药物(0.02, 0.04, 8,16,32,64,125,250 ug/ml),设3个复孔,5%CO2,37℃孵育48小时,倒置显微镜下观察。
⑶每孔加入20ul MTT溶液(5mg/ml,即0.5%MTT),继续培养4h。
⑷终止培养,小心吸去孔内培养液。每孔加入150ul二甲基亚砜,在酶联免疫检测仪OD492nm处测量各孔的吸光值。
⑸同时设置调零孔(培养基、MTT、二甲基亚砜),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜)。
⑹实验数据通过GraphPad Prism 5进行分析计算。
两种化合物活性试验结果
表1 两种化合物抗癌活性
综上所述,两种化合物具有良好的抗癌活性,扩展了这些单体化合物的应用前景。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
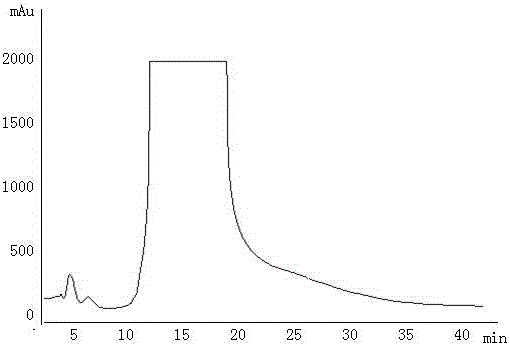
图1为本发明中一级分离制备色谱图。
图2 为本发明中二级分离制备色谱图。
图3为本发明中麦芽酚-3-o-β-D-葡萄糖苷的色谱图。
图4为为本发明中色氨酸色谱图。
具体实施方式
实施例1 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将镰形棘豆用体积浓度为5%的乙醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:5 mL,提取温度为50℃,提取次数1次,每次1h,超声功率为1KW。
减压浓缩的条件是指真空度为0.07MPa,水浴温度为65℃。
⑵萃取:
将棘豆提取物浸膏用其质量1倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-20℃,真空度为20Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的1倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为0%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为5%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为10mL/min,检测波长为200nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为AB-8。
捕集设备吸附填料为聚苯乙烯聚合物。
二级制备色谱柱中的色谱填料为C18。
二级制备色谱柱的分离条件是指流速为5mL/min,检测波长为200nm。
实施例2 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将甘肃棘豆用体积浓度为95%的乙醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:30 mL,提取温度为95℃,提取次数4次,每次4 h,超声功率为100KW。
减压浓缩的条件是指真空度为0.05MPa,水浴温度为70℃。
⑵萃取:
将棘豆提取物浸膏用其质量10倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-50℃,真空度为10Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的30倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为20%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为20%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为60mL/min,检测波长为400nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为D101。
捕集设备吸附填料为甲基丙烯酸-二乙烯基苯聚合物。
二级制备色谱柱中的色谱填料为C8。
二级制备色谱柱的分离条件是指流速为60mL/min,检测波长为400nm。
实施例3 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将多叶棘豆用体积浓度为5%的甲醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:30 mL,提取温度为75℃,提取次数2次,每次2h,超声功率为70KW。
减压浓缩的条件是指真空度为0.08MPa,水浴温度为75℃。
⑵萃取:
将棘豆提取物浸膏用其质量10倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-40℃,真空度为30Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的30倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为20%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为10%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为35mL/min,检测波长为300nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为X-5。
捕集设备吸附填料为甲基丙烯酸-二乙烯基苯聚合物。
二级制备色谱柱中的色谱填料为C18。
二级制备色谱柱的分离条件是指流速为25mL/min,检测波长为254nm。
实施例4 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将镰形棘豆用体积浓度为100%的甲醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:15 mL,提取温度为55℃,提取次数3次,每次2.5 h,超声功率为80KW。
减压浓缩的条件是指真空度为0.03MPa,水浴温度为72℃。
⑵萃取:
将棘豆提取物浸膏用其质量6倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-70℃,真空度为20Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的15倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为10%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为15%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为40mL/min,检测波长为360nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为AB-8。
捕集设备吸附填料为甲基丙烯酸-二乙烯基苯聚合物。
二级制备色谱柱中的色谱填料为C8。
二级制备色谱柱的分离条件是指流速为15mL/min,检测波长为254nm。
实施例5 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将甘肃棘豆用体积浓度为75%的乙醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:14mL,提取温度为70℃,提取次数2次,每次2 h,超声功率为65KW。
减压浓缩的条件是指真空度为0.04MPa,水浴温度为68℃。
⑵萃取:
将棘豆提取物浸膏用其质量6倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-60℃,真空度为18Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的2倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为12%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为12%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为30mL/min,检测波长为280nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为X-5。
捕集设备吸附填料为甲基丙烯酸-二乙烯基苯聚合物。
二级制备色谱柱中的色谱填料为C8。
二级制备色谱柱的分离条件是指流速为36mL/min,检测波长为300nm。
实施例6 基于平行分离模式制备色谱分离棘豆中化学对照品的方法,包括以下步骤:
⑴制备棘豆提取物浸膏:
将多叶棘豆用体积浓度为80%的甲醇进行超声提取,得到提取液;提取液经减压浓缩后得到棘豆提取物浸膏。
其中:
超声提取的条件是指料液比为1 g:20 mL,提取温度为85℃,提取次数3次,每次3 h,超声功率为50KW。
减压浓缩的条件是指真空度为0.04MPa,水浴温度为68℃。
⑵萃取:
将棘豆提取物浸膏用其质量5倍的去离子水溶解后,依次用石油醚、乙酸乙酯进行萃取,分别得到石油醚部位、乙酸乙酯部位和水部位。
⑶将水部位干燥至恒重后,得到水部位干燥粉末。
其中:干燥条件是指冷肼温度为-60℃,真空度为18Pa的冷冻干燥。
⑷将水部位干燥粉末用其质量的25倍的去离子水溶解后,注入到具有平行分离模式的制备色谱装置(专利号:201520827784.5)中,经过一级制备色谱柱分离并用20倍柱体积、体积浓度为15%乙醇冲洗样品后,经在线紫外检测,得到目标化合物组分(如图1)。
该目标化合物组分经捕集设备进行富集浓缩,然后进入二级制备色谱柱,经二级制备色谱柱分离、体积浓度为15%的甲醇洗脱、在线紫外检测,即得符合化学对照品要求且纯度>98%的两种化合物麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)和色氨酸 (tryptophan)(如图2)。
其中:
一级制备色谱柱的分离条件是指流速为50mL/min,检测波长为350nm。
一级制备色谱柱中的色谱填料为大孔树脂,型号为D101。
捕集设备吸附填料为聚苯乙烯聚合物。
二级制备色谱柱中的色谱填料为C18。
二级制备色谱柱的分离条件是指流速为40mL/min,检测波长为300nm。
上述实施例1~6所得的两种化合物的结构式和结构表征数据如下:
麦芽酚-3-o-β-D-葡萄糖苷(Maltol-3-o-β-D-glucoside)的结构式如下图:
结构表征数据如下:
麦芽酚-3-o-β-D-葡萄糖苷:1H NMR (CD3OD, 400 MHz) δH (ppm); 6.47(H5, d, J=5.6 Hz), 7.81(H6, d, J=5.6 Hz), 2.38 (–CH3, s), 5.41 (H1’, d, J=7.6 Hz), 4.18 (H2’), 4.24 (H3’), 4.16 (H4’), 3.94 (H5’), 4.32 (H6’), 4.48 (H6’) and13C NMR (CD3OD, 100 MHz) δC (ppm); 161.71 (C2), 143.04 (C3), 175.24 (C4), 116.65 (C5), 155.15 (C6), 15.26 (CH3), 105.68 (C1’), 75.33 (C2’), 70.23 (C3’), 77.95 (C4’), 78.82 (C5’), 62.19 (C6’)。
色氨酸 (tryptophan)的结构式如下图:
结构表征数据如下:
色氨酸:1H NMR ( DMSO-d6,400 MHz) δH: 10.95 ( 1H,s,N-H),7.56 ( 1H,d,J =7.8 Hz,H-4),7.35 (1H,d,J =8.1Hz,H-7),7.22(1H,d,J=2.0Hz,H2),7.06(1H,m,H-6),6.97(1H,m,H-5),3.46(1H,dd,J=8.1,4.0Hz,H-9),3.31(1H,dd,J=15.1,4.0Hz,Ha-8),2. 98(1H,dd,J=15.1,8.1Hz,Hb-8); δC: 170.1(C-10),136.3(C-7a),127.3(C-3a),124.0(C-2),120.8(C-5),118.3(C4),118.2(C-6),111.3(C-7),109.7 (C-3),54.7(C-9),27.1 (C-8)。
上述实施例1~6所得的两种化合物在制备抗炎、止疼、清热解毒、止血、利便、清肿、细胞凋亡诱导剂以及预防和/或治疗骨质增生、炭疽病、麻风病、扁桃体炎、流感、慢性支气管炎、癌症药物中的应用是指:该两种化合物作为有效组分按常规方法与药学上可接受的任何载体制成各类药用制剂。
- 还没有人留言评论。精彩留言会获得点赞!