一种快速色谱制备非达霉素的方法与流程
本发明属于微生物制药领域,具体涉及一种快速色谱制备非达霉素的方法。
背景技术:
艰难梭菌是一种革兰氏阳性厌氧芽孢杆菌,广泛分布于自然环境及动物和人的粪便中。其过度生长并释放毒素时,可引起艰难梭菌感染(CDI),导致结肠炎症、严重腹泻甚至死亡。
非达霉素(fidaxomicin)是Optimer制药公司研发的一种新型窄谱的大环内酯类抗生素,于2011年5月获得FDA批准在美国上市,成为30年来首个主要用于治疗艰难梭菌相关性腹泻(CDAD)的抗生素。非达霉素通过抑制艰难梭菌的RNA聚合酶,阻断核糖核酸合成而杀菌。与传统药物万古霉素相比,它可显著降低艰难梭菌感染的复发率并提高整体治愈率。非达霉素的结构如下:
现有技术中,从发酵液中提取纯化非达霉素的方法有:
中国专利CN104846043A公开了一种从发酵液中分离和纯化非达霉素的工艺;该工艺采用极性有机溶剂浸提菌丝体;浸提液通过大孔吸附树脂柱并解吸;解吸液用有机溶剂萃取,再经过正相柱层析,得到非达霉素粗品;该粗品经高压液相色谱设备,以有机溶剂/酸水洗脱,收集高纯度非达霉素流出液;洗脱液再经聚苯乙烯微球树脂柱层析;洗脱液萃取、浓缩、干燥,得到白色粉末状非达霉素纯品,纯度96%~97%,收率约73%。该工艺步骤繁琐,而且使用了高压液相设备,仅适合于实验室操作。
中国专利CN104418925A公开了一种制备高纯度非达霉素的方法;该方法将从非达霉素发酵液中分离出的菌丝体用极性有机溶剂浸提;浸提液加水稀释后导入大孔吸附树脂SP825L吸附,然后对树脂柱进行净化和解吸,得到非达霉素的粗品解吸液Ⅰ,浓缩、结晶后得非达霉素粗品;非达霉素粗品用乙腈的水溶液溶解后,导入UniPS40树脂柱,经洗脱得到非达霉素洗脱液Ⅱ,蒸除溶解得到固体,再用极性有机溶剂重结晶,得到非达霉素产品。该方法收率50%~60%,纯度98.5%以上,但需一次或多次结晶,操作较为繁琐。
中国专利CN104098637A公开了一种非达霉素的纯化方法;该方法将非达霉素发酵液进行固液分离得到菌丝体,接着用有机溶剂浸泡菌丝体得到含非达霉素的溶液;将该溶液进行纳滤浓缩;浓缩液通过装有C8填料的DAC200制备柱层析,并用含有有机溶剂的酸水溶液进行洗脱,收集、合并含非达霉素的馏分,加水逼出非达霉素,过滤、干燥得到非达霉素干粉,且收率达到50%以上、纯度达到99.5%以上。该法操作简单、获得非达霉素纯度及收率高,但是由于采用了动态轴向压缩柱(DAC)技术,对设备和填料规格要求较高,成本投入较大。
因此,从发酵液中提取纯化非达霉素的方法仍需进行优化改进,以期得到一种具有如下优点的方法:纯度和收率高,同时操作相对简单、成本投入较低,且适用于工业化生产。
技术实现要素:
本发明所要解决的技术问题在于提供一种快速色谱制备非达霉素的方法,不仅所得非达霉素的纯度与收率高,而且操作相对简单、成本较低,并适用于工业化生产。
本发明是通过以下技术方案解决上述技术问题的:一种快速色谱制备非达霉素的方法,包括如下具体操作步骤:
(1)、将非达霉素发酵液进行固液分离得到菌丝体,然后加入60%~80%乙醇浸泡菌丝体并离心,得到非达霉素浸提液,待用;
(2)、将步骤(1)所得的非达霉素浸提液用水稀释至乙醇浓度为10%~40%,之后导入聚苯乙烯树脂柱内进行吸附,然后采用乙醇进行梯度解吸,收集非达霉素含量45%以上的解吸液;
(3)、将步骤(2)所收集的解吸液合并,并加水稀释至乙醇浓度为45%~55%,接着导入反相硅胶层析柱中,采用甲醇-水-乙酸进行梯度洗脱,收集非达霉素含量85%以上的洗脱液;
(4)、将步骤(3)所收集到的洗脱液合并,并采用水稀释至甲醇浓度为55%~65%,再次导入反相硅胶层析柱中,采用乙腈-水-乙酸进行梯度洗脱,收集非达霉素含量98.5%以上的洗脱液并进行合并,进行浓缩、干燥后得到高纯度的非达霉素成品。
进一步地,所述步骤(1)中,60%~80%乙醇的加入量为每千克湿的菌丝体中加入1~8升;浸提温度为10~50℃;浸提时间为2~8h。
进一步地,所述步骤(2)中,聚苯乙烯树脂柱为DIAION HP-20聚苯乙烯树脂柱、纳微NM-200聚苯乙烯树脂柱、D101聚苯乙烯树脂柱、HPD-400聚苯乙烯树脂柱、AmberliteXAD-8聚苯乙烯树脂柱或HZ816聚苯乙烯树脂柱中的任一种。
进一步地,所述步骤(3)中,反相硅胶层析柱的填料选用C4、C8或C18烷基硅胶键合相中的任一种,且粒径为50μm。
进一步地,所述步骤(4)中,反相硅胶层析柱的填料选用C4、C8或C18烷基硅胶键合相中的任一种,且粒径为50μm。
本发明的有益效果在于:
提供一种快速色谱制备非达霉素的方法,不仅能够快速便捷的获得非达霉素,而且所获得的非达霉素的纯度与收率均高,此外,整个方法操作相对简单、成本较低,能够适用于工业化生产。
【附图说明】
下面参照附图结合实施例对本发明作进一步的描述。
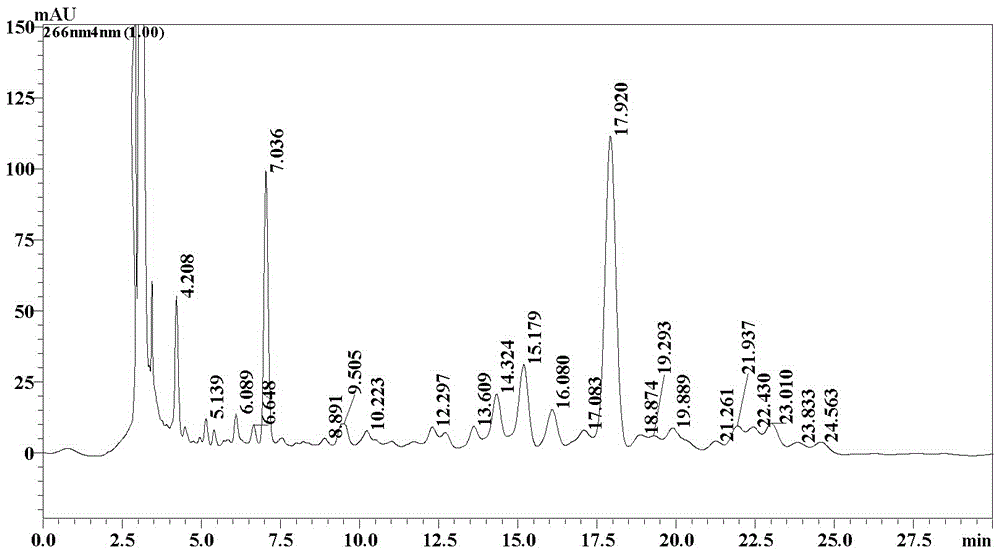
图1是本发明实施例1-3中浸提液的HPLC色谱图。
图2是本发明实施例1中解吸液的HPLC色谱图。
图3是本发明实施例1中所收集非达霉素含量85%以上的洗脱液的HPLC色谱图。
图4是本发明实施例1中所收集非达霉素含量98.5%以上的洗脱液的HPLC色谱图。
图5是本发明实施例2中解吸液的HPLC色谱图。
图6是本发明实施例2中所收集非达霉素含量85%以上的洗脱液的HPLC色谱图。
图7是本发明实施例2中所收集非达霉素含量98.5%以上的洗脱液的HPLC色谱图。
图8是本发明实施例3中解吸液的HPLC色谱图。
图9是本发明实施例3中所收集非达霉素含量85%以上的洗脱液的HPLC色谱图。
图10是本发明实施例3中所收集非达霉素含量98.5%以上的洗脱液的HPLC色谱图。
【具体实施方式】
本发明一种快速色谱制备非达霉素的方法,包括如下具体操作步骤:
(1)、将非达霉素发酵液进行固液分离得到菌丝体,然后加入60%~80%乙醇浸泡菌丝体并离心,得到非达霉素浸提液,待用;
(2)、将步骤(1)所得的非达霉素浸提液用水稀释至乙醇浓度为10%~40%,之后导入聚苯乙烯树脂柱内进行吸附,然后采用乙醇进行梯度解吸,收集非达霉素含量45%以上的解吸液;
(3)、将步骤(2)所收集的解吸液合并,并加水稀释至乙醇浓度为45%~55%,接着导入反相硅胶层析柱中,采用甲醇-水-乙酸进行梯度洗脱,收集非达霉素含量85%以上的洗脱液;
(4)、将步骤(3)所收集到的洗脱液合并,并采用水稀释至甲醇浓度为55%~65%,再次导入反相硅胶层析柱中,采用乙腈-水-乙酸进行梯度洗脱,收集非达霉素含量98.5%以上的洗脱液并进行合并,进行浓缩、干燥后得到高纯度的非达霉素成品。
其中,步骤(1)中,60%~80%乙醇的加入量为每千克湿的菌丝体中加入1~8升;浸提温度为10~50℃;浸提时间为2~8h。步骤(2)中,聚苯乙烯树脂柱为DIAION HP-20聚苯乙烯树脂柱、纳微NM-200聚苯乙烯树脂柱、D101聚苯乙烯树脂柱、HPD-400聚苯乙烯树脂柱、AmberliteXAD-8聚苯乙烯树脂柱或HZ816聚苯乙烯树脂柱中的任一种;可以优选纳微NM-200聚苯乙烯树脂柱或HZ816聚苯乙烯树脂柱。步骤(3)中,反相硅胶层析柱的填料选用C4、C8或C18烷基硅胶键合相中的任一种,且粒径为50μm;可以优选C18烷基硅胶键合相(粒径为50μm)。步骤(4)中,反相硅胶层析柱的填料选用C4、C8或C18烷基硅胶键合相中的任一种,且粒径为50μm;可以优选C18烷基硅胶键合相(粒径为50μm)。需要说明的是,本发明中甲醇浓度、乙醇浓度的百分数在无特殊说明的情况下均为体积百分数。
另外,本发明中所提及的非达霉素发酵液的发酵培养所用游动放线菌为Actinoplanes deccanensis ATCC21983,购自美国模式培养物集存库(ATCC);DIAION HP-20聚苯乙烯树脂购自三菱化学株式会社;纳微NM-200聚苯乙烯树脂、D101聚苯乙烯树脂、HPD-400聚苯乙烯树脂购自苏州纳微生物科技有限公司;AmberliteXAD-8聚苯乙烯树脂购自北京慧德易科技有限公司;HZ816聚苯乙烯树脂购自上海华震科技有限公司;购买而来的聚苯乙烯树脂在应用时填入相应的柱体内形成相应的聚苯乙烯树脂柱;反相硅胶层析柱的填料是购自YMC公司;甲醇、乙醇、乙腈等试剂均为市售;水为蒸馏水;高效液相色谱仪为岛津LC-20A。
非达霉素检测采用高效液相色谱法,色谱条件:色谱柱为月旭Ultimate XB-C18(ID4.6mm×250mm,5μm),流动相为甲醇:0.1%甲酸水溶液(73:27),流速1mL/min,检测波长266nm,进样量10μL,柱温40℃;非达霉素的保留时间在不同检测批次间略有波动,范围在17~18min。
本发明中非达霉素发酵液的具体制备过程如下:
a、斜面菌落的制备与培养:将游动放线菌菌体接至斜面培养基上,并于30℃下培养10天;斜面培养基为采用ISP培养基,其配方为:酵母提取物4g/L,麦芽提取物10g/L,葡萄糖4g/L,琼脂20g/L,pH7.2;
b、种子培养基的配制与培养:采用铂环将斜面培养基上培养所得的单菌落移入种子培养基中,并在培养温度30℃下,240rpm摇床振荡培养48h,获得非达霉素发酵的一级种子液;
种子培养基配方:可溶性淀粉20g/L,葡萄糖5g/L,蛋白胨5g/L,酵母粉5g/L,黄豆粉5g/L,硫酸铵0.5g/L,磷酸氢二钾0.5g/L,七水合硫酸镁0.5g/L,碳酸钙2g/L,pH7.2,摇瓶装液量为50mL/500mL。
c、发酵培养基的配制与培养:以体积百分比为5%的接种量将步骤(b)所获得的一级种子液移入发酵培养基中发酵培养,发酵培养温度28℃,240rpm摇床振荡培养136h,则获得本发明所需的非达霉素发酵液;
发酵培养基配方:可溶性淀粉4g/L,葡萄糖10g/L,蛋白胨3g/L,酵母提取物1g/L,黄豆粉20g/L,氯化钠2.5g/L,硫酸铵0.25g/L,磷酸氢二钾0.25g/L,七水合硫酸镁0.25g/L,碳酸钙5g/L,微盐1mL,pH7.5。
为了能够清楚的阐述本发明方法的具体过程,本申请人例举了如下几个具体实施例。
实施例1
取非达霉素发酵液10L,将发酵液以4500rpm离心10分钟,得到2kg菌丝体(湿重);在菌丝体中加入70%乙醇4L,室温下,电动搅拌器搅拌(350rpm)浸提4小时后离心,收集含非达霉素的浸提液(4.5L,含非达霉素1179mg),且浸提液的HPLC色谱图如图1所示;将浸提液加水稀释至乙醇浓度为20%后导入纳微NM-200聚苯乙烯树脂柱吸附内进行吸附,树脂装量为300mL,流速为2BV/h,树脂柱依次用浓度40%、50%、60%的乙醇溶液进行梯度解吸,流速为2BV/h,分段收集非达霉素含量45%以上的解吸液,解吸液的HPLC色谱图如图2所示。
将收集到的非达霉素含量45%以上的解吸液合并,加水稀释至乙醇浓度为50%后导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径3cm,柱长38cm),然后依次用甲醇:水:乙酸=50:50:0.1(V/V/V)、甲醇:水:乙酸=70:30:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为3BV、10BV,流速为10mL/min,分段收集非达霉素含量85%以上的洗脱液,该洗脱液的HPLC色谱图如图3所示。
将收集到的非达霉素含量85%以上的洗脱液合并,加水稀释至甲醇浓度为58%后再次导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径3cm,柱长38cm),然后依次用乙腈:水:乙酸=30:70:0.1(V/V/V)、乙腈:水:乙酸=45:55:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为3BV、10BV,流速为10mL/min,分段收集非达霉素含量98.5%以上的洗脱液,该脱液的HPLC色谱图如图4所示;合并收集到的非达霉素含量98.5%以上的洗脱液并将其浓缩、干燥得到非达霉素精粉390mg。经测定本实施非达霉素的总收率为33.1%。
根据面积归一化法计算了本实施例制备过程各步骤中非达霉素的HPLC纯度:浸提液中非达霉素纯度为33.7%;解吸液中非达霉素纯度为55.5%,YMC·GEL ODS-A-HG反相硅胶层析柱的甲醇/水/乙酸洗脱液中非达霉素纯度为92.9%,YMC·GEL ODS-A-HG层析柱的乙腈/水/乙酸洗脱液中非达霉素纯度为98.8%。
实施例2
取非达霉素发酵液20L,将发酵液以4500rpm离心10分钟,得到3.9kg菌丝体(湿重);在菌丝体中加入60%乙醇8L,室温下,电动搅拌器搅拌(350rpm)浸提4小时后离心,收集含非达霉素的浸提液(9L,含非达霉素2358mg),且浸提液的HPLC色谱图如图1所示;将浸提液加水稀释至乙醇浓度为40%后导入纳微NM-200聚苯乙烯树脂柱吸附内进行吸附,树脂装量为500mL,流速为2BV/h,树脂柱依次用浓度40%、50%、60%的乙醇溶液进行梯度解吸,流速为2BV/h,分段收集非达霉素含量45%以上的解吸液,解吸液的HPLC色谱图如图5所示。
将收集到的非达霉素含量45%以上的解吸液合并,加水稀释至乙醇浓度为45%后导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径3cm,柱长38cm),然后依次用甲醇:水:乙酸=50:50:0.1(V/V/V)、甲醇:水:乙酸=70:30:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为4BV、10BV,流速为10mL/min,分段收集非达霉素含量85%以上的洗脱液,该洗脱液的HPLC色谱图如图6所示。
将收集到的非达霉素含量85%以上的洗脱液合并,加水稀释至甲醇浓度为55%后再次导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径3cm,柱长38cm),然后依次用乙腈:水:乙酸=30:70:0.1(V/V/V)、乙腈:水:乙酸=50:50:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为3BV、10BV,流速为12mL/min,分段收集非达霉素含量98.5%以上的洗脱液,该脱液的HPLC色谱图如图7所示;合并收集到的非达霉素含量98.5%以上的洗脱液并将其浓缩、干燥得到非达霉素精粉806mg;经测定本实施非达霉素的总收率为34.2%。
根据面积归一化法计算了本实施例制备过程各步骤中非达霉素的HPLC纯度:浸提液中非达霉素纯度为33.7%;解吸液中非达霉素纯度为58.8%,YMC·GEL ODS-A-HG反相硅胶层析柱的甲醇/水/乙酸洗脱液中非达霉素纯度为92.7%,YMC·GEL ODS-A-HG层析柱的乙腈/水/乙酸洗脱液中非达霉素纯度为99.1%。
实施例3
取非达霉素发酵液30L,将发酵液以4500rpm离心10分钟,得到5.9kg菌丝体(湿重);在上述菌丝体中加入80%乙醇12L,室温下,电动搅拌器搅拌(350rpm)浸提4小时后离心,收集含非达霉素的浸提液(13.6L,含非达霉素3531mg),且浸提液的HPLC色谱图如图1所示;将浸提液加水稀释至乙醇浓度为10%后导入纳微NM-200聚苯乙烯树脂柱吸附,树脂装量为500mL,流速为2BV/h,树脂柱依次用浓度40%、50%、60%的乙醇溶液进行梯度解吸,流速为2BV/h,分段收集收集非达霉素含量45%以上的解吸液,解吸液的HPLC色谱图如图8所示。
将收集到的非达霉素含量45%以上的解吸液合并,加水稀释至乙醇浓度为55%后导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径4.6cm,柱长40cm),然后依次用甲醇:水:乙酸=50:50:0.1(V/V/V)、甲醇:水:乙酸=70:30:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为2BV、10BV,流速为25mL/min,分段收集非达霉素含量85%以上的洗脱液,该洗脱液的HPLC色谱图如图9所示。
将收集到的非达霉素含量85%以上的洗脱液合并,加水稀释至甲醇浓度为65%后再次导入YMC·GEL ODS-A-HG反相硅胶层析柱(柱直径4.6cm,柱长40cm),然后依次用乙腈:水:乙酸=30:70:0.1(V/V/V)、乙腈:水:乙酸=45:55:0.1(V/V/V)进行梯度洗脱,洗脱体积分别为2BV、10BV,流速为25mL/min,分段收集非达霉素含量98.5%以上的洗脱液,该洗脱液的HPLC色谱图如图10所示;合并收集到的非达霉素含量98.5%以上的洗脱液并将其浓缩、干燥得到非达霉素精粉1144mg;经测定本实施非达霉素的总收率为32.4%。
根据面积归一化法计算了本实施例制备过程各步骤中非达霉素的HPLC纯度:浸提液中非达霉素纯度为33.7%;解吸液中非达霉素纯度为55.1%,YMC·GEL ODS-A-HG反相硅胶层析柱的甲醇/水/乙酸洗脱液中非达霉素纯度为88.5%,YMC·GEL ODS-A-HG层析柱的乙腈/水/乙酸洗脱液中非达霉素纯度为98.9%。
综上,本发明方法,不仅能够快速便捷的获得非达霉素,而且所获得的非达霉素的纯度与收率均高,此外,整个方法操作相对简单、成本较低,能够适用于工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!