一种工程菌及其构建方法与在制备香叶醇中的应用与流程
本发明涉及基因工程领域,尤其涉及一种工程菌及其构建方法与在制备香叶醇中的应用。
背景技术:
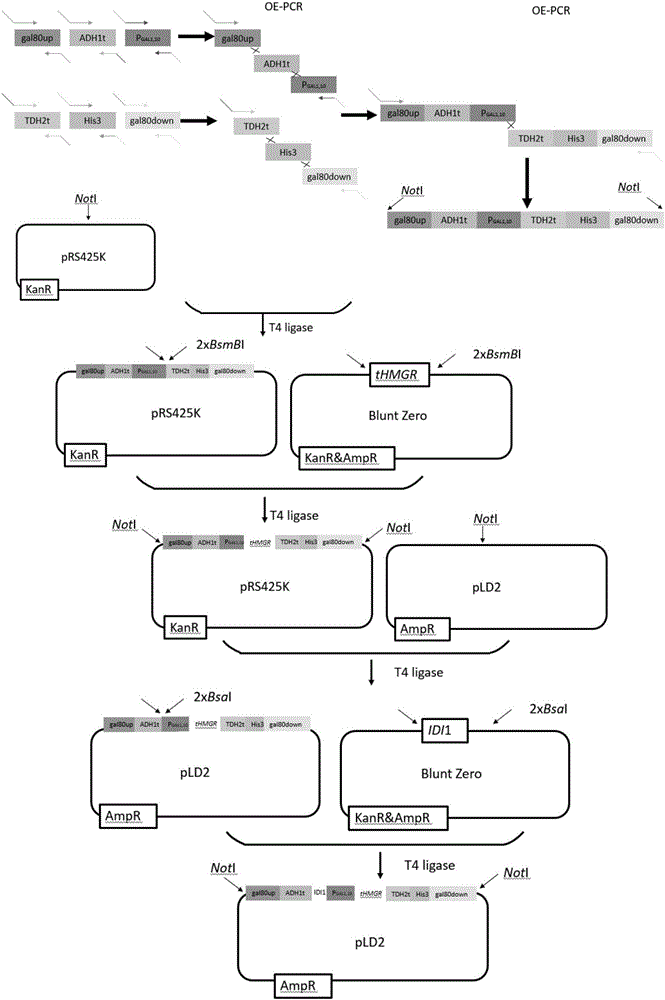
:香叶醇(Geraniol,3,7-二甲基-2,6-辛二烯-1-醇,C10H18O,分子量为154.2493),又名牦牛儿醇,是从植物挥发油中发现的一种无环单萜类化合物。由于香叶醇具有温和的玫瑰花味道,被广泛用于花香型日用香精,GB2760-1996规定,香叶醇为允许使用的食用香料,主要用以配制苹果、桃、杏、李、草莓、柠檬、姜、肉桂、肉豆蔻等香精。它被作为玫瑰系香精的主剂,是各种花香香精中不可缺少的调香原料,可用于化妆品、肥皂等。香叶醇也是生产香茅醇、紫罗兰酮、维生素A等的原料,香叶醇形成的酯也是很好的香料。除了被用于香精,香叶醇还具有一定的药理活性,可以用于抗菌、驱虫以及慢性支气管炎的临床治疗,还被证明可用于癌症的治疗。此外,由于香叶醇能量高、吸湿性低、挥发性相对较弱的特性,它还被认为是一种优于乙醇的汽油替代品。但是天然生产的香叶醇产量有限,化学合成又存在安全问题,面对不断增加的市场需求,微生物细胞工厂不失为一个优良的香叶醇生产平台。微生物合成具有成本低、产量高和产品安全而且易于操作等优点。目前,在微生物合成香叶醇的研究中,所采用的宿主主要集中于大肠杆菌、酿酒酵母以及甲烷球菌。微生物生产香叶醇的方法最早出现于2013年,江南大学的工业生物科技实验室通过加强前体供应的方法在酿酒酵母中实现了香叶醇的生产。随后,不断的有微生物生产香叶醇的成功案例出现,但大多以是大肠杆菌作为宿主。酿酒酵母作为公认的安全模式微生物,遗传背景清楚、基因操作简单、可进行大规模发酵生产。相比大肠杆菌,它的菌体维生素、蛋白质含量高,可作食用药用和饲料,而且发酵过程不需要添加抗生素类物质。因此,实现香叶醇在酿酒酵母中的高产将会在香叶醇微生物生产产业化上展现极大的竞争力。然而,截至目前利用酿酒酵母合成香叶醇的报道较少且产量很低。相比于香叶醇在大肠杆菌中的产量,香叶醇在酿酒酵母中的产量仍相对较低,远远不能达到工业化的要求。因此,亟待开发高产香叶醇的重组酿酒酵母。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供一种工程菌及其构建方法与在制备香叶醇中的应用,本发明提供的菌株能够发酵产生香叶醇,产生香叶醇的最高浓度可达360mg/L。本发明提供了经改造的GES基因,其核苷酸序列如SEQIDNO:1~7中任一项所示;或为SEQIDNO:1~7任一项所示核苷酸序列中经取代、缺失或添加一个或多个核苷酸得到的核苷酸序列。本发明提供的GES基因分别来自7种不同的植物,其中:SEQIDNO:1所示核苷酸序列改造自细毛樟(Cinnamomumtenuipile)的GES基因(CtGES);SEQIDNO:2所示核苷酸序列改造自甜舌草(Lippiadulcis)的GES基因(LdGES);SEQIDNO:3所示核苷酸序列改造自葡萄(Vitisvinifera)的GES基因(VvGES);SEQIDNO:4所示核苷酸序列改造自紫苏柠檬桉(Perillacitriodora)的GES基因(PcGES);SEQIDNO:5所示核苷酸序列改造自长春花(Catharanthusroseus)的GES基因(CrGES);SEQIDNO:6、7所示核苷酸序列改造自缬草(Valerianaofficinalis)的GES基因(VoGES);其中,SEQIDNO:6(VoGES1)与SEQIDNO:7(VoGES2)所表达GES蛋白之间只有一个氨基酸的区别;。本发明实验表明,在酵母菌转化如IDIl基因和tHMG基因的酵母菌中,进一步转入SEQIDNO:1~7所示核苷酸序列的GES基因,能够使酵母菌产生香叶醇。在SEQIDNO:1~7任一项所示的核苷酸序列中经取代、缺失或添加一个或多个核苷酸得到的核苷酸序列,且能够编码具有GES酶活性的蛋白质的DNA分子,也在本发明的保护范围之内。根据检测结果分析,GES定位于叶绿体,但是酿酒酵母中没有叶绿体,可能会导致GES不能很好地折叠从而影响其活性,所以对其定位序列进行截短。GES蛋白的膜定位序列位于N端,因此,对GES基因序列的5’端进行截短。GES蛋白的膜定位序列的长度约14~88个氨基酸。本发明实施例对LdGES、CrGES、VoGES1、VoGES2截短后的效果进行验证,在LdGES截短N端28个氨基酸,CrGES分别截短N端14个、28个、43个氨基酸,而VoGES1、VoGES2分别截短N端58个和88个氨基酸,以表达上述截短后GES蛋白的基因转入酵母菌,能够进一步的提高香叶醇的产量。本发明提供的经改造的GES基因的序列为SEQIDNO:1~7任一项所示核苷酸序列的5’端的缺失一个或多个核苷酸。所述多个为42个~264个,具体为42个、69个、84个、129个、174个、264个。本发明实施例中,经改造的GES基因序列如SEQIDNO:8~15任一项所示。一些具体实施例中,在SEQIDNO:2所示核苷酸序列的5’端缺失69个核苷酸(SEQIDNO:8);在SEQIDNO:5所示核苷酸序列的5’端缺失42个核苷酸(SEQIDNO:9)、84个核苷酸(SEQIDNO:10)、129个核苷酸(SEQIDNO:11);在SEQIDNO:6所示核苷酸序列的5’端缺失174个核苷酸(SEQIDNO:12)、264个核苷酸(SEQIDNO:13);在SEQIDNO:7所示核苷酸序列的5’端缺失174个核苷酸(SEQIDNO:14)、264个核苷酸(SEQIDNO:15)。实验表明,对LdGES基因5’端截短84个核苷酸后,LdGES酶N端被截短28个氨基酸,转化入酵母菌后,香叶醇的产量由4.53mg/L提高至127.68mg/L,提高了约28倍;对CrGES基因5’端截短42个核苷酸后,CrGES酶N端被截短14个氨基酸,转化入酵母菌后,香叶醇的产量由42.63mg/L提高至283.36mg/L,提高了约7倍;对CrGES基因5’端截短84个核苷酸后,CrGES酶N端被截短28个氨基酸,转化入酵母菌后,香叶醇的产量由42.63mg/L提高至295.62mg/L,提高了约7倍;对CrGES基因5’端截短129个核苷酸后,CrGES酶N端被截短43个氨基酸,转化入酵母菌后,香叶醇的产量由42.63mg/L提高至360.06mg/L,提高了约8倍;对VoGES1基因5’端截短174个核苷酸VoGES1酶N端被截短58个氨基酸,转化入酵母菌后,香叶醇的产量由2.73mg/L提高至102.46mg/L,提高了约37.53倍;对VoGES1基因5’端截短264个核苷酸后,VoGES1酶N端被截短88个氨基酸,转化入酵母菌后,香叶醇的产量由2.73mg/L提高至12.41mg/L,提高了约5倍;对VoGES2基因5’端截短174个核苷酸后,VoGES2酶N端被截短58个氨基酸,转化入酵母菌后,香叶醇的产量由9.51mg/L提高至241.28mg/L,提高了约25倍;对VoGES2基因5’端截短264个核苷酸后,VoGES2酶N端被截短88个氨基酸,转化入酵母菌后,香叶醇的产量由9.51mg/L提高至98.54mg/L,提高了约10倍。可见,转化SEQIDNO:11所示核苷酸序列可将香叶醇的产量提高至360.06mg/L。转化SEQIDNO:9~11、SEQIDNO:14任一项所示核苷酸序列可将香叶醇的产量提高至200mg/L以上。转化SEQIDNO:8~12、SEQIDNO:14任一项所示核苷酸序列可将香叶醇的产量提高至100mg/L以上。转化SEQIDNO:8~12、SEQIDNO:14~15任一项所示核苷酸序列可将香叶醇的产量提高至98.5mg/L以上。本发明提供的经改造的GES基因在构建产香叶醇的工程菌中的应用。本发明还提供了一种工程菌,其表达IDI1基因、tHMG基因和经改造的GES基因;所述IDI1基因的序列如SEQIDNO:16所示;所述tHMG基因序列如SEQIDNO:17所示。根据香叶醇的生物合成途径(图1),HMGCoA经HMGR、IDIl、ERG20、GES作用后形成香叶醇。本发明通过使底盘菌表达IDI1基因、tHMG基因和经改造的GES基因,从而实现了在工程菌中高产香叶醇。本发明所述的工程菌选自藻类、酵母菌、霉菌或细菌。其中,酵母菌优选解脂属酵母、克鲁维属酵母或酿酒酵母;所述酿酒酵母选自CEN.PK系列、BY系列;所述霉菌优选链霉菌;细菌优选大肠杆菌或枯草芽孢杆菌。在本发明实施例中,其起始菌株为酵母菌CEN.PK2-1C。所述IDIl基因和tHMG基因来自酵母CEN.PK2-1基因组。所述IDIl基因和tHMG基因整合在酵母菌CEN.PK2-1C的GAL80基因位置,酵母菌CEN.PK2-1C的GAL80基因被敲除。所述经改造的GES基因采用着丝粒质粒导入。本发明提供的工程菌的基因型为CEN.PK2-1C,Δgal80::tHMG-PGAL1,10-IDI1-His3,pRS415-GPM1t-PGAL7-GES-GPDt。其中,GES的基因序列如SEQIDNO:1~7任一项所示,或为SEQIDNO:1~7任一项所示核苷酸序列中经取代、缺失或添加一个或多个核苷酸得到的核苷酸序列。本发明实施例中,经改造的GES基因序列如SEQIDNO:8~15任一项所示。本发明提供的工程菌在生产香叶醇中的应用。采用本发明提供的工程菌能够使香叶醇的产量提高至360.1mg/L。为了构建本发明提供的工程菌,本发明还提供了一种敲除盒,包括顺序连接的gal80左同源臂,ADH1t终止子、GAL1/10启动子、TDH2t终止子、His营养标签,gal80右同源臂。所述gal80左同源臂的长度为400bp,gal80右同源臂的长度为400bp。作为优选,敲除盒的骨架为pRS425K。其中,gal80左同源臂、gal80右同源臂、ADH1t终止子、GAL1/10启动子、TDH2t终止子来自酵母CEN.PK2-1。His营养标签来自酵母菌S288C。扩增gal80左同源臂的引物对如SEQIDNO:20~21所示。扩增ADH1t终止子的引物对如SEQIDNO:22~23所示。扩增GAL1,10启动子的引物对如SEQIDNO:24~25所示。扩增TDH2t终止子的引物对如SEQIDNO:26~27所示。扩增gal80右同源臂的引物对如SEQIDNO:28~29所示。扩增His营养标签的引物对如SEQIDNO:30~31所示。本发明提供的敲除盒的构建方法包括:步骤1:将gal80左同源臂,ADH1t终止子、GAL1/10启动子、TDH2t终止子、His营养标签,gal80右同源臂通过OE-PCR方法顺次拼接得到片段gal80up-ADH1t-PGAL1/10-TTDH2t-His-gal80down;步骤2:将片段gal80up-ADH1t-PGAL1/10-TTDH2t-His-gal80down与多拷贝质粒pRS425K通过NotI酶切位点连接,得到Δgal80::ADH1t-PGAL1,10-TDH2t-His3敲除盒。所述OE-PCR以如SEQIDNO:20的引物为上游引物,以如SEQIDNO:31的引物为下游引物。进一步的,将IDIl和tHMG连接入敲除盒,获得敲除盒Δgal80::ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His3,具体方法为:步骤1:将tHMG片段通过BsmBI酶切位点与敲除盒Δgal80::ADH1t-PGAL1,10-TDH2t-His3连接后经NotI酶切后回收敲除盒,将敲除盒转移到pLD2载体上获得含有tHMG基因的敲除盒;步骤2:将IDI1片段通过BsaI酶切位点连接到含有IDIl基因的敲除盒上,获得pLD2-gal80up-ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His-gal80down。本发明提供的敲除盒Δgal80::ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His3在构建产香叶醇的工程菌中的应用。为了构建产香叶醇的工程菌,本发明还提供了一种含有改造后GES基因的着丝粒质粒,其构建方法和质粒图谱如图3所示。该着丝粒质粒以pRS415质粒为骨架,包括顺序连接的GPM1t、GAL7启动子、GES基因、GPDt。该着丝粒质粒的构建以表达盒pLD2-GPM1t-PGAL7-GPDt为起始,将经改造的GES基因通过BsaI酶切连入表达盒中得到pLD2-GPM1t-PGAL7-GES-GPDt。利用NotI酶切位点,将表达盒转移到单拷贝质粒pRS415上。本发明对GES基因片段的制备方法不做限定,为了将GES基因连接入表达盒,在GES基因的5’端添加序列gcggccgcggtctcca(SEQIDNO:18);3’添加序列taaaggagaccgcggccgc(SEQIDNO:19)。本发明提供的工程菌的构建方法,将IDI1基因、tHMG基因和经改造的GES基因转化入起始菌。具体的,本发明提供的工程菌的构建方法包括:步骤1:以敲除盒Δgal80::ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His3将IDI1基因和tHMG基因转化入起始菌获得底盘菌;步骤2:将含有改造后GES基因的着丝粒质粒转化入底盘菌,获得本发明提供的工程菌。本发明中,起始菌为酵母菌,优选的酵母菌为CEN.PK2-1C。步骤1、步骤2中所述转化采用醋酸锂高效转化法。本发明还提供了一种香叶醇的制备方法,发酵本发明提供的工程菌。所述发酵为两相发酵;所述两相发酵的有机相采用十四酸异丙酯。本发明采用两相发酵法尽可能减小香叶醇对酿酒酵母细胞的伤害。所述发酵的培养基包括:合成酵母氮源YNB6.7g/L;葡萄糖20g/L;缺亮氨酸的混合氨基酸粉末2g/L。所述十四酸异丙酯体积为发酵培养基的20%。所述发酵的温度为30℃,200rpm震荡。所述发酵具体为:以初始OD600=0.2接种于新鲜的5ml发酵培养基中,于30℃、250rpm条件下培养12h左右至菌体生长至对数中期,以初始OD600=0.2接种于50ml发酵培养基中,同时加入体积分数为20%的十四酸异丙酯在30℃、200rpm条件下进行两相发酵,20h时补加10g/L无水乙醇,120h后结束发酵。采用本发明提供的工程菌发酵,由于初始培养基中因有葡萄糖存在,GES的转录受到葡萄糖抑制;随着发酵的进行,葡萄糖逐渐被消耗,发酵19h左右葡萄糖耗尽,葡萄糖抑制效应解除,在GAL80已经敲除的情况下PGAL启动子自动开启,GES开始转录并翻译,从而逐渐积累香叶醇。利用PGAL使得菌体生长和产物生产得以分开,从而减小了产物毒性对细胞生长的不利影响,进而使香叶醇产量的进一步提升成为可能。所述发酵结束后,还包括提取的步骤。所述提取为:取十四酸异丙酯层,除水后获得含有香叶醇的溶液。本发明提供了一种工程菌及其构建方法与在生产香叶醇中的应用,本发明提供的工程菌中表达IDI1基因、tHMG基因和经改造的GES基因。相对于现有技术中的菌株,本发明提供的工程菌产香叶醇的产量更高发酵120h,香叶醇的浓度可达360.06mg/L。附图说明图1示利用重组酿酒酵母合成香叶醇的路径图;图2示底盘菌株敲除盒构建图;图3示GES基因表达盒构建图;图4示不同发酵环境下细胞的生长曲线图。具体实施方式本发明提供了一种工程菌及其构建方法与在制备香叶醇中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明中,合成香叶醇的前体物质是GPP,GPP在香叶醇合酶(geraniolsynthase,GES)的作用下合成香叶醇。本发明采用的GES基因来源及序列如表1。本发明中,英文缩写表示的含义如下:GES香叶醇合酶tHMG3-羟基-3-甲基戊二酰辅酶A还原酶编码基因IDI1异戊烯基焦磷酸异构酶gal80upGAL左同源臂gal80downGAL右同源臂PGAL1GAL1启动子TTDH2tTDH2t终止子PGAL1/10GAL1/10启动子△ga80l::Gal80被敲除后,被::后面的序列取代Glucose葡萄糖Acetyl-CoA乙酰辅酶AHMG-CoA3-羟基-3甲基戊二酰辅酶mevalonate甲羟戊酸IPP异戊二烯焦磷酸DMAPP二甲基丙烯基二磷酸-三铵盐GPP牻牛儿基焦磷酸Geraniol香叶醇ALD基因醛脱氢酶基因OE-PCR重叠延伸PCR本发明提供的酿酒酵母工程菌株及其构建方法、应用中所用质粒等生物材料均可由市场购得,引物序列均可由生物公司合成。下面结合实施例,进一步阐述本发明:实施例1构建底盘菌株以CEN.PK2-1C为初始菌株,构建敲除基因GAL80同时在GAL80位置整合idi1(SEQIDNO:16)和tHMGR(SEQIDNO:17)基因的酿酒酵母菌株CEN.PK2-1C,Δgal80::tHMG-PGAL1,10-IDI1-His3,得到最终底盘菌株SyBE_Sc020201。具体构建过程如下:构建过程中用到的引物序列如表1:表1:引物序列扩增gal80左同源臂SEQIDNO:20~21扩增ADH1t终止子SEQIDNO:22~23扩增GAL1,10启动子SEQIDNO:24~25扩增TDH2t终止子SEQIDNO:26~27扩增gal80右同源臂SEQIDNO:28~29扩增His营养标签SEQIDNO:30~31扩增OE-PCRSEQIDNO:20、31扩增基因IDI1SEQIDNO:35~36扩增基因tHMGSEQIDNO:37~38菌落PCRSEQIDNO:35-38以酿酒酵母CEN.PK2-1基因组为模板,设计上、下游引物PCR扩增gal80上下游400bp同源臂、ADH1t终止子、PGAL1,10启动子、TDH2t终止子、His营养标签,然后将gal80上游同源臂、ADH1t终止子、PGAL1,10启动子、TDH2t终止子、His营养标签、gal80下游同源臂通过OE-PCR方法拼接起来,得到两端包含NotI酶切位点且在PGAL1启动子和TDH2t终止子之间包含两个BsaI酶切位点,在PGAL10启动子和ADH1t终止子之间包含两个BsmBI的片段gal80up-ADH1t-PGAL1/10-TTDH2t-His-gal80down,与多拷贝质粒pRS425K通过NotI酶切位点连接,得到Δgal80::ADH1t-PGAL1,10-TDH2t-His3敲除盒。以酿酒酵母CEN.PK2-1基因组为模板,设计上下游引物分别扩增基因IDI1和tHMG,首先将扩增得到的tHMG通过BsmBI酶切位点与敲除盒连接,转入大肠杆菌感受态TransT1中,菌落PCR筛选,提质粒进行NotI酶切验证以及测序验证得到正确的质粒pRS425K-gal80up-ADH1t-PGAL1/10-tHMG-TTDH2t-His-gal80down,将该质粒经NotI酶切后回收敲除盒,将敲除盒转移到pLD2载体上,经蓝白斑筛选、菌落PCR验证和NotI酶切验证得正确克隆,其质粒为pLD2-gal80up-ADH1t-PGAL1/10-tHMG-TTDH2t-His-gal80down。然后将扩增得到的IDI1通过BsaI酶切位点连接到上一步得到的质粒中进而得到pLD2-gal80up-ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His-gal80down,同样经过测序以及酶切验证以后得到正确的克隆。敲除盒构建完成以后,用NotI内切酶进行酶切,得到片段gal80up-ADH1t-IDI1-PGAL1/10-tHMG-TTDH2t-His-gal80down,采用醋酸锂高效转化法将得到的片段单独转化酿酒酵母菌株CEN.PK2-1C,通过GAL80左右同源序列与酵母基因组上GAL80位点发生同源重组而整合至酿酒酵母基因组上。转化后采用SC-drop固体培养基(合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺色氨酸、亮氨酸、组氨酸和尿嘧啶的混合氨基酸粉末2g/L,2%的琼脂粉)进行筛选,得到的转化子进行划线分纯和富集培养后提取酵母基因组进行PCR验证,对验证正确的重组菌株保存甘油菌并命名为SyBE_Sc020201(CEN.PK2-1C,Δgal80::tHMG-PGAL1,10-IDI1-His3)。实施例2生产香叶醇酿酒酵母菌株的构建1、外源功能基因元件的获得外源基因包括用于合成香叶醇的香叶醇合成酶基因GES:选取9种不同来源的功能基因筛选合成香叶醇最优的基因来源(如表2),本发明共涉及10个合成香叶醇的外源基因。上述基因均为经过酿酒酵母密码子优化并适当规避常用限制性酶切位点后,在基因5’端添加gcggccgcggtctcca(SEQIDNO:18)、3’添加taaaggagaccgcggccgc(SEQIDNO:19)通过人工合成得到。表2经改造CrtZ基因来源及序列其中VoGES1和VoGES2编码的蛋白之间只有一个氨基酸的区别。5’端缺失片段的获得方式为:通过网站http://www.cbs.dtu.dk/index.shtml预测LdGES、CrGES、VoGES的膜定位序列,并根据预测结果进行梯度截短。截短方法如下:以合成的基因LdGES、CrGES、VoGES为模板,设计上下游引物(表3)扩增得到截短且两端带有BsaI酶切位点的tGES。LdGES截短N端23个氨基酸,CrGES分别截短N端14个、28个、43个氨基酸,而VoGES1、VoGES2分别截短N端58个和88个氨基酸。表3扩增截短序列的上下游引物目的片段引物序列SEQIDNO:8SEQIDNO:46、SEQIDNO:47SEQIDNO:9SEQIDNO:39、SEQIDNO:42SEQIDNO:10SEQIDNO:40、SEQIDNO:42SEQIDNO:11SEQIDNO:41、SEQIDNO:42SEQIDNO:12SEQIDNO:43、SEQIDNO:45SEQIDNO:13SEQIDNO:44、SEQIDNO:45SEQIDNO:14SEQIDNO:43、SEQIDNO:45SEQIDNO:15SEQIDNO:44、SEQIDNO:452、生产香叶醇酿酒酵母菌株的构建利用实验室已有表达盒pLD2-GPM1t-PGAL7-GPDt(其序列如SEQIDNO:48所示),将10种人工合成的GES通过BsaI酶切连入表达盒中得到pLD2-GPM1t-PGAL7-GES-GPDt。利用NotI酶切位点,将表达盒转移到单拷贝质粒pRS415上,转化大肠杆菌TransT1,经过蓝白斑筛选、菌落PCR验证以及测序验证后得到正确的克隆,其质粒为pRS415-GPM1t-PGAL7-GES-GPDt。通过醋酸锂高效转化法将得到的质粒分别转入优化后的酿酒酵母菌株SyBE_Sc020201中,转化后采用SC-drop固体板(合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺色氨酸、亮氨酸、组氨酸和尿嘧啶的混合氨基酸粉末2g/L,2%的琼脂粉)进行筛选,得到的转化子进行划线分纯和富集培养后进行菌落PCR验证,对验证正确的重组菌株保存甘油菌并分别命名:菌种命名与转入序列对应关系如表4:表4菌种命名及转入GES基因序列SyBE_Sc020202SEQIDNO:1SyBE_Sc020204SEQIDNO:32SyBE_Sc020205SEQIDNO:33SyBE_Sc020206SEQIDNO:2SyBE_Sc020207SEQIDNO:3SyBE_Sc020208SEQIDNO:4SyBE_Sc020209SEQIDNO:5SyBE_Sc020210SEQIDNO:6SyBE_Sc020211SEQIDNO:7SyBE_Sc020212SEQIDNO:34SyBE_Sc020215SEQIDNO:8SyBE_Sc020216SEQIDNO:9SyBE_Sc020217SEQIDNO:10SyBE_Sc020218SEQIDNO:11SyBE_Sc020219SEQIDNO:12SyBE_Sc020220SEQIDNO:13SyBE_Sc020221SEQIDNO:14SyBE_Sc020222SEQIDNO:15实施例3香叶醇的制备试验材料:实施例2构建的生产香叶醇酿酒酵母菌株试验方法:种子培养基:合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺亮氨酸的混合氨基酸粉末2g/L发酵培养基:合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺亮氨酸的混合氨基酸粉末2g/L从固体划线平板上挑取单菌落接种于5mlSC-Leu液体培养基中,在30℃、250rpm条件下培养20h左右至菌体生长达到对数中期的时候,以初始OD600=0.2接种于新鲜的5mlSC-Leu液体培养基中,于30℃、250rpm条件下培养12h左右至菌体生长至对数中期,以初始OD600接种于50ml发酵培养基Sc-Leu中,同时加入20%的十四酸异丙酯在30℃、200rpm条件下进行两相发酵,20h时补加10g/L无水乙醇,120h后结束发酵。香叶醇提取方法:将发酵液倒入50ml离心管中,12000rpm离心5min,用移液器将上层十四酸异丙酯转移至2ml离心管中,向其中加入适量烘干的无水硫酸钠上下翻转数次并静置10min左右进行除水,最后通过0.22μm有机滤膜过滤以及正己烷稀释后,利用GC-MS进行检测分析。检测结果如表5:表5各菌种香叶醇产量实验结果:初始培养基中因有葡萄糖存在,GES的转录受到葡萄糖抑制;随着发酵的进行,葡萄糖逐渐被消耗,发酵19h左右葡萄糖耗尽,葡萄糖抑制效应解除,在GAL80已经敲除的情况下PGAL启动子自动开启,GES开始转录并翻译,从而逐渐积累香叶醇。利用PGAL使得菌体生长和产物生产得以分开,从而减小了产物毒性对细胞生长的不利影响,进而使香叶醇产量的进一步提升成为可能。由表4可知,未进行截短的序列转化酵母菌后,SyBE_Sc020209的香叶醇产量最高,显著优于其它转化未截短序列的酵母菌(p<0.01)。SyBE_Sc0202010和SyBE_Sc020211虽然只有一个氨基酸的差异但是产量却相差接近4倍。由此可知,寻求最优的基因来源,采用PGAL启动子对于高效生产香叶醇有着积极的意义。转化截短的序列后,大多数酵母菌株的香叶醇产量大幅提升,其中,SyBE_Sc020218的香叶醇产量高达360mg/L显著优于其它菌株(p<0.01)。对于三种不同截短的CrGES,香叶醇产量都有明显提升,且按照预测结果将定位序列完全截短所得到的香叶醇产量最高,显著优于部分截短的菌株(p<0.01);而LdGES、VoGES1、VoGES2截短后香叶醇产量都有一定程度的提高,但是对于VoGES1和VoGES2按照预测结果将定位序列完全截短的效果不如部分截短好。实施例4两相发酵对细胞生长的影响1、对照菌株的构建将质粒pRS415通过醋酸锂高效转化法将得到的质粒分别转入优化后的酿酒酵母菌株SyBE_Sc020201中,转化后采用SC-Leu固体板(合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺亮氨酸的混合氨基酸粉末2g/L,2%的琼脂粉)进行筛选,得到的转化子进行划线分纯培养后进行菌落PCR验证,对验证正确的重组菌株保存甘油菌并分别命名为SyBE_Sc020214。2、比较两相发酵和水相发酵对细胞生长及香叶醇生产的影响试验材料:SyBE_Sc020209、SyBE_Sc020214试验方法:种子培养基:合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺亮氨酸的混合氨基酸粉末2g/L发酵培养基:合成酵母氮源YNB6.7g/L,葡萄糖20g/L,缺亮氨酸的混合氨基酸粉末2g/L从固体划线平板上挑取单菌落接种于5mlSD-Leu液体培养基中,在30℃、250rpm条件下培养20h左右至菌体生长达到对数中期的时候,以初始OD600=0.2接种于新鲜的5mlSC-Leu液体培养基中,于30℃、250rpm条件下培养12h左右至菌体生长至对数中期,以初始OD600接种于50ml发酵培养基Sc-Leu中,在30℃、200rpm条件下进行发酵。对于SyBE_Sc020209接种时分别加入20%的十四酸异丙酯或者正癸烷进行两相发酵,对于SyBE_Sc020214接种时加入20%的十四酸异丙酯进行两相发酵。此外,对于SyBE_Sc020209也同时用水相进行了单相发酵。19h时补加10g/L无水乙醇,120h后结束发酵。实验结果:如图4所示,未添加十四酸异丙酯的SyBE_Sc020209对照组在19h以后生长显著低于实验组,说明19h左右葡萄糖逐渐耗完,香叶醇开始积累,对细胞产生毒性而十四酸异丙酯可以很好的缓解香叶醇对细胞的毒性;添加正癸烷的实验组细胞生长明显不如其他组细胞,说明正癸烷对细胞有较大的毒性;添加十四酸异丙酯的SyBE_Sc020214对照组生长与添加十四酸异丙酯的SyBE_Sc020209实验组生长基本一致,进一步说明十四酸异丙酯可以很好的缓解香叶醇产生的细胞毒性。由此可知,采用十四酸异丙酯作为有机相进行两相发酵对于酿酒酵母高效生产香叶醇有着积极的意义。以上仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1