番茄S‑亚硝基谷胱甘肽还原酶基因的新用途的制作方法
本发明涉及基因工程领域,具体涉及番茄S-亚硝基谷胱甘肽还原酶基因的新用途,即其植物表达载体的构建及其在获得抗硝酸盐、抗NaCl、抗干旱胁迫能力提高的转基因植物的应用。
背景技术:
自然界中的植物经常遇到各种不良环境条件,如NO3-过量导致的土壤次生盐渍化、干旱、盐渍、洪涝、低温、高温等非生物胁迫,影响植物的生长发育,甚至导致植物死亡。非生物胁迫是制约植物生长发育、影响作物产量和质量的关键因素,探讨非生物胁迫对植物生长发育的影响是研究植物抗逆机制的重要内容之一,对于开展逆境胁迫耐受性植物育种有着重要意义。
S-亚硝基谷胱甘肽还原酶(S-nitrosoglutathione reductase,GSNOR),以前被称为谷胱甘肽依赖型甲醛脱氢酶,属于醇脱氢酶III(alcohol dehydrogenase, ADHIII)家族成员。GSNOR存在于细菌、酵母、哺乳动物、植物等所有物种中,保守性高。在拟南芥、玉米、水稻、向日葵、甜椒、番茄、豌豆、黄瓜、甜瓜中都发现GSNOR存在。
NO作为一种重要的信号分子,介导了包括种子萌发、侧根生长、开花、气孔关闭等植物发育过程以及生物和非生物胁迫的应答。目前认为NO对植物体的作用具有双重性,低浓度的NO可以在胁迫下保护植物免受伤害,但是NO本身是一个活性很强的自由基,在高浓度下又可以引起一些毒性效应。NO可以与体内主要的抗氧化物质谷胱甘肽(GSH)反应生成S-亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO)。GSNO参与的主要反应包括将NO基团转移到靶蛋白的巯基上,形成S-亚硝基硫醇(nitrosothiols,SNOs),这个过程也被称为S-亚硝基化(S-nitrosylation)。SNOs在NO的生物功能中起非常重要的作用,尤其是GSNO,参与了NO的储存和转运、调节蛋白的活性和信号传导。
GSNOR是特异的GSNO降解酶,以NADH为还原力催化GSNO最终形成氧化型谷胱甘肽(GSSG)和NH3。GSNOR通过还原GSNO调节胞内的NO、小分子SNOs和蛋白质亚硝基硫醇的水平,阻止GSNO引起的NO信号传递,保护机体免受亚硝化胁迫的影响。GSNOR通过促进GSNO代谢降低NO的生物活性以间接调控蛋白亚硝基化的水平。此外,由于GSNOR参与的反应影响GSH和NADH之间的平衡,所以GSNOR可以间接参与调控细胞内的氧化还原状态。
GSNOR参与植物生长、气孔信号转导、抵御病原菌、热耐受性、细胞死亡和镉胁迫等多种生理过程。低温、高温、连续光照、连续黑暗以及机械伤害处理下豌豆和向日葵中的GSNOR的活性降低,砷胁迫下拟南芥中GSNOR活性增加,而镉胁迫下豌豆叶片GSNOR活性降低,并伴随NO和GSH含量降低。GSNOR通过调控细胞内的SNOs水平参与拟南芥的抗病性并正向调控水杨酸信号途径。反义表达GSNOR的植株对霜霉病表现出更高的抗性,此外,系统获得性抗性和病程相关蛋白(PR1)基因的表达增加,而过表达植株抗性受到抑制。GSNOR参与植物耐热性调控,GSNOR缺失导致植物对高温敏感,而对百草枯的抗性增加。
技术实现要素:
本发明的目的在于提供番茄S-亚硝基谷胱甘肽还原酶基因的新用途,即用于制备抗硝酸盐、抗NaCl、抗干旱胁迫能力增强的转基因植物;所述的S-亚硝基谷胱甘肽还原酶基因SlADH3的cDNA来源于番茄(Lycopersicon esculentum Mill.),GenBank登录号为NM_001251867。
本发明通过构建番茄S-亚硝基谷胱甘肽还原酶基因的植物表达载体pRI101-GFP-SlADH3,利用该载体制备抗性提高的转基因植物;该载体含有番茄SlADH3基因的编码区序列(GenBank登录号为NM_001251867)及35S组成型启动子、绿色荧光蛋白(GFP)、卡那霉素筛选标记基因(Kan),S-亚硝基谷胱甘肽还原酶基因SlADH3 cDNA的上游为CaMV 35S的组成型表达启动子。
上述载体中,用于构建所属植物表达载体的起始载体为pRI101(购自Takara公司)。
本发明的上述目的是通过下述的技术方案得以实现的:
1、植物表达载体的构建
(1)从GenBank中查找番茄SlADH3基因的cDNA序列,并设计序列如下的一对引物:
上游引物为SlADH3-F-SalI: 5’-GTCGACATGGCTACACAAGGTCAAGT-3’ (下划线表示添加Sal I酶切位点);下游引物为SlADH3-R-KpnI: 5’-GGTACCTCATACAAACATATCCAGGAC (下划线表示添加KpnI酶切位点) 。以番茄第一链cDNA为模板扩增,通过PCR扩增得到SlADH3基因的全长cDNA(1140bp);
(2)回收并纯化SlADH3全长基因cDNA片段,并将其连接到pMD18-T载体上,转化大肠杆菌DH5a中,提取质粒DNA,通过PCR检测和酶切检测获得正确的重组质粒pMD18-SlADH3;
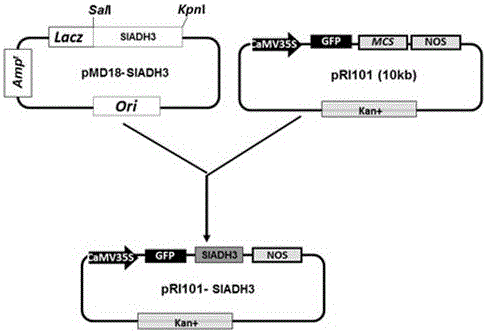
(3)用限制性内切酶Sal I和KpnI酶切pMD18-SlADH3和pRI101空载体,回收酶切的片段,通过T4 DNA连接酶连接获得重组的pRI101-GFP-SlADH3 植物表达载体。
本发明的植物表达载体对那些能实施转基因操作的植物都适用,如烟草、拟南芥、矮牵牛、非洲菊等。在本发明的实施中以烟草为例说明该表达载体的应用过程。
2、烟草的转化
采用电转化转化质粒pRI101- GFP-SlADH3进入农杆菌感受态细胞LBA4404,涂布在利福平(Spe)和卡那霉素的平板上生长两天后,用菌落PCR检测质粒是否转化到农杆菌中。PCR扩增用SlADH3的上下游引物, 扩增片段理论长度为1140 bp,PCR产物经电泳检测显示与理论值相符,表明质粒已转入农杆菌中。准备烟草(Nicotiana tabacum cv. NC89)的无菌苗,通过农杆菌介导的叶盘法转化烟草,然后通过组织培养获得小苗,筛选具有卡那霉素(Kan)抗性植株,将其转移到含有卡那霉素的MS培养基(含有3 %蔗糖)上继续培养,从而获得无菌的转基因烟草植株。
3、转基因烟草的检测
(1)为了检测目的基因SlADH3是否插入转进烟草的基因组,以抗性苗的基因组为模板,利用SlADH3上下游引物做PCR检测,PCR扩增产物片段理论长度为1140 bp,PCR产物经电泳检测显示与理论值相符,说明目的基因SlADH3已插入到烟草基因组中;
(2)为了检测目的基因SlADH3在转基因烟草中是否翻译,提取不同株系的蛋白,利用Western blot检测蛋白表达水平,发现转基因株系中SlADH3水平高,但是野生型烟草中没有表达,说明SlADH3蛋白在转基因烟草中正常表达;
(3)SlADH3转基因烟草中S-亚硝基谷胱甘肽还原酶活性的检测
为了检测SlADH3转基因烟草中其酶活性是否提高,选取转基因烟草的嫩叶,提取总蛋白,测定S-亚硝基谷胱甘肽还原酶的比活力,测定结果显示,转基因植物GSNOR比活力明显高于野生型,说明SlADH3编码酶在烟草中已成功表达。
4、SlADH3转基因烟草种子萌发期抗硝酸盐能力检测
将野生型烟草(WT)植株和转基因烟草SlADH3株系 #4、#5、#6的种子,消毒后播种到添加100 mM NO3- 的MS培养基上培养,并统计每天种子萌发率,结果表明转基因烟草的发芽率高于野生型植株。
5、SlADH3转基因烟草幼苗期抗NaCl能力检测
将野生型烟草(WT)植株和转基因烟草SlADH3株系 #4、#5、#6的种子,消毒后播种到添加100 mM NaCl的MS培养基上培养,并统计每天种子萌发率,结果表明转基因烟草的发芽率高于野生型植株。
6、SlADH3转基因烟草幼苗期抗干旱能力检测
将野生型烟草(WT)植株和转基因烟草SlADH3株系 #4、#5、#6的种子,消毒后播种到添加150 mM 甘露醇的MS培养基上培养,并统计每天种子萌发率,结果表明转基因烟草的发芽率高于野生型植株。
以上实施例说明本发明的重组载体pRI101-GFP-SlADH3在转基因植株中的应用可提高其对硝酸盐、NaCl、干旱胁迫的抵抗能力。
附图说明
图1为 pMD18-T-SlADH3的克隆策略;
图2为植物表达载体pRI101-GFP-SlADH3的克隆策略;
图3为转基因烟草的检测;其中 图A为SlADH3基因在转基因烟草基因组中整合情况检测示意图,图B为SlADH3在转基因烟草中的western blot水平检测;图中以野生型烟草基因组为对照模板(WT),#1~6为经抗生素筛选出的转基因烟草株系;
图4为SlADH3基因在转基因烟草中的S-亚硝基谷胱甘肽还原酶活性;
图5为SlADH3转基因烟草种子萌发期抗硝酸盐能力检测结果;A图为野生型和SlADH3转基因烟草种子在MS培养基中发芽的图片;B图为野生型和SlADH3转基因烟草种子在MS中添加100 mM 硝酸盐培养基中发芽的图片;C图 为野生型和SlADH3转基因烟草种子在MS培养基中发芽率;D图为野生型和SlADH3转基因烟草种子在MS中添加100 mM 硝酸盐培养基中发芽率;
图6为SlADH3转基因烟草种子萌发期抗NaCl能力检测结果;A图为野生型和SlADH3转基因烟草种子在MS培养基中发芽的图片;B图为野生型和SlADH3转基因烟草种子在MS中添加100 mM NaCl培养基中发芽的图片;C 图为野生型和SlADH3转基因烟草种子在MS培养基中发芽率;D图为野生型和SlADH3转基因烟草种子在MS中添加100 mM NaCl培养基中发芽率;
图7为SlADH3转基因烟草种子萌发期抗干旱能力检测结果;A图为野生型和SlADH3转基因烟草种子在MS培养基中发芽的图片;B图为野生型和SlADH3转基因烟草种子在MS中添加150 mM 甘露醇培养基中发芽的图片;C图 为野生型和SlADH3转基因烟草种子在MS培养基中发芽率;D图为野生型和SlADH3转基因烟草种子在MS中添加150 mM 甘露醇培养基中发芽率。
具体实施方式
本实施中采用的试剂主要包括分子生物学实验试剂、植物遗传转化所需的培养基以及转基因植物鉴定和检测所需的各种试剂;各种限制性内切酶、Taq DNA聚合酶、反转录酶、RNA酶抑制剂、dNTP、质粒提取试剂盒、RNA提取试剂盒等为宝生物工程有限公司(大连)产品;其余试剂均为国产分析纯;仪器均为分子生物学以及基因工程实验室常用仪器;所有引物序列均在上海捷瑞生物有限公司合成。本发明实施例中所用方法如无特别说明均为常规方法。
实施例1:SlADH3基因cDNA的PCR扩增及TA克隆
从GenBank中查找番茄SlADH3基因的cDNA序列,并设计一对序列如下的引物:
上游引物为SlADH3-F-SalI: 5’-GTCGACATGGCTACACAAGGTCAAGT-3’(下划线表示添加Sal I酶切位点);下游引物为SlADH3-R-KpnI: 5’-GGTACCTCATACAAACATATCCAGGAC (下划线表示添加KpnI酶切位点) 。以番茄第一链cDNA为模板扩增,通过PCR扩增得到SlADH3基因的全长cDNA(1140bp);
用TRIzoL Reagent(Takara)从番茄幼苗中提取总RNA,取番茄嫩根约0.1g,加入1mL的TRIzoL提取液在研钵中研磨,室温静置5min后移入离心管,再加入0.2 mL氯仿,振荡混匀,离心15 min(12000 rpm),转移上清液至新管,加入0.5 mL异丙醇,混匀室温放置10 min,4℃离心10 min(12000 rpm),弃上清,沉淀用75%乙醇1 mL清洗,4℃离心5 min(7500 rpm),弃乙醇真空干燥沉淀或自然晾干,用20 μl焦碳酸二乙酯(DEPC)处理水溶解RNA。使用M-MuLV Reverse Transcriptase Kit(TaKaRa)进行cDNA的合成,取植物总RNA约0.1 -5μg,oligo(dT) 50 ng,10 mM dNTP mix 1 μl,用DEPC处理水补足至10 μl,混匀后,短暂离心将之收集于管底,置于65℃加热5 min,冰浴10 min,加入反应混合物9 μl(5×reaction buffer 4 μl,25 mM MgCl2 4 μl,0.1M DTT 2 μl,RNA酶抑制剂1μl),将上述混合物混匀,短暂离心将之收集于管底,25℃保温2min,加入1 μl M-MuLV Reverse Transcriptase,将上述混合物混匀,短暂离心将之收集于管底,25℃保温20 min,然后42℃保温70 min,合成cDNA。
以cDNA为模板,用SlADH3基因cDNA上下游特异性引物进行PCR,PCR反应条件:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。反应体系(20 μL)为1 μL cDNA、2 μL 10×Long taq Buffer、0.4 μL dNTP (10 mM each) 0.1 μL 正向(20μM)、 0.1 μL 反向引物(20μM)、0.2 μL ex Taq DNA polymerase (2U/μL) 16.2 μL ddH2O。PCR结束后,取5 μL用于琼脂糖凝胶电泳,扩增得到SlADH3的全长cDNA 1140 bp。回收并纯化SlADH3全长基因片段,并将其连接到pMD-18T (大连宝生物公司)载体上(图1),转化大肠杆菌感受态DH5α(天根生化科技),采用碱裂解法提取质粒DNA,经1%琼脂糖凝胶电泳,选取大小和理论值相符的重组质粒做进一步的PCR检测和双酶切检测。以重组质粒为模板,用引物SlADH3-F-SalI和SlADH3-R-KpnI引物扩增得到1140bp的PCR产物。用SalI和KpnI双酶切重组质粒,经1%琼脂糖凝胶电泳检测酶切产物,连接成功的重组质粒pMD18T-SlADH3单酶切产物理论上为2.7kb和1.14kb左右的条带。测序结果表明SlADH3基因正确。
实施例2:构建植物表达载体pRI101-GFP-SlADH3
用SalI和KpnI双酶切pMD18-SlADH3和pRI101,通过琼脂糖凝胶电泳分离已切开的载体和插入片段,分别回收pMD18- SlADH3被切割后产生的SlADH3基因的cDNA片段和pRI101被切割后产生的载体片段,然后用宝生物(TaKaRa)的T4 DNA连接酶连接pRI101和SlADH3基因的cDNA片断产生植物表达载体pRI101-GFP-SlADH3(图2)。用连接反应混合物转化高效率(108)的大肠杆菌感受态细胞(DH5α,购自天根生化科技公司),把转化好的大肠杆菌涂于加有卡那霉素(Kan,50 μg/mL)的平板上,于37℃过夜培养,筛选Kan抗性重组子菌落,从Kan抗性重组子菌落中提取质粒,筛选连接成功的质粒载体pRI101-SlADH3。以质粒为模板,利用SlADH3基因上下游引物进行PCR扩增,扩增结果得到约1140bp左右的条带。用SalI和KpnI双酶切检测,连接成功的质粒在琼脂糖凝胶电泳图上只产生两条带,分别为约10kb和1140bp。确认是连接成功的质粒后,重新转化大肠杆菌DH5α,挑单个菌落进行液体培养,用试剂盒纯化质粒pRI101-GFP-SlADH3。
实施例3:用pRI101-GFP-SlADH3植物表达载体转化农杆菌
制备农杆菌的感受态细胞,用电脉冲法将上述构建好的植物表达载体pRI101-GFP-SlADH3转入农杆菌(Agrobacterium tumefaciens)LBA4404中,在加有卡那霉素的平板上筛选转化子。取少量质粒加入农杆菌感受态细胞中,轻轻混匀;将混合物加入到预冷的电转化杯中,轻轻敲击杯身使混和液落至杯底;将电转化杯置于电转化仪(BIO-RAD)滑槽中,用1 mm的电击杯和200欧姆,2.5kV/0.2cm的参数进行电击,电击后立即取出电转化杯, 迅速加入0.5mL LB培养基,混匀,转移到1.5 mL的离心管中;28℃, 200 rpm摇床培养3-5h;室温下,7500 rpm离心1 min,弃大部分上清,保留100 μl将细胞悬浮;把农杆菌涂布于有卡纳霉素(Kan,100 μg/mL)的LB固体培养基上,28℃培养2天获得单菌落;首先用牙签挑取农杆菌菌落放入20 μl ddH2O中,98℃处理5分钟后取出10 μl农杆菌裂解液作为PCR反应的模板。PCR检测pRI101-GFP-SlADH3转化结果,正对照扩增体系模板使用pRI101-GFP-SlADH3质粒,扩增片断理论长度约为1140bp,PCR产物经电泳分析显示其片段大小与理论预测值相符,表明质粒已转入农杆菌。
实施例4:用含有SlADH3的植物表达载体的农杆菌转化烟草
挑取携带有质粒pRI101-GFP-SlADH3的农杆菌单菌落接种于50 mL的LB培养基中(含Kan,100 μg/mL),180 rpm,28℃培养24 h,待菌液OD600至1.0左右,离心10 min(3000 rpm),沉淀菌体。再用10 mL左右的MS液体培养基悬浮,离心10 min(3000 rpm),沉淀菌体。重复以上操作2~3次。最后加入一定体积的MS液体培养基重悬浮,使菌体的OD600值为0.5。准备烟草(Nicotiana tabacum cv.NC89)的无菌苗,通过农杆菌介导,用叶盘法转化烟草,然后通过组织培养获得小苗,进一步筛选获得所需的转基因植物。把无菌烟草的叶片切成小片叶盘,在制备好的农杆菌菌液中浸染15~20 min,用无菌吸水纸吸干后,平铺于愈伤组织诱导培养基MS1(MS+NAA02.1μg/mL+BA 0.02μg/mL)上黑暗共培养2天,将外植体转移至含卡那霉素(50 μg/mL)的芽诱导培养基MS4(MS+NAA0.53 μg/mL+BA 0.5 μg/mL)上进行芽的诱导,约15天继代一次。待有芽生成后,转入卡那霉素(50μg/mL)的MS培养基上进行根的诱导。
实施例5:SlADH3基因在转基因烟草中插入情况及表达水平的检测
为了确认通过卡那霉素筛选的转基因烟草株系确实含有导入的目的基因DNA片段,用PCR方法对筛选到的转基因烟草作进一步的鉴定。
首先采用CTAB法提取植物基因组:称取植物叶片100mg左右置于1.5mL离心管中,加液氮用特制研棒研磨至粉末状;加入900μl预热到65℃的2×CTAB缓冲液(Tris-HCl pH 7.5 100mM,EDTA 20mM,NaCl 1.4M,CTAB 2%),65℃度水浴加热20分钟后取出冷却;加入500μl氯仿-异戊醇混合液(24:1)摇匀,4℃离心10min(7500rpm)后转移上清至1.5mL EP管;再次加入500μl氯仿-异戊醇混合液(24:1)摇匀,4℃离心10min(7500rpm);取出上清置于新的EP管中,加入1/10体积3M pH5.2 醋酸钠和等体积异丙醇,摇匀后4℃离心20min(12000rpm);弃上清,用75%乙醇清洗两次后,干燥,用含RNase的TE缓冲液溶解并降解RNA,获得的基因组DNA样品。以转ADH3烟草抗性苗基因组作为模板,用ADH3基因上下游引物进行PCR扩增检测SlADH3是否插入烟草基因组。扩增产物大小约为1140bp左右,和预期推测一致,说明目的基因均已插入这些转基因株系的基因组(图3A)。
为了检测目的基因是否在转基因烟草中翻译成蛋白,提取野草的蛋白,利用western blot分析蛋白的表达水平,野生型烟草中没有目的蛋白的表达,而转基因烟草中有目的蛋白,结果表明基因SlADH3编码蛋白已经翻译(图3B)。
为了检测目的基因ADH3编码的蛋白在烟草中是否提高了转基因植株的S-亚硝基谷胱甘肽还原酶的活性,选取经western blot检测正确的转基因株系的嫩叶,测定转基因植株和野生型植株的S-亚硝基谷胱甘肽还原酶活性,测定结果显示转基因植株的SlADH3比活力明显高于野生型植株,说明SlADH3编码的蛋白在烟草中已成功表达并发挥作用(图4)。
实施例6:转基因烟草种子萌发期的非生物胁迫抗性检测
选取经过western blot筛选的#4,#5,#6转基因株系的T2代种子,用70%酒精消毒5分钟,再用0.7%NaClO消毒20分钟,用灭菌水冲洗5-6遍。然后将种子播种到添加100 mM的硝酸盐(硝酸钾和硝酸钙提供等摩尔的硝酸根)、100 mM NaCl和150 mM甘露醇的MS培养基中,以MS培养基为对照。每个株系播种50粒/皿,每个处理三次重复。每天统计发芽数,第12天发芽结束时照相,计算发芽率。在MS培养基中,SlADH3转基因株系的种子和野生型烟草(WT)的种子的发芽率没有差异,都达到了100%(图5、6、7中的图A和图C)。在硝酸盐、NaCl和甘露醇处理下,转基因烟草种子的发芽时间早于野生型烟草,并且发芽率都高于野生型烟草。硝酸盐处理第5天时,转基因株系#4、#5、#6的发芽率分别为88%,92%,92%,而WT为40%。NaCl处理第5天时,转基因株系#4、#5、#6的发芽率为82%,88%,82%,而WT为36%。干旱胁迫在第5天时,转基因株系#4、#5、#6的发芽率为92%,92%,94%,而WT为70%(图5、6、7中的图B和图D)。实验结果表明SlADH3基因的转基因烟草对硝酸盐、NaCl和干旱胁迫的抗性增强。
本发明为增强植物对非生物胁迫的抗性提供了一种新的方法,通过基因工程手段培育抗性植物能克服传统育种的不足,不仅育种周期短,而且操作简单,容易获得高抗材料。本发明来自番茄的SlADH3基因能增强植物对非生物的抗性,将该基因导入烟草、水稻、康乃馨、洋桔梗等植物中,可以产生具有非生物胁迫抗性的种质和品种。利用基因工程技术防治非生物胁迫具有明显的优势和不可取代的重要性。它可以为作物、花卉等大规模生产提供方便,为农业生产节约成本且提高管理水平,因此本发明具有广阔的市场应用前景。
本发明通过功能基因组学相关技术证实SlADH3基因具有提高植物抗非生物胁迫的功能。将SlADH3基因构建到植物表达载体上并转入烟草中过量表达,转基因烟草具有很强的对硝酸盐、NaCl、干旱胁迫等非生物胁迫的抗性。
序列表
<110> 昆明理工大学
<120> 番茄S-亚硝基谷胱甘肽还原酶基因的新用途
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 26
<212> DNA
<213> 人工序列
<400> 1
gtcgacatgg ctacacaagg tcaagt 26
<210> 2
<211> 27
<212> DNA
<213> 人工序列
<400> 1
ggtacctcat acaaacatat ccaggac 27
- 还没有人留言评论。精彩留言会获得点赞!