DNA测序方法与流程
本发明涉及生物
技术领域:
,具体涉及一种DNA测序方法。
背景技术:
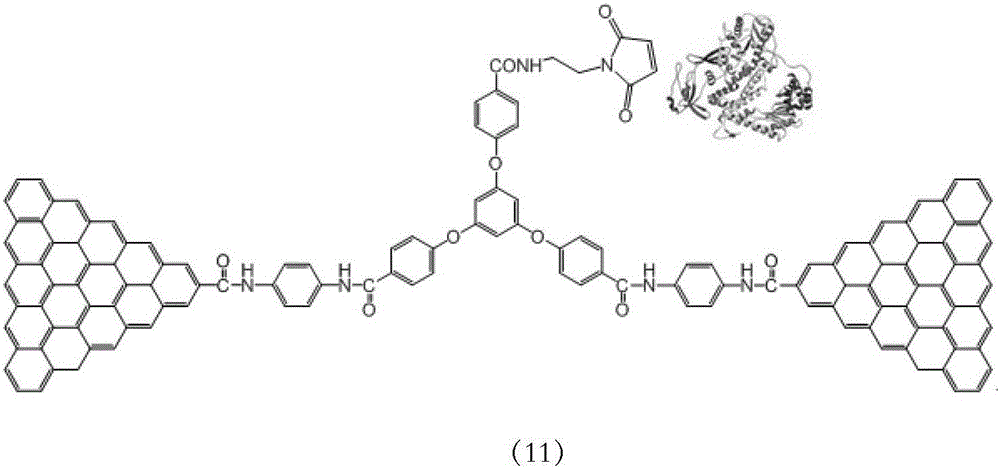
:DNA是遗传信息的载体,其内四种碱基对的特定排列顺序是遗传信息的本质所在。确定DNA中碱基对的特定排列顺序被称为DNA测序,其对于揭示生命奥秘、控制遗传过程、推动疾病诊断、提升医疗技术有着根本的促进作用。迄今为止,先后已经有两代测序技术被成功研发并得到广泛应用:第一代基于双脱氧链终止法的测序技术打开了人类揭示遗传奥秘的大门,奠定了基因工程最为重要的基础;第二代大规模平行合成荧光检测法,则是在第一代测序技术的基础上,利用PCR扩增及荧光检测技术,该方法在很大程度上提高了测序的效率,为第一个人类基因组测序的完成做出了巨大贡献。尽管前两代测序技术发展的很成熟,但是仍旧有许多弊端亟待解决,如PCR扩增耗时长成本高,荧光标记及检测过程复杂不稳定等等。同时,随着人类对生命本质的理解加深和医学领域技术手段的不断进步,个性化治疗方案及分子诊断逐渐成为热点,这对DNA测序提出了更高的要求。因此,如何快速、准确、低成本进行DNA测序已经成为炙手可热的研究领域。目前相对成熟的DNA测序技术是基于纳米孔的电学测试平台,甚至已经有商业化测试仪原型出现,但还存在诸多缺陷,如DNA移动速度难以控制、测序信号分辨率低、测序不准确等等,使基于此方法的测序技术的发展陷入瓶颈。随着各种新型纳米材料的不断涌现,以及微纳加工技术的不断升级进步,具有单分子检测能力的器件平台迅猛发展,为DNA测序的持续推进提供源源不断的动力和机会。技术实现要素:本发明所要解决的技术问题是如何进行DNA测序。为解决上述问题,本发明首先提供了DNA测序方法。本发明所提供的DNA测序方法具体可为方法一,依次可包括如下步骤:(1)在待测DNA的3’末端增加标签序列,形成含有标签序列的待测DNA;所述标签序列的核苷酸序列与测序引物的核苷酸序列反向互补;(2)将所述含有标签序列的待测DNA和所述测序引物混合,形成5’末端双链主体单链形式的产物;(3)完成步骤(2)后,将产物分别与dATP、dCTP、dTTP和dGTP混合,得到四个体系,分别将每个体系加入特异DNA聚合酶修饰的单分子器件,读取电信号,与其它三个体系的电信号显著不同的体系中的dNTP即为a1)或a2):a1)所述待测DNA的3’末端的第一个核苷酸;a2)所述待测DNA的3’末端的第一区段的核苷酸;所述第一区段由N个核苷酸组成,N为自然数且大于等于2。本发明所提供的DNA测序方法具体可为方法二,依次可包括如下步骤:(1)在待测DNA的3’末端增加标签序列,形成含有标签序列的待测DNA;所述标签序列的核苷酸序列与测序引物的核苷酸序列反向互补;(2)将所述含有标签序列的待测DNA和所述测序引物混合,形成5’末端双链主体单链形式的产物;(3)完成步骤(2)后,将产物分别与dATP、dCTP、dTTP和dGTP混合,得到四个体系,分别将每个体系加入特异DNA聚合酶修饰的单分子器件,读取电信号,与其它三个体系的电信号显著不同的体系中的dNTP即为a1)或a2):a1)所述待测DNA的3’末端的第一个核苷酸;a2)所述待测DNA的3’末端的第一区段的核苷酸;所述第一区段由N个核苷酸组成,N为自然数且大于等于2;(4)将前一步骤中与其它三个体系的电信号显著不同的体系的产物分别与dATP、dCTP、dTTP和dGTP混合,得到四个体系,分别将每个体系加入所述特异DNA聚合酶修饰的单分子器件,读取电信号,与其它三个体系的电信号显著不同的体系中的dNTP即为b1)或b2):b1)所述待测DNA的3’末端的第二个核苷酸;b2)所述待测DNA的3’末端的第二区段的核苷酸;所述第二区段由M个核苷酸组成,M为自然数且大于等于2。本发明所提供的DNA测序方法具体可为方法三,依次可包括如下步骤:(1)在待测DNA的3’末端增加标签序列,形成含有标签序列的待测DNA;所述标签序列的核苷酸序列与测序引物的核苷酸序列反向互补;(2)将所述含有标签序列的待测DNA和所述测序引物混合,形成5’末端双链主体单链形式的产物;(3)完成步骤(2)后,将产物分别与dATP、dCTP、dTTP和dGTP混合,得到四个体系,分别将每个体系加入特异DNA聚合酶修饰的单分子器件,读取电信号,与其它三个体系的电信号显著不同的体系中的dNTP即为a1)或a2):a1)所述待测DNA的3’末端的第一个核苷酸;a2)所述待测DNA的3’末端的第一区段的核苷酸;所述第一区段由N个核苷酸组成,N为自然数且大于等于2;(4)将前一步骤中与其它三个体系的电信号显著不同的体系的产物分别与dATP、dCTP、dTTP和dGTP混合,得到四个体系,分别将每个体系加入所述特异DNA聚合酶修饰的单分子器件,读取电信号,与其它三个体系的电信号显著不同的体系中的dNTP即为b1)或b2):b1)所述待测DNA的3’末端的第二个核苷酸;b2)所述待测DNA的3’末端的第二区段的核苷酸;所述第二区段由M个核苷酸组成,M为自然数且大于等于2;(5)重复步骤(4),直至获得所述待测DNA的测序结果。上述DNA测序方法中,所述a2)中,N具体可为50。上述DNA测序方法中,所述b2)中,M具体可为50。上述DNA测序方法中,所述待测DNA为单链DNA。当待测DNA为双链DNA时,需先变性,再和所述测序引物混合。上述DNA测序方法中,所述测序引物的核苷酸序列可如序列表中序列4自5’末端起第51至68位所示。上述DNA测序方法中,所述单分子器件可为以低维纳米材料或单个分子为传感核心的超灵敏电学测序器件。所述单分子器件可以是现有技术中任何能响应单分子变化的器件,即本领域技术人员通过检测或观察该单分子器件的变化,便能知晓相应的分子是否发生变化。以本发明为例,本发明使用了单分子器件,具体使用了以石墨烯或硅纳米线作为电极的单分子器件,并使其与所述特异DNA聚合酶连接,本领域技术人员通过检测该单分子器件的电流变化,就可知晓所述特异DNA聚合酶的构象是否发生了变化。上述DNA测序方法中,所述单分子器件具体可为c1)或c2)或c3)或c4):c1)石墨烯基单分子器件;c2)硅纳米线单分子器件;c3)一维纳米材料单分子器件;c4)低维纳米材料单分子器件。所述石墨烯基单分子器件和所述硅纳米线单分子器件的制备过程均可参考文献(CaoY,DongS,LiuS,HeL,GanL,YuX,SteigerwaldML,WuX,LiuZ,GuoX.Buildinghigh-throughputmolecularjunctionsusingindentedgraphenepointcontacts.AngewChemIntEdEngl.2012Dec3;51(49):12228—32.)中记载的方法。所述特异DNA聚合酶和所述单分子器件的连接方式,可以采用本领域技术人员公知公用的任何方式,只要保证所述特异DNA聚合酶的活性和构象变化即可。所述特异DNA聚合酶和所述石墨烯基单分子器件的连接方式具体可按照下述步骤进行:(1)制备所述石墨烯基单分子器件;(2)将所述石墨烯基单分子器件和对苯二胺混合,得到末端被氨基修饰的石墨烯电极;(3)将1,3,5-tris(4-carbonylphenyloxy)benzene和所述末端被氨基修饰的石墨烯电极混合,得到电学回路;(4)将所述电学回路和N-羟基琥珀酰亚胺磺酸钠盐混合,得到Sulfo-NHS活化的电学回路;(5)将所述Sulfo-NHS活化的电学回路和N-(2-氨乙基)马来酰亚胺盐酸盐混合,得到处理后的石墨烯基单分子器件;(6)将所述处理后的石墨烯基单分子器件和过量的所述特异DNA聚合酶混合,得到特异DNA聚合酶修饰的石墨烯基单分子器件。所述特异DNA聚合酶和所述硅纳米线单分子器件的连接方式具体可按照下述步骤进行:(1)制备所述硅纳米线单分子器件;(2)将所述硅纳米线单分子器件和HF溶液混合,得到刻蚀的硅纳米线单分子器件;所述HF溶液由7体积份的40%(质量百分比)的NH4F水溶液和1体积份的HF水溶液混合而成,其中HF水溶液的浓度为40%(质量百分比),具体可为北京化工厂的产品。(3)将所述刻蚀的硅纳米线单分子器件和10—十一碳炔酸混合,得到电学回路;(4)将步骤(3)所述电学回路和N-羟基琥珀酰亚胺磺酸钠盐混合,得到Sulfo-NHS活化的电学回路;(5)将步骤(4)所述Sulfo-NHS活化的电学回路和N-(2-氨乙基)马来酰亚胺盐酸盐混合,得到处理后的硅纳米线单分子器件;(6)将所述处理后的硅纳米线单分子器件和过量的所述特异DNA聚合酶混合,得到酶修饰的硅纳米线单分子器件。上述DNA测序方法中,所述特异DNA聚合酶满足如下条件:(1)具有DNA聚合酶的生物活性;(2)与所述单分子器件进行连接且仅有一个连接位点,提供该连接位点的氨基酸残基位于所述特异DNA聚合酶的构象变化区;(3)提供该连接位点的氨基酸残基在所述特异DNA聚合酶中仅出现一次。所述“与所述单分子器件进行连接且仅有一个连接位点,提供该连接位点的氨基酸残基位于所述特异DNA聚合酶的构象变化区”指的是只有一个氨基酸残基与单分子器件连接,且不影响所述特异DNA聚合酶的构象变化。所述“提供该连接位点的氨基酸残基在所述特异DNA聚合酶中仅出现一次”指的是:为了保证只有唯一一个连接位点,若所述特异DNA聚合酶中除了该连接位点外,在其它位置还有与该连接位点一致的氨基酸或氨基酸序列,则需将其它位置的氨基酸或氨基酸序列进行修饰或突变,以防止其它位置的氨基酸或氨基酸序列与单分子器件连接。如果所述特异DNA聚合酶中,除了该唯一连接位点外,其余位置没有与该唯一连接位点一致的氨基酸或氨基酸序列,则无需将其它位置的氨基酸或氨基酸序列进行修饰或突变。所述修饰或突变指的是在不改变所述特异DNA聚合酶活性和构象变化的情况下,结合本领域技术人员的常规知识,进行的修饰或突变,如本发明中,将序列表中序列1所示的氨基酸序列自N末端起第907位的半胱氨酸残基替换为丝氨酸残基。所述DNA聚合酶可为大肠杆菌DNA聚合酶Ⅰ。大肠杆菌DNA聚合酶Ⅰ的氨基酸序列可如序列表中序列1所示,其核苷酸序列如序列表中序列2所示。上述DNA测序方法中,所述特异DNA聚合酶可用微腔包被。所述微腔的材质可为聚二甲基硅氧烷。每一个特异DNA聚合酶用一个所述微腔包被。上述DNA测序方法中,所述特异DNA聚合酶可为b1)或b2)或b3):b1)氨基酸序列是序列表中序列3所示的蛋白质;b2)将序列表中序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质;b3)将序列表中序列1所示的氨基酸序列自N末端起第907位的半胱氨酸残基替换为非半胱氨酸残基,第790位的亮氨酸残基变为半胱氨酸残基,得到的蛋白质。所述b3)具体可为将序列表中序列1所示的氨基酸序列自N末端起第907位的半胱氨酸残基替换为丝氨酸残基,第790位的亮氨酸残基变为半胱氨酸残基,得到的蛋白质。所述特异DNA聚合酶与所述单分子器件的连接时,所述特异DNA聚合酶的连接位点为序列表中序列1所示的氨基酸序列自N末端起第790位的半胱氨酸。上述DNA测序方法中,所述读取电信号是通过检测所述特异DNA聚合酶的构象变化进行的。所述特异DNA聚合酶也属于本发明的保护范围。上述DNA测序方法中,所述待测DNA为5’-CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCC-3’、5’-AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA-3’、5’-GGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGG-3’或5’-TTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTT-3’。为解决上述技术问题,本发明还提供了用于DNA测序的试剂盒。本发明所提供的DNA测序的试剂盒,具体可为试剂盒甲,所述试剂盒甲可包括上述任一所述特异DNA聚合酶。上述试剂盒甲中,还可包括所述测序引物。上述试剂盒甲中,还可包括上述任一所述单分子器件。上述试剂盒甲中,还可包括记载有上述任一所述DNA测序方法的载体。本发明所提供的DNA测序的试剂盒,具体可为试剂盒乙,所述试剂盒乙可包括上述任一所述特异DNA聚合酶修饰的单分子器件。上述试剂盒乙中,还可包括所述测序引物。上述试剂盒乙中,还可包括记载有上述任一所述DNA测序方法的载体。实验证明,本发明所提供的方法可进行DNA测序,测序结果显示,DNA的合成速度与已有文献(TivoliJ.Olsen,YongkiChoi,PatrickC.Sims,O.TolgaGul,BradL.Corso,ChengjunDong,WilliamA.Brown,PhilipG.CollinsandGregoryA.Weiss,ElectronicMeasurementsofSingle-MoleculeProcessingbyDNAPolymeraseI(KlenowFragment),JournaloftheAmericanChemicalSociety2013,135,7855-7860)记载的合成速度基本一致。本发明所提供的DNA测序方法具有重要的应用价值。附图说明图1为酶修饰的石墨烯基单分子器件的制备。图2为低分辨探针台检测电学性质;其中Vsd为源漏偏压,Isd为源漏电流。图3为酶修饰的石墨烯基单分子器件和酶修饰的硅纳米线单分子器件。图4为半胱氨酸和处理后的石墨烯基单分子器件进行化学反应的反应式。图5为采用酶修饰的石墨烯基单分子器件对模板链C进行DNA测序的动力学数据和峰值统计结果。图6为采用酶修饰的石墨烯基单分子器件对模板链C进行DNA测序的高态时间和低态时间的统计分析结果。图7为采用酶修饰的石墨烯基单分子器件对模板链A进行DNA测序的动力学数据和峰值统计结果。图8为采用酶修饰的石墨烯基单分子器件对模板链A进行DNA测序的高态时间和低态时间的统计分析结果。图9为采用酶修饰的石墨烯基单分子器件对模板链G进行DNA测序的动力学数据和峰值统计结果。图10为采用酶修饰的石墨烯基单分子器件对模板链G进行DNA测序的高态时间和低态时间的统计分析结果。图11为采用酶修饰的石墨烯基单分子器件对模板链T进行DNA测序的动力学数据和峰值统计结果。图12为采用酶修饰的石墨烯基单分子器件对模板链T进行DNA测序的高态时间和低态时间的统计分析结果。图13为酶修饰的硅纳米线单分子器件的制备。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。DTT缓冲液为含50mMNaCl、10mMMgCl2和1mMDTT的pH7.8、10mMTris-HCl缓冲液。HF溶液:由7体积份的40%(质量百分比)的NH4F水溶液和1体积份的HF水溶液混合而成;其中HF水溶液的浓度为40%(质量百分比),具体可为北京化工厂的产品。单链DNA分子甲:5’-(C)50ACTGGCCGTCGTTTTACA-3’(序列表中序列4所示)。单链DNA分子乙:5’-TGTAAAACGACGGCCAGT-3’(序列表中序列5所示)。单链DNA分子丙:5’-(A)50ACTGGCCGTCGTTTTACA-3’(序列表中序列6所示)。单链DNA分子丁:5’-(G)50ACTGGCCGTCGTTTTACA-3’(序列表中序列7所示)。单链DNA分子戊:5’-(T)50ACTGGCCGTCGTTTTACA-3’(序列表中序列8所示)。模板链C的制备方法为:人工合成单链DNA分子甲和单链DNA分子乙,然后将10μL单链DNA分子甲(单链DNA分子甲的浓度为10μM)、10μL单链DNA分子乙(单链DNA分子乙的浓度为10μM)和980μLDTT缓冲液混合,70℃加热1h,自然冷却至室温,即获得模板链C。模板链C需在动力学测试前3h制备。模板链A的制备方法为:人工合成单链DNA分子丙和单链DNA分子乙,然后将10μL单链DNA分子丙(单链DNA分子丙的浓度为10μM)、10μL单链DNA分子乙(单链DNA分子乙的浓度为10μM)和980μLDTT缓冲液混合,70℃加热1h,自然冷却至室温,即获得模板链A。模板链A需在动力学测试前3h制备。模板链G的制备方法为:人工合成单链DNA分子丁和单链DNA分子乙,然后将10μL单链DNA分子丁(单链DNA分子丁的浓度为10μM)、10μL单链DNA分子乙(单链DNA分子乙的浓度为10μM)和980μLDTT缓冲液混合,70℃加热1h,自然冷却至室温,即获得模板链G。模板链G需在动力学测试前3h制备。模板链T的制备方法为:人工合成单链DNA分子戊和单链DNA分子乙,然后将10μL单链DNA分子戊(单链DNA分子戊的浓度为10μM)、10μL单链DNA分子乙(单链DNA分子乙的浓度为10μM)和980μLDTT缓冲液混合,70℃加热1h,自然冷却至室温,即获得模板链T。模板链T需在动力学测试前3h制备。低分辨探针台由半导体参数仪(安捷伦公司的产品,型号为4155C)和探针台(KarlSuess公司的产品,型号为PM5)两个部分组成。高分辨探针台由前置放大器(DigitalInstruments公司的产品,型号为DL1211)和锁相放大器(ZurichInstruments公司的产品,型号为HF2LI)两个核心部件组成。1,3,5-tris(4-carbonylphenyloxy)benzene为济南恒化科技有限公司的产品。dATP溶液由DTT缓冲液溶解dATP获得。dCTP溶液由DTT缓冲液溶解dCTP获得。dTTP溶液由DTT缓冲液溶解dTTP获得。dGTP溶液由DTT缓冲液溶解dGTP获得。dATP、dCTP、dTTP和dGTP均为北京赛百盛基因技术有限公司的产品。实施例1、采用石墨烯基单分子器件进行DNA测序一、酶修饰的石墨烯基单分子器件的制备1、制备石墨烯基单分子器件石墨烯基单分子器件的制备过程参考如下文献:CaoY,DongS,LiuS,HeL,GanL,YuX,SteigerwaldML,WuX,LiuZ,GuoX.Buildinghigh-throughputmolecularjunctionsusingindentedgraphenepointcontacts.AngewChemIntEdEngl.2012Dec3;51(49):12228—32.石墨烯基单分子器件上具有纳米间隙的石墨烯电极(以下简称石墨烯电极,其结构式如图1中(1))。2、末端氨基修饰完成步骤1后,将所述石墨烯基单分子器件和对苯二胺(见图1中(2))混合,得到末端被氨基修饰的石墨烯电极。末端被氨基修饰的石墨烯电极的结构式见图1中(3)。3、电学回路的构建完成步骤2后,将1,3,5-tris(4-carbonylphenyloxy)benzene(见图1中(4))和末端被氨基修饰的石墨烯电极混合,得到电学回路。用低分辨探针台检测电学回路的电学性质,结果见图2中左上图。电学回路的部分结构式如图1中(5)所示。4、NHS活化完成步骤3后,将电学回路和N-羟基琥珀酰亚胺磺酸钠盐(见图1中(6))混合,得到Sulfo-NHS活化的电学回路。用低分辨探针台检测Sulfo-NHS活化的电学回路的电学性质,结果见图2中右上图。NHS活化的电学回路的部分结构式如图1中(7)所示。5、处理后的石墨烯基单分子器件的获得完成步骤4后,将Sulfo-NHS活化的电学回路和N-(2-氨乙基)马来酰亚胺盐酸盐(见图1中(8))混合,得到处理后的石墨烯基单分子器件。处理后的石墨烯基单分子器件的部分结构式如图1中(9)所示。用低分辨探针台检测处理后的石墨烯基单分子器件的电学性质,结果见图2中左下图。6、大肠杆菌DNA聚合酶Ⅰ的改造(1)改造原则大肠杆菌DNA聚合酶Ⅰ(以下简称DNA聚合酶Ⅰ)的氨基酸序列如序列表中序列1所示,核苷酸序列如序列表中序列2所示。改造后的DNA聚合酶Ⅰ需同时具有如下特点:(1)具有DNA聚合酶Ⅰ的生物活性,即指导DNA的合成;(2)改造后的DNA聚合酶Ⅰ可与处理后的石墨烯基单分子器件进行连接且仅有一个连接位点,提供该连接位点的氨基酸残基(命名为供体氨基酸残基)应位于改造后的DNA聚合酶Ⅰ的构象变化区(目的为提高后续DNA测序的灵敏度);(3)供体氨基酸残基对应的氨基酸和非提供连接位点的氨基酸残基(命名为非供体氨基酸残基)对应的氨基酸种类不同。(2)改造后的DNA聚合酶Ⅰ的获得经过大量实验,得到改造后的DNA聚合酶Ⅰ。改造后的DNA聚合酶Ⅰ(氨基酸序列如序列表中序列3所示),由生工生物工程(上海)股份有限公司制备。改造后的DNA聚合酶Ⅰ为将DNA聚合酶Ⅰ(氨基酸序列如序列表中序列1所示)自N末端起第907位的半胱氨酸残基变为丝氨酸残基,第790位的亮氨酸残基变为半胱氨酸残基。序列表中序列3自N末端起第790位氨基酸残基位于构象变化区。7、酶修饰的石墨烯基单分子器件的制备完成步骤6后,将处理后的石墨烯基单分子器件和过量的改造后的DNA聚合酶Ⅰ(见图1中(10))混合,得到酶修饰的石墨烯基单分子器件(图3中左图),酶修饰的石墨烯基单分子器件的部分结构式见图1中(11)。用低分辨探针台检测酶修饰的石墨烯基单分子器件的电学性质,结果见图2中右下图。改造后的DNA聚合酶Ⅰ中半胱氨酸和处理后的石墨烯基单分子器件进行化学反应的反应式见图4。将制备的酶修饰的石墨烯基单分子器件置于低分辨探针台,观察导电性,若具有导电性,则进行下述实验。二、采用酶修饰的石墨烯基单分子器件对模板链C进行DNA测序1、取酶修饰的石墨烯基单分子器件,将改造后的DNA聚合酶Ⅰ的区域用体积为40μL的微腔进行包被,微腔的材质为聚二甲基硅氧烷(polydimethylsiloxane,PDMS),得到含有微腔的石墨烯基单分子器件。2、完成步骤1后,将含有微腔的石墨烯基单分子器件置于高分辨探针台,采样5min,进行动力学测试(即测试源漏电流随时间的变化情况),实验结果见图5中A的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图5中A的右图。3、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入10μLDTT缓冲液,采样5min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图5中B的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图5中B的右图。4、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链C的DTT缓冲液,采样5min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图5中C的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图5中C的右图。5、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链C的DTT缓冲液、5μL的dATP溶液(浓度为5μM)、5μL的dTTP溶液(浓度为5μM)和5μL的dCTP溶液(浓度为5μM),采样10min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图5中D的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图5中D的右图。6、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链C的DTT缓冲液和5μL的dGTP溶液(浓度为5μM),采样10min,测试聚合酶在进行DNA合成时源漏电流随时间的变化情况,亦即DNA聚合酶进行DNA聚合时的动力学数据。实验结果见图5中E的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图5中E的右图。结果表明,步骤6中的动力学数据与其它对照实验中的动力学数据在表观上有本质区别,即当体系中存在与模板链C以及与之匹配的脱氧核苷酸时,体系的动力学数据才能与其余四组对照实验不同。7、将步骤6获得的动力学数据拉展,采用Qub软件选定相应的高态电流(即大电流)及低态电流(即小电流)(图6中A)。将高态电流对应的高态时间(τhi)和低态电流对应的低态时间(τlow)进行统计分析,实验结果分别见图6中B和C。根据平均低态时间和平均高态时间,计算得到本体系中DNA的合成速度是每秒62.62个dGTP核苷酸(见表1),与已有的文献(TivoliJ.Olsen,YongkiChoi,PatrickC.Sims,O.TolgaGul,BradL.Corso,ChengjunDong,WilliamA.Brown,PhilipG.CollinsandGregoryA.Weiss,ElectronicMeasurementsofSingle-MoleculeProcessingbyDNAPolymeraseI(KlenowFragment),JournaloftheAmericanChemicalSociety2013,135,7855-7860)记载的合成速度基本一致。值得说明的是,这里提及的平均,并不是简单意义上的线性平均,而是在指数分布基础上的泊松平均,具体的计算过程,由MatLab软件进行。表1模板链C模板链G模板链T模板链Aτlow(ms)0.1560.1220.7102.825τhi(ms)15.8136.8233.5853.575合成速度(个/秒)62.62143.99232.83156.25三、采用酶修饰的石墨烯基单分子器件对模板链A进行DNA测序1、同步骤二中1。2、同步骤二中2。动力学测试的实验结果见图7中A的左图。峰值统计的实验结果见图7中A的右图。3、同步骤二中3。动力学测试的实验结果见图7中B的左图。峰值统计的实验结果见图7中B的右图。4、同步骤二中4的方法,仅将模板链C替换为模板链A。动力学测试的实验结果见图7中C的左图。峰值统计的实验结果见图7中C的右图。5、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链A的DTT缓冲液、5μL的dATP溶液(浓度为5μM)、5μL的dGTP溶液(浓度为5μM)和5μL的dCTP溶液(浓度为5μM),采样10min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图7中D的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图7中D的右图。6、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链A的DTT缓冲液和5μL的dTTP溶液(浓度为5μM),采样10min,测试聚合酶在进行DNA合成时源漏电流随时间的变化情况,亦即DNA聚合酶进行DNA聚合时的动力学数据。实验结果见图7中E的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图7中E的右图。结果表明,步骤6中的动力学数据与其它对照实验中的动力学数据在表观上有本质区别,即当体系中存在与模板链A以及与之匹配的脱氧核苷酸时,体系的动力学数据才能与其余四组对照实验不同。7、按照步骤二中7的方法,将高态电流对应的高态时间(τhi)和低态电流对应的低态时间(τlow)进行统计分析,实验结果见图8(左图为低态时间,右图为高态时间)。根据平均低态时间和平均高态时间,计算得到本体系中DNA的合成速度是每秒156.25个dTTP核苷酸(见表1),与已有的文献(TivoliJ.Olsen,YongkiChoi,PatrickC.Sims,O.TolgaGul,BradL.Corso,ChengjunDong,WilliamA.Brown,PhilipG.CollinsandGregoryA.Weiss,ElectronicMeasurementsofSingle-MoleculeProcessingbyDNAPolymeraseI(KlenowFragment),JournaloftheAmericanChemicalSociety2013,135,7855-7860)记载的合成速度基本一致。四、采用酶修饰的石墨烯基单分子器件对模板链G进行DNA测序1、同步骤二中1。2、同步骤二中2。动力学测试的实验结果见图9中A的左图。峰值统计的实验结果见图9中A的右图。3、同步骤二中3。动力学测试的实验结果见图9中B的左图。峰值统计的实验结果见图9中B的右图。4、同步骤二中4的方法,仅将模板链C替换为模板链G。动力学测试的实验结果见图9中C的左图。峰值统计的实验结果见图9中C的右图。5、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链G的DTT缓冲液、5μL的dATP溶液(浓度为5μM)、5μL的dGTP溶液(浓度为5μM)和5μL的dTTP溶液(浓度为5μM),采样10min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图9中D的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图9中D的右图。6、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链G的DTT缓冲液和5μL的dCTP溶液(浓度为5μM),采样10min,测试聚合酶在进行DNA合成时源漏电流随时间的变化情况,亦即DNA聚合酶进行DNA聚合时的动力学数据。实验结果见图9中E的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图9中E的右图。结果表明,步骤6中的动力学数据与其它对照实验中的动力学数据在表观上有本质区别,即当体系中存在与模板链G以及与之匹配的脱氧核苷酸时,体系的动力学数据才能与其余四组对照实验不同。7、按照步骤二中7的方法,将高态电流对应的高态时间(τhi)和低态电流对应的低态时间(τlow)进行统计分析,实验结果见图10(左图为低态时间,右图为高态时间)。根据平均低态时间和平均高态时间,计算得到本体系中DNA的合成速度是每秒143.99个dCTP核苷酸(见表1),与已有的文献(TivoliJ.Olsen,YongkiChoi,PatrickC.Sims,O.TolgaGul,BradL.Corso,ChengjunDong,WilliamA.Brown,PhilipG.CollinsandGregoryA.Weiss,ElectronicMeasurementsofSingle-MoleculeProcessingbyDNAPolymeraseI(KlenowFragment),JournaloftheAmericanChemicalSociety2013,135,7855-7860)记载的合成速度基本一致。五、采用酶修饰的石墨烯基单分子器件对模板链T进行DNA测序1、同步骤二中1。2、同步骤二中2。动力学测试的实验结果见图11中A的左图。峰值统计的实验结果见图11中A的右图。3、同步骤二中3。动力学测试的实验结果见图11中B的左图。峰值统计的实验结果见图11中B的右图。4、同步骤二中4的方法,仅将模板链C替换为模板链T。动力学测试的实验结果见图11中C的左图。峰值统计的实验结果见图11中C的右图。5、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链T的DTT缓冲液、5μL的dCTP溶液(浓度为5μM)、5μL的dGTP溶液(浓度为5μM)和5μL的dTTP溶液(浓度为5μM),采样10min,进行动力学测试(即测试源漏电流随时间的变化情况)。实验结果见图11中D的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图11中D的右图。6、完成步骤1后,向含有微腔的石墨烯基单分子器件的微腔中加入30μL含100nM模板链T的DTT缓冲液和5μL的dATP溶液(浓度为5μM),采样10min,测试聚合酶在进行DNA合成时源漏电流随时间的变化情况,亦即DNA聚合酶进行DNA聚合时的动力学数据。实验结果见图11中E的左图。然后采用MatLab软件进行初步的峰值统计,实验结果见图11中E的右图。结果表明,步骤6中的动力学数据与其它对照实验中的动力学数据在表观上有本质区别,即当体系中存在与模板链T以及与之匹配的脱氧核苷酸时,体系的动力学数据才能与其余四组对照实验不同。7、按照步骤二中7的方法,将高态电流对应的高态时间(τhi)和低态电流对应的低态时间(τlow)进行统计分析,实验结果见图12(左图为低态时间,右图为高态时间)。根据平均低态时间和平均高态时间,计算得到本体系中DNA的合成速度是每秒232.83个dATP核苷酸(见表1),与已有的文献(TivoliJ.Olsen,YongkiChoi,PatrickC.Sims,O.TolgaGul,BradL.Corso,ChengjunDong,WilliamA.Brown,PhilipG.CollinsandGregoryA.Weiss,ElectronicMeasurementsofSingle-MoleculeProcessingbyDNAPolymeraseI(KlenowFragment),JournaloftheAmericanChemicalSociety2013,135,7855-7860)记载的合成速度基本一致。因此,采用酶修饰的石墨烯基单分子器件可进行DNA测序。实施例2、采用硅纳米线单分子器件进行DNA测序一、酶修饰的硅纳米线单分子器件的制备1、制备硅纳米线单分子器件硅纳米线单分子器件的制备过程参考如下文献:CaoY,DongS,LiuS,HeL,GanL,YuX,SteigerwaldML,WuX,LiuZ,GuoX.Buildinghigh-throughputmolecularjunctionsusingindentedgraphenepointcontacts.AngewChemIntEdEngl.2012Dec3;51(49):12228—32.硅纳米线单分子器件上具有纳米间隙的硅纳米线电极(以下简称硅纳米线电极)。2、刻蚀完成步骤1后,将硅纳米线单分子器件和HF溶液混合,得到刻蚀的硅纳米线单分子器件。部分刻蚀的硅纳米线单分子器件的结构示意图如图13中(1)所示。3、电学回路的构建完成步骤2后,将刻蚀的硅纳米线单分子器件和10—十一碳炔酸(见图13中(2))混合,得到电学回路。电学回路的部分结构示意图如图13中(3)所示。4、Sulfo-NHS活化完成步骤3后,将电学回路和N-羟基琥珀酰亚胺磺酸钠盐(见图13中(4))混合,得到Sulfo-NHS活化的电学回路。Sulfo-NHS活化的电学回路的部分结构式如图13中(5)所示。5、处理后的硅纳米线单分子器件的获得完成步骤4后,将Sulfo-NHS活化的电学回路和N-(2-氨乙基)马来酰亚胺盐酸盐(见图13中(6))混合,得到处理后的硅纳米线单分子器件。处理后的硅纳米线单分子器件的部分结构式如图13中(7)所示。6、大肠杆菌DNA聚合酶Ⅰ的改造同实施例1步骤一中的6。7、酶修饰的硅纳米线单分子器件的制备完成步骤6后,将处理后的硅纳米线单分子器件和过量的改造后的DNA聚合酶Ⅰ(见图7中(8))混合,得到酶修饰的硅纳米线单分子器件(见图3中右图)。部分酶修饰的硅纳米线单分子器件的结构示意图如图7中(7)所示。将制备的酶修饰的硅纳米线单分子器件置于低分辨探针台,观察导电性,若具有导电性,则进行下述实验。二、采用酶修饰的硅纳米线单分子器件对模板链C进行DNA测序按照实施例1步骤二的方法,将酶修饰的石墨烯基单分子器件替换为酶修饰的硅纳米线单分子器件,其它步骤均不变,得到本体系中DNA的合成速度是每秒65.30个dGTP核苷酸,与采用酶修饰的石墨烯基单分子器件对模板链C进行DNA测序的结果无显著差异。三、采用酶修饰的硅纳米线单分子器件对模板链A进行DNA测序按照实施例1步骤三的方法,将酶修饰的石墨烯基单分子器件替换为酶修饰的硅纳米线单分子器件,其它步骤均不变,得到本体系中DNA的合成速度是每秒117.27个TTP核苷酸,与采用酶修饰的石墨烯基单分子器件对模板链A进行DNA测序的结果无显著差异。四、采用酶修饰的硅纳米线单分子器件对模板链G进行DNA测序按照实施例1步骤四的方法,将酶修饰的石墨烯基单分子器件替换为酶修饰的硅纳米线单分子器件,其它步骤均不变,得到本体系中DNA的合成速度是每秒154.51个dCTP核苷酸,与采用酶修饰的石墨烯基单分子器件对模板链G进行DNA测序的结果无显著差异。五、采用酶修饰的硅纳米线单分子器件对模板链T进行DNA测序按照实施例1步骤五的方法,将酶修饰的石墨烯基单分子器件替换为酶修饰的硅纳米线单分子器件,其它步骤均不变,得到本体系中DNA的合成速度是每秒234.60个dATP核苷酸,与采用酶修饰的石墨烯基单分子器件对模板链T进行DNA测序的结果无显著差异。因此,采用酶修饰的硅纳米线单分子器件可进行DNA测序。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1