定量检测荷花腐败病菌的实时荧光等温扩增引物组、反应体系及检测方法与流程
本发明属于生物
技术领域:
,具体涉及一种定量检测土壤及植株中荷花腐败病菌的实时荧光等温扩增(Real-timeLAMP)引物组、反应体系及检测方法。
背景技术:
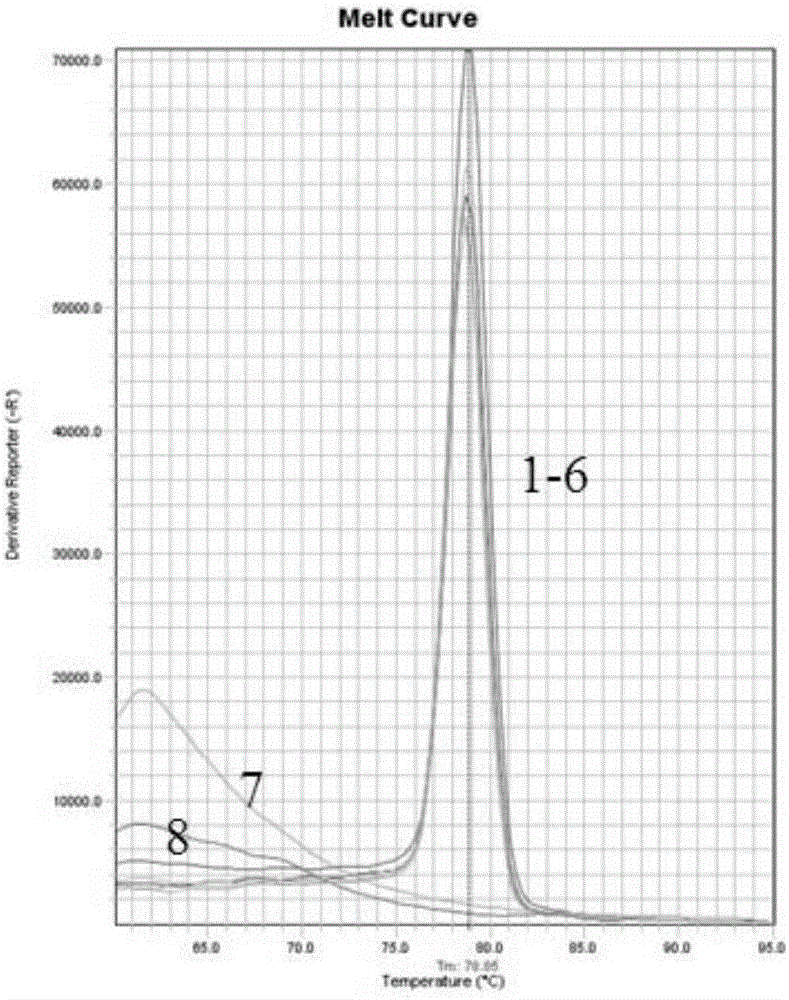
:荷花腐败病是由镰孢菌(Fusariumcommune)引起的,病菌往往造成藕鞭、藕节、藕根腐烂,同时地上部分的叶、花也会萎蔫黄枯,发病严重的整株枯死。荷花种植面广,荷花腐败病发生普遍,危害巨大,已成为制约广东省乃至全国荷花产业发展的重大障碍,也是我国都市农业发展及湿地环境绿化中面临的重要瓶颈问题。近年来,有报道证实基于PCR的方法已经成功用于荷花腐败病菌检测,但是公开的检测方法均是定性检测,还没有关于荷花腐败病菌快速定量检测方法的报道。由于荷花腐败病属土传病害,定量检测土壤中病原菌的数量可以为荷花种植土壤的科学管理提供依据。另外,植物和土壤中病原菌的分子定量检测可替代传统的稀释平板计数法,并且这种方法快速、特异、灵敏、重复性好,将有利于研究病原菌在植物和土壤中的数量和分布。因此,开发荷花腐败病菌的快速定量检测方法对于定量跟踪荷花腐败病的发生动态,及指导病害防控意义重大。技术实现要素:为了解决上述问题,本发明的目的之一在于提供了一种定量检测荷花腐败病菌的实时荧光等温扩增(Real-timeLAMP)引物组。本发明的目的之二是提供一种定量检测荷花腐败病菌的实时荧光等温扩增(Real-timeLAMP)反应体系,所述实时荧光等温扩增反应体系包括有实时荧光等温扩增引物组。本发明的目的之三是提供了利用实时荧光等温扩增引物组或实时荧光等温扩增反应体系定量检测荷花腐败病菌的方法。本发明是通过以下技术方案来实现的:一种用于定量检测荷花腐败病菌的实时荧光等温扩增引物组,其特征在于,所述实时荧光等温扩增引物组包含一对外引物F3、B3和一对内引物FIP、BIP,所述外引物F3、B3和所述内引物FIP、BIP的序列分别为:F3:CCAGACGGTCAATATAGCTTAT;B3:TAGTTTGCTAGGCTAACCCTA;FIP:CATAGAGGGCTGCCTTCGCGGCAGTACTTGAGGAGGA;BIP:GGACGAAGGCACAGAGAACAAGTTATCTGACCTATGGCATTCA。较佳地,所述实时荧光等温扩增反应体系包括如上所述的实时荧光等温扩增引物组。较佳地,所述实时荧光等温扩增反应体系还包括待检DNA提取液、反应液、BstDNA聚合酶及荧光染料。较佳地,所述荧光染料为10×SYBRGreenI。较佳地,所述反应液包括dNTP、MgSO4及甜菜碱,所述dNTP、所述MgSO4及所述甜菜碱的体积比为:dNTP:MgSO4:甜菜碱=8:5:2。较佳地,所述实时荧光等温扩增反应体系含有0.2μM所述外引物F3、0.2μM所述外引物B3、0.8μM所述内引物FIP、0.8μM所述内引物BIP、2μL所述待检DNA提取液、12.5μL所述反应液、0.32U/μL所述BstDNA聚合酶及0.5μL所述荧光染料,去离子水补齐到25μL。本发明还提供一种利用上述实时荧光等温扩增引物组或实时荧光等温扩增反应体系定量检测荷花腐败病菌的方法,包括以下步骤:S1.在反应管中配置实时荧光等温扩增反应体系:向若干25μL的反应管中均加入0.2μM外引物F3、0.2μM外引物B3、0.8μM内引物FIP、0.8μM内引物BIP、12.5μL反应液、0.32U/μLBstDNA聚合酶及0.5μL荧光染料,然后向所述反应管中的其中之一加入阳性基因组DNA,剩余所述反应管中分别加入2μL待检DNA提取液,去离子水补齐到25μL;S2.实时荧光等温扩增法检测:将步骤S1中配置好的若干所述实时荧光等温扩增反应体系混匀后离心,然后放置于实时荧光分析仪上,所述实时荧光等温扩增反应体系在所述实时荧光分析仪上进行等温扩增反应及熔解曲线分析,同时所述荧光分析仪实时读取等温扩增反应及熔解曲线分析产生的荧光信号;S3.所述实时荧光分析仪根据等温扩增反应及熔解曲线分析产生的荧光信号绘制等温扩增曲线及熔解曲线,若等温扩增曲线的值高于本底噪音信号值且熔解曲线的Tm吸收峰值与阳性基因组DNA的熔解曲线的Tm吸收峰值一致,则说明所述待检DNA提取液含有荷花腐败病菌的DNA。较佳地,在所述实时荧光分析仪上设定实时荧光等温扩增反应的程序为:63℃,60min;等温扩增反应结束后立即进行熔解曲线分析,在所述实时荧光分析仪上设定熔解曲线分析的程序为:95℃,15s,然后60℃,1min,从60℃开始每秒升高0.3℃至95℃,95℃保持15s。较佳地,所述实时荧光分析仪为ESE-QuantTubeScanner或荧光定量PCR仪。较佳地,所述阳性基因组DNA包括若干已知浓度的荷花腐败病菌样品的DNA,并于步骤S3中可得到若干已知浓度的荷花腐败病菌样品的DNA对应的Ct值,从而得出一个标准曲线,根据所述标准曲线的函数关系,得出所述待检DNA提取液中荷花腐败病菌的DNA含量。较佳地,在步骤S1之前还包括提取待检DNA提取液的步骤:如果检测样本为荷花腐败病菌菌丝体,则利用改进的SDS法抽提荷花腐败病菌菌丝体的DNA;如果检测样本为荷花植株组织,则利用CTAB法抽提荷花植株组织中的DNA;如果检测样本为土壤,则利用土壤基因组DNA快速提取试剂盒提取疑感染土壤的微生物的DNA。较佳地,所述荷花植株组织为地下茎、莲鞭、藕节或须根部位的组织。与现有技术相比,本发明具有以下有益效果:(1)特异性强:针对靶基因的不同区域设计实时荧光等温扩增引物组,不会受到实时荧光等温扩增反应体系中存在的其他非靶标DNA的影响,同时可根据熔解曲线鉴别非特异性扩增。因此,可从植物组织及土壤中复杂的病原菌环境准确地检测到荷花腐败病菌;(2)灵敏性高:等温扩增反应+实时荧光法检测所检测的是荧光信号,能检测到普通PCR的1/10-1/100的拷贝数;(3)等温:该实时荧光等温扩增反应体系只需在恒定温度下就能扩增反应,不需要预先进行双链DNA的变性;(4)快速:实时荧光等温扩增法检测在63.5min即可完成,等温扩增反应可设定于30min-60min内完成;(5)定量检测:可根据已检样品的Ct值计算出DNA提取液或样品中荷花腐败病菌的DNA含量,实现对荷花植株及土壤中的荷花腐败病菌的定量检测,能实时跟踪荷花腐败病菌侵染植株的情况;也可同时进行高通量的样本检测;(6)闭管检测:反应管可盖密封,整个过程在密封的反应管中检测,避免因开盖造成气溶胶污染;(7)操作简便快捷,基于对核苷酸的检测,不受培养条件限制,实用性强,可满足植物病害诊断及监测的需要。附图说明图1是实时荧光等温扩增法检测荷花腐败病菌的灵敏度实验的等温扩增曲线;其中,1~6:10ng/μL,1ng/μL,100pg/μL,10pg/μL,1pg/μL,100fg/μL;7:10fg/μL;8:阴性对照。图2是实时荧光等温扩增法检测荷花腐败病菌的灵敏度实验的熔解曲线;其中,1~6:10ng/μL,1ng/μL,100pg/μL,10pg/μL,1pg/μL,100fg/μL;7:10fg/μL;8:阴性对照。图3是实时荧光等温扩增法检测荷花腐败病菌的DNA标准曲线。图4是实时荧光等温扩增法检测荷花腐败病菌的特异性实验的等温扩增曲线;1~5:荷花腐败病(Fusariumcommune)菌株;6~11:非荷花腐败病菌株;12:空白对照。图5是实时荧光等温扩增法检测荷花腐败病菌的特异性实验的熔解曲线;1~5:荷花腐败病(Fusariumcommune)菌株;6~11:非荷花腐败病菌株;12:空白对照。图6是实时荧光等温扩增法检测接种土壤中荷花腐败病菌所产生的等温扩增曲线;其中,1:107个分生孢子/克土壤;2:106个分生孢子/克土壤;3:105个分生孢子/克土壤;4:104个分生孢子/克土壤;5:103个分生孢子/克土壤;6:102个分生孢子/克土壤;7:10个分生孢子/克土壤;8:1个分生孢子/克土壤;9:未接菌土壤对照。图7是实时荧光等温扩增法检测土壤中荷花腐败病菌的DNA标准曲线,展示了土壤中分生孢子数目的对数和对应的土壤中荷花腐败病菌的DNA在Real-timeLAMP中的Ct值间的线性关系。具体的实施方式下面结合具体实施方式对本发明作进一步的详细说明,以助于本领域技术人员理解本发明。一、实时荧光等温扩增引物组设计荷花腐败病菌的引物设计选取荷花腐败病菌的线粒体小亚基(mtSSUrRNAgenes)基因片段,该基因片段重复性、特异性好,且序列长度约700bp。运用日本荣研株式会社在线软件PrimerExplorerV4(http://primerexplorer.jp/e/)设计荷花腐败病菌实时荧光等温扩增(Real-timeLAMP)检测方法的特异性引物组:包括一对内引物(FIP,BIP)和一对外引物(F3,B3),引物序列如下:F3:CCAGACGGTCAATATAGCTTATB3:TAGTTTGCTAGGCTAACCCTAFIP:CATAGAGGGCTGCCTTCGCGGCAGTACTTGAGGAGGABIP:GGACGAAGGCACAGAGAACAAGTTATCTGACCTATGGCATTCA荷花腐败病菌的线粒体小亚基(mtSSUrRNAgenes)基因片段的全序列如下:GCCTAACGGCTGAACTGGCAACTTGGAGAAGTGGCAAGTCTTCCAGTATGGGGAGCAAAACAGCTATGGGTCAAGTCCGATATCTTTAGGAGAAGTCTTATTGTGAGGGCGAGTTATATAACACCATAGGACTGGCCGTCCCATATGAAAAGATTATATTAGAATTGAATGAAGCTTTGTTTATATATTGATAATGACAGTATATATATCGTGTCTTGACTAATTGCGTGCCAGCAGTCGCGGTAATACGTAAGAGACTAGTGTTATTCATCTTAATTAGGTTTAAAGGGTACCCAGACGGTCAATATAGCTTATAAAATGTTAGTACTTGACTAGAGTTTTATGTAAGAGGGCAGTACTTGAGGAGGAGAGATGAAATTTCGTGATACCAAAGGGACTCTGTAAAGGCGAAGGCAGCCCTCTATGTAAAAACTGACGTTGAAGGACGAAGGCACAGAGAACAAACAGGATTAGATACCCAAGTAGTCTTTGCAGTAAATGATGAATGCCATAGGTCAGATAACCAGTTAATGTTTATAGTCTAATAGGGTTAGCCTAGCAAACTAATGACATAGACTATCCATTAAAAATATTTGGTCTATAAATGAAAGTGTAAGCATTTCACCTCAAGAGTAATGTGGCAACGCAGGAACTGAAATCACTAGACCGTTTCTGACACCAGTAGTGAAGTAT。二、荷花腐败病菌的实时荧光等温扩增检测方法利用上述实时荧光等温扩增引物组(FIP、BIP、F3和B3)对样品进行检测,步骤如下:(1)从检测样本中提取DNA:如果检测样本为荷花腐败病菌菌丝体,则利用改进的SDS法抽提荷花腐败病菌菌丝体的DNA;如果检测样本为荷花植株组织,则利用CTAB法抽提荷花植株组织中的DNA,所述荷花植株组织为地下茎、莲鞭、藕节或须根部位的组织;如果检测样本为土壤,则利用土壤基因组DNA快速提取试剂盒提取疑感染土壤的微生物总DNA;(2)在反应管中配置实时荧光等温扩增反应体系:向若干25μL的反应管中均加入0.2μM外引物F3、0.2μM外引物B3、0.8μM内引物FIP、0.8μM内引物BIP、12.5μL反应液、8UBstDNA聚合酶及0.5μL10×SYBRGreenI,然后向所述反应管中的其中之一加入2μL阳性基因组DNA,向剩余的所述反应管中分别加入2μL检测样本DNA提取液,去离子水补齐到25μL;(3)实时荧光等温扩增法检测:将步骤(2)中配置好的若干所述实时荧光等温扩增反应体系混匀后离心,然后放置于实时荧光分析仪上,所述实时荧光等温扩增反应体系在所述实时荧光分析仪上进行实时荧光等温扩增反应及熔解曲线分析,同时所述荧光分析仪实时读取等温扩增反应及熔解曲线分析产生的荧光信号;较佳地,在所述实时荧光分析仪上设定等温扩增反应的程序为:63℃,60min;等温扩增反应结束后立即进行熔解曲线分析,在所述实时荧光分析仪上设定熔解曲线分析的程序为:95℃,15s,然后60℃,1min,从60℃开始每秒升高0.3℃至95℃,95℃保持15s;(4)所述实时荧光分析仪根据等温扩增反应及熔解曲线分析产生的荧光信号绘制等温扩增曲线及熔解曲线,若等温扩增曲线的值高于本底噪音信号值且熔解曲线的Tm吸收峰值与阳性基因组DNA的熔解曲线的Tm吸收峰值一致,则判定为阳性结果,等温扩增曲线的值低于本底噪音信号值则判定为阴性结果;较佳地,所述实时荧光分析仪为ESE-QuantTubeScanner或荧光定量PCR仪。三、实时荧光等温扩增法检测荷花腐败病菌的灵敏度实验所述阳性基因组DNA包括若干已知浓度的荷花腐败病菌基因组DNA,具体地,用10倍稀释的荷花腐败病菌基因组DNA作为模版进行灵敏度实验,将100ng/μL荷花腐败病菌基因组DNA以10倍梯度稀释为10ng/μL,1ng/μL,100pg/μL,10pg/μL,1pg/μL,100fg/μL,10fg/μL七个浓度梯度作为检测模版,用实施例2的方法进行检测,结果显示,在图1的扩增曲线中,有6个浓度梯度的模版DNA得到了扩增,所以最低可检出的荷花腐败病菌基因组DNA浓度为100fg/μL。在图2中,融解曲线Tm=79±0.5,则以后用于检测样品时,根据此Tm值即可排除假阳性的可能。此外,根据等温扩增实时荧光检测结果绘制荷花腐败病菌基因组DNA的标准曲线如图3所示,结果表明稀释荷花腐败病菌基因组DNA浓度的对数(X)和对应的Real-timeLAMP中的Ct值(Y)之间的线性关系为:Y=-2.011X+21.03(R2=0.995,E=186.08%),R2=0.995,很接近1,说明本实验线性率及可信度较高。此实例得出的结论是,本发明方法的最低检测DNA浓度为100fg/μL。根据所述标准曲线的函数关系,可得出所述检测样本DNA提取液中荷花腐败病菌的DNA含量。四、实时荧光等温扩增法检测荷花腐败病菌的灵敏度实验使用上述的实时荧光等温扩增法分别对样品1-5:分离自不同地区的5个荷花腐败病菌(Fusariumcommune)菌株,6:培养的香蕉枯萎病菌(Fusariumoxysporumf.sp.cubense),7:冬瓜枯萎病菌(Fusariumoxysporumf.sp.benincasae),8:棉花枯萎病菌(Fusariumoxysporumf.sp.vasinfectum),9:莲小菌核叶腐病菌(Sclerotiumhydrophilum),10:甘蔗稍腐病菌(Fusariumsacchari),11:莲炭疽病菌(Colletotrichumgloeosporioides),12:无菌水为空白对照进行检测,结果显示5个分离自不同地区的荷花腐败病菌(样品1-5)菌株扩增正常,且熔解曲线为单一尖锐峰,Tm值为79.5±0.5;而香蕉枯萎病菌、冬瓜枯萎病菌、棉花枯萎病菌、莲小菌核叶腐病菌、甘蔗稍腐病菌、莲炭疽病菌及空白对照均无扩增,如图4-5所示。表明本发明提供的实时荧光等温扩增引物组及实时荧光等温扩增检测方法对荷花腐败病菌具有较好的特异性。五、接种土壤中荷花腐败病菌(F.commune)标准曲线的绘制及灵敏度检测将荷花腐败病菌株置于100mLPDB培养基中,在25℃,180r/min的摇床上摇菌培养5天。用4层纱布过滤孢子,以转速10000g离心l0min,用灭菌的蒸馈水冲洗2次。将采自广东东莞市荷田的土壤样品,121℃,60min灭菌2次,去掉土壤杂物,置于烘箱中烘至恒重。分生孢子悬液经显微镜观察计数后,稀释成不同浓度5×107个孢子/mL,5×106个孢子/mL,5×105个孢子/mL,5×104个孢子/mL,5×103个孢子/mL,5×102个孢子/mL,5×10个孢子/mL及5个孢子/mL,分别加入100μL到15mL体积且装有500mg灭菌土壤的离心管中,以未接菌的土壤作为空白对照,试验重复三次。用土壤基因组DNA快速提取试剂盒如土壤DNA提取试剂盒EZNASoilDNA提取待测土壤样品总DNA,用上述实时荧光等温扩增检测方法对接种不同浓度分生孢子的土壤总DNA进行等温扩增反应和绘制标准曲线,并根据Ct值的有无来确定实时荧光等温扩增检测方法检测土壤中分生孢子数目的灵敏度。结果表明:土壤中分生孢子数目的对数(X)和对应的土壤DNA的Ct值(Y)之间的线性关系为:Y=-3.2319X+31.825(R2=0.979,E=113.30%)(如图7所示)。以后根据此函数可以计算出待测土壤样品中荷花腐败病菌分生孢子数的数目。低于103个分生孢子/克土壤时,该实时荧光等温扩增反应体系三次重复试验不是都能检测到(如图6所示),因此,该等温扩增实时荧光法检测土壤中分生孢子的下限是103个分生孢子/克土壤。六、实时荧光等温扩增检测方法的田间应用2015年在广东省东莞市桥头镇莲湖公园采集不同发病级别的荷花地下茎(藕)样品16个,用5%的NaClO消毒3min,用无菌水冲洗2次,用无菌滤纸吸干。然后用无菌的解剖刀切下约5g的组织,放到不同的离心管中,快速冷冻提取DNA。参照上述实时荧光等温扩增检测方法对提取的植物组织DNA进行等温扩增反应,得到不同检测样品的CT值,根据已建立的标准曲线计算出荷花腐败病不同发病级别的每克植物组织中病原菌(F.commune)的DNA含量,试验重复三次。通过检测得到不同发病级别荷花样品的Ct值及对应的病原菌DNA含量如表1所示,16个不同发病级别的荷花地下茎样品DNA含量差异较显著,发病越严重(病害级别越高),其地下茎组织中DNA的含量越高,但是有一个肉眼观察没有发病的荷花地下茎也检测出微量的病原菌DNA,说明了还没显示出病害症状的荷花植株也可能已经被病菌侵染,此实时荧光等温扩增检测方法为提前预测病害的严重程度,制定科学防控措施提供了良好的依据。表1不同发病级别荷花植株中病原菌的DNA含量病害级别CT值DNA含量(ng)0无无0无无038.47282.11985×10-10133.32327.70941×10-10133.32327.70941×10-10226.526791.84773×10-6225.34687.135×10-6225.87753.886×10-6318.11490.028318.18550.028318.27460.029418.87470.012417.997320.032512.290922.164513.26897.233512.516617.116当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种气单胞菌的核酸等温扩增检测试剂盒及其检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 用于扩增细胞群的方法、试剂盒及装置与制造工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一套鉴定甘蔗上三种短体线虫的环介导等温扩增引物及其试剂盒的制造方法与工艺
- RNA扩增方法与制造工艺
- 用于扩增核酸样品的等温方法与制造工艺