一种酿酒酵母工程菌株及其构建方法、应用与流程
本发明涉及基因工程技术领域,特别涉及一种酿酒酵母工程菌株及其构建方法、应用。
背景技术:
青蒿素是一种有效抗疟疾药物,其众多的衍生物都被世界卫生组织于2002年认定为一线抗疟疾药物。目前,青蒿素的获得方式主要是从植物青蒿中直接提取。青蒿在世界各地均有分布,但绝大数青蒿中青蒿素含量都很低(≤1‰),且提取成本较高。青蒿的生长依赖于天气、土壤、阳光等多种条件因素,且需要花费漫长的时间,无法即时满足市场的需要,这也导致青蒿素相关药物的市场价格摇摆不定。而化学合成法从头合成青蒿素,因青蒿素分子本身结构复杂,导致合成难度高,步骤多,副产物多,成本高,在经济上不可行。
基于从植物中提取与化学合成方法获得青蒿素的种种缺陷,通过生物半合成方法获得青蒿素成为最佳的选择,即通过基因工程改造微生物使其生产青蒿素前体青蒿二烯、青蒿酸或二氢青蒿酸等,再通过几步简单的化学合成方法合成青蒿素。其中,构建高产的前体物的工程菌株是该方法的核心步骤。近年来,分子生物学技术、合成生物学技术、DNA合成技术的快速发展,使得向工程菌株中导入多个外源基因,对基因组进行大规模改造变得更加容易和方便,也为实现构建高产青蒿素前体物提供重要技术支持。
目前,利用酿酒酵母直接生产二氢青蒿酸的工作很少,只有发掘出AaDBR2基因的Patrick S.Covello在2008年利用酵母合成了二氢青蒿酸产量为15.7mg/L,同时伴有11.8mg/L的青蒿酸。而其他的课题组更多是合成青蒿二烯或是青蒿酸,再通过高效的化学转化合成二氢青蒿酸。因此,急需提供一种高效的生产二氢青蒿酸的酵母菌株及二氢青蒿酸合成方法。
技术实现要素:
有鉴于此,本发明提供了一种酿酒酵母工程菌株及其构建方法、应用。该酿酒酵母工程菌株可以积累1.17g/L二氢青蒿酸。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种酿酒酵母工程菌株,菌株过表达ERG10、ERG13、tHMG1、ERG8、ERG19、ERG20、ERG12、IDI1、ADS、CYP71AV1、AaCPR1、AaCYB5、AaADH1和AaALDH1基因,敲除了gal80、gal1、gal7和gal10基因。
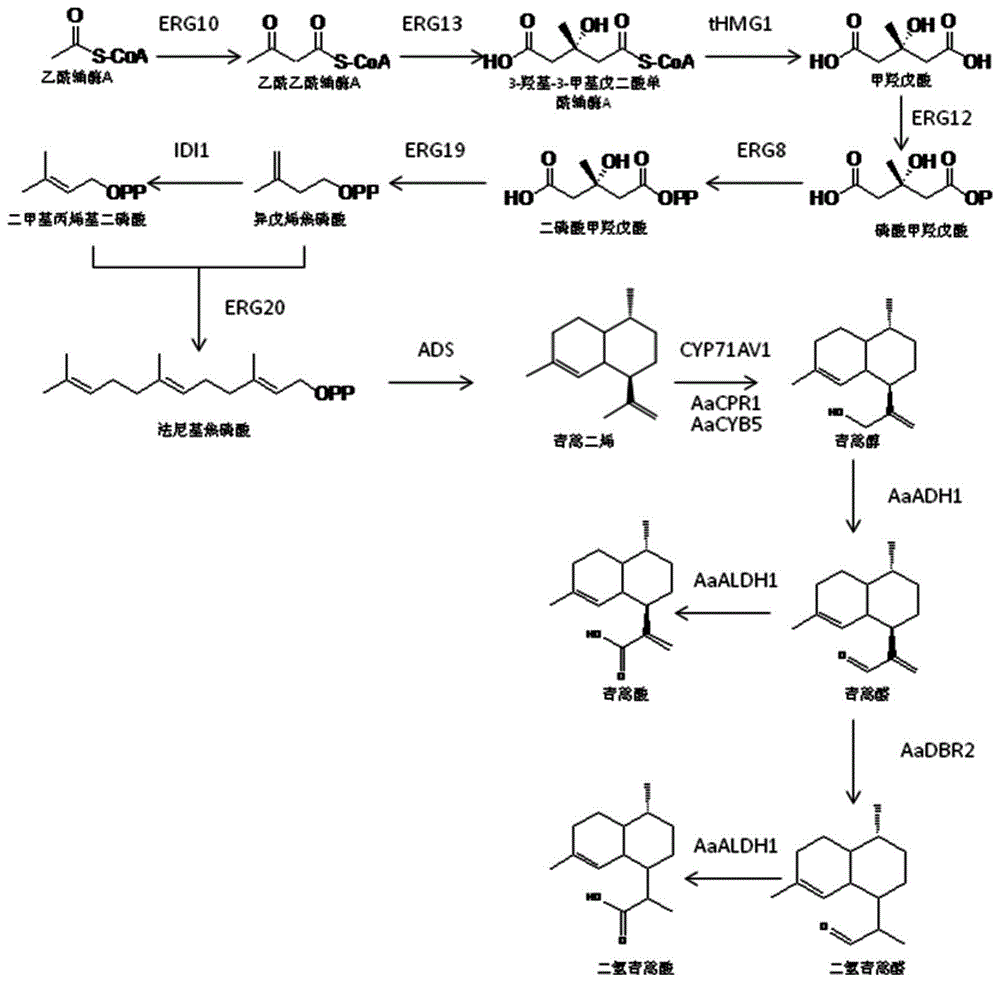
本发明提供的酿酒酵母工程菌株可高效生产二氢青蒿酸。二氢青蒿酸是一种倍半萜的衍生物,是合成青蒿素的直接底物。它含有15个碳原子。其在青蒿中的生物合成途径如下:青蒿利用光合作用合成的糖生产2碳中间体乙酰-CoA,进入甲羟戊酸(MVA)途径,合成15个碳的法尼基焦磷酸(FPP),再以FPP为底物,通过青蒿二烯合成酶(ADS)的催化合成青蒿二烯,随后被P450单氧化酶CYP71AV1氧化为青蒿醇,在AaADH1催化下合成青蒿醛,青蒿醛在AaDBR2催化下合成二氢青蒿醛,最后经过AaALDH1催化生成二氢青蒿酸,具体合成途径见图1。
本发明通过过表达酿酒酵母MVA途径上所有基因,特别是限速酶tHMG1,提高到二氢青蒿酸前体物FPP的通量,表达AaCPR1,AaCYB5强化关键酶CYP17AV1的功能;在多拷贝质粒上强表达AaDBR2,使代谢流更多流向二氢青蒿酸而不是青蒿酸。最终得到的菌株可以积累1.17g/L二氢青蒿酸。
本申请采用CEN.PK2.1C(来源)为底盘菌进行菌株的构建,利用强启动子Pgal1和Pgal10过表达MVA途径上所有酵母内源基因(ERG10,ERG13,tHMG1,ERG8,ERG19,ERG20,ERG12,IDI1)增加前体物FPP的通量,其中,MVA途径中的限速酶tHMG1(截短的内源HMG1基因),过表达3份,以上改造均整合在基因组上。青蒿酸合成中的关键基因ADS和CYP71AV1在pRS425多拷贝质粒上用Pgal1和Pgal10进行过表达。其余相关基因AaCPR1(源于A.annua的细胞色素P450还原酶),AaCYB5(源于A.annua的细胞色素b5),AaADH1以及AaALDH1均整合在基因组上。同时,为了使过表达的基因正常工作,敲除了抑制Pgal启动子的gal80基因,同时为了减少细胞代谢负担敲除了半乳糖代谢相关基因gal1、gal7和gal10。
在本发明提供的一些实施例中,酿酒酵母工程菌株的基因型为:
gal1,7,10Δ::Pgal3-AaCPR1-CYC1t_NATR;
leu2Δ::G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8;
ade1Δ::tHMG1-Pgal1,10-IDI1_ADE1;
his3Δ::His3_Pgal7-AaALDH1-TDH1t_ERG12-Pgal1,10-ERG10;
ura3Δ::tHMG1-Pgal1,10-ERG13;
trp1Δ::tHMG1-Pgal1,10-ERG20_TPR1;
gal80Δ::URA3_Pgal7-AaADH1-TDH1t;
pRS425_Pgal7-AaDBR2-CYC1t_ADH1t-CYP71AV1-Pgal1,10-ADS-PGK1t。
本发明还提供了该酿酒酵母工程菌株的构建方法,包括:
将基因片段tHMG1、Pgal1,10、IDI1连接,获得模块A;
将基因片段tHMG1、Pgal1,10、ERG13连接,获得模块U;
将基因片段tHMG1、Pgal1,10、ERG20连接,获得模块T;
将基因片段pAgTEF1、Kan和AgTEF1t连接,获得G418R;将G418R、Pgal7、AaCYB5、CYC1t、ERG19、Pgal1,10、ERG8连接,获得模块L;
将基因片段Gal7up、Pgal3、AaCPR1、CYC1t、NATR、Gal1down连接,获得模块N;
将基因片段pAgTEF1、hphA、AgTEF1t连接,获得HPHR;将HPHR、Pgal7、AaALDH1、TDH1t、ERG12、Pgal1,10、ERG10连接,获得模块H;
将基因片段Gal80up、URA3、Pgal7、AaADH1、TDH1t、Gal80down与载体连接,获得模块G;
将基因片段ADH1t、CYP71AV1、Pgal1,10、ADS、PGK1t连接,获得模块1;
将基因片段AaDBR2、CYC1t、Pgal7与模块1连接,获得模块2;
将模块A、模块U、模块N、模块T、模块L、模块H、模块G和模块2导入酿酒酵母基因组中,获得酿酒酵母工程菌株。
在本发明中,模块A、模块U、模块N、模块T、模块L、模块H、模块G可起到的作用分别为:
模块A:表达tHMG1基因,过表达IDI1;
模块U:表达tHMG1基因,过表达ERG13;
模块T:表达tHMG1基因,过表达ERG20;弥补了细胞的色氨酸缺陷;
模块H:过表达ERG12和ERG10基因;过表达AaALDH1基因;弥补了细胞的组氨酸缺陷;
模块L:过表达ERG8和ERG19基因;过表达AaCYB5基因;赋予细胞G418抗性;
模块N:表达AaCPR1基因;敲除细胞的gal1,gal10,gal7三个基因;赋予细胞诺尔斯菌素抗性;
模块G:过表达AaADH1基因;敲除细胞的gal80基因。
在本发明提供的一些实施例中,构建方法中所用筛选标记为URA3标记、TRP1标记、LEU2标记、HIS3标记、KlURA3标记、G418R标记、Ade1标记或NATR标记。
在本发明提供的一些实施例中,NATR由pAgTEF1、nat1、AgTEF1t基因片段通过OE-PCR组装获得。
在本发明提供的一些实施例中,该生物工程菌株的构建方法包括:
将基因片段Ade1up、tHMG1、Pgal1,10、IDI1、ADE1连接,获得模块A(Ade1up_tHMG1-Pgal1,10-IDI1_ADE1);
将基因片段Ura3up、tHMG1、Pgal1,10、ERG13、URA3连接,获得模块U(Ura3up_tHMG1-Pgal1,10-ERG13_URA3);
将基因片段Trp1up、tHMG1、Pgal1,10、ERG20、TRP1连接,获得模块T(Trp1up_tHMG1-Pgal1,10-ERG20_TRP1);
将基因片段pAgTEF1、Kan和AgTEF1t连接,获得G418R;将Leu2up、G418R、Pgal7、AaCYB5、CYC1t、ERG19、Pgal1,10、ERG8、Leu2down连接,获得模块L(Leu2up_G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8-Leu2down);
将基因片段Gal7up、Pgal3、AaCPR1、CYC1t、NATR、Gal1down连接,获得模块N(Gal7up_Pgal3-AaCPR1-CYC1t_NATR_Gal1down);
将基因片段pAgTEF1、hphA、AgTEF1t连接,获得HPHR;将His3up、HPHR、Pgal7、AaALDH1、TDH1t、ERG12、Pgal1,10、ERG10、His3down连接,获得模块H(His3up_HPHR_Pgal7-AaALDH1-TDH1t_ERG12-gal1,10-ERG10-His3down);
将基因片段Gal80up、URA3、Pgal7、AaADH1、TDH1t、Gal80down与载体连接,获得模块G(Gal80up_URA3_Pgal7-AaADH1-TDH1t_Gal80down);
将基因片段pRS425、ADH1t、CYP71AV1、Pgal1,10、ADS、PGK1t连接,获得模块1(pRS425_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t);
将基因片段AaDBR2、CYC1t、Pgal7与模块1连接,获得模块2(pRS425_Pgal7-AaDBR2-CYC1t_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t);
将模块A、模块U、模块N、模块T、模块L、模块H、模块G和模块2导入酿酒酵母基因组中,获得酿酒酵母工程菌株。
在本发明提供的一些实施例中,酿酒酵母工程菌株的底盘菌为S.cerevisiae CEN.PK2.1C。
在本发明提供的一些实施例中,酿酒酵母为ScA菌株,该ScA菌株以CEN.PK2.1C为基础菌,其ade1基因被KlURA3基因取代。
在本发明提供的一些实施例中,该生物工程菌株的构建方法具体为:
1、基本原件的合成:
将AaCYB5基因片段与载体连接,获得质粒SyBE_Ec01110022;
将ADS基因片段与载体连接,获得质粒SyBE_Ec01110024;
将CYP71AV1基因片段与载体连接,获得质粒SyBE_Ec01110027;
将AaCPR1基因片段与载体连接,获得质粒SyBE_Ec01110030;
将AaALDH1基因片段与载体连接,获得质粒SyBE_Ec01110032;
将AaADH1基因片段与载体连接,获得质粒SyBE_Ec01110033;
将hphA基因片段与载体连接,获得质粒SyBE_Ec01130025;
将nat1基因片段与载体连接,获得质粒SyBE_Ec01130026;
将pAgTEF1基因片段与载体连接,获得质粒SyBE_Ec01130027;
将AgTEF1t基因片段与载体连接,获得质粒SyBE_Ec01130028;
2、模块的构建:
将基因片段Ade1up、tHMG1、Pgal1,10、IDI1、ADE1与载体连接,获得含有模块A(Ade1up_tHMG1-Pgal1,10-IDI1_ADE1)的SyBE_Ec01130008质粒;
将基因片段Ura3up、tHMG1、Pgal1,10、ERG13、URA3与载体连接,获得含有模块U(Ura3up_tHMG1-Pgal1,10-ERG13_URA3)的SyBE_Ec01130009质粒;
将基因片段Trp1up、tHMG1、Pgal1,10、ERG20、TRP1与载体连接,获得含有模块T(Trp1up_tHMG1-Pgal1,10-ERG20_TRP1)的SyBE_Ec01130010质粒;
将基因片段pAgTEF1、Kan和AgTEF1t连接,获得G418R;将Leu2up、G418R、Pgal7、AaCYB5、CYC1t、ERG19、Pgal1,10、ERG8、Leu2down与载体连接,获得含有模块L(Leu2up_G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8-Leu2down)的SyBE_Ec01130017质粒;
将基因片段Gal7up、Pgal3、AaCPR1、CYC1t、NATR、Gal1down与载体连接,获得含有模块N(Gal7up_Pgal3-AaCPR1-CYC1t_NATR_Gal1down)的SyBE_Ec01130024质粒;
将基因片段pAgTEF1、hphA、AgTEF1t连接,获得HPHR;将His3up、HPHR、Pgal7、AaALDH1、TDH1t、ERG12、Pgal1,10、ERG10、His3down与载体连接,获得含有模块H(His3up_HPHR_Pgal7-AaALDH1-TDH1t_ERG12-gal1,10-ERG10-His3down)的SyBE_Ec01130018质粒;
将基因片段Gal80up、URA3、Pgal7、AaADH1、TDH1t、Gal80down与载体连接,获得含有模块G(Gal80up_URA3_Pgal7-AaADH1-TDH1t_Gal80down)的SyBE_Ec01130016质粒;
将基因片段pRS425、ADH1t、CYP71AV1、Pgal1,10、ADS、PGK1t与载体连接,获得含有模块1(pRS425_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t)的SyBE_Ec01130020质粒;
将基因片段AaDBR2、CYC1t、Pgal7与模块1连接,获得含有模块2(pRS425_Pgal7-AaDBR2-CYC1t_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t)的SyBE_Ec01130021质粒;
3、酿酒酵母工程菌株构建:
从菌株CEN.PK2.1C出发,依次导入2中所构建的模块和质粒,经SyBE_Sc01130001、SyBE_Sc01130002、SyBE_Sc01130003、SyBE_Sc01130004、SyBE_Sc01130005、SyBE_Sc01130027、SyBE_Sc01130057,最终获得酿酒酵母工程菌株SyBE_Sc01130085。具体为:
敲除CEN.PK2.1C中的ADE1,导入模块A,得到菌株SyBE_Sc01130001;
将模块U导入菌株SyBE_Sc01130001,得到菌株ScAU,敲除URA3,得到SyBE_Sc01130002;
将模块N导入菌株SyBE_Sc01130002,得到菌株SyBE_Sc01130003;
将模块T导入SyBE_Sc01130003,得到SyBE_Sc01130004;
将模块L导入SyBE_Sc01130004,得到菌株SyBE_Sc01130005;
将模块H与H-His3共转化导入SyBE_Sc01130005,得到菌株SyBE_Sc01130027;
将模块G导入SyBE_Sc01130027,得到菌株SyBE_Sc01130057;
将质粒SyBE_Ec01130021经酵母转化导入SyBE_Sc01130057中,得到菌株SyBE_Sc01130085。
本发明还提供了一种二氢青蒿酸的制备方法,利用本发明构建的酿酒酵母工程菌株进行发酵培养,生产二氢青蒿酸。
作为优选,发酵培养采用的发酵培养基包括:
20g/L葡萄糖,8g/L KH2PO4,15g/L(NH4)2SO4,9.25g/L MgSO4·7H2O,10mL/L金属离子溶液,12mL/L维生素溶液;
金属离子溶液含5.57g/L ZnSO4·7H2O、0.32g/L MnCl2·4H2O、0.47g/L CoCl2·6H2O、0.32g/L CuSO4、0.48g/L Na2MoO4·2H2O、2.9g/L CaCl2·2H2O、2.8g/L FeSO4·7H2O和80mL/L 0.5M EDTA;
维生素溶液含0.05g/L生物素、1g/L泛酸钙、1g/L烟酸、25g/L肌醇、1g/L盐酸硫胺素、1g/L盐酸吡哆醇、0.2g/L对氨基苯甲酸和2g/L硫酸腺嘌呤。
作为优选,发酵培养的条件为:发酵温度为30℃,pH为5.05,通气量为1.5vvm,溶氧为40%,搅拌转速为300~700rpm。
本发明提供了一种酿酒酵母工程菌株及其构建方法、应用。该酿酒酵母工程菌株过表达ERG10、ERG13、tHMG1、ERG8、ERG19、ERG20、ERG12、IDI1、ADS、CYP71AV1、AaCPR1、AaCYB5、AaADH1和AaALDH1基因,敲除了gal80、gal1、gal7和gal10基因。本发明得到的酿酒酵母工程菌株可以积累1.17g/L二氢青蒿酸,为高效合成青蒿素奠定了基础。
附图说明
图1示二氢青蒿酸的合成途径;
图2示二氢青蒿酸和青蒿酸的HPLC检测色谱图;其中2-1示青蒿酸的标准色谱图,2-2示二氢青蒿酸的标准色谱图,2-3示发酵产物的色谱图;
图3示产物鉴定结果,其中3-1为样品质谱图,3-2为标准品质谱图;
图4示本发明生物工程菌株SyBE_Sc01130085的发酵曲线;
图5示二氢青蒿酸和青蒿酸的产量。
具体实施方式
本发明公开了一种酿酒酵母工程菌株及其构建方法、应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明中英文缩写表示的含义如下:
MVA: 甲羟戊酸
FPP: 法尼基焦磷酸
ADS: 青蒿二烯合成酶
CYP71AV1: P450单氧化酶
AaALDH1: A.annua源的(二氢)青蒿醛脱氢酶
AaADH1: A.annua源的青蒿醇脱氢酶
AaCPR1: CYP71AV1P450单氧化酶的还原酶
LEU2: 酿酒酵母亮氨酸筛选标记
TRP1: 酿酒酵母色氨酸筛选标记
HIS3: 酿酒酵母组氨酸筛选标记
KlURA3: 克鲁维亚酵母尿嘧啶筛选标记
ERG10: 酿酒酵母ERG10基因ORF框,编码乙酰乙酰-CoA合成酶
tHMG1: 截短的酿酒HMG1基因ORF框,编码HMG-CoA还原酶
IDI1: 酿酒酵母IDI1基因ORF框,编码异戊二烯焦磷酸异构酶
gal80: 酿酒酵母gal80基因,编码半乳糖代谢阻遏因子
loxP位点: 一段DNA序列,
TAACTTCGTATAATGTATGCTATACGAAGTTAT
hphA: 潮霉素B抗性基因ORF框
HPHR: 潮霉素B抗性基因
nat1: 诺尔斯菌素抗性基因ORF框
NATR: 诺尔斯菌素抗性基因
pAgTEF1: 抗性基因的启动子
AgTEF1t: 抗性基因的终止子
Ade1: 酿酒酵母ade1基因
kan: G418抗性基因ORF框
CYC1t: 酿酒酵母CYC1基因终止子
G418R: G418抗性基因
TDH1t: 酿酒酵母TDH1基因终止子
ADH1t: 酿酒酵母ADH1基因终止子
PGK1t: 酿酒酵母PGK1基因终止子
Sc-leu: 亮氨酸筛选培养基
Sc-trp: 色氨酸筛选培养基
Sc-ura: 尿嘧啶筛选培养基
5-FOA: 5氟乳清酸培养基
Sc-his:组氨酸筛选培养基
在本发明中,基因型、模块表述说明如下:
以Leu2up_G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8-Leu2down和leu2Δ::G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8为例,其中,“_”用以分割独立转录单元,“-”用以连接转录单元中各个元件;
leu2Δ::用以表示,酿酒酵母基因组上leu2基因被后面的G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8片段所取代。
这里需要说明的是gal1,7,10,在酿酒酵母中gal1、gal7和gal10三个基因是连续排列在基因组上的,所以这个位点的整合会导致直接丢失这三个基因,因而这个整合位点被记作gal1,7,10。
本发明提供的酿酒酵母工程菌株及其构建方法、应用中所用质粒等生物材料均可由市场购得,引物序列均可由生物公司合成。
下面结合实施例,进一步阐述本发明:
实施例1 菌株的构建
本实施例中所有需要菌株和质粒如表1所示:
表1 构建所涉及的所有菌株和质粒
本实验采用CEN.PK2.1C(来源)为底盘菌进行菌株的构建,利用强启动子Pgal1和Pgal10过表达MVA途径上所有酵母内源基因(ERG10,ERG13,tHMG1,ERG8,ERG19,ERG20,ERG12,IDI1)增加前体物FPP的通量,其中,MVA途径中的限速酶tHMG1(截短的內源HMG1基因),过表达3份,以上改造均整合在基因组上。青蒿酸合成中的关键基因ADS和CYP71AV1在pRS425多拷贝质粒上用Pgal1和Pgal10进行过表达。其余相关基因AaCPR1(源于A.annua的细胞色素P450还原酶),AaCYB5(源于A.annua的细胞色素b5),AaADH1以及AaALDH1均整合在基因组上。同时,为了使过表达的基因正常工作,敲除了抑制Pgal启动子的gal80基因,同时为了减少细胞代谢负担敲除了半乳糖代谢相关基因gal1,gal7和gal10。最终菌株SyBE_Sc01130085的基因型如下表所示:
表2 SyBE_Sc01130085的基因型
菌株SyBE_Sc01130085的基因构建方法具体如下:
1.基本元件的合成
本实验所需所有外源基因和片段(ADS,CYP71AV1,AaALDH1,AaCPR1,AaADH1,AaCYB5,hphA,pAgTEF1,AgTEF1t)的序列全部通过网上基因设计软件GeneDesign(www.genedesign.org)来进行设计,各基因的DNA序列和蛋白序列编号如下,具体序列见序列表:
ADS的DNA序列见SEQ ID NO:1,蛋白序列参考GI号:114149227;
CYP71AV1的DNA序列见SEQ ID NO:2,蛋白序列参考GI号:122225321;
AaCPR1的DNA序列见SEQ ID NO:3,蛋白序列参考GI号:83854017;
AaCYB5的DNA序列见SEQ ID NO:4,蛋白序列参考GI号:422779535;
AaALDH1的DNA序列见SEQ ID NO:5,蛋白序列参考GI号:422034338;
AaADH1的DNA序列见SEQ ID NO:6,蛋白序列参考GI号:336109264;
tHMG1的DNA序列见SEQIDNO:7,蛋白序列参考GI号:587536;
ERG13的DNA序列见SEQIDNO:8,蛋白序列参考GI号:1023941427;
ERG20的DNA序列见SEQIDNO:9,蛋白序列参考GI号:1008358;
IDI1的DNA序列见SEQIDNO:10,蛋白序列见参考GI号:285815425;
ERG12的DNA序列见SEQIDNO:11,蛋白序列参考GI号:1023941776;
ERG10的DNA序列见SEQIDNO:12,蛋白序列参考GI号:1023940179;
ERG19的DNA序列见SEQIDNO:13,蛋白序列参考GI号:6324371;
ERG8的DNA序列见SEQIDNO:14,蛋白序列参考GI号:1023941787;
AaDBR2的DNA序列见SEQIDNO:15,蛋白序列参考GI号:494114617。
其中,外源基因片段ADS,CYP71AV1,AaALDH1,AaCPR1,AaADH1,AaCYB5的序列按照S.cerevisiae密码子优化进行反转录获得,hphA,pAgTEF1,AgTEF1t的序列与质粒pAG32相同,nat1序列与pAG25相同(这些质粒全序列可从NCBI数据库中获得),pAgTEF1,AgTEF1t内均包含loxP位点。将这些序列通过GeneDesign拆分成50-60bp的引物,通过PCR组装这些引物合成相应基因片段,所有基因均连入pEasy-Blunt载体中。
以SyBE_Ec01130027(含pAgTEF1基因片段)为例,质粒构建的具体操作流程如下:
1)将pAgTEF1的DNA序列利用GeneDesign软件拆分成引物序列,共14条,记作pAgTEF1.01至pAgTEF1.14(具体序列见引物列表),由金维智公司合成。
2)将所合成的引物用水稀释至10uM的浓度,等体积混合。
3)以2)中的引物混合物为模板进行第一轮PCR。体系:20μL,其中双蒸水13.3μL,5×fastpfu buffer 4μL,10mM dNTP 0.5μL,模板2μL,Fastpfu(2.5U/μL)0.2μL;反应条件:(1)95℃5min(2)95℃30s,69℃(每个循环降低1℃),72℃30s共30个循环(3)72℃5min(4)4℃保存(Fastpfu,及Fastpfu buffer由全式金公司提供)。
4)以3)中的PCR产物为模板,pAgTEF1.01和pAgTEF1.14为引物进行第二轮PCR。体系20μL,其中双蒸水12.5μL,5×fastpfu buffer 4μL,10mM dNTP 0.5μL,模板2μL,引物各0.4μL,Fastpfu(2.5U/μL)0.2μL;反应条件:(1)95℃5min(2)95℃30s,55℃,72℃30s共30个循环(3)72℃5min(4)4℃保存。
5)将4)中PCR产物克隆至pEASY-Blunt载体中,具体过程见全式金公司pEASY-Blunt Cloning Kit产品说明书。
6)挑去测序正确的克隆进行后续工作。
质粒SyBE_Ec01110022(含AaCYB5基因片段)、SyBE_Ec01110024(含ADS基因片段)、SyBE_Ec01110027(含CYP71AV1基因片段)、SyBE_Ec01110030(含AaCPR1基因片段)、SyBE_Ec01110032(含AaALDH1基因片段)、SyBE_Ec01110033(含AaADH1基因片段)、SyBE_Ec01130025(含hphA基因片段)、SyBE_Ec01130026(含nat1基因片段)、SyBE_Ec01130027(含pAgTEF1基因片段)、SyBE_Ec01130028(含AgTEF1t基因片段)均由此方法构建。
2.模块的构建
该部分共构建出9个质粒:
SyBE_Ec01130008(含模块A:Ade1up_tHMG1-Pgal1,10-IDI1_ADE1),
SyBE_Ec01130009(含模块U:Ura3up_tHMG1-Pgal1,10-ERG13_URA3),
SyBE_Ec01130010(含模块T:Trp1up_tHMG1-Pgal1,10-ERG20_TRP1),
SyBE_Ec01130017(含模块L:Leu2up_G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8-Leu2down),
SyBE_Ec01130024(含模块N:Gal7up_Pgal3-AaCPR1-CYC1t_NATR_Gal1down),
SyBE_Ec01130018(含模块H:His3up_HPHR_Pgal7-AaALDH1-TDH1t_ERG12-gal1,10-ERG10-His3down),
SyBE_Ec01130016(含模块G:Gal80up_URA3_Pgal7-AaADH1-TDH1t_Gal80down),
SyBE_Ec01130020(含模块1:pRS425_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t),
SyBE_Ec01130021(含模块2:pRS425_Pgal7-AaDBR2-CYC1t_ADH1t-CYP71AV1-Pgal10,1-ADS-PGK1t)。
其中前7个质粒所含模块(模块A、U、T、L、H、G、N)均用于整合酵母基因组;SyBE_Ec01130020为过渡质粒,SyBE_Ec01130021直接用做最终菌株的2u多拷贝质粒。具体构建方法如下(构建模块所需所有引物序列见表3):
1)SyBE_Ec01130008的构建,
片段Ade1up、tHMG1、Pgal1,10、IDI1、ADE1均以CEN.PK2.1D基因组为模板通过PCR扩增获得,其中Ade1up用引物A-ADE1up-F,A-ADE1up-R扩增获得,tHMG1片段用引物A-tHMG1-F,A-tHMG1-R扩增获得,Pgal1,10用引物A-pGal1,10-F和A-pGal1,10-R扩增获得,IDI1片段用A-IDI1-F,A-IDI1-R扩增获得,ADE1用A-ADE1-F和A-ADE1-R扩增获得。载体pRS425经限制性内切酶PstI(从NEB购买)消化后,得到线性化片段,将这个片段与Ade1up、tHMG1、Pgal1,10、IDI1、ADE1等摩尔比混合后进行Gibson组装得到SyBE_Ec01130008。Gibson组装具体操作如下:
配制反应体系20μL,其中,Tris-PEG溶液(25%PEG8000,500mM Tris-HCL,pH=7.5)4μL,50mM MgCl2溶液4μL,2.5mM dNTP溶液1.6μL,1M DTT溶液0.2μL,50mM NAD+溶液0.2μL,40U/μL Taq ligase 2μL,0.2U/μL T5exonuclease 0.4μL,2U/μL phusion DNA polymerase 0.25μL,需要组装的DNA片段混合物9μL。将体系置于50℃反应1个小时后,取5μL转化50μL E.coli感受态细胞。然后,先通过菌落PCR或酶切验证筛选出组装成功的克隆,再通过测序得到测序正确可用于后续使用的正确克隆。(下文中所用的Gibson方法与此相同,不再做详细描述)
2)SyBE_Ec01130009的构建
URA3以pRS426为模板,U-URA3-F和U-URA3-R为引物通过PCR扩增获得。Ura3up、tHMG1、Pgal1,10、ERG13以CEN.PK2.1C基因组为模板通过PCR扩增获得,其中Ura3up用引物U-Ura3up-F和U-Ura3up-R扩增获得,tHMG1用U-tHMG1-F和U-tHMG1-R扩增获得,Pgal1,10用引物U-Pgal1,10-F和U-Pgal1,10-R扩增获得,ERG13用U-ERG13-F和U-ERG13-R扩增获得,URA3通过U-URA3-F和U-URA3-R扩增获得。将该5个片段与使用PstI处理过的pRS425混合进行Gibson组装得到SyBE_Ec01130009。
3)SyBE_Ec01130010的构建
TPR1以pRS424为模板,以T-TPR1-F和T-TPR1-R为引物扩增获得,Trp1up、tHMG1、Pgal1,10、ERG20以CEN.PK2.1C基因组为模板通过PCR扩增获得,其中TRP1用引物T-Trp1up-F和T-Trp1up-R扩增获得,tHMG1用T-tHMG1-F和T-tHMG1-R扩增获得,Pgal1,10用引物T-Pgal1,10-F和T-Pgal1,10-R扩增获得,ERG20用T-ERG20-F和T-ERG20-R扩增获得。将该5个片段与使用PstI处理过的pRS425混合进行Gibson组装得到SyBE_Ec01130010。
4)SyBE_Ec01130017的构建
Leu2up、Pgal7、CYC1t、Pgal1,10、ERG19、ERG8、Leu2down以CEN.PK2.1D基因组为模板通过PCR扩增获得,其中Leu2up用L-Leu2up-F和L-Leu2up-R扩增获得,Pgal7用L-Pgal7-F和L-Pgal7-R扩增获得,CYC1t用L-CYC1t-F和L-CYC1t-R扩增获得,ERG19用L-ERG19-F和L-ERG19-R扩增获得,Pgal1,10用L-Pgal1,10-F和L-Pgal1,10-R扩增获得,ERG8用L-ERG8-F和L-ERG8-R扩增获得,Leu2down用L-Leu2down-F和L-Leu2down-R扩增获得。AaCYB5以SyBE_Ec01110022为模板,L-AaCYB5-F和L-AaCYB5-R为引物通过PCR扩增获得。G418R由3部分组成:pAgTEF1,Kan,AgTEF1t,先通过PCR分别获得这3个片段,其中pAgTEF1以SyBE_Ec01130027为模板,pAgTEF1-F,pAgTEF1-R为引物扩增获得;AgTEF1t以SyBE_Ec01130028为模板,AgTEF1t-F和AgTEF1-R为引物扩增获得;Kan以YNL280C为模板,kan-F和kan-R扩增获得。然后,将3个片段为模板通过OE-PCR,以L-G418R-F和L-G418R-R为引物扩增获得G418R。
因片段较多,为了Gibson组装提高效率,先将部分片段用OE-PCR拼接起来。以片段Leu2up和G418R为模板,L-leu2up-F和L-G418R-R为引物PCR扩增得到Leu2up-G418R片段;以片段Pgal7、AaCYB5、CYC1t为模板,L-Pgal7-F和L-CYC1t-R为引物扩增得到Pgal7-AaCYCB5-CYC1t;以ERG19、Pgal1,10、ERG8为模板,L-ERG19-F和L-ERG8-R为引物扩增得到ERG19-Pgal1,10-ERG8。最后,将Leu2up-G418R、Pgal7-AaCYB5-CYC1t、ERG19-Pgal1,10-ERG8、Leu2down和用PstI处理过的pRS425这5个片段混合通过Gibson组装构建出质粒SyBE_Ec01130017。
5)SyBE_Ec01130024的构建
片段Gal7up、Pgal3、CYC1t、Gal1down以CEN.PK2.1C基因组为模板PCR扩增获得,其中Gal7up用引物N-Gal7up-F和N-Gal7up-R扩增获得;Pgal3用引物N-Pgal3-F和N-Pgal3-R扩增获得;CYC1用N-CYC1t-F和N-CYC1t-R扩增获得;Gal1down用N-Gal1down-F和N-Gal1down-R扩增获得。AaCPR1以SyBE_Ec00011130为模板,N-AaCPR1-F和N-AaCPR1-R扩增获得。NatR由pAgTEF1、nat1、AgTEF1t三个片段通过OE-PCR组装而成,其中pAgTEF1和AgTEF1t扩增方法同上,nat1以SyBE_Ec01130026为模板,nat-F和nat-R为引物扩增获得。NATR以这3个片段为模板,N-NatR-F和N-NatR-R为引物扩增获得。将Gal7up、Pgal3、CYC1t、Gal1down、AaCPR1、NatR这6个片段与用PstI单酶切处理过的pRS425混合通过Gibson组装构建质粒SyBE_Ec01130024。
6)SyBE_Ec01130018
His3up、Pgal7、TDH1t、Pgal1,10、ERG12、ERG10、Leu2down以CEN.PK2.1C基因组为模板通过PCR扩增获得,其中His3up用H-His3up-F和H-His3up-R扩增获得,Pgal7用H-Pgal7-F和H-Pgal7-R扩增获得,TDH1t用H-TDH1t-F和H-TDH1t-R扩增获得,ERG10用H-ERG10-F和H-ERG10-R扩增获得,Pgal1,10用H-Pgal1,10-F和HPgal1,10-R扩增获得,ERG12用H-ERG12-F和H-ERG12-R扩增获得,His3down用H-His3down-F和H-His3down-R扩增获得。AaALDH1以SyBE_Ec00011132为模板,H-AaALDH1-F和H-AaALDH1-R为引物通过PCR扩增获得。HPHR由3部分组成:pAgTEF1,hphA,AgTEF1t,其中pAgTEF1,AgTEF1t获得方式同上,hphA以SyBE_Ec01130025为模板,hphA-F和hphA-R扩增获得。然后,将3个片段为模板通过OE-PCR,以H-HphR-F和H-HphR-R为引物扩增获得。
以片段His3up和HphR为模板,H-His3up-F和H-HphR-R为引物PCR扩增得到His3up-HphR片段;以片段Pgal7、AaALDH1、TDH1t为模板,H-Pgal7-F和H-TDH1t-R为引物扩增得到Pgal7-AaALDH1-TDH1t;以ERG10、Pgal1,10、ERG12为模板,H-ERG12-F和H-ERG10-R为引物扩增得到ERG12-Pgal1,10-ERG10。最后,将His3up-HPHR、Pgal7-AaALDH1-TDH1t、ERG12-Pgal1,10-ERG10、His3down和用PstI处理过的pRS425这五个片段混合通过Gibson组装构建出质粒SyBE_Ec01130018。
7)SyBE_Ec01130016的构建
Gal80up、Pgal7、TDH1t、Gal80down以CEN.PK2.1C基因组为模板PCR扩增获得,其中Gal80up用引物G-Gal80up-F和G-Gal80up-R扩增获得;Pgal7用引物G-Pgal7-F和G-Pgal7-R扩增获得;TDH1t用G-TDH1t-F和G-TDH1t-R扩增获得;Gal80down用G-Gal80down-F和N-Gal80down-R扩增获得。AaADH1以SyBE_Ec00011133为模板,G-AaADH1-F和G-AaADH1-R扩增获得。URA3以pRS426为模板,以G-URA3-F和G-URA3-R为引物扩增获得。将Gal80up、Pgal7、TDH1t、Gal80down、AaADH1、URA3这6个片段与用PstI单酶切处理过的pRS425混合通过Gibson组装构建质粒SyBE_Ec01130016。
8)SyBE_Ec01130020的构建
ADH1t、Pgal1,10、PGK1t以CEN.PK2.1C基因组为模板PCR扩增获得,其中ADH1t用引物2u-ADH1t-F和2u-ADH1t-R扩增获得;Pgal1,10用引物2u-Pgal1,10-F和2u-Pgal1,10-R扩增获得;PGK1t用2u-PGK1t-F和2u-PGK1t-R扩增获得;ADS以SyBE_Ec00011124为模板,2u-ADS-F和2u-ADS-R为引物扩增获得;CYP71AV1以SyBE_Ec00011127为模板,2u-CYP71AV1-F和2u-CYP71AV1-R为引物扩增获得。将ADH1t、Pgal1,10、PGK1t、ADS、CYP71AV1与用PstI处理过的pRS425混合,通过Gibson组装构建出质粒SyBE_Ec01130020。
9)SyBE_Ec01130021的构建
片段AaDBR2以SyBE_Ec01130100为模板,以DCA-DBR2-F和DCA-DBR2-R为引物通过PCR扩增获得;片段CYC1t以CEN.PK2.1C基因组为模板,以DCA-CYC1t-F和DCA-CYC1t-R为引物通过PCR扩增获得;片段Pgal7以CEN.PK2.1C基因组为模板,以DCA-Pgal7-F和DCA-Pgal7-R为引物通过PCR扩增获得。以片段AaDBR2、CYC1t、Pgal7混合物为模板,以DCA-Pgal7-F和DCA-CYC1t-R为模板,通过PCR扩增出Pgal7-AaDBR2-CYC1t片段。这个片段与质粒SyBE_Ec01130020都用XhoI和PstI进行双酶切处理,处理后的DNA片段用T4连接酶进行连接,最后将连接产物转化至E.coli感受态细胞,通过菌落PCR或酶切验证筛选出组装成功的克隆,再经测序验证后,得到质粒SyBE_Ec01130021。
3.产二氢青蒿酸菌株的构建
从菌株CEN.PK2.1C出发,依次导入2中所构建的模块和质粒,经SyBE_Sc01130001,SyBE_Sc01130002,SyBE_Sc01130003,SyBE_Sc01130004,SyBE_Sc01130005,SyBE_Sc01130027,SyBE_Sc01130057最终获得菌株SyBE_Sc01130085。每步酵母的构建过程如下:
1)SyBE_Sc01130001(CEN.PK2.1C,ade1Δ::tHMG1-Pgal1,10-IDI1_ADE1)的构建
该模块整合标签为ADE1,所以需要先对宿主菌的ADE1进行敲除。首先以pWJ1042为模板,用KlURA3ade1-F和KlURA3ade1-R扩增出A-KlURA3-1,再以这个片段为模板,用KlURA3ade1-F2和KlURA3ade1-R2扩增出A-KlURA3-2,将这个片段经酵母转化导入CEN.PK2.1C中菌株敲除ADE1,在Sc-ura的培养基挑选出红色菌落,得到菌株ScA,再以这个菌为宿主进行后续整合。
将质粒SyBE_Ec01130008用PmeI酶切,释放模块A,通过琼脂糖凝胶电泳分离模块A的片段,将该片段通过酵母转化导入ScA中,在5-FOA的平板中筛选,得到菌株SyBE_Sc01130001。
2)SyBE_Sc01130002(SyBE_Sc01130001,ura3Δ::tHMG1-Pgal1,10-ERG13)的构建
将质粒SyBE_Ec01130009用PmeI酶切,释放模块U,通过琼脂糖凝胶电泳分离模块U的片段,将该片段通过酵母转化导入SyBE_Sc01130001中,在Sc-ura的平板中筛选,得到菌株ScAU。
因其他模块中也有以URA3为标签的模块,所以在向宿主导入模块U需要敲除URA3。所以先以pRS426为模板扩增ΔuraF和ΔuraR,其中ΔuraF用ΔuraF-F和ΔuraF-R扩增获得,ΔuraR用ΔuraR-F和ΔuraR-R扩增获得。再将ΔuraF和ΔuraR片段利用OE-PCR进行拼接,以ΔuraF-F和ΔuraR-R为引物扩增出Δura。将片段Δura经酵母转化导入ScAU中,以回收URA3得到SyBE_Sc01130002。
3)SyBE_Sc01130003(SyBE_Sc01130002,gal1,7,10Δ::Pgal3-AaCPR1-CYC1t_NATR)的构建
将质粒SyBE_Ec01130024用PmeI酶切,释放模块N,通过琼脂糖凝胶电泳分离模块N的片段,将该片段通过酵母转化导入SyBE_Sc01130002中,在含100mg/L诺尔斯菌素的YPD平板中筛选,得到菌株SyBE_Sc01130003。
4)SyBE_Sc01130004(SyBE_Sc01130003,trp1Δ::tHMG1-Pgal1,10-ERG20_TPR1)的构建
将质粒SyBE_Ec01130010用PmeI酶切,释放模块T,通过琼脂糖凝胶电泳分离模块T的片段,将该片段通过酵母转化导入SyBE_Sc01130003中,在Sc-trp的平板中筛选,得到菌株SyBE_Sc01130004。
5)SyBE_Sc01130005(SyBE_Sc01130004,leu2Δ:G418R_Pgal7-AaCYB5-CYC1t_ERG19-Pgal1,10-ERG8)的构建
将质粒SyBE_Ec01130017用PmeI酶切,释放模块L,通过琼脂糖凝胶电泳分离模块L的片段,将该片段通过酵母转化导入SyBE_Sc01130004中,在含200mg/L的YPD平板中筛选,得到菌株SyBE_Sc01130005。
6)SyBE_Sc01130027(SyBE_Sc01130005,his3Δ::His3_Pgal7-AaALDH1-TDH1t_ERG12-Pgal1,10-ERG10)的构建
以pRS423为模板,H-His3a-F和H-His3a-R为引物通过PCR扩增获得H-His3a;以SyBE_Ec01130018为模板,H-His3b-F和H-His3b-R为引物通过PCR扩增获得H-His3b。再以H-His3a和H-His3b的等摩尔混合物为模板,以H-His3a-F和H-His3b-R为引物扩增出H-His3。将质粒SyBE_Ec01130018用PmeI和XhoI双酶切,释放模块H,通过琼脂糖凝胶电泳分离模块H的片段,将该片段与H-His3共转化导入SyBE_Sc01130005中,在Sc-his的平板中筛选,得到菌株SyBE_Sc01130027。
7)SyBE_Sc01130057(SyBE_Sc011300027,gal80Δ::URA3_Pgal7-AaADH1-TDH1t)的构建
将质粒SyBE_Ec01130016用PmeI酶切,释放模块G,通过琼脂糖凝胶电泳分离模块G的片段,将该片段通过酵母转化导入SyBE_Sc01130027中,在Sc-ura平板中筛选,得到菌株SyBE_Sc01130057。
8)SyBE_Sc01130085(SyBE_Sc01130057,pRS425_Pgal7-AaDBR2-CYC1t_ADH1t-CYP71AV1-Pgal1,10-ADS-PGK1t)的构建
将质粒SyBE_Ec01130021经酵母转化直接导入SyBE_Sc01130057中,在Sc-leu平板中筛选,得到菌株SyBE_Sc01130085。
表3 构建模块所需所有引物列表(不含合成基因所需引物)
实施例2 菌株发酵特性表征
1.种子制备
将构建好的菌株SyBE_Sc01130085在Sc固体培养基(20g/L葡萄糖,6.7g/L酵母氮源,20g/L琼脂粉)上划线,30℃培养3天。之后,挑取单菌落,接入3mL种子培养基中,于30℃培养24h,待OD600至5时,取1.2mL培养物分装转接至4瓶50mL种子培养基中,初始OD600约为0.05,于30℃培养24h以备发酵罐接种使用。种子培养基配方如下:20g/L葡萄糖,8g/L KH2PO4,15g/L(NH4)2SO4,9.25g/L MgSO4·7H2O,10mL/L金属离子溶液,12mL/L维生素溶液。其中,金属离子溶液含5.57g/L ZnSO4·7H2O,0.32g/L MnCl2·4H2O,0.47g/L CoCl2·6H2O,0.32g/L CuSO4,0.48g/L Na2MoO4·2H2O,2.9g/L CaCl2·2H2O,2.8g/L FeSO4·7H2O和80mL/L 0.5M EDTA,pH=8;维生素溶液含0.05g/L生物素,1g/L泛酸钙,1g/L烟酸,25g/L肌醇,1g/L盐酸硫胺素,1g/L盐酸吡哆醇,0.2g/L对氨基苯甲酸和2g/L硫酸腺嘌呤。
2.发酵罐配制与接种
将16g KH2PO4,30g(NH4)2SO4,3.4g柠檬酸溶解于1596mL蒸馏水中加入发酵罐中,121℃高压灭菌20分钟。之后向发酵罐中加入经高压灭菌的715g/L水合葡萄糖60mL,经过滤灭菌的185g/L MgSO4·7H2O溶液100mL,金属离子溶液20mL,维生素溶液24mL,及400mL萃取剂IPM(十四酸异丙酯)。最后,加入200mL种子培养物,开始发酵,总发酵体积为2L,成分与种子培养基相同,初始OD600约为0.7。
3.发酵条件和控制
发酵温度控制在30℃,pH控制在5.05,其中控制pH所用碱液中含2.5M氨水与7.5M NaOH,通气量为1.5vvm,溶氧与搅拌关联,控制溶氧在40%,搅拌转速最低300rpm,最高700rpm。在葡萄糖耗尽时开始以流加方式补料,起初补357g/L水合葡萄糖,待OD600达到50后停止补葡萄糖,待乙醇耗尽时开始补95%乙醇,整个补料过程控制培养基内葡萄糖浓度为0,开始补乙醇后控制乙醇浓度小于5g/L。每24h根据补充的葡萄糖和乙醇的总体积添加其体积1/10补料盐溶液(80g/L KH2PO4,92.25g/L MgSO4·7H2O,35g/L K2SO4,Na2SO4,100mL/L金属离子溶液,120mL/L维生素溶液)。
4.产物提取与检测
将从发酵罐中取的样品离心,分离出上层IPM有机相,用甲醇溶解稀释后进紫外-高效液相色谱进行产物测定,稀释倍数根据产物浓度有所不同(10-200倍)。高效液相色谱仪器方法如下:色谱柱为Thermo C18高效液相色谱柱(4.6mmX150mmX5μm),柱温25℃;进样量为10μL,总流速为1mL/min,流动相A为乙腈+0.1%甲酸,流动相B为65%乙腈+0.1%甲酸水溶液,梯度程序如下:0-3min,维持0%A,100%B;3-10min A由0%均匀上升至100%;10-13min维持100%A;13min-15min A相由100%均匀下降至0%,并维持0%A,100%B至20min。检测194nm紫外吸收,青蒿酸于8.5min出峰,二氢青蒿酸于7.5min出峰,如图2所示,图2-1为二氢青蒿酸标品,图2-2为二氢青蒿酸标品,图2-3为样品,黑色三角指示的峰为青蒿酸,红色三角指示为二氢青蒿酸。
5.产物鉴定
为了方便产物鉴定,所用萃取剂更换为十二烷,并用摇瓶进行发酵。培养基成分如下:8g/L KH2PO4,9.225g/L MgSO4.7H2O,15g/L(NH4)2SO4,10ml/L金属离子溶液,12mL/L维生素溶液,葡萄糖40g/L,乙醇20g/L,其中,维生素溶液和金属离子溶液配方同上。发酵培养基体积25ml,萃取剂5ml,30度培养120小时。发酵结束后将培养基离心,分离出上清,经正己烷稀释后,用GC-TOF/MS对产物进行鉴定。同时,以正己烷稀释的二氢青蒿酸标准品为对照。
色谱条件:DB-5MS毛细管色谱柱(30m×0.25mm×0.25μm);升温程序为:初始温度100℃,保持2min,以8℃·min-1的速率升温至160℃;以25℃·min-1速率升温至250℃,保持5min;进样口温度设定250℃,分流进样(分流比1:50),进样体积1μL。质谱条件:EI+电离源;电子能量70eV;离子源温度设定为250℃;溶剂延迟时间为5min;质量扫描方式选择全离子扫描;质谱结果如图3所示。图3-1为样品质谱图,图3-2为标准品质谱图,二者图谱近似,可判断为同一物质。
6.发酵结果
发酵过程中OD值变化曲线见图4。产物产量测试结果见图5,该测试含有A、B两个平行,二氢青蒿酸产量最高可达1.17g/L。(AA为青蒿酸,DA为二氢青蒿酸)
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!