PRRSV诱导猪脾细胞氧化胁迫模型的建立方法与流程
本发明属于病毒诱导免疫细胞氧化胁迫模型技术领域,尤其涉及一种PRRSV诱导猪脾细胞氧化胁迫模型的建立方法。
背景技术:
氧化应激是指细胞内氧化和抗氧化系统失衡,导致活性氧(ROS)自由基产生速率大于清除速率,从而引起细胞和组织损伤的一种病理状态。氧化损伤主要包括生物膜脂质过氧化、细胞内蛋白及酶变性、DNA损害,最后导致细胞死亡或凋亡,并引发疾病。病毒感染是导致多种疾病的直接原因,并与氧化损伤密切相关;一方面,病毒感染引起ROS释放;另一方面,感染使吞噬细胞活化并释放如TNF和IL-1等前氧化性细胞因子。机体通过维持氧化物和抗氧化物平衡来保持正常状态,而病毒可以影响细胞内抗氧化系统,如谷胱甘肽(GSH)水平和诱生型一氧化氮合酶(iNOS)活性,增加细胞的前氧化物如NO,从而引起细胞凋亡。
猪繁殖与呼吸综合征病毒(PRRSV)是猪繁殖与呼吸综合征的主要病原,能感染诱发机体免疫抑制,造成免疫失败、继发感染及其他疾病,给世界养猪业造成巨大经济损失。
技术实现要素:
:
本发明要解决的技术问题是提供一种PRRSV诱导猪脾细胞氧化胁迫模型的建立方法,为后续深入研究PRRSV的感染机制和开发应用于PRRSV感染的制剂提供技术平台和理论参考。
为解决上述技术问题,本发明采用以下技术方案:PRRSV诱导猪脾细胞氧化胁迫模型的建立方法,采用PRRSV体外与猪脾细胞共培养,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-4,感染时间为4-48h。
病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的10-2,感染时间为4h。
上述PRRSV诱导猪脾细胞氧化胁迫模型的建立方法,包括以下步骤:
设细胞对照组和病毒组,调节细胞浓度为5×106个/mL,按500μL/孔加至24孔板内,对照组加500μL培养液,实验组分别加入500μL病毒液,置于37℃,5%CO2培养44h后每孔弃去10μL上清液,加入10μL MTT(5mg/mL),继续孵育4h后离心并弃掉上清液,每孔加入100μL DMSO,摇匀使颗粒溶解后静置10min,用酶标仪测定490nm波长处吸光度值;
分别收集细胞上清液或细胞,用于测定表征氧化胁迫模型的相关指标。
猪脾细胞为猪原代脾细胞。
病毒组中病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100、10-1、10-2、10-3、10-4。
PRRSV病毒与细胞吸附时间为2h。
收集细胞上清液或细胞在培养后第4h、8h、12h、24h、48h。
相关指标包括NO、ROS、GSH、GSSG、XOD、MPO和iNOS。
猪脾细胞按以下操作制备:无菌取仔猪脾脏,除去表面血渍及纤维组织,用灭菌的注射器内芯在PBS(pH 7.2)缓冲液中研磨组织,200目尼龙滤网过滤,收获的脾细胞滤液经过1500rpm,5min离心后,去除上清液;接着加入10mL的Tris-NH4Cl溶液,悬浮沉淀细胞,37℃培养箱内放置10min,使红细胞充分裂解,1500rpm,离心5min,弃上清;用PBS液和培养液分别各洗涤一次后用10%FBS的RPMI 1640完全培养液重悬细胞,200目尼龙滤网再过滤一次,收集细胞滤液;台盼蓝拒染后测定活细胞数,当活细胞数大于95%后计数,备用。
为研究PRRSV体外诱导猪脾细胞氧化应激,发明人以猪原代脾细胞为研究对象,建立了一种PRRSV诱导猪脾细胞氧化胁迫模型的建立方法,采用PRRSV体外与猪脾细胞共同培养,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-4,感染时间为4-48h。应用本发明,利用不同浓度PRRSV作用不同时间,通过检测细胞存活率,NO释放,细胞内ROS水平,GSH和GSSG含量,XOD、MPO和iNOS活性等指标,可以确定建立PRRSV体外诱导猪脾细胞氧化胁迫模型的最佳条件,为阐明PRRSV体外诱导猪脾细胞氧化应激与疾病的发生发展的关系提供了有力的理论依据,也为后续深入研究PRRSV的感染机制和开发应用于PRRSV感染的制剂提供技术平台和理论参考。
附图说明
图1是PRRSV对猪脾细胞存活率的影响图。
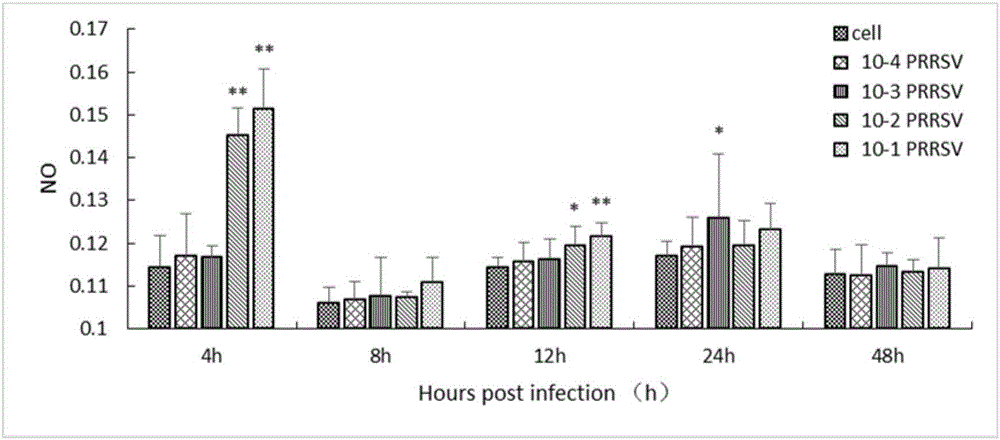
图2是PRRSV体外对猪脾细胞对NO分泌的影响图。
图3是PRRSV体外对猪脾细胞内ROS水平的影响图。
图4是PRRSV体外对猪脾细胞内GSH含量的影响图。
图5是PRRSV体外对猪脾细胞内GSSG含量的影响图。
图6是PRRSV体外对猪脾细胞内GSH/GSSG的影响图。
图7是PRRSV体外对猪脾细胞内XOD活力的影响图。
图8是PRRSV体外对猪脾细胞内MPO活力的影响图。
图9是PRRSV体外对猪脾细胞内iNOS活力的影响图。
具体实施方式
一、研究思路
本发明通过PRRSV体外与猪脾细胞共同培养,测定细胞分泌一氧化氮(NO)的水平、细胞内总活性氧(ROS)水平、还原型谷胱甘肽(GSH)含量、氧化型谷胱甘肽(GSSG)含量、黄嘌呤氧化酶(XOD)活性、髓过氧化物酶(MPO)活性、诱生型一氧化氮合酶(iNOS)活性,探讨PRRSV体外诱发猪脾细胞氧化应激的因素,建立猪脾细胞氧化胁迫体外模型。
二、实验方法
(1)猪脾细胞的制备:无菌取仔猪脾脏,除去表面血渍及纤维组织,用灭菌的注射器内芯在PBS(pH 7.2)缓冲液中研磨组织,200目尼龙滤网过滤,收获的脾细胞滤液经过1500rpm,5min离心后,去除上清液。接着加入10mL的Tris-NH4Cl溶液,悬浮沉淀细胞,37℃培养箱内放置10min,使红细胞充分裂解,1500rpm,离心5min,弃上清。用PBS液和培养液分别各洗涤一次后用10%FBS的RPMI 1640完全培养液重悬细胞,200目尼龙滤网再过滤一次,收集细胞滤液。台盼蓝拒染后测定活细胞数,当活细胞数大于95%后计数,备用。
(2)设细胞对照组和5个不同梯度病毒组(100、10-1、10-2、10-3、10-4),调节细胞浓度为5×106个/mL,按500μL/孔加至24孔板内,对照组加500μL培养液,实验组分别加入500μL不同浓度病毒液,使病毒终浓度分别为100、10-1、10-2、10-3、10-4,置于37℃,5%CO2培养44h后每孔弃去10μL上清液,加入10μL MTT(5mg/mL),继续孵育4h后离心并弃掉上清液,每孔加入100μL DMSO,摇匀使颗粒溶解后静置10min,用酶标仪测定490nm波长处吸光度值。其中,PRRSV病毒原液的TCID50为10-5.5/0.1mL。
(3)分别在培养后第4h、8h、12h、24h、48h分别收集细胞上清液或细胞,用于测定表征氧化胁迫模型的相关指标(肝脏丙二醛含量、谷胱甘肽含量、谷胱甘肽过氧化物酶活力、T-SOD、总抗氧化力);MTT法检测细胞存活率,Griess法检测NO水平,DCFH-DA荧光探针法检测ROS水平,荧光光度法检测GSH、GSSG水平,分光光度法检测XOD、MPO、iNOS酶活力。
(4)所测得数据用SPSS 21.0统计软件进行统计学处理。所有实验结果以均数±标准差表示,采用单因素方差分析及Duncan多重比较进行统计学分析。以P<0.05表示为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。肩标*表示与对照组相比P<0.05,肩标**表示与对照组相比P<0.01。
三、实验结果
1.猪脾细胞存活率
细胞存活率结果如图1所示,不同稀释度PRRSV体外感染猪脾细胞均能降低细胞存活率,其中10-1稀释度病毒液抑制最为明显,与对照组比较差异极显著(P<0.01)。结果表明10-4~10-2稀释度病毒液细胞存活率较大,分别为92.7%、93.1%和92.1%,适用于造模的后续试验。
2猪脾细胞分泌NO的水平
NO分泌结果如图2所示,PRRSV体外诱导猪脾细胞引起细胞NO分泌增加,且随着作用时间增加逐渐升高。与对照组相比,10-2和10-1稀释度病毒液体外感染猪脾细胞4h和12h均能显著升高猪脾细胞NO的分泌(P<0.05),10-3稀释度病毒液体外与猪脾细胞共培养24h显著升高猪脾细胞NO的分泌(P<0.05)。
3.猪脾细胞内ROS的水平影响
细胞内活性氧水平如图3所示,PRRSV体外诱导猪脾细胞能升高细胞内ROS水平,一定范围内随着作用时间的延长,ROS水平逐渐降低,但始终高于对照组。与对照组相比,各稀释度病毒液体外处理猪脾细胞均能升高细胞内活性氧水平,且差异极显著(P<0.01)。其中感染4h、8h、12h和24h以10-2稀释度病毒液引起细胞活性氧水平最高。
4.猪脾细胞内GSH和GSSG的含量
细胞内还原型谷胱甘肽含量如图4所示,PRRSV体外处理猪脾细胞4h不影响细胞内GSH含量的变化,随着培养时间的增加,病毒处理组细胞内GSH含量明显升高,且随着培养时间增加GSH含量呈逐渐增加趋势。其中,与对照组相比,培养8h时,10-3稀释度病毒液组显著升高细胞内GSH含量(P<0.05),10-1稀释度病毒液组能极显著升高细胞内GSH水平(P<0.01);培养12h时,10-3和10-2稀释度病毒液极显著升高细胞内GSH含量(P<0.01),10-1稀释度病毒液显著升高细胞内GSH含量(P<0.05);培养48h时,各病毒浓度组均能极显著升高细胞内GSH含量(P<0.01)。
细胞内氧化型谷胱甘肽含量如图5所示,PRRSV体外处理猪脾细胞能升高细胞内GSSG含量,且随着培养时间增加GSSG含量呈下降趋势。其中,与对照组相比,感染4h和8h时,各稀释度病毒液组均能极显著升高细胞内GSSG含量(P<0.01);处理12h时,10-2稀释度病毒液极显著升高猪脾细胞内GSSG含量,而10-1稀释度病毒液则显著降低了细胞内GSSG含量(P<0.05);随着培养时间的增加,当感染24h和48h时,只有10-4稀释度病毒液分别能显著(P<0.05)和极显著(P<0.01)升高细胞内GSSG含量。
细胞内氧化还原状态如图6所示,PRRSV体外处理猪脾细胞能降低细胞内GSH/GSSG比值,且随着作用时间的增加呈先降低后上升的趋势。其中与对照组相比,10-3稀释度病毒液处理4h、12h均能显著降低细胞内GSH/GSSG比值(P<0.05);10-2稀释度病毒液处理细胞4h、12h分别能显著(P<0.05)和极显著降(P<0.01)低细胞内GSH/GSSG比值;10-4稀释度病毒液处理细胞12h、24h均能极显著降低细胞内GSH/GSSG比值(P<0.01)。5.猪脾细胞内XOD、MPO和iNOS活力
XOD活力如图7所示,PRRSV体外处理猪脾细胞能升高细胞内黄嘌呤氧化酶活力,且与病毒处理呈浓度依赖性。其中与对照组相比,10-1稀释度病毒液在培养各个时间段均能极显著升高细胞内XOD活力(P<0.01);10-2稀释度病毒液在处理4h、8h和48h均能显著升高细胞内XOD活力(P<0.05),其中8h差异极显著(P<0.01);10-3稀释度病毒液在培养12h和48h时能显著升高细胞内XOD活力(P<0.05);有趣的是,10-4稀释度病毒液处理猪脾细胞8h和12h分别能极显著(P<0.01)和显著(P<0.05)降低细胞内XOD活力。
MPO活力如图8所示,PRRSV体外处理猪脾细胞能升高细胞内髓过氧化物酶活力,且与病毒处理呈浓度依赖性。其中与对照组相比,采用4h、12h和24h,10-2稀释度病毒液分别能极显著(P<0.01)和显著(P<0.05)升高细胞内MPO活力;采用48h,10-1稀释度病毒液能显著升高细胞内MPO活力(P<0.05)。
iNOS活力如图9所示,PRRSV体外处理猪脾细胞能升高细胞内诱生型一氧化氮合酶活力,且随培养时间的增加呈上升趋势,处理24h时达到峰值,当处理48h时,iNOS活力降至最低值。其中与对照组相比,处理4h时,10-3、10-2和10-1稀释度病毒液均能极显著升高细胞内iNOS活力;处理12h,较低稀释度病毒液(10-4、10-3)能显著升高细胞内iNOS活力(P<0.05),较高稀释度病毒液(10-2、10-1)则极显著升高细胞内iNOS活力(P<0.01);处理24h时,10-3和10-2稀释度病毒液能显著升高细胞内iNOS活力(P<0.05),10-1稀释度病毒液则极显著升高细胞内iNOS活力(P<0.01)。
四、研究结论
从实验结果可知,随着病毒浓度的增加及作用时间延长,猪脾细胞存活率下降,NO分泌水平和细胞内XOD、MPO、iNOS活力逐渐升高,细胞内GSH和GSSG含量逐渐增加,GSH/GSSG比值和ROS水平逐渐下降。在10-2PRRSV体外处理猪脾细胞4h条件下,细胞分泌的NO含量极显著高于对照组(P<0.01),细胞内活性氧水平、GSSG含量、MPO活性和iNOS活性均极显著高于对照组(P<0.01),GSH/GSSG比值显著低于对照组(P<0.05),细胞内XOD活力显著高于对照组(P<0.05),且该条件下细胞有较高存活率(93.15%)。因此,PRRSV体外能诱发猪脾细胞氧化应激,选择10-2PRRSV体外处理猪脾细胞4h是建立猪脾细胞氧化胁迫模型的最佳条件。
- 还没有人留言评论。精彩留言会获得点赞!