一种产β‑半乳糖苷酶的克雷伯氏菌及其应用的制作方法
发明涉及一种产β-半乳糖苷酶的克雷伯氏菌及其应用,属于微生物分离、培养技术领域。
技术背景
β-半乳糖苷酶(β-galactosidase),全名为β-D-半乳糖水解酶(β-D-galactoside galcagalcato-hydrolase,EC.3.2.1.23),简称乳糖酶。β-半乳糖苷酶的应用很广泛,在食品加工、医药、免疫、环境监测中均有体现,但以在食品中的应用为主。一方面,它可以应用到乳制品生产中,水解乳糖,提高乳制品甜度、改善风味,降低乳制品中乳糖含量,进而适应乳糖不耐症患者的需求;由于乳糖在低温下溶解性较差,因此当乳糖含量降低时,可以有效防止乳制品冷冻时出现结晶,改善口感等。另一方面,酶的受体为乳糖或者半乳糖等时,可通过转糖苷反应生成低聚半乳糖;低聚半乳糖是一种新型功能性糖,它可以促进益生菌的生长繁殖,提高机体免疫力,同时又具有低能量、低甜度等功能特性。
β-半乳糖苷酶来源非常丰富,广泛存在于植物、微生物、及动物肠道中。但目前用于工业生产的β-半乳糖苷酶仅来源于微生物;其中,细菌、酵母、霉菌均存在多种产β-半乳糖苷酶的菌种;而不同微生物来源的β-半乳糖苷酶的水解活性和转糖苷活性的比例不同。某些微生物,如黑曲霉、乳酸克鲁维酵母、脆壁克鲁维酵母等所产生的β-半乳糖苷酶具有较强的水解活性;而保加利亚乳杆菌、嗜热链球菌、嗜热脂肪芽孢杆菌和米曲霉等所产生的β-半乳糖苷酶则具有较强的转糖苷活性。但是,目前的天然产酶菌株的所产β-半乳糖苷酶的酶活普遍较低,优良天然菌株资源匮乏,因此筛选新型高产酶优良菌株具有主要意义。
技术实现要素:
针对目前的天然产酶菌株所产β-半乳糖苷酶的的酶活普遍较低,优良天然菌株资源匮乏的现状,本发明的目的在于提供一种可产β-半乳糖苷酶的菌株。
本发明还提供了上述可产β-半乳糖苷酶的菌株的应用及其通过发酵获得β-半乳糖苷酶的方法。
技术方案
本发明从土壤中筛选并分离出了一株新的菌株,命名为B5582Y;该菌株B5582Y,于37℃在筛选平板培养基平板培养24h,菌落呈圆形,直径2-5mm,中间凸起,表面光滑、粘稠,不易挑取;经革兰氏染色后呈红色,显微镜观察为革兰氏阴性菌短杆菌,无芽孢生成。所述筛选培养基:乳糖10g/L、胰蛋白胨5g/L、酵母浸粉10g/L、NaCl 4g/L、琼脂20g/L、水余量,pH为7.0。
对本发明的菌株B5582Y进行BIOLOG GEN III生理生化试验,其生理生化特征与克雷伯氏菌相吻合。
对本发明的菌株B5582Y进行16s基因测序,序列SEQ ID NO.3所示。将所得菌株序列通过Genebank序列比对,利用MEGA6建立系统发育树,结果见图1。通过16S rDNA序列系统发育分析,菌株B5582Y鉴定为:克雷伯氏菌,Klebsiella michiganensis。
本发明的克雷伯氏菌(Klebsiella michiganensis)B5582Y,保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏号:CGMCCNo.13035,保藏日期为2016年9月23日。
本发明的克雷伯氏菌B5582Y,能够产β-半乳糖苷酶;所产β-半乳糖苷酶为胞内酶;所产β-半乳糖苷酶具有水解和转糖苷两种活性。
本发明的克雷伯氏菌B5582Y,产β-半乳糖苷酶的能力较强;通过摇瓶发酵10-24h,即可获得水解酶活为12U/mL的发酵液。
本发明的克雷伯氏菌B5582Y,连续传代10代以上,产β-半乳糖苷酶能力不变。
因此,与现有的能产生β-半乳糖苷酶菌株相比,本发明的克雷伯氏菌的特殊之处在于菌株较为新颖,所产β-半乳糖苷酶具有水解和转糖苷两种活性,产β-半乳糖苷酶的能力较强,遗传稳定性好。
本发明还提供了克雷伯氏菌B5582Y的应用,产生β-半乳糖苷酶。
一种采用克雷伯氏菌B5582Y产β-半乳糖苷酶的方法,包括以下步骤:
发酵培养:将克雷伯氏菌B5582Y接种到发酵培养基,于转速160-200r/min、37℃的条件下恒温培养10h-24h,即可获得含有β-半乳糖苷酶的发酵液;
所述发酵培养基:乳糖10-40g/L、硫酸铵0-10g/L、胰蛋白胨5g/L、酵母浸粉0-10g/L、NaCl4g/L、水余量,pH为7.0。
优选的,所述发酵培养基:乳糖40g/L、硫酸铵10g/L、胰蛋白胨5g/L、NaCl 4g/L、水余量,pH为8.0。此时,所获得的发酵液的水解酶活力达到35.7U/mL。
上述方法,还可以包括以下步骤:
β-半乳糖苷酶粗酶液的制备:将发酵液于4℃以8000 rpm离心10 min,将沉淀用pH 6.7的钠盐PBS缓冲液洗涤、离心后,再次加入pH 6.7的PBS缓冲液,冰水浴超声处理10min,然后于4℃以8000 rpm离心10min,取上清液即为β-半乳糖苷酶粗酶液;
超声处理条件:500W、超声1.5s、间歇2s。
上述方法,还可以包括以下步骤:克雷伯氏菌B5582Y接种到发酵培养基之前依次进行平板培养和增殖培养;
平板培养:将克雷伯氏菌B5582Y接种到斜面培养基,37℃恒温培养24h;
增殖培养:将平板培养后的克雷伯氏菌B5582Y取两环接种到增殖培养基,转速160-200r/min、37℃恒温培养24h,得增殖菌液;
其中,所斜面培养基、增殖培养基的pH均为7.0;
每1L斜面培养基含有以下成分:乳糖10g,胰蛋白胨5g,酵母浸粉10g,NaCl 4g,琼脂20g,水余量;
每1L增殖培养基含有以下成分:胰蛋白胨5g,酵母浸粉10g,NaCl 4g,水余量。
本发明所用专业术语说明:
水解酶活力单位(U)定义:在上述条件下,酶催化oNPG反应1 min生成1 μmol的oNP所需酶量定义为1个酶活力单位。
有益效果:
1、本发明的克雷伯氏菌B5582Y的液体发酵液中所产β-半乳糖苷酶具有水解和转糖苷两种活力;
2、通过摇瓶发酵优化,发酵周期12-24h,含有β-半乳糖苷酶的发酵液的水解酶活可达35.7U/mL;
3、与本发明之前的β-半乳糖苷酶相比,同时具备了较高的水解酶活力和较强的转糖苷活力;
4、本菌株遗传稳定性好,操作简单,连续传代10代以上,产β-半乳糖苷酶能力不变。
保藏信息
保藏单位 : 中国微生物菌种保藏管理委员会普通微生物中心
地址:北京市朝阳区北辰西路1号院 中国科学院微生物研究所
保藏日期 :2016年9月23日
保藏编号 :CGMCCNo.13035
分类命名 :克雷伯氏菌(Klebsiella michiganensis)。
附图说明
图1克雷伯氏菌B5582Y系统进化发育树图;
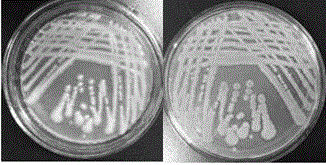
图2克雷伯氏菌B5582Y菌落形态;
图3克雷伯氏菌B5582Y显微观察;
图4酶解前乳糖底物HPLC图;
图5酶解后产物的HPLC图。
具体实施方式
在下面所述的具体实施例中,如无特殊说明,均为本领域常用方法。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件(参考赵瑞香和Gul-Guvend的相关文献)或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明实施例所用培养基如下:
筛选平板培养基:乳糖10g/L、胰蛋白胨5g/L、酵母浸粉10g/L、NaCl 4g/L、琼脂20g/L、水余量,pH为7.0;
斜面培养基:乳糖10g/L、胰蛋白胨5g/L、酵母浸粉10g/L、NaCl 4g/L、琼脂20g/L、水余量,pH为7.0;
增殖培养基:胰蛋白胨5g/L、酵母浸粉10g/L、NaCl 4g/L、水余量,pH为7.0;
基础发酵培养基:乳糖10g/L、胰蛋白胨5g/L、酵母浸粉10g/L、NaCl 4g/L、水余量,pH为7.0。
实施例1克雷伯氏菌B5582Y筛选分离与鉴定
一、克雷伯氏菌(Klebsiella michiganensis)B5582Y筛选分离
称取0.1g采集于河南省新乡市金利尔乳制品厂附近的土样,放进装有无菌水的1.5mL的PE小管中充分震荡均匀;然后用无菌水将其分别稀释成体积浓度为1×10-4、1×10-5两个梯度的稀释液;分别用灭菌的枪头吸取100μL不同梯度的稀释液涂布于预先配制、灭菌的并涂有40mL的20mg/mL x-gal筛选平板培养基中,于37℃培养24-36h。从筛选平板培养基上挑取带有蓝色水解圈的单菌落,划线分离单菌落,将挑取的单菌落中的部分制片镜检判断菌株纯度(显微镜观察菌体为同一形态特征)。如果不是纯菌落,应反复多次划线分离单菌落,直至获得纯菌落为止。将获得的纯菌落用斜面培养基保存,得到菌株纯培养体。
后续复筛:将有具有蓝色透明圈的菌株进行摇瓶培养,制备粗酶液,测定水解酶活,选取水解酶活较高菌株,命名为B5582Y做进一步鉴定。
二、克雷伯氏菌(Klebsiella michiganensis)B5582Y的鉴定
1.形态特征
菌株B5582Y于37℃在筛选平板培养基平板培养24h,菌落呈圆形,直径2-5mm,中间凸起,表面光滑、粘稠,不易挑取,结果见图2。经革兰氏染色后呈红色,显微镜观察为革兰氏阴性菌短杆菌,无芽孢生成,结果见图3。
2.16S rDNA 序列分析:
正向引物F:5’-AGA GTT TGA TCC TGG CTC AG-3’,SEQ ID NO:1;
反向引物R:5'-ACG GTT ACC TTG TTA CGA CTT-3',SEQ ID NO:2;
利用PCR 技术扩增该菌的16S rDNA;
PCR扩增反应的具体操作如下(未具体说明的操作为常规操作):
将反应体系依次加入PE小管;打开PCR扩增仪扩增;完成反应后关闭仪器;取出反应液进行琼脂糖凝胶电泳检验扩增DNA。PCR产物经琼脂糖凝胶电泳检验后测序,PCR扩增产物委托北京奥科鼎盛公司完成测序工作;扩增产物DNA序列表为:SEQ ID NO:3。将所得菌株序列通过Genebank序列比对,利用MEGA6建立系统发育树,结果见图1。通过16S rDNA序列系统发育分析,菌株B5582Y鉴定为:克雷伯氏菌,Klebsiella michiganensis。
PCR扩增反应体系所涉及各种试剂及用量:PCR扩增反应体系10×PCR Buffer(Mg2+Plus)5 µL,dNTP Mixture(2.5 mM)8µL,引物F(10 µmol/L)1µL,引物R(10 µmol/L)1µL,模板DNA 1µL,Taq(5 U/µl)0.5 µL,总体积为50µL,其余用灭菌后的ddH2O补充。
PCR扩增反应条件: 95℃变性5min;95℃变性60s,57℃退火60s,72℃延伸90s,30个循环;72℃延伸5min。
3.生理生化特征
对菌株B5582Y进行BIOLOG GEN III生理生化试验(见表1),其生理生化特征与克雷伯氏菌相吻合。
表1:生理生化反应表
实施例2 含β-半乳糖苷酶、克雷伯氏菌B5582Y的发酵液的制备及发酵优化
一、斜面培养
克雷伯氏菌B5582Y接种于斜面培养基上,于37℃培养24h,得斜面菌株。
二、液体增殖培养及发酵
将得斜面菌株挑取2 环接入增殖培养基中,于37℃、180rpm培养24h,得增殖菌液;增殖菌液以 2%(v/v)的接种量接入到装有50mL基础发酵培养基的250 mL三角瓶中,于37℃、180rpm培养24h,得发酵液。
三、发酵培养基及发酵条件的优化
在基础发酵培养基的基础上,对碳源种类及浓度、氮源种类及浓度、发酵液初始pH、接种量、发酵时间、发酵温度、摇瓶转速进行优化,得到产β-半乳糖苷酶的优化发酵培养基:乳糖40g/L、硫酸铵10g/L、胰蛋白胨5g/L、NaCl 4g/L、水余量,pH为8.0。将步骤(2)培养好的增殖菌液以4%的接种量接种到120℃灭菌20min的装有50mL优化发酵培养基的250mL的三角瓶中,30℃恒温培养15h,转速180r/min,水解酶活力达到最高为35.7U/mL。
实施例3 β-半乳糖苷酶的确认及酶活力的测定
一、粗酶液的制备
将实施例2中获得的发酵液于4℃、8000 rpm离心10 min,将菌体沉淀用pH 6.7的PBS缓冲液(钠盐)洗涤、离心两次后,再次加入与发酵液相同体积的pH 6.7 PBS缓冲液,冰水浴超声处理(500W,超声1.5s,间歇2s)10min,然后于4℃、 8000 rpm离心10min,取上清液即为β-半乳糖苷酶粗酶液。
二、β-半乳糖苷酶水解酶活力测定
准确称取一定量的oNPG粉末,用0.05 mol/L、pH 6.7的PBS缓冲液配制2 mg/mL的oNPG溶液;取2mLoNPG溶液置于试管中,于50℃保温10 min,然后加入0.5 mL适当稀释使最终反应结束后,待测液的OD值在0.2-0.8之间,通常稀释100倍左右。将步骤1中的酶液,振荡混匀后在50℃下反应10 min,加入2.5 mL的0.5mol/L Na2CO3溶液终止反应。对照管先加2.5 mL的0.5mol/LNa2CO3溶液再加0.5mL适当稀释(100倍左右)的步骤1中的酶液。在420 nm下测定样品的吸光度,根据oNP标准曲线计算酶活力。
三、β-半乳糖苷酶转糖苷活力测定
用0.05 mol/L、pH 6.7 的PBS缓冲液配制 0.5 mol/L的乳糖溶液;取500 μL乳糖溶液置于离心管中,50℃ 保温10 min 后加入1000μL实施例3中步骤1中粗酶液,振荡混匀继续反应4h,然后放入沸水浴中煮沸10 min灭酶。取适量酶解后液体经0.22μm微孔过滤器过滤后,经HPLC检测乳糖水解活性与低聚半乳糖的生成情况,结果如图4和5。图4为酶解前底物乳糖的HPLC图,图5为酶解后乳糖的水解产物葡萄糖,半乳糖以及发生转苷后产生的低聚糖的HPLC图,两图对比方可看出加了乳糖酶后对乳糖的作用效果。
色谱测定条件:Agilent 1260高效液相色谱-示差折光检测器;色谱柱:Inertsil HPLC Column NH2 5μm、4.6*250 mm;柱温:30℃;流动相:乙腈:水=70:30;流速:1.0 mL/min。
<110>北京工商大学
<120>一种产β-半乳糖苷酶的克雷伯氏菌及其应用
<160>3
<210>1
<211>20
<212>DNA
<213>人工合成
<400>1
AGAGTTTGAT CCTGGCTCAG 20
<210>2
<211>21
<212>DNA
<213>人工合成
<400>2
ACGGTTACCT TGTTACGACT T 21
<210>3
<211>1461
<212>DNA
<213>人工合成
<400>3
CACATGCAGT CGAACGGTAG CACAGAGAGC TTGCTCTCGG GTGACGAGTG GCGGACGGGT 60
GAGTAATGTC TGGGAAACTG CCTGATGGAG GGGGATAACT ACTGGAAACG GTAGCTAATA 120
CCGCATAACG TCGCAAGACC AAAGAGGGGG ACCTTCGGGC CTCTTGCCAT CAGATGTGCC 180
CAGATGGGAT TAGCTAGTAG GTGGGGTAAC GGCTCACCTA GGCGACGATC CCTAGCTGGT 240
CTGAGAGGAT GACCAGCCAC ACTGGAACTG AGACACGGTC CAGACTCCTA CGGGAGGCAG 300
CAGTGGGGAA TATTGCACAA TGGGCGCAAG CCTGATGCAG CCATGCCGCG TGTATGAAGA 360
AGGCCTTCGG GTTGTAAAGT ACTTTCAGCG GGGAGGAAGG CGATAAGGTT AATAACCTCG 420
TCGATTGACG TTACCCGCAG AAGAAGCACC GGCTAACTCC GTGCCAGCAG CCGCGGTAAT 480
ACGGAGGGTG CAAGCGTTAA TCGGAATTAC TGGGCGTAAA GCGCACGCAG GCGGTCTGTC 540
AAGTCGGATG TGAAATCCCC GGGCTCAACC TGGGAACTGC ATTCGAAACT GGCAGGCTGG 600
AGTCTTGTAG AGGGGGGTAG AATTCCAGGT GTAGCGGTGA AATGCGTAGA GATCTGGAGG 660
AATACCGGTG GCGAAGGCGG CCCCCTGGAC AAAGACTGAC GCTCAGGTGC GAAAGCGTGG 720
GGAGCAAACA GGATTAGATA CCCTGGTAGT CCACGCTGTA AACGATGTCG ACTTGGAGGT 780
TGTTCCCTTG AGGAGTGGCT TCCGGAGCTA ACGCGTTAAG TCGACCGCCT GGGGAGTACG 840
GCCGCAAGGT TAAAACTCAA ATGAATTGAC GGGGGCCCGC ACAAGCGGTG GAGCATGTGG 900
TTTAATTCGA TGCAACGCGA AGAACCTTAC CTACTCTTGA CATCCAGAGA ACTTAGCAGA 960
GATGCTTTGG TGCCTTCGGG AACTCTGAGA CAGGTGCTGC ATGGCTGTCG TCAGCTCGTG 1020
TTGTGAAATG TTGGGTTAAG TCCCGCAACG AGCGCAACCC TTATCCTTTG TTGCCAGCGA 1080
TTCGGTCGGG AACTCAAAGG AGACTGCCAG TGATAAACTG GAGGAAGGTG GGGATGACGT 1140
CAAGTCATCA TGGCCCTTAC GAGTAGGGCT ACACACGTGC TACAATGGCA TATACAAAGA 1200
GAAGCGACCT CGCGAGAGCA AGCGGACCTC ATAAAGTATG TCGTAGTCCG GATTGGAGTC 1260
TGCAACTCGA CTCCATGAAG TCGGAATCGC TAGTAATCGT GGATCAGAAT GCCACGGTGA 1320
ATACGTTCCC GGGCCTTGTA CACACCGCCC GTCACACCAT GGGAGTGGGT TGCAAAAGAA 1380
GTAGGTAGCT TAACCTTCGG GAGGGCGCTT ACCACTTTG 1419
- 还没有人留言评论。精彩留言会获得点赞!