具有固体荧光的多孔吡咯并吡咯二酮类聚合物的制作方法
本发明涉及一种吡咯并吡咯二酮类聚合物,具体地说,涉及一种具有固体荧光的多孔吡咯并吡咯二酮类聚合物。
背景技术:
固体荧光材料在发光二极管及其他发光器件中有广泛应用。目前已成熟的红色固体荧光材料主要是:基于稀土金属的无机物(如中国专利文献CN 105349148A报道了用铕激活的氧化钇制备红色荧光粉的方法;中国专利文献CN 105349147A揭示了采用镨离子激活的钆离子实现材料的红色荧光)或是基于稀土金属的有机配位化合物(中国专利文献CN1880403A公开了用β-二酮与铕离子形成的配合物实现红色荧光的方法)。这些红色固体荧光材料的制备需要稀土元素,一定程度上提高了它们的生产成本。因此探寻新型红色固体荧光材料很有必要。
近年来,对于有机发光材料的研究备受关注。吡咯并吡咯二酮(DPP)是一种高性能颜料,具有高荧光量子产率、优异的发色、耐化学溶剂、耐晒和耐老化等优良特性。所以被广泛地用于太阳能电池、场效应晶体管、有机发光二极管等领域。然而,与一般的π-共轭荧光团类似,DPP分子基本为平面结构,在高浓度下或在固态下彼此之间有弱相互作用,因此会形成堆积体,猝灭其荧光。
目前实现固体荧光的途径主要有:(1)在荧光团上修饰大位阻的取代基(如苯甲基硅烷或金刚烷等);(2)引入特殊的聚集诱导荧光(AIE)基团(如四苯乙烯或苯基硅烷等)。但是,这些途径或是涉及复杂的合成步骤,或是需要引入特殊的基团。因此,开辟实现固体荧光的新途径仍具有实际需要和广阔前景。
技术实现要素:
本发明的发明人经研究发现:将吡咯并吡咯二酮衍生物与含芳乙炔基的化合物经Sonogashira反应,可获得具有微孔及介孔结构的大分子化合物(聚合物)。该聚合物不仅具有固体荧光,而且具有和优异的化学稳定性。
因此,本发明的目的在于,提供一种具有固体荧光的多孔吡咯并吡咯二酮类聚合物。
本发明所述的具有固体荧光的吡咯并吡咯二酮类聚合物,主要由式Ⅰ所示化合物与式Ⅱ所示化合物经Sonogashira反应至少反应24小时后得到:
式中,R1和R2分别独立选自:C1~C4直链或支链烷基或中一种;R3和R4分别独立选自:溴代苯基中一种;X为二价的C6~C12芳环基;Y为氮(N),碳(C),硅(Si)或四价的金刚烷(三环(3.3.1.1(3.7))癸烷)基;n为3或4;
其中,R5为C1~C4直链或支链烷基,苯基,或由C1~C4直链或支链烷基取代的苯基;曲线标记处为取代位(下同)。
本发明所述的具有固体荧光的吡咯并吡咯二酮类聚合物为具有介孔及微孔结构的固体,其孔容为0.05cm3/g~0.35cm3/g,比表面积(BET)20m2/g~450m2/g。其荧光发射光谱中最大波长为635nm~650nm(红光)。
附图说明
图1.是DPPm-PPN-4-1粉末在荧光显微镜下观察到的形貌(激发波长为450纳米);
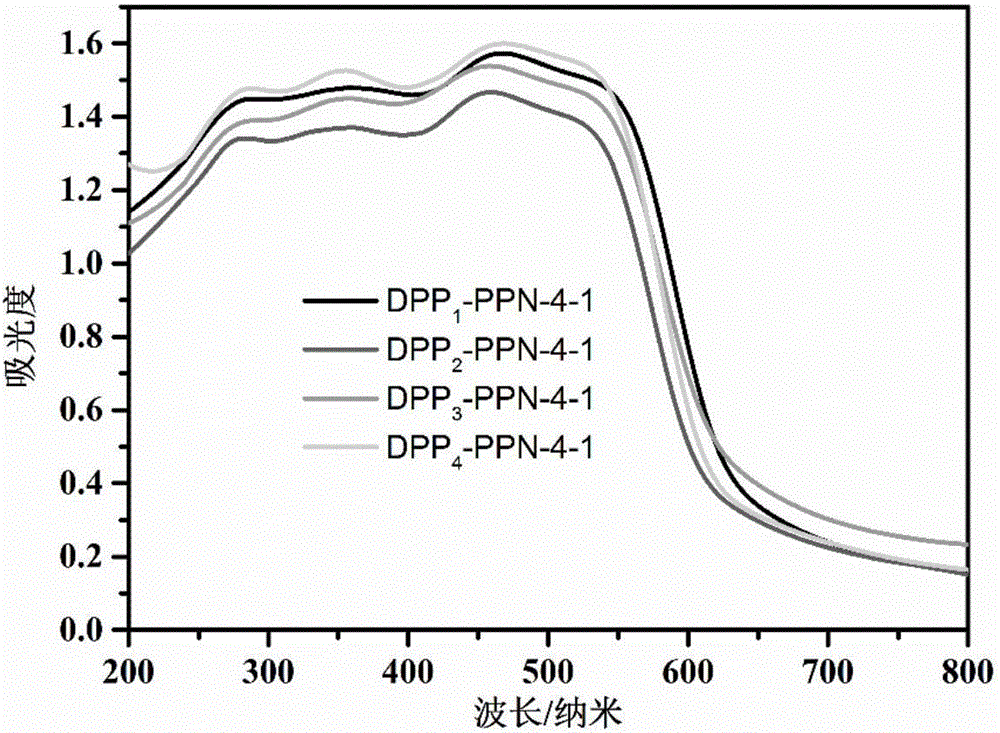
图2.是DPPm-PPN-4-1粉末的紫外-可见吸收光谱;
图3.是DPPm-PPN-4-1的固体荧光光谱;
图4.是DPPm-PPN-4-1在77K下的氮气吸附等温线;
图5.是DPPm-PPN-4-1热重曲线;
其中:m为1~4的整数。
具体实施方式
在本发明一个优选的技术方案中,R1和R2分别独立选自:甲基,乙基,丙基或中一种;
其中,R5为甲基,乙基,丙基,异丙基,异丁基,叔丁基,苯基,或由甲基、乙基、丙基、异丙基、异丁基或叔丁基取代的苯基。
更优选的技术方案是:R1和R2分别独立选自:甲基,乙基,丙基或中一种,且R1和R2相同;
其中,R5为甲基,乙基,丙基,异丙基,异丁基,叔丁基,苯基,或由甲基、乙基、丙基、异丙基、异丁基或叔丁基取代的苯基。
更进一步优选的技术方案是:R1和R2分别独立选自:乙基或中一种,且R1和R2相同;
其中,R5为乙基,叔丁基,或由叔丁基取代的苯基。
在本发明另一个优选的技术方案中,R3和R4分别独立选自:溴代苯基中一种,且R3和R4相同。
更进一步优选的技术方案是:R3和R4均为对溴苯基。
在本发明又一个优选的技术方案中,X为二价的苯基或联苯基;
更进一步优选的技术方案是:X为或
在本发明又一个优选的技术方案中,Y为N,C,Si或
在本发明又一个优选的技术方案中,式Ⅰ所示化合物与式Ⅱ所示化合物反应(Sonogashira反应)时间为72小时至120小时,反应温度为70℃~90℃。
在本发明又一个优选的技术方案中,在式Ⅰ所示化合物与式Ⅱ所示化合物反应(Sonogashira反应)中,式Ⅰ所示化合物中溴与式Ⅱ所示化合物中乙炔基的摩尔数相等,所用的催化剂为CuI/Pd(PPh3)4,所用反应溶剂为烷基苯(如甲苯或二甲苯等)或烷基胺(如三甲胺或三乙胺等)。
下面通过实施例对本发明做进一步阐述,其目的仅在于更好理解本发明的目的。因此,所举之列不限制本发明的保护范围。
实施例1
氮气保护气氛下,在三口烧瓶中加入2.4mmol的3,6-二(4-溴基苯基)-2,5-二乙基吡咯[3,4-c]并吡咯-1,4(2H,5H)-二酮(式Ⅰa所示化合物)和1.6mmol的三(4-乙炔基苯基)胺(式Ⅱa所示化合物)催化量的四三苯基膦钯和碘化亚铜,再加入30ml三乙胺和甲苯(1:1v/v)各作溶剂,反应液在氮气保护下,升温至70℃~90℃,在此状态保持72小时至120小时,冷却后,抽滤,收集固体,固体用二氯甲烷,甲醇,稀盐酸,水洗涤,并用二氯甲烷索氏提取24小时,所得固体即为目标物(简记为“DPP1-PPN-3-1”)。
FTIR(KBr压片):3054cm-1,2978cm-1,2936cm-1,2206cm-1,1678cm-1,1604cm-1,1510cm-1,1411cm-1,1377cm-1,1188cm-1,1081cm-1,1019cm-1,824cm-1,744cm-1,541cm-1。
实施例2
除以式Ⅰb所示化合物替换式Ⅰa所示化合物,及式Ⅱb所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP2-PPN-3-2”)。
FTIR(KBr压片):3038cm-1,2981cm-1,2926cm-1,2213cm-1,1748cm-1,1679cm-1,1607cm-1,1510cm-1,1416cm-1,1373cm-1,1208cm-1,1125cm-1,1080cm-1,1019cm-1,825cm-1,751cm-1,546cm-1。
实施例3
除以式Ⅰc所示化合物替换式Ⅰa所示化合物,及式Ⅱb所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP3-PPN-3-3”)。
FTIR(KBr压片):3073cm-1,2977cm-1,2932cm-1,2210cm-1,1743cm-1,1685cm-1,1602cm-1,1510cm-1,1415cm-1,1369cm-1,1226cm-1,1151cm-1,1018cm-1,984cm-1,822cm-1,748cm-1,542cm-1。
实施例4
除以式Ⅰd所示化合物替换式Ⅰa所示化合物,及式Ⅱc所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP4-PPN-3-4”)。
FTIR(KBr压片):3059cm-1,2963cm-1,2870cm-1,2207cm-1,1765cm-1,1688cm-1,1601cm-1,1511cm-1,1415cm-1,1377cm-1,1208cm-1,1199cm-1,1110cm-1,1018cm-1,823cm-1,747cm-1,543cm-1。
实施例5
除以式Ⅱd所示化合物替换式Ⅱa所示化合物、及化合物Ⅰa与化合物Ⅱd的摩尔比为2∶1外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP1-PPN-4-1”)。
FTIR(KBr压片):3033cm-1,2973cm-1,2864cm-1,2196cm-1,1682cm-1,1598cm-1,1509cm-1,1409cm-1,1377cm-1,1263cm-1,1188cm-1,1086cm-1,1016cm-1,822cm-1,744cm-1,541cm-1。
实施例6
除以式Ⅰb所示化合物替换式Ⅰa所示化合物,及式Ⅱd所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP2-PPN-4-1”)。
FTIR(KBr压片):3036cm-1,2983cm-1,2921cm-1,2206cm-1,1753cm-1,1674cm-1,1613cm-1,1502cm-1,1409cm-1,1384cm-1,1203cm-1,1121cm-1,1083cm-1,1015cm-1,829cm-1,756cm-1,548cm-1。
实施例7
除以式Ⅰc所示化合物替换式Ⅰa所示化合物,及式Ⅱd所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP3-PPN-4-1”)。
FTIR(KBr压片):3080cm-1,2974cm-1,2928cm-1,2218cm-1,1735cm-1,1683cm-1,1601cm-1,1511cm-1,1412cm-1,1366cm-1,1224cm-1,1155cm-1,1012cm-1,985cm-1,823cm-1,748cm-1,542cm-1。
实施例8
除以式Ⅰd所示化合物替换式Ⅰa所示化合物,及式Ⅱd所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP4-PPN-4-1”)。
FTIR(KBr压片):3057cm-1,2970cm-1,2872cm-1,2212cm-1,1777cm-1,1683cm-1,1598cm-1,1509cm-1,1413cm-1,1379cm-1,1206cm-1,1177cm-1,1108cm-1,1015cm-1,821cm-1,742cm-1,545cm-1。
实施例9
除以式Ⅰb所示化合物替换式Ⅰa所示化合物,及式Ⅱe所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP2-PPN-4-2”)。
FTIR(KBr压片):3036cm-1,2984cm-1,2921cm-1,2211cm-1,1744cm-1,1673cm-1,1609cm-1,1512cm-1,1413cm-1,1374cm-1,1208cm-1,1125cm-1,1080cm-1,1019cm-1,825cm-1,751cm-1,546cm-1。
实施例10
除以式Ⅱf所示化合物替换式Ⅱa所示化合物外,其它条件及步骤与实施例1相同,得到目标物(简记为“DPP1-PPN-4-3”)。
FTIR(KBr压片):3055cm-1,2971cm-1,2932cm-1,2202cm-1,1674cm-1,1607cm-1,1513cm-1,1413cm-1,1376cm-1,1183cm-1,1084cm-1,1015cm-1,824cm-1,744cm-1,541cm-1。
实施例11
分别对上述制备的聚合物DPP1~4-PPN-4-1进行比表面(BET法)、孔容、热分解温度及固体荧光进行测定,其结果见表1。
表1
同样,对聚合物DPP1~4-PPN-3-1~4、DPP2-PPN-4-2和DPP1-PPN-4-3进行上述测试,结果是:聚合物DPP1~4-PPN-3-1~4的比表面积(BET)为20m2/g~300m2/g,总孔容0.05m3/g~0.23m3/g,微孔孔容0.0006m3/g~0.12m3/g,热分解温度为280℃~290℃,荧光最大发射波长为640nm~670nm;最大发射强度为(0.3-1.2)Ⅹ107a.u,荧光产率为2.4%~15%。
聚合物DPP2-PPN-4-2与DPP1-PPN-4-3与相对应的“四苯甲烷”的聚合物(即聚合物DPP2-PPN-4-1)相比,比表面积和孔容变小,热分解温度和最大发射波长与分别为260℃和200℃,及640nm和635nm左右;最大发射强度量子产率低于聚合物DPP2-PPN-4-1的最大发射强度量子产率。
此外,发现上述所制备聚合物不溶于常规溶剂(如石油醚、甲苯、丙酮、二氯甲烷、四氢呋喃、甲醇、N,N-二甲基甲酰胺和水等),表明其具有较好的化学稳定性。
- 还没有人留言评论。精彩留言会获得点赞!