一种利于间充质干细胞应用于骨再生的培养体系的制作方法
本发明属于生物技术领域中的一种利于胎盘间充质干细胞应用于骨再生的培养体系。
背景技术:
骨组织缺损是因外伤、感染、肿瘤等因素使机体丧失一些骨质从而形成较大间隙,这一问题在临床较为常见并且较难处理。如何促进骨组织缺损的修复,一直是该领域研究人员研究的重点。近年来,随着骨组织工程技术的发展,这一问题得到了一定程度的解决。骨组织工程中种子细胞起着关键的作用。因此,种子细胞的选择至关重要,早期研究人员选用骨细胞和骨髓基质细胞,但是这些种子细胞取材困难,容易对患者造成二次伤害,并且这些细胞体外扩增能力较弱。此后,研究人员将种子细胞的目标锁定在了间充质干细胞。间充质干细胞具有多向分化的潜能,在一定的条件下可分化为成骨细胞、成脂肪细胞和成软骨细胞等成熟的细胞。胎盘间充质干细胞和脂肪间充质干细胞分别是从胎盘组织和脂肪组织中分离出来的,其具以下优点:组织来源广泛,保证有充足的细胞来源;胎盘和脂肪间充质干细胞具有多向分化的潜能;胎盘和脂肪间充质干细胞免疫原性较低,不会引起患者自身的免疫排斥反应。胎盘和脂肪间充质干细胞如同其它组织来源的间充质干细胞,其成骨诱导后决定骨再生的关键转录因子(Osterix、RUNX)和骨再生早期典型代表因子(骨桥蛋白-OPN、碱性磷酸酶-ALP)的基因表达均上调,但是成骨诱导这一过程需要至少14天的时间。因此,如何缩短成骨诱导时间或避免成骨诱导的步骤,显的尤为重要。
技术实现要素:
本发明的目的在于提供一种利于胎盘间充质干细胞应用于骨再生的培养体系,采用本发明的培养体系培养的胎盘和脂肪间充质干细胞依然保持着较高的干性;采用本发明的培养体系培养的胎盘和脂肪间充质干细胞作为种子细胞用于骨组织工程治疗骨缺损,避免了胎盘和脂肪间充质干细胞体外成骨诱导的步骤,为临床应用骨组织工程治疗骨缺损缩短了至少14天的时间;采用本发明的培养体系培养的胎盘间充质干细胞相比较于脂肪间充质干细胞其成骨再生相关因子的基因显著性高表达。
本发明解决其技术问题所采用的技术方案是:
一种利于间充质干细胞应用于骨再生的培养体系,a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽。
一种利于胎盘间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴胎盘间充质干细胞的分离:获取无菌的胎盘组织,无菌条件下剥离胎盘组织的外膜和胎盘组织内动、静脉,分离出胎盘华通氏胶并剪碎至2-3mm3,将剪碎的华通氏胶贴于培养瓶底面,1-4h后向培养瓶内添加适量培养液,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵胎盘间充质干细胞的消化、传代,待胎盘间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中。
一种利于胎盘间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴脂肪间充质干细胞的分离:获取无菌的脂肪组织,无菌条件下将其剪碎,使用磷酸缓冲液反复冲洗,加入0.1%的I型胶原酶消化90min,1500rpm离心弃上清,磷酸缓冲液清洗得到的沉淀,1500rpm离心5min,将获得的细胞制成单细胞悬液,计数,以1×106/cm2接种至培养瓶中培养,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵脂肪间充质干细胞的消化、传代,待脂肪间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中。
一种利于脐带间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴脐带间充质干细胞的分离:获取无菌的脐带组织,无菌条件下剥离脐带组织的外膜和脐带组织内动、静脉,分离出脐带华通氏胶并剪碎至2-3mm3,将剪碎的华通氏胶贴于培养瓶底面,1-4h后向培养瓶内添加适量培养液,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵脐带间充质干细胞的消化、传代,待脐带间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中。
一种利于脐带间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴脐带血间充质干细胞的分离:获取无菌的脐带血,加入5g/L的甲基纤维素粉沉淀红细胞,将沉淀过红细胞的脐带血无菌条件下1500rpm离心5min;弃去上清液,使用无菌磷酸缓冲液反复冲洗,1500rpm离心5min,弃上清;磷酸缓冲液等倍稀释混匀沉淀,缓慢添加到淋巴分离液上,2000rpm离心20min;收集白膜层单核细胞于新的无菌的离心管内,磷酸缓冲液清洗,1500rpm离心5min;弃上清,用培养液重悬沉淀,计数,以1×106/cm2接种至培养瓶中培养,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵脐带血间充质干细胞的消化、传代,待脐带血间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中
本发明的有益效果是:
1、本发明采用一种新的培养体系培养胎盘和脂肪间充质干细胞,其中培养体系中关键的细胞因子-重组人脑利钠肽(hBNP),其具有扩张血管的作用,在临床上可用于治疗轻微活动时呼吸困难的急性心力衰竭患者,本发明将其添加到培养胎盘和脂肪间充质干细胞的培养液中,发现胎盘和脂肪间充质干细胞内决定成骨再生的关键基因均显著性高表达;
2、本发明采用一种新的培养体系,从胎盘和脂肪间充质干细胞原代开始用培养体系进行培养,本发明采用的培养体系培养出的胎盘和脂肪间充质干细胞依然保持着干细胞的特性,此外胎盘间充质干细胞相比较于脂肪间充质干细胞其成骨再生的关键转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)的基因均显著性高表达。
3、应用本发明的培养体系可以促进胎盘间充质干细胞成骨再生的转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)高表达,为骨缺损修复提供合适的种子细胞。
4、本发明采用的一种新的培养体系,在胎盘间充质干细胞正常培养时使用本发明的培养体系,胎盘间充质干细胞在维持其原有干性的同时,决定成骨再生的相关因子的基因表达上调,为应用骨组织工程治疗骨缺损提供了必要的种子细胞,也为骨组织工程治疗骨缺损缩短了时间。
5、本发明采用本发明的培养体系培养胎盘间充质干细胞,提高了成骨再生关键转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)的基因的表达;
6、本发明采用本发明的培养体系培养的胎盘间充质干细胞依然保持着较高的干性;采用本发明的培养体系培养的胎盘间充质干细胞作为种子细胞用于骨组织工程治疗骨缺损,避免了胎盘间充质干细胞体外成骨诱导的步骤,为临床应用骨组织工程治疗骨缺损缩短了至少14天的时间。
7、本发明采用一种新的培养体系培养脐带和脐血间充质干细胞,其中培养体系中的关键因子-重组人脑利钠肽(hBNP),其具有扩张血管的作用,在临床上可用于治疗轻微活动时呼吸困难的急性心力衰竭患者,本发明将其用于培养脐带和脐带血间充质干细胞,发现脐带和脐带血间充质干细胞内决定成骨再生的关键基因均显著性高表达;
8、本发明采用一种新的培养体系,从脐带和脐带血间充质干细胞原代开始用该培养体系进行培养,本发明采用的培养体系培养出的脐带和脐带血间充质干细胞内决定成骨再生的关键转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)的基因明显高表达。
9、应用本发明的培养体系可以促进脐带间充质干细胞成骨再生的转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)高表达,为骨缺损修复提供理想的种子细胞。
10、本发明在脐带和脐带血间充质干细胞正常培养时使用本发明的培养体系,脐带和脐带血间充质干细胞在维持其原有干性的同时,决定成骨再生的相关因子的基因表达上调,为应用骨组织工程治疗骨缺损提供了必要的种子细胞,也为骨组织工程治疗骨缺损缩短了时间。
11、采用本发明的培养体系培养的脐带和脐带血间充质干细胞,提高了成骨再生关键转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)的基因的表达;采用本发明的培养体系培养的脐带和脐带血间充质干细胞依然保持着较高的干性;采用本发明的培养体系培养的脐带血间充质干细胞作为种子细胞用于骨组织工程治疗骨缺损,避免了间充质干细胞体外成骨诱导的步骤,为临床应用骨组织工程治疗骨缺损缩短了至少14天的时间;采用本发明的培养体系培养的脐带间充质干细胞相比较于脐带血间充质干细胞其成骨再生相关因子的基因显著性高表达。
附图说明
图1为Osterix的mRNA表达水平(相对荧光强度);
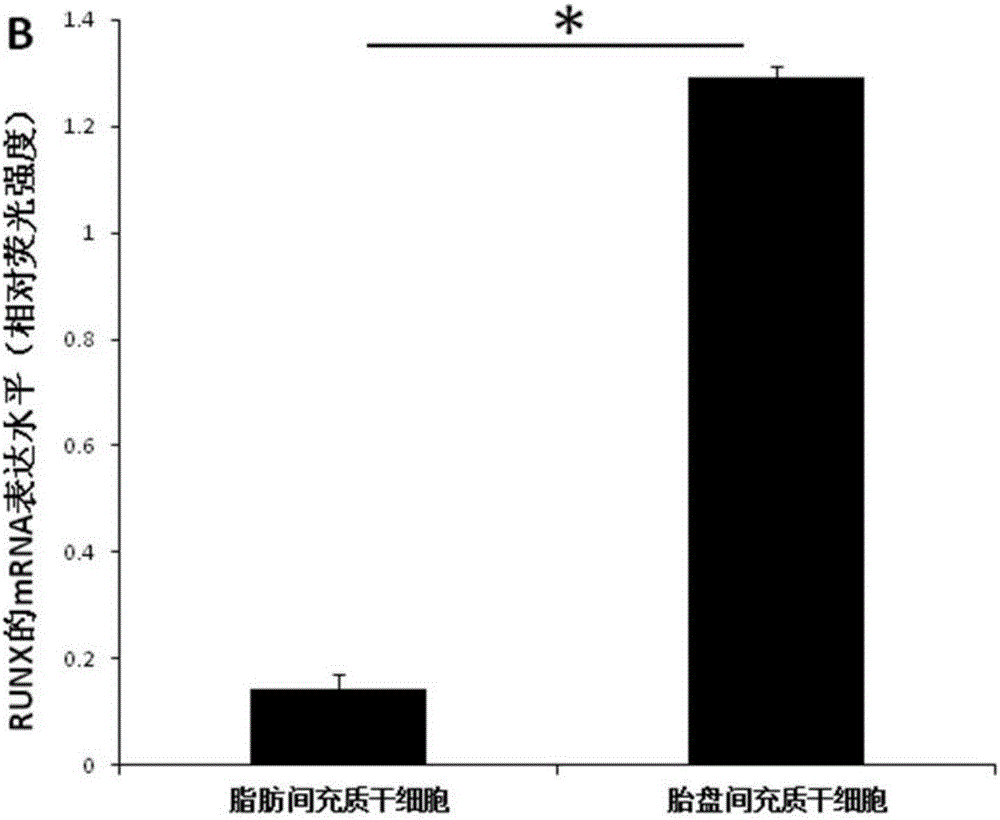
图2为RUNX的mRNA表达水平(相对荧光强度);
图3为OPN的mRNA表达水平(相对荧光强度);
图4为ALP的的mRNA表达水平(相对荧光强度);
图5为Osterix的mRNA表达水平(相对荧光强度);
图6为RUNX的mRNA表达水平(相对荧光强度);
图7为OPN的mRNA表达水平(相对荧光强度);
图8为ALP的的mRNA表达水平(相对荧光强度);
具体实施方式
下面结合附图并通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
一种利于脐带间充质干细胞应用于骨再生的培养体系,其特征在于:a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP)。
利用上述体系来培养四种细胞,以考察其培养体系的适应性。
实施例1
一种利于胎盘间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴胎盘间充质干细胞的分离:获取无菌的胎盘组织,无菌条件下剥离胎盘组织的外膜和胎盘组织内动、静脉,分离出胎盘华通氏胶并剪碎至2-3mm3,将剪碎的华通氏胶贴于培养瓶底面,1-4h后向培养瓶内添加适量培养液,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵胎盘间充质干细胞的消化、传代,待胎盘间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中;
⑶脂肪间充质干细胞的分离:获取无菌的脂肪组织,无菌条件下将其剪碎,使用磷酸缓冲液反复冲洗,加入0.1%的I型胶原酶消化90min,1500rpm离心弃上清,磷酸缓冲液清洗得到的沉淀,1500rpm离心5min,将获得的细胞制成单细胞悬液,计数,以1×106/cm2接种至培养瓶中培养,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑷脂肪间充质干细胞的消化、传代,待脂肪间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中;
⑸取同种培养体系培养的第三代胎盘和脂肪间充质干细胞进行流式鉴定,两种间充质干细胞阳性率均高于95%,阴性率均低于5%;
⑹取培养到第三代胎盘和脂肪间充质干细胞,提取RNA-反转录获得cDNA-进行Q-PCR,比较两种间充质干细胞成骨再生相关的转录因子(Osterix、RUNX)和骨再生早期典型代表因子(OPN、ALP)基因的表达量。
实施例2
一种利于脐带间充质干细胞应用于骨再生的培养体系,步骤如下:
⑴脐带间充质干细胞的分离:获取无菌的脐带组织,无菌条件下剥离脐带组织的外膜和脐带组织内动、静脉,分离出脐带华通氏胶并剪碎至2-3mm3,将剪碎的华通氏胶贴于培养瓶底面,1-4h后向培养瓶内添加适量培养液,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑵脐带间充质干细胞的消化、传代,待脐带间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中。
⑶脐带血间充质干细胞的分离:获取无菌的脐带血,加入5g/L的甲基纤维素粉沉淀红细胞,将沉淀过红细胞的脐带血无菌条件下1500rpm离心5min;弃去上清液,使用无菌磷酸缓冲液反复冲洗,1500rpm离心5min,弃上清;磷酸缓冲液等倍稀释混匀沉淀,缓慢添加到淋巴分离液上,2000rpm离心20min;收集白膜层单核细胞于新的无菌的离心管内,磷酸缓冲液清洗,1500rpm离心5min;弃上清,用培养液重悬沉淀,计数,以1×106/cm2接种至培养瓶中培养,培养液采用a-MEM+5%血小板裂解物+50mg/ml抗坏血酸+10nmol/L EGF+10nmol/L bFGF+10nmol/L重组人脑利钠肽(hBNP);
⑷脐带血间充质干细胞的消化、传代,待脐带血间充质干细胞长至80%时,采用0.05%的胰蛋白酶+0.02%的EDTA对其进行消化,以1×104cells/cm2传至新的培养瓶中。
- 还没有人留言评论。精彩留言会获得点赞!