一种以睾丸支持细胞为滋养层提高精子活力的方法与流程
本技术发明属于精子体外处理技术领域,具体涉及一种以睾丸支持细胞为滋养层提高精子活力的方法。
背景技术:
体外受精是指哺乳动物的精子和卵子在体外人工控制的环境中完成受精过程的技术。在生物学中,把体外受精胚胎移植到母体后获得的动物称试管动物。人工授精技术是一项应用于哺乳动物的繁育高新技术,利用人工授精,结合胚胎移植技术,可以更好地开发遗传特性优良的母畜繁殖潜力,较快地扩大良种畜群。
自1978年第一例试管婴儿出生以来,不孕、不育症的治疗获得了突破。在利用体外受精技术与胚胎移植技术相结合获得试管婴儿的过程中,提高体外精子的活力及精子的体外获能是该技术的两个关键环节。自1992年卵胞浆内单精子注射(ICSI)技术问世以来,即使精液中无精子的患者也有望利用睾丸、附睾中的精子进行ICSI获得生育。但是,睾丸中的精子不能运动,难以判断其是否为活精子,需要体外培养一段时间部分精子才能获得一定运动能力。为了提高睾丸、附睾内精子的活力和活率,便于选择成活精子用于ICSI中,本技术发明对睾丸、附睾内精子用睾丸支持细胞为滋养层进行体外共培养处理,能够在体外实现提高附睾内精子活力和活率的效果。
技术实现要素:
本发明的目的解决上述技术问题,提供一种体外提高附睾内精子活力的方法,其以睾丸支持细胞为滋养层对附睾内精子进行体外处理,以期增加体外附睾内精子的活力和活率,进而提高体外精子的受精能力。
为了解决上述技术问题,本发明采用以下技术方案:一种以睾丸支持细胞为滋养层提高精子活力的方法,其包括下列步骤:
(1)睾丸支持细胞的分离培养:
1)取出生后4-6天的动物睾丸,将其放入预热温度为37℃的生理盐水中冲洗,再在含有双抗的PBS中清除多余脂肪并剥离白膜,将剥离好的睾丸转入DMEM/F12吹打混匀离心去上清;
2)加入适量的透明质酸酶和胶原酶IV消化2分钟,加入适量的DMEM/F12吹打混匀离心去上清;
3)加入适量的胰酶和DNase酶消化2分钟,加入体积相当于胰酶和DNase酶体积的之和的含10%FBS 的DMEM/F12培养液,终止消化,将细胞悬液先后通过80目、200目、300目的细胞筛,离心,弃上清,向沉淀中加入含10%FBS 的DMEM/F12培养液2ml混匀制成细胞悬液,将2ml细胞悬液全部加入底层铺有明胶的培养皿中培养;
4)培养1小时后,弃去培养液,贴壁细胞即为睾丸支持细胞,继续培养,传代后,备用;
(2)支持细胞滋养层的制备:支持细胞分离培养2天后,细胞单层形成,加入丝裂霉素C处理2小时,制备成睾丸支持细胞滋养层;
(3)从成熟雄性动物的附睾中获取精子,加入以睾丸支持细胞为滋养层的培养体系中,将精子与支持细胞共培养。
进一步地,步骤(1)的1)中,选取的是刚出生后4-6天的动物的睾丸。
进一步地,步骤(1)的2)中,加入的透明质酸酶的体积为1ml-3ml。
进一步地,步骤(1)的2)中,加入的胶原酶IV的体积为1ml-3ml。
进一步地,步骤(1)的2)中,加入的透明质酸酶和胶原酶IV体积相同。
进一步地,步骤(1)的2)中,加入的DMEM/F12的体积相当于透明质酸酶与胶原酶IV的体积的总和。
进一步地,步骤(1)的3)中,加入的胰酶的体积为1ml-3ml。
进一步地,步骤(1)的3)中,加入的DNase酶的体积为1ml-3ml。
进一步地,步骤(1)的3)中,加入的胰酶和DNase酶体积相同。
与现有技术相比,本发明的有益效果是:采用本发明的技术,提高了精子的活力和活率,增加了精子受精的能力。本发明通过上述具体方法,以睾丸支持细胞为滋养层体外培养睾丸、附睾内的精子,解决了现有技术中体外精子活力低的问题,提高了体外精子的活力和活率,增加了精子的受精能力。
附图说明
图1为全自动精子分析仪记录的对照组精子活力情况;
图2为全自动精子分析仪记录的实验组精子活力情况;
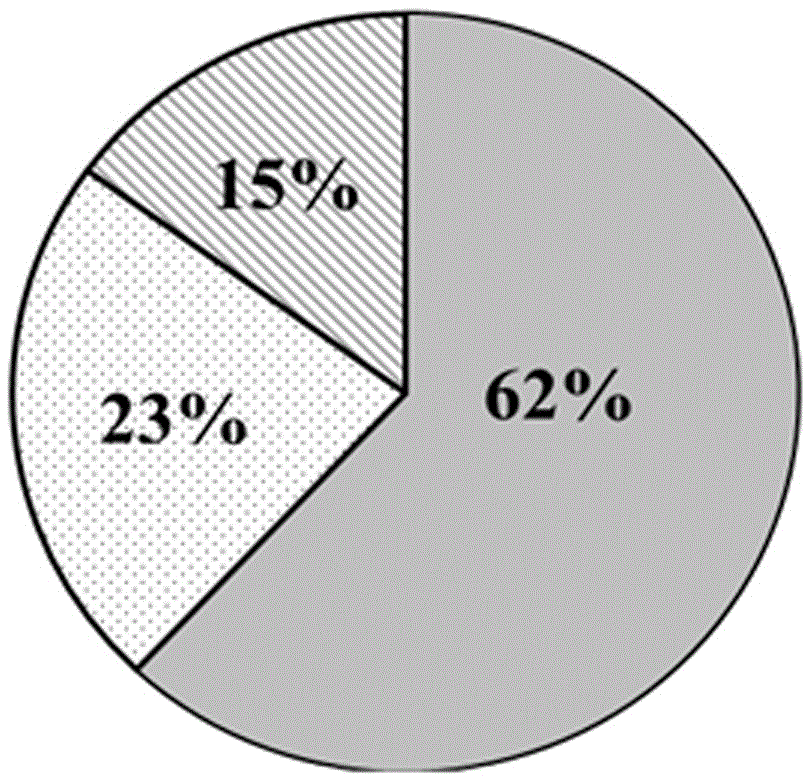
图3为统计的对照组精子活力情况结果图示;
图4为统计的实验组精子活力情况结果图示。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。
实施例1
本实施例为实验组,实验组的处理如下:
一种以睾丸支持细胞为滋养层提高精子活力的方法,其包括下列步骤:
(1)取出生后4-6天小鼠睾丸,将其放入预热温度为37℃的生理盐水中冲洗,再在含有双抗的PBS中清除多余脂肪并剥离白膜,将剥离好的睾丸转入DMEM/F12吹打混匀离心去上清;
(2)加入1.5ml透明质酸酶和1.5ml胶原酶IV消化2分钟,加入等体积(3ml)的DMEM/F12吹打混匀离心去上清;
(3)加入1.5ml胰酶和1.5ml DNase酶消化2分钟,等体积(3ml)含10%FBS 的DMEM/F12培养液,终止消化,将细胞悬液先后通过80目、200目、300目的细胞筛,离心,弃上清,向沉淀中加入含10%FBS 的DMEM/F12培养液2ml混匀制成细胞悬液,将2ml细胞悬液全部加入底层铺有明胶的3.5cm培养皿中培养;
(4)培养1小时后,弃去培养液,贴壁细胞即为睾丸支持细胞,继续培养,传代后,备用;
(5)支持细胞分离培养2天后,细胞单层形成,加入丝裂霉素C处理2小时,制备成睾丸支持细胞滋养层;
(6)成熟公鼠脱臼法处死,立即摘出睾丸和附睾,在灭菌滤纸上除去血液和脂肪组织,用眼科剪刀剪开附睾尾,取出精子团,加入以睾丸支持细胞为滋养层的1ml培养体系中,置培养箱内37℃,培养2h。
培养2h后,利用全自动精子分析仪计录精子的活力。
实施例2
本实施例为对照组的具体实施方式,对照组的处理如下:
(1)成熟公鼠脱臼法处死,立即摘出睾丸和附睾,在灭菌滤纸上除去血液和脂肪组织;
(2)用眼科剪刀剪开附睾尾,取出精子团,加入1ml含10%FBS 的DMEM/F12培养体系中,置培养箱内37℃,培养2h。
(3)培养2h后,利用全自动精子分析仪计录精子的活力。
如图1和图2所示为全自动精子分析仪结果图片,红线代表快速前向运动精子,绿线代表慢速前向运动精子,蓝线代表非前向运动精子,黄点代表不动精子。
如图3和图4所示,数据结果显示,对照组快速前向运动精子占44%(图中的灰色区域),不动精子占37%(图中的白色网格区域);实验组(即支持细胞滋养层培养组)快速前向运动精子占62%(图中的灰色区域),不动精子占15%(图中的白色网格区域)。
由实验结果可以看出,本发明以睾丸支持细胞为滋养层体外培养睾丸、附睾内的精子,显著提高了体外精子的活力和活率、增加了精子的受精能力。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!