一种外胚层干细胞系及其建立方法与用途与流程
本发明涉及生物
技术领域:
,具体涉及一种外胚层干细胞系及其建立方法与用途。
背景技术:
:哺乳动物胚胎早期发育是一个快速而有序的过程。从内细胞团(InnerCellMass,ICM)形成到胚胎着床的过程中,内细胞团细胞发育分化为上胚层(Epiblast)。上胚层经原肠运动分化成为外胚层(Ectoderm)、中胚层(Mesoderm)和内胚层(Endoderm)。其中,外胚层可进一步分化为神经和表皮等终末分化的组织。由于外胚层缺乏标记基因,并且其发育过程的时间窗口短暂,目前对于外胚层谱系发育的研究相对较少。由于原肠运动时期小鼠胚胎个体极小,较难获取足够量的处于这一发育时期的胚胎材料,因此大多数早期发育的研究在小鼠多能干细胞系(Pluripotentstemcells,PSCs)的体外分化模型中展开(Rossant,2008)。目前从小鼠的早期胚胎可以获得两种多能干细胞系,分别为小鼠胚胎干细胞系(EmbryonicStemCells,ESCs)和小鼠上胚层干细胞系(Epiblaststemcells,EpiSCs)。ESCs来源于E3.5的内细胞团(EvansandKaufman,1981),EpiSCs来源于E5.5-E6.5的上胚层(Bronsetal.,2007),都是具有三胚层分化潜力的多能干细胞系。目前尚没有建立对应于外胚层的细胞系,对外胚层发育的分子机制研究造成了不便。我们实验室2010年研究发现,通过调整外部信号通路的方法,可以从胚胎干细胞诱导得到上胚层干细胞(ESCderivedEpiSCs,ESD-EpiSCs)(Zhangetal.,2010),提示体外的多能性干细胞系能够响应外部信号定向分化,模拟体内的发育过程。我们实验室最新的研究发现,抑制ESD-EpiSCs的Activin/Nodal信号通路18个小时后可以得到外胚层前体细胞,这种外胚层前体细胞具有受BMP4调控分化成为神经和表皮的潜能(Lietal.,2015)。但是,外胚层前体细胞不能在体外自我更新和增殖。并且这种诱导得到的类似于外胚层的状态非常短暂,只能维持几个小时,因此其应用价值就受到了一定的限制。技术实现要素:为了克服现有技术中所存在的问题,本发明的目的在于提供一种外胚层干细胞系及其 建立方法与用途。为实现本发明的目的及其他相关目的,本发明采用以下技术方案:本发明的第一方面,提供了SB431542和bFGF在体外构建外胚层干细胞中的用途。优选地,所述用途具体是指在上胚层干细胞在培养过程中加入SB431542和bFGF,将上胚层干细胞诱导分化为外胚层干细胞。优选地,所述上胚层干细胞来自哺乳动物。更优选地,来自鼠。更优选地,来自小鼠。上述SB431542和bFGF均可通过市售途径获得。其中,SB431542的CAS号为301836-41-9。本发明的第二方面,提供一种体外构建外胚层干细胞系的方法,包括步骤:在上胚层干细胞的培养过程中加入SB431542和bFGF。优选地,将SB431542和bFGF加入上胚层干细胞的基础培养基中。更优选地,所述基础培养基为CDM。更优选地,每1000ml所述CDM培养基中含有:500mlIMDM,500mlF12,7㎎Insulin,15㎎转铁蛋白(transferrin),450μmol硫代甘油,以及5gBSA。优选地,加入的SB431542在基础培养基中的终浓度为2-10μM。加入的bFGF在基础培养基中的终浓度为10-20ng/ml。优选地,所述上胚层干细胞来自哺乳动物。更优选地,来自鼠。更优选地,来自小鼠。进一步的,本发明还提供所述体外构建外胚层干细胞系的方法在干细胞培养领域的应用。本发明的第三方面,提供了一种外胚层干细胞系,由前述方法构建获得。本发明的第四方面,提供了一种用于体外构建胚胎干细胞的组合物,所述组合物包括上胚层干细胞基础培养基、SB431542和bFGF。优选地,所述基础培养基为CDM。更优选地,每1000ml所述CDM培养基中含有:500mlIMDM,500mlF12,7㎎Insulin,15㎎转铁蛋白transferrin,450μmol硫代甘油,以及5gBSA。优选地,SB431542在基础培养基中的终浓度为2-10μM。bFGF在基础培养基中的终浓度为10-20ng/ml。与现有技术相比,本发明的有益效果为:本发明首次发现,在上胚层干细胞在培养过程中加入SB431542和bFGF,将上胚层干细胞诱导分化为外胚层干细胞。通过此方法构建获得的外胚层干细胞,可以连续传代40代以上,并保持类似于上胚层干细胞的形态,具有外胚层的分化潜能。所述外胚层干细胞在 不加BMP4的条件下也同样可以很快分化到神经命运,神经标记基因的表达比上胚层干细胞分化得到的神经前体细胞略高。在添加BMP4的条件下,外胚层干细胞能够向表皮分化,并且表皮标记基因的表达水平比上胚层干细胞分化得到的表皮前体细胞高很多。,外胚层干细胞在添加BMP4的条件下,不能向中内胚层分化,中内胚层的标记基因的表达不能上调,始终保持很低的表达水平。亦即,所述外胚层干细胞在分化能力上更类似于外胚层,缺乏分化成为中内胚层的能力,但是向表皮分化的能力与上胚层干细胞相比更强。相比于多能性的上胚层干细胞,本发明的外胚层多能干细胞其分化潜能更加特化。附图说明图1:从上胚层干细胞建立外胚层干细胞系的建系流程示意图,将上胚层干细胞培养在SB43+bFGF的条件下,每两天传一代。图2:在体外传代过程中,外胚层干细胞的形态和上胚层干细胞的形态类似。图3:外胚层干细胞的基因表达谱和胚胎发育时间及空间上的对应:(A)收取E5.5,E6.0,E6.5,E7.0,E7.5的小鼠胚胎,分取不同区域的组织,进行RNA扩增,然后做RNA测序分析;(B)外胚层干细胞的基因表达谱和胚胎各时期各区域的基因表达谱的皮尔森相关系数热图;(C)将B图的对应结果投射在胚胎上的示意图。图4:外胚层干细胞的体外分化潜能:将上胚层干细胞和外胚层干细胞分别在KSR培养液中进行成团分化4天,分别不添加BMP4和添加BMP4,不添加BMP4向神经外胚层分化,添加BMP4向中内胚层和表皮分化;收取第2天和第4天的样品进行Q-PCR检测各类标记基因的表达变化趋势,(A-C):神经外胚层的标记基因Sox1,Zfp521,Nestin;(D-F):表皮标记基因Ck18,Ck8,Ck19;(G-I):中内胚层标记基因Flk1,Gata6,Sox17。图5:(A)免疫荧光检测分化到第4天的细胞团里神经外胚层标记基因Tuj1和Nestin,表皮标记基因Ck18,中内胚层标记基因Flk1和Nkx2.5的表达情况;(B)对A图的统计结果。具体实施方式以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭 露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
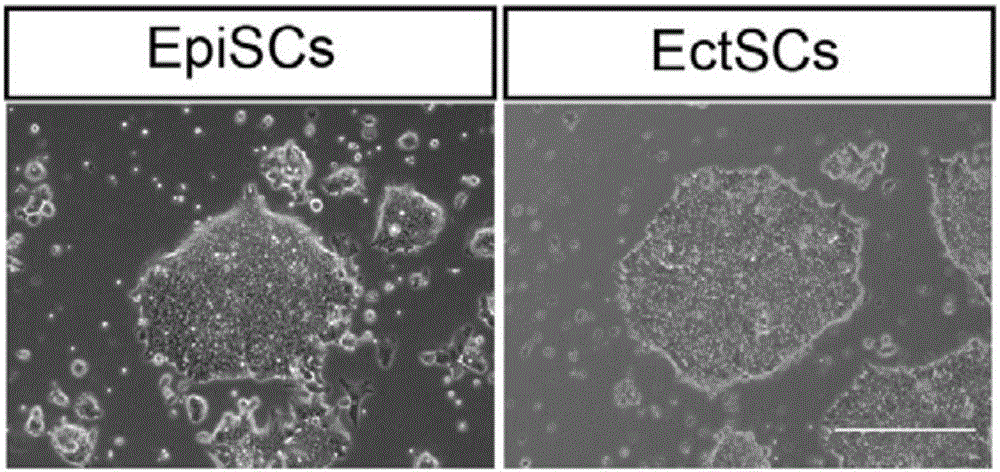
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECULARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECULARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。实施例1从小鼠上胚层干细胞建立外胚层干细胞依据体内早期胚胎发育研究基础,我们在上胚层干细胞的基础培养基CDM(Chemicallydefinedmedium)中添加Nodal抑制剂SB431542和bFGF信号通路因子,将小鼠上胚层干细胞(Epiblaststemcells,EpiSCs)诱导为外胚层干细胞(Ectodermstemcells,EctSCs)。上胚层干细胞的制备方法为现有技术,可参照:Brons,I.G.,etal.,Derivationofpluripotentepiblaststemcellsfrommammalianembryos.Nature,2007.448(7150):p.191-5.具体方法为,先将小鼠上胚层干细胞用四型胶原酶消化成小块,然后将细胞团块以大约1.5×105密度种在由血清(FBS)包被过夜并用PBS漂洗两次的的培养皿中,培养液为含有SB431542(2μM))及bFGF(10ng/ml)的CDM,所述CDM的配方为50mlIMDM,50mlF12,添加7μg/mlInsulin,15μg/ml转铁蛋白transferrin,450μM硫代甘油,以及5mg/mlBSA。两天后以大约1.5×105的密度传代,继续培养在含有SB431542(2μM))及bFGF(10ng/ml)的CDM中(如图1所示)。所得到的外胚层干细胞能够在体外稳定传代40代以上,并保持类似于上胚层干细胞的形态,均为柱状上皮细胞,核质比大的干细胞形态(如图2所示)。此外,经试验发现,当CDM中,所添加的SB431542的终浓度为2-10μM,bFGF的终浓度为10-20ng/ml时,均能够较好地将上胚层干细胞诱导分化为外胚层干细胞。实施例2外胚层干细胞系在基因表达谱上与小鼠外胚层类似为了研究实施例所得到的外胚层干细胞对应于小鼠胚胎的哪一个时期和哪一个位置,我们对所得外胚层干细胞的基因表达谱和胚胎各时期各区域组织的基因表达谱进行皮尔森相关系数分析。相关系数热图反映出不同细胞状态对应的胚胎位置。结果显示,外胚层干细胞对应于E7.0胚胎的AP部分,以及E7.5胚胎的AP和AD部分(如图3B-C所示)。E是Embryonicday的简称,E5.5就是胚胎发育5.5天的意思。具体方法为如下:胚胎解剖与分区我们对E5.5,E6.0,E6.5,E7.0,E7.5天的胚胎进行解剖和切割,把E5.5和E6.0的胚胎分成上胚层(Epiblast)和胚外(ExE)部分。E6.5的胚胎将ExE分离后,又将上胚层分为前端(Anterior,A)和后端(Posterior,P)部分,共三个部分。E7.0和E7.5的胚胎将ExE分离后,又将上胚层分为前端近轴端(Anteriorproximal,AP),前端远轴端(Anteriordistal,AD)和后端(Posterior,P)部分,共四个部分(如图3A所示)。然后将除去ExE之后的10个胚胎组织样品做RNA扩增和RNA测序分析。实验步骤如下:RNA扩增和RNA测序分析(1)样品裂解及RNA提取(a)向每个收集管中加入50μl4M异硫氰酸胍(GuanidineIsothiocyanate)溶液。(b)将收集管放于42℃烘箱中加热15分钟。(c)7000rpm4℃离心30秒,使裂解液离心到管底。注意离心速度不宜过高。(d)将裂解液转移到1.5ml离心管中,加入150μlnuclease-free水,600μl无水乙醇,20μl醋酸钠(1.5M,pH5.5)以及1μl糖原(20mg/ml)。(e)混合均匀后,放于-80℃至少30分钟(-80℃可以放置过夜)。(f)12000rpm4℃离心30分钟。(g)去掉上清,75%乙醇(nuclease-free水配制)洗一遍。(h)12000rpm4℃离心10分钟,去上清。用枪头吸尽残余液体,室温下使沉淀彻底干燥。干燥后立即进行下一步溶解步骤。(2)RNA溶解及变性(a)按下表配制溶解buffer,放置于冰上:ComponentVolume(μl)FinalconcentrationNuclease-freewater1.453’CDSprimer(10μM)11μMdNTP(10mM)11mMRNaseinhibitor(40Uμl-1)0.052UTotalvolume3.45注:3’CDSprimer的核苷酸序列如SEQIDNO:1所示,具体为:5’-AAGCAGTGGTATCAACGCAGAGTACTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTVN-3’。其中3’端,‘N’代表任意碱基,‘V’为A,C或G的任意一个。(b)取3.45μl溶解buffer加到上面的沉淀中,用枪头反复吹打使沉淀完全溶解。注意不要产生气泡,然后将溶解的RNA全部转移到0.2ml薄壁PCR管中。(c)于PCR仪中72℃加热3分钟使RNA变性,结束后立即转移到冰上冷却。(d)7000rpm4℃离心30秒。(3)反转录(a)按下表配制反转录体系ComponentVolume(μl)FinalconcentrationSuperScriptIIreversetranscriptase(200Uμl-1)0.5100URNAseinhibitor(40Uμl-1)0.2510USuperscriptIIfirst-strandbuffer(5×)21XDTT(100mM)0.55mMBetaine(5M)21MMgCl2(1M)0.099mMLNA-TSOprimer(10μM)11μMNulease-freewater0.21Totalvolume6.55注:LNA-TSOprimer的核苷酸序列如SEQIDNO:2所示,具体为:5’-AAGCAGTGGTATCAACGCAGAGTACATrGrG+G-3’。在其3’端有两个核糖核酸碱基(rG)以及一个LNA修饰的鸟嘌呤(+G)。(b)取6.55μlRTmixture加到上述变性的RNA溶液中。(c)7000rpm4℃离心30秒。(d)按以下程序进行RT反应注:SuperScriptII反转录酶活性温度为42℃,温度较低,部分RNA高级结构(如发卡结构,RNA环)等无法完全打开。因此有额外10个循环的变性-反转录反应,使RNA反转录完全。最后70℃15min使反转录酶失活。(e)7000rpm4℃离心30秒。(4)cDNA预扩增(a)按下面表格配置PCR扩增体系ComponentVolume(μl)FinalconcentrationKAPAHiFiHotStartReadyMix(2×)251XA-ISPCRprimers(10μM)10.1μMNuclease-freewater14Totalvolume40注:A-ISPCRprimer的核苷酸序列如SEQIDNO:3所示,具体为:5’-(NH2)AAGCAGTGGTATCAACGCAGAGT-3’,在其5’端碱基的C6处有一个氨基(NH2)修饰。(b)向反转录得到的cDNA中加入40μlPCRmix,混合均匀。7000rpm4℃离心30秒。(c)按照以下程序进行PCR扩增注:PCR反应循环数可根据实际情况进行适当修改。用于胚胎组织使用15个循环。(5)PCR质量检测(a)取2μlPCR产物,稀释20倍。(d)Real-timeQ-PCR检测内参基因GAPDH的表达。若GAPDH的Ct值大于22,则表明扩增结果不理想,样品质量无法满足进行测序要求。此外,还可以检测一些样品特异性表达的基因,检测这些基因的表达是否正常。(e)其余样品进行下一步操作或-80℃保存。(6)cDNA样品的磁珠纯化(a)将AmpureXP磁珠由4℃拿出,使其达到室温平衡,震荡使其混合均匀。(b)每一个cDNA产物(约48μl)中加入38μl磁珠(磁珠:cDNA体积比约为0.8:1)。用枪吹打使其混合均匀。室温孵育8分钟使cDNA结合到磁珠上。(c)将装有cDNA-磁珠混合液的PCR管放到磁力架上,静置5分钟以上,使液体澄清。(d)用枪小心吸尽上清液,避免磁珠被吸走。(e)加入200μl新鲜配制的80%乙醇,磁力架上静置40秒后吸掉乙醇。(f)重复步骤(e)一次。(g)1000rpm离心10秒,使残留的液体聚集到PCR管底部。(h)将PCR管重新放回磁力架,用小枪头吸尽残余液体。(i)打开PCR管盖,室温放置约3-5分钟,使乙醇挥发干净。(j)向PCR管中加入16μl0.1XTE,用枪吹使磁珠在TE溶液中混匀。室温孵育2分钟, 使磁珠上的cDNA溶解。(k)将PCR管重新放回磁力架上,静置2分钟使液体澄清。(l)用小枪头小心吸出液体,转移到新的EP管中,注意不要吸走磁珠。(7)纯化后样品质量检测(a)取1μl样品,用QuibitdsDNAHSAssayKit测定纯化后样品浓度。一般样品浓度要达到0.2ng/μl以上。(b)取1μl样品,用Agilent2100high-sensitivityDNA芯片检测cDNA样品片段大小分布。cDNA样品片段分布应集中在1.5-2kb左右,且没有500bp以下片段出现。(8)样品建库及测序建库及测序部分由测序公司(北京贝瑞和康生物技术有限公司)完成。皮尔森相关系数分析(a)使用R分析软件对早期胚胎切割的10个样品2个细胞系(EpiSCs和EctSCs)的基因表达谱进行分析,计算出差异表达基因。(b)计算每个细胞系与胚胎所有不同区域之间差异表达基因的皮尔森相关系数(PearsonCorrelationCoefficients,PCC)。(c)根据皮尔森相关系数绘制出相关系数热图。实施例3外胚层干细胞系能够在体外分化系统中特异地向神经和表皮分化为了考察外胚层干细胞是否具有外胚层的分化潜能,我们将上胚层干细胞和外胚层干细胞分别在不加BMP4的培养液(G-MEM基础培养液中添加8%KSR,2mMglutamine,1mMpyruvate,0.1mMnonessentialaminoacids,and0.1mMβ-mercaptoethanol)里悬浮培养成细胞团(EB)做神经分化,或在添加BMP4的培养液里悬浮培养成细胞团做表皮分化。我们发现,上胚层干细胞具有多能性,在不加BMP4的条件下可以很快分化到神经命运。而在添加BMP4的条件下则可以向表皮和中内胚层分化。外胚层干细胞在不加BMP4的条件下也同样可以很快分化到神经命运,神经标记基因的表达比上胚层干细胞分化得到的神经前体细胞略高。在添加BMP4的条件下,外胚层干细胞能够向表皮分化,并且表皮标记基因的表达水平比上胚层干细胞分化得到的表皮前体细胞高很多。有意思的是,外胚层干细胞在添加BMP4的条件下,不能向中内胚层分化,中内胚层的标记基因的表达不能上调,始终保持很低的表达水平(如图4所示)。具体实验方法为:RNA的抽提收取相应天数的细胞样品。加入1mlTrizol,冰上放置10min。转移到1.5mlRNase-free的离心管中,Vortex混匀,加入200μlRNase-free氯仿,用力混匀,放置3min。12,000g,4℃离心15min。吸取上清,加入等体积异丙醇,室温放置10min。12,000g,4℃离心10min。弃上清,加入1ml70%的无水乙醇洗盐。7500g,4℃离心5min,弃上清,晾干。加的DEPC水溶解RNA,取1μl通过Nanotrop分光光度计进行定量。反转录RNA并扩增(RT-PCR):取2.5μgRNA,加1μlrandomprimer(Takara),补RNase-free水至12.5μl,置于PCR仪中65℃,10min,然后取出冰浴5min。加入4μl5×firststrandbuffer,2μlDTT,1μl10mMdNTP,0.5μlSuperScriptIIIRNaseH-逆转录酶(Invitrogen),按下列程序继续反应:25℃,10min;50℃,60min;70℃,10min。反应后将RT-PCR产物稀释至200μl,分装后-20℃保存备用。PCR反应考察看家基因GPADH或β-actin的表达验证RT效果。反应体系(10μl)PCRbuffer1μl2mMdNTP1μl20μMprimer(5’+3’)1μlcDNAtemplate2μlTaqenzyme0.1μld2H2O4.9μl反应条件:定量PCR(Q-PCR)(参考相关试剂说明书)反应体系(20ul):2×TaqMixture10μlEvagreen1μl20μMprimer(5’+3’)1μlcDNAtemplate3μld2H2O5μl所用引物的序列序列如下表所示:反应条件:免疫染色的结果进一步证实,体外分化4天之后,在不添加BMP4,向神经分化的条件下,上胚层干细胞和外胚层干细胞都能够向神经命运特化,能够高效地分化成为神经标记基因Tuj1和Nestin阳性的神经前体细胞,外胚层干细胞的神经分化效率略高于上胚层。在添加BMP4的分化体系中,外胚层干细胞能够高效地分化为Ck18阳性的表皮细胞,其分化效率显著高于上胚层干细胞。上胚层干细胞能够在添加BMP4的分化体系中高效地分化为Flk1和Nkx2.5阳性的中内胚层细胞,而外胚层干细胞则不能分化成为Flk1和Nkx2.5阳性的中内胚层细胞(如图5所示)。上述结果提示外胚层干细胞在分化能力上更类似于外胚层,缺乏分化成为中内胚层的能力,但是向表皮分化的能力与上胚层干细胞相比更强。相比于多能性的上胚层干细胞,其分化潜能更加特化。免疫染色的具体实验方法如下:(1)细胞团的固定用巴斯德吸管吸取悬浮培养的细胞团,转移到离心管中,使其自然沉降。小心吸去上清,1×PBS洗细胞团2次,尽量通过自然沉降,不要离心。4℃,4%PFA固定细胞团1hr,1×PBS洗细胞团1次。弃PBS,加入20%蔗糖4℃平衡细胞团,2-3hr后细胞沉到管底,即可切片。若不及时切片,则包埋后转移至-80℃保存。(2)细胞团的冰冻切片用OCT包埋细胞团,注意包埋时蔗糖溶液尽量少。冰冻切片,厚度为10μm。切片在室温放置1-2hr,使切片晾干后转移到-20℃或者-80℃保存。(3)细胞团的免疫染色从冰箱中取出切片,在室温放置10min,使切片上的水汽晾干。在1×PBS中浸泡10min,使OCT溶解在1×PBS中。在玻片上均匀滴加含0.1%TritonX-100,0.5%NGS,1%BSA的 封闭液,在玻片上盖一片parafilm膜,使封闭液分布均匀,室温封闭1hr。弃去封闭液,加1st抗体,4℃反应过夜。1×PBS洗去未吸附的1st抗体,10min×3次。再加2nd抗体,室温避光反应2-3hr。1×PBS洗去未吸附的2nd抗体,10min×3次。而后DAPI染色,室温3-5min,PBS洗一次。封片,室温干燥过夜后4℃保存。以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1