蛋白酯酶E8及其表达纯化、晶体结构和应用的制作方法
本发明属于生物技术领域,具体涉及一种深海沉积物蛋白酯酶E8、其体外重组表达纯化、晶体结构,及其在工业酶制剂中的应用。
背景技术:
酯酶(esterase EC 3.1.1.1)广泛存在于微生物中,能够催化酯类化合物的水解和合成。酯酶具有许多优良的特性,例如具有高度手性选择特异性,催化反应不需要辅酶和辅因子,拥有较广的底物谱,在有机溶液中保持高稳定性等,使得酯酶在工业生产中成为重要的催化剂。酯酶可广泛应用于手性药物合成、食品加工及食品风味改良、油脂水解、皮革绢纺原料脱脂、废水处理、洗涤工业等领域。
海洋来源的酯酶通常具有与海洋环境相关的优良性质,例如温度稳定性、耐盐性、耐碱性、耐低温、以及优异的手性选择性等等,因此,从海洋微生物中筛选出独具特性的酯酶就成了开发新型工业酶制剂的一个重要方向。本发明利用结晶的方法得到了酯酶E8的蛋白晶体并解析了其三维结构。E8晶体结构可在工业酶制剂中底物改造及提高酶活方面具有广泛的应用前景。
技术实现要素:
本发明的目的在于提供一种来源于深海细菌E4A9T的酯酶E8,并对其进行基因工程改造,获得在大肠杆菌中的高效表达、纯化和结晶的方法,以及提供所述酯酶E8第1位到第241位氨基酸的三维晶体结构,及其在工业方面的应用。
本发明提供一种来源于深海细菌E4A9T的酯酶E8,其有241个氨基酸,氨基酸序列如SEQ.ID.NO.1所示,分子量为26.28kDa。
本发明还将来源于深海细菌E4A9T的酯酶E8进行基因工程改造,将其全长基因克隆在pET28b-sumo的载体上。其中,扩增酯酶全基因的上游引物为:
E8F(5’-TCGCGGATCCATGGCTGTTTTTCTTCTG-3’,BamHI),(SEQ.ID.NO.2);
下游引物为:
E8R(5’-TCCGCTCGAGTCATCCCACGATCTCCAGC-3’,XhoI)。(SEQ.ID.NO.3);
表达质粒为pET28b-sumo,转化方法为CaCl2转化法,转化菌株为大肠杆菌DH5α,表达菌株为大肠杆菌BL21(DE3)plus。
本发明优先选择了使用大肠杆菌的原核细胞表达系统(但不排除其他的表达系统,如在其它细菌或者其他的真核生物细胞中进行表达);对以上所述蛋白以融合蛋白的方式进行表达,优先选择了His标签得到了可溶性表达(但不排除其它标签,如MBP或GST等标签也有可溶性表达)。
本发明提供来源于深海细菌E4A9T的酯酶E8的表达和纯化方法,该方法包括:构建融合未突变的E8全长基因的重组载体,用该载体转化大肠杆菌,从而表达带有标签的融合蛋白E8,将上述获得的蛋白通过特异性的与所述特异标签识别的方法分离出目的蛋白,去除标签后再通过凝胶过滤层析的方法得到高纯度的E8的蛋白。
其中,亲和层析的平衡缓冲液优先选择50mM Tris-HCl,pH 8.0;500mM NaCl;5-10%甘油;5-10mM咪唑;2-5mMβ-Me;0.2mM PMSF,洗脱缓冲液优先选择50mM Tris-HCl,pH 8.0;500mM NaCl;5%甘油;250mM咪唑;2mMβ-Me。凝胶过滤层析的缓冲液优先选择20mM Tris-HCl,pH7.4;100mM NaCl;2mM DTT。
本发明还提供来源于深海细菌E4A9T的酯酶E8在催化酯类水解中的应用。
通过酯酶活力测定表明,E8酯酶或上述能表达E8酯酶的宿主菌可用于水解短链脂肪酸酯,例如C2-C10短碳链脂肪酸酯。优选的短链脂肪酸脂为具有C2-C10短碳链的对硝基苯酚酯,例如对硝基苯乙酸酯、对硝基苯丁酸酯、对硝基苯己酸酯、对硝基苯辛酸酯和对硝基苯癸酸酯等,其中底物为对硝基苯酚丁酸酯(C4)时催化活性最高,酶活达U/mg。
E8酯酶催化水解温度范围为20~65℃,优选为45~55℃;所述水解的pH值为4.0~10.5,优选为7.0~8.0。
该酯酶E8酶学活性高,成本低廉,可用于食品加工及食品风味改良、油脂水解、皮革绢纺原料脱脂、废水处理、洗涤工业等领域。
本发明提供上述酯酶E8的结晶方法,所述的方法包括:将酯酶E8浓缩至10-40mg/ml,在4-30℃下用气相扩散法筛选晶体生长条件,优先选择使用15-20℃。
本发明提供衍射性能良好的酯酶E8蛋白质的晶体。
本发明提供酯酶E8与其产物的三维结构,该结构描述了酯酶E8的二级结构组成,肽链走向、组织模式以及三维分子构造。其中,针对酯酶E8蛋白进行衍射,得到酯酶E8蛋白的晶体衍射数据,以印度药用植物Rauvolfia serpentina来源的对聚精液素醛酯酶(PDB ID:2WFL)为模型进行结构解析,最终得到酯酶E8蛋白的三维结构。
在具体的实施方式中,提供了酯酶E8(及其产物对硝基苯酚)的晶体三维结构,其中所述晶体三维结构中的原子为附表1中所列的至少一部分的原子坐标,或者任何与该坐标中至少40%氨基酸残基的主链碳骨架的原子三维坐标的平均根方差小于或等于的结构。
本发明获得了优选酯酶E8的晶体三维结构,分辨率为其晶体结构空间群为P21。晶胞参数为:α=γ=90°,β=91.69°。
在一具体的实施方式中,所述的酯酶E8的三维结构在一个晶体学不对称单位内有两个蛋白分子。该结构共由6个β折叠和15个α螺旋组成,其中,所述的6个β折叠位于中心,所述的15个α螺旋围绕在β折叠的周围。其中β折叠1,即含Ala2-Met7的氨基酸区段,α螺旋1,即含Gly13-Trp17的氨基酸区段,α螺旋2,即含Lys18-Lys27的氨基酸区段,β折叠2,即含Thr30-Phe32的氨基酸区段,α螺旋3,即含Phe39-Ile46的氨基酸区段,α螺旋4,即含Gly51-Glu66的氨基酸区段,β折叠3,即含Val71-Ser77的氨基酸区段,α螺旋5,即含Tyr78-Val82的氨基酸区段,α螺旋6,即含Ala83-Gly91的氨基酸区段,β折叠4,即含Arg93-Gly101的氨基酸区段,α螺旋7,即含Arg110-Met115的氨基酸区段,α螺旋8,即含Ser119-Gly132的氨基酸区段,α螺旋9,即含Gly140-His152的氨基酸区段,α螺旋10,即含Asp157-Leu168的氨基酸区段,α螺旋11,即含Met173-Cys178的氨基酸区段,α螺旋12,即含Gly183-Ile187的氨基酸区段,β折叠5,即含Pro190-His198的氨基酸区段,α螺旋13,即含Met201-Leu211的氨基酸区段,β折叠6,即含Thr214-His222的氨基酸区段,α螺旋14,即含Ala223-Asp228的氨基酸区段,α螺旋15,即含Pro229-Val240的氨基酸区段。
本发明提供酯酶E8发挥酯酶水解功能的作用机制。所述的酯酶E8的晶体结构,第77位丝氨酸(Ser77),第101位天冬氨酸(Asp101)与第222位组氨酸(His222)所构成的催化三连体组成活性中心。
本发明提供酯酶E8位于活性中心的氨基酸残基,包括第77位丝氨酸、第101位天冬氨酸及第222位组氨酸及通过氢键作用稳定构象。
酯酶E8的三维结构可在工业酶制剂中底物改造及提高酶活方面具有广泛的应用前景。
附图说明
图1为酯酶E8的三维结构飘带示意图(α螺旋用紫色表示;β折叠用黄色表示;无规则卷曲用绿色表示;结构包括15个α螺旋和6个β折叠)。其中,A:E8单体;B:E8异构单元(两个分子)。
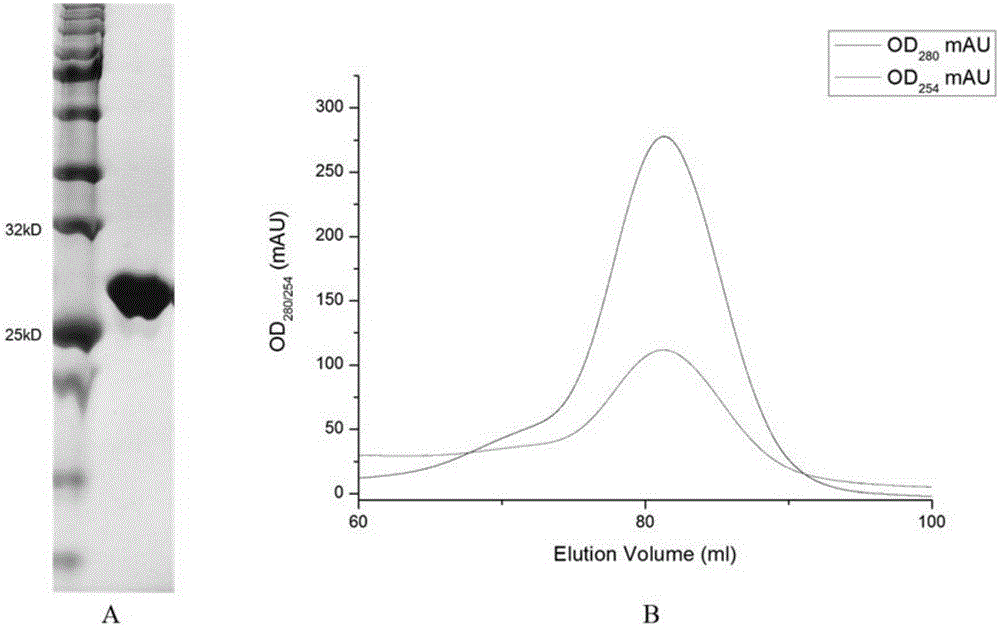
图2为酯酶E8的蛋白纯化图。其中,A:E8聚丙烯酰胺凝胶电泳分析图;B:凝胶过滤层析分析图(Superdex200 16/600,GE Healthcare)。
图3为酯酶E8底物特异性图。C2:对硝基苯酚乙酸酯;C4:对硝基苯酚丁酸酯,C6:对硝基苯酚己酸酯,C8:对硝基苯酚辛酸酯,C10:对硝基苯酚癸酸酯,C12:对硝基苯酚十二酸酯,C14:对硝基苯酚十四酸酯。
图4为酯酶E8最适反应pH图。
图5为酯酶E8最适反应温度图。
图6为酯酶E8热稳定性图。
图7为二价阳离子对酯酶E8活性影响图。
图8为有机溶剂和去垢剂对酯酶E8活性影响图。
图9为酯酶E8的酶活位点示意图。酶活位点包括77位丝氨酸、101位天冬氨酸和222位组氨酸。
具体实施方式
下面采用具体实施例进一步说明本发明的内容。
以下内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
实施例1、酯酶E8的表达、纯化
来源于深海细菌E4A9T的酯酶E8,其氨基酸序列如下:
MAVFLLMHGGGMGGWTWKFMRDALESKGHTVFTPTFTGFGEREHLIGRDVGNAVHVTDIVNVLKYEDLSDVILVAHSYAGTVAPGVLAQAGDRVRRVIYLDAIVPHAGERIASMMGFASEEEAAGLDAMLDGGEGPIGSGVHEQQRAMAKDHPHMMDRNREKWLLDHLSDQPMRATSCVIPVGAESITHPVDYIAAEHTIMGMMHERAEKLGWTIHKHPGDHAFNVGDPEGLADMMLEIVG(SEQ.ID.NO.1)。
通过分子克隆技术将酯酶E8的全长基因克隆到pET28b-sumo的载体上,用来表达氨基末端融合6个His的融合蛋白,将重组载体转化到大肠杆菌BL21(DE3)plus中,37℃振荡培养至OD600达到0.5-0.8时加入终浓度为0.4-1.0mM的IPTG进行诱导表达,表达条件为:20-25℃振荡培养8-16h。
将构建好的重组表达载体转化到大肠杆菌BL21(DE3)plus中进行酯酶E8的可溶性表达。将以50μg/ml卡那霉素和34μg/ml氯霉素为选择压力,转接重组表达菌株于含有上述选择压力的LB液体培养基中,37℃振荡培养至OD600达到0.8时加入终浓度为0.5mM的IPTG进行诱导表达,表达条件为:25℃振荡培养8h。至OD600达到0.8时加入终浓度为0.5mM的IPTG进行诱导表达。25℃,200rpm振荡培养,8h至10小时后通过离心收集细菌,用于纯化。
将离心收集的表达菌以适量缓冲液(50mM Tris,pH 8.0;500mM NaCl;5%甘油;10mM咪唑;2mMβ-Me;0.2mM PMSF)悬菌,使用低温超高压细胞破碎仪(广州聚能生物科技有限公司)裂解菌体,以18000rpm高速离心1h去除沉淀和其它颗粒状杂质。将离心后上清液与Ni-NTA亲和介质结合后,用50mM Tris,pH 8.0;500mM NaCl;5%甘油;50mM咪唑;2mMβ-Me的缓冲液冲洗介质,去除杂蛋白。最终用50mM Tris,pH 8.0;500mM NaCl;5%甘油;250mM咪唑;2mMβ-Me的洗脱液将目的蛋白从亲和介质上洗脱下来,以蛋白质量1/500的UlpⅠ酶切去sumo-His标签,用50mM Tris,pH 8.0;500mM NaCl;5%甘油;10mM咪唑;2mMβ-Me的缓冲液透析降低咪唑浓度,与Ni-NTA亲和介质结合后,收集流穿,流穿以10kDa截留的浓缩管将洗脱液浓缩。将浓缩后的蛋白溶液进一步用凝胶过滤层析(superdex200,16/600)的方法纯化,使用的缓冲液为20mM Tris,pH7.4;100mM NaCl;2mM DTT。将洗脱下来的目的蛋白进行浓缩至浓度为15-30mg/ml,于-80℃保存,用于结晶实验。
实施例2、酯酶E8底物特异性分析
酯酶E8的底物特异性分析,采用体系:100mM磷酸盐缓冲液(pH 7.5),1mM底物,加入3μg纯酶蛋白,在40℃下连续测定吸光值A405 2min。测定采用的底物为:对硝基苯酚乙酸酯(C2),对硝基苯酚丁酸酯(C4),对硝基苯酚己酸酯(C6),对硝基苯酚辛酸酯(C8),对硝基苯酚癸酸酯(C10),对硝基苯酚十二酸酯(C12),对硝基苯酚十四酸酯(C14)。经测定表明,酯酶E8对酰基碳链较短的对硝基苯酚酯(C2、C4、C6、C8、C10和C12)具有催化活性,其中底物为对硝基苯酚丁酸酯(C4)时催化活性最高,较难水解对硝基苯酚十四酸酯(C14)(图2)。结果表明,酯酶E8对酰基碳链较短脂类物质具有催化活性,对于短链脂类的水解活力优于长链脂类。
实施例3、酯酶E8最适反应条件分析
酯酶E8最适反应温度在25~55℃范围内测定。具体操作为:100mM磷酸盐缓冲液(pH 7.5),1mM对硝基苯酚丁酸酯,加入3μg纯酶蛋白,分别在25、30、35、40、45、50、55和60℃条件下连续测定吸光值A405 2min。测定结果表明E8的反应温度范围为25~60℃,最适反应温度为25~55℃(图3)。
酯酶E8最适反应pH在3.0~10.0范围内测定。具体操作为:在不同pH缓冲液中加入1mM对硝基苯酚丁酸酯和3μg纯酶蛋白,在50℃下连续测定吸光值A405 2min。测定使用的缓冲液为:100mM柠檬酸-柠檬酸钠缓冲液(pH 3.0~6.0),100mM磷酸二氢钾—氢氧化钠缓冲液(pH6.0~8.0),100mM Tris-盐酸缓冲液(pH 7.5~8.5)和50mM 2-环己胺基乙磺酸-氢氧化钠缓冲液(pH 8.5~10.0)。测定结果表明,酯酶E8最适反应pH为pH 7.5,在pH 5.0~9.5范围内具有活性(图4)。
实施例4、酯酶E8酶学稳定性分析
二价阳离子对酯酶E8活性影响的测定具体操作为:在反应体系中分别加入10mM Co2+、Cu2+、Ca2+、Mg2+、Zn2+、Sr2+、Mn2+、Ni2+、Ba2+和乙二胺四乙酸(EDTA),测定酶活性。测酶活体系为:100mM Tris-盐酸缓冲液(pH 7.5),1mM对硝基苯酚丁酸酯,3μg纯酶蛋白,于50℃下连续测定吸光值A405 2min。测定结果表明,酯酶E8活性会被Ni2+和Cu2+完全抑制,在Sr2+和EDTA存在下仍能保持较强活性(图5)。
有机溶剂和去垢剂对酯酶E8活性影响的测定具体操作为:在反应体系中分别加入15%(v/v)有机溶剂(异丙醇、乙腈、乙醇、甲醇、丙酮、二甲基亚砜和二甲基甲酰胺)和1%去垢剂(w/v或v/v)(SDS、吐温20、吐温80和Triton X-100)然后测定酶的活性。测活体系为:100mM磷酸盐缓冲液(pH 7.5),1mM对硝基苯酚丁酸酯,3μg纯酶蛋白,于50℃下连续测定吸光值A405 2min。测定结果表明,酯酶E8活性会被SDS、DMF、乙腈、二甲基亚砜、甲醇、Triton X-100、吐温20和80抑制(图6)。
实施例5、酯酶E8的结晶方法
将如上方法表达纯化好的酯酶E8浓缩至浓度约为20-30mg/ml,使用结晶试剂盒(来自Hampton Research等公司的Crystal Screen Kit I/II,Index,Salt,PEG/Ion等)作为晶体生长的初筛条件,采用悬滴气象扩散法进行结晶。本发明人在多个不同的结晶试剂条件下获得了初始晶体。通过后期的优化调整,优选0.1M咪唑,pH7.0-8.0;0.1-0.2M Ca(Ac)2;15%-25%PEG1000的缓冲液作为晶体生长条件,收集到一套分辨率为的X射线衍射数据。
实施例6、酯酶E8的数据收集及结构解析
将制备的晶体以25%的甘油作为防冻剂处理后,冻存于液氮中。晶体X射线衍射的数据收集在上海光源(SSRF)生物大分子晶体学光束线站(BL17U)进行。数据处理使用HKL2000,结构解析以印度药用植物Rauvolfia serpentina来源的对聚精液素醛酯酶(PDB ID:2WFL)为模型,采用分子置换法,利用Refmac程序并辅以Coot软件做进一步修正,最终解析得到酯酶E8蛋白的晶体结构。本领域的普通技术人员可知,于其中所述晶体三维结构中的原子具有表1中所列的至少40%的原子坐标,或者3D蛋白的晶体三维结构中至少40%氨基酸的主链碳骨架的原子结构坐标与表1中的坐标的平均根方差小于或等于的原子坐标,均可被认为与3D蛋白具有雷同结构。
具体而言,所述的酯酶E8的晶体三维结构,一个晶体学不对称单位内有两个蛋白分子。由6个β折叠和15个α螺旋组成,其中,所述的6个β折叠位于中心,所述的15个α螺旋围绕在β折叠的周围。其中β折叠1,即含Ala2-Met7的氨基酸区段,α螺旋1,即含Gly13-Trp17的氨基酸区段,α螺旋2,即含Lys18-Lys27的氨基酸区段,β折叠2,即含Thr30-Phe32的氨基酸区段,α螺旋3,即含Phe39-Ile46的氨基酸区段,α螺旋4,即含Gly51-Glu66的氨基酸区段,β折叠3,即含Val71-Ser77的氨基酸区段,α螺旋5,即含Tyr78-Val82的氨基酸区段,α螺旋6,即含Ala83-Gly91的氨基酸区段,β折叠4,即含Arg93-Gly101的氨基酸区段,α螺旋7,即含Arg110-Met115的氨基酸区段,α螺旋8,即含Ser119-Gly132的氨基酸区段,α螺旋9,即含Gly140-His152的氨基酸区段,α螺旋10,即含Asp157-Leu168的氨基酸区段,α螺旋11,即含Met173-Cys178的氨基酸区段,α螺旋12,即含Gly183-Ile187的氨基酸区段,β折叠5,即含Pro190-His198的氨基酸区段,α螺旋13,即含Met201-Leu211的氨基酸区段,β折叠6,即含Thr214-His222的氨基酸区段,α螺旋14,即含Ala223-Asp228的氨基酸区段,α螺旋15,即含Pro229-Val240的氨基酸区段。
附表1蛋白酯酶E8晶体的原子坐标群如下:
晶体空间群:P21。
晶胞参数为:α=γ=90°,β=91.69°。
I/σ:14.9(2.29)
Rwork/Rfree(%)分别为:14.41和16.94
分辨率范围50-1.50
数据完整性(%):97.9
SEQUENCE LISTING
<110> 复旦大学
<120> 蛋白酯酶E8及其表达纯化、晶体结构和应用
<130> 001
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 241
<212> PRT
<213>
<400> 1
Met Ala Val Phe Leu Leu Met His Gly Gly Gly Met Gly Gly Trp Thr
1 5 10 15
Trp Lys Phe Met Arg Asp Ala Leu Glu Ser Lys Gly His Thr Val Phe
20 25 30
Thr Pro Thr Phe Thr Gly Phe Gly Glu Arg Glu His Leu Ile Gly Arg
35 40 45
Asp Val Gly Asn Ala Val His Val Thr Asp Ile Val Asn Val Leu Lys
50 55 60
Tyr Glu Asp Leu Ser Asp Val Ile Leu Val Ala His Ser Tyr Ala Gly
65 70 75 80
Thr Val Ala Pro Gly Val Leu Ala Gln Ala Gly Asp Arg Val Arg Arg
85 90 95
Val Ile Tyr Leu Asp Ala Ile Val Pro His Ala Gly Glu Arg Ile Ala
100 105 110
Ser Met Met Gly Phe Ala Ser Glu Glu Glu Ala Ala Gly Leu Asp Ala
115 120 125
Met Leu Asp Gly Gly Glu Gly Pro Ile Gly Ser Gly Val His Glu Gln
130 135 140
Gln Arg Ala Met Ala Lys Asp His Pro His Met Met Asp Arg Asn Arg
145 150 155 160
Glu Lys Trp Leu Leu Asp His Leu Ser Asp Gln Pro Met Arg Ala Thr
165 170 175
Ser Cys Val Ile Pro Val Gly Ala Glu Ser Ile Thr His Pro Val Asp
180 185 190
Tyr Ile Ala Ala Glu His Thr Ile Met Gly Met Met His Glu Arg Ala
195 200 205
Glu Lys Leu Gly Trp Thr Ile His Lys His Pro Gly Asp His Ala Phe
210 215 220
Asn Val Gly Asp Pro Glu Gly Leu Ala Asp Met Met Leu Glu Ile Val
225 230 235 240
Gly
<210> 2
<211> 28
<212> DNA
<213>
<400> 2
tcgcggatcc atggctgttt ttcttctg 28
<210> 3
<211> 29
<212> DNA
<213>
<400> 3
tccgctcgag tcatcccacg atctccagc 29
- 还没有人留言评论。精彩留言会获得点赞!