XI型成骨不全致病基因FKBP10的突变位点及其应用的制作方法
本发明涉及XI型成骨不全致病基因FKBP10的突变位点及其应用,具体为XI型成骨不全治病基因FKBP10的突变位点及利用该位点进行致病检测的试剂盒,属于突变基因检测
技术领域:
。
背景技术:
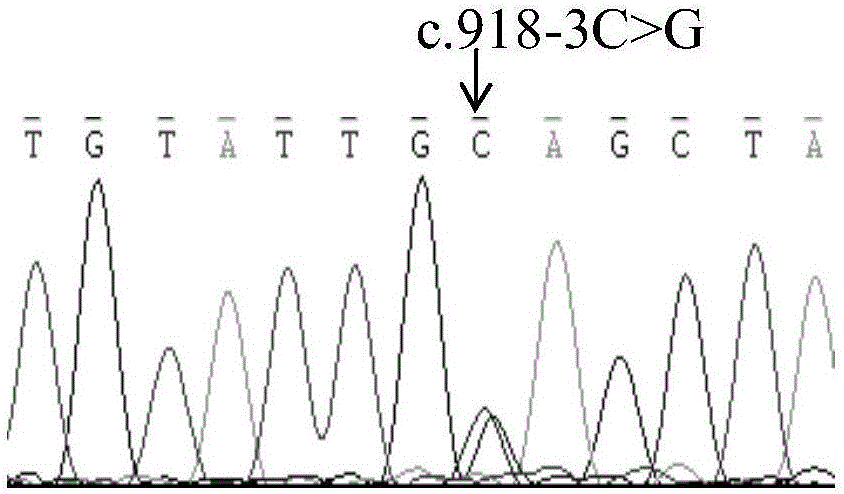
:成骨不全(osteogenesisimperfecta,OI)是一类因I型胶原蛋白合成代谢障碍而引起的遗传性结缔组织疾病.临床症状主要包括骨质疏松、易骨折,部分患者还会有身材矮小、蓝巩膜、牙本质发育不全、早熟性耳硬化、关节及韧带松弛以及肌肉薄弱等症状。患者的个体发病率约为1/10000。成骨不全具有表型与遗传异质性,其临床表现从轻微、无症状到严重骨骼畸形甚至围产期死亡等严重程度不等。1979年,Sillence根据病人临床体征和影像学等特性将成骨不全分为Ⅰ-Ⅳ型。I-IV型均是由于I型胶原蛋白结构基因COL1A1或COL1A2发生突变所致。其后,V-VII型成骨不全先后从异质性较高的IV型成骨不全患者中分离开来,VIII-XVII型成骨不全根据致病基因的先后发现顺序而命名。成骨不全具有遗传异质性,存在常染色体显性遗传与常染色体隐性遗传两种遗传方式,其中常染色体显性遗传是由于I型胶原蛋白结构基因COL1A1或COL1A2突变所致或是IFITM5的定点突变所致。常染色体隐性遗传方式涉及到的患者数量少,但是致病基因种类众多,包括SERPINF1、CRTAP、LEPRE1、PPIB、SERPINH1、FKBP10、SP7、BMP1、TMEM38B、WNT1、CREB3L1、SPARC等。其中FKBP10为XI型成骨不全的致病基因。目前关于FKBP10基因突变的成骨不全患者报道数量非常少,主要以点突变为主,目前尚无关于该基因拷贝数变异的报道。包括全基因组重测序、全外显子组测序、靶向捕获测序等高通量测序技术的出现,为遗传性致病基因的发现提供了有利工具,目前通过高通量发现的遗传性疾病的新致病基因以及致病基因的新发突变位点数量剧增,高通量测序技术结合传统的Sanger测序以及其它单核苷酸多态性检测技术的联合应用,极大的推动了遗传性疾病的基因检测的发展。成骨不全致病基因新突变位点的发现,对于开展该类疾病的分子诊断具有重要意义。技术实现要素:本发明针对现有技术的不足,提供XI型成骨不全致病基因FKBP10的突变位点及其应用。发明概述本发明采用全基因组重测序技术结合数字化PCR、Sanger测序等综合技术,针对临床疑似成骨不全患者进行了全基因组重测序,结合生物信息学发现FKBP10基因外显子2到外显子4存在拷贝数变异,同时外显子5存在杂合剪切位点突变c.918-3C>G。分别通过数字化PCR以及传统PCR基础上的Sanger测序分析,进一步验证了FKBP10外显子2到4的拷贝数变异与杂合剪切突变。拷贝数变异与杂合突变的发现,为探讨XI型成骨不全的发病机制,丰富与发展其诊断方法,从而为临床诊断与治疗提供依据与参考,为开发早期致病基因筛查与治疗等提供基础依据。发明详述本发明技术方案如下:XI型成骨不全致病基因FKBP10的突变位点,该突变位点位于FKBP10基因外显子5的-3bp处,该处核苷酸由C突变为G,突变后该突变所在的cDNA核苷酸序列如SEQIDNO.1所示。上述XI型成骨不全致病基因FKBP10的突变位点的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.11所示,下游引物核苷酸序列如SEQIDNO.12所示;测序引物核苷酸序列如SEQIDNO.11所示。在一实施方案中,FKBP10外显子5上游-3位c.918-3C>G杂合剪切突变扩增的上、下游引物序列分别为SEQIDNO.11与SEQIDNO.12。包括外显子5FKBP10外显子5及其相邻内含子扩增的PCR产物的Sanger测序反应中,测序引物为SEQIDNO.11。XI型成骨不全致病基因FKBP10外显子2的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.2所示,下游引物核苷酸序列如SEQIDNO.3所示;检测探针核苷酸序列如SEQIDNO.4所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。XI型成骨不全致病基因FKBP10外显子3的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.5所示,下游引物核苷酸序列如SEQIDNO.6所示;检测探针核苷酸序列如SEQIDNO.7所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。XI型成骨不全致病基因FKBP10外显子4的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.8所示,下游引物核苷酸序列如SEQIDNO.9所示,检测探针核苷酸序列如SEQIDNO.10所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。一种XI型成骨不全的检测试剂盒,包括拷贝数变异检测部分和杂合突变检测部分,拷贝数变异检测部分包括:上述XI型成骨不全致病基因FKBP10外显子2的扩增引物和检测探针,XI型成骨不全致病基因FKBP10外显子3的扩增引物和检测探针,XI型成骨不全致病基因FKBP10外显子4的扩增引物和检测探针;以及数字化PCR的常规溶液;杂合突变检测部分包括:上述XI型成骨不全致病基因FKBP10的突变位点的扩增引物和测序引物,以及PCR溶液、PCR产物纯化试剂和Sanger测序试剂。根据本发明优选的,所述数字化PCR的常规溶液包括2×ddPCRSupermix,去RNase与DNase水以及微滴发生油。数字化PCR体系中各组分的工作浓度为:ddPCRSupermix浓度为1×,微滴发生油与PCR反应产物体积比为3.5:1,扩增引物900nM,检测探针250nM,样品浓度为2ng/μl。根据本发明优选的,PCR溶液包括:2.5mMdNTP,含Mg2+的10×PCR缓冲液,5U/μlTaqDNA聚合酶,去RNase与DNase水;PCR体系中各组分的工作浓度为:200μMdNTP,含Mg2+的1×PCR缓冲液,0.025U/μlTaqDNA聚合酶,PCR扩增引物0.4μM,样品浓度2.5~5ng/μl。PCR产物纯化试剂包括:1U/μlSAP酶,10U/μlExoI酶,去RNase与DNase水。PCR产物纯化体系中各组分的工作浓度为:0.05U/μlSAP酶,0.5U/μlExoI酶;PCR产物与PCR纯化体系的体积比为2:5。所述Sanger测序试剂包括:BigDye3.1混合液、0.125MEDTA溶液、无水乙醇、体积百分比为75%的乙醇溶液,去RNase与DNase水、Hi-Di甲酰胺溶液。Sanger测序体系中各组分的工作浓度为:BigDye混合液1×,测序引物浓度为0.64pMol/L,样品0.5~2ng/μl。有益效果1、本发明首次发现了FKBP10c.918-3C>G杂合突变与FKBP10基因外显子2到外显子4的拷贝数与XI型成骨不全病症之间的关系,构建了相关的扩增引物和检测探针并设计出相应的检测试剂盒,可用于XI型成骨不全的辅助检测与分子诊断;2、本发明采用于数字化PCR以及传统PCR扩增的引物和探针,均经过前期优化,保证了扩增的特异性与高效性,提高了对拷贝数变异进行识别,提高了检测的可信度与灵敏度;3、本发明丰富了FKBP10基因的致病突变谱,为探讨基因型与表型之间的相互关系、及其分子致病机制的研究具有重要意义,可以用于临床诊断与基础研究。附图说明图1、FKBP10外显子2到外显子4拷贝数变异分析图;图中,从左至右分别为空白对照、患者母亲、患者父亲与患者三人的FKBP10外显子2,外显子3与外显子4的拷贝数。图2、FKBP10c.918-3C>G杂合突变与正常对照Sanger测序峰图;图3、患者父亲、母亲以及患者FKBP10外显子2,外显子3与外显子4的相对表达量柱状图;图4、FKBP10外显子2到外显子4拷贝数变异分析图;图中,从左至右分别为空白对照以及患者母亲羊水、正常对照的FKBP10外显子2,外显子3与外显子4的拷贝数。图5、患者母亲胎儿样本FKBP10外显子5Sanger测序峰图;具体实施方式为详细说明本发明的技术内容、所实现的目的及效果,下面结合实施例做进一步的说明如下。试剂来源Msel(10U/μl,货号R0525S)、Bstz17I(5U/μl,货号R0549S)与CutSmartBuffer(10×conc,货号B7204S)均购自NEB公司。QIAampDNABlood试剂盒(货号51104)购于Qiagen公司。ddPCRTMSupermixforprobes(货号186-3026)与微滴发生油Dropletgenerationoil(货号186-4005)均购自伯乐公司。TaKaRaTaqTM(R001A)PCR溶液相关试剂购自Takara公司。SAP(1U/μl,货号70092Y)、ExoI(10U/μl,货号70073Z)均购自USB公司。BigDye3.1(货号4337455,ThermoFisherScientific公司)、Na2EDTA﹒2H2O(货号15576028,ThermoFisherScientific公司)、Hi-DiFormamide(货号4404307,ABI公司)无水乙醇购自国药集团;去RNase酶与DNase酶水(货号10977015),购自ThermoFisherScientific公司;实施例所需引物与探针均由华大基因合成。实施例1本实施采用全基因组重测序技术,包括外周血样本采集、全基因组DNA提取、DNA片段化、文库构建与测序、测序结果分析等流程,针对一中国汉族成骨不全患者核心家庭进行了全基因组重测序,结合生物信息学分分析发现成骨不全患者FKBP10基因存在外显子2到外显子4的拷贝数变异以及c.918-3C>G杂合突变。其中,父母分别为携带者,其中,母亲为FKBP10外显子2到外显子4拷贝数异常减半,父亲为FKBP10c.918-3C>G杂合突变。根据该结果,通过实施例2与3进行该结果的验证。实施例2采用数字化PCR,分别对FKBP10外显子2到外显子4拷贝数变化进行验证,具体实施如下:(1)FKBP10外显子2到外显子4数字化PCR引物与探针的设计与优化采用BeaconDesigner8.14软件进行上、下游引物与探针的设计,其中,FKBP10外显子2与3的上、下游引物均设计3对,外显子4的上、下游引物设计2对。采用罗氏iCycler480定量PCR仪,通过SyBrGreenI基础上的相对定量PCR方法,根据荧光定量PCR扩增的特异性、熔点曲线峰值的均一性以及Ct值得大小筛选出针对每一外显子的最佳上、下游引物,根据引物序列得到相对应的探针序列,其中,FKBP10外显子2到4的探针的5’端均标记FAM荧光基团、3’端为BHQ1淬灭基团。内参采用拷贝数为2的CEP17基因。CEP17探针5’端标记VIC荧光基团。所有引物与探针序列提交北京华大基因合成。(2)外周血全基因组DNA提取及其片段化采用Qiagen公司QIAampDNABlood试剂盒(货号51104),按照试剂说明书进行全血基因组DNA的提取,采用Nanodrop2000仪器进行DNA浓度与纯度的测定。基因组DNA的片段化反应体系为25μl,其中10×NEBCutSmart缓冲液2.5μl、10U/μlMseI0.5μl、5U/μlBstz1710.5μl、DNA300ng,剩余体积用去RNase与DNase水补足。片段化酶切条件为:37℃孵育15分钟,然后65℃灭火20分钟。(3)数字化PCR反应及反应程序数字PCR反应体系为20μl,其中包括:2×ddPCRSupermix(Bio-Rad公司)10μl、FKBP10外显子2到4的上、下游引物工作浓度均为900nM,探针浓度为250nM。内参基因采用CEP17,内参基因与各外显子的扩增均分别在同一反应管中进行,其中模板量总量为40ng。同时,以去RNase与DNase水替代模板,其它组分不变,作为空白对照。将上述20μl混合物加入其中70μl微滴生成油(Bio-Rad公司,货号10040718),将加样孔放入微滴发生器QX200中,打开电源,2分钟后完成微滴生成。同时,以去RNase与DNase水作为模板,将40μl微滴混合液移入96孔板中,采用定量PCR仪进行定量PCR反应,定量PCR反应程序为:95℃预变性8分钟;95℃30秒,60℃60秒,共计40轮循环;98℃10分钟。(4)定量PCR微滴信号的检测采用微滴阅读器检测发光信号,QuantaSoftsoreware软件计算阳性、阴性扩增的微滴个数,再利用泊松分布计算目标片段的起始浓度,拷贝数计算采用CNV=A/B*Na公式计算。其中,A为靶基因的浓度,B为内参基因的浓度,Na为内参基因在基因组上的拷贝数。人CEP17拷贝数为2。实施例3采用传统PCR基础上的Sanger测序分析,对FKBP10外显子5c.918-3C>G杂合突变进行验证。具体实施如下(1)PCR引物的设计采用在线Primer3.0进行FKBP10外显子引物的设计,交由北京华大基因合成。(2)PCR反应PCR反应体系为20μl,其中包括:10×PCR反应缓冲液2μl、2.5mMdNTP1.8μl、TaqDNA聚合酶0.1μl、5μM上游引物1.6μl、5μM下游引物1.6μl,非酶切片段化DNA模板50ng~100ng,去RNase与DNase水补足至20μl。采用BIO-RAD公司PIC-200型PCR仪,进行降落PCR,PCR反应条件如下:94℃预变性5分钟;94℃变性20秒,62℃退火30秒,退火温度每一循环降低0.5℃,72℃延伸40秒,循环次数14;然后,94℃变性20秒,55℃退火30秒,72℃延伸40秒,循环次数21;72℃终延伸5分钟。(3)PCR产物纯化PCR纯化体系为20μl,其中包括:PCR产物8μl,1U/μlSAP酶1μl,10U/μlExoI酶1μl,去RNase与DNase水10μl。(4)Sanger测序反应DNA测序反应的体系为10μl,包括4μlBigDye,3.2pMol/L测序引物2μl,5~20ng纯化的PCR物,用去RNase与DNase水补足至10μl。反应条件为:96℃10秒,50℃5秒,60℃4分钟,共28个循环反应。PCR循环完并冷却到4℃,取下并马上进行短时间离心。测序反应结束后将反应产物中加入2.5μl0.125M的EDTA溶液,然后加入30μl无水乙醇,颠倒混匀后室温放置15分钟。在12000g离心10分钟后,移除上清。加入60μl体积百分比浓度为70%的乙醇溶液,4℃12000g离心15分钟后,移除上清,重复一次后,待乙醇挥发干净后将沉淀溶于10μlHi-Di甲酰胺。95℃变性4分钟后采用ABI3130XL测序仪进行测序分析。(5)测序结果分析测序结果采用MutationSurvey软件进行突变位点的识别。实验结果全基因组重测序与数字化PCR证明FKBP10基因外显子2到外显子4在正常人以及患者父亲中的拷贝数为2,而在患者以及患者母亲中为1,结果如图1所示。FKBP10c.918-3C>G杂合突变存在于患者及其患者父亲中,正常人与患者母亲中不存在,结果如图2所示。该突变后的cDNA核苷酸序列如SEQIDNO.1所示,具体如下:gagGGACAGTGATCCCCCCACAGGCCTCGCTGGTCTTTCACGTCCTCCTGATTGACGTGCACAACCCGAAGGACGCTGTCCAGCTAGAGACGCTGGAGCTCCCCCCCGGCTGTGTCCGCAGAGCCGGGGCCGGGGACTTCATGCGCTACCACTACAATGGCTCCTTGATGGACGGCACCCTCTTCGATTCCAG实施例4一种XI型成骨不全的检测试剂盒,包括拷贝数变异检测部分和杂合突变检测部分,拷贝数变异检测部分包括:XI型成骨不全致病基因FKBP10外显子2的扩增引物和检测探针,XI型成骨不全致病基因FKBP10外显子3的扩增引物和检测探针,XI型成骨不全致病基因FKBP10外显子4的扩增引物和检测探针;以及数字化PCR的常规溶液;杂合突变检测部分包括:XI型成骨不全致病基因FKBP10的突变位点的扩增引物和测序引物,以及PCR溶液、PCR产物纯化试剂和Sanger测序试剂。所述XI型成骨不全致病基因FKBP10的突变位点的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.11所示,下游引物核苷酸序列如SEQIDNO.12所示;测序引物核苷酸序列如SEQIDNO.11所示;XI型成骨不全致病基因FKBP10外显子2的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.2所示,下游引物核苷酸序列如SEQIDNO.3所示;检测探针核苷酸序列如SEQIDNO.4所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。XI型成骨不全致病基因FKBP10外显子3的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.5所示,下游引物核苷酸序列如SEQIDNO.6所示;检测探针核苷酸序列如SEQIDNO.7所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。XI型成骨不全致病基因FKBP10外显子4的扩增引物,该扩增引物为一对,上游引物核苷酸序列如SEQIDNO.8所示,下游引物核苷酸序列如SEQIDNO.9所示,检测探针核苷酸序列如SEQIDNO.10所示,检测探针5’端连接有FAM荧光标记,3’端连接有BHQ1淬灭基团。上述序列如表1所示:表1名称序列长度SEQID.2CTATGATCGCAACACCTT18SEQID.3GACACACATGCCCATGA17SEQID.4FAM-CCATCGTGGTGGGTGTGGG-BHQ119SEQID.5GTGTGGAACAAGGAAGAC18SEQID.6TGCCATTGTAGTGGTAGC18SEQID.7FAM-AAGTCGCCGTCCTGGACCAT-BHQ120SEQID.8CTCTGGTTGGCTGATCAA18SEQID.9CAGGAATGGAGGGATGATA19SEQID.10FAM-TCTCCAGGACACATGCCCAG-BHQ120SEQID.11GAGGAGCAAGAAGCAGGGC19SEQID.12GAATCAGATGGGGTGACCAG19所述数字化PCR的常规溶液包括2×ddPCRSupermix,去RNase与DNase水以及微滴发生油。2×SuperMix的货号为186-3026,微滴发生油的货号186-3005,均购自伯乐公司。数字化PCR体系中各组分的工作浓度为:ddPCRSupermix浓度为1×,微滴发生油体积与PCR产物体积比为3.5:1,扩增引物900nM,检测探针250nM,样品浓度2ng/μl。PCR溶液包括:2.5mMdNTP,含Mg2+的10×PCR缓冲液,5U/μlTaqDNA聚合酶,去RNase与DNase水;PCR体系中各组分的工作浓度为:200μMdNTP,含Mg2+的1×PCR缓冲液,0.025U/μlTaqDNA聚合酶,PCR扩增引物0.4μM,样品浓度2.5~5ng/μl。PCR产物纯化试剂包括:1U/μlSAP酶,10U/μlExoI酶,去RNase与DNase水;PCR产物纯化体系中各组分的工作浓度为:0.05U/μlSAP酶,0.5U/μlExoI酶;PCR产物与PCR纯化体系的体积比为2:5。所述Sanger测序试剂包括:BigDye3.1混合液、0.125MEDTA溶液、无水乙醇、体积百分比为75%的乙醇溶液,去RNase与DNase水、Hi-Di甲酰胺溶液。Sanger测序体系中各组分的工作浓度为:BigDye混合液1×,测序引物0.64pMol/L,样品0.5~2ng/μl。实验例按照表1中FKBP10外显子2到外显子4数字化PCR引物序列,对FKBP10外显子2与外显子4进行相对定量PCR分析,所用样本包括正常人、患者、患者父母外周血样本。采用Qiagen公司QIAampDNABlood试剂盒(货号51104),按照试剂说明书进行全血基因组DNA的提取,采用Nanodrop2000仪器进行DNA浓度与纯度的测定。定量PCR反应体系10μl,包括LC4802×SYBRGreenIMaster5μl、10μMFKBP10外显子2或外显子3或外显子4以及内参基因CEP17上、下游引物各0.5μl,全基因组DNA10ng,其余用水补足。定量PCR反应程序为该实验反应程序:95℃5min;95℃10s,60℃10s,72℃10s为1个循环,共计45个循环;95℃5s,65℃1min,97℃Continuous为1个循环,熔解曲线分析;98℃10min,37℃5min冷却。所得到的不同样本不同外显子的Cp值利用公式2^(-△△Cp)方法进行相对定量分析,以正常对照作为参考,则可以看出,相对于正常对照,患者父亲FKBP10外显子2,外显子3与外显子4相对表达量分别为0.68、0.82与0.65;患者母亲FKBP10外显子2,外显子3与外显子4的相对表达量分别为0.31、0.40与0.23;患者FKBP10外显子2~4相对表达量分别为0.33、0.41与0.35;与正常对照相比,患者以及患者母亲的相对表达量低于健康对照以及患者父亲,患者父亲的FKBP10外显子2-4相对表达量也要低于健康对照(图3)。比较相对定量PCR与数字化PCR结果可以看出,数字化PCR能够直接计算出每一样本的实际拷贝数,从检测的准确度与灵敏度方面均高于定量PCR。采用数字化PCR对患者母亲羊水DNA样本进行患者已发现的两位点的突变检测,即FKBP10外显子2,外显子3以及外显子4的拷贝数以及外显子5上游-3位是否存在C到G的杂合突变。图4与图5表明患者母亲羊水样本中存在FKBP10外显子2~4的拷贝数为正常人的一半,即拷贝数为1,不存在c.918-3C>G的杂合突变。该结果表明本发明的方法能够准确识别FKBP10外显子2到外显子4拷贝数变异的检测以及FKBP10外显子5上游内含子的基因突变检测,该方法亦适用于其它拷贝数变异的检测与基因突变检测。SEQUENCELISTING<110>山东省医药生物技术研究中心<120>XI型成骨不全致病基因FKBP10的突变位点及其应用<160>12<170>PatentInversion3.5<210>1<211>193<212>DNA<213>Homosapiens<400>1gagggacagtgatccccccacaggcctcgctggtctttcacgtcctcctgattgacgtgc60acaacccgaaggacgctgtccagctagagacgctggagctcccccccggctgtgtccgca120gagccggggccggggacttcatgcgctaccactacaatggctccttgatggacggcaccc180tcttcgattccag193<210>2<211>18<212>DNA<213>人工合成<400>2ctatgatcgcaacacctt18<210>3<211>17<212>DNA<213>人工合成<400>3gacacacatgcccatga17<210>4<211>19<212>DNA<213>人工合成<400>4ccatcgtggtgggtgtggg19<210>5<211>18<212>DNA<213>人工合成<400>5gtgtggaacaaggaagac18<210>6<211>18<212>DNA<213>人工合成<400>6tgccattgtagtggtagc18<210>7<211>20<212>DNA<213>人工合成<400>7aagtcgccgtcctggaccat20<210>8<211>18<212>DNA<213>人工合成<400>8ctctggttggctgatcaa18<210>9<211>19<212>DNA<213>人工合成<400>9caggaatggagggatgata19<210>10<211>20<212>DNA<213>人工合成<400>10tctccaggacacatgcccag20<210>11<211>19<212>DNA<213>人工合成<400>11gaggagcaagaagcagggc19<210>12<211>20<212>DNA<213>人工合成<400>12gaatcagatggggtgaccag20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1