一种6‑取代‑9H‑嘌呤类衍生物及其制备方法和应用与流程
本发明属于药物化学领域,具体涉及一种用于抗炎的6-取代-9H-嘌呤类衍生物及其制备方法和应用。
背景技术:
炎症(inflammation)是机体对病原体刺激所发生的防御反应,以血管反应为中心,伴随实质和间质细胞的再生以修复受损组织。通常情况下,炎症是一个自限性过程,随着致炎因素消失,促炎反应介质与抗炎反应介质达到平衡,炎症消退,但在某些特殊情况下,致炎因素持续性低强度刺激,使炎症反应持续进行,转为慢性炎症(chronic inflammation),这种持续存在、无法消退的炎症也称为非可控性炎症(non-resolvinginflammation)。适度的炎症反应对机体起保护作用,而慢性非可控性炎症对机体造成的损伤则远甚于致炎因素本身机体产生炎症,会引起物质代谢障碍,细胞变性和坏死。近年来,研究发现机体炎症在某些因素的影响下,还会诱发心血管疾病和癌症等严重危害人们健康的疾病。
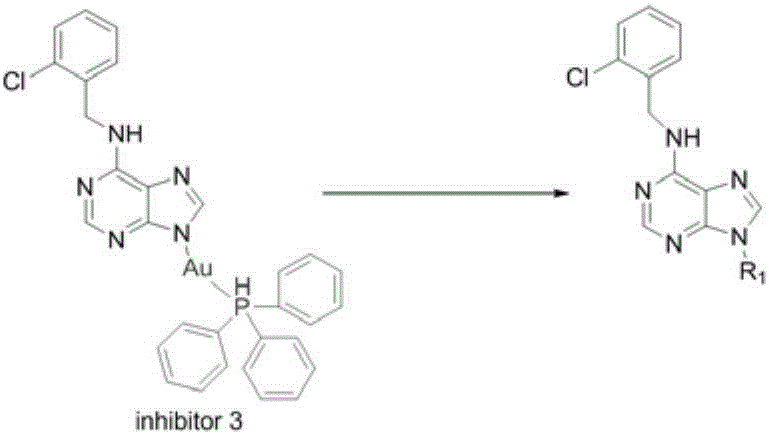
6-苄基嘌呤化合物络合金离子(inhibitor 3)具有很强的抗炎活性,能够显著降低由LPS诱导的巨噬细胞产生的多种炎症因子的表达量,包括TNF-α、IL-1β等,产生的抗炎效果可以达到目前临床上使用的吲哚美辛水平。但对化合物inhibitor 3进行结构分析后,发现inhibitor 3存在一些不足之处,具体如下:由于inhibitor 3含有金离子,使得药物生产成本增加,加重了患者的治疗负担;如果长期服用,会导致体内金元素的堆积,诱发药物的副作用,限制了其对慢性炎症的治疗;化合物含有重金属元素,改变嘌呤化合物的极性,导致化合物在体内的溶解性和生物学利用度不高。基于上述的分析,可以对inhibitor 3进行有针对性的设计和结构优化(见图1),以期待得到一种高效和廉价的抗炎效果好的化合物。
技术实现要素:
本发明提供了一种6-取代-9H-嘌呤类衍生物及其制备方法与应用,该6-取代-9H-嘌呤类衍生物具有较好的抗炎活性,具有作为抗炎药物的潜力。
一种6-取代-9H-嘌呤类衍生物,结构如式(I)所示:
式(I)中,R选自吡咯烷基、呋喃-2-甲基、苯磺酰基、取代或者未取代的苯基或苄基的一种,其中,苯基或苄基上的取代基独立地选自C1~C4烷氧基、C1~C4烷基、羟基、卤素、中的一种或者多种;
R4独立地选自H或者烷基取代的苄基。
试验结果表明,同6-苄基嘌呤化合物络合金离子(inhibitor 3)相比,本发明的6-取代-9H-嘌呤类衍生物对炎症因子的抑制率更高,具有更好的抗炎活性,具有作为抗炎药物的潜力。
作为优选,所述的R4为H,即所述的6-取代-9H-嘌呤类衍生物的具体结构如下:
作为优选,所述的6-取代-9H-嘌呤类衍生物,结构如式(II)或式(III)所示:
式(II)中,R1为F、Cl、OH、-OCH3;
式(III)中,R2独立地选自4-F。
式(IV)中,R4为
作为优选,式(I I)所示的化合物为W1中,式(III)所示的化合物为W2~W8中的一种,式(IV)所示的化合物为W9~W10,取代基的种类和位置如具体实施方式中的表2所示。
作为进一步的优选,所述的6-取代-9H-嘌呤嘌呤衍生物为下列具体化合物中的一种:
N-(3-氟苄基)-9H-嘌呤-6-胺,化学结构如下:
N-(4-甲氧基苯基)-9H-嘌呤-6-胺,化学结构如下:
N-(呋喃-2-基甲基)-9H-嘌呤-6-胺,化学结构如下:
本发明还提供了一种所述的6-取代-9H-嘌呤类衍生物的制备方法,包括以下步骤:
在催化剂的作用下,6-氯嘌呤和胺类化合物在有机溶剂中发生反应,反应结束后经过后处理得到所述的6-取代-9H-嘌呤类衍生物。
作为优选,所述的催化剂为三乙胺,所述的有机溶剂为正丁醇。
该制备方法具体过程如下:称取1mmol的6-氯嘌呤以及2mmol的W1-W10对应的胺类化合物与25mL圆底烧瓶中,其两种原料的摩尔比为1:2,并加入5mL溶剂正丁醇,并加入50μL的三乙胺作为催化剂,在110℃油浴加热回流搅拌5h,取反应液进行TLC跑板,紫外荧光下观察反应完全,冷却,抽滤,重结晶得到W1-W10。
本发明还提供了一种所述的6-取代-9H-嘌呤类衍生物在制备抗炎药物中的应用。
作为优选,所述的抗炎药物包含治疗有效量的6-取代-9H-嘌呤类衍生物和药用辅料。
所述的抗炎药物的剂型为注射剂、片剂、胶囊剂、气雾剂、栓剂、膜剂、滴丸剂、软膏剂、控释剂、缓释剂或纳米制剂。
同现有技术相比,本发明的有益效果体现在:
本发明的6-取代-9H-嘌呤类衍生物对试验用细胞有一定抑制作用,表现出一定的抗炎活性。合成的化合物W2、W4对炎症因子的抑制率普遍高于阳性对照药6-苄基嘌呤化合物络合金离子(inhibitor 3),所以这类化合物具有较好的抗炎作用。
附图说明
图1为现有技术中对6-苄基嘌呤化合物络合金离子(inhibitor 3)的结构进行优化的方式;
图2为本发明所有目标化合物毒性检测的示意图;
图3为本发明所有目标化合物作用于抑制炎症因子的抑制率的示意图;
图4为本发明所有目标化合物作用于抑制炎症因子的抑制率的示意图;
图5为本发明所有目标化合物作用于NO的抑制率的示意图;
图6为本发明所有目标化合物作用于抑制COX和iNOS的示意图。
具体实施方式
下面将结合附图和实施例对本发明做进一步的描述。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效果。
一、化合物的合成
实施例1~2L1-L2的合成
步骤1:称取80mg 6-氯嘌呤于25mL圆底烧瓶中并加入5mL正丁醇,超声溶解,然后加入147mg 2-氯苄胺,2-氯苄胺与6-氯嘌呤的摩尔比为2:1,并加入50μL三乙胺作为催化剂。在110℃油浴加热回流搅拌5h,进行TLC跑板监测,紫外荧光下观察反应完全,冷却,抽滤得固体,重结晶得到6-(2-氯苄胺基)嘌呤。
步骤2:称取90mg 6-(2-氯苄胺基)嘌呤与氯代甲烷于适量的圆底烧瓶中,氯代甲烷与6-(2-氯苄胺基)嘌呤的摩尔比为2:1,量取适量溶剂乙腈,并加入80mg碳酸钾作为催化剂。在80℃油浴加热回流搅拌24h,进行减压旋干。加入适量水,所得固体抽滤取出,液体用乙酸乙酯萃取后旋干制沙,合并所有固体,利用柱层析进行纯化得到L1-L2化合物的纯品。产物结构和分子量见表1。
反应式如下:
实施例3~10L3-L10的合成
步骤1:称取80mg 6-氯嘌呤于25mL圆底烧瓶中并加入5mL正丁醇,超声溶解,然后加入147mg 2-氯苄胺,2-氯苄胺与6-氯嘌呤的摩尔比为2:1,并加入50μL三乙胺作为催化剂。在110℃油浴加热回流搅拌5h,取反应液进行TLC跑板,紫外荧光下观察反应完全,冷却,抽滤得固体重结晶得到6-(2-氯苄胺基)嘌呤。
步骤2:称取90mg 6-(2-氯苄胺基)嘌呤以及L3-L10对应的不同结构的卤代烃于适量的圆底烧瓶中,卤代烃与6-(2-氯苄胺基)嘌呤的摩尔比为2:1,量取适量溶剂乙腈,并加入80mg碳酸钾作为催化剂。在80℃油浴加热回流搅拌24h,进行减压旋干。加入适量水,所得固体抽滤取出液体用乙酸乙酯萃取后旋干制沙,合并所有固体,利用柱层析进行纯化。产物结构和分子量见表1。
反应式如下:
R=F、Cl、-C(CH3)3、-CF3、-OCH3或-NO2
实施例11W1的合成
称取1mmol的6-氯嘌呤以及2mmol的对氟苄胺于25mL圆底烧瓶中,其两种原料的摩尔比为1:2,并加入5mL溶剂正丁醇,并加入50μL的三乙胺作为催化剂,在110℃油浴加热回流搅拌5h,取反应液进行TLC跑板,紫外荧光下观察反应完全,冷却,抽滤,重结晶得到W1产物结构和分子量见表2。
反应式如下:
实施例12-18W2-W8的合成
称取1mmol的6-氯嘌呤以及2mmol的W2-W8对应的苯胺类化合物于25mL圆底烧瓶中,其两种原料的摩尔比为1:2,并加入5mL溶剂正丁醇,并加入50μL的三乙胺作为催化剂,在110℃油浴加热回流搅拌5h,取反应液进行TLC跑板,紫外荧光下观察反应完全,冷却,抽滤,重结晶得到W2-W8。产物结构和分子量见表2。
反应式如下:
R=F、Cl、OH、-OCH3;其中,表示取代位置
实施例19-20W9-W10的合成
称取1mmol的6-氯嘌呤以及2mmol的W9-W10对应的胺类化合物于25mL圆底烧瓶中,其两种原料的摩尔比为1:2,并加入5mL溶剂正丁醇,并加入50μl的三乙胺作为催化剂,在110℃油浴加热回流搅拌5h,取反应液进行TLC跑板,紫外荧光下观察反应完全,冷却,抽滤,重结晶得到W9-W10。
反应式如下:
其中,表示取代位置
表1化合物L1-L10的结构及物理数据
表2化合物W1-W10的结构及物理数据
化合物L1-L10、W1-W10的ESI-MS,1H-NMR和13C-NMR数据
N-(2-chlorobenzyl)-9H-purin-6-amine(L1)
White powder,Yield:85.6%,Mp:156.1-158.9℃,ESI-MS[M+H]+:260.2,1H-NMR(600MHz,DMSO-d6):δ(ppm):12.987(m,1H,9-Purine-H),8.140-8.157(m,3H,2,8-Purine-H+NH),7.432-7.439(m,1H,3'-2-Cl-Ph-H),7.252-7.283(m,3H,4',5',6'-2-Cl-Ph-H),4.760(s,2H,CH2).13C-NMR(600MHz,DMSO-d6):152.343,139.107,131.711,129.020,128.226,127.970,127.052.
N-(2-chlorobenzyl)-9-methyl-9H-purin-6-amine(L2)
White powder,Yield:50.5%;Mp:120.1-123.2℃;ESI-MS[M+H]+:274.3;1H-NMR(600MHz,CD3Cl):δ(ppm):8.414(s,1H,2-Purine-H),7.752(s,1H,8-Purine-H),7.473-7.487(m,1H,3-Ph-H),7.370-7.385(m,1H,6-Ph-H),7.201-7.260(m,2H,4,5-Ph-H),6.474(s,1H,NH),4.975(s,2H,CH2),4.226(s,3H,9-CH3).13C-NMR(600MHz,CD3Cl):δ(ppm):154.828,153.181,139.476,136.192,133.816,129.689128.912,127.083,120.112,38.954,15.722.
N-(2-chlorobenzyl)-9-(4-fluorobenzyl)-9H-purin-6-amine(L3)
Light Yellow powder,Yield:45.2%;Mp:150.1-152.9℃;ESI-MS[M+H]+:368.2;1H-NMR(600MHz,CD3Cl):δ(ppm):8.435(s,1H,2-Purine-H),7.678(s,1H,8-Purine-H),7.493-7.502(m,1H,3'-2-Cl-Ph-H),7.363-7.366(m,1H,6'-2-Cl-Ph-H),7.260-7.286(m,2H,4',5'-2-Cl-Ph-H),7.193-7.213(m,2H,2',6'-4-F-Ph-H),7.013-7.041(m,2H,3',5'-4-F-Ph-H),6.459(s,1H,NH),5.319(s,2H,9-CH2),4.926(s,2H,NHCH2).13C-NMR(600MHz,CD3Cl):163.612,161.971,154.872,139.684,136.095,133.853,131.658,129.956,129.756,128.974,127.100,116.235,46.635,32.075,29.507.
9-(4-(tert-butyl)benzyl)-N-(2-chlorobenzyl)-9H-purin-6-amine(L4)
Yellow powder,Yield:45.2%;Mp:140.1-142.8℃;ESI-MS[M+H]+:406.2;1H-NMR(600MHz,CD3Cl):δ(ppm):8.440(s,1H,2-purine-H),7.673(s,1H,8-purine-H),7.192-7.484(m,8H,Ph-H),6.465(s,1H,NH),5.434(s,2H,9'-CH2),4.966(s,2H,N-CH2),1.257(s,9H,CH3).13C-NMR(600MHz,CD3Cl):154.916,153.709,139.803,139.671,133.894,130.029,130.723,129.747,129.035,128.039,127.126,126.196,46.752.
N-(2-chlorobenzyl)-9-(4-chlorobenzyl)-9H-purin-6-amine(L5)
Green powder,Yield:56.2%;Mp:149.2-152.8℃;ESI-MS[M+H]+:384.6;1H-NMR(600MHz,CD3Cl):δ(ppm):8.412(s,1H,2-Purine-H),7.672(s,1H,8-Purine-H),7.474-7.484(m,1H,3'-2-Cl-Ph-H),7.335-7.365(m,1H,6'-2-Cl-Ph-H),7.302-7.326(m,2H,4',5'-2-Cl-Ph-H),7.183-7.236(m,4H,2',3',5',6'-4-Cl-Ph-H),6.456(s,1H,NH),5.316(s,2H,9-CH2),4.964(s,2H,N-CH2).13C-NMR(600MHz,CD3Cl):154.891,153.652,145.231,139.710,136.027,133.176,130.419,129.394,129.099,128.721,128.929,127.142,125.915,46.651,29.835.
N-(2-chlorobenzyl)-9-(3-nitrobenzyl)-9H-purin-6-amine(L6)
Yellow powder,Yield:46.9%;Mp:160.8-162.7℃;ESI-MS[M+H]+:395.1;1H-NMR(600MHz,CD3Cl):δ(ppm):8.425(s,1H,2-Purine-H),8.177(s,1H,2'-3-NO2Ph-H),8.163(m,1H,4'-3-NO2Ph-H),7.744(s,1H,8-Purine-H),7.599-7.612(m,1H,2'-2-Cl-Ph-H),7.481-7.536(m,2H,5',6'-3-NO2Ph-H),7.360-7.375(m,1H,6'-2-Cl-Ph-H),7.199-7.215(m,2H,4',5'-2-Cl-Ph-H),6.456(s,1H,NH),5.316(s,2H,9-CH2),4.964(s,2H,N-CH2).13C-NMR(600MHz,CD3Cl):154.921,153.728,148.732,139.484,137.947,135.928,130.332,130.032,129.724,129.014,123.527,122.730,46.501.
N-(2-chlorobenzyl)-9-(4-methoxybenzyl)-9H-purin-6-amine(L7)
Light Yellow powder,Yield:47.3%;Mp:164.3-166.9℃;ESI-MS[M+H]+:380.7;1H-NMR(600MHz,CD3Cl):δ(ppm):8.445(s,1H,2-Purine-H),7.675(s,1H,8-Purine-H),7.498-7.513(m,1H,3'-2-Cl-Ph-H),7.362-7.373(m,1H,6'-2-Cl-Ph-H),7.210-7.289(m,2H,4',5'-2-Cl-Ph-H),7.191-7.248(m,2H,2,6'-4-OCH3-Ph-H),6.860-6.886(m,2H,3',5'-4-OCH3-Ph-H),6.350(s,1H,NH),5.277(s,2H,9-CH2),4.615(s,2H,NHCH2),3.801(s,3H,OCH3).13C-NMR(600MHz,CD3Cl):159.831,154.802,154.402,139.833,133.864,129.974,129.721,137.102,114.547,55.426,46.922.
N-(2-chlorobenzyl)-9-(3,5-dimethoxybenzyl)-9H-purin-6-amine(L8)
White powder,Yield:45.6%;Mp:175.2-178.1℃;ESI-MS[M+H]+:410.1;1H-NMR(600MHz,CD3Cl):δ(ppm):8.432(s,1H,2-Purine-H),7.665(s,1H,8-Purine-H),7.464-7.578(m,1H,3'-2-Cl-Ph-H),7.352-7.365(m,1H,6'-2-Cl-Ph-H),7.174-7.210(m,2H,4',5'-2-Cl-Ph-H),6.515-6.525(m,1H,4'-3,5-OCH3-Ph-H),6.404(s,2H,2',6'-3,5-OCH3-Ph-H),6.388(s,1H,NH),5.268(s,2H,9-CH2),4.905(s,2H,N-CH2),3.737(s,6H,OCH3).13C-NMR(600MHz,CD3Cl):161.441,154.862,153.439,139.934,137.936,136.123,133.822,129.914,129.694,128.943,127.033,106.022,100.132,55.512,47.313.
N-(2-chlorobenzyl)-9-(4-(trifluoromethyl)benzyl)-9H-purin-6-amine(L9)
White powder,Yield:81.3%;Mp:170.7-172.5℃;ESI-MS[M+H]+:418.3;1H-NMR(600MHz,CD3Cl):δ(ppm):8.343(s,1H,2-Purine-H),7.874(s,1H,8-Purine-H),7.593-7.606(d,2H,3',5'-4-CF3-Ph-H,J=7.8Hz),7.480-7.495(m,1H,3'-2-Cl-Ph-H),7.369-7.383(m,3H,4',5',6'-2-Cl-Ph-H),7.191-7.229(m,2H,2',6'-4-CF3-Ph-H),6.251(s,1H,NH),5.464(s,2H,9-CH2),4.872(s,2H,N-CH2).13C-NMR(600MHz,CD3Cl):154.922,153.714,139.805,139.676,133.892,130.203,129.735,129.034,128.034,127.143,126.204,46.745.
N-(2-chlorobenzyl)-9-(3-methoxybenzyl)-9H-purin-6-amine(L10)
White powder,Yield:47.3%;Mp:145.2-147.1℃;ESI-MS[M+H]+:380.4;1H-NMR(600MHz,CD3Cl):δ(ppm):8.423(s,1H,2-Purine-H),7.654(s,1H,8-Purine-H),7.489-7.532(m,1H,3'-2-Cl-Ph-H),7.384-7.396(m,1H,6'-2-Cl-Ph-H),7.195-7.213(m,2H,4',5'-2-Cl-Ph-H),6.819-6.855(m,4H,2',4',5',6'-3-OCH3-Ph-H),6.591(s,1H,NH),5.834(s,2H,9-CH2),4.956(s,2H,N-CH2),3.873(s,3H,-OCH3).13C-NMR(600MHz,CD3Cl):160.223,154.821,153.452,139.953,137.251,136.121,133.833,130.237,129.492,129.751,128.954,127.106,120.130,113.823,55.243,47.244,42.446.
N-(4-fluorobenzyl)-9H-purin-6-amine(W1)
Yellow powder,Yield:80.1%;Mp:155.2-157.1℃;ESI-MS[M+H]+:244.2;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.961(s,1H,9-Purine-H),8.653(s,1H,2-Purine-H),8.093(s,1H,8-Purine-H),7.285-7.337(d,2H,2,6-Ph-H,J=8.0Hz),7.124-7.243(d,2H,3,5-Ph-H,J=8.0Hz),6.721(s,1H,NH),5.901(s,2H,N-CH2).13C-NMR(600MHz,DMSO-d6):154.787,152.314,151.236,139.154,128.546,126.784,119.414,43.024.
N-(3-methoxyphenyl)-9H-purin-6-amine(W2)
Yellow powder,Yield/%:76.5;Mp:146.2-149.1℃;ESI-MS[M+H]+:242.3;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.891(s,1H,9-Purine-H),8.621(s,1H,2-Purine-H),8.232(s,1H,8-Purine-H),7.209-7.232(m,1H,6-Ph-H),7.120-7.134(m,2H,4,5-Ph-H),6.825-6.825(m,1H,2-Ph-H),6.571(s,1H,NH),3.762(s,3H,CH3).13C-NMR(600MHz,DMSO-d6):162.121,152.914,150.346,143.734,141.236,129.456,119.224,109.523,108.455,100.235,56.348.
N-(3-chlorophenyl)-9H-purin-6-amine(W3)
Green powder,Yield:86.2%;Mp:135.1-137.9℃;ESI-MS[M+H]+:246.7;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.842(s,1H,9-Purine-H),8.622(s,1H,2-Purine-H),7.802(s,1H,8-Purine-H),7.509-7.472(m,1H,6-Ph-H),7.220-7.324(d,2H,4,5-Ph-H),6.927-7.125(d,1H,2-Ph-H),6.651(s,1H,NH).13C-NMR(600MHz,DMSO-d6):153.965,152.673,144.984,139.761,136.128,131.245,121.786,118.745,117.563.
N-(4-chloro-3-fluorophenyl)-9H-purin-6-amine(W4)
White powder,Yield:73.9%;Mp:135.1-138.2℃;ESI-MS[M+H]+:264.6;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.636(s,1H,9-Purine-H),8.552(s,1H,2-Purine-H),7.792(s,1H,8-Purine-H),7.420-7.424(m,1H,6-Ph-H),7.217-7.255(m,1H,5-Ph-H),7.127-7.225(m,1H,2-Ph-H),6.672(s,1H,NH).13C-NMR(600MHz,DMSO-d6):164.39,151.93,150.73,144.96,139.83,131.49,118.18,109.84,107.39.N-(4-chlorophenyl)-9H-purin-6-amine(W5)
White powder,Yield:73.9%;Mp:156.7-158.2℃;ESI-MS[M+H]+:246.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):12.531(s,1H,9-Purine-H),8.141(s,1H,2-Purine-H),7.562(s,1H,8-Purine-H),7.485-7.524(d,2H,2,6-Ph-H,J=7.6Hz),6.934-7.143(d,2H,3,5-Ph-H,J=8.0Hz),6.456(s,1H,NH).13C-NMR(600MHz,DMSO-d6):153.965,152.674,144.984,139.763,136.124,131,245,121.784,118.741,117.568.
N-(furan-2-ylmethyl)-9H-purin-6-amine(W6)
White powder,Yield:76.4%;Mp:162.2-164.8℃;ESI-MS[M+H]+:216.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):12.942(s,1H,9-Purine-H),8.113-8.202(s,3H,2,8-Purine-H+NH),7.538(s,1H,4'-Furan-H),6.358(s,1H,3'-Furan-H),6.230(s,1H,2'-Furan-H),4.694(s,2H,N-CH2).13C-NMR(600MHz,DMSO-d6):154.846,152.795,151.592,146.713,143.575,137.414,119.723,113.454,107.232,39.734.
N-(4-methoxyphenyl)-9H-purin-6-amine(W7)
Grey powder,Yield:74.8%;Mp:161.9-164.2℃;ESI-MS[M+H]+:242.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):11.291(s,1H,9-Purine-H),8.742(s,1H,2-Purine-H),8.033(s,1H,8-Purine-H),7.585-7.624(d,2H,2,6-Ph-H,J=8.0Hz),7.034-7.123(d,2H,3,5-Ph-H,J=8.0Hz),6.744(s,1H,NH),3.963(s,3H,-CH3).13C-NMR(600MHz,DMSO-d6):153.756,153.746,149.243,136.794,133.722,129.563,122.135,119.233,114.483,60.235.
N-((4-((9H-purin-6-yl)amino)phenyl)sulfonyl)acetamide(W8)
Grey powder,Yield:74.3%;Mp:200.1-202.7℃;ESI-MS[M+H]+:333.4;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.052(s,1H,9-Purine-H),11.461(s,1H,NH-C=O),8.843(s,1H,2-Purine-H),8.731(s,1H,8-Purine-H),7.475-7.524(d,2H,3,5-Ph-H,J=8.0Hz),7.204-7.243(d,2H,2,6-Ph-H,J=7.8Hz),6.632(s,1H,NH),1.923(s,3H,-CH3).13C-NMR(600MHz,DMSO-d6):172.095,154.283,152.863,144.264,143.791,139.855,129.986,119.778,111.793,28.372.
4-((9H-purin-6-yl)amino)phenol(W9)
White powder,Yield:77.3%;Mp:156.1-157.3℃;ESI-MS[M+H]+:228.1;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.091(s,1H,9-Purine-H),8.782(s,1H,2-Purine-H),7.892(s,1H,8-Purine-H),7.285-7.324(d,2H,2,6-Ph-H,J=7.6Hz),6.934-7.143(d,2H,3,5-Ph-H,J=8.0Hz),6.561(s,1H,NH),5.534(s,1H,OH).13C-NMR(600MHz,DMSO-d6):153.236,151.837,143.924,140.713,138.242,131.232,129.652,123.522,119.235.
6-(pyrrolidin-1-yl)-9H-purine(W10)
White powder,Yield:85.2%;Mp:162.1-164.2℃;ESI-MS[M+H]+:190.2;1H-NMR(600MHz,DMSO-d6):δ(ppm):13.241(s,1H,9-Purine-H),8.742(s,1H,2-Purine-H),8.121(s,1H,8-Purine-H),3.786(m,4H,N-CH2+N-CH2),1.879(m,4H,CH2CH2).13C-NMR(600MHz,DMSO-d6):159.122,155.124,153.527,149.238,138.955,127.944,125.734,117.684,60.235,42.824.
本发明所合成目标化合物的性状及其溶解性如下:
化合物L1-2,L8-10,W4-6,W9-10为白色固体。L3,L7为浅黄色,W1-2,L4,L6为黄色,L5,W3为绿色,W7-8为灰色。易溶于DMSO、DMF中。
本发明所合成的化合物,进行质谱测试,正极均显示了[M+1]+,且信号较强,本发明所合成的化合物,进行1H-NMR和13C-NMR测试,从1H-NMR和13C-NMR图谱上可以清楚的看到化合物的氢信号及其所处的化学位移。
二、化合物抗炎活性数据
1、合成化合物细胞毒性测试
(1)细胞铺板:1)计算实验所需细胞的密度,小心地吸取培养瓶中的培养液,接着加入一定量的PBS液把培养液洗干净,再用胰酶溶液(0.25%)溶解贴壁生长细胞3min,然后往培养基中加入10%的血清,用来中止胰酶继续消化细胞,吹打瓶壁使得贴壁生长的细胞脱离进入并且均匀地分散于培养液中,在培养瓶中加入1640培养液,并将细胞稀释至所需的密度44000cells/mL;2)按每个孔的浓度90μl/well的标准,将所配好的细胞溶液均匀地加入到96孔酶标孔中,用无菌的PBS填充边缘孔;3)取出96孔酶标培养板,按照要求合理地设置好实验组和对照组。其中以inhibitor3作为阳性对照药,实验组各组使用一种化合物,每种化合物分别设成9个相同的浓度梯度,每个梯度浓度设置三个复孔,作为重复实验,保证实验的准确性和可靠性,对照组中的每一个孔则直接接种100μl细胞悬液,不加入任何物质,可以检测实验是否受到污染;4)最后合适的条件下培养细胞,具体要求是在5%CO2,37℃的条件下,孵育24h。
(2)加入测试化合物:1)将所合成的测试化合物和阳性对照物均溶解于100%的DMSO中配置成浓度为200x的溶液;2)用移液枪准确地吸取上述配置好的溶液7μl到含有133μl的完全培养基中(即稀释20倍,最后得到为10x的溶液);3)吸取上述稀释后的溶液10μL均匀地加入到96孔酶标板中(最后得到为1x的溶液),4)最后在合适的条件下培养细胞,具体要求是在5%CO2,37℃的条件下,孵育24h。
(3)、结果测定:1)将步骤(2)中,经过24h孵育的96孔酶标板取出,按要求先放置在室温下30min,备用;2)根据先前计算好的量,向每孔加入30μl的Cell Titer-Glo试剂并且摇晃10min用来诱导细胞并且促使细胞溶解作用;3)放置在室温2min后,使得荧光信号达到稳定的状态;4)用酶联免疫的方法检测波长在570nm处各孔的吸光值,并且准确地记录下结果。最后按照给出的公式,计算出化合物的抑制率。具体的公式如下:抑制率(%)=(对照孔OD值-实验孔OD值)/对照孔OD值X100%。
实验结果:图2为本发明所有目标化合物毒性检测的示意图。从图2可以看出:合成的化合物毒性均普遍低于阳性对照药inhibitor 3。
2、ELISA法检测TNF-α和IL-1β含量
操作方法:
1)配制肉汤——刺激小鼠产生大量巨噬细胞
称取牛肉膏0.15g,蛋白胨0.5g,NaCl 0.25g,可溶性淀粉3g,将肉汤煮至透明,降至室温才可以腹腔注射。
2)给小鼠注射肉汤2mL,三天后提细胞(此期间可以将化合物配制好,用DMSO溶解)。
3)提细胞铺板:小鼠摘眼,放血减少腹腔中红细胞,后断髓处死,身体用75%酒精消毒,仰位定在泡沫上,固定头,四肢,尾。在胸廓正中线中位处,用弯镊夹起隔膜,用注射器向腹腔内注射RPMI-1640培养基(不含FBS)3~4ml,轻揉腹部,使巨噬细胞与培养基混匀。用弯镊夹起中间隔膜,用手术剪(竖直方向拿),剪开隔膜,用移液枪将腹腔内液体吸起,移入15ml离心管内,离心1100r,5min,弃上清。向已离心的细胞内加入含有FBS的培养基约2ml,反复轻轻吹打成细胞悬液。细胞计数(20μL/孔),将细胞分到六孔板1ml上培养(5×105/孔)于37℃,5%CO2培养。4~6h后,取出用PBS洗,换液。
4)加10μmol浓度的合成化合物1μl,30min后加入LPS(0.5μg/ul)1μl刺激,分为三组:同种类药+LPS,LPS(刺激组),con(对照组,只有细胞与DMSO)。
5)上述处理完毕后再放入培养箱中进行孵育>24h。
检测方法:
(1)包被:取出经过孵化后的培养基,加入40μl的一抗(capureantibody),1mL的coating buffer(10X),用移液枪吹打均匀混匀,加入到ELISA板中,每个孔均加入100μl,用保鲜膜对ELISA板进行包埋,在4℃的条件下过夜。在此期间配置PBST:将500μl的吐温20溶解于1000mL的PBS溶液之中。
(2)加入AD进行封闭:将过夜培养之后的培养基倒掉,用PBST洗三次,每个孔加入250μl的量,每次用移液枪吹打1~2min,最后一次将培养基倒过来,轻轻在纸上拍干,按每孔200μl的量加入AD溶液,加完之后,用保鲜膜包好,在摇床上封闭1h。当培养基封闭完之后,继续用PBST溶液洗三次,每次依旧加入250μl的量,用移液枪轻轻吹打1~2min。在进行上述封闭的过程中,可以将上清液拿出解冻。
(3)加样:按照每孔100μl的量加入一定的混合溶液,其中样品占5%,AD占95%,用保鲜膜继续包好,并且在摇床上孵育2h。
(4)加入二抗:取出二抗40μl,AD100mL,充分混匀之后,按照每孔100μl的量,加入到上述的ELISA板中,继续用保鲜膜进行包好,放在摇床上继续孵育1h。
(5)加入酶:取出ELISA板后,用PBST洗三次,每孔加入250μl的量,每次用移液枪吹打1~2min,加入HRP酶,每孔的量为100μl,继续用保鲜膜进行包好,然后放在摇床上继续孵育1h。
(6)加入显色剂:用PBST洗三次,每孔加入250μl的量,每次用移液枪吹打1~2min,在避光的条件下,按照每孔100μl的量加入显色剂TMP,显色至蓝色即可。
(7)终止反应:取出ELISA板后,向每个孔加入50μl加入浓度为2mol/L的H2SO4。
(8)测OD值:在波长为450nm的条件下,测定对炎症因子的吸光度,根据公式计算。
实验结果:图3为本发明所有目标化合物作用于抑制炎症因子的抑制率的示意图。从图3可以看出:合成的化合物L1,L4,W2,W4对炎症因子的抑制率高于阳性对照药inhibitor 3,所以这几种化合物具有较好的抗炎作用。
通过比较目标化合物和阳性对照药可以发现:化合物L1,L4,W2,W4对炎症因子TNF-a和IL-6的抑制率达到都超过了50%,最高为80%左右,初步推断2、9-二取代嘌呤衍生物对抗炎药物的研发有一定的潜力。4个优选化合物抗炎活性的进一步研究
通过第一部分化合物在10μM浓度下对LPS诱导的TNF-α和IL-1β含量抑制作用的初筛结果,得到化合物L1,L4,W2和W4对炎症因子TNF-α和IL-1β具有较强的抑制作用。因此,本部分将选取这4个化合物进一步研究其抗炎活性。
3、ELISA法检测TNF-α、IL-1β、PGE2和IL-6的含量
具体的实验操作步骤如下:
(1)、包被:取出经过孵化后的培养基,加入40μl的一抗(capureantibody),1mL的coating buffer(10X),用移液枪吹打均匀混匀,加入到ELISA板中,每个孔均加入100μl,用保鲜膜对ELISA板进行包埋,在4℃的条件下过夜。在此期间配置PBST:将500μl的吐温20溶解于1000mL的PBS溶液之中。
(2)、加入AD进行封闭:将过夜培养之后的培养基倒掉,用PBST洗三次,每个孔加入250μl的量,每次用移液枪吹打1~2min,最后一次将培养基倒过来,轻轻在纸上拍干,按每孔200μl的量加入AD溶液,加完之后,用保鲜膜包好,在摇床上封闭1h。当培养基封闭完之后,继续用PBST溶液洗三次,每次依旧加入250μl的量,用移液枪轻轻吹打1~2min。在进行上述封闭的过程中,可以将上清液拿出解冻。
(3)、加样:按照每孔100μl的量加入一定的混合溶液,其中样品占5%,AD占95%,用保鲜膜继续包好,并且在摇床上孵育2h。
(4)、加入二抗:取出二抗40μl,AD100mL,充分混匀之后,按照每孔100μl的量,加入到上述的ELISA板中,继续用保鲜膜进行包好,放在摇床上继续孵育1h。
(5)、加入酶:取出ELISA板后,用PBST洗三次,每孔加入250μl的量,每次用移液枪吹打1~2min,加入HRP酶,每孔的量为100μl,继续用保鲜膜进行包好,然后放在摇床上继续孵育1h。
(6)、加入显色剂:用PBST洗三次,每孔加入250μl的量,每次用移液枪吹打1~2min,在避光的条件下,按照每孔100μl的量加入显色剂TMP,显色至蓝色即可。
(7)、终止反应:取出ELISA板后,向每个孔加入50μl加入浓度为2mol/L的H2SO4。
(8)、测OD值:在波长为450nm的条件下,测定对炎症因子的吸光度,根据公式计算。
实验结果:图4为本发明所有目标化合物作用于抑制炎症因子的抑制率的示意图。从图4可以看出:合成的化合物L1,L4,W2和W4对几种炎症因子的抑制率普遍接近或高于阳性对照药inhibitor 3,且有一定剂量依赖性,所以这类化合物具有较好的抗炎作用。
通过比较目标化合物和阳性对照药可以发现:化合物L1,L4,W2和W4对几种炎症因子抑制率普遍接近或高于阳性对照药inhibitor 3,初步推断2,9-二取代嘌呤衍生物对抗炎药物的研发有一定的潜力。
4、NO含量的测定
具体的实验操作步骤如下:
(1)RAW264.7细胞培养:细胞株购买于中国科学院上海分院的细胞库,培养条件:双抗生素(链霉素和青霉素)和10%的胎牛血清的DMEM完全培养基中,并放在37℃,5%CO2培养环境中培养。
(2)Griess法检测NO的含量:取对数期的RAW264.7细胞进行实验操作,加入LPS,培养30min,加入药物2.5,5,10,20μmol,继续培养过夜。取细胞培养液,离心(6000rpm,5min),取10μl细胞上清液,加入Griess试剂(2%对氨基苯磺酰胺用5%H3PO4配制,0.2%的奈乙烯二胺)100μl与之混匀,室温避光静置10min,用酶标仪于540nm波长处测定吸光度值,计算样品中的NO含量。
抑制NO含量结果:图5为本发明所有目标化合物作用于NO的抑制率的示意图。从图5可以看出:合成的化合物合成的化合物L1,L4,W2和W4对几种炎症因子的抑制率普遍接近或高于阳性对照药inhibitor 3,且有一定剂量依赖性,所以这类化合物具有较好的抗炎作用。
通过比较目标化合物和阳性对照药可以发现:化合物L1,L4,W2和W4对几种炎症因子的抑制率普遍接近或高于阳性对照药inhibitor 3,且有一定剂量依赖性,初步推断2,9-二取代嘌呤衍生物对抗炎药物的研发有一定的潜力。
5、RT-PCR的测定
具体的实验操作步骤如下:
(1)、RNA含量的测定:利用TRIzol方法提取RNA,根据计算加入和适量的TRIzol试剂,混合后静置5min,按TRIzol:氯仿=5:1的量加入氯仿,静置3min,然后在12000rpm,4℃离心15min,吸取含有RNA水层进入新的离心管;按TRIzol:异丙醇=1:2的量加入异丙醇,静置10min,然后12000rpm,4℃离心10min,留沉淀,弃上清;按TRIzol:75%的乙醇(DEPC配置),离心,小心弃去上清。
(2)、RNA浓度和纯度的测定:分别用琼脂糖凝胶电泳和分光光度计检测所提取RNA的完整性和浓度。
(3)、RT-PCR:
反应体系:
引物序列:qmCOX2(74bp):
Forward Primer5'TGAGCAACTATTCCAAACCAGC3'
Reverse Primer5'GCACGTAGTCTTCGATCACTATC3'
qmGAPDH(149bp):
Forward Primer5'TATGTCGTGGAGTCTACTGGT 3'
Reverse Primer 5'GAGTTGTCATATTTCTCGTGG 3'
qmiNOS(127bp):
Forward Primer5'GTTCTCAGCCCAACAATACAAGA 3'
Reverse Primer 5'GTGGACGGGTCGATGTCAC 3'
实验结果:图6为本发明所有目标化合物作用于抑制COX和iNOS的示意图。从图6可以看出:合成的化合物L1,L4,W2和W4对COX和iNOS的抑制率普遍接近或高于阳性对照药inhibitor 3,且有一定剂量依赖性,所以这类化合物具有较好的抗炎作用。
通过比较目标化合物和阳性对照药可以发现:化合物L1,L4,W2和W4对几种炎症因子的抑制率普遍接近或高于阳性对照药inhibitor 3,且有一定剂量依赖性,初步推断2,9-二取代嘌呤衍生物对抗炎药物的研发有一定的潜力。
化合物的抗炎活性实验总结
所合成的20个6,9-二取代嘌呤衍生物先在10μM的浓度条件下,用ELISA法检测其对TNF-α和IL-1β的抑制作用,初筛选出具有良好抗炎活性的化合物。我们发现化合物L1、L4、W2和W4对炎症因子显示出较好的抑制作用,于是开始对这4个化合物进行深入的抗炎活性研究。抗炎活性的深入研究主要体现在以下三个方面,首先是化合物检测浓度的增加,检测浓度范围从10μM,增加到5,2.5μM,探讨化合物浓度对抗炎活性的影响。化合物L1、L4、W2和W4浓度与抑制作用呈线性关系,即随着化合物的浓度增加,其抗炎能力增强。其次是炎症因子种类的增多,从初筛的两种炎症因子(TNF-α和IL-1β)增加到包括IL-6、PGE2和NO在内的五种炎症因子。化合物L1、L4、W2和W4对这五种炎症因子均具有抑制作用。最后是检测水平的增加,从初筛单纯考虑炎症因子水平到深入研究考虑炎症相关mRNA水平的变化。化合物L1、L4、W2和W4能够在mRNA水平上,抑制COX-2和iNOS,从而起到抗炎作用。
- 还没有人留言评论。精彩留言会获得点赞!