多肽探针、包含该探针的试剂盒及其应用的制作方法
本发明涉及生物医疗领域,具体而言,涉及一种多肽探针、包含该探针的试剂盒及其应用。
背景技术:
细胞凋亡是一种由基因控制的细胞主动死亡过程,对多细胞生物个体的发育、正常细胞更新、组织保持正常结构与功能有着积极而重要的意义,异常细胞凋亡则会导致肿瘤、神经退行性疾病等疾病的发生。细胞凋亡的实施是由一系列半胱氨酸蛋白酶所引发的级联反应来实现的(Cold Spring Harb.Perspect.Biol.,2013,5(4):a008656),在半胱氨酸蛋白酶家族中,半胱氨酸蛋白酶-3属于效应型凋亡酶,激活的半胱氨酸蛋白酶-3可降解一系列底物,包括凋亡抑制物、细胞外基质与骨架蛋白以及DNA修复相关因子,使细胞生化以及形态学发生改变,导致细胞凋亡(Oncogene,2008,27(48):6194-6206)。半胱氨酸蛋白酶-3是细胞凋亡执行阶段的关键蛋白酶,因此可以通过测定半胱氨酸蛋白酶-3的活性来测定细胞凋亡过程。
双砷染料-四半胱氨酸标签体系是一种具有广阔应用前景的活细胞蛋白荧光标记方法(Science,1998,281(5374):269-272)。在该系统中,四半胱氨酸标签是一个包含四个半胱氨酸残基的六肽或十二肽(Nat.biotechnol.,2005,23(10):1308-1314),半胱氨酸残基两两结合在一起,形成半胱氨酸-半胱氨酸二联子,这两个二联子被脯氨酸-甘氨酸二联子分隔开来。四半胱氨酸标签对双砷染料具有较高的特异性和亲和力。双砷染料在被1,2-乙二硫醇螯合的情况下不发荧光,但是一旦与四半胱氨酸标签结合就会发出很强的荧光。除了以线性方式存在外,四半胱氨酸标签中的两个半胱氨酸-半胱氨酸二联子还可以被分离开来,但是它们在空间上必须相临近(Nat.Chem.Biol.,2007,3(12):779-784)。在该标记系统中,四半胱氨酸标签的空间构象会对所形成双砷染料-四半胱氨酸标签复合物的稳定性和量子产率产生极大的影响(J.Am.Chem.Soc.,2002,124(21):6063-6076)。
半胱氨酸蛋白酶-3通常以无活性的酶原存在细胞中,需要被上游的激活型凋亡酶切割而得以活化。激活的半胱氨酸蛋白酶-3可以特异性切割天冬氨酸-谷氨酸-缬氨酸-天冬氨酸四肽序列,根据这一特性,一系列基于天冬氨酸-谷氨酸-缬氨酸-天冬氨酸的探针被开发出来用于测定半胱氨酸蛋白酶-3的活性,对应的方法有荧光检测法、电化学法、比色法、表面等离子体共振法、生物发光法、电致化学发光法。随着纳米技术的发展,一些基于纳米材料的多肽探针如量子点复合多肽探针、纳米金复合多肽探针、石墨烯复合多肽探针也被开发出来用于测定半胱氨酸蛋白酶-3的活性(Chem.rev.,2015,115(22):12546-12629)。此外,一些基于荧光共振能量转移反应的蛋白探针以及荧光开关(Nat.Commun.,2013;,4:2157)也被开发出来用于测定细胞内半胱氨酸蛋白酶-3的活性。在这些方法中,荧光标记会在一定程度上降低半胱氨酸蛋白酶-3对底物的切割效率,制备纳米传感器则使得检测过程变得复杂和低效。因此迫切需要发展简单、灵敏、高效的方法来测定细胞内半胱氨酸蛋白酶-3活性从而来检测细胞凋亡过程。此外,本领域在检测其它酶的活性时也或多或少的存在上述问题,且缺乏一种高效的可针对各种酶的活性进行检测的技术。
有鉴于此,特提出本发明。
技术实现要素:
在本发明中,我们充分利用双砷染料-四半胱氨酸标签复合物的稳定性和量子产率极度依赖于四半胱氨酸标签空间构象这一特性,设计了一种新型无标记多肽分子探针,进而发展了一种简单、灵敏测定酶活性的方法。
在描述本发明的化合物、组合物、蛋白质、肽等以及方法之前,应当理解,这些实施方式不限于所描述的特定方法、方案以及试剂,这是因为它们可以变化。还应当理解,本文所使用的术语仅用于描述特定实施方式目的,并且不旨在限制本实施方式或权利要求的范围。
为了实现本发明的上述目的,特采用以下技术方案:
一种多肽探针,所述多肽探针选自下列物质及其二聚体的组合物:
X1-Y1-CC;
其中,X1为具有二聚化能力的多肽;
Y1选自待检测酶的酶切位点序列。
其中,X1段形成的二聚体可自发形成,也可在其它辅助蛋白或辅助条件下形成(例如X1段某些氨基酸残基被修饰或肽段处于疏水环境中),优选的,所述二聚体为自发形成。
该探针包含有至少三个不同的功能区域,CC即两个半胱氨酸,是与双砷染料结合的部位,用来读取待检测酶的活性。在没有被待检测酶切割的时候,多肽探针之间的(自发)二聚化会使得两个半胱氨酸-半胱氨酸二联子在空间上相互接近,从而能与双砷染料结合发出较强的荧光;相反,待检测酶的酶解作用会将半胱氨酸-半胱氨酸二联子从多肽中解离下来,虽然被切割的多肽依然能够二聚,但却缺少了锚定双砷染料的部位,双砷染料因而不能发光。因此,通过测定切割前后荧光的变化,可以定量测定待检测酶的活性。
通过更改Y1段多肽的序列,理论上本发明提供的探针可对所有具有切割肽段能力的酶的活性进行检测。
优选的,如上所述的多肽探针,所述X1的全部或部分氨基酸序列选自D构型氨基酸。
由于在生物进化过程中,氨基酸自然选择为L型,生物体内的酶无法识别并切割D构型氨基酸。此设计可防止X1区段被其它蛋白酶非特异性切割,也能有效延长本发明提供的多肽探针的半衰期。
X1区段中D构型和L构型的氨基酸可交叉排列,例如一个D构型一个L构型交替相接,也可以起到上述作用;最优选的,X1的氨基酸序列全部选自D构型氨基酸。
优选的,如上所述的多肽探针,所述X1为亮氨酸拉链,或包含亮氨酸拉链结构的多肽。
亮氨酸拉链是一种作为二聚体化结构域的超二级结构,且使相互平行的α-螺旋之间产生粘附力。一个亮氨酸拉链包含了多个亮氨酸残基,通常每七个氨基酸残基就出现一次,这形成了一条两性的α-螺旋,疏水区只在其中一侧。这个疏水区提供了二聚化的区域,使得基序可以像“拉链”一样拉起来。
除此之外,根据本发明提供的技术内容的启示,X1段多肽可根据生物中常见的蛋白二聚体中负责二聚化的蛋白区段进行设计,例如受体酪氨酸激酶、某些核受体蛋白、14-3-3蛋白、驱动蛋白、Factor XI、Factor XIII、Toll样受体、纤维原蛋白、G蛋白的βγ亚基二聚体等等,这对本领域技术人员是容易的。亮氨酸拉链仅作为最优选的技术方案。
优选的,X1段多肽可选自下述氨基酸序列:
QLEDKVEELLSKNYHLENEVARLKKLVG;
KLEALEGKLEAEGKGKLEAUGICLEALE;
GEIAALKQEIAALKKENAALKWEIAALKQGYY;
ASIARLEEKVKTLKAQNYELASTANMLREQVAQLGAP;
ASAAELEERVKTLKAEIYELQSEANMLREQIAQLGAP;
ASAAELEERVKTLKAEIYELQSEANMLREQGAP;
ASAAELEERVKTLKAEIYELQSEGAP;
ESKVSSLESKVSSLESKVSSLESKVSSLESKVSSLESKVSS。
更优选的,上述氨基酸序列均为D构型氨基酸。
优选的,如上所述的多肽探针,所述多肽探针的N端进行了乙酰化修饰;
和/或;
所述多肽探针的C端进行了酰胺化修饰。
多肽探针两端的修饰可起到增加探针的稳定性的作用。
优选的,如上所述的多肽探针,所述X1与所述Y1之间还包括Linker1和/或所述Y1与所述CC之间还包括Linker2;
优选的,所述Linker1的氨基酸数目为1~30个,更优选为1~5个;
优选的,所述Linker2的氨基酸数目为1~30个,更优选为1~5个。
Linker1及Linker2的氨基酸数量可以是1,2,3,4,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个。
Linker1及Linker2的序列也可以选自(GGGGS)n、(GGGS)n、(GGS)n或Gn,其中n可以是1,2,3,4,5或6。
优选的,如上所述的多肽探针,所述Y1的序列为DEVD。
DEVD为半胱氨酸蛋白酶-3(Caspase3)及半胱氨酸蛋白酶-7(Caspase7)的酶切位点。
优选的,如上所述的多肽探针,所述X1的氨基酸序列为D构型的asaaeleervktlkaeiyelrskanmlreqiaqlgap。
此序列为D构型的亮氨酸拉链结构。
优选的,如上所述的多肽探针,所述Linker2的氨基酸序列为G。
一种多肽探针,用于检测Caspase3或Caspase7的酶活性,其序列为asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC;其中asaaeleervktlkaeiyelrskanmlreqiaqlgap为D构型的氨基酸。
优选的,asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC的N端和C端分别进行了乙酰化和酰胺化修饰。
一种诊断试剂盒,其包括如上所述的多肽探针、双砷染料、待检测酶切割所述多肽探针得到酶切产物时所用的缓冲液1以及所述双砷染料对所述酶切产物进行标记时所用的缓冲液2;
优选的,所述缓冲液1为含有用于避免二硫键出现的还原剂,更优选的,所述还原剂选自二硫苏糖醇和/或三(2-羰基乙基)磷盐酸盐;
优选的,所述缓冲液2为含有用于避免单个所述CC片段与所述双砷染料的结合的洗脱剂,更优选的,所述洗脱剂选自2,3-二巯基-1-丙醇和/或1,2-乙二硫醇。
优选的,如上所述的诊断试剂盒,所述双砷染料选自ReAsH-EDT2、FlAsH-EDT2、F2FlAsH或F4FlAsH中的一种或多种。
优选的,如上所述的诊断试剂盒,当所述还原剂选自二硫苏糖醇时,所述还原剂的浓度为0.5~2mM。
优选的,如上所述的诊断试剂盒,当所述洗脱剂选自2,3-二巯基-1-丙醇时,所述洗脱剂的浓度为0.03~0.10mM。
如上所述的多肽探针或如上所述的诊断试剂盒在检测Y1所对应的酶的活性中的应用;
优选的,所述检测在细胞裂解液中或在体细胞中进行;
更优选的,所述细胞选自HeLa细胞、NIH/3T3细胞、C6细胞、MCF7细胞、人HCE细胞、Jurkat T细胞、Huh-7细胞、DU145细胞、U-937细胞以及HepG2细胞中的任一种。
如上所述的多肽探针或如上所述诊断试剂盒在检测单个细胞中特定酶的活性中的应用。
如上所述的多肽探针或如上所述诊断试剂盒在检测半胱氨酸蛋白酶-3和/或半胱氨酸蛋白酶-7活性中的应用。
如上所述的多肽探针或如上所述诊断试剂盒在检测细胞凋亡中的应用。
优选的,所述细胞凋亡可为自然发生的细胞程序性死亡、疾病造成的细胞凋亡或环境造成的细胞凋亡,例如紫外照射、双氧水、地塞米松、肿瘤坏死因子等所诱导的细胞凋亡的测定。
如上所述的多肽探针或如上所述诊断试剂盒在制备和/或评价用于治疗细胞凋亡相关疾病的药物中的应用;
优选的,如上所述的应用,所述细胞凋亡相关疾病为肿瘤、自体免疫性疾病或神经退行性疾病;
更优选的,如上所述的应用,所述肿瘤包括:白血病、淋巴瘤、头颈部鳞状细胞癌、肺癌、食道癌、肝癌、结直肠癌、乳腺癌、卵巢癌、宫颈癌、肾细胞癌和黑色素瘤;
更优选的,如上所述的应用,所述自体免疫性疾病包括:系统性红斑性狼疮、自身免疫性淋巴细胞增生综合征、类风湿性关节炎、甲状腺炎;
更优选的,如上所述的应用,所述神经退行性疾病包括:阿兹海默氏症、亨丁顿舞蹈症、帕金森病、中风和肌肉萎缩性侧索硬化症。
一种诊断细胞凋亡相关疾病的方法,包括:
将待诊断主体的细胞裂解液或组织裂解液与如上所述的多肽探针,或如上所述诊断试剂盒中的成分进行接触,根据反应所得信号值对所述主体进行诊断。
优选的,如上所述的诊断细胞凋亡相关疾病的方法,所述信号值为所述多肽探针与双砷染料反应产生的荧光信号值。
优选的,如上所述的诊断细胞凋亡相关疾病的方法,所述主体为动物,更优选为哺乳动物,更优选为灵长类动物,更优选为人。
优选的,如上所述的诊断细胞凋亡相关疾病的方法,所述细胞凋亡相关疾病为肿瘤、自体免疫性疾病或神经退行性疾病;
更优选的,所述肿瘤包括:白血病、淋巴瘤、头颈部鳞状细胞癌、肺癌、食道癌、肝癌、结直肠癌、乳腺癌、卵巢癌、宫颈癌、肾细胞癌和黑色素瘤;
更优选的,所述自体免疫性疾病包括:系统性红斑性狼疮、自身免疫性淋巴细胞增生综合征、类风湿性关节炎、甲状腺炎;
更优选的,所述神经退化性疾病包括:阿兹海默氏症、亨丁顿舞蹈症、帕金森病、中风和肌肉萎缩性侧索硬化症。
与现有技术相比,本发明的有益效果为:
1)、多肽分子探针没有任何标记,与待检测酶之间具有较好的生物相容性,可提高切割效率;
2)、在本发明所提供试剂盒的整个检测反应过程中,没有分离和清洗步骤,操作简单和方便;
3)、检测模式具有灵活性,探针可以被具有不同激发和发射波长的双砷染料所标记,因而有多种方式来测定细胞凋亡水平;
4)、本发明特定提供的用于测定Caspase3及Caspase7的多肽探针由氨基酸构成,将编码多肽探针的DNA转入细胞内,可以测定单个细胞的凋亡情况。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
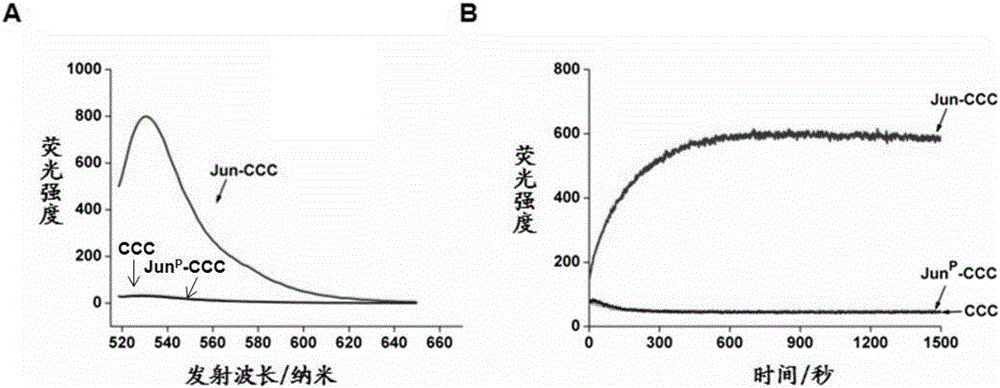
图1为新型无标记多肽分子探针的性能测定;(A)多肽探针与双砷染料FlAsH-EDT2结合所形成复合物的发射光谱;(B)多肽探针与双砷染料FlAsH-EDT2的结合动力学测定;
图2为利用新型探针定量测定体外重组半胱氨酸蛋白酶-3;(A)半胱氨酸蛋白酶-3对多肽探针的切割会降低多肽探针-双砷染料复合物的荧光强度;位于上方的曲线代表的是Jun-CCC,位于下方的曲线代表的是Jun-CCC+半胱氨酸蛋白酶-3;(B)对图A的定量分析;(C)多肽探针特异性测定半胱氨酸蛋白酶-3的活性;(D)半胱氨酸蛋白酶-3切割导致荧光强度的减少(ΔF)与半胱氨酸蛋白酶-3浓度之间的关系图;
图3为利用新型探针测定星孢菌素诱导RAW264.7细胞的凋亡;(A)星孢菌素诱导RAW264.7细胞凋亡的免疫印迹分析;(B)多肽探针测定星孢菌素诱导RAW264.7细胞的凋亡;(C)Ac-DEVD-CHO抑制细胞内半胱氨酸蛋白酶-3活性的免疫印迹分析;(D)Ac-DEVD-CHO抑制凋亡细胞内半胱氨酸蛋白酶-3活性的荧光分析。
具体实施方式
除非另有限定,本发明使用的所有技术和科学术语具有与所公开的实施方案所属领域的普通技术人员通常理解的相同的含义。虽然与本发明所述的方法和材料类似或等同的方法和材料可用于本实施方式的实践或测试中,但下文仍然描述了合适的方法和材料。本发明提及的所有出版物、专利申请、专利以及其他参考文献通过引用全部内容结合于本文中。在冲突的情况下,本说明书(包括定义)将起支配作用。此外,材料、方法以及实施例仅仅是说明性的,而不旨在限制。实施方式的其它特征和优点将从以下详细的说明书和权利要求中变得明显。
为了促进理解本文描述的实施方式这一目的,将参考某些实施方式,并且将使用特定语言来描述这些实施方式。本文所使用的术语仅用于描述具体实施方式目的,而不旨在限制本公开的范围。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
在本发明的实施例中,以用于测定Caspase3的探针为例,来说明本发明探针的效果。该实施例的技术方案包括新型无标记多肽分子探针的设计、新型探针的性能测定、新型探针定量测定体外重组半胱氨酸蛋白酶-3、新型探针对凋亡细胞的测定四个方面。
实施例
1.新型无标记多肽分子探针的设计
所设计的多肽分子探针命名为Jun-CCC,其序列为asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC,探针的N端和C端分别进行了乙酰化和酰胺化修饰来增加探针的稳定性。该探针包含有三个不同的功能区域,其中asaaeleervktlkaeiyelrskanmlreqiaqlgap是二聚化功能区,为防止多肽探针被其它蛋白酶非特异性切割,该区域全部由D-型氨基酸构成;DEVD是半胱氨酸蛋白酶-3的特异性切割序列,由L-型氨基酸构成;其后的氨基酸G为linker,用以增加CC与双砷染料反应的灵活性;CC是与双砷染料结合的部位,用来读取半胱氨酸蛋白酶-3的活性。在没有被半胱氨酸蛋白酶-3切割的时候,多肽探针之间的自二聚化会使得两个半胱氨酸-半胱氨酸二联子在空间上相互接近,从而能与双砷染料结合发出较强的荧光;相反,半胱氨酸蛋白酶-3的酶解作用会将半胱氨酸-半胱氨酸二联子从多肽中解离下来,虽然被切割的多肽依然能够二聚,但却缺少了锚定双砷染料的部位,双砷染料因而不能发光。因此,通过测定切割前后荧光的变化,可以定量测定半胱氨酸蛋白酶-3的活性,进而测定细胞凋亡过程。
2.新型探针的性能测定
为表明双砷染料与探针的结合依赖于探针之间的二聚化作用,我们同时设计了两条没有二聚化能力的探针JunP-CCC和CCC,其中JunP-CCC的序列为asaaepeervktpkaeiyeprskanmpreqiaqpgapDEVDGCC,CCC的序列为GCC,JunP-CCC是将Jun-CCC中二聚化区域中的亮氨酸残基全部突变为脯氨酸残基来丧失其二聚化功能,CCC是通过缺失Jun-CCC中的二聚化功能区使之不能二聚化。另外,两个多肽的N端和C端分别进行了乙酰化修饰和酰胺化修饰。我们测定了Jun-CCC、JunP-CCC以及CCC与双砷染料之间的结合能力。如图1A所示,Jun-CCC可以与双砷染料结合,产生很强的荧光信号,相反,缺少二聚化能力的JunP-CCC和CCC则只能产生一些背景荧光信号,这表明是二聚化的探针而不是单个探针与双砷染料相结合。并且,Jun-CCC探针与双砷染料之间的结合是十分迅速的,约十分钟左右的时间就可以达到最大荧光强度(图1B);此外,Jun-CCC探针与双砷染料之间的结合是比较稳定的(测定的平衡解离常数为3.17±0.39微摩尔每升)。
3.新型探针对体外重组半胱氨酸蛋白酶-3的定量测定
为了测定探针Jun-CCC能否被半胱氨酸蛋白酶-3所切割,我们添加0.1微升1毫摩尔每升的Jun-CCC以及0.2微升半胱氨酸蛋白酶-3到10微升的切割缓冲液(25mM HEPES,100mM NaCl,1mM EDTA,10%sucrose,0.1%CHAPS,1mM DTT,pH=7.4)中,并在37度孵育一小时。该混合物随后加入到40微升包含有1微摩尔每升FlAsH-EDT2的双砷染料标记缓冲液(100mM Tris·Cl,75mM NaCl,1mM EDTA,1mM DTT,0.05mM BAL,pH=7.4)中,并在室温避光孵育30分钟。我们测定了酶解前后的荧光水平(图2A)。半胱氨酸蛋白酶-3的切割会导致Jun-CCC-双砷染料复合物的荧光强度下降30倍(图2B)。进一步,我们测定该探针能否特异性测定半胱氨酸蛋白酶-3的活性,我们在相同的反应体系中测定了胰蛋白酶、凝血酶、类泛素蛋白酶1对Jun-CCC的切割作用,从图2C中我们可以看到,胰蛋白酶、凝血酶、类泛素蛋白酶1不能切割Jun-CCC,因此,探针Jun-CCC可以特异性测定半胱氨酸蛋白酶-3的活性。进一步,我们将Jun-CCC探针与不同浓度半胱氨酸蛋白酶-3相孵育,并测定每种浓度半胱氨酸蛋白酶-3所导致荧光的下降ΔF,ΔF与半胱氨酸蛋白酶-3浓度之间的关系如图2D所示,计算出的最低检测限为0.128纳克每毫升,优于现有大部分检测方法。
4.新型探针对凋亡细胞的测定
进一步,我们利用探针Jun-CCC来测定星孢菌素诱导的细胞凋亡。我们采用RAW264.7细胞作为研究模型,并利用1微摩尔每升的星孢菌素来诱导RAW264.7细胞的凋亡,同时将没有经过任何处理的细胞作为对照组。细胞的凋亡同时采用免疫印迹法以及基于探针Jun-CCC的荧光法来测定。加入星孢菌素可明显看到半胱氨酸蛋白酶-3大亚基的出现(图3A),表明细胞内半胱氨酸蛋白酶-3被成功激活。与免疫印迹结果相一致的是,星孢菌素处理过的细胞中其荧光信号要弱于对照组(图3B)。并且,星孢菌素诱导RAW264.7细胞的凋亡是时间依赖的,随着诱导时间的增加,会出现更多的半胱氨酸蛋白酶-3大亚基以及更弱的荧光信号。为进一步验证荧光较少是由于激活半胱氨酸蛋白酶-3对探针Jun-CCC的切割所导致的,我们加入了半胱氨酸蛋白酶-3特异性抑制剂Ac-DEVD-CHO来抑制细胞内半胱氨酸蛋白酶-3的活性。如图3C和3D所示,加入Ac-DEVD-CHO并不会改变半胱氨酸蛋白酶-3的蛋白量,但是却会导致荧光恢复,表明荧光的减少是由于半胱氨酸蛋白酶-3对探针Jun-CCC的切割引起的。因此,探针Jun-CCC是可以有效测定细胞凋亡的。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 带DNA分子探针的石墨烯微电极电化学检测传感器的制造方法与工艺
- 一种小型化时间分辨的激光泵浦X射线探测仪的制造方法与工艺
- 一种气冷高温稳态压力探针的制造方法与工艺
- 基于超磁致伸缩与石英摆线复合机理的隔微振装置的制造方法
- 纳米材料制备装置及纳米材料制备方法与流程
- 一种用于EB病毒荧光定量PCR检测的引物和探针组、及试剂盒的制造方法与工艺
- 一种用于鉴定川贝母及伪品的荧光PCR检测引物、探针组合物、试剂盒及检测方法与应用与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程