具有LPAAT消融的产油微藻的制作方法
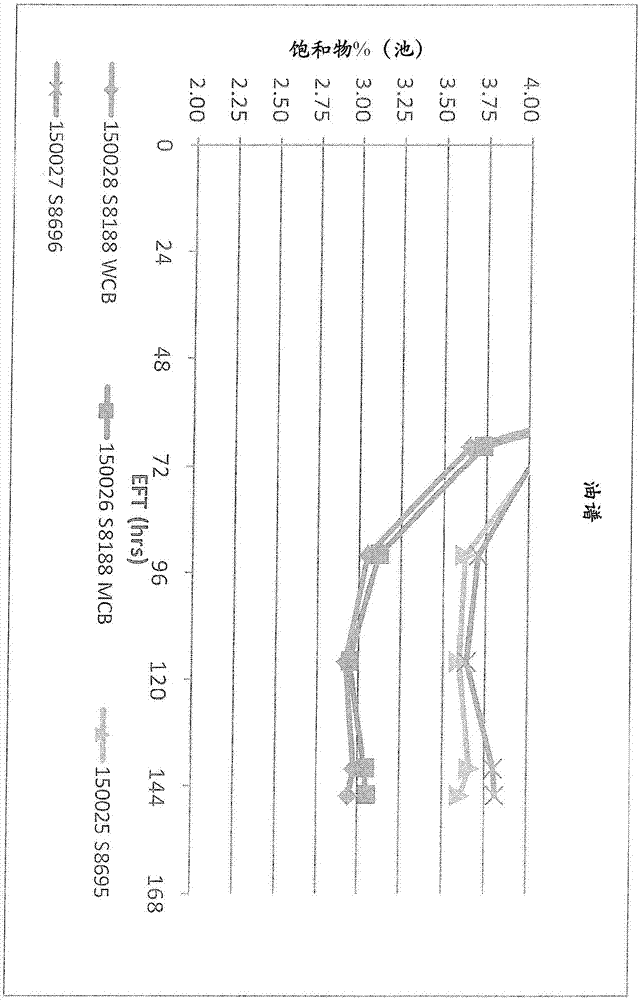
相关申请的交叉引用本申请根据35usc119(e)要求2015年4月6日提交的美国临时专利申请号62/143,711和2015年4月10日提交的美国临时专利申请号62/145,723的权益,这些专利通过引用结合在此。序列表的引用本申请包括在详细说明的最后所显示的序列表。发明领域本发明的实施例涉及油/脂肪、燃料、食品及油脂化学品,以及由遗传工程改造的细胞的培养物对其进行的制造。具体实施例涉及具有高三酸甘油酯含量并且在甘油主链上带有呈特定区域特异性模式的脂肪酰基的油、高度稳定的油、具有高油酸或中链脂肪酸水平的油以及由这些油制造的产品。发明背景pct公开案wo2008/151149、wo2010/06031、wo2010/06032、wo2011/150410、wo2011/150411、wo2012/061647、wo2012/061647、wo2012/106560以及wo2013/158938披露了多种油以及在微生物(包括微藻)中制造那些油的方法。这些公开案还描述了这些油用于制备食品、油脂化学品和燃料的用途。脂肪酰基辅酶a延长路径的某些酶起到了延伸脂肪酰基辅酶a分子的长度的作用。延长酶-复合物酶通过增加2个碳使脂肪酰基辅酶a分子延伸,例如肉豆蔻酰基辅酶a变为棕榈酰基辅酶a、硬脂酰基辅酶a变为花生酰基辅酶a,或油酰基辅酶a变为二十烷酰基辅酶a,二十烷酰基辅酶a变为芥酰基辅酶a。此外,延长酶还使酰基链长度以2个碳的增量延伸。kcs酶使酰基辅酶a分子与来自丙二酰基辅酶a的两个碳缩合以形成β-酮脂酰辅酶a。kcs和延长酶可以对于使具有特定碳长度的酰基底物缩合、修饰(如羟基化)或饱和程度显示出特异性。举例来说,已经证实,荷荷巴(油蜡树)β-酮脂酰辅酶a合酶偏好单不饱和及饱和c18辅酶a和c20辅酶a底物以提高转基因植物中芥酸的产量(拉丝纳(lassner)等,植物细胞(plantcell),1996,第8(2)卷,第281-292页),而布氏锥虫的特定延长酶则对延长短链和中链饱和coa底物显示出偏好(李(lee)等,细胞(cell),2006,第126(4)卷,第691-9页)。ii型脂肪酸生物合成路径采用了由多种可溶性蛋白质催化的一系列反应,其中间物在多种酶之间穿梭,如酰基载体蛋白(acp)的硫酯。相比之下,i型脂肪酸生物合成路径使用了单一较大的多功能多肽。产油的非光合作用藻类桑葚型无绿藻在营养碳供应过量的条件下储存大量的三酰甘油酯,但由于其他必需养分的限制,细胞分裂受到抑制。碳链长度多达c18的脂肪酸的大量生物合成是在质体中发生;然后,脂肪酸被输出到内质网,相信(如果它发生的话)在其中发生了延长超过c18以及结合到三酰甘油酯(tag)中。脂质被储存在较大的胞质细胞器中,称为脂质体,直到环境条件变为有利于生长,此时,它们被动员起来,为合成代谢提供能量和碳分子。发明概述根据一个实施例,存在一种产生按干重计至少20%的油的细胞,任选地是微藻细胞。该油具有脂肪酸谱,其具有5%或更少的饱和脂肪酸,任选地具有小于4%、小于3.5%或小于3%的饱和脂肪酸。脂肪酸谱可以具有(a)小于2.0%的c16:0;(b)小于2%的c18:0;和/或(c)大于20的c18:1/c18:0比。可替代的,脂肪酸谱可以具有(a)小于1.9%的c16:0;(b)小于1%的c18:0;和/或(c)大于100的c18:1/c18:0比。脂肪酸谱可以具有2.5%或更少或者任选地2.2%或更少的c16:0和c18:0的总和。该细胞可以过量表达kasii基因和sad基因。任选地,kasii基因编码与seqidno:18具有至少80%、85%、90%或95%序列同一性的成熟kasii蛋白质和/或sad基因编码与seqidno:65具有至少80%、85%、90%或95%序列同一性的成熟sad蛋白质。任选地,细胞具有内源性fata基因和/或内源性fad2基因的破坏。在一些情形中,细胞包含编码用以下调去饱和酶的表达的抑制性rna的核酸。在一些情形中,抑制性rna是下调fad2基因的发夹rna。细胞可以是真核微藻细胞;油具有如下固醇,该固醇具有的固醇谱的特征在于相对于β-谷甾醇过量的麦角固醇和/或22,23-二氢菜籽固醇、多孔甾醇或穿贝海绵甾醇的存在。在一个实施例中,一种方法包括培养重组细胞并从细胞中提取油。任选地,将油用于具有至少一种其他可食用成分的食物产品中或者使其经历化学反应。在一个实施例中,一种产油真核微藻细胞产生细胞油,该细胞包含编码溶血磷脂酸酰基转移酶(lpaat)的内源性多核苷酸的一个或多个等位基因的消融(敲除)。在一些实施例中,细胞包含lpaat的两个等位基因的消融。在一些实施例中,细胞包含鉴定为lpaat1的lpaat的等位基因的消融或者鉴定为lpaat2的lpaat的等位基因的消融。在一些实施例中,细胞包含lpaat1的两个等位基因的消融或者lpaat2的两个等位基因的消融。在一些实施例中,产油真核微藻细胞具有内源性lpaat的消融和编码活性lpcat、pdct、dag-cpt、lpaat以及fae中的一种或多种的重组核酸二者。lpcat与seqidno:86、87、88、89、90、91或92或者与seqidno:97、98、99、100、101、102或103的相关部分具有至少80%、85%、90%或95%序列同一性。pdct与seqidno:93的相关部分具有至少80%、85%、90%或95%序列同一性。dag-cpt与seqidno:94、95或96的相关部分具有至少80%、85%、90%或95%序列同一性。lpaat与seqidno:12、16、26、27、28、29、30、31、32、33、63、82或83的相关部分具有至少80%、85%、90%或95%序列同一性。fae与seqidno:19、20、84或85的相关部分具有至少80%、85%、90%或95%序列同一性。在一些实施例中,产油真核微藻细胞具有内源性lpaat的消融以及编码活性lpcat、pdct、dag-cpt和lpaat中的一种或多种的第一重组核酸和编码活性fae的第二重组核酸。在一些实施例中,产油真核微藻细胞具有内源性lpaat的消融以及编码活性lpcat、pdct、dag-cpt、lpaat和fae中的一种或多种的一种重组核酸和编码活性蔗糖转化酶的另一种重组核酸。在一些实施例中,本发明是由真核微藻细胞产生的油,该细胞任选地是无绿藻属细胞,该细胞包含编码lpaat的内源性多核苷酸的一个或多个等位基因的消融。在其他实施例中,本发明包括由真核微藻细胞产生的油,该细胞具有内源性lpaat的消融和编码活性lpcat、pdct、dag-cpt、lpaat以及fae中的一种或多种的重组核酸二者。在一些实施例中,本发明包括由产油真核微藻细胞产生的油,该细胞具有内源性lpaat的消融以及编码活性lpcat、pdct、dag-cpt和lpaat中的一种或多种的第一重组核酸和编码活性fae的第二重组核酸。在一些实施例中,该油包含至少10%、至少15%、至少20%或至少25%或更高的c18:2。在其他实施例中,该油包含至少5%、至少10%、至少20%或至少25%或更高的c18:3。在一些实施例中,该油包含至少1%、至少5%、至少7%或至少10%或更高的c20:1。在一些实施例中,该油包含至少1%、至少5%、至少7%或至少10%或更高的c22:1。在一些实施例中,该油包含至少10%、至少15%或至少20%或更高的组合量的c20:1和c22:1。在一些实施例中,该油包含小于50%、小于40%、小于30%或小于20%或更低的c18:1。在一些实施例中,产油真核微藻细胞产生细胞油,该细胞包含编码选自下组的活性酶中的一种或多种的重组核酸,该组由以下各项组成:lpcat、pdct、dag-cpt、lpaat以及fae。在其他实施例中,该细胞包含编码活性蔗糖转化酶的第二外源基因。在一个实施例中,产油真核微藻细胞产生细胞油。该细胞任选地是无绿藻属细胞并且包括编码以下类型之一的活性酶的第一外源基因:(a)溶血磷脂酰胆碱酰基转移酶(lpcat);(b)磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct);或者(c)cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt);以及任选地编码以下的第二外源基因(d)脂肪酸延长酶(fae),其活性为增加油中c20:1和/或c22:1脂肪酸的量。在一些实施例中,提供非自养地培养本发明的重组细胞的方法。在一些实施例中,提供非自养地和黑暗中培养重组细胞的方法。所培养细胞可以脱水和/或干燥。来自所培养细胞的油可以通过机械方式提取。来自所培养细胞的油可以通过使用非极性有机溶剂提取,这些非极性有机溶剂诸如己烷、庚烷、戊烷以及类似物。可替代地,可以使用甲醇、乙醇或其他极性有机溶剂。当使用可混溶剂诸如乙醇时,可以使用盐诸如nacl“破坏”水相与有机相之间的乳剂。在一个方面,本发明涉及一种由上文或在此所讨论的产油真核微藻细胞产生的油。在一些实施例中,对本发明的油执行一个或多个化学反应以产生润滑剂、燃料或其他有用产品。在其他实施例中,通过将本发明的油添加到另一种可食用食物成分中来制备食物产品。在一个方面,本发明涉及一种产生细胞油的产油真核微藻细胞,其中该细胞任选地是无绿藻(prototheca)属细胞,并且该细胞包含编码活性酮脂酰辅酶a还原酶、羟酰基辅酶a脱水酶或烯酰基辅酶a还原酶的外源性多核苷酸。在一些实施例中,外源性多核苷酸与seqidno:144具有至少80%、85%、90%或95%序列同一性并且编码活性酮脂酰辅酶a还原酶。在一些实施例中,外源性多核苷酸与seqidno:143具有至少80%、85%、90%或95%序列同一性并且编码活性羟酰基辅酶a脱水酶。在一些实施例中,外源性多核苷酸与seqidno:142的烯酰基辅酶a还原酶编码部分具有至少80%、85%、90%或95%序列同一性并且编码活性烯酰基辅酶a还原酶。在一些情形中,细胞进一步包含编码以下各项的外源性核酸:溶血磷脂酰胆碱酰基转移酶(lpcat)、磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct)、cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt)、溶血磷脂酸酰基转移酶(lpaat)或脂肪酸延长酶(fae)。在一些情形中,细胞进一步包含编码选自下组的酶的外源性核酸,该组由蔗糖转化酶和α半乳糖苷酶组成。在一些情形中,细胞进一步包含编码去饱和酶和/或酮酰基合酶的外源性核酸。在一些情形中,细胞进一步包含内源性fata基因的破坏。在一些情形中,细胞进一步包含内源性或fad2基因的破坏。在一些实施例中,细胞进一步包含编码下调去饱和酶的表达的抑制性rna的核酸。在一些实施例中,细胞油包含具有如下固醇谱的固醇,该固醇谱的特征在于相对于β-谷甾醇过量的麦角固醇和/或22,23-二氢菜籽固醇、多孔甾醇或穿贝海绵甾醇的存在。在一个方面,本发明提供一种由产油真核微藻细胞产生的油,其中该细胞任选地是无绿藻属,并且该细胞包含编码活性酮脂酰辅酶a还原酶、羟酰基辅酶a脱水酶或烯酰基辅酶a还原酶的外源性多核苷酸。在一些情形中,外源性多核苷酸与seqidno:144具有至少80%、85%、90%或95%序列同一性并且编码活性酮脂酰辅酶a还原酶。在一些情形中,外源性多核苷酸与seqidno:143具有至少80%、85%、90%或95%序列同一性并且编码活性羟酰基辅酶a脱水酶。在一些情形中,外源性多核苷酸与seqidno:142的烯酰基辅酶a还原酶编码部分具有至少80%、85%、90%或95%序列同一性并且编码活性烯酰基辅酶a还原酶。在一些实施例中,该油由细胞产生,该细胞进一步包含编码以下的外源性核酸:溶血磷脂酰胆碱酰基转移酶(lpcat)、磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct)、cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt)、溶血磷脂酸酰基转移酶(lpaat)或脂肪酸延长酶(fae)。在一些情形中,细胞进一步包含编码选自下组的酶的外源性核酸,该组由蔗糖转化酶和α半乳糖苷酶组成。在一些情形中,该油包含至少10%的c18:2。在一些情形中,该油包含至少15%的c18:2。在一些情形中,该油包含至少1%的c18:3。在一些情形中,该油包含至少5%的c18:3。在一些情形中,该油包含至少10%的c18:3。在一些情形中,该油包含至少1%的c20:1。在一些情形中,该油包含至少5%的c20:1。在一些情形中,该油包含至少7%的c20:1。在一些情形中,该油包含至少1%的c22:1。在一些情形中,该油包含至少5%的c22:1。在一些情形中,该油包含至少7%的c22:1。在一些实施例中,该油包含具有如下固醇谱的固醇,该固醇谱的特征在于相对于β-谷甾醇过量的麦角固醇和/或22,23-二氢菜籽固醇、多孔甾醇或穿贝海绵甾醇的存在。在一个方面中,本发明涉及一种产生细胞油的无绿藻属或小球藻(chlorella)属细胞,其中该细胞包含置换内源基因的内源性调节元件的外源性多核苷酸。在一些情形中,细胞是无绿藻细胞。在一些情形中,细胞是桑葚型无绿藻(protothecamoriformis)细胞。在一些实施例中,内源性调节元件是控制内源性乙酰辅酶a羧化酶的表达的启动子。在一些情形中,外源性多核苷酸是桑葚型无绿藻amt03启动子。在一些情况下,细胞进一步包含编码活性酮脂酰辅酶a还原酶、羟酰基辅酶a脱水酶或烯酰基辅酶a还原酶的外源性核酸。在一些实施例中,外源性核酸与seqidno:144具有至少80%、85%、90%或95%序列同一性并且编码活性酮脂酰辅酶a还原酶。在一些实施例中,外源性核酸与seqidno:143具有至少80%、85%、90%或95%序列同一性并且编码活性羟酰基辅酶a脱水酶。在一些实施例中,外源性核酸与seqidno:142的烯酰基辅酶a还原酶编码部分具有至少80%、85%、90%或95%序列同一性并且编码活性烯酰基辅酶a还原酶。在一些情形中,细胞进一步包含编码以下各项的外源性核酸:溶血磷脂酰胆碱酰基转移酶(lpcat)、磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct)、cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt)、溶血磷脂酸酰基转移酶(lpaat)或脂肪酸延长酶(fae)。在一些情形中,细胞进一步包含编码去饱和酶和/或酮酰基合酶的外源性核酸。在一些情形中,细胞进一步包含内源性fata基因的破坏。在一些情形中,细胞进一步包含内源性或fad2基因的破坏。在一些情形中,细胞进一步包含编码下调去饱和酶的表达的抑制性rna的核酸。在一些实施例中,细胞油包含具有如下固醇谱的固醇,该固醇谱的特征在于相对于β-谷甾醇过量的麦角固醇和/或22,23-二氢菜籽固醇、多孔甾醇或穿贝海绵甾醇的存在。在一个方面,本发明提供一种由上文或在此所讨论的细胞中的任一种产生的油。在一个方面,本发明提供一种方法,该方法包括(a)培养如上文或在此讨论的细胞以产生油,以及(b)从细胞中提取油。在一个方面,本发明提供一种制备组合物的方法,该方法包括使上文或在此所讨论的油经历化学反应。在一个方面,本发明提供一种制备食物产品的方法,该方法包括将上文或在此所讨论的油添加到另一种可食用成分中。在一个方面,本发明提供与seqidno:144具有至少80%、85%、90%或95%序列同一性的多核苷酸。在一些情形中,多核苷酸包含seqidno:144的核苷酸序列。在一个方面,本发明提供与seqidno:143具有至少80%、85%、90%或95%序列同一性的多核苷酸。在一些情形中,多核苷酸包含seqidno:143的核苷酸序列。在一个方面,本发明提供与seqidno:142的核苷酸4884至5816具有至少80%、85%、90%或95%序列同一性的多核苷酸。在一些情形中,多核苷酸包含seqidno:142的核苷酸4884至5816的核苷酸序列。在一个方面,本发明提供一种由seqidno:144的核苷酸序列编码的酮脂酰辅酶a还原酶(kcr)。在一些情形中,kcr由与seqidno:144具有至少80%、85%、90%或95%序列同一性的多核苷酸编码。在一个方面,本发明提供一种由seqidno:143的核苷酸序列编码的羟酰基辅酶a脱水酶(hacd)。在一些情形中,hacd由与seqidno:143具有至少80%、85%、90%或95%序列同一性的多核苷酸编码。在一个方面,本发明提供一种由seqidno:142的核苷酸4884至5816的核苷酸序列编码的烯酰基辅酶a还原酶(ecr)。在一些情形中,ecr由与seqidno:142的核苷酸4884至5816具有至少80%、85%、90%或95%序列同一性的多核苷酸编码。在本发明的各个实施例中,上文或在此所讨论的两个或更多个特性可以组合在一起。附图简述图1示出在15-l分批补料发酵批次140558f22和140574f24中的s8188总饱和脂肪酸水平。图2示出由在实例17中讨论的各种细胞系产生的饱和度百分比。“mcb”是指主细胞库,并且“wcb”是指工作细胞库。品系s8695和s8696当在液体培养基中培养时分别具有约3.6%和3.75%的总饱和度。图3示出桑葚型无绿藻和植物酮脂酰辅酶a还原酶蛋白质的氨基酸序列的比对。图4示出桑葚型无绿藻和植物羟酰基辅酶a脱水酶蛋白质的氨基酸序列的比对。图5示出桑葚型无绿藻和植物烯酰基辅酶a还原酶蛋白质的氨基酸序列的比对。图6a和图6b示出桑葚型无绿藻乙酰辅酶a羧化酶蛋白质的两个等位基因pmacc酶1-1和pmacc酶1-2的氨基酸序列的比对发明详细说明i.定义“等位基因”是指有机体具有多个相似或相同基因拷贝的基因的拷贝,即使在同一染色体上。等位基因可以编码相同或相似的蛋白质。结合脂肪酸谱中的两种脂肪酸,“被平衡”应该表示这两种脂肪酸在其平均面积百分比的指定百分比内。因此,对于丰度为x%的脂肪酸a和丰度为y%的脂肪酸b而言,如果|x-((x+y)/2)|和|y-((x+y)/2)|≤100(z),则这些脂肪酸被“平衡在z%内”。“细胞油”或“细胞脂肪”应当是指从生物体获得的主要含三酸甘油酯的油,其中该油未经历与另一种天然油或合成油掺混,或分馏以实质上改变该三酸甘油酯的脂肪酸谱。结合一种包括了具有特定区域特异性的三酸甘油酯的油,该细胞油或细胞脂肪未经历酯交换或其他合成工艺以致未获得该区域特异性三酸甘油酯谱,而是由一个细胞或细胞群天然地产生区域特异性。对于由细胞产生的细胞油而言,油的固醇谱通常通过细胞产生的固醇来确定,而不是通过添加固醇以便模拟该细胞油进行该油的人工重建来确定。结合细胞油或细胞脂肪,并且如本披露通篇总体上所使用,术语油和脂肪可互换地使用,除非另作注释。因此,“油”或“脂肪”取决于该物质的组成和其他条件,在室温下可以是液体、固体或部分固体的。在此,术语“分馏”表示以相对于由有机体所产生的谱而改变其脂肪酸谱的方式来从该油去除物质,不管用何种方法完成。术语“细胞油”和“细胞脂肪”包括如从生物体获得的油,其中该油已经历最低限度的不实质上改变其三酸甘油酯谱的加工,包括精炼、漂白和/或脱胶。细胞油还可以是“非酯交换的细胞油”,表示该细胞油未经历这样一种加工,其中脂肪酸与甘油的酰基连接被重新分布且基本上保持了与从有机体中回收时相同的构型。“外源基因”应当是指已经被引入到细胞中(例如通过转化/转染)的编码rna和/或蛋白质的表达的一种核酸,并且还被称为“转基因”。包含外源基因的细胞可以被称为重组细胞,可以向其中引入另外的外源基因。相对于正在转化的细胞,外源基因可以来自不同的物种(并因此是异源的),或来自相同的物种(并因此是同源的)。因此,外源基因相对于该基因的内源副本,可以包括占据了细胞基因组中不同位置或处于不同控制下的同源基因。外源基因可以在细胞中以多于一个副本存在。外源基因可以在细胞中作为基因组(核或质体)中的插入序列或作为游离型分子来维持。“fadc”(又称为“fad2”)是编码δ-12脂肪酸去饱和酶的基因。“脂肪酸”应当表示游离脂肪酸、脂肪酸盐、或甘油脂中的脂肪酰基部分。应理解的是,甘油脂的脂酰基可以根据甘油三酯水解或皂化时产生的羧酸或羧酸阴离子来描述。“固定碳源”是在环境温度和压力下以固体或液体形式存在于培养基中的含碳分子,典型地是有机分子,它可以被该培养基中所培养的微生物利用。因此,二氧化碳不是固定碳源。“处于可操作连接”是在两个核酸序列(如控制序列(典型地是启动子)和连接的序列(典型地是编码蛋白质的序列,也称作编码序列))之间的功能性连接。如果某启动子可以介导外源基因的转录,则该启动子与这个基因处于可操作的连接。“微藻”是含有叶绿体或其他质体并且任选地能够进行光合作用的真核微生物有机体,或能够进行光合作用的原核微生物有机体。微藻包括不能代谢固定碳源作为能量的专性光能自养生物,以及能够仅以固定碳源为生的异养生物。微藻包括在细胞分裂后不久与姊妹细胞分开的单细胞生物体,如衣藻属,以及微生物,如例如,团藻属,它是由两种不同细胞类型构成的简单多细胞光合微生物。微藻包括细胞例如小球藻属、杜氏藻属以及无绿藻属。微藻还包括了展现出细胞-细胞粘附的其他微生物光合有机体,例如阿格门氏藻属(agmenellum)、鱼腥藻属、以及桑葚藻属(pyrobotrys)。微藻还包括专性异养微生物,它们已经丧失进行光合作用的能力,如某些双鞭甲藻属(dinoflagellate)藻类物种和无绿藻属物种。结合脂肪酸长度,“中链”应该表示c8至c16脂肪酸。结合重组细胞,术语“敲减”是指就基因所编码的蛋白质的产生或活性来说,该基因已部分地受抑制(例如,约1%-95%)。另外,结合重组细胞,术语“敲除”是指就基因所编码的蛋白质的产生或活性来说,该基因已完全或几乎完全地(例如,>95%)受抑制。敲除物可以经由通过将核酸序列同源重组于编码序列中、基因缺失、突变或其他方法消融基因来制备。当执行同源重组时,插入的核酸(“敲入”)可以是编码感兴趣的外源基因的序列或者不编码感兴趣的基因的序列。“产油”细胞是能够天然地或通过重组或经典品系改良而产生以干细胞重量计至少20%的脂质的一种细胞。“产油微生物(oleaginousmicrobe)”或“产油微生物体(oleaginousmicroorganism)”是一种产油的微生物,包括微藻(尤其是储存脂质的真核微藻)。产油细胞还涵盖已经去除其一部分或全部脂质或其他内含物的细胞,并且涵盖活细胞和死细胞。“订制油”或“订制脂肪”是形成的晶体主要具有指定的多形性结构的油或脂肪。举例来说,订制油或订制脂肪可以具有超过50%、60%、70%、80%或90%的β或β’多形性形式的晶体。结合细胞油,“谱”是在该油内特定种类或甘油三酯或脂肪酰基的分布。“脂肪酸谱”是在不参考与甘油主链的连接的情况下,该油的甘油三酯中脂肪酰基的分布。脂肪酸谱典型地是通过转化成脂肪酸甲酯(fame),随后进行气相色谱(gc)分析与火焰离子化检测(fid)来确定,如在实例1中。脂肪酸谱可以表示为由一种脂肪酸的曲线下面积测定的总脂肪酸信号中该脂肪酸的一个或多个百分比。fame-gc-fid测量值近似为这些脂肪酸的重量百分含量。“sn-2谱”是在油中三酰甘油酯的sn-2位置处所见的脂肪酸的分布。“区域特异性谱”是在参考酰基连接到甘油主链的位置而不参考立体特异性的情况下三酸甘油酯的分布。换句话说,区域特异性谱描述了在sn-1/3处相对于在sn-2处的酰基连接。因此,在区域特异性谱中,pos(棕榈酸酯-油酸酯-硬脂酸酯)和sop(硬脂酸酯-油酸酯-棕榈酸酯)是进行相同地处理。“立体特异性谱”描述了在sn-1、sn-2及sn-3处酰基的连接。除非另作指示,否则三酸甘油酯(如sop和pos)应被视为等效的。“tag谱”是在参考与甘油主链的连接,但不参考这些连接的区域特异性的性质的情况下在三酸甘油酯中所见的脂肪酸的分布。因此,在tag谱中,该油中的sso百分比是sso与sos的总和,而在区域特异性谱中,sso的百分比是在不包括该油中的sos种类的情况下计算。与fame-gc-fid分析的重量百分比相比,三酸甘油酯的百分含量典型地以摩尔百分含量给出;也就是在tag混合物中给定tag分子的百分比。在两个或更多个氨基酸或核酸序列的背景下,术语“序列同一性百分比”是指如使用序列比较算法或通过目测进行测量,当比较和比对最大对应性时,两个或更多个序列或子序列是相同的或具有指定百分比的相同的氨基酸残基或核苷酸。关于确定核苷酸或氨基酸同一性百分比的序列比较,典型地以一个序列作为参考序列,将测试序列与之进行比较。当使用序列比较算法时,把测试序列和参考序列输入计算机中,必要时指定子序列坐标,并指定序列算法程序参数。基于指定的程序参数,序列比较算法随后相对于参考序列计算检验序列的序列同一性百分比。用于比较的序列的最佳比对可以使用设置为默认参数的ncbiblast软件(ncbi.nlm.nih.gov/blast/)进行。例如,为了比较两个核酸序列,可以使用blastn与设置为以下默认参数的“blast2序列”工具版本2.0.12(2000年4月21日):矩阵:blosum62;匹配加分:1;错配罚分:-2;开放空位:5个罚分和延伸空位:2个罚分;空位x下降(drop-off):50;期望:10;字长:11;滤波器:开。对于两个氨基酸序列的成对比较,可以使用“blast2序列”工具版本2.0.12(2000年4月21日)与例如,设置为以下默认参数的blastp设置:矩阵:blosum62;开放空位:11个罚分和和延伸空位:1个罚分;空位x下降50:期望:10;字长:3;滤波器:开。“重组体”是因引入外源核酸或改变天然核酸而已经被修饰的细胞、核酸、蛋白质或载体。因此,例如,重组细胞可以表达在天然(非重组)形式的细胞内没有发现的基因,或以与非重组细胞表达这些基因不同的方式表达天然基因。重组细胞可以但不限于包括编码基因产物或抑制元件(如降低细胞中的活性基因产物的水平的突变、敲除、反义、干扰rna(rnai)或dsrna)的重组核酸。“重组核酸”是最初在体外形成(总体来说,通过操作核酸,例如使用聚合酶、连接酶、核酸外切酶及核酸内切酶)、使用化学合成的核酸,或另外地呈通常未见于自然界中的形式。可以产生重组核酸,例如,以使两个或更多个核酸处于可操作连接。因此,出于本发明的目的,分离的核酸或通过连接通常在自然界中不接合的dna分子在体外形成的表达载体均被认为是重组体。一旦重组核酸制成并且引入至宿主细胞或生物体中,它就可使用宿主细胞的体内细胞机制复制;然而,出于本发明的目的,此类核酸,一旦重组产生,虽然随后在细胞内复制,但仍然被认为是重组的。类似地,“重组蛋白”是使用重组技术,即,通过量表达重组核酸所产生的蛋白质。如本领域中所知,术语“三酸甘油酯”、“三酰甘油酯”及“tag”可互换地使用。ii.综述本发明的说明性实施例的特征在于产油细胞,这些细胞产生改变的脂肪酸谱和/或甘油脂中改变的脂肪酸区域特异性分布;以及由这些细胞产生的产物。产油细胞的实例包括具有ii型脂肪酸生物合成途径的微生物细胞,包括质体产油细胞,如产油藻类的那些,以及适用时高等植物的产油细胞,包括但不限于商业油籽作物,如大豆、玉米、油菜籽/卡诺拉(canola)、棉花、亚麻、向日葵、红花以及花生。细胞的其他具体实例包括绿藻门,四胞藻纲(trebouxiophytae),小球藻目或小球藻科的异养或专性异养微藻。产油微藻和培养方法的实例还提供于公开的pct专利申请wo2008/151149、wo2010/06032、wo2011/150410及wo2011/150411中,包括了小球藻属和无绿藻属(一种包含专性异养生物的属)的种类。产油细胞可以例如能够产生以细胞重量计25%、30%、40%、50%、60%、70%、80%、85%或约90%的油,±5%。任选地,所产生的这些油可以具有较少的高度不饱和脂肪酸,如dha或epa脂肪酸。举例来说,这些油可以包含不到5%、2%或1%的dha和/或epa。上文提及的出版物也披露了用于培养此类细胞并确切地说从微藻细胞提取油的方法;此类方法适用于在此披露的细胞并且对于这些教授内容通过引用结合。当使用微藻细胞时,它们可以自养地(如果不是专性异养生物的话)或使用糖(例如葡萄糖、果糖和/或蔗糖)在暗处培养。在此描述的任何实施例中,这些细胞可以是包含外源转化酶基因的异养细胞,由此使这些细胞能够由蔗糖原料产生油。可替代的,或此外,这些细胞可以由纤维素原料代谢木糖。举例来说,这些细胞可以被遗传工程改造成表达一个或多个木糖代谢基因,如编码活性木糖转运蛋白、木酮糖-5-磷酸转运蛋白、木糖异构酶、木酮糖激酶、木糖醇脱氢酶及木糖还原酶的那些。参见2012年11月15日公开的wo2012/154626,“代谢木糖的遗传工程改造的微生物(geneticallyengineeredmicroorganismsthatmetabolizexylose)”,包括利用木糖的遗传工程改造的桑葚型无绿藻品系的披露。可以任选地在生物反应器/发酵罐中培养产油细胞。举例来说,可以在含糖营养肉汤上培养异养产油微藻细胞。任选地,培养可以按两个阶段进行:种子阶段(seedstage)和脂质产生阶段。在种子阶段中,细胞的数量从起子培养物增加。因此,该一个或多个种子阶段典型地包括被设计用于促进快速细胞分裂的富营养、氮充满培养基。在该一个或多个种子阶段之后,可以在营养限制性(例如氮稀疏)条件下向这些细胞给料糖,这样使得该糖将被转化为三酸甘油酯。如在此所用,“标准脂质产生条件”意指培养条件是氮限制的。糖和其他营养素可以在发酵过程中添加,但是没有添加额外的氮。这些细胞将消耗所用或几乎所有存在的氮,但是没有提供额外的氮。举例来说,相对于种子阶段,脂质产生阶段中的细胞分裂速率可以下降50%、80%或更多。另外地,种子阶段与脂质产生阶段之间的培养基变化可以诱导重组细胞表达不同的脂质合成基因并且由此改变正被产生的三酸甘油酯。举例来说,如下文所论述,可以将氮和/或ph敏感型启动子放置在内源或外源基因之前。当将在脂质产生阶段中产生在种子阶段中不支持细胞的最佳生长的油时,这是尤其有用的。产油细胞表达一个或多个编码脂肪酸生物合酶的外源基因。因此,一些实施例的特征在于从非植物或非种子油无法获得或根本无法获得的细胞油。产油细胞(任选地是微藻细胞)可以通过经典品系改良技术(如uv和/或化学诱变),随后在环境条件下筛选或选择(包括在化学或生物化学毒素上进行选择)而改良。举例来说,可以在脂肪酸合成抑制剂、糖代谢抑制剂或除草剂上对细胞进行选择。作为选择的结果,可以获得具有增加的糖产量、增加的油生产(例如,作为细胞体积、干重或升的细胞培养物的百分比)或改进的脂肪酸谱或tag谱的品系。2015年3月31日提交的共同拥有的美国申请60/141167描述了用于经典地诱变产油细胞的方法。举例来说,这些细胞可以基于以下一种或多种选择:1,2-环己二酮;19-醋酸炔诺酮;2,2-二氯丙酸;2,4,5-三氯苯氧基乙酸;2,4,5-三氯苯氧基乙酸,甲酯;2,4-二氯苯氧基乙酸;2,4-二氯苯氧基乙酸,丁酯;2,4-二氯苯氧基乙酸,异辛酯;2,4-二氯苯氧基乙酸,甲酯;2,4-二氯苯氧基丁酸;2,4-二氯苯氧基丁酸,甲酯;2,6-二氯苯甲腈;2-脱氧葡萄糖;5-十四烷基氧基-w-糠酸;a-922500;乙草胺;甲草胺;莠灭净;两性霉素;莠去津;氟草胺;地散磷;苯达松;除草定;溴苯腈;唑草胺;羰基氰酯邻-氯苯基腙(cccp);羰基氰酯-对-三氟甲氧基苯基腙(fccp);浅蓝菌素;氯苯胺灵;绿黄隆;降固醇酸;二氯吡啶酸;秋水仙碱;草灭特;环己酰胺(cyclohexamide);c75;dacthal(四氯对苯二酸二甲酯);麦草畏;二氯丙烷((r)-2-(2,4-二氯苯氧基)丙酸);吡氟酰草胺;二氢茉莉酸,甲酯;杀草快;敌草隆;二甲亚砜;表没食子儿茶素没食子酸酯(egcg);草藻灭;乙丁烯氟灵;乙醇;唑啶草;精噁唑禾草灵;精稳杀得;伏草隆;fomasefen;甲酰胺磺隆;赤霉酸;草铵膦铵;草甘膦;吡氟氯禾灵;环嗪酮;咪唑喹啉酸;异恶草胺;脂肪酶抑制剂thl((-)-四氢利泼斯汀);丙二酸;mcpa(2-甲基-4-氯苯氧基乙酸);mcpb(4-(4-氯-邻-甲苯氧基)丁酸);甲基磺草酮;二氢茉莉酮酸甲酯;甲氧毒草安;赛克津;米屈肼;草达灭;抑草生;去甲哈尔满;奥利司他;恶草灵;氧氟吩;百草枯;喷达曼萨林;五氯苯酚;pf-04620110;苯乙醇;苯敌草;毒莠定;平板素;平板霉素;扑灭通;扑草净;拿草特;扑草胺;敌稗;扑灭津;杀草敏;精喹禾灵;s-乙基二丙基硫代氨基甲酸酯(eptc);s,s,s-三丁基三硫磷酸酯;水杨基羟肟酸;芝麻酚;环草隆;甲烷砷酸钠;西玛三嗪;t-863(dgat抑制剂);丁噻隆;特草定;禾草丹;三甲苯草酮;野麦畏;定草酯;三氯生;氟乐灵;以及狐衣酸。产油细胞产生一种储存油,该油主要是三酰甘油酯并且可以被储存在细胞的储存体中。可以由细胞,通过破坏细胞并分离出油来获得粗油。粗油可以包括由这些细胞产生的固醇。wo2008/151149、wo2010/06032、wo2011/150410及wo2011/1504披露了针对产油微藻的异养培养和油分离技术。举例来说,可以通过提供或培养这些细胞,进行干燥并压榨来获得油。如本领域中所知或如wo2010/120939中所描述,所产生的油可以进行精炼、漂白并除臭(rbd)。粗油或rbd油可以被用于多种食品、化学品或工业产品或工艺中。即使在这样的加工之后,该油仍可以保留来源的固醇谱特征。下文披露了微藻固醇谱。尤其参见本专利申请中的第xiii节。在回收油之后,有价值的残留生物质保留下来。该残留生物质的用途包括了制造纸、塑料、吸收剂、吸附剂、钻井液、作为动物饲料、用于人类营养或用于肥料。本发明的核酸可以含有与感兴趣的基因(包括lpaat、lpcat、fae、pdct、dag-cpt)以及在此所讨论的其他脂质生物合成路径基因可操作地连接的上游和下游控制序列。这些控制序列包括启动子、靶向序列、非翻译序列以及其他控制元件。本发明的核酸可以经密码子优化以用于在靶宿主细胞中表达(例如,使用表1和2的密码子使用表)。例如,根据表1或2,所使用的至少60%、65%、70%、75%、80%、85%、90%、95%或100%的密码子可以是最优选的密码子。可替代的,根据表1或2,所使用的至少60%、65%、70%、75%、80%、85%、90%、95%或100%的密码子可以是第一或第二最优选的密码子。无绿藻属品系和原壳小球藻的偏好密码子分别示于表1和2中。表1:无绿藻属品系中的优选密码子使用。表2:原壳小球藻中的优选密码子使用。本发明的细胞油可以与常规植物或动物三酰甘油来源区别开来,因为固醇谱将指示与常规来源可区别开的宿主有机体。常规油来源包括大豆、谷物、向日葵、红花、棕榈树、棕榈仁、椰子、棉籽、卡诺拉(canola)、油菜(rape)、花生、橄榄、亚麻、动物脂油、猪油、可可、非洲酪脂树、芒果、婆罗双树、雾冰草脂、印度山竹子以及阿兰藤黄。参见本披露针对微藻固醇的论述的第xiii节。表3:一些商业油籽品系的脂肪酸谱。在此处给出甘油三酯(又称为“三酰甘油酯”或“tag”)细胞油的脂肪酸谱的情况下,应了解的是,这是指从细胞提取的储存油的未分馏样品,该样品在已经去除磷脂的条件下或用实质上对磷脂的脂肪酸不敏感的分析方法(例如,使用色谱法和质谱法)进行分析。该油可以经历rbd工艺以去除磷脂,游离脂肪酸和气味对于该油中甘油三酯的脂肪酸谱仅具有微小或可忽略的改变。由于这些细胞是产油的,故在一些情形中,储存油将构成该细胞中全部tag的大部分。以下实例1给出了用于测定tag脂肪酸组成和区域特异性结构的分析方法。广泛分类地,本发明的某些实施例包括(i)重组产油细胞,该细胞包含内源性多核苷酸的一个或两个或所有等位基因的消融,该内源性多核苷酸包括编码溶血磷脂酸酰基转移酶(lpaat)的多核苷酸,或者(ii)产生具有低浓度多不饱和脂肪酸的油的细胞,包括不饱和脂肪酸营养缺陷型细胞;(iii)由于编码将脂肪酸转化成甘油或甘油酯的酶的一个或多个外源基因的表达而产生具有高浓度的特定脂肪酸的油的细胞;(iv)产生区域特异性油的细胞;(v)编码lpaat、溶血磷脂酰胆碱酰基转移酶(lpcat)、磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct)、二酰基甘油胆碱磷酸转移酶(dag-cpt)或脂肪酸延长酶(fae)的遗传构建体或细胞,(vi)产生低水平饱和脂肪酸和/或高水平c18:1、c18:2、c18:3、c20:1或c22:1的细胞,(vii)以及涉及产生具有改变的谱的细胞油的其他发明。这些实施例还涵盖由这些细胞产生的油;在提取油之后来自这些细胞的残留生物质;由这些油制造的油脂化学品、燃料及食品;以及培养这些细胞的方法。在以下任何实施例中,所用细胞任选地为具有ii型脂肪酸生物合成路径的细胞,如微藻细胞,包括异养或专性异养微藻细胞,包括归类为绿藻门,四胞藻纲,小球藻目,小球藻科或绿藻纲的细胞,或使用合成生物学工具工程改造成具有ii脂肪酸生物合成路径(即,将ii型脂肪酸生物合成的遗传机器移植到缺乏此类路径的有机体中)的细胞。使用具有ii型途径的宿主细胞避免了外源酰基-acp硫酯酶或其他acp结合酶与i型细胞机器的多酶复合体之间的非相互作用可能。在具体实施例中,该细胞属于桑葚型无绿藻、克鲁加尼无绿藻(protothecakrugani)、斯塔格诺拉无绿藻(protothecastagnora)或饶氏无绿藻,或具有与seqidno:25具有至少65%、70%、75%、80%、85%、90%或95%核苷酸一致性的23srrna序列。通过在暗处或使用专性异养生物培养,所产生的细胞油可以具有较少叶绿素或其他着色剂。举例来说,该细胞油在未实质上纯化的情况下可以具有不到100、50、10、5、1、0.0.5ppm的叶绿素。稳定碳同位素值δ13c是相对于标准品(例如pdb,来自美国南卡罗来纳州皮迪组(peedeeformation)的箭石的化石骨架的天然焦)的13c/12c的比率的一种表示。油的稳定碳同位素值δ13c(‰)可以与所用原料的δ13c值相关。在一些实施例中,这些油衍生自异养地生长于衍生自c4植物(如玉米或甘蔗)的糖上的产油生物体。在一些实施例中,油的δ13c(‰)是从-10到-17‰或从-13到-16‰。在以下论述的具体实施例和实例中,一个或多个脂肪酸合成基因(例如,编码酰基acp硫酯酶、酮酰基acp合酶、lpaat、lpcat、pdct、dag-cpt、fae、硬脂酰基acp去饱和酶或在此描述的其他酶)被合并到微藻中。已经发现,对于某些微藻来说,植物脂肪酸合成基因产物是在相应植物酰基载体蛋白(acp)不存在下起作用,甚至当该基因产物是需要结合acp来起作用的酶(如酰基-acp硫酯酶)时。因此,任选地,微藻细胞可以利用这些基因来制备所希望的油,而不共表达植物acp基因。对于包含外源基因或基因组合的重组细胞的不同实施例,考虑到用具有60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%核酸序列同一性的基因取代那些基因可以给出类似结果,用编码具有60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%或99.5%氨基酸序列同一性的蛋白质的基因进行取代也可以给出类似结果。同样,对于新颖调节元件而言,考虑到用具有60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%核酸的核酸取代那些核酸可以是有效的。在不同实施例中,应当理解的是,对于功能而言非必需的序列(例如,标签或插入的限制性位点)在使用时通常可以被省去或在比较基因、蛋白质和变体中被忽略。尽管使用微藻发现或用微藻示例,但是这里报道的新颖基因和基因组合可以使用本领域熟知的技术用于高等植物中。举例来说,在高等植物中使用外源脂质代谢基因被描述于美国专利6028247、5850022、5639790、5455167、5,512,482及5,298,421中,披露了具有外源酰基-acp硫酯酶的高等植物。wo2009129582和wo1995027791披露了lpaat在植物中的克隆。高等植物中的fad2抑制传授于wo2013112578和wo2008006171中。如实例7所描述,使用转录物谱分析来发现响应于低氮条件调节表达的启动子。这些启动子有用于选择性表达不同基因和改变微生物油的脂肪酸组成。根据一个实施例,存在包含异源启动子和基因的非天然构建体,其中该启动子与实例7的启动子中的任一项(例如,seqidno:43-58)具有至少60%、65%、70%、75%、80%、85%、90%或95%序列同一性并且该基因在低与高氮条件下是差异表达的。任选地,对于amt03启动子而言,表达对ph较不敏感。举例来说,这些启动子在亚油酸营养缺陷体中可以被放置在fad2基因之前,以在高氮条件、然后是低氮条件下培养之后产生具有低于5%、4%、3%、2%或1%亚油酸的油。iii.lpaat和/或fata的消融(敲除)在一个实施例中,对细胞进行遗传工程改造以使得脂质路径基因的一个、两个或所有等位基因都被敲除。在一个实施例中,脂质路径基因是lpaat基因。可替代的,等位基因的基因产物的量或活性被敲除,例如通过抑制性rna技术,包括rnai、sirna、mirna、dsrna、反义链以及发夹rna技术。当脂质路径基因的一个等位基因被敲除时,观察到酶活性的相应降低。当脂质路径基因的所有等位基因被敲除或充分抑制时,形成营养缺陷型细胞。可以产生一种带有与该基因的一个或多个等位基因同源的供体序列的第一转化构建体。可以引入这种第一转化构建体并且随后进行选择方法,以获得以一个或多个等位基因破坏为特征的分离品系。作为替代方案,可以产生一种第一品系,该品系被工程改造成通过插入第一等位基因中来表达可选择标记物,由此使该第一等位基因失活。这一品系可以用作宿主以进一步进行遗传工程改造以使脂质路径基因的其余一个或多个等位基因敲除或敲减(例如,使用第二可选择标记物破坏第二等位基因)。可以通过带有最初除去了活性的内源基因的另外的转化构建体的工程改造的表达,或通过适合异源基因的表达,来实现内源基因的补充。补充基因的表达可以组成性地调控或通过可调控的控制进行调控,藉此允许将表达调谐到所希望的水平,从而容许生长或产生任意营养缺陷型条件。在一个实施例中,脂肪酸营养缺陷型细胞群体用于筛选或选择补充基因;例如,通过使用外源性脂肪酸合成酶的特定基因候选物或者据信含有此类候选物的核酸文库转化。所希望的基因的所有等位基因的敲除以及敲除的基因的补充无需依序进行。所关注内源基因的破坏以及通过适合补充基因的组成性或可诱导表达进行的其补充可以按若干方式进行。在一种方法中,这可以通过多种适合构建体的共转化来实现,一种破坏所关注基因,并且另一种在适合的替代性基因座处提供补充。在另一种方法中,靶基因的除去可以通过在可诱导启动子控制下(“启动子劫持(promoterhijacking)”)用适合基因直接代替该靶基因来实现。以这种方式,被靶向的基因的表达现处于可调控启动子的控制下。一种另外的方法是用外源的可诱导基因表达系统代替一个基因的内源调控元件。依据这样一种方案,现可以取决于特定需要而开启或关闭所关注基因。又另一种方法是产生第一品系以表达能够补充所关注基因的外源基因,然后对这种第一品系中的所关注基因的所有等位基因进行敲除或敲减。多等位基因敲减或敲除方法以及用外源基因补充可以用于改变工程改造的细胞的脂肪酸谱、区域特异性谱、sn-2谱或tag谱。在使用可调控启动子的情况下,该启动子可以是ph敏感的(例如,amt03)、氮和ph敏感的(例如,amt03)或氮敏感的但ph不敏感的(例如,实例7的新发现的启动子)或其与上述启动子中任一项具有至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的变体。结合启动子而言,ph不敏感的意指当在ph从6.8变到5.0的环境条件下时,该启动子与amt03启动子相比较不敏感(例如,与用amt03作为启动子的等效细胞相比,当ph转变时,活性相对变化少至少5%、10%、15%或20%)。在一个具体实施例中,重组细胞包含多种核酸,这些核酸可操作以降低内源酰基-acp硫酯酶的活性;例如,优先水解长度c18(例如硬脂酸酯(c18:0)或油酸酯(c18:1))或c8:0-c16:0脂肪酸的脂肪酰基-acp链的fata或fatb酰基-acp硫酯酶。可以通过敲除或敲减法来降低内源酰基-acp硫酯酶的活性。敲减可以例如通过使用一个或多个rna发夹构建体、通过启动子劫持(用更低活性或可诱导启动子取代内源基因的天然启动子)或通过基因敲除与在可诱导启动子控制下类似或相同基因的引入相结合来实现。实例9描述了内源性fata基因座的消融和由消融的基因组表达蔗糖转化酶与sad。因此,产油细胞,包括具有ii型脂肪酸生物合成路径的有机体的那些,可以具有编码酰基-acp硫酯酶或编码lpaat的等位基因敲除或敲减达到如在脂肪酸补充或基因补充不存在下消除或严重限制这些细胞的活力的程度。这些品系可以用于对表达酰基-acp-硫酯酶或lpaat转基因的转化子进行选择。可替代的,或此外,这些品系可以用于完全地移植外源酰基-acp-硫酯酶,以得到由这些细胞产生的细胞油的明显不同的脂肪酸谱。举例来说,可以完全或几乎完全地消除fata表达并且用产生中链脂肪酸的fatb基因代替。可替代的,含有相对于硬脂酸或油酸(c18)对棕榈酸(c16)具有特异性的内源fata基因的有机体可以用对硬脂酸(c18:0)具有更大相对特异性的外源fata基因代替或用对油酸(c18:1)具有更大相对特异性的外源fata基因代替。在某些具体实施例中,这些具有内源酰基-acp硫酯酶双敲除的转化子产生了具有超过50%、60%、70%、80%或90%的辛酸、癸酸、月桂酸、肉豆蔻酸或棕榈酸,或具有链长度不超过18个碳的总脂肪酸的细胞油。这些细胞可能需要用更长链的脂肪酸(如硬脂酸或油酸)进行补充,或在调控fata基因的可诱导启动子情形中在容许生长与限制性状态之间的环境条件转变。如在此所讨论的,lpaat酶催化脂肪酰基转移到取代的酰基甘油酯的sn-2位置中。根据特定lpaat,酶可能偏好短链、中链或长链脂肪酰基的底物。某些lpaat具有广泛特异性并且可以催化短链和中链脂肪酰基或者中链或长链脂肪酰基。在本发明的宿主细胞中,宿主细胞可以具有一种或多种内源性lpaat酶以及具有编码特定lpaat的1个、2个或更多个等位基因。在此用于指示lpaat及其相应等位基因的符号如下。lpaat1-1指示编码lpaat1的等位基因1;lpaat1-2指示编码lpaat1的等位基因2;lpaat2-1指示编码lpaat2的等位基因1;lpaat2-2指示编码lpaat2的等位基因2。在本发明的宿主细胞中,宿主细胞可以具有一种或多种内源性硫酯酶以及具有编码特定硫酯酶的1个、2个或更多个等位基因。在此用于指硫酯酶及其相应等位基因的符号如下。fata-1指示编码fata的等位基因1;fata-2指示编码fata的等位基因2;fatb-1指示编码fatb的等位基因1;fatb-2指示编码fatb的等位基因2。可替代的,或此外,这些品系可以用于完全地移植外源性lpatt,以得到由这些细胞产生的细胞油的明显不同的sn-2谱。例如,lpaat表达可以完全或几乎完全消除并且被催化脂肪酰基转移到sn-2位置的lpaat基因置换。可替代的,含有对长链脂肪酰基具有特异性的内源性lpaat基因的生物体可以被对中链具有更大相对特异性的外源性lpaat基因置换或者被对短链脂肪酰基具有更大相对特异性的外源性lpaat基因置换。在一个实施例中,对产油细胞进行培养(例如,在生物反应器中)。这些细胞关于一种或多种类型的脂肪酸是完全或部分营养缺陷型的(即,致命性或合成疾病的)。在补充脂肪酸情况下培养这些细胞,由此增加细胞数量,然后使细胞能积累油(例如,以干细胞重量计达到至少40%)。可替代地,细胞包含一个可调控脂肪酸合成基因,该基因可以基于环境条件以及在第一、细胞分裂、有利于产生脂肪酸阶段期间的环境条件和在第二、油积累、不利于产生脂肪酸阶段期间的环境条件来转变活性。在可诱导基因的情形中,可以(不限于)经由环境ph(例如,通过使用amt3启动子,如实例中所描述)来介导可诱导基因的调控。由于应用了这些补充或调控方法,可以从具有较少量的对于最佳细胞繁殖必需的一种或多种脂肪酸的细胞获得细胞油。可以获得的油的特定实例包括含较少硬脂酸、亚油酸和/或亚麻酸的那些。这些细胞和方法结合正下文的部分中的低多不饱和油示出。同样,脂肪酸营养缺陷型可以在其他脂肪酸合成基因中制造,包括了编码sad、fad、kasiii、kasi、kasii、kcs、fae、lpcat、pdct、dag-cpt、gpat、lpaat、dgat或agpat或pap的那些。这些营养缺陷型可以用于选择补充基因或消除这些基因的天然表达以利于所希望的外源基因,以便改变由产油细胞产生的细胞油的脂肪酸谱、区域特异性谱或tag谱。因此,在本发明的一个实施例中,存在一种用于制造油/脂肪的方法。该方法包括在生长阶段中,在容许细胞分裂的第一组条件下培养重组产油细胞,由此因脂肪酸的存在而增加细胞数量;在油产生阶段中,在限制细胞分裂但容许耗尽脂肪酸的油产生的第二组条件下培养该细胞;并且从该细胞提取该油,其中该细胞具有突变或外源核酸,这些核酸可操作以抑制脂肪酸合成中的酶的活性,该酶任选地为硬脂酰基-acp去饱和酶、δ12脂肪酸去饱和酶或酮酰基-acp合酶、fad、kasiii、kasi、kasii、kcs、fae、lpcat、pdct、dag-cpt、gpat、lpaat、dgat或agpat或pap。由该细胞产生的油可以使脂肪酸减少至少50%、60%、70%、80%或90%。该细胞可以异养地培养。该细胞可以是异养地或自养地培养的微藻细胞,并且可以产生以干细胞重量计至少40%、50%、60%、70%、80%或90%的油。iv.具有小于3%的饱和脂肪的细胞油在本发明的一个实施例中,由该细胞产生的细胞油具有小于3%的总饱和脂肪酸。该细胞油在室温下可以为液体或固体,或液体与固体油的掺混物,包括区域特异性或立体特异性油、或具有高单不饱和脂肪酸含量的油,如在下文中描述的。举例来说,osi(氧化稳定性指数)测试可以在介于110℃与140℃之间的温度下执行。通过对遗传工程改造成降低一种或多种脂肪酸去饱和酶的活性的细胞进行培养(例如,以上或在本文别处所提到的任何质体微生物细胞)来产生油。举例来说,可以对细胞进行遗传工程改造,以降低一种或多种负责将油酸(18:1)转化成亚油酸(18:2)的脂肪酰基δ12去饱和酶和/或一种或多种负责将亚油酸(18:2)转化成亚麻酸(18:3)的脂肪酰基δ15去饱和酶的活性。可以使用不同方法来抑制该去饱和酶,包括在编码或调控区中编码该去饱和酶的基因的一个或多个等位基因的敲除或突变;该酶的rna转录或翻译的抑制,包括rnai、sirna、mirna、dsrna、反义及发夹rna技术。也可以使用本领域中已知的其他技术,包括了引入一种产生抑制性蛋白质或对该去饱和酶具有特异性的其他物质的外源基因。在具体实例中,将一个脂肪酰基δ12去饱和酶等位基因的敲除与第二等位基因的rna水平抑制相结合。实例9描述了具有小于3%由产油微藻细胞产生的总饱和脂肪酸的油,在该细胞中fad基因被敲除。在另一个特定实施例中,存在一种与抗氧化剂(诸如pana和抗坏血酸棕榈酸酯)组合的油。甘油三酯油和这些抗氧化剂的组合可以具有一般适用性,包括产生稳定的生物可降解润滑剂(例如,喷气发动机润滑剂)。油的氧化稳定性可以在确定的温度下,使用aocscd12b-92标准测试通过熟知的技术(包括兰奇马特方法)确定。举例来说,osi(氧化稳定性指数)可以在一个温度范围内,优选地介于110℃与140℃之间确定。适用于本发明的油的抗氧化剂包括α、δ及γ生育酚(维生素e)、生育三烯酚、抗坏血酸(维生素c)、谷胱甘肽、硫辛酸、尿酸、β-胡萝卜素、番茄红素、叶黄素、视黄醇(维生素a)、泛醌(辅酶q)、褪黑激素、白藜芦醇、类黄酮、迷迭香提取物、没食子酸丙酯(pg)、叔丁基氢醌(tbhq)、丁基化羟基苯甲醚(bha)及丁基化羟基甲苯(bht)、n,n'-二-2-丁基-1,4-亚苯基二胺、2,6-二-叔丁基-4-甲基苯酚、2,4-二甲基-6-叔丁基苯酚、2,4-二甲基-6-叔丁基苯酚、2,4-二甲基-6-叔丁基苯酚、2,6-二-叔丁基-4-甲基苯酚、2,6-二-叔丁基苯酚及苯基-α-萘胺(pana)。除去饱和酶修饰外,在相关实施例中,可以进行其他基因修饰以进一步订制该油的特性(如通篇所描述),包括了具有改变的链长度特异性的酰基-acp硫酯酶的引入或取代和/或编码kas、sad、lpaat、dgat、kasiii、kasi、kasii、kcs、fae、lpcat、pdct、dag-cpt、gpat、lpaat、dgat或agpat或pap基因的内源或外源基因的过量表达。举例来说,产生升高的油酸水平的品系还可以产生低水平多不饱和物。这些基因修饰可以包括通过引入外源sad基因来增加硬脂酰基-acp去饱和酶(sad)的活性;通过引入外源kasii基因来增加延长酶活性,和/或对fata基因进行敲减或敲除。参见实例9。在一个具体实施例中,可以产生具有较少的多不饱和物的高油酸细胞油。举例来说,该油可以具有一种含超过60%、70%、80%、90%或95%的油酸和不到5%、4%、3%、2%或1%的多不饱和物的脂肪酸谱。在相关实施例中,通过一种具有重组核酸的细胞来产生细胞油,这些重组核酸可操作以降低脂肪酸δ12去饱和酶活性并且任选地减少脂肪酸δ15去饱和酶,由此产生了具有低于或等于3%的多不饱和脂肪酸并且超过60%的油酸、低于2%的多不饱和脂肪酸和超过70%的油酸、低于1%的多不饱和脂肪酸和超过80%的油酸,或低于0.5%的多不饱和脂肪酸和超过90%的油酸的油。已经发现,增加油酸的一种方式是使用重组核酸,这些重组核酸可操作以减少fata酰基-acp硫酯酶的表达并且任选地过量表达kasii基因;此类细胞可以产生一种具有超过或等于75%的油酸的油。可替代的,可以使用kasii的过量表达,而不对fata进行敲除或敲减。通过使用以上方法降低δ12脂肪酸去饱和酶活性,由此减少被转化成不饱和亚油酸和亚麻酸的油酸的量,来进一步增加油酸水平。因此,所产生的油可以具有一种含至少75%的油酸和至多3%、2%、1%或0.5%的亚油酸的脂肪酸谱。在一个相关实例中,该油具有介于80%与95%之间的油酸和约0.001%到2%的亚油酸、0.01%到2%的亚油酸或0.1%到2%的亚油酸。在另一个相关实例中,通过培养产油细胞(例如,微藻)来生产油,这样使得该微藻产生具有低于10%棕榈酸、超过85%油酸、1%或更少多不饱和脂肪酸和低于7%饱和脂肪酸的细胞油。在具有fad和fata敲除和外源kasii基因的表达的微藻中产生这样一种油。这些油将具有较低凝固点和优良的稳定性并且可用于食品、用于油炸、燃料或化学应用中。另外,这些油可以随时间展现出降低的变色倾向。v.具有外源酰基转移酶的细胞在本发明的不同实施例中,可以将一个或多个编码酰基转移酶(负责使一种脂肪酸与甘油或甘油衍生物缩合形成酰基甘油的一种酶)的基因引入产油细胞(例如,质体微藻细胞)中,由此改变由该细胞产生的细胞油的脂肪酸组成。这些基因可以编码以下各项中的一种或多种:甘油-3-磷酸酰基转移酶(gpat);溶血磷脂酸酰基转移酶(lpaat),又称为1-酰基甘油-3-磷酸酰基转移酶(agpat);磷脂酸磷酸酶(pap);或二酰基甘油酰基转移酶(dgat),它将一个酰基转移到dag的sn-3位置,藉此产生tag。重组核酸可以整合到一个质粒或细胞的染色体中。可替代的,该基因编码脂质路径中通过与以上分开的不依赖于脂肪酰基辅酶a的途径产生tag前体分子的一种酶。酰基-acp可以作为质体gpat和lpaat酶和/或线粒体gpat和lpaat酶的底物。在能够并入酰基(例如来自膜磷脂)以产生tag的另外的酶中有磷脂二酰基甘油酰基转移酶(pdat)。磷脂合成以及可能影响三酸甘油酯组成的重建中涉及又另外的酰基转移酶,包括溶血磷脂酰胆碱酰基转移酶(lpcat)、溶血磷脂酰丝氨酸酰基转移酶(lpsat)、溶血磷脂酰乙醇胺酰基转移酶(lpeat)及溶血磷脂酰肌醇酰基转移酶(lpiat)。外源基因可以编码对于转移包含特定数量碳原子和/或特定饱和度的酰基底物具有优先特异性的酰基转移酶,将该基因引入产油细胞中,由此产生富含指定区域特异性三酸甘油酯的油。举例来说,已经证实椰子(椰)溶血磷脂酸酰基转移酶对于c12:0辅酶a底物的偏好高于其他酰基辅酶a底物(克努顿(knutzon)等,植物生理学(plantphysiology),第120卷,1999,第739-746页),而成熟红花种子的1-酰基-sn-3-甘油-3-磷酸酯酰基转移酶显示对于亚油酰基辅酶a和油酰基辅酶a底物的偏好高于其他酰基辅酶a底物,包括硬脂酰基辅酶a(市原(ichihara)等,欧洲生物化学杂志(europeanjournalofbiochemistry),第167卷,1989,第339-347页)。另外,酰基转移酶蛋白质可以对一种或多种短链、中链或长链酰基辅酶a或酰基-acp底物展现优先特异性,但该优先选择只能在溶血磷脂酸供体底物的sn-1或sn-3位置中存在特定(例如中链)酰基的情况下碰到。作为外源基因的结果,可以由在sn-2位置处发现的特定脂肪酸超过20%、30%、40%、50%、60%、70%、90%或90%为tag分子的细胞来产生tag油。在本发明的一些实施例中,细胞制造出富含饱和-不饱和-饱和(sat-unsat-sat)tag的油。饱和-不饱和-饱和tag包括1,3-双十六酰基-2-(9z-十八碳烯酰基)-甘油(也称为1-棕榈酰基-2-油烯基-甘油基-3-棕榈酰基)、1,3-双十八酰基-2-(9z-十八碳烯酰基)-甘油(也称为1-硬脂酰-2-油烯基-甘油基-3-硬脂酰)以及1-十六酰-2-(9z-十八碳烯酰基)-3-十八烷酰基-甘油(也称为1-棕榈酰基-2-油烯基-甘油基-3-硬脂酰)。这些分子对应地更常称为pop、sos及pos,其中‘p’表示棕榈酸,‘s’表示硬脂酸并且‘o’表示油酸。饱和-不饱和-饱和tag的另外的实例包括mom、lol、mol、coc及col,其中‘m’表示肉豆蔻酸、‘l’表示月桂酸,并且‘c’表示癸酸(c8:0)。三饱和物,即具有三个饱和脂肪酰基的三酸甘油酯,常常因其结晶速率高于其他类型三酸甘油酯而被探索用于食品应用。三饱和物的实例包括ppm、ppp、lll、sss、ccc、pps、ppl、ppm、llp及lls。此外,tag中脂肪酸的区域特异性分布是在消化和吸收期间膳食脂肪代谢命运的一个重要决定因素。在一些实施例中,酰基转移酶(例如,lpaat)的表达降低了tag的c18:1含量和/或增加了tag的c18:2、c18:3、c20:1或c22:1含量。实例10披露了微藻中的lpaat表达,这些微藻显示了c18:1的显著降低和c18:2、c18:3、c20:1或c22:1的显著增加。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:1的降低量可以增加低于10%、低于15%、低于20%、低于25%、低于30%、低于35%、低于50%、低于55%、低于60%、低于65%、低于70%、低于75%、低于80%、低于85%、低于90%或低于95%。在一些实施例中,酰基转移酶(例如,lpaat)的表达增加了tag的c18:2、c18:3、c20:1或c22:1含量。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:2、c18:3、c20:1或c22:1的增加量可以增加超过10%、超过15%、超过20%、超过25%、超过30%、超过35%、超过50%、超过55%、超过60%、超过65%、超过70%、超过75%、超过80%、超过85%、超过90%、超过100%、超过100%-500%或超过500%。根据本发明的某些实施例,用重组核酸转化产油细胞,作为引入了重组核酸的结果,由此产生了包含升高的量的指定区域特异性三酸甘油酯(例如,1-酰基-2-油酰基-甘油-3-酰基或1-酰基-2-月桂酰基-甘油-3-酰基,其中油酸或月桂酸对应地在sn-2位置)的细胞油。可替代的,辛酸、癸酸、肉豆蔻酸或棕榈酸可以在sn-2位置处。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的指定区域特异性三酸甘油酯的量可以增加超过5%、超过10%、超过15%、超过20%、超过25%、超过30%、超过35%、超过40%、超过50%、超过60%、超过70%、超过80%、超过90%、超过100%-500%,或超过500%。因此,该细胞三酸甘油酯的sn-2谱可以具有超过10%、20%、30%、40%、50%、60%、70%、80%或90%的特定脂肪酸。位于甘油脂类中的不同立体特异性或区域特异性位置中的酰基链的同一性可以经由本领域已知的一种或多种分析方法来评价(参见,乐迪(luddy)等人,美国石油化学学会期刊(j.am.oilchem.soc.),41,693-696(1964),布鲁克霍夫(brockerhoff),脂类研究杂志(j.lipidres.),6,10-15(1965),安格斯(angers)和艾瑞(aryl),美国石油化学学会期刊(j.am.oilchem.soc.),卷76:4,(1999),buchgraber等人,欧洲脂质科学与技术杂志(eur.j.lipidsci.technol.),106,621-648(2004))或者根据以下给出的实例1来评价。三酸甘油酯分子中脂肪酸的位置分布会受到酰基转移酶的底物特异性以及可用酰基部分底物池的浓度和类型影响。适于改变重组微生物中产生的三酸甘油酯的区域特异性的酶的非限制性实例列于表4-7中。本领域普通技术人员可以鉴别出另外的适合蛋白质。表4.甘油-3-磷酸酰基转移酶和基因库(genbank)登录号。适合于供本发明的微生物和方法使用的溶血磷脂酸酰基转移酶包括但不限于表5中列出的那些。表5.溶血磷脂酸酰基转移酶和基因库登录号。适合于供本发明的微生物和方法使用的二酰基甘油酰基转移酶包括但不限于表6中列出的那些。表6.二酰基甘油酰基转移酶和基因库登录号。适合于供本发明的微生物和方法使用的磷脂二酰基甘油酰基转移酶包括但不限于表7中列出的那些。表7.磷脂二酰基甘油酰基转移酶和基因库登录号。在本发明的一个实施例中,将已知或新型lpaat基因转化到产油细胞中以便改变那些细胞产生的甘油三酯的脂肪酸谱,这是经由改变甘油三酯的sn-2谱或者经由增加甘油三酯中的c18:3、c20:1或c22:1含量或者经由降低甘油三酯的c18:1含量来进行。举例来说,由于在产油细胞中表达外源活性的lpaat,在sn-2位置处不饱和脂肪酸的百分比增加10%、20%、30%、40%、50%、60%、70%、80%、90%或更高。举例来说,细胞可以产生在sn-2位置处具有30%不饱和物(它们可能主要为18:1和18:2以及18:3脂肪酸)的三酸甘油酯。在另一个实施例中,活性lppat的表达导致c18:1的产生量增加10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。在另一个实施例中,活性lppat的表达导致c18:2、c18:3、c20:1或c22:1单独或一起的产生量增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%、500%或超过500%。可替代的,可以使用外源lpaat来增加在sn-2位置处的中链脂肪酸,包括饱和中链脂肪酸,如c8:0、c10:0、c12:0、c14:0或c16:0部分。结果是,总脂肪酸谱中的中链水平可能增加。lpaat基因的选择很重要,因为不同的lpaat会引起sn-2和脂肪酸谱向不同酰基链长度或饱和水平转变。本发明的具体实施例是一种核酸构建体、一种包含该核酸构建体的细胞、一种培养该细胞以产生三酸甘油酯的方法,以及所产生的三酸甘油酯油,其中该核酸构建体具有可操作地连接到一个新颖lpaat编码序列的一个启动子。该编码序列可以在上游具有起始密码子并且在下游具有终止密码子随后是3utr序列。在一个具体实施例中,lpaat基因具有lpaat活性和与seqidno:29至34的cdna中的任一项具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的编码序列,或其功能片段,包括由遗传密码的简并性产生的等效序列。也可以将内含子插入该序列中。除了微藻和其他产油细胞之外,表达作为转基因的新颖lpaat的植物清楚地包括在这些实施例中并且可以使用已知的遗传工程改造技术产生。vi.具有外源延长酶或延长酶复合酶的细胞在本发明的不同实施例中,可以将编码延长酶或脂肪酰基辅酶a延长复合物的组分的一种或多种基因引入产油细胞(例如质体微藻细胞)中,由此改变该细胞或由该细胞产生的细胞油的脂肪酸组成。这些基因可以编码β-酮脂酰辅酶a合酶(又称为延长酶、3-酮酰基合酶、β-酮酰基合酶或kcs)、酮脂酰辅酶a还原酶、羟酰基辅酶a脱水酶、烯酰基辅酶a还原酶或延长酶。由这些基因编码的酶在延长由酰基-acp硫酯酶释放的酰基辅酶a分子方面具有活性。重组核酸可以整合到一个质粒或细胞的染色体中。在一个具体实施例中,该细胞属于绿藻门,包括异养细胞,如无绿藻属的那些。适合于供本发明的微生物和方法使用的β-酮脂酰辅酶a合酶和延长酶包括但不限于,表8和序列表中列出的那些。表8.以基因库登录号列出的β-酮脂酰辅酶a合酶和延长酶。在本发明的一个实施例中,将编码对于延长一种包含特定数量碳原子和/或特定酰基链饱和度的酰基底物具有优先特异性的β-酮脂酰辅酶a合酶或延长酶的外源基因引入产油细胞中,由此产生了富含具有指定链长度和/或饱和的脂肪酸的细胞或油。实例10和15描述了无绿藻属品系的工程改造,其中已经对优先选择延伸长链脂肪酰基辅酶a的外源脂肪酸延长酶进行过量表达以增加c18:2、c18:3、c20:1和/或c22:1的浓度。在具体实施例中,产油细胞产生了包含超过0.5%、1%、2%、5%、10%、20%、30%、40%、50%、60%、70%或80%亚油酸、亚麻酸、芥酸和/或二十碳烯酸的油。可替代的,该细胞产生了包含0.5%-5%、5%-10%、10%-15%、15%-20%、20%-30%、30%-40%、40%-50%、50%-60%、60%-70%、70%-80%、80%-90%或90%-99%的亚油酸、亚麻酸、芥酸或二十碳烯酸的油。该细胞可以包含以上结合高油酸油描述的重组酸,其中另外引入了在延长油酰基辅酶a方面具有活性的外源β-酮脂酰辅酶a合酶。作为该外源β-酮脂酰辅酶a合酶表达的结果,由该细胞天然产生的亚麻酸、芥酸或二十碳烯酸可以增加超过2、3、4、5、10、20、30、40、50、70、100、130、170、200、250、300、350或400倍。高芥酸和/或二十碳烯酸油也可以是一种高稳定性油;例如,包含低于5%、4%、3%、2%或1%的多不饱和物和/或具有描述于部分iv或本申请和所附实例中的osi值的油。在一个具体实施例中,该细胞是一种任选异养地培养的微藻细胞。与在其他实施例中相同,可以通过质体细胞(包括绿藻门,四胞藻纲,小球藻目或小球藻科的异养微藻)的遗传工程改造来产生油/脂肪。优选地,该细胞是产油的并且能够积累以干细胞重量计至少40%的油。该细胞可以是专性异养的,如无绿藻属种类,包括桑葚型无绿藻或饶氏无绿藻。在具体实施例中,产油微生物细胞表达与表8的酶具有80%、85%、90%、95%、96%、97%、98%或99%氨基酸序列同一性的酶,所述细胞任选地是产油微藻细胞,任选地属于绿藻门,四胞藻纲,小球藻目或小球藻科。vii.区域特异性和立体特异性油/脂肪在一个实施例中,重组细胞产生了具有指定区域特异性构成的细胞脂肪或油。因此,该细胞可以产生具有形成给定多晶型结晶的趋势的甘油三酯脂肪;例如,当加热至熔融温度以上并且然后冷却到脂肪的熔融温度之下时。举例来说,该脂肪在回火或不回火情况下可能倾向于形成β或β’形式的晶体多形物(例如,如通过x射线衍射分析所测定)。这些脂肪可能为订制的脂肪。在具体实施例中,脂肪可以直接来自冷却时的β或β’结晶;或者,脂肪可以进行通过β形式至β’形式。此类脂肪可以被用作食品应用的结构化、层叠或涂覆脂肪。细胞脂肪可以被并入蜜饯、黑或白巧克力、巧克力味的糖果、冰淇淋、人造黄油或其他抹酱、奶油糖膏馅、软点心或其他食品中。任选地,这些脂肪可以为半固体(在室温下),但不含人工地产生的反式脂肪酸。此类脂肪还可以用于皮肤护理和其他消费品或工业产品中。与在其他实施例中相同,可以通过质体细胞(包括绿藻门,四胞藻纲,小球藻目或小球藻科的异养真核微藻)的遗传工程改造来产生脂肪。优选地,该细胞是产油的并且能够积累以干细胞重量计至少40%的油。该细胞可以是专性异养的,如无绿藻属种类,包括桑葚型无绿藻或饶氏无绿藻。还可以在自养藻类或植物中产生脂肪。任选地,该细胞能够使用蔗糖产生油并且可以引入重组转化酶基因以使蔗糖代谢,如pct公开wo2008/151149、wo2010/06032、wo2011/150410、wo2011/150411;以及国际专利申请pct/us12/23696中所描述。该转化酶可以经过密码子优化并且被整合到细胞染色体中,并且在此提到的所有基因也可以进行此操作。已经发现,培养的重组微藻可以在低于硬原料脂肪的熔点的温度下产生硬原料脂肪。举例来说,桑葚型无绿藻可以被改变成在15℃至30℃范围内的温度下异养产生具有超过50%硬脂酸的三酸甘油酯油,其中当保持在30℃下时,该油凝固。在一个实施例中,细胞脂肪具有至少30%、40%、50%、60%、70%、80%或90%的具一般结构[饱和脂肪酸(sn-1)-不饱和脂肪酸(sn-2)-饱和脂肪酸(sn-3)]的脂肪。这在以下称为sat-unsat-sat脂肪。在一个具体实施例中,这一结构中的饱和脂肪酸优选地为硬脂酸酯或棕榈酸酯并且该不饱和脂肪酸优选地为油酸酯。因此,该脂肪可以主要形成β或β’多形性晶体,或这些的混合物,并且具有相应的物理特性,包括用于食品或个人护理产品所希望的那些。举例来说,该脂肪可以在口腔温度(对于食品来说)或在皮肤温度(对于乳膏、洗液或其他个人护理产品来说)下熔融(例如,熔融温度为30℃到40℃,或32℃到35℃)。任选地,这些脂肪可以具有2l或3l的层状结构(例如,如通过x射线衍射分析所测定)。任选地,该脂肪可以在不回火的情况下形成这一多形性形式。在一个具体的相关实施例中,细胞脂肪三酸甘油酯具有高浓度sos(即,在末端sn-1和sn-3位置处具有硬脂酸酯并且在甘油主链的sn-2位置处具有油酸酯的三酸甘油酯)。举例来说,该脂肪可以具有的三酸甘油酯包含至少50%、60%、70%、80%或90%的sos。在一个实施例中,该脂肪具有的三酸甘油酯含至少80%的sos。任选地,至少50%、60%、70%、80%或90%的sn-2连接的脂肪酸是不饱和脂肪酸。在一个具体实施例中,至少95%的sn-2连接的脂肪酸是不饱和脂肪酸。此外,sss(三-硬脂酸酯)水平可以低于20%、10%或5%,和/或c20:0脂肪酸(花生酸)水平可以低于6%,并且任选地高于1%(例如从1%到5%)。举例来说,在一个具体实施例中,由重组细胞产生的细胞脂肪具有至少70%sos三酸甘油酯,其中至少80%的sn-2为不饱和脂肪酰基部分。在另一个具体实施例中,由重组细胞产生的细胞脂肪具有含至少80%sos三酸甘油酯并且具有至少95%的sn-2不饱和脂肪酰基部分的tag。在又另一个具体实施例中,由重组细胞产生的细胞脂肪具有含至少80%sos、至少95%的sn-2不饱和脂肪酰基部分及介于1%到6%之间的c20脂肪酸的tag。在又另一个具体实施例中,该细胞脂肪的脂肪酸谱中硬脂酸酯和棕榈酸酯百分比的总和是油酸酯百分含量的两倍,±10%、20%、30%或40%[例如,(%p+%s)/%o=2.0±20%]。任选地,这一脂肪的sn-2谱为至少40%并且优选地至少50%、60%、70%或80%的油酸酯(在sn-2位置处)。另外任选地,这一脂肪可以为至少40%、50%、60%、70%、80%或90%的sos。任选地,该脂肪包含介于1%到6%之间的c20脂肪酸。在这些实施例中的任一项中,高饱和不饱和饱和脂肪可能倾向于形成β’多形性晶体。与先前可用的植物脂肪(如可可脂)不同,由细胞产生的饱和不饱和饱和脂肪可以在不回火的情况下形成β’多形性晶体。在一个实施例中,在加热到熔融温度以上并且冷却到低于该熔融温度,保持3、2、1或0.5小时之后,形成该多形物。在一个相关实施例中,在加热到60℃以上并且冷却到10℃,保持3、2、1或0.5小时之后,形成该多形物。在不同实施例中,该脂肪当加热到熔融温度以上并且冷却到低于熔融温度,并且任选地在5、4、3、2、1、0.5小时或更短时间内进行到至少50%多形性平衡时,当加热到熔融温度以上并且然后在10℃下冷却时形成β形式、β’形式或两种形式的多形物。该脂肪可以以比可可脂快的速率形成β’晶体。任选地,这些脂肪中任一种可以具有不到2摩尔%的二酰基甘油,或总计不到2摩尔%的单酰基甘油和二酰基甘油。在一个实施例中,该脂肪可以具有的熔融温度在30℃-60℃、30℃-40℃、32℃到37℃、40℃到60℃或45℃到55℃之间。在另一个实施例中,该脂肪可以在20℃下具有40%到50%、15%到25%、或低于15%的固体脂肪含量(sfc)和/或在35℃下具有低于15%的sfc。用于制备脂肪的细胞可以包括多种可操作以改变细胞三酸甘油酯中脂肪酸的饱和物与不饱和物比率,以便有利于形成satunsatsat脂肪的重组核酸。举例来说,可以使用硬脂酰基-acp去饱和酶(sad)基因的敲除或敲减而相对于油酸酯有利于形成硬脂酸酯,或外源中链偏好型酰基-acp硫酯酶基因的表达可以增加中链饱和物的水平。可替代的,编码sad酶的基因可以过量表达以增加不饱和物。在一个具体实施例中,该细胞具有了可操作以提高细胞中硬脂酸酯水平的重组核酸。因此,可以增加sos的浓度。增加硬脂酸酯水平的另一种基因修饰包括了增加细胞中酮酰基acp合酶(kas)活性,由此增加硬脂酸酯产生的速率。增加细胞中的硬脂酸酯水平的方法描述于wo2012/1106560、wo2013/158938和pct/us2014/059161。本发明的细胞油可以与常规植物或动物三酰甘油来源区别开来,因为固醇谱将指示与常规来源可区别开的宿主有机体。常规油来源包括大豆、谷物、向日葵、红花、棕榈树、棕榈仁、椰子、棉籽、卡诺拉(canola)、油菜(rape)、花生、橄榄、亚麻、动物脂油、猪油、可可、非洲酪脂树、芒果、婆罗双树、雾冰草脂、印度山竹子以及阿兰藤黄。参见本披露针对微藻固醇的论述的第xiii节。viii.表达编码lpcat、pdct、dag-pct和/或fae的重组核酸和富含c18:2、c18:3、c20:1和c22:1的油的细胞溶血磷脂酰胆碱酰基转移酶(lpcat)在磷脂酰胆碱(pc)的酰基编辑中起重要作用。lpcat酶以正向模式和可逆反应模式两者起作用。在正向模式中,其负责将脂肪酸引导到pc(在两个可用的sn位置)中。在可逆反应模式中,lpcat酶将脂肪酸从pc中转移到酰基coa池中。然后可以将释放的脂肪酸结合到tag的形成中或进一步去饱和或延长。在释放的油酸的情况下,其可以结合到tag的形成中或者可以进一步加工成亚油酸、亚麻酸或者进一步延长成c20:1、c22:1或更高去饱和度的脂肪酸,其然后可以结合以形成tag。磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(pdct)和二酰基甘油胆碱磷酸转移酶(dag-cpt)催化亚油酸或亚麻酸从pc中去除。释放的脂肪酸然后可以结合到tag的形成中或者可以进一步延长成c20:1、c22:1或更高去饱和度的脂肪酸,其然后可以结合以形成tag。在本发明的不同实施例中,可以将编码lpcat、pdct、dag-cpt和/或fae的一种或多种核酸引入到产油细胞(例如质体微藻细胞)中,以便改变该细胞或由该细胞产生的细胞油的脂肪酸组成。重组核酸可以整合到一个质粒或细胞的染色体中。在一个具体实施例中,该细胞属于绿藻门,包括异养细胞,如无绿藻属的那些。在一些实施例中,lpcat、pdct、dag-cpt和/或fae的表达降低了tag的c18:1含量和/或增加了tag的c18:2、c18:3、c20:1或c22:1含量。实例11、12和16披露了微藻中的lpcat表达,这些微藻显示了c18:1的显著降低和c18:2、c18:3、c20:1或c22:1的显著增加。实例13和14披露了微藻中的pdct表达,这些微藻显示了c18:1的显著降低和c18:2、c18:3、c20:1或c22:1的显著增加。实例15披露了微藻中的dag-cpt表达,这些微藻显示了c18:1的显著降低和c18:2、c18:3、c20:1或c22:1的显著增加。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:1的降低量可以增加低于10%、低于15%、低于20%、低于25%、低于30%、低于35%、低于50%、低于55%、低于60%、低于65%、低于70%、低于75%、低于80%、低于85%、低于90%或低于95%。在一些实施例中,lpcat、pdct、dag-cpt和/或fae的表达增加了tag的c18:2、c18:3、c20:1或c22:1含量。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:2、c18:3、c20:1或c22:1的增加量可以增加超过10%、超过15%、超过20%、超过25%、超过30%、超过35%、超过50%、超过55%、超过60%、超过65%、超过70%、超过75%、超过80%、超过85%、超过90%、超过100%、超过100%-500%或超过500%。ix.具有内源基因的消融和编码lpcat、pdct、dag-pct和/或fae的重组核酸和富含c18:2、c18:3、c20:1和c22:1的油的细胞本发明的一个实施例是一种重组细胞,在该细胞中内源基因的一个、两个或所有等位基因被消融(敲除)并且表达了编码lpcat、pdct、dag-pct和/或fae的一个或多个重组核酸。任选地,消融的基因是脂质生物合成路径基因。可替代的,等位基因的基因产物的量或活性被敲减,例如通过抑制性rna技术,包括rnai、sirna、mirna、dsrna、反义链以及发夹rna技术,以使得需要补充脂肪酸。当脂质路径基因的一个等位基因被敲除时,观察到酶活性的相应降低。当脂质路径基因的所有等位基因被敲除或充分抑制时,形成营养缺陷型细胞。如本文所论述,可以产生带有与该基因的一个或多个等位基因同源的供体序列的构建体。可以引入这种第一转化构建体并且随后进行选择方法,以获得以一个或多个等位基因破坏为特征的分离品系。作为替代方案,可以产生一种第一品系,该品系被工程改造成通过插入第一等位基因中来表达可选择标记物,由此使该第一等位基因失活。这一品系可以用作宿主以进一步进行遗传工程改造以使脂质路径基因的其余一个或多个等位基因敲除或敲减(例如,使用第二可选择标记物破坏第二等位基因)。在一些实施例中,消融的等位基因也是插入编码lpcat、pdct、dag-pct和/或fae的核酸的基因座。在一个实施例中,被敲除的等位基因是编码lpaat的基因。在实例10中,指示为lpaat1-1的一个lpaat1等位基因被消融并且用作插入编码lpaat的核酸的基因座。而且在实例10中,6s位点用作插入编码fae的核酸的基因座。在实例11中,指示为lpaat1-1的一个lpaat1等位基因被消融并且用作插入编码lpcat的核酸的基因座。实例11也披露了lpaat1-1的消融,其用作插入编码fae的核酸的基因座。在实例13中,lpaat1-1(等位基因1)或lpaat1-2(等位基因2)用作插入编码pdct的核酸的基因座。实例13也披露了fae到6s位点中的插入。在实例14中,lpaat1-1是用于插入pdct的基因座。在实例15中,lpaat1-1或lpaat2-2是用于插入dag-pct的基因座。实例15也披露了fae到6s位点中的插入。在实例16中,lpaat1-1是用于插入lpcat的基因座。实例16也披露了fae到6s位点中的插入。在一些实施例中,脂质生物合成路径基因(任选地为lpaat)的消融和lpcat、pdct、dag-cpt和/或fae的表达降低了tag的c18:1含量和/或增加了tag的c18:2、c18:3、c20:1或c22:1含量。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:1的降低量可以增加低于10%、低于15%、低于20%、低于25%、低于30%、低于35%、低于50%、低于55%、低于60%、低于65%、低于70%、低于75%、低于80%、低于85%、低于90%或低于95%。在一些实施例中,脂质生物合成路径基因(任选地为lpaat)的消融和lpcat、pdct、dag-cpt和/或fae的表达增加了tag的c18:2、c18:3、c20:1或c22:1含量。相较于由不含重组核酸的微生物所产生的细胞油,该细胞油中存在的c18:2、c18:3、c20:1或c22:1的增加量可以增加超过10%、超过15%、超过20%、超过25%、超过30%、超过35%、超过50%、超过55%、超过60%、超过65%、超过70%、超过75%、超过80%、超过85%、超过90%、超过100%、超过100%-500%或超过500%。x.低饱和物油在一个实施例中,细胞油是由一种重组细胞产生的。所产生的油具有一种具有低于4%、3%、2%或1%(面积%)的饱和脂肪酸的脂肪酸谱。在一个具体实施例中,该油具有0.1%至5%、0.1%至4%或0.1%至3.5%的饱和脂肪酸。某些此类油可以被用于产生一种具有可忽略的量的饱和脂肪酸的食品。任选地,这些油具有的脂肪酸谱可以包含至少90%的油酸或至少90%的油酸和至少3%的多不饱和脂肪酸。在一个实施例中,由重组细胞产生的细胞油包含至少90%的油酸、至少3%的亚油酸与亚麻酸的总和、或至少2%的亚油酸和亚麻酸的总和并且具有小于4%或小于3.5%的饱和脂肪酸。在一个相关实施例中,由重组细胞产生的细胞油包含至少90%的油酸、至少3%的亚油酸与亚麻酸的总和并且具有小于4%或小于3.5%的饱和脂肪酸,这些饱和脂肪酸中大部分包含链长度10到16。在一个相关实施例中,由重组细胞产生的细胞油包含至少90%的油酸、至少2%或3%的亚油酸与亚麻酸的总和,具有不到3.5%的饱和脂肪酸,并且包含至少0.5%、至少1%或至少2%的棕榈酸。这些油可以由重组产油细胞产生,包括但不限于,在此以及美国专利申请号13/365,253中所描述的那些。举例来说,在具有高活性sad的细胞中kasii酶的过量表达可以产生一种具有低于或等于3.75%、3.6%或3.5%的饱和物的高油酸油。任选地,油酸酯特异性酰基-acp硫酯酶也被过量表达和/或具有对低于c18的酰基链进行水解的倾向的内源硫酯酶被敲除或抑制。该油酸酯特异性酰基-acp硫酯酶可以是一种对acp-棕榈酸酯和acp-硬脂酸酯具有低活性的转基因,以使得所产生的油的脂肪酸谱中油酸相对于棕榈酸和硬脂酸的总和的比率大于3、5、7或10。可替代的,或此外,可以敲除或敲减fata基因。fata基因可以被敲除或敲减并且外源kasii过量表达。另一种任选的修饰是增加kasi和/或kasiii活性,这可以进一步抑制更短链的饱和物的形成。任选地,对于将不饱和脂肪酰基部分转移到被取代的甘油具有特异性的一种或多种酰基转移酶(例如lpaat)也被过量表达和/或内源酰基转移酶被敲除或衰减。一种另外的可选修饰是使对于延长不饱和脂肪酸具有特异性的kcs酶的活性增加和/或使对于延长饱和脂肪酸具有特异性的内源kcs敲除或衰减。任选地,通过敲除或敲减δ12脂肪酸去饱和酶,在损害亚油酸酯产生的情况下增加油酸酯。任选地,所使用的外源基因是植物基因;例如,从来源于油籽中可见的mrna的cdna获得。实例9披露了具有低于3.5%的饱和脂肪酸的细胞油。除以上基因修饰外,低饱和物油因少量的多不饱和脂肪酸而可以为高稳定性油。在此描述高稳定性、低多不饱和油的方法和表征,包括了降低内源δ12脂肪酸去饱和酶活性的方法。在一个具体实施例中,通过具有ii型脂肪合成路径的产油微生物细胞来产生油,并且该油具有不超过3.5%的饱和脂肪酸并且还具有不超过3%的多不饱和脂肪酸。在另一个具体实施例中,该油具有不超过3%的饱和脂肪酸并且还具有不超过2%的多不饱和脂肪酸。在另一个具体实施例中,该油具有不超过3%的饱和脂肪酸并且还具有不超过1%的多不饱和脂肪酸。在另一个具体实施例中,真核微藻细胞包括将棕榈酸去饱和成棕榈油酸的外源基因,该外源基因与在该微藻细胞中可操作的调节元件处于可操作连接。该细胞进一步包括fad基因的敲除或敲减。归因于遗传修饰,该细胞产生具有以下脂肪酸谱的细胞油,其中棕榈油酸(c16:1)与棕榈酸(c16:0)的比率大于0.1,具有不超过3%的多不饱和脂肪酸。任选地,棕榈油酸包括0.5%或更多的该谱。任选地,该细胞油包括低于3.5%的饱和脂肪酸。低饱和物和/或低饱和物/高稳定性油可以与不太昂贵的油掺混以在更低费用下达到靶向的饱和脂肪酸水平。举例来说,含1%饱和脂肪酸的油可以与具有7%饱和脂肪的油(例如,高油酸向日葵油)掺混以得到一种具有3.5%或更少饱和脂肪的油。根据本发明的实施例产生的油可以用在运输燃料、油脂化学品、和/或食品以及化妆品工业等应用中。举例来说,脂质的转酯作用可以产生作为生物柴油有用的长链脂肪酸酯。可以定制其他酶促和化学过程以产生脂肪酸、醛、醇、烷烃及烯烃。在一些应用中,产生了可再生柴油、喷气燃料、或其他烃化合物。本披露还提供了培养微藻的方法,该微藻用于增加生产力以及增加脂质产率,和/或用于更具成本效益地制造在此所描述的组合物。此处描述的方法允许从质体细胞大规模(例如1000、10,000、100,000升或更大)制造油。在一个实施例中,从细胞提取的油具有3.5%、3%、2.5%或2%或更少的饱和脂肪,并且被合并到食品中。完成的食品具有3.5%、3%、2.5%或2%或更少的饱和脂肪。举例来说,从此类重组微藻回收的油可以用于油炸用油或用作饱和脂肪低的预制食物中的成分。这些油可以未经稀释地使用或其他油掺混,这样使得每份食物具有低于0.5g的饱和脂肪,由此允许标明零饱和脂肪的标签(按照美国规定)。在一个具体实施例中,该油具有含至少90%的油酸、低于3%的饱和脂肪和比亚油酸多的油酸的脂肪酸谱。与本专利申请中披露的其他油一样,在此节中描述的低饱和物油(包括具有增加水平的棕榈油酸的那些)可以具有如在本申请的第xiii节描述的微藻固醇谱。举例来说,经由表达外源pad基因,可以产生具有以下脂肪酸谱和固醇谱的油,该脂肪酸谱为特征至少为0.1的棕榈油酸与棕榈酸比率和/或0.5%或更高的棕榈油酸水平为特征,如通过famegc/fid分析所确定,该固醇谱以超过β-谷固醇过量的的麦角固醇和/或22,23-二氢菜籽固醇、多孔固醇或穿贝海绵甾醇的存在为特征。xi.微量油组分根据以上方法生产的油在一些情形中是使用微藻宿主细胞制造。如以上所描述,微藻可以(不限于)属于绿藻门,四胞藻纲,小球藻目,小球藻科或绿藻纲。已经发现,四胞藻纲的微藻基于其固醇谱而可以与植物油相区别。发现由原壳小球藻产生的油可产生固醇,当通过gc-ms检测时,这些固醇看来为菜籽固醇、麦角固醇、菜油固醇、豆固醇及β-谷固醇。然而,据信由小球藻产生的所有固醇都具有c24β立体化学。因此,据信被检测为菜油固醇、豆固醇及β-谷固醇的分子实际上对应地为22,23-二氢菜籽固醇、多孔固醇及穿贝海绵甾醇。因此,由以上描述的微藻产生的油因具有c24β立体化学的固醇的存在以及所存在的固醇中c24α立体化学的不存在而可以与植物油相区分。举例来说,产生的油可能含有22,23-二氢菜籽固醇,但缺乏菜油固醇;含有穿贝海绵甾醇,但缺乏β-谷固醇,和/或含有多孔甾醇但缺乏豆固醇。可替代的,或此外,这些油可以含有大量的δ7-多孔固醇。在一个实施例中,在此提供的油不是植物油。植物油是从植物和植物种子提取的油。植物油可以基于其油含量而与在此提供的非植物油相区分。用于分析油含量的多种方式都可以用于确定该油的来源或在此提供的油是否掺杂了具有不同(例如植物)起源的油。该确定可以基于分析方法之一或组合来作出。这些测试包括但不限于以下各项中一种或多种的分析:游离脂肪酸、脂肪酸谱、总三酰基甘油含量、二酰基甘油含量、过氧化物值、光谱特性(例如uv吸收)、固醇谱、固醇降解产物、抗氧化剂(例如生育酚)、颜料(例如叶绿素)、d13c值及感官分析(例如,味道、气味及口感)。许多此类测试已经针对商业油进行标准化,如食品法典有关可食用脂肪和油的标准。固醇谱分析是一种特别众所周知的用于确定有机物质的生物来源的方法。菜油固醇、b-谷固醇及豆固醇是常见的植物固醇,其中β-谷固醇是一种主要的植物固醇。举例来说,在某些种子油的分析中发现β-谷固醇是最丰富的,在玉米种接近64%,在油菜籽中为29%,在向日葵中为64%,在棉籽中为74%,在大豆中为26%并且在橄榄油中为79%(古尔(gul)等,细胞和分子生物学杂志(j.cellandmolecularbiology)5:71-79,2006)。从桑葚型无绿藻品系utex1435分离的油单独地被澄清(cl),精炼并漂白(rb),或精炼,漂白并除臭(rbd)并且根据jaocs第60卷,第8期,1983年8月中所描述的程序针对固醇含量进行测试。分析结果示于下表9中(单位为mg/100g)。表9.来自utex1435的油的固醇谱。这些结果示出了三个突出的特征。第一,发现麦角固醇是所有固醇中最丰富的,占总固醇约50%或更高。麦角固醇的量大于菜油固醇、β-谷固醇以及豆固醇组合的量。麦角固醇是常见于真菌中的类固醇并且不常见于植物中,并且它的特别大量的存在用作非植物油的有用标记物。第二,发现该油含有菜籽固醇。除油菜籽油外,菜籽固醇不常见于基于植物的油中。第三,发现存在不到2%的β-谷固醇。β-谷固醇是不常见于微藻中的一种重要的植物固醇,并且它的特别大量的存在用作植物起源的油的一种有用标记物。概括起来,已经发现桑葚型无绿藻品系utex1435以总固醇内含物的百分含量计含有大量的麦角固醇和仅痕量的β-谷固醇。因此,麦角固醇:β-谷固醇的比率或与菜籽固醇的存在组合可以被用于将这一油与植物油相区分。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计含有低于20%、15%、10%、5%、4%、3%、2%或1%的β-谷固醇。在其他实施例中,该油不含β-谷固醇。对于披露于本申请中的油或细胞油中的任一项而言,该油可以具有以上表9的任一列的固醇谱,其中固醇间的变化为30%、20%、10%或更少。在一些实施例中,该油不含以下各项中的一种或多种:β-谷固醇、菜油固醇或豆固醇。在一些实施例中,该油不含β-谷固醇、菜油固醇及豆固醇。在一些实施例中,该油不含菜油固醇。在一些实施例中,该油不含豆固醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计包含低于20%、15%、10%、5%、4%、3%、2%或1%的24-乙基胆固-5-烯-3-醇。在一些实施例中,该24-乙基胆固-5-烯-3-醇是穿贝海绵甾醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计包含至少1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的穿贝海绵甾醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计含有低于20%、15%、10%、5%、4%、3%、2%或1%的24-甲基胆固-5-烯-3-醇。在一些实施例中,该24-甲基胆甾-5-烯-3-醇是22,23-二氢菜籽固醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计包含至少1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的22,23-二氢菜籽固醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计含有低于20%、15%、10%、5%、4%、3%、2%或1%的5,22-二烯胆甾-24-乙基-3-醇。在一些实施例中,该5,22-胆甾二烯-24-乙基-3-醇是多孔固醇。在一些实施例中,在此提供的油的油内含物以占总固醇的百分含量计包含至少1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的多孔固醇。在一些实施例中,在此提供的油的油内含物含有麦角固醇或菜籽固醇或二者的组合。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少5%、10%、20%、25%、35%、40%、45%、50%、55%、60%或65%的麦角固醇。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少25%的麦角固醇。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少40%的麦角固醇。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少5%、10%、20%、25%、35%、40%、45%、50%、55%、60%或65%的麦角固醇与菜籽固醇的组合。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少1%、2%、3%、4%或5%的菜籽固醇。在一些实施例中,该油内含物以占总固醇的百分含量计含有低于10%、9%、8%、7%、6%或5%的菜籽固醇。在一些实施例中,麦角固醇与菜籽固醇的比率为至少5:1、10:1、15:1或20:1。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少5%、10%、20%、25%、35%、40%、45%、50%、55%、60%或65%的麦角固醇和低于20%、15%、10%、5%、4%、3%、2%或1%的β-谷固醇。在一些实施例中,该油内含物以占总固醇的百分含量计含有至少25%的麦角固醇和低于5%的β-谷固醇。在一些实施例中,该油内含物另外包含菜籽固醇。固醇含有27至29个碳原子(c27至c29)并且在所有真核生物中发现。动物仅产生c27固醇,因为他们缺乏进一步修饰c27固醇以产生c28和c29固醇的能力。然而,植物能够合成c28和c29固醇,并且c28/c29植物固醇通常被称为植物甾醇。给定植物的固醇谱富含c29固醇,并且植物中的主要固醇通常是c29固醇b-谷固醇和豆固醇。相比之下,非植物有机体的固醇谱含有更大百分比的c27和c28固醇。例如,真菌和许多微藻中的固醇主要是c28固醇。植物中的固醇谱并且特别是c29固醇相比c28固醇的突出优势已被用来确定土壤样品中植物和海洋物质的比例(huang、wen-yen、meinscheinw.g.,“作为生态指示的固醇(sterolsasecologicalindicators)”;地球化学与宇宙化学学报(geochimicaetcosmochimiaacta.),第43卷,第739-745页)。在一些实施例中,在此提供的微藻油中的主要固醇是b-谷固醇和豆固醇以外的固醇。在微藻油的一些实施例中,c29固醇以重量计占总固醇含量的小于50%、40%、30%、20%、10%、或5%。在一些实施例中,在此提供的微藻油含有超过c29固醇的c28固醇。在微藻油的一些实施例中,c28固醇以重量计占总固醇含量的大于50%、60%、70%、80%、90%、或95%。在一些实施例中,c28固醇是麦角固醇。在一些实施例中,c28固醇是菜籽固醇。xii.燃料和化学品以上单独或组合论述的油可用于制造食品、燃料及化学品(包括塑料、泡沫、膜等)。这些油、甘油三酯、来自这些油的脂肪酸可以经历c-h活化、氢氨基甲基化反应、甲氧基-碳酸化反应、臭氧分解、酶促转化、环氧化反应、甲基化反应、二聚合反应、硫醇化反应、复分解反应、氢烷基化反应、内酯化反应或其他化学过程。这些油可以被转化成烷烃(例如,可再生柴油)或酯(例如,由转酯化反应产生甲基或乙基酯以用于生物柴油)。这些烷烃或酯可以用作燃料、溶剂或润滑剂,或用作化学原料。用于制造可再生柴油和生物柴油的方法是本领域中充分确定的。参见例如wo2011/150411。在本发明的一个具体实施例中,以上描述的高油酸或高油酸高稳定性油被酯化。举例来说,这些油可以用甲醇进行转酯化,得到富含油酸甲酯的油。已经发现这些配制物有利地与来自大豆油的油酸甲酯相比较。在另一个具体实例中,该油被转化成c36二酸或c36二酸的产物。从该油产生的脂肪酸可以聚合以得到富含c36二聚酸的组合物。在一个具体实例中,使高油酸油分离以得到一种高油酸脂肪酸材料,该材料聚合以得到一种富含c36二聚酸的组合物。任选地,该油是高油酸高稳定性油(例如,超过60%的油酸和低于3%的多不饱和物、超过70%的油酸和低于2%的多不饱和物,或超过80%的油酸和低于1%的多不饱和物)。据信,使用一种高油酸、高稳定性起始材料将得到更少量的环状产物,这在一些情形中可能为希望的。在使该油水解之后,获得了高浓度油酸。在制备二聚酸的过程中,高油酸物流将转化成一种“更清洁的”c36二聚酸并且不产生因c18:2和c18:3酸的存在而获得的三聚酸(c54)及其他更复杂的环状副产物。举例来说,该油可以被水解成脂肪酸并且这些脂肪酸被纯化并在蒙脱粘土存在下在250℃下二聚合。参见sri天然脂肪酸(srinaturalfattyacid),2009年3月。回收到富含油酸的c36二聚物的产物。另外,这些c36二聚酸可以酯化并氢化以得到二醇。这些二醇可以通过催化脱水进行聚合。还可以通过二聚物二醇与碳酸二甲酯的转酯化反应来产生聚合物。为了根据本发明的方法生产燃料,通过任何方便的手段收获或以别的方式收集由本发明的细胞产生的脂质。可以通过全细胞提取分离脂质。首先破坏细胞,并且然后可以如通过使用离心从细胞团中分离细胞内脂质和细胞膜/细胞壁结合的脂质以及细胞外烃。在一些实施例中,产油细胞中产生的细胞内脂质是在使细胞溶解之后提取。一旦被提取,就对这些脂质进一步精炼以产生油、燃料或油脂化学品。不同方法可用于分离脂质与细胞溶解产物。举例来说,脂质和脂质衍生物(如脂肪醛、脂肪醇)及烃(如烷烃)可以用疏水性溶剂(如己烷)提取(参看弗伦兹(frenz)等人,1989,酶与微生物技术(enzymemicrob.technol.),11:717)。脂质和脂质衍生物也可以使用以下方式提取:液化(参见例如佐和山(sawayama)等人1999,生物质与生物能源(biomassandbioenergy)17:33-39以及井上(inoue)等人1993,生物质与生物能源6(4):269-274);油液化(参见例如轮育久(minowa)等人1995,燃料(fuel)74(12):1735-1738)以及超临界co2萃取(参见例如曼德斯(mendes)等人2003,无机化学学报(inorganicachimicaacta)356:328-334)。苗(miao)和吴(wu)描述了从原始小球藻培养物回收微藻脂质的方案,其中将细胞通过离心收获、用蒸馏水洗涤并且通过冷冻干燥法干燥。在研钵中粉碎所得到的细胞粉末并且然后用正己烷提取。苗和吴,生物资源技术(biosourcetechnology)(2006)97:841-846。脂质和脂质衍生物可以通过用有机溶剂提取来回收。在一些情形中,优选的有机溶剂是己烷。典型地,将有机溶剂直接添加至溶解产物中,而不事先分离溶解产物组分。在一个实施例中,使通过以上描述的一种或多种方法产生的溶解产物与有机溶剂接触足以允许脂质和/或烃组分与有机溶剂形成溶液的一段时间。在一些情形中,然后可以进一步精炼溶液以回收特定的所希望的脂质或烃组分。己烷提取法是本领域众所周知的。如在此描述的在体内由细胞产生或在体外酶促修饰的脂质可以任选地通过常规手段进一步加工。加工可以包括“裂化”以减少尺寸,并且因此增加烃分子的氢:碳比。催化裂化和热裂化方法常规地用于烃和甘油三酯油加工中。催化性方法涉及使用催化剂,如固态酸催化剂。这种催化剂可以是二氧化硅-氧化铝或沸石,这引起碳-碳键的异裂性或非对称破裂,产生碳正离子和负离子。这些活性中间体随后经历重排或与另一种烃发生氢负离子转移。反应可以因此再生这些中间体以导致自增殖链机制。也可以加工烃以减少其中碳-碳双键或三键的数目,任选地至零。也可以加工烃以除去或消除其中的环或环状结构。还可以加工烃以增加氢:碳比率。这可以包括加氢(“氢化”)和/或烃“裂化”成更小的烃。热方法包括使用升高的温度和压力来减小烃的大小。可以使用约800℃的升高的温度以及约700kpa的升高的压力。这些条件产生“轻质(light)”烃,这是一个有时用来指代富氢烃分子的术语(与光子通量区别),同时还通过缩合产生更重质的氢相对耗乏的烃分子。该方法论提供了均裂断裂或对称断裂并且产生烯,其可以是任选地如以上所述酶促饱和的。在工厂中用于烃加工和炼油的催化方法和热方法是标准的。因此可以经由常规手段收集并且加工或精炼由在此所描述的细胞产生的烃。参见希伦(hillen)等人(生物技术与生物工程(biotechnologyandbioengineering)),第xxiv卷:193-205(1982))关于微藻产生的烃的加氢裂解的报道。在可替代的实施例中,将该级分用另一种催化剂处理,如有机化合物、热、和/或无机化合物。为了将脂质加工为生物柴油,在这一节中使用了如以下描述的转酯化方法。通过本发明的方法产生的烃在多种工业应用中是有用的。举例来说,制造直链烷基苯磺酸盐(las)(一种在几乎所有类型的去污剂以及清洁制剂中使用的阴离子表面活性剂)利用了一般包含10-14个碳原子的链的烃。参见例如,美国专利号:6,946,430;5,506,201;6,692,730;6,268,517;6,020,509;6,140,302;5,080,848;以及5,567,359。表面活性剂(如las)可以用于制造个人护理组合物和去污剂,如以下美国专利号中所描述的那些:5,942,479;6,086,903;5,833,999;6,468,955;以及6,407,044。日益增长的兴趣指向生物起源的烃组分在燃料(如生物柴油、可再生柴油、以及喷气燃料)中的用途,因为可以替代衍生自化石燃料的起始材料的可再生生物起始材料是可获得的,并且其使用是令人希望的。对从生物材料制造烃组分的方法存在迫切需要。本发明通过以下满足了这一需要:提供了使用通过在此描述的方法产生的脂质作为生物材料产生生物柴油、可再生柴油以及喷气燃料的方法,从而产生生物柴油、可再生柴油以及喷气燃料。传统的柴油燃料是富含石蜡烃的石油馏出物。它们具有宽至370°f到780°f的沸程,适合在压燃式发动机中燃烧,如柴油发动机车辆。根据该沸程,连同可允许范围的其他燃料特性,如十六烷值、浊点、闪点、粘度、苯胺点、含硫量、含水量、灰分含量、铜片腐蚀以及碳渣,美国试验与材料协会(americansocietyoftestingandmaterials;astm)建立了柴油的等级。技术上,衍生自生物质或以其他方式满足适当的astm规范的任何烃馏出物材料可以定义为柴油燃料(astmd975)、喷气燃料(astmd1655),或如果它是脂肪酸甲酯则定义为生物柴油(astmd6751)。在提取之后,可以使从在此描述的微生物生物质回收的脂质和/或烃组分经受化学处理以制造在柴油车辆或喷气发动机中使用的燃料。生物柴油是一种颜色在金色与深棕色之间变化的液体,这取决于生产原料。它与水几乎不混溶,具有高沸点和低蒸汽压。生物柴油是指供在柴油发动机车辆中使用的等同柴油的加工燃料。生物柴油是可生物降解的并且是无毒的。生物柴油胜过常规柴油燃料的一个另外的益处是较低的发动机磨损。典型地,生物柴油包含c14-c18烷基酯。不同方法将生物质或如在此描述而产生并分离的脂质转变为柴油燃料。产生生物柴油的一种优选方法是借助于如在此描述的脂质的转酯化反应。用作生物柴油的一种优选烷基酯是甲酯或乙酯。在大多数现有的柴油发动机车辆中,通过在此描述的方法生产的生物柴油可以单独使用或以任何浓度与常规柴油燃料共混使用。当与常规柴油燃料(石化柴油)掺混使用时,存在的生物柴油可以从约0.1%至约99.9%。世界上许多地方使用被称为“b”因子的系统来说明生物柴油在任何燃料混合物中的量。举例来说,含有20%生物柴油的燃料被标识为b20。纯生物柴油被称为b100。生物柴油可以通过包含在富油生物质中的三酸甘油酯的酯交换来生产。因此,本发明的另一个方面提供了一种用于生产生物柴油的方法。在一个优选实施例中,用于生产生物柴油的方法包括以下步骤:(a)使用在此披露的方法培养含脂质微生物,(b)裂解含脂质微生物以产生一种裂解产物,(c)从该裂解的微生物分离脂质,并且(d)将该脂质组合物酯交换,由此产生了生物柴油。用于微生物生长、裂解微生物以产生裂解产物、在包含有机溶剂的介质中处理该裂解产物以形成异质混合物以及将该处理的裂解产物分离为脂质组合物的方法已经描述于上文并且也可以在生产生物柴油的方法中使用。生物柴油的脂质谱通常与原料油的脂质谱高度类似。脂质组合物可以经受酯交换以产生作为生物柴油有用的长链脂肪酸酯。优选的转酯化反应概述于下并且包括碱催化的转酯化和使用重组脂肪酶的转酯化。在碱催化的转酯化方法中,在碱性催化剂(典型地是氢氧化钾)的存在下使三酰甘油酯与醇(如甲醇或乙醇)反应。这一反应形成甲酯或乙酯以及作为副产物的丙三醇(甘油)。如以上所讨论,还已经使用一种酶(如脂肪酶)代替碱来进行酯交换。可以在例如介于室温与80℃之间的温度以及大于1:1(优选约3:1)的tag与低级醇的摩尔比下进行脂肪酶催化的转酯化。对于转酯化有用的脂肪酶的其他实例见于例如美国专利号4,798,793、4,940,845、5,156,963、5,342,768、5,776,741以及wo89/01032中。这样的脂质肪酶包括但不限于由以下微生物产生的脂肪酶:根霉属、曲霉属、假丝酵母属、毛霉属、假单胞菌属、根毛霉属、假丝酵母属以及腐质霉属,以及胰脂肪酶。如果将在特别冷的温度中使用生物柴油,还可以使用后续过程。这样的过程包括冬化和分馏。两种过程都被设计为通过降低浊点(生物柴油开始结晶的温度)来改良燃料的冷流和冬季性能。存在使生物柴油冬化的若干途径。一种途径是将生物柴油与石化柴油掺混。另一种途径是使用能够降低生物柴油的浊点的添加剂。另一种途径是通过混入添加剂并且允许饱和物结晶,并且然后过滤出晶体来不加选择地去除饱和的甲酯。分馏选择性地将甲酯分离成单独的组分或馏分,从而允许去除或者纳入特定的甲酯。分馏方法包括尿素分馏、溶剂分馏及热蒸馏。由本发明的方法提供的另一种有价值的燃料是可再生柴油,其包含链烷,如c10:0、c12:0、c14:0、c16:0以及c18:0并且因此是与生物柴油是可区别的。高质量的可再生柴油符合astmd975标准。由本发明的方法产生的脂质可以用作产生可再生柴油的原料。因此,在本发明的另一个方面中提供了一种用于制造可再生柴油的方法。可以通过至少三种方法来产生可再生柴油:氢热处理(氢化处理)、加氢处理以及间接液化。这些方法产生非酯馏出物。在这些方法期间,如在此描述所产生并分离的三酰甘油酯被转化成烷烃。在一个实施例中,用于生产可再生柴油的方法包括(a)使用在此披露的方法培养含脂质微生物,(b)将微生物裂解以产生裂解产物,(c)从该裂解的微生物分离脂质,以及(d)将该脂质脱氧和氢化处理以产生链烷,由此产生可再生柴油。适合于制造可再生柴油的脂质可以经由使用有机溶剂(如己烷)从微生物生物质提取,或经由其他方法(如描述于美国专利5,928,696中的那些)获得。一些适合的方法可以包括机械压制和离心。在一些方法中,首先对微生物脂质进行裂化连同氢化处理以对应地减少碳链长度并使双键饱和。然后将该材料异构化,也连同将其氢化处理。然后通过蒸馏去除石脑油(naptha)部分,随后进行另外的蒸馏以蒸发并蒸馏柴油燃料中所希望的组分以符合astmd975标准,同时留下比所希望的组分更重的组分以便符合d975标准。对油(包括三酸甘油酯油)进行化学改性的氢化处理、加氢裂化、脱氧以及异构化方法在本领域中是众所周知的。参见例如欧洲专利申请ep1741768(a1);ep1741767(a1);ep1682466(a1);ep1640437(a1);ep1681337(a1);ep1795576(a1);以及美国专利7,238,277;6,630,066;6,596,155;6,977,322;7,041,866;6,217,746;5,885,440;6,881,873。在用于生产可再生柴油的方法的一个实施例中,产生链烷的脂质处理是通过脂质组合物的氢化处理来进行的。在氢热处理中,典型地,生物质是在升高的温度和压力下在水中发生反应以形成油和残留固体。转化温度典型地是300°f到660°f,并且压力足以保持水主要为液态,100到170个标准大气压(atm)。反应时间是约15到30分钟。在反应完成之后,从水中分离有机物。由此产生了适合于柴油的馏出物。在制造可再生柴油的一些方法中,处理三酸甘油酯的第一步骤是加氢处理以使双键饱和,接着是在氢和催化剂存在下在升高的温度进行脱氧。在一些方法中,氢化和脱氧在同一个反应中发生。在其他方法中,脱氧在氢化之前发生。然后任选地进行异构化,同样是在氢和催化剂的存在下进行。优选通过蒸馏去除石脑油组分。例如参见美国专利5,475,160(甘油三酯的氢化);5,091,116(脱氧、氢化和气体去除;6,391,815(氢化);以及5,888,947(异构化)。一种适合的用于三酸甘油酯的氢化的方法包括制备铜、锌、镁以及镧盐的水溶液以及另外的碱金属溶液,或优选碳酸铵溶液。这两种溶液可以被加热至约20℃到约85℃的温度并且以使得沉淀容器中的ph维持在5.5与7.5之间的速率一起计量放入该沉淀容器中,以便形成一种催化剂。另外的水可以最初用于该沉淀容器中或者与该盐溶液和沉淀溶液同时添加。然后将得到的沉淀物充分洗涤、干燥、在大约300℃煅烧并且在从大约100℃至大约400℃的温度范围在氢中进行活化。然后可以在反应器中在上述催化剂的存在下使一种或多种三酸甘油酯与氢接触并反应。该反应器可以是滴流床反应器、固定床气固反应器、填充的鼓泡塔反应器、连续搅拌槽反应器、浆液反应器、或在本领域内已知的任何其他适合的反应器类型。该过程可以分批或以连续方式进行。反应温度典型地在从约170℃至约250℃的范围内,同时反应压力典型地在从约300psig至约2000psig的范围内。此外,在本发明的该过程中的氢与三酸甘油酯的摩尔比典型地在从约20:1至约700:1的范围内。该过程典型地是在范围从约0.1hr-1至约5hr-1的重量时空速度(whsv)下进行。本领域的普通技术人员将认识到,反应所需要的时间期限将根据所使用的温度、氢与三酸甘油酯的摩尔比、以及氢分压而变化。通过这样的氢化过程产生的产物包括脂肪醇、甘油、痕量的石蜡以及未反应的三酸甘油酯。典型地通过常规手段将这些产物分离,例如像蒸馏、萃取、过滤、结晶,等等。石油精炼厂使用加氢处理以便通过用氢处理进料来去除杂质。加氢处理转化温度典型地是300°f至700°f。压力典型地是40至100个大气压。反应时间典型地是近似10分钟至60分钟。采用了固体催化剂来增加某些反应速率,改良对于某些产物的选择性并且优化氢消耗。用于油的脱氧的适合方法包括将一种油加热至约350°f至约550°f范围的温度并且在至少范围从约大气压至大气压以上的压力下使该加热的油连续地与氮接触至少约5分钟。适合的用于异构化的方法包括使用碱异构化以及本领域内已知的其他油异构化。氢化处理和加氢处理最终导致三酸甘油酯进料的分子量的减小。三酸甘油酯分子在加氢处理条件下被还原为四个烃分子:一个丙烷分子以三个较重的烃分子,典型地在c8至c18的范围。因此,在一个实施例中,对本发明的脂质组合物进行的一种或多种化学反应的产物是包含astmd975可再生柴油的烷烃混合物。由微生物产生烃评述于米特格(metzger)等人,应用微生物学与生物技术(applmicrobiolbiotechnol)(2005)66:486–496;以及美国能源部水生物种计划回顾:由藻类得到的生物柴油(alookbackattheu.s.departmentofenergy’saquaticspeciesprogram:biodieselfromalgae),nrel/tp-580-24190,约翰夏汗(johnsheehan),特瑞度纳罕(terridunahay),约翰本曼(johnbenemann)及保罗罗斯勒(paulroessler)(1998)中。根据t10-t90(对应地在10%与90%蒸馏体积下的温度)描述柴油燃料的蒸馏特性。可以采用在此披露的油的氢化处理、异构化以及其他的共价修饰方法、以及在此披露的蒸馏和分提方法(如冷过滤),使用根据在此披露的方法生产的三酸甘油酯油来产生具有其他t10-t90范围(如20℃、25℃、30℃、35℃、40℃、45℃、50℃、60℃以及65℃)的可再生柴油组合物。可以采用在此披露的油的氢化处理、异构化及其他共价改性方法,以及在此披露的蒸馏和分馏方法(如冷过滤)来产生具有其他t10值(如在180与295之间、在190与270之间、在210与250之间、在225与245之间、以及至少290的t10)的可再生柴油组合物。可以采用在此披露的油的氢化处理、异构化及其他共价改性方法,以及在此披露的蒸馏和分馏方法(如冷过滤)来产生具有某些t90值(如在280与380之间、在290与360之间、在300与350之间、在310与340之间、以及至少290的t90)的可再生柴油组合物。可以采用在此披露的油的氢化处理、异构化及其他共价改性方法,以及在此披露的蒸馏和分馏方法(如冷过滤)来产生具有其他fbp值(如在290与400之间、在300与385之间、在310与370之间、在315与360之间、以及至少300的fbp)的可再生柴油组合物。可以使通过本发明的方法和组合物提供的其他油经受氢化处理、异构化以及其他共价修饰的组合,这些油包括具有多种脂质谱的油,这些脂质谱包括(a)至少1%-5%、优选至少4%的c8-c14;(b)至少0.25%-1%、优选至少0.3%的c8;(c)至少1%-5%、优选至少2%的c10;(d)至少1%-5%、优选至少2%的c12;以及(3)至少20%-40%、优选至少30%的c8-c14。可以通过两步法从任何形式的生物质生产传统的超低硫柴油。首先,将该生物质转化为一种合成气,合成气是一种富含氢和一氧化碳的气体混合物。然后,将该合成气催化转化为液体。典型地,使用费歇尔-托罗普希(fischer-tropsch;ft)合成来完成液体的产生。这一技术适用于煤、天然气以及重油。因此,在用于生产可再生柴油的方法的又另一个优选实施例中,对于产生链烷的脂质组合物的处理是通过对该脂质组合物进行间接液化来进行的。本发明还提供了生产喷气燃料的方法。喷气燃料是澄明至稻草色的。最常见的燃料是一种基于无铅/石蜡油的、被分类为飞机a-1(aeroplanea-1)的燃料,其按照一套国际标准化的规范生产。喷气燃料是大量的不同的烃的混合物,这些烃可能多达一千种或更多。它们的大小范围(分子量或碳数)受到对产品的要求的限制,例如凝固点或烟点。煤油型(kerosone-type)飞机燃料(包括喷气a(jeta)以及喷气a-1(jeta-1))具有在大约8与16碳数之间的碳数分布。宽馏或石脑油类型的飞机燃料(包括喷气b)典型地具有在约5与15个碳之间的碳数分布。在本发明的一个实施例中,喷气燃料是通过将藻类燃料与现有喷气燃料掺混而生产的。由本发明的方法产生的这些脂质可以用作产生喷气燃料的原料。因此,在本发明的另一个方面中提供了一种用于制造喷气燃料的方法。同此提供了由通过本发明的方法产生的脂质来产生喷气燃料的两种方法:流化催化裂化(fcc)以及加氢脱氧(hdo)。流化催化裂化(fcc)是一种用于从重质粗馏分产生烯烃,尤其是丙烯的方法。通过本发明的方法产生的脂质可以转化为烯烃。该方法涉及使所产生的脂质流动通过fcc区并且收集由烯烃组成的产物流,它适用作喷气燃料。将所产生的脂质在裂化条件下与裂化催化剂相接触以提供作为喷气燃料有用的包含烯烃和烃的产物流。在一个实施例中,用于生产喷气燃料的方法包括(a)使用在此披露的方法培养含脂质微生物,(b)将该含脂质微生物裂解以产生裂解产物,(c)从该裂解产物分离脂质,并且(d)处理该脂质组合物,由此产生喷气燃料。在用于生产喷气燃料的方法的一个实施例中,可以使该脂质组合物流动通过一个流体催化裂化区,在一个实施例中,其包括使该脂质组合物在裂化条件下与裂化催化剂相接触以提供一种包括c2-c5烯烃的产物流。在这种方法的某些实施例中,可能令人希望的是去除任何可能存在于该脂质组合物中的污染物。因此,在使该脂质组合物流动通过液体催化裂化区之前,将该脂质组合物进行处理。预处理可以涉及使该脂质组合物与一种离子交换树脂相接触。该离子交换树脂是一种酸性离子交换树脂,如amberlysttm-15,并且可以在反应器中用作供该脂质组合物流动通过(向上流动或向下流动)的床。其他预处理可以包括通过使该脂质组合物与酸(如硫酸、乙酸、硝酸或盐酸)接触而进行的温和酸洗。接触通常是在环境温度和大气压下用稀酸溶液完成的。任选地使预处理过的脂质组合物流到fcc区,在此这些含烃组分被裂化为烯烃。催化裂化是通过使该脂质组合物在反应区中与由精细分散的微粒材料组成的催化剂接触来完成的。与加氢裂化相对,该反应是催化裂化并且是在不添加氢气或无氢气消耗下进行的。随着该裂化反应的进行,大量的焦炭沉积在催化剂上。通过在一个再生区内燃烧来自该催化剂的焦炭在高温下再生该催化剂。含焦炭的催化剂(在此称为“积炭催化剂”)从反应区连续地输送至再生区以进行再生并且被来自再生区的基本上无焦炭的再生催化剂代替。不同气体流对这些催化剂颗粒的流化允许催化剂在反应区与再生区之间输送。用于在流化的催化剂流中使烃(如在此描述的脂质组合物中的那些)裂化、在反应区与再生区之间输送催化剂、以及在再生器中燃烧焦炭的方法对于fcc过程领域内的技术人员是众所周知的。示范性fcc应用和适用于使脂质组合物裂化以产生c2-c5烯烃的催化剂描述于美国专利号6,538,169、7,288,685中,它们通过引用以全文结合。适合的fcc催化剂一般包含至少两种组分,它们可以在或可以不在相同基质上。在一些实施例中,两种组分都可以循环遍及整个反应容器。第一组分通常包括在流化催化裂化领域内使用的任何熟知催化剂,如活性无定形粘土型催化剂和/或高活性结晶分子筛。分子筛催化剂可以是比无定形催化剂更优选的,这是因为它们对于所希望的产物的大大改良的选择性。在一些优选的实施例中,沸石可以用作fcc过程中的分子筛。优选地,该第一催化剂组分包括大孔沸石,如y型沸石、活性氧化铝材料、粘合剂材料,包括二氧化硅或氧化铝以及惰性填料(如高岭土)。在一个实施例中,使本发明的脂质组合物裂化发生在fcc区的提升管段(risersection)或可替代地,发生在上升段(liftsection)。通过一个喷嘴将脂质组合物引入该提升管,导致脂质组合物的迅速蒸发。在接触催化剂之前,脂质组合物通常将具有约149℃至约316℃(300°f至600°f)的温度。催化剂从掺混容器流到提升管,在此它与脂质组合物接触约2秒或更少的时间。然后将掺混的催化剂和反应的脂质组合物蒸气从提升管的顶部通过一个出口排出并且分离成包括烯烃的裂化产物蒸气流以及一批覆盖有大量焦炭并且一般被称为“积炭催化剂”的催化剂颗粒。在最小化脂质组合物与催化剂的接触时间的努力中(可以促进所希望的产物另外转化为不希望的其他产物),可以使用任何分离器安排(如涡旋臂安排)以从产物流中迅速去除积炭催化剂。该分离器,例如涡旋臂分离器,被定位在一个腔的上部分,该腔具有一个汽提区位于该腔的下部分。通过该涡旋臂安排而分离的催化剂下落到该汽提区中。包含裂化的烃(包括轻烯烃)的裂化产物蒸气流和某一催化剂经由一个管道从该腔排出,该管道与旋风分离器连通。这些旋风分离器从该产物蒸气流去除剩余的催化剂颗粒以将颗粒浓度降低至极低水平。然后该产物蒸气流从分离容器的顶部排出。使通过这些旋风分离器分离的催化剂返回到分离容器并且然后到达汽提区。汽提区通过与物流逆流接触将来自催化剂表面的吸附的烃去除。低的烃分压起作用以有利于低碳烯烃的产生。因此,提升管压力被设置在大约172至241kpa(25至35磅/平方英寸(绝对压力)),具有大约35至172kpa(5至25磅/平方英寸(绝对压力))的烃分压,具有优选的大约69至138kpa(10至20磅/平方英寸(绝对压力))的烃分压。这种相对低的烃分压是通过使用流作为稀释剂达到这种程度而实现的:该稀释剂是脂质组合物的10重量%至55重量%并且优选是脂质组合物的大约15重量%。其他稀释剂,如干燥气体,可以用来达到等同的烃分压。在提升管出口的裂解流的温度将是大约510℃至621℃(950°f至1150°f)。然而,566℃(1050°f)以上的提升管出口温度产生更多的干燥气体和更多的烯烃。然而,566℃(1050°f)以下的提升管出口温度产生更少的乙烯和丙烯。因此,在约566℃至约630℃的优选温度、约138kpa至约240kpa(20至35psia)的优选压力下执行fcc方法是优选的。用于该方法的另一个条件是催化剂与脂质组合物的比率,该比率可以在从约5至约20并且优选在从约10至约15间变化。在用于制造喷气燃料的方法的一个实施例中,脂质组合物被引入fcc反应器的上升段。上升段的温度会非常热并且范围是从约700℃(1292°f)至约760℃(1400°f),具有约100至约150的催化剂与脂质组合物比率。预期的是,将脂质组合物引入上升段将产生大量的丙烯和乙烯。在使用脂质组合物或如在此描述所产生的脂质产生喷气燃料的方法的另一个实施例中,该脂质组合物或脂质的结构是通过一种被称为加氢脱氧(hdo)的方法破坏的。hdo表示借助于氢来去除氧,即,在破坏该材料的结构的同时去除氧。烯属双键被氢化并且任何硫和氮化合物被去除。硫去除被称作加氢脱硫(hds)。原料(脂质组合物或脂质)的预处理和纯化有助于催化剂的使用寿命。一般在hdo/hds步骤中,将氢与原料(脂质组合物或脂质)混合并且然后使该混合物作为并向流(作为单相或两相原料)通过催化剂床。在hdo/mds步骤之后,对产物馏分进行分离并且传送到一个单独的异构化反应器。用于生物起始物质的异构化反应器在文献(fi100248)中被描述为一种并流反应器(co-currentreactor)。用于通过氢化烃进料(例如,在此处的脂质组合物或脂质)而生产燃料的方法还可以通过以下来进行:使该脂质组合物或脂质作为与氢气的并流通过一个第一氢化区,并且其后通过使氢气作为相对于烃流出物的逆流经过一个第二氢化区而使该烃流出物进一步在该第二氢化区中氢化。示范性hdo应用和适用于使脂质组合物裂化以产生c2-c5烯烃的催化剂描述于美国专利号7,232,935中,该案通过引用以其全文结合。典型地,在加氢脱氧步骤中,生物组分(如在此的脂质组合物或脂质)的结构被分解,氧、氮、磷及硫化合物、以及呈气体形式的轻烃被去除,并且烯属键被氢化。在该方法的第二个步骤中,即,在所谓的异构化步骤中,进行异构化以使烃链分支化并且改良石蜡在低温下的性能。在该裂化方法的第一个步骤(即,hdo步骤)中,将氢气以及有待氢化的在此的脂质组合物或脂质作为并流或逆流传送到hdo催化剂床系统,所述催化剂床系统包括一个或多个催化剂床,优选地1-3个催化剂床。该hdo步骤典型地是以并流方式操作的。在hdo催化剂床系统包括两个或更多个催化剂床的情况下,可以使用逆流原理对这些床中的一个或多个进行操作。在该hdo步骤中,压力在20巴与150巴之间、优选在50巴与100巴之间变化,并且温度是在200℃与500℃之间、优选在300℃-400℃的范围内变化。在该hdo步骤中,可以使用含有来自周期系统第vii族和/或第vib族金属的已知的氢化催化剂。优选地,这些氢化催化剂负载有pd、pt、ni、nimo或como的催化剂,载体是氧化铝和/或二氧化硅。典型地,使用了nimo/al2o3和como/al2o3催化剂。在该hdo步骤之前,可以任选地通过在更温和的条件下预氢化来处理在此的脂质组合物或脂质,由此避免双键的副反应。这种预氢化是在预氢化催化剂存在下,在50℃-400℃的温度以及1-200巴的氢气压力(优选在150℃与250℃之间的温度和在10巴与100巴之间的氢气压力)下进行的。该催化剂可以含有来自周期系统第viii族和/或第vib族的金属。优选地,该预氢化催化剂是负载有pd、pt、ni、nimo或como的催化剂,载体是氧化铝和/或二氧化硅。对来自该hdo步骤的含有氢的气体流进行冷却并且然后从其中去除一氧化碳、二氧化碳、氮、磷以及硫化合物、气态轻烃以及其他杂质。在压缩之后,使纯化的氢或再循环的氢返回至该第一催化剂床和/或这些催化剂床之间以补偿退出的气流。去除冷凝的液体中的水。将该液体传送到该第一催化剂床或这些催化剂床之间。在该hdo步骤之后,使产物经受异构化步骤。对于该过程而言重要的是在烃与异构化催化剂接触之前尽可能完全地去除杂质。该异构化步骤包括一个任选的汽提步骤,其中可以通过用水蒸气或适合的气体(如轻烃、氮气或氢气)进行汽提而纯化来自该hdo步骤的反应产物。该任选的汽提步骤是以逆流方式在异构化催化剂上游的一个单元中进行的,其中气体与液体彼此接触,或者在利用逆流原理的分开的汽提单元中的实际异构化反应器之前进行。在该汽提步骤之后,将氢气以及在此处的氢化脂质组合物或脂质、以及任选地n-石蜡混合物传送到包括一个或多个催化剂床的反应性异构化单元。该异构化步骤的这些催化剂床可以按并流或逆流方式进行操作。对于该过程而言重要的是逆流原理在该异构化步骤中适用。在该异构化步骤中,这是通过以逆流方式进行该任选的汽提步骤或该异构化反应步骤或两者来完成的。在该异构化步骤中,压力在20-150巴范围内、优选是在20-100巴范围内变化,温度是在200℃与500℃之间、优选是在300℃与400℃之间变化。在该异构化步骤中,可以使用在本领域内已知的异构化催化剂。适合的异构化催化剂含有分子筛和/或来自第vii族的金属和/或载体。优选地,该异构化催化剂含有sapo-11或sapo41或zsm-22或zsm-23或镁碱沸石,以及pt、pd或ni和al2o3或sio2。典型的异构化催化剂为例如pt/sapo-11/al2o3、pt/zsm-22/al2o3、pt/zsm-23/al2o3及pt/sapo-11/sio2。该异构化步骤和该hdo步骤可以在同一个压力容器中或在分开的压力容器中进行。任选的预氢化可以在分开的压力容器中或在同一个压力容器中进行,如同hdo和异构化步骤一样。因此,在一个实施例中,一个或多个化学反应的产物是包含hrj-5的烷烃混合物。在另一个实施例中,一个或多个化学反应的产物是包含astmd1655喷气燃料的烷烃混合物。在一些实施例中,符合astm1655喷气燃料的规范的组合物具有低于10ppm的含硫量。在其他实施例中,符合astm1655喷气燃料的规范的组合物具有低于205℃的蒸馏曲线的t10值。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有低于300℃的终沸点(fbp)。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有至少38℃的闪点。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有介于775k/m3与840k/m3的密度。在又另一个实施例中,符合astm1655喷气燃料的规范的组合物具有低于-47℃的凝固点。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有至少42.8mj/k的燃烧热。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有至少13.4质量%的氢含量。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有热稳定性,如在260℃下通过定量重量分析jftot在低于3mmhg下所测试的。在另一个实施例中,符合astm1655喷气燃料的规范的组合物具有低于7mg/dl的实际胶质。因此,本发明披露了多种方法,其中进行微藻脂质的化学修饰以产生在多种工业和其他应用中有用的产物。用于修饰由本文中公开的方法产生的油的方法实例包括但不限于,油的水解、油的氢化加工和油的酯化。微藻脂质的其他化学改性包括而不限于,环氧化、氧化、水解、硫酸盐化、磺化、乙氧基化、丙氧基化、酰胺化及皂化。微藻油的改性产生基本油脂化学品,这些化学品可以针对所希望的功能进一步改性成所选择的衍生油脂化学品。按以上参考燃料制造方法所描述类似的方式,也可以对从在此描述的微生物培养物产生的油进行这些化学改性。基础油脂化学品的实例包括但不限于,肥皂、脂肪酸、脂肪酯、脂肪醇、脂肪氮化合物、脂肪酸甲酯、以及甘油。衍生油脂化学品的实例包括但不限于,脂肪腈、酯类、二聚酸、季铵化合物(包括甜菜碱)、表面活性剂、脂肪烷醇酰胺、脂肪醇硫酸酯、树脂、乳化剂、脂肪醇、烯烃、钻井泥浆、多元醇、聚氨基甲酸酯、聚丙烯酸酯、橡胶、蜡烛、化妆品、金属皂、肥皂、α-磺化甲酯、脂肪醇硫酸酯、脂肪醇乙氧基化物、脂肪醇醚硫酸盐、咪唑啉、表面活性剂、去污剂、酯类、季铵化合物(包括甜菜碱)、臭氧分解产物、脂肪胺、脂肪烷醇酰胺、乙氧基硫酸盐、单酸甘油酯、二酸甘油酯、三酸甘油酯(包括中链三酸甘油酯)、润滑剂、液压流体、油脂、介电流体、脱模剂、金属加工液、传热流体、其他功能性流体、工业化学品(例如,清洁剂、纺织加工助剂、增塑剂、稳定剂、添加剂)、表面涂层、涂料以及清漆、电气布线绝缘材料、以及更高级烷烃。其他衍生物包括脂肪酰胺基胺、酰胺基胺羧酸酯、酰胺基胺氧化物、酰胺基胺氧化物羧酸酯、酰胺基胺酯、乙醇胺酰胺、磺酸酯、酰胺基胺磺酸酯、二酰胺基胺二氧化物、磺化烷基酯烷氧基化物、甜菜碱、季铵化二酰胺基胺甜菜碱以及硫代甜菜碱。来自通过本发明的方法产生的甘油酯的脂肪酸组分的水解产生游离脂肪酸,这些脂肪酸可以被衍生化以产生其他有用的化学品。水解在水和催化剂(可以是酸或碱)的存在下发生。释放的游离脂肪酸可以被衍生化以产生多种产物,如以下所报道:美国专利号5,304,664(高硫酸化脂肪酸);7,262,158(清洁组合物);7,115,173(织物软化组合物);6,342,208(用于治疗皮肤的乳液);7,264,886(防水组合物);6,924,333(涂料添加剂);6,596,768(富含脂质的反刍动物原料);以及6,380,410(用于去垢剂和清洁剂的表面活性剂)。在一些方法中,化学修饰的第一步可以是加氢处理以使双键饱和,接着是在氢和催化剂存在下在升高的温度进行脱氧。在其他方法中,氢化和脱氧可以在同一反应中发生。在又其他方法中,脱氧在氢化之前发生。然后可以任选地进行异构化,同样在氢和催化剂的存在下进行。最后,如果希望的话,可以去除气体和石脑油。例如参见美国专利5,475,160(甘油三酯的氢化);5,091,116(脱氧、氢化和气体去除;6,391,815(氢化);以及5,888,947(异构化)。在本发明的一些实施例中,三酸甘油酯油被部分或完全脱氧。这些脱氧反应形成所希望的产物,包括但不限于,脂肪酸、脂肪醇、多元醇、酮以及醛。通常,不受任何特定的理论限制,这些脱氧反应涉及各种不同反应途径的组合,包括但不限于:氢解、氢化、连续的氢化-氢解、连续的氢解-氢化、以及组合的氢化-氢解反应,其导致氧从脂肪酸或脂肪酸酯中至少部分去除以产生可以通过进一步加工而容易地转化为所希望的化学品的反应产物,如脂肪醇。举例来说,在一个实施例中,可以通过fcc反应将脂肪醇转化为烯烃或通过缩合反应转化为高级烷烃。一种这样的化学修饰是羟化,其是将氢加成至甘油或游离脂肪酸的脂肪酸组分中的双键。氢化过程允许液体油转化成半固体或固体脂肪,它们更适合于特定应用。由在此描述的方法产生的油的氢化可以与在此提供的一种或多种方法和/或材料结合进行,如在以下文献中报道:美国专利号7,288,278(食品添加剂或药剂);5,346,724(润滑产品);5,475,160(脂肪醇);5,091,116(可食用油);6,808,737(用于人造黄油和涂抹酱中的结构化脂肪);5,298,637(卡路里减少的脂肪替代物);6,391,815(氢化催化剂和硫吸收剂);5,233,099和5,233,100(脂肪醇);4,584,139(氢化催化剂);6,057,375(泡沫抑制剂);以及7,118,773(可食用乳状涂抹酱)。本领域的技术人员将认识到可以使用各种方法将碳水化合物氢化。一种适合的方法包括使碳水化合物与氢或与混合有适合的气体或催化剂的氢在氢化反应器中在足以形成氢化产物的条件下接触。氢化催化剂一般可以包括cu、re、ni、fe、co、ru、pd、rh、pt、os、ir以及其合金或任何组合,它可以是单独的或与促进剂(如w、mo、au、ag、cr、zn、mn、sn、b、p、bi以及其合金或任何组合)结合。其他有效的氢化催化剂材料包括负载型镍或用铼改性的钌。在一个实施例中,取决于所希望的催化剂的功能性,该氢化催化剂还包括任何一种载体。可以通过本领域的普通技术人员已知的方法来制备这些氢化催化剂。在一些实施例中,氢化催化剂包括负载型第viii族金属催化剂和金属海绵材料(例如,海绵镍催化剂)。雷尼镍(raneynickel)提供了适合于在本发明中使用的活化的海绵镍催化剂的一个实例。在其他实施例中,本发明的氢化反应是使用一种包含镍-铼催化剂或钨改性的镍催化剂的催化剂进行的。用于本发明的氢化反应的适合催化剂的一个实例是碳负载型镍-铼催化剂。在一个实施例中,适合的拉尼镍催化剂可以通过以下来制备:用水性碱溶液(例如,含有大约25重量%的氢氧化钠)处理按重量计大致等量的镍和铝的合金。铝被水性碱溶液选择性地溶解,产生主要包含镍并带有少量铝的海绵状材料。最初的合金包括一定量的促进剂金属(即,钼或铬),该量使得大约1重量%至2重量%保留在所形成的海绵镍催化剂中。在另一个实施例中,使用亚硝酰硝酸钌(iii)、氯化钌(iii)于水中的溶液浸透适合载体材料来制备该氢化催化剂。然后将该溶液干燥以形成一种具有按重量计低于约1%的含水量的固体。然后可以将该固体在旋转球式炉中在大气压下,在氢气流中在300℃(非煅烧的)或400℃(煅烧的)下还原4小时。在冷却并用氮气使该催化剂具有惰性之后,使按体积计含5%氧的氮气在催化剂上越过,持续2小时。在某些实施例中,描述的催化剂包括一种催化剂载体。该催化剂载体稳定并负载该催化剂。所使用的催化剂载体的类型取决于所选择的催化剂和反应条件。用于本发明的适合载体包括但不限于,碳、二氧化硅、二氧化硅-氧化铝、氧化锆、二氧化钛、二氧化铈、氧化钒、氮化物、氮化硼、杂多酸、羟基磷灰石、氧化锌、氧化铬、沸石、碳纳米管、碳富勒烯以及其任何组合。可以使用本领域已知的那些常规方法来制备在本发明中使用的催化剂。适合的方法可以包括但不限于,初期润湿、蒸发浸透、化学气相沉积、洗涂(washcoating)、磁控溅射技术,等等。用于进行氢化反应的条件将根据起始材料的类型和所希望的产物而变化。得益于本披露,本领域的普通技术人员将认识到适当的反应条件。一般来说,氢化反应是在80℃至250℃并且优选在90℃至200℃,并且最优选在100℃至150℃的温度下进行的。在一些实施例中,氢化反应是在500kpa至14000kpa的压力下进行的。在本发明的氢解反应中使用的氢可以包括外部氢、再循环氢、原位产生的氢、以及其任何组合。如在此使用的,术语“外部氢”是指不是源自生物质反应本身而是从另一种来源加入到系统中的氢。在本发明的一些实施例中,令人希望的是将起始碳水化合物转化为一种较小的分子,该分子更容易转化为所希望的较高级烃。用于这种转化的一种适合方法是通过氢解反应。已知用于进行碳水化合物的氢解的不同方法。一种适合的方法包括使碳水化合物在氢解反应器中与氢或混有适合气体的氢和氢解催化剂在足以形成包含更小的分子或多元醇的反应产物的条件下接触。如在此使用的,术语“更小的分子或多元醇”包括具有更小分子量的任何分子,该分子可以包括比起始碳水化合物更少数目的碳原子或氧原子。在一个实施例中,这些反应产物包括包含多元醇和醇的较小的分子。本领域的普通技术人员将能够选择进行氢解反应的适当方法。在一些实施例中,可以使用一种氢解催化剂将5和/或6碳糖或糖醇转化为丙二醇、乙二醇、以及甘油。氢解催化剂可以包括cr、mo、w、re、mn、cu、cd、fe、co、ni、pt、pd、rh、ru、ir、os以及其合金或任何组合,它可以是单独的或与促进剂(如au、ag、cr、zn、mn、sn、bi、b、o以及其合金或任何组合)组合。氢解催化剂还可以包括一种含有过渡金属(例如,铬、钼、钨、铼、锰、铜、镉)或第viii族金属(例如,铁、钴、镍、铂、钯、铑、钌、铱以及锇)的含碳焦化聚合物催化剂。在某些实施例中,氢解催化剂可以包括与碱土金属氧化物结合或附着至催化活性载体上的任何以上金属。在某些实施例中,在氢解反应中的所描述的催化剂可以包括一种如以上描述的用于氢化反应的催化剂载体。用于进行氢解反应的条件将根据起始材料的类型和所希望的产物而变化。得益于本披露,本领域的普通技术人员将认识到用来进行该反应的适当条件。一般来说,氢解反应是在110℃至300℃,并且优选在170℃至220℃,并且最优选在200℃至225℃的温度下进行的。在一些实施例中,氢解反应是在碱性条件下,优选在8至13的ph,并且甚至更优选在10至12的ph下进行的。在一些实施例中,氢解反应是在60kpa与16500kpa之间的范围内,并且优选在1700kpa与14000kpa之间的范围内,并且甚至更优选在4800kpa与11000kpa之间的范围内的压力下进行的。在本发明的氢解反应中使用的氢可以包括外部氢、再循环氢、原位产生的氢、以及其任何组合。在一些实施例中,可以在缩合反应器中通过缩合反应将以上讨论的反应产物转化为高级烃。在这样的实施例中,这些反应产物的缩合在一种能够形成高级烃的催化剂的存在下发生。虽然不意图受理论限制,但是据信高级烃的产生是通过逐步加成反应而进行,包括碳-碳或碳-氧键的形成。所得到的反应产物包括了含有这些部分的许多化合物,如在以下更详细描述。在某些实施例中,适合的缩合催化剂包括酸催化剂、碱催化剂、或酸/碱催化剂。如在此所使用的,术语“酸/碱催化剂”是指具有酸和碱官能度两者的催化剂。在一些实施例中,缩合催化剂可以包括但不限于沸石、碳化物、氮化物、氧化锆、氧化铝、二氧化硅、铝硅酸盐、磷酸盐、氧化钛、氧化锌、氧化钒、氧化镧、氧化钇、氧化钪、氧化镁、氧化铈、氧化钡、氧化钙、氢氧化物、杂多酸、无机酸、酸改性树脂、碱改性树脂、以及其任何组合。在一些实施例中,缩合催化剂还可以包括一种改性剂。适合的改性剂包括la、y、sc、p、b、bi、li、na、k、rb、cs、mg、ca、sr、ba及其任何组合。在一些实施例中,缩合催化剂还可以包括一种金属。适合的金属包括cu、ag、au、pt、ni、fe、co、ru、zn、cd、ga、in、rh、pd、ir、re、mn、cr、mo、w、sn、os、合金以及其任何组合。在某些实施例中,在缩合反应中所描述的催化剂可以包括一种如在以上描述的用于氢化反应的催化剂载体。在某些实施例中,缩合催化剂是自负载的。如在此所使用的,术语“自负载”表示该催化剂不需要另一种材料作为载体。在其他实施例中,该缩合催化剂与一种适合于使该催化剂悬浮的分开的载体结合使用。在一个实施例中,该缩合催化剂载体是二氧化硅。缩合反应在其下发生的条件将根据起始材料的类型和所希望的产物而变化。得益于本披露,本领域的普通技术人员将认识到用来进行该反应的适当条件。在一些实施例中,该缩合反应是在对于所提出的反应的热力学是有利的温度下进行的。缩合反应的温度将取决于特定的起始多元醇或醇而变化。在一些实施例中,缩合反应的温度是在从80℃至500℃,并且优选从125℃至450℃,并且最优选从125℃至250℃的范围内。在一些实施例中,缩合反应是在0kpa与9000kpa之间的范围内并且优选在0kpa与7000kpa之间的范围内,并且甚至更优选在0kpa与5000kpa之间的范围内的压力下进行的。由本发明形成的高级链烷包括但不限于具有从4至30个碳原子的支链或直链链烷、具有从4至30个碳原子的支链或直链烯、具有从5至30个碳原子的环烷、具有从5至30个碳原子的环烯、芳基、稠和芳基、醇、以及酮。适合的链烷包括但不限于丁烷、戊烷、戊烯、2-甲基丁烷、己烷、己烯、2-甲基戊烷、3-甲基戊烷、2,2,-二甲基丁烷、2,3-二甲基丁烷、庚烷、庚烯、辛烷、辛烯、2,2,4-三甲基戊烷、2,3-二甲基己烷、2,3,4-三甲基戊烷、2,3-二甲基戊烷、壬烷、壬烯、癸烷、癸烯、十一烷、十一烯、十二烷、十二烯、十三烷、十三烯、十四烷、十四烯、十五烷、十五烯、壬基癸烷、壬基癸烯、二十烷、二十烯、二十一烷、二十一烯、二十二烷、二十二烯、二十三烷、二十三烯、二十四烷、二十四烯、以及其异构体。这些产物中的一些可以适合用作燃料。在一些实施例中,这些环烷和环烯是未经取代的。在其他实施例中,这些环烷和环烯是单取代的。仍然在其他实施例中,这些环烷和环烯是多取代的。在包含取代的环烷和环烯的实施例中,这些取代的基团包括但不限于具有1至12个碳原子的支链或直链烷基、具有1至12个碳原子的支链或直链亚烷基、苯基、以及其任何组合。适合的环烷和环烯包括但不限于环戊烷、环戊烯、环己烷、环己烯、甲基-环戊烷、甲基-环戊烯、乙基-环戊烷、乙基-环戊烯、乙基-环己烷、乙基-环己烯、其异构体以及任何组合。在一些实施例中,所形成的芳基是未取代的。在另一个实施例中,所形成的芳基是单取代的。在包含取代的芳基的实施例中,这些取代的基团包括但不限于,具有1至12个碳原子的支链或直链烷基、具有1至12个碳原子的支链或直链亚烷基、苯基以及其任何组合。用于本发明的适合芳基包括但不限于,苯、甲苯、二甲苯、乙苯、对二甲苯、间二甲苯以及其任何组合。在本发明中产生的醇具有从4至30个碳原子。在一些实施例中,这些醇是环状的。在其他实施例中,这些醇是支链的。在另一个实施例中,这些醇是直链的。用于本发明的适合醇包括但不限于,丁醇、戊醇、己醇、庚醇、辛醇、壬醇、癸醇、十一醇、十二醇、十三醇、十四醇、十五醇、十六醇、庚基癸醇、辛基癸醇、壬基癸醇、二十醇、二十一醇(uneicosanol)、二十二醇(doeicosanol)、二十三醇(trieicosanol)、二十四醇(tetraeicosanol)以及其异构体。在本发明中产生的酮具有从4至30个碳原子。在一个实施例中,这些酮是环状的。在另一个实施例中,这些酮是支链的。在另一个实施例中,这些酮是直链的。用于本发明的适合酮包括但不限于,丁酮、戊酮、己酮、庚酮、辛酮、壬酮、癸酮、十一烷酮、十二烷酮、十三烷酮、十四烷酮、十五烷酮、十六烷酮、庚基癸酮、辛基癸酮、壬基癸酮、二十烷酮、二十一烷酮(uneicosanone)、二十二烷酮(doeicosanone)、二十三烷酮(trieicosanone)、二十四烷酮(tetraeicosanone)以及其异构体。另一种这样的化学修饰是酯交换。天然产生的甘油脂不具有脂肪酸组分的均匀分布。在油的情况下,酯交换是指在不同甘油脂的两个酯之间的酰基的交换。该酯交换过程提供了一种机制,通过该机制可以将甘油脂混合物的脂肪酸组分重排以改变分布模式。酯交换是一种众所周知的化学过程,并且一般包括在一种催化剂的存在下(如碱金属或碱金属烷基化物(例如,甲醇钠))将油的混合物加热(至约200℃)一段时间(例如,30分钟)。这个过程可以用来使一种油混合物的脂肪酸组分的分布模式随机化,或者可以指向产生所希望的分布模式。可以对在此提供的材料(如具有至少20%细胞干重的脂质的微生物生物质)进行脂质的这种化学改性方法。可以通过将油混合物维持在低于可能出现的一些tag的熔点以下的温度来进行定向酯交换(其中寻求一种特定的脂肪酸分布模式)。这使得这些tag选择性结晶,从而在它们结晶时有效地将其从反应混合物中去除。举例来说,该过程可以继续直到油中的大多数脂肪酸已经沉淀。定向酯交换可以用来例如通过用较短链对应物取代较长链脂肪酸来生产一种具有较低卡路里含量的产物。定向酯交换还可以用来生产一种具有脂肪混合物的产物,该产物可以提供在食品添加剂或产品(例如,人造黄油)中寻求的所希望的熔化特性和结构特征,无需借助于氢化,氢化可能产生不需要的反式异构体。由在此描述的方法产生的油的酯交换可以与一种或多种方法和/或材料结合进行,或产生如在以下文献中报道的产品:美国专利号6,080,853(不可消化的脂肪替代物);4,288,378(花生酱稳定剂);5,391,383(可食用喷淋油);6,022,577(用于食物产品的可食用脂肪);5,434,278(用于食物产品的可食用脂肪);5,268,192(低卡路里坚果产品);5,258,197(减少卡路里的可食用组合物);4,335,156(可食用脂肪产品);7,288,278(食品添加剂或药剂);7,115,760(分馏过程);6,808,737(结构化脂肪);5,888,947(发动机润滑剂);5,686,131(可食用油混合物);以及4,603,188(可固化尿烷组合物)。在根据本发明的一个实施例中,如以上描述的油的转酯化之后是转酯化的产物与多元醇的反应(如在美国专利号6,465,642中报道)以产生多元醇脂肪酸聚酯。这一酯化和分离过程可以包括如下步骤:在皂存在下使低级烷基酯与多元醇反应;从产物混合物中去除残余皂;将产物混合物水洗并干燥以去除杂质;漂洗产物混合物以精炼;从产物混合物的多元醇脂肪酸多元酯中分离至少一部分未反应的低级烷基酯;以及使分离的未反应的低级烷基酯再循环。还可以对具有短链脂肪酸酯的微生物生物质进行转酯化,如在美国专利6,278,006中报道的。一般来说,可以通过在一种适合的催化剂存在下将一种短链脂肪酸酯添加至一种油中并且加热该混合物来进行转酯化。在一些实施例中,该油按重量计占该反应混合物的约5%至约90%。在一些实施例中,该短链脂肪酸酯按重量计占该反应混合物的约10%至约50%。催化剂的非限制性实例包括碱催化剂;甲醇钠;酸催化剂,包括无机酸(如硫酸)与酸化粘土,有机酸,如甲烷磺酸、苯磺酸以及甲苯磺酸,以及酸性树脂,如amberlyst15。金属(如钠与镁)以及金属氢化物也是有用的催化剂。另一种这样的化学修饰是羟化,其包括将水加成至双键,从而导致饱和以及羟基部分的掺入。该羟化过程提供了一种用于将甘油脂的一种或多种脂肪酸组分转化为羟基脂肪酸的机制。羟化可以例如经由在美国专利号5,576,027中报道的方法来进行。羟化脂肪酸(包括蓖麻油及其衍生物)适用作若干工业应用(包括食品添加剂、表面活性剂、颜料润湿剂、消泡剂、防水添加剂、增塑剂、化妆品乳化和/或除臭剂)以及电子设备、药物、涂料、油墨、胶粘剂以及润滑剂中的组分。可以如何进行甘油酯的羟基化的一个实例如下:可以将脂肪加热,优选至约30℃-50℃,与庚烷组合并且在该温度下维持三十分钟或更长时间;然后可以将乙酸添加到混合物,接着添加硫酸水溶液,然后添加过氧化氢水溶液,该过氧化氢在一个小时内以小增量添加到混合物中;在过氧化氢水溶液之后,然后可以将温度增加到至少约60℃并且搅拌至少六小时;在搅拌之后,使混合物沉淀并且可以去除由该反应形成的下水层,同时可以用具有约60℃的温度的热水洗涤由该反应形成的上庚烷层;然后可以将所洗涤的庚烷层用过氧化钾水溶液中和至约5至7的ph并且然后通过真空蒸馏去除;然后可以在真空下在100℃下干燥反应产物并且在真空条件下对干燥的产物进行蒸汽脱臭,并且在约50℃至60℃下使用硅藻土过滤。由在此描述的方法产生的微生物油的羟化可以与一种或多种方法和/或材料结合进行,或生产如在以下文献中报道的产品:美国专利号6,590,113(油基涂料和油墨);4,049,724(羟基化方法);6,113,971(橄榄油黄油);4,992,189(润滑剂和润滑油添加剂);5,576,027(羟基化乳);以及6,869,597(化妆品)。羟化甘油酯可以被转化为交内酯。交内酯由其中羟化脂肪酸组分已经被酯化为另一种脂肪酸分子的甘油酯组成。羟化甘油脂向交内酯的转化可以通过以下来进行:加温甘油脂与脂肪酸的混合物并且使该混合物与一种矿物酸接触,如由伊斯贝尔(isbell)等,jaocs71(2):169-174(1994)所描述的。交内酯在多种应用中是有用的,包括但不限于在以下文献中报道的那些:美国专利号7,196,124(弹性体材料和地板覆盖物);5,458,795(用于高温应用的稠化油);5,451,332(用于工业应用的流体);5,427,704(燃料添加剂);以及5,380,894(润滑剂、润滑脂、增塑剂以及印刷用油墨)。另一种这样的化学修饰链烯烃复分解。在烯烃复分解中,催化剂切断烯烃(alkene/olefin)中的亚烷基碳并且通过使它们中的每一个与不同的亚烷基碳进行配对而形成新的烯。烯烃复分解反应提供了用于如以下过程的机制:通过乙烯醇分解截断烯烃上的不饱和脂肪酸烷基链,通过自我复分解经由烯键交联脂肪酸,并且通过与衍生化烯烃的交叉复分解在脂肪酸上并入新的官能团。结合其他反应,如酯交换和氢化,烯烃复分解可以将不饱和甘油酯转化为不同的终产物。这些产物包括用于蜡的甘油脂寡聚物;用于润滑剂的短链甘油脂;用于化学剂和聚合物的同型-和异型-双官能烷基链;用于生物燃料的短链酯;以及用于喷气燃料的短链烃。烯烃复分解可以例如使用报道于以下各项中的催化剂和方法对三酰基甘油和脂肪酸衍生物进行:美国专利号7,119,216、美国专利公开号2010/0160506以及美国专利公开号2010/0145086。生物油的烯烃复分解一般包括在其他烯烃存在(交叉复分解)或不存在(自我复分解)下,在惰性条件下将ru催化剂溶液以约10至250ppm的装载量添加至不饱和脂肪酸酯中。典型地允许这些反应进行从数小时至数日并且最终产生烯烃产物的一种分布。可以如何对脂肪酸衍生物进行烯烃复分解的一个实例如下:将第一代格拉布(grubbs)催化剂(二氯[2(1-甲基乙氧基-α-o)苯基]亚甲基-α-c](三环己基-膦))在甲苯中的溶液以222ppm的催化剂装载量添加至含有经脱气并干燥的油酸甲酯的容器中。然后将该容器用约60psig的乙烯气体进行加压并且在约30℃或30℃以下维持3小时,由此可以产生约50%产率的9-癸烯酸甲酯。由在此描述的方法产生的油的烯烃复分解可以与一种或多种方法和/或材料结合进行,或生产如在以下文献中报道的产品:美国申请pct/us07/081427(α-烯烃脂肪酸)和美国专利申请号12/281,938(石油膏)、12/281,931(彩弹枪用胶囊)、12/653,742(增塑剂和润滑剂)、12/422,096(双官能有机化合物)以及11/795,052(蜡烛)。可以对微藻油进行的其他化学反应包括使甘油三酯与环丙烷化剂反应以增强流动性和/或氧化稳定性,如美国专利6,051,539所报道的;由甘油三酯制造蜡,如美国专利6,770,104所报道;以及甘油三酯的环氧化作用,如在“脂肪酸组合物对环氧化甘油三酯的丙烯酰化动力学的作用(theeffectoffattyacidcompositionontheacrylationkineticsofepoxidizedtriacylglycerols)”,美国石油化学家协会杂志(journaloftheamericanoilchemists'society),79:1,59-63,(2001)以及自由基生物学与医学(freeradicalbiologyandmedicine),37:1,104-114(2004)中所报道的。用于如以上描述的燃料和化学产品的含油微生物生物质的产生导致脱脂生物质粉的产生。脱脂粉是制备藻油的副产物并且作为农场动物(例如,反刍动物、家禽、猪以及水产养殖)的动物饲料是有用的。所得到的粉虽然具有降低的油含量,但仍然含有高品质的蛋白质、碳水化合物、纤维、灰分、残油以及其他适合用于动物饲料的营养素。由于这些细胞大部分被油分离过程溶解,该脱脂粉是容易地被这些动物可消化的。脱脂粉可以任选地在动物饲料中与其他成分结合,如谷粒。由于脱脂粉具有粉状一致性(powderyconsistency),故可以使用可商购的挤出机或膨胀器或另一种类型的机器将它压制成小丸。已经在以上详述的本发明在以下实例中进行了举例说明,提供这些实例旨在说明而不是限制要求保护的发明。实例实例1:通过脂肪酸甲酯检测进行脂肪酸分析从干燥生物质制备脂质样品。将20-40mg的干燥生物质再悬浮于2ml含5%h2so4的meoh中,并且添加含有适量的适合内部标准品(c19:0)的200μl甲苯。将该混合物进行短暂地声波处理以分散该生物质,然后在70℃-75℃下加热3.5小时。添加2ml的庚烷以提取脂肪酸甲酯,接着添加2ml的6%k2co3(水溶液)以中和酸。将该混合物剧烈搅拌,并且将一部分上层转移至含有na2so4(无水)的小瓶中用于使用标准famegc/fid(脂肪酸甲酯气相色谱火焰离子化检测)方法进行气相色谱分析。通过这种方法来确定下文报告的脂肪酸谱。实例2:针对脂肪酸和sn-2谱对微生物进行工程改造通过外源lpaat表达使月桂酸增加本实例描述了使用多种编码椰1-酰基-sn-甘油-3-磷酸酰基转移酶(cnlpaat)的重组多核苷酸对一种微生物进行工程改造,其中转化的微生物的脂肪酸谱和sn-2谱已经富含月桂酸。根据如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中描述的生物射弹转化法,最初用质粒构建体psz1283转化桑葚型无绿藻(utex1435)的经典地诱变品系,品系a。pct/us2011/038463、pct/us2011/038464及pct/us2012/023696(通过引用结合于此)中所描述的psz1283包含赖特萼距花(cupheawrightii)fatb2(cwte2)硫酯酶(seqidno:10)的编码序列;用于整合到核基因组中的6s基因组区的5’(seqidno:1)和3’(seqidno:2)同源重组靶向序列(侧接该构建体);以及在莱氏衣藻β-微管蛋白启动子/5’utr(seqidno:5)和普通小球藻硝酸还原酶3’utr(seqidno:6)控制下表达seqidno:3中给出的蛋白质序列的酿酒酵母suc2(s.cerevisiaesuc2)蔗糖转化酶编码区(seqidno:4)。这种酿酒酵母suc2表达盒作为seqidno:7列出并且用作一种可选择标记物。表达seqidno:11中给出的蛋白质序列的cwte2蛋白质编码序列是在桑葚型无绿藻amt03启动子/5'utr(seqidno:8)和普通小球藻(c.vulgaris)硝酸还原酶3'utr的控制下。对cwte2和suc2的蛋白质编码区进行密码子优化以反映桑葚型无绿藻utex1435核基因中固有的密码子偏倚,如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所描述。将psz1283转化至品系a中之后,在含有蔗糖作为唯一碳源的琼脂平板上选择阳性克隆。然后将初级转化子以克隆方式纯化并且选出单个转化子(品系b)用于进一步基因修饰。用质粒构建体psz2046转化这一遗传工程改造过的品系以中断品系b的ploop基因组基因座。构建体psz2046包含椰1-酰基-sn-甘油-3-磷酸酰基转移酶(cnlpaat)(seqidno:12)的编码序列;用于整合到核基因组中的ploop基因组区的5’(seqidno:13)和3’(seqidno:14)同源重组靶向序列(侧接该构建体);以及在莱氏衣藻β-微管蛋白启动子/5’utr(seqidno:5)和普通小球藻硝酸还原酶3’utr(seqidno:6)控制下的新霉素抗性蛋白质编码序列。这一neor表达盒作为seqidno:15列出并且用作一种可选择标记物。cnlpaat蛋白质编码序列是在桑葚型无绿藻amt03启动子/5’utr(seqidno:8)和普通小球藻(c.vulgaris)硝酸还原酶3'utr的控制下。对cnlpaat和neor的蛋白质编码区进行密码子优化以反映桑葚型无绿藻utex1435核基因中固有的密码子偏倚,如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所描述。cnlpaat的氨基酸序列提供为seqidno:16。在psz2046转化至品系b中,由此产生品系c之后,在包含g418(遗传霉素)的琼脂平板上选择阳性克隆。个别转化子以克隆方式纯化并使其在ph7.0下于适合产生脂质的条件下生长,如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所详述。由来自每个转化子的干燥的生物质制备脂质样品并且使用如实例1中所描述的标准脂肪酸甲酯气相色谱火焰离子化(famegc/fid)检测法分析这些样品中的脂肪酸谱。在作为唯一碳源的葡萄糖上生长的桑葚型无绿藻utex1435(u1)、未转化品系b和五种psz2046阳性转化子(品系c,1-5)呈现在表10中。表10.lpaat表达对包含中链偏好型硫酯酶的桑葚型无绿藻(utex1435)的脂肪酸谱的影响。如表10中所示,表达cwte2的品系b的脂肪酸谱显示相对于未转化的utex1435品系,c10:0、c12:0及c14:0脂肪酸的组成增加以及c16:0、c18:0及c18:1脂肪酸减少。另外的基因修饰对于转化品系的脂肪酸谱(即,品系b中cnlpaat的表达)的影响是c10:0和c12:0脂肪酸的组成仍进一步增加,c16:0、c18:0及c18:1脂肪酸仍进一步减少,但对c14:0脂肪酸组成无显著影响。这些数据指示,cnlpaat在微生物宿主有机体的情形中显示出底物偏好。未转化的桑葚型无绿藻品系a是以包含低于0.5%的c12脂肪酸和低于1%的c10-c12脂肪酸的脂肪酸谱为特征。相比之下,表达赖特萼距花硫酯酶的品系b的脂肪酸谱包含31%的c12:0脂肪酸,并且c10-c12脂肪酸占总脂肪酸超过36%。另外,表达高等植物硫酯酶和cnlpaat酶的品系c的脂肪酸谱包含介于45.67%与46.63%之间的c12:0脂肪酸,并且c10-c12%脂肪酸占总脂肪酸介于71%与73%之间。表达外源硫酯酶的结果是使得工程改造过的微生物中存在的c12脂肪酸的百分含量增加62倍。表达外源硫酯酶和外源lpaat的结果是使得工程改造过的微生物中存在的c12脂肪酸的百分含量增加92倍。对从品系a、b及c提取的油样品的tag部分的三酰甘油酯的sn-2谱进行分析。提取并加工tag,并且如实例1中那样进行分析。从品系a、b及c提取的油的tag部分的脂肪酸组成和sn-2谱(以占总脂肪酸的面积%表示)呈现于表11中。未报道的值以“n.r.”指示。表11.lpaat表达对由包含中链偏好型硫酯酶的转化的桑葚型无绿藻(utex1435)产生的tag的脂肪酸组成和sn-2谱的影响。如表11中所示,相对于从未转化的品系a分离的tag的脂肪酸谱,从表达cwte2的品系b分离的三酸甘油酯(tag)的脂肪酸组成中c10:0、c12:0及c14:0脂肪酸增加并且c16:0和c18:1脂肪酸减少。另外的基因修饰对转化品系的脂肪酸谱(即cnlpaat表达)的影响是c10:0和c12:0脂肪酸的组成仍进一步增加,c16:0、c18:0及c18:1脂肪酸仍进一步减少,但对c14:0脂肪酸组成无显著影响。这些数据指示,外源cnlpaat的表达改良了转化的微生物的中链脂肪酸谱。未转化的桑葚型无绿藻品系a以约0.6%的c14、约1.6%的c16:0、约0.3%的c18:0或约90%的c18:1以及约5.8%的c18:2的sn-2谱为特征。相比于品系a,表达赖特萼距花硫酯酶的品系b以更高的中链脂肪酸和更少的长链脂肪酸的sn-2谱为特征。c12脂肪酸占品系bsn-2谱的25%。另外的基因修饰对转化品系的sn-2谱(即cnlpaat的表达)的影响是c12脂肪酸仍进一步增加(从25%到52.8%),c18:1脂肪酸减少(从36.6%到17.5%)以及c10:0脂肪酸减少。(c14:0和c16:0脂肪酸的sn-2谱组成对于品系b和c是相对类似的。)这些数据证实了容许外源lpaat表达的多核苷酸改变工程改造的微生物的脂肪酸谱并且特别是在增加微生物细胞中c10:0和c12:0脂肪酸浓度方面的效用和有效性。这些数据另外证实了容许外源硫酯酶和外源lpaat表达的多核苷酸改变由微生物细胞产生的tag的sn-2谱,特别是增加sn-2谱的c12组成并减少sn-2谱的c18:1组成的效用和有效性。实例3:区域特异性谱的分析使用耦合到配备有apci源的岛津(shimadzu)lcms8030三重四极质谱仪上的岛津奈克塞拉(nexera)超高效液相色谱系统进行lc/mstag分布分析,该系统包括一个sil-30ac自动取样器、两个lc-30ad泵、一个dgu-20a5在线脱气器以及一个cto-20a柱恒温箱。使用在cid气体(氩气)压力被设定成230kpa的阳离子模式中在1428u/sec的扫描速度下的m/z350-1050的q3扫描采集数据。将apci、去溶剂化管以及加热块温度对应地设定成300℃、250℃以及200℃,喷雾和干燥气体的流速对应地是3.0l/min和5.0l/min,并且接口电压是4500v。使油样品溶解在二氯甲烷-甲醇(1:1)中至5mg/ml的浓度,并且将0.8μl样品注射到维持在30℃下的岛津西姆-帕克(shim-pack)xr-odsiii(2.2μm,2.0×200mm)上。在0.48ml/min下的、历经27分钟的、从30%二氯甲烷-2-丙醇(1:1)/乙腈到51%二氯甲烷-2-丙醇(1:1)/乙腈的线性梯度用于色谱分离。实例4:通过延长酶或β-酮脂酰辅酶a合酶过量表达对微生物进行工程改造以增加芥酸的产生在本发明的一个实施例中,对可操作以在任选地质体产油微生物中表达外源延长酶或β-酮脂酰辅酶a合酶的重组多核苷酸转化载体进行构建并采用该载体,根据如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所描述的生物射弹转化法转化桑葚型无绿藻(utex1435)以获得芥酸产生增加的细胞。该转化载体包括一种过量表达延长酶或β-酮脂酰辅酶a合酶的蛋白质编码区(如表8中所列的那些);用以调控该外源基因表达的启动子和3’utr控制序列;靶向用于整合到桑葚型无绿藻(utex1435)核基因组中的重组多核苷酸的5’和3’同源重组靶向序列;以及可操作以表达一种可选择标记物的核苷酸。对转化载体的蛋白质编码序列进行密码子优化以在桑葚型无绿藻(utex1435)中表达,如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所描述。在此并且在pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中披露了编码可操作以在桑葚型无绿藻(utex1435)中表达的启动子、3’utr及可选择标记物的重组多核苷酸。在将转化载体转化至桑葚型无绿藻(utex1435)或桑葚型无绿藻(utex1435)的经典诱变品系中之后,在琼脂平板上选择阳性克隆。对个别转化子以克隆方式进行纯化并在适合脂质产生的异养条件下培养,如pct/us2009/066141、pct/us2009/066142、pct/us2011/038463、pct/us2011/038464及pct/us2012/023696中所详述。由来自每个转化子的干燥生物质制备脂质样品并使用如实例1中所描述的脂肪酸甲酯气相色谱火焰离子化(famegc/fid)检测法分析这些样品中的脂肪酸谱。作为这些操作的结果,该细胞可以展现出芥酸增加至少5、10、15或20倍。转基因cupsr23lpaat2品系(d1520a-e)显示出c10:0、c12:0及c14:0脂肪酸积累的显著增加以及c18:1和c18:2的伴随减少。转基因cupsr23lpaat3品系(d1521a-e)显示出c10:0、c12:0及c14:0脂肪酸积累的显著增加以及c18:1的伴随减少。这些转基因株中cupsr23lpaat的表达看来直接地负责总体上中链脂肪酸并且尤其是月桂酸酯积累的增加。尽管这些转基因株显示出从更长链的脂肪酸(c16:0及以上)向中链脂肪酸的转变,但该转变主要地针对c10:0和c12:0脂肪酸并且对c14:0脂肪酸具有微小影响。所呈现的数据显示,来自正萼距花psr23lpaat2和lpaat3基因与来自赖特萼距花的fatb2的共表达(在品系b中表达)对于c12:0脂肪酸的积累具有加和效应。结果表明,来自正萼距花psr23的lpaat酶在衍生自utex1435的藻类品系中具有活性。这些结果还证实,该酶结合在品系b中表达的异源fatb2酰基-acp硫酯酶(来自赖特萼距花)起作用。转基因cupsr23lpaatxs品系(d1542a-e)显示出c10:0、c12:0及c14:0脂肪酸的积累相对于亲本品系b显著减少以及c16:0、c18:0、c18:1及c18:2的伴随增加。这些转基因株中cupsr23lpaatx基因的表达看来直接地负责中链脂肪酸(c10-c14)的积累减少以及c16:0和c18脂肪酸积累的增加,其中观察到的棕榈酸酯(c16:0)增加最明显。所呈现的数据还显示,尽管有来自赖特萼距花的中链特异性fatb2表达(存在于品系b中),但cupsr23lpaatx的表达看来有利于更长链的脂肪酸并入tag中。结果表明,来自正萼距花psr23的lpaatx酶在衍生自utex1435的藻类品系中具有活性。与使中链脂肪酸水平增加的正萼距花psr23lpaat2和lpaat3相反,cupsr23lpaatx导致c16:0和c18:0水平增加。这些结果证实,衍生自cupsr23的不同lpaat(lpaat2、lpaat3及lpaatx)在品系b中展现不同的脂肪酸特异性(如通过它们对总体脂肪酸水平的影响所判断)。实例5:二十碳烯酸和芥酸脂肪酸的制造在此实例中,证实异源脂肪酸延长酶(fae)(也称为3-酮脂酰辅酶a合酶(kcs))、来自海甘蓝(crambleabyssinica)(cafae,登录号:ay793549)、银扇草(lunariaannua)(lafae,acj61777)和希腊碎米荠(cardaminegraeca)(cgfae,acj61778)的基因的表达导致在utex1435品系z的经典诱变的衍生物中产生长链单不饱和脂肪酸诸如二十碳烯酸(20:1δ11)和和芥酸(22:1δ13)。在另一方面,来自旱金莲的一个推定的fae基因(tmfae,abd77097)和来自油菜的两个fae基因(bnfae1,aaa96054和bnfae2,aat65206)在导致二十碳烯酸(20:1δ11)适度增加时在品系z中未产生可检测的芥酸。有趣的是,通过在品系z中bnfae1的异源表达所获得的不饱和脂肪酸谱引起二十二碳二烯酸(c22:2n6)的明显增加。对所有这些基因进行密码子优化以反映utex1435密码子用法。这些结果表明,cafae、lafae或cgfae基因编码了利用单不饱和和饱和酰基底物生物合成极长链所涉及的缩合酶,并且该酶对于改良二十碳烯酸和芥酸含量具有特定能力。用于在桑葚型无绿藻(utex1435品系z)中表达海甘蓝脂肪酸延长酶(cafae)的构建体-[psz3070]:在此实例中,生成用构建体psz3070转化的品系品系z,该品系表达蔗糖转化酶(允许其在含有蔗糖的培养基中选择和表达)海甘蓝fae基因。被引入以在品系z中表达的构建体psz3070可以写为6s::crtub2-scsuc2-cvnr:pmamt03-cafae-cvnr::6s。转化用dna(transformingdna)的序列提供如下。该构建体中的相关限制性位点以小写字母粗体指示,并且从5’至3’端分别为bspqi、kpni、xbai、mfei、bamhi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自品系z的允许经由同源重组在6s基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,通过小写字母、加框文本指示驱动酿酒酵母suc2基因(编码蔗糖水解活性,由此允许该品系在蔗糖上生长)表达的莱氏衣藻β-微管蛋白启动子。suc2的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的内源amt3启动子。cafae的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由小写字母粗体文本指示的品系z6s基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz3070中所含转化用dna的核苷酸序列:用于在品系z中表达来自高等植物的fae基因的构建体:除cafae基因(psz3070)外,已经对来自银扇草的lafae(psz3071)、来自希腊碎米荠的cgfae(psz3072)、来自旱金莲的tmfae(psz3067)以及来自油菜的bnfae1(psz3068)和bnfae2(psz3069)基因进行构建以在品系z中表达。这些构建体可以描述为:psz3071-6s::crtub2-scsuc2-cvnr:pmamt03-lafae-cvnr::6spsz3072-6s::crtub2-scsuc2-cvnr:pmamt03-cgfae-cvnr::6spsz3067-6s::crtub2-scsuc2-cvnr:pmamt03-tmfae-cvnr::6spsz3068-6s::crtub2-scsuc2-cvnr:pmamt03-bnfae1-cvnr::6spsz3069-6s::crtub2-scsuc2-cvnr:pmamt03-bnfae2-cvnr::6s所有这些构建体具有与psz3070相同的载体主链、可选择标记物、启动子以及3’utr,差别仅在于对应的fae基因。这些构建体中的相关限制性位点也与psz3070中相同。lafae、cgfae、tmfae、bnfae1及bnfae2的序列显示于下。以粗体文本显示的包括spei和aflii在内的相关限制性位点以5’-3’对应地显示。psz3071中所含lafae的核苷酸序列:psz3072中所含cgfae的核苷酸序列:psz3067中所含tmfae的核苷酸序列:psz3068中所含bnfae1的核苷酸序列:psz3069中所含bnfae2的核苷酸序列:为了确定它们对脂肪酸谱的影响,将受pmamt3启动子驱动的含有不同异源fae基因的以上构建体独立地转化至品系z中。对初级转化子以克隆方式纯化并使其在ph7.0下于低氮脂质产生条件下生长(所有质粒都需要在ph7.0下生长以当通过ph调控的pmamt03启动子驱动时允许最大fae基因表达)。由通过将psz3070、psz3071、psz3072、psz3067、psz3068以及psz3069转化至品系z中产生的一组代表性克隆得到的谱对应地显示于下表12-17中。表达异源fae基因的所有转基因品系z都显示c20:1和c22:1脂肪酸积累增加(参见表12-17)。二十碳烯酸(20:1δ11)和芥酸(22:1δ13)水平相对于野生型的增加始终地高于野生型水平。另外地,通过在品系z中bnfae1的异源表达所获得的不饱和脂肪酸谱引起二十二碳二烯酸(c22:2n6)的明显增加。在品系z中表达的以上提到的fae的蛋白质比对示于图中。表12.用psz3070(cafae)dna转化的品系z和代表性衍生物转基因株的不饱和脂肪酸谱。表13.用psz3071(lafae)dna转化的品系z和代表性衍生物转基因株的不饱和脂肪酸谱。表14.用psz3072(cgfae)dna转化的品系z和代表性衍生物转基因株的不饱和脂肪酸谱。表15.用psz3070(tmfae)dna转化的品系ar和代表性衍生物转基因株的不饱和脂肪酸谱。对于这些转基因株未报道可检测的芥酸(22:1)峰。表16.用psz3068(bnfae1)dna转化的品系z和代表性衍生物转基因株的不饱和脂肪酸谱。对于这些转基因株未报道可检测的芥酸(22:1)峰。表17.用psz3069(bnfae2)dna转化的品系z和代表性衍生物转基因株的不饱和脂肪酸谱。对于这些转基因株未报道可检测的芥酸(22:1)峰。实例6:通过量表达萼距花属psr23lpaat2和lpaat3基因,在utex1435中的tag区域特异性我们证实了在utex1435衍生物品系s2014中表达2个来自萼距花属psr23(cupsr23)的不同1-酰基-sn-甘油-3-磷酸酰基转移酶(lpaat)(lpaat2和lpaat3)基因导致c10:0、c12:0和c14:0脂肪酸水平升高。在这一实例中,我们提供了以下证据:萼距花属psr23lpaat2对将c10:0脂肪酸掺入tag中的sn-2位置展示出高特异性。萼距花属psr23lpaat3将c18:2脂肪酸特异性低掺入tag中的sn-2位置处。先前描述了桑葚型无绿藻(utex1435)转基因株b、分别表达cupsr23lpaat2和lpaat3基因的转化载体psz2299和psz2300及其序列的组成和特性。为了确定萼距花属psr23lpaat基因对所得脂肪酸谱的影响,我们已经利用以相对较高的水平合成中链和长链脂肪酸两者的品系b。如表18所示,在品系b中表达lpaat2基因(d1520)导致c10-c12:0水平增加(在最佳品系d1520.3-7中高达12%),表明这种lpaat对中链脂肪酸具特异性。作为替代方案,lpaat3基因的表达产生的增加相对适度(在最佳品系d1521.28-7中高达5%),表明它对中链水平具有很少或没有影响。表18.品系b和用psz2299(d1520)和psz2300(d1521)dna转化的代表性转基因株的脂肪酸谱。为了确定萼距花属psr23lpaat基因的表达是否影响脂肪酸在sn-2位置处的区域特异性,我们利用猪胰脂肪酶方法分析了来自代表性d1520和d1521品系的tag。如表19所证实,萼距花属psr23lpaat2基因对c10:0脂肪酸显示出显著的特异性并且显现将多50%的c10:0脂肪酸掺入sn-2位置处。萼距花属psr23lpaat3基因显现仅对c18:2脂肪酸起作用,导致c18:2脂肪酸重新分布到sn-2位置上。因此,通过引入具有相应特异性的外源lpaat基因可获得具有含超过15%或20%的c10:0或c18:2脂肪酸的sn-2谱的微生物三酸甘油酯油。表19.亲本s2014品系和表达萼距花属psr23lpaat2(bj)和lpaat3(bk)基因的子代品系的油的tag和sn-2脂肪酸谱。实例7:一套用于同步于脂质产生来条件性控制产油细胞中的基因表达水平的可调控启动子通过敲除桑葚型无绿藻中fata1(pmfata1)的两个拷贝同时在δfad2株s2532中过量表达内源pmkasii基因而产生s5204。s2532本身是先前通过将红花acp硫酯酶(登录号:aaa33019.1)在crtub2启动子的控制下插入s1331的fad2基因座处而产生的fad2(还称为fadc)双敲除品系。s5204及其亲本s2532具有被破坏的内源pmfad2-1基因,导致没有δ12特异性去饱和酶活性,如在种子和脂质产生两个阶段中c18:2(亚油酸)水平均为0%所表现。在s5204(及其亲本s2532)中缺乏任何c18:2导致生长缺陷,这可以通过在种子阶段中外源性添加亚油酸而得到部分缓解。然而,对于零亚油酸油的工业应用而言,外源性添加亚油酸需要额外成本。我们先前已显示,为s5204(和其他δfad2品系s2530和s2532)补充用ph诱导型amt03p驱动的pmfad2-1在ph7.0下将c18:2恢复到野生型水平并且还在没有任何亚油酸补充的情况下在种子阶段过程中产生被挽救的生长特征。另外地,当随后将来自ph7.0生长补偿株的种子转移到ph调节至5.0(以控制amt03p驱动的fad2蛋白水平)的低氮脂质产生烧瓶中时,所得的最终油谱与亲本s5204或s2532谱匹配,具有零亚油酸水平,但是具有被挽救的生长和生产力度量。因此,本质上用amt03p驱动的fad2-1的情况下,我们已经开发了取决于所希望的应用潜在地可以用来产生具有不同亚油酸水平的油的ph可调控品系。桑葚型无绿藻在培养基中的氮耗尽并且细胞转向储存脂质之前的前24-30hr过程中在发酵罐中经历快速细胞分裂。发酵罐中的最初细胞分裂和生长对于总体品系生产力而言是关键的,并且如上文所报道,fad2蛋白对于维持特定品系的旺盛生长特征而言是关键的。然而,当在ph5.0下在7l发酵罐中运行第一代、单插入、遗传干净的pmfad2-1补偿品系(s4694和s4695)(其中种子在ph7.0下生长)时,就生产力而言,它们没有表现出与原始亲本基础品系(s1331)同等的水平。western数据表明,不考虑发酵罐ph(5.0或7.0),驱动pmfad2-1的amt03p启动子(如通过fad2蛋白水平所测量)在发酵罐中的0-30hr之间被严重下调。对发酵条件(在产生阶段过程中分批与未分批/受限的初始n,在不同时间点ph从7变到5)的研究表明,在早期脂质产生过程中氮的初始批处理量(和过量)可能是发酵罐中amt03p启动子下调的原因。实际上,可以在发酵过程中在转录时程中直接看到amt03的初始抑制。早在与发酵罐中的nh4水平直接对应的运行中观察到amt03表达的显著下降。当以受限n进行发酵时,我们能够部分地挽救amt03p启动子活性并且虽然s4694/s4695的每个细胞生产力与亲本s1331具有同等水平,总生产力仍落后。这些结果表明,在早期发酵阶段中次优或无活性的amt03p启动子并且由此限制fad2蛋白抑制了任何补偿品系达到其完全生长潜力和总体生产力。此处,我们鉴别了新的改进的在高氮生长和低氮脂质产生阶段过程中允许差异性基因活性的启动子。具体而言,我们观察到:·在使用基于转录组的生物信息学方法鉴别的下调启动子元件的控制下从桑葚型无绿藻(pmfad2-1)中反式表达脂肪酸去饱和酶-2基因,在δfad2,δfata1品系s5204中导致恢复生长的pmfad2-1的功能互补。·表现在稳健生长表型中的s5204的补偿仅在当新启动子元件积极地驱动pmfad2-1表达的种子和早期发酵阶段中发生。·一旦细胞进入活性脂质产生阶段(在发酵罐中的n耗尽的时候左右),新鉴别的启动子被下调,导致没有另外的fad2蛋白,并且补偿株的最终油谱与亲本s5204相同,但是具有更好的生长特性。·这些品系应该潜在地缓解在较早的补偿品系中遇到的amt03p驱动的fad2的问题。·重要的是,我们已经鉴别出具有不同强度的可下调启动子,其中的一些在运行的剩余部分过程中在以低至中等水平提供的情况下在开始是相对较强的。因此,取决于表型,可以选择这些启动子用于微调转基因的所希望的水平。生物信息学方法:从在典型发酵罐运行过程中取自8个时间点的细胞制备rna。对rna进行polya选择用于在亿明达(illumina)hiseq上运行。收集亿明达配对末端数据(100bp读数x2,约600bp片段大小)并且使用fastqc[www.bioinformatics.babraham.ac.uk/projects/fastqc/]针对读数质量对其进行处理。在对读数执行重复数据消除、质量修整且长度修整的定制读数处理管线中运行读数。转录物由亿明达配对末端读数使用oases/velvet组装[velvet:使用debruijn图进行的从头短读数组装算法d.r.杰比诺(zerbino)和e.伯尼(birney).基因组研究(genomeresearch)18:821-829]并且经由n50和其他度量进行评定。使用cd-hit进一步压缩来自所有8个时间点的转录物。[付黎敏(liminfu)、牛北方(beifangniu)、朱正伟(zhengweizhu)、吴思涛(sitaowu)和李伟忠(weizhongli),cd-hit:加速用于聚集下一代测序数据(acceleratedforclusteringthenextgenerationsequencingdata).生物信息学(bioinformatics),(2012),28(23):3150-3152.doi:10.1093/bioinformatics/bts565;cd-hit:“用于聚集和比较大集合的蛋白质或核苷酸序列的快速程序(afastprogramforclusteringandcomparinglargesetsofproteinornucleotidesequences)”,李伟忠和亚当葛迪科(adamgodzik)生物信息学,(2006)22:1658-9]。这些转录物被用作表达水平分析的基础(参考组件)。使用在每百万的转录物(transcriptspermillion)(tpm)中提供原始读数计数以及归一化值的rsem分析来自8个时间点的读数。[李波(li,bo)和杜威科林(dewey,colin)n.(2011).rsem:在使用或未使用参考基因组的情况下来自rna-seq数据的准确转录定量,生物医学中心:开放获取出版社(biomedcentral:theopenaccesspublisher).在2012年10月10日检索自网站temoa:开放教育资源(oer)入口www.temoa.info/node/441614]。使用tpm确定表达水平。还使用先前在筛选强启动子中鉴别的基因判定哪些水平应被视为显著高或低。将此数据加载到postgres数据库中并且用spotfire可视化,连同包括基因功能和其他特征(如基于表达谱的分类)的集成数据。这使得能够快速且定向地分析具有显著表达变化的基因。在s376(我们的参考物桑葚型无绿藻品系)的高质量参考基因组上标绘我们选择的基因的启动子。简言之,将pacbio长读数(约2kb)通过高质量pacbioccs读数(约600bp)进行误差修正并且使用allora汇编器在smrtpipe[pacbiodevnet.com]中组装。使用参考基因组连同转录组读数作图注释感兴趣区域内的精确基因结构、启动子和utr位置以及启动子元件,其然后指导进一步测序和启动子元件选择。用于鉴别启动子元件的标准是:1.在种子和早期脂质产生阶段(t0-t30hr)中下游基因的合理表达(例如,每百万转录物[tpm]>500、<100或<50)2.当发酵罐中的氮耗尽时,以上基因显著下调(例如,>5倍、10-倍或15-倍)。3.ph中性的启动子元件(例如,在培养条件下,在从ph5.0到ph7.0时,tpm变化低于2倍),或在ph5条件下操作至少是有效的。使用上述标准,我们鉴别出若干潜在下调的启动子元件,其最终被用于驱动s5204中的pmfad2-1表达。选择了一系列启动子,包括一些开始作为弱启动子并且降至极低水平的启动子,以及那些开始相当高并且仅下降至适度低水平的启动子。这样选择是因为经推理不清楚早期需要多少fad2表达来支持稳健生长,以及在脂质产生阶段过程中需要多少fad2以便实现零亚油酸表型。被选择用于进行筛选的启动子元件及其等位基因形式以其下游基因命名并且如下:1.氨基甲酰磷酸合酶(pmcps1p和pmcps2p)2.dipthine合酶(pmdps1p和pmdps2p)3.无机焦磷酸酶(pmipp1p)4.腺苷高半胱氨酸酶(pmahc1p和pmahc2p)5.肽基脯氨酰基顺反异构酶(pmppi1p和pmppi2p)6.gmp合成酶(pmgmps1p和pmgmps2p)7.谷氨酸合酶(pmgsp)8.柠檬酸合酶(pmcs1p和pmcs2p)9.γ-谷氨酰水解酶(pmggh1p)10.乙酰羟酸异构酶(pmahi1p和pmahi2p)11.半胱氨酸内肽酶(pmcep1p)12.脂肪酸去饱和酶2(pmfad2-1p和pmfad2-2p)[对照]两个代表性基因(即pmipp(无机焦磷酸酶)和pmahc(腺苷高半胱氨酸酶))的转录物谱开始非常强(4000-5000tpm),但是一旦细胞进入活性脂质产生,其水平非常快地下降。虽然pmipp的转录物水平下降到接近0tpm,pmahc的水平降至250tpm左右并且然后在发酵的其余部分保持稳定。所有其他启动子(基于其下游基因转录物水平)显示出类似的向下表达谱。将这些元件进行pcr扩增并且无论在什么情况下都鉴别来自等位基因的可能启动子、进行克隆并且相应地命名,例如,氨基甲酰磷酸合酶的2个基因的启动子元件被命名为pmcps1p和pmcps2p。作为比较物,还扩增了来自pmfad2-1和pmfad2-2的启动子元件并且将其用于驱动pmfad2-1基因。虽然在本实例中,我们使用fad2-1表达并且因此使用c18:2水平来探询新鉴别的下调启动子,原则上这些启动子元件都可以被用来下调任何感兴趣的基因。用于在pmcps1p表达下在δfad2品系s5204中表达桑葚型无绿藻脂肪酸去饱和酶2(pmfad2-1)的构建体-[psz3377]:用构建体psz3377转化δfad2δfata1s5204品系。转化用dna的序列提供如下。构建体psz3377(6s::pmhxt1p-scmel1-cvnr::pmcps1p-pmfad2-1-cvnr::6s)中的相关限制性位点以小写字母、加下划线和粗体指示,并且从5’至3’端分别为bspq1、kpni、spei、snabi、ecorv、spei、afiii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自utex1435的允许经由同源重组在6s基因座处靶向整合转化用dna的基因组dna。沿5’到3’方向继续向前,来自utex1435的驱动酿酒酵母蜜二糖酶(scmel1)基因表达的己糖转运体(hxt1)基因启动子以加框文本指示。scmel1的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的utex1435cps1p启动子。pmfad2-1的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的utex14356s基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz3377中所含转化用dna的核苷酸序列:在构建体psz3377中在普通小球藻硝酸盐还原酶3'utr之间的重组在转基因株中产生了pmfad2-1的多个拷贝,其然后在发酵结束时最可能表现出更高的c18:2水平。由于目标是为了产生具有0%终端c18:2的品系,我们采取了预防措施以避免这种重组。在以上质粒的另一个形式中,scmel1基因后接原始小球藻(utex250)延长因子1a(cpef1a)3’utr而非普通小球藻3’utr。以下示出了在构建体psz3384和其他具有这一3’utr(下文描述)的构建体中使用的原始小球藻(utex250)延长因子1a(cpef1a)3’utr的序列。质粒psz3384以写为6s::pmhxt1p-scmel1-cpef1a::pmcps1p-pmfad2-1-cvnr::6s。psz3384中的原始小球藻(utex250)延长因子1a(cpef1a)3’utr的核苷酸序列:原始小球藻(utex250)延长因子1a3’utr序列的侧翼是以小写字母粗体下划线文本示出的5’端的限制性位点snabi和3’端的ecorv。要注意的是,在scmel1终止密码子之后含有cpef1a3’utr的质粒(psz3384和下文描述的其他质粒)在5’snabi位点之前包含10个额外的核苷酸。这些核苷酸在于s.scmel1终止密码子之后包含普通小球藻硝酸还原酶3’utr的质粒中是不存在的。除表达上述重组型cvnr-启动子-pmfad2-1-cvnr或非重组型cpef1a-启动子-pmfad2-1-cvnr表达单元的质粒psz3377和psz3384之外,还构建了用于在s5204中表达的使用上文提到的其他启动子元件的质粒。这些构建体连同其转化身份(d#)可以被描述为:以上构建体与psz3377或psz3384是相同的,除了驱动pmfad2-1的启动子元件之外。下文示出了以上构建体中使用的不同启动子元件的序列。质粒psz3378和psz3385中所含氨基甲酰磷酸合酶等位基因2启动子的核苷酸序列(pmcps2p启动子序列):质粒psz3379和psz3386中所含dipthine合酶等位基因1启动子的核苷酸序列(pmdps1p启动子序列):质粒psz3380和psz3387中所含dipthine合酶等位基因2启动子的核苷酸序列(pmdps2p启动子序列):质粒psz3480和psz3481中所含无机焦磷酸酶等位基因1启动子的核苷酸序列(pmipp1p启动子序列):质粒psz3509和psz3516中所含腺苷高半胱氨酸酶等位基因1启动子的核苷酸序列(pmahc1p启动子序列):质粒psz3510中所含腺苷高半胱氨酸酶等位基因2启动子的核苷酸序列(pmahc2p启动子序列):质粒psz3513和psz3689中所含肽基脯氨酰基顺反异构酶等位基因1启动子的核苷酸序列(pmppi1p启动子序列):质粒psz3514和psz3518中所含肽基脯氨酰基顺反异构酶等位基因2启动子的核苷酸序列(pmppi2p启动子序列):质粒psz3515和psz3519中所含gmp合成酶等位基因1启动子的核苷酸序列(pmgmps1p启动子序列):质粒psz3520中所含gmp合成酶等位基因2启动子的核苷酸序列(pmgmps2p启动子序列):质粒psz3684和psz3686中所含柠檬酸合酶等位基因1启动子的核苷酸序列(pmcs1p启动子序列):质粒psz3685中所含柠檬酸合酶等位基因2启动子的核苷酸序列(pmcs2p启动子序列):质粒psz3688中所含γ-谷氨酰水解酶等位基因1启动子的核苷酸序列(pmggh1p启动子序列):质粒psz3517中所含乙酰羟酸异构酶等位基因1启动子的核苷酸序列(pmahi1p启动子序列):质粒psz3511中所含乙酰羟酸异构酶等位基因2启动子的核苷酸序列(pmahi2p启动子序列):质粒psz3512中所含半胱氨酸内肽酶等位基因1启动子的核苷酸序列(pmcep1启动子序列):质粒psz3375和3382中所含脂肪酸去饱和酶2等位基因1启动子的核苷酸序列(pmfad2-1启动子序列):质粒psz3376和3383中所含脂肪酸去饱和酶2等位基因2启动子的核苷酸序列(pmfad2-2启动子序列):为了确定其对生长和脂肪酸谱的影响,将上述构建体独立地转化到δfad2δfata1品系s5204中。将初级转化子以克隆方式纯化并使其在ph5.0下或在ph7.0下于标准脂质产生条件下生长。由通过转化产生的一组代表性克隆得到的谱显示于表20-50中。表20.用包含驱动pmfad2-1的pmfad2-1p的psz3375dna转化的一些代表性补偿(d2087)和亲本s5204株的脂肪酸谱。表21.用包含驱动pmfad2-1的pmfad2-1p的psz3382dna转化的一些代表性补偿(d)和亲本s5204株的脂肪酸谱。表22.用包含驱动pmfad2-1的pmfad2-2p的psz3376dna转化的一些代表性补偿(d2088)和亲本s5204株的脂肪酸谱。表23.用包含驱动pmfad2-1的pmfad2-2p的psz3383dna转化的一些代表性补偿(d)和亲本s5204株的脂肪酸谱。表24.用包含驱动pmfad2-1的pmcps1p的psz3377dna转化的代表性补偿(d2089)和亲本s5204株的脂肪酸谱。表25.用包含驱动pmfad2-1的pmcps1p的psz3384dna转化的一些代表性补偿(d2096)和亲本s5204株的脂肪酸谱。表26.用包含驱动pmfad2-1的pmcps2p的psz3378dna转化的一些代表性补偿(d2090)和亲本s5204株的脂肪酸谱。表27.用包含驱动pmfad2-1的pmcps2p的psz3385dna转化的一些代表性补偿(d2097)和亲本s5204株的脂肪酸谱。表28.用包含驱动pmfad2-1的pmdps1p的psz3379dna转化的一些代表性补偿(d2091)和亲本s5204株的脂肪酸谱。表29.用包含驱动pmfad2-1的pmdps1p的psz3386dna转化的一些代表性补偿(d2098)和亲本s5204株的脂肪酸谱。表30.用包含驱动pmfad2-1的pmdps2p的psz3380dna转化的一些代表性补偿(d2092)和亲本s5204株的脂肪酸谱。表31.用包含驱动pmfad2-1的pmdps2p的psz3387dna转化的一些代表性补偿(d2099)和亲本s5204株的脂肪酸谱。表32.用包含驱动pmfad2-1的pmipp1p的psz3480dna转化的一些代表性补偿(d2259)和亲本s5204株的脂肪酸谱。表33.用包含驱动pmfad2-1的pmipp1p的psz3481dna转化的一些代表性补偿(d2260)和亲本s5204株的脂肪酸谱。表34.用包含驱动pmfad2-1的pmahc1p的psz3509dna转化的一些代表性补偿(d2434)和亲本s5204株的脂肪酸谱。表35.用包含驱动pmfad2-1的pmahc1p的psz3516dna转化的一些代表性补偿(d2266)和亲本s5204株的脂肪酸谱。表36.用包含驱动pmfad2-1的pmahc2p的psz3510dna转化的一些代表性补偿(d2435)和亲本s5204株的脂肪酸谱。表37.用包含驱动pmfad2-1的pmppi1p的psz3513dna转化的一些代表性补偿(d2263)和亲本s5204株的脂肪酸谱。表38.用包含驱动pmfad2-1的pmppi1p的psz3689dna转化的一些代表性补偿(d2440)和亲本s5204株的脂肪酸谱。表39.用包含驱动pmfad2-1的pmppi2p的psz3514dna转化的一些代表性补偿(d2264)和亲本s5204株的脂肪酸谱。表40.用包含驱动pmfad2-1的pmppi2p的psz3518dna转化的一些代表性补偿(d2268)和亲本s5204株的脂肪酸谱。表41.用包含驱动pmfad2-1的pmgmps1p的psz3515dna转化的一些代表性补偿(d2265)和亲本s5204株的脂肪酸谱。表42.用包含驱动pmfad2-1的pmgmps1p的psz3519dna转化的一些代表性补偿(d2269)和亲本s5204株的脂肪酸谱。表43.用包含驱动pmfad2-1的pmgmps2p的psz3520dna转化的一些代表性补偿(d2270)和亲本s5204株的脂肪酸谱。表44.用包含驱动pmfad2-1的pmcs1p的psz3684dna转化的一些代表性补偿(d2436)和亲本s5204株的脂肪酸谱。表45.用包含驱动pmfad2-1的pmcs1p的psz3686dna转化的一些代表性补偿(d2438)和亲本s5204株的脂肪酸谱。表46.用包含驱动pmfad2-1的pmcscp的psz3685dna转化的一些代表性补偿(d2437)和亲本s5204株的脂肪酸谱。表47.用包含驱动pmfad2-1的pmgghp的psz3688dna转化的一些代表性补偿(d2439)和亲本s5204株的脂肪酸谱。表48.用包含驱动pmfad2-1的pmahi2p的psz3511dna转化的一些代表性补偿(d2261)和亲本s5204株的脂肪酸谱。表49.用包含驱动pmfad2-1的pmahi1p的psz3517dna转化的一些代表性补偿(d2267)和亲本s5204株的脂肪酸谱。表50.用包含驱动pmfad2-1的pmcep1p的psz3512dna转化的一些代表性补偿(d2262)和亲本s5204株的脂肪酸谱。在野生型无绿藻属品系(像s3150、s1920或s1331)中内源pmfad2-1和pmfad2-2的组合基线表达表现出5%-7%的c18:2。s5204过量表达pmkasii,这导致了c16:0向c18:0的延长。这一增加的c18:0池最终被pmsad2去饱和,从而导致c18:1的水平升高。另外地,在s5204中破坏pmfad2的两个拷贝(即pmfad2-1和pmfad2-2)防止c18:1进一步去饱和为c18:2并且产生具有0%亚油酸(c18:2)的独特的高油酸油(c18:1)。然而,如上文所提及,具有0%的c18:2的任何品系都生长地非常不好并且需要外源性添加亚油酸以维持生长/生产力。为品系像s5204补充可诱导pmamt03p驱动的pmfad2-1可以挽救生长表型,同时保留具有0%的c18:2水平的终端高c18:1。然而数据表明,pmamt03在发酵的早期阶段关闭,因此严重损害了任何补偿品系达到其完全生长和生产力潜力的能力。这项工作的目的是鉴别以下启动子元件,其允许补偿品系在发酵的早期阶段(t0-t30hr;不考虑发酵罐中过量的批处理的n)有效生长并且然后一旦细胞进入活性脂质产生(当培养基中的n被耗尽时)便关闭,这样使得补偿品系仍最终有非常高的c18:1和0%的c18:2水平。作为比较物,我们还为s5204补充了由pmfad2-1p或pmfad2-2p启动子元件驱动的pmfad2-1。使用被设计用于扩增pmfad2-1拷贝数的载体(例如psz3375或psz3376)或其中的pmfad2-1拷贝数被限制为一个的载体(psz3382或psz3383),为s5204补充由pmfad2-1p或pmfad2-2p启动子元件驱动的pmfad2-1使得c18:2水平得到完全恢复。这些品系中的pmfad2-1拷贝数对最终c18:2水平似乎具有非常轻微的影响。另一方面,由任何这些新启动子元件驱动的pmfad2-1的表达导致最终c18:2水平显著减少。来自表达驱动fad2-1的新启动子的不同品系的代表谱显示在表20-50中。c18:2水平的这种减少在其中pmfad2-1拷贝数限制为一个的品系中甚至更明显。启动子元件像mdps1(d2091&d2098)、pmdps2(d2092&d2099)、pmppi1(d2263&d2440)、pmppi2(d2264&d2268)、pmgmps1(d2265&d2269)、pmgmps2(d2270)在单或多拷贝pmfad2-1形式两者中都产生了具有0%或低于0.5%最终c18:2水平的品系。剩余的启动子产生了范围在1%-5%之间的最终c18:2水平。一个出乎意料的结果是来自d2434和d2435中的驱动pmfad2-1的pmahc1p和pmahc2p的数据。这两个启动子在多拷贝fad2-1形式中都产生了非常高水平的c18:2(9%-20%)。d2266的单拷贝形式中的最终c18:2水平与转录组数据更相符,表明当细胞在氮耗尽环境中正积极地产生脂质时,pmahc启动子活性和相应的pmahc转录被严重下调。快速浏览转录组揭示到,pmahc的初始转录是非常高的(4000-5500tpm),然后突然下降至约250tpm。因此,可以想到的是,在pmfad2-1上具有多拷贝的品系(d2434和d2435)中,在发酵中较早产生的大量pmfad2-1蛋白缓慢消失并且导致高c18:2水平。在单拷贝pmfad2-1品系中,情况并不是这样并且因此我们在d2266中没有看到升高的c18:2水平。在具有0%最终c18:2水平的补偿品系中,关键问题是它们是否首先被补充。为了对其进行确定,使代表性品系连同亲本s5204和先前补充amt03p驱动的pmfad2-1的s2532(即s4695)品系在96孔板的种子培养基中生长。以0.1od单位/ml接种培养物并且在不同时间点检查od750。与生长非常不好的s5204相比,仅有s4695和新补偿的品系在20和44h时生长至任何有意义的od(表51),证实以上鉴别的启动子早期有活性并且一旦细胞进入活性脂质产生阶段便关闭。表51.δfad2δfata1品系s5204、s4695和代表性补充s5204品系在种子培养基中的生长特征由44h的od750分选。应注意在1ml96孔板在初始快速分裂和生长之后,细胞由于缺乏营养素、通气等而停止有效生长。考虑到此处发现的这些启动子或其变体可以用于调控在细胞(包括微藻细胞)中表达的脂肪酸合成基因(例如,在此披露的fata、fatb、sad、fad2、kasi/iv、kasii、lpaat或kcs基因中的任一项)或其他基因或基因抑制元件。变体与此处披露的序列可以具有例如60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高一致性。实例8:组合kasii、fata和lpaat转基因以产生高sos油。在桑葚型无绿藻中,我们过量表达了桑葚型无绿藻kasii,敲除了内源sad2等位基因,敲除了内源fata等位基因,并且过量表达了来自油菜的lpaat和来自山竹的fata基因(“garmfat1”)两者。所得品系产生了具有超过55%的sos、超过70%的sat-o-sat和低于8%的三饱和tag的油。用线性化质粒转化基础品系,所述质粒带有被设计用于在sad2位点处同源重组的侧翼区。将构建体除去sad2并过量表达桑葚型无绿藻kasii。使用thic选择标记物。使用转化酶作为选择标记物,经由在6s染色体位点处进行同源重组,用以下构建体进一步转化这一品系,所述构建体被设计成过量表达garmfata1与桑葚型无绿藻sasd1质体靶向肽。所得品系产生了具有约62%的硬脂酸酯、6%的棕榈酸酯、5%的亚油酸酯、45%的sos和20%的三饱和物的油。来自garmfata1表达构建体(psz3204)的转化用dna的序列示于以下seqidno:61中。相关限制性位点以小写字母、粗体指示并且从5’至3’端为bspqi、kpni、xbai、mfei、bamhi、avrii、ecorv、spei、asci、clai、aflii、saci以及bspqi。在该构建体的5’和3’侧翼处加下划线的序列表示能够经由在6s基因座处同源重组靶向整合转化用dna的来自桑葚型无绿藻的基因组dna。沿5’到3’方向继续向前,驱动酿酒酵母suc2(scsuc2)基因表达、使得品系能够利用外源蔗糖的crtub2启动子以小写字母、加框文本指示。scsuc2的起始子atg和终止子tga由大写字母斜体指示,同时编码区由小写字母斜体表示。cvnr基因的3’utr以小体大写字母指示。间隔区由小写字母文本表示。驱动嵌合cpsad1tp_garmfata1_flag基因表达的桑葚型无绿藻(pmsad2-2)启动子以小写字母、加框文本指示。起始子atg和终止子tga由大写字母斜体指示;编码cpsad1tp的序列由小写字母、加下划线斜体表示;编码garmfata1成熟多肽的序列由小写字母斜体指示;并且3xflag表位标签由大写字母、粗斜体表示。第二cvnr3’utr由小体大写字母指示。来自psz3204的转化用dna的核苷酸序列:用以下构建体并且使用α半乳糖苷酶作为在蜜二糖上进行选择的选择标记物进一步转化所得品系,所述构建体被设计成在内源fata处重组(并且由此将其破坏)并且还在uapa1启动子的控制下表达来自油菜的lpaat。所得品系显示出增加的sos(约57%-60%)和sat-o-sat(约70%-76%)产生和较低量的三饱和物(4.8%至7.6%)。在高c18:0s6573背景中产生品系,其中我们通过将油菜lpat2(bn1.13)基因和pmfad2hparnai构建体两者靶向fata-1基因座而最大化了sos产生并且最小化了三饱和tag的形成。来自pmfad2hpa表达构建体psz4164的转化用dna的序列示于以下seqidno:62中。相关限制性位点以小写字母、粗体指示并且从5’至3’端为bspqi、kpni、spei、snabi、bamhi、ndei、nsii、aflii、ecori、spei、bsiwi、xhoi、saci以及bspqi。在该构建体的5’和3’侧翼处加下划线的序列表示能够经由在fata-1基因座处同源重组靶向整合转化用dna的来自桑葚型无绿藻的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1(scarmel1)基因表达、使得品系能够利用外源蜜二糖的pmhxt1启动子以小写字母、加框文本指示。scarmel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区由小写字母斜体表示。桑葚型无绿藻pgk基因的3’utr以小体大写字母指示。间隔区由小写字母文本表示。驱动bnlpat2(bn1.13)基因表达的桑葚型无绿藻uapa1启动子以小写字母、加框文本指示。起始子atg和终止子tga由大写字母斜体指示;编码bnlpat2(bn1.13)的序列由小写字母、加下划线斜体表示。cvnr基因的3’utr以小体大写字母指示。第二间隔区由小写字母文本表示。驱动pmfad2hpa发夹表达的莱氏衣藻crtub2启动子以小写字母、加框文本指示。处于正向的fad2外显子1序列以小写字母斜体指示;fad2内含子1序列以小写字母、粗斜体表示;短连接区以小写字母文本指示,并且处于反向的fad2外显子1序列以小写字母、加下划线斜体指示。第二cvnr3’utr由小体大写字母指示。来自psz4164的转化用dna的核苷酸序列:实例9:每份食物具有“零”饱和脂肪的藻油在此实例中,我们证实桑葚型无绿藻中的三酰甘油(来源于utex1435)可以在饱和脂肪酸水平下利用分子遗传学和经典诱变方法两者显著降低。如下文所述的,品系s8188产生在多个发酵批次中具有小于或约3%总饱和脂肪酸的油。品系8188表达外源基因,这些基因产生seqidno:64和65的成熟kasii和sad蛋白质,这些基因分别具有破坏内源fata等位基因的表达的插入。品系s8188生成的汇总。通过两次连续转化产生品系s8188。首先用构建体psz3870(fata13'::crtub2-scsuc2-cvnr:pmsad2-2-cpsadtp-pmkasii-cvnr::fata15')转化高油酸基本品系s7505,该构建体破坏fata1等位基因的单个拷贝,同时过量表达桑葚型无绿藻kasii。所得高油酸、低棕榈酸品系s7740在发酵批次中产生1.4%棕榈酸酯和7.3%总饱和物(表52)。确切地说,s7505和s5100是低c16:0滴度和高c18:1滴度的品系s3150的耐浅蓝菌素分离株,其根据2015年3月31日提交的共同拥有申请62/141,167所披露的方法制成。随后用psz4768(fad2-15'::pmhxt1v2-scarmel1-pmpgk:pmsad2-2p-cpsadtp-pmkasii-cvnr:pmacp1-pmsad2-1-cvnr::fad2-13')转化s7740,从而引入pmkasii的另一个拷贝并且同时过量表达靶向fad2(δ-12脂肪酸去饱和酶)基因座的pmsad2-1基因,以产生品系s8188。品系s8188产生1.7%的c16:0和0.5%的c18:0,以及约3%的总饱和脂肪酸水平(表52)。注意,破坏fad2会提高油酸相对于多不饱和物的水平,但是此破坏对于实现低水平不饱和物可能是不需要的。表52.在高细胞密度发酵实验中在品系s7505、s7740和s8188之间的脂肪酸谱的比较。品系s7740产生较低c16:0;而s8188产生较低c16:0和c18:0,因此总饱和脂肪酸较低。优化pmkasii的表达以生成较低棕榈酸品系。桑葚型无绿藻utex1435品系中的主要饱和脂肪酸包括c16:0和c18:0。为了使c16:0脂肪酸水平最小化,我们研究优化pmkasii基因表达是否可导致棕榈酸酯的进一步减少,从而减少总饱和脂肪酸水平。利用总计14种推定的强内源启动子驱动pmkasii基因的表达(表53)。将这些启动子作为表达盒的一部分单独克隆到pmkasii基因的上游,该表达盒同时敲除fata的单个等位基因。表53.内源性启动子经由转录组分析鉴定并且在本研究中评价:pmuapa1(尿酸黄嘌呤透性酶1);pmhxt1(己糖协同转运蛋白);pmsad2-2(硬脂酰基acp去饱和酶2-2);pmsod(超氧化物歧化酶);pmatpb1(atp合成酶亚基b);pmef1-1(延长因子等位基因1);pmef1-2(延长因子等位基因2);pmacp-p1(酰基载体蛋白塑料-1);pmacp-p2(酰基载体蛋白塑料-2);pmc1lyr1(c1lyr家族结构域同源物);pmamt1-1(铵转运蛋白1-1)pmamt1-2(铵转运蛋白1-2);pmamt3-1(铵转运蛋白3-1);pmamt3-2(铵转运蛋白3-2)所有14种构建体具有相同的构型,除了驱动pmkasii基因表达的启动子不同之外。这些转化用dna的序列在以下序列中提供。在这些构建体中,将酿酒酵母(saccharomycescerevisiae)转化酶基因(suc2)用作可选择标记,赋予品系在蔗糖上生长的能力。首先将所得构建体转化到高油酸基本品系s5100中,并且然后评定由每个转化产生的最少20个转基因株。如表54所示,过量表达由启动子诸如pmsad2-2、pmacp-p1、pmacp-p2、pmuapa1以及pmhxt1驱动的pmkasii基因的转基因株显示c16:0脂肪酸水平的显著降低。我们还观察到c18:1脂肪酸的显著积累。然后我们将这前五种构建体(pmsad2-2、pmacp-p1、pmacp-p2、pmuapa1以及pmhxt1)转化到高油酸品系s7505中。再评定最少20个转基因株。总体上,由s7505中生成的转基因株实现的平均c16:0水平低于s5100中生成的那些的水平,这与亲本品系中观察到的水平一致。在另一方面,引起最低c16:0水平的启动子根据所测试的高油酸基本品系是不同的。例如,pmacp-p2似乎是驱动pmkasii在s5100中表达的最佳启动子,而在s7505中,pmsad2-2启动子作用最佳(表54)。表54.在过量表达pmkasii的转基因株中实现的棕榈酸酯水平与在高油酸基本品系s5100和s7505中的fata1下调一致。最低和平均c16:0水平是评定来自每个转化的最少20个转基因株的结果。假设初始结果当由品系s7505中的pmsad2-2启动子驱动时经由fata1的灭活和pmkasii的过量表达可见,则我们将这些转基因株中的若干种移动遗传稳定性测定和dna印迹分析对整合事件的评定中。品系s7740是显示dna正确整合到fata1基因座中的所得稳定株。当在实验室规模发酵罐中评价时s7740的脂肪酸谱示出在表55中。正如预期,品系s7740中的c16:0水平比在相同条件下运行的先前高油酸主要品系s5587中观察到的水平低2.3%(表55)。s5587是其中psz2533在s5100中表达的品系。表55.在高细胞密度发酵实验中在品系s5587和s7740之间的脂肪酸谱的比较。品系s7740产生比s5587少2.3%的c16:0,而油酸酯水平在两个品系之间是相当的。s7740是由转化s7505的psz3870(fata13'::crtub2:scsuc2:cvnr::pmsad2-2-cpsadtp:pmkasii-cvnr::fata15')生成的转化子之一。psz3870转化用dna的序列提供在seqidno:66中。构建体中的相关限制性位点以小写字母、粗体并加下划线指示并且5’-3’端对应地为bspq1、kpni、asci、mfei、ecorv、spei、asci、clai、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表允许经由同源重组在fata1基因座处靶向整合的fata13’基因组dna。沿5’到3’方向继续向前,驱动酵母蔗糖转化酶基因表达的莱氏衣藻β-微管蛋白启动子以加框文本指示。转化酶的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻sad2-2启动子。pmkasii的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。原始小球藻s106硬脂酰基-acp去饱和酶转运肽位于起始子atg与asci位点之间。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的fata15’基因组区域。如我们早期所述的,我们利用13种附加启动子来驱动pmkasii的表达。所有14种构建体具有相同的构造和相关限制性位点。psz3870中所含转化用dna的核苷酸序列:psz2533中所含pmuapa1启动子的核苷酸序列:psz3869中所含pmhxt1启动子的核苷酸序列:psz3935中所含pmsod启动子的核苷酸序列:psz3936中所含pmatpb1启动子的核苷酸序列:psz3937中所含pmef1-1启动子的核苷酸序列:psz3938中所含pmef1-2启动子的核苷酸序列:psz3939中所含pmacp1启动子的核苷酸序列:psz3940中所含pmacp2启动子的核苷酸序列:psz3941中所含pmc1lyr1启动子的核苷酸序列:psz3942中所含pmamt1-1启动子的核苷酸序列:psz3943中所含pmamt1-2启动子的核苷酸序列:psz3944中所含pmamt3-1启动子的核苷酸序列:psz3945中所含pmamt3-2启动子的核苷酸序列:pmsad2-1在s7740中的表达引起零satfat品系s8188然后将pmsad2-1基因引入到s7740中以减小硬脂酸水平。品系s8188是经由将psz4768dna(fad25'::pmhxt1v2-scarmel1-pmpgk:pmsad2-2p-cpsadtp-pmkasii-cvnr:pmacp1-pmsad2-1-cvnr::fad23')转化到s7740中而生成的稳定株之一。在这个构建体中,卡尔酵母(saccharomycescarlbergensis)mel1基因被用作可选择标记物,以便使用先前描述的转化法(生物射弹)通过同源重组将pmsad2-1和pmkasii的额外拷贝引入到桑葚型无绿藻品系s7740的fad2-1基因座中。psz4768(d3870)转化用dna的序列提供在seqidno:85中。psz4768中的相关限制性位点以小写、粗体和下划线表示,并且分别为5'-3'bspq1、kpni、snabi、bamhi、avrii、spei、asci、clai、ecori、spei、asci、clai、paci、sacibspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表允许经由同源重组在fad2-1基因座处靶向整合的fad2-15'基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因表达的桑葚型无绿藻hxt1启动子以加框文本指示。scarmel1的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。桑葚型无绿藻pgk3'utr由小写字母加下划线文本指示,后接由加框斜体文本指示的pmsad2-2启动子。pmkasii的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。原始小球藻s106硬脂酰基-acp去饱和酶转运肽位于起始子atg与asci位点之间。普通小球藻硝酸还原酶3’utr是以小写字母加下划线文本指示,后接驱动pmsad2-1基因表达的pmacp1启动子。该pmacp1启动子是以带框斜体文本指示。pmsad2-1的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。原始小球藻s106硬脂酰基-acp去饱和酶转运肽位于起始子atg与asci位点之间。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的fad2-13'基因组区域。psz4768(d3870)中所含转化用dna的核苷酸序列:来自用psz4768(d3870)转化到s7740中而产生的代表性克隆的所得谱示出在表56中。过量表达pmsad2-1基因的影响是c18:0链长度的明显减小,从而显著降低总饱和脂肪酸的水平。品系s8188是来自转化子d3870-21的稳定株之一(表56),并且当在摇瓶实验中评价时其产生约4%总饱和脂肪酸。为了确认s8188能够产生具有较低总饱和物的油,在发酵实验中进一步评价s8188的性能。如图1所示,品系s8188在两个发酵批次140558f22和140574f24中产生2.9%-3.0%的总饱和物。表56.由用d3870(psz4768)dna转化到品系s7740中产生的代表性克隆的脂肪酸谱。实例10:lpaat在高芥酸转基因微藻e中的表达在以下给出的实例中,我们证实使用溶血磷脂酸酰基转移酶(lpaat)改变油在用于产生某些极长链脂肪酸(vlcfa)的转基因藻类品系中的含量和组成的可行性。确切地说,显示为,来自荷包蛋花(limdlpaat,uniprot登录号:q42870,seqidno:82)或绣线菊(limalpaat,uniprot登录号:42868、seqidno:83)的异源lpaat基因在转基因高芥酸品系s7211和s7708中的表达引起单个株中的芥酸(22:1δ13)相对于亲本的超过3倍的增强。s7211和s7708分别通过在utex1435和s3150池的经典诱变衍生物(选择高产油量)中表达编码海甘蓝亚种(crambehispanicasubsp.abyssinica)(也称为海甘蓝)(seqidno:84)和银扇草(seqidno:85)脂肪酸延长酶(fae)的基因生成,如共同拥有的申请wo2013/158938中所披露的。在此实例中,生成用构建体psz5119转化的s7211和s7708品系,其表达卡尔酵母(sacharomycescarlbergenesis)mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和荷包蛋花lpaat基因(靶向内源pmlpaat1-1基因组区域)。被引入以在s7211和s7708中表达的构建体psz5119可以被写成lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpaat-cvnr::lpaat1-13'侧翼。转化用dna的序列提供在seqidno:104中。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的内源amt3启动子。limdlpaat的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。用于在芥酸品系s7211和s7708中表达荷包蛋花溶血磷脂酸酰基转移酶(limdlpaat)的构建体-[psz5119]。质粒psz5119中所含转化用dna的核苷酸序列:用于在s7211和s7708中表达来自高等植物的limdlpaat和limalpaat基因的构建体。除了靶向plsc-2/pmlpaat1-1基因座(psz5119)的荷包蛋花lpaat之外,已构建靶向plsc-2/lpaat1-2基因座(psz5120)的荷包蛋花lpaat、靶向plsc-2/pmlpaat1-1基因座(psz5343)的绣线菊lpaat和靶向plsc-2/pmlpaat1-2基因座(psz5348)的绣线菊lpaat,以在s7211和s7708中表达。这些构建体可以被描述为:psz5120:plsc-2/lpaat1-25'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpaat-cvnr::plsc-2/lpaat1-23'侧翼psz5343:plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limalpaat-cvnr::plsc-2/lpaat1-13'侧翼psz5348:plsc-2/lpaat1-25'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limalpaat-cvnr::plsc-2/lpaat1-23'侧翼所有这些构建体具有与psz5119相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向的基因组区域和/或对应lpaat基因。这些构建体中的相关限制性位点也与psz5119中相同。正下方的序列分别指示plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼、limalpaat的序列。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5120和psz5348中的plsc-2/lpaat1-25'侧翼的序列plsc-2/lpaat1-25'侧翼:psz5120和psz5348中的plsc-2/lpaat1-23'侧翼的序列plsc-2/lpaat1-23'侧翼:psz5343和psz5348中所含绣线菊lpaat(limalpaat)的核苷酸序列-limalpaat:为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s7211或s7708中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。品系s7211和s7708在ph调节的、amt03(铵转运蛋白03)启动子的控制下分别表达来自海甘蓝或银扇草的fae。因此两个亲本(s7211和s7708)和所得lpaat转化的品系需要在ph7.0下生长以允许最大脂肪酸延长酶(fae)基因表达。来自由用psz5119(d3979)、psz5120(d3980)、psz5343(d4204)和psz5348(d4209)转化到s7211或s7708中引起的一系列代表性克隆的所得谱示出在表57至62中。表达来自荷包蛋花或绣线菊的lpaat基因的所有转基因s7211或s7708品系显示2倍或更多倍的增强的c22:1脂肪酸累积(参见表57至62)。芥酸(c22:1δ13)水平的增强在s7708;t1127;d3979-15中是相对于亲本s7708的4.2倍并且在s7211;t1181;d4204-5;ph7中是相对于亲本s7211的3.7倍。这些结果清楚地证实使用lpaat基因改变了转基因藻类品系中的vlcfa含量。表57.在s3150、s7211和用psz5119(在plsc-2/lpaat1-1基因组基因座处的limdlpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1120;d3979-24;ph737.0114.51.636.954.32s7211;t1120;d3979-31;ph738.9913.631.546.313.96s7211;t1120;d3979-2;ph744.8710.841.054.981.99s7211;t1120;d3979-19;ph746.1010.431.014.691.97s7211;t1120;d3979-29;ph743.8010.661.054.731.97s7211a;ph746.809.890.844.401.60s7211b;ph746.809.890.844.371.65s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00表58.在s3150、s7211和用psz5120(在plsc-2/lpaat1-1基因组基因座处的limdlpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表59.在s3150、s7708和用psz5119(在plsc-2/lpaat1-2基因组基因座处的limdlpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7708;t1127;d3979-15;ph733.3414.981.954.096.50s7708;t1127;d3979-32;ph743.3111.281.054.723.89s7708;t1127;d3979-42;ph742.7611.351.054.653.81s7708;t1127;d3979-3;ph746.6710.221.074.183.19s7708;t1127;d3979-40;ph746.389.960.904.143.00s7708a;ph749.618.470.692.911.53s7708b;ph750.148.370.702.971.52s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00表60.在s3150、s7708和用psz5120(在plsc-2/lpaat1-2基因组基因座处的limdlpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表61.在s3150、s7708和用psz5343(在plsc-2/lpaat1-1基因组基因座处的limalpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4204-5;ph737.2713.621.606.645.12s7211;t1181;d4204-16;ph739.3912.581.785.863.12s7211;t1181;d4204-6;ph742.5211.531.314.822.01s7211;t1181;d4204-2;ph745.9710.560.994.731.92s7211;t1181;d4204-11;ph745.7610.521.004.631.88s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph757.996.620.560.190s3150;ph557.77.080.540.110表62.在s3150、s7708和用psz5348(在plsc-2/lpaat1-2基因组基因座处的limalpaat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4209-24;ph740.4613.181.436.593.94s7211;t1181;d4209-18;ph741.7912.711.296.103.50s7211;t1181;d4209-3;ph743.3211.651.455.222.79s7211;t1181;d4209-27;ph747.419.681.016.012.36s7211;t1181;d4209-5;ph743.6712.770.995.052.24s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph757.996.620.560.190s3150;ph557.707.080.540.110实例11:lpcat在微藻中的表达在此我们证实使用高等植物溶血磷脂酰胆碱酰基转移酶(lpcat)基因改变用于产生富含亚油酸的油的转基因藻类品系中的油的含量和组成的可行性。我们证实桑葚型无绿藻品系s7485中的异源lpcat酶表达引起单个株中的亚油酸(c18:2)相对于在亲本中增强大于3倍。野生型无绿藻品系当在低氮脂质生产条件下培养时产生具有约5%-7%c18:2水平的提取的细胞油并且指向宿主中的功能性内源lpcat和下游dag-cpt和/或pdct酶。当将高等植物lpcat或dag-cpt用作饵剂时,两种基因的转录物可见于桑葚型无绿藻转录组。然而未发现相应pdct样基因的命中基因。我们鉴定桑葚型无绿藻中的lpcat的两个等位基因(pmlpcat1)。两个等位基因的总体转录非常低。两者的转录物水平以50-60个转录物/一百万开始并且然后在脂质产生过程中缓慢增加。pmlpcat1-1达到约210个转录物/一百万,而pmlpcat1-2增加至约150个转录物/一百万。使用来自拟南芥的编码(atlpcat1np_172724.2[seqidno:86]、atlpcat2np_176493.1[seqidno:87])的公共数据库中可用的两个lpcat基因鉴定来自芜菁、芥菜和荷包蛋花的内部组装的转录组的相应lpcat基因。鉴定5个全长序列并将其命名为brlpcat[seqidno:99]、bjlpcat1[seqidno:108]、bjlpcat2[seqidno:109]、limdlpcat1[seqidno:101]以及limdlpcat2[seqidno:102]。除bjlpcat1之外的这些酶的密码子优化的序列连同atlpcat基因一起在桑葚型无绿藻品系s7485中表达。s7485是根据2015年3月31日提交的共同拥有的申请号62/141,167中所披露的方法制成的品系。确切地说,s7485是具有低c16:0滴度和高c18:1的品系k的耐浅蓝菌素分离株。用于在s7485中表达芥菜溶血磷脂酰胆碱酰基转移酶-1(bjlpcat1)的构建体[psz5298]:用构建体psz5298转化品系s7485,以表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和芜菁lpcat基因(靶向内源pmlpaat1-1基因组区域)。被引入以在s7485中表达的构建体psz5298可以被书写为plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjlpcat1-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供在以下seqidno:110中。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的内源amt3启动子。bjlpcat1的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5298中所含转化用dna的核苷酸序列:用于在s7485中表达来自高等植物的brlpcat、limdlpcat1、limdlpcat2、atlpcat1以及atlpcat2基因的构建体。除了靶向plsc-2/pmlpaat1-1基因座(psz5298)的芥菜lpcat1之外,已构建靶向plsc-2/pmlpaat1-1基因座(psz5299)的芜菁lpcat、靶向plsc-2/pmlpaat1-1基因座(psz5300)的荷包蛋花lpcat1、靶向plsc-2/pmlpaat1-1基因座(psz5301)的荷包蛋花lpcat2、靶向plsc-2/lpaat1-2基因座(psz5307)的拟南芥lpcat1、靶向plsc-2/lpaat1-2基因座(psz5308)的拟南芥lpcat2、靶向plsc-2/pmlpaat1-2基因座(psz5309)的芜菁lpcat以及靶向plsc-2/pmlpaat1-2基因座(psz5310)的荷包蛋花lpcat2,以用于在s7211中表达。这些构建体可以被描述为:psz5299:plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brlpcat-cvnr::plsc-2/lpaat1-1psz5300:plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat1-cvnr::plsc-2/lpaat1-1psz5301:plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat2-cvnr::plsc-2/lpaat1-1psz5307:plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat1-cvnr::plsc-2/lpaat1-2psz5308:plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat2-cvnr::plsc-2/lpaat1-2psz5309:plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brlpcat-cvnr::plsc-2/lpaat1-2psz5310:plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat2-cvnr::plsc-2/lpaat1-2所有这些构建体具有与psz5298相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向的基因组区域和/或对应lpcat基因。这些构建体中的相关限制性位点也与psz5298中相同。图5至图11分别指示了plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼、brlpcat、limdlpcat1、limdlpcat2、atlpcat1以及atlpcat2的序列。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5307、psz5308、psz5309和psz5310中的plsc-2/lpaat1-25'侧翼的序列。plsc-2/lpaat1-25'侧翼:psz5307、psz5308、psz5309和psz5310中的plsc-2/lpaat1-23'侧翼的序列。plsc-2/lpaat1-23'侧翼:psz5299和psz5309中所含芜菁lpcat(brlpcat)的核苷酸序列。brlpcat:psz5300中所含荷包蛋花lpcat1(limdlpcat1)的核苷酸序列。limdlpcat1:psz5301和psz5310中所含荷包蛋花lpcat2(limdlpcat2)的核苷酸序列。limdlpcat2:psz5307中所含拟南芥lpcat1(atlpcat1)的核苷酸序列。atlpcat1:psz5308中所含拟南芥lpcat2(atlpcat2)的核苷酸序列。atlpcat2:为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s7211中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。s7211在ph调节的、amt03(铵转运蛋白03)启动子的控制下表达来自海甘蓝的fae。因此亲本(s7211)和所得lpcat转化的品系两者需要在ph7.0下生长以允许最大脂肪酸延长酶(fae)基因表达。来自由用psz5298(d4159)、psz5299(d4160)、psz5300(d4161)、psz5301(d4162)、psz5307(d4168)、psz5308(d4169)、psz5309(d4170)以及psz5310(d4171)转化引起的一系列代表性克隆的所得谱分别示出在表63至70中。除了荷包蛋花lpcat2之外,所有测试的lpcat酶均引起c18:2水平相对于亲本s7485增加3倍。在表达limdlpcat2的品系的情况下,c18:2的增加虽然显著但仅是相对于亲本的2倍。在s7211;t1172;d4157-14;ph7(在plsc-2/lpaat1-1基因座处表达atlpcat1)中的c18:2增加是2.54倍(相对于亲本s7211)。所得结果明显表明在藻类宿主中的异源lpcat基因表达增强了c18:1辅酶a到c18:1-pc的转化。pc相关的c18:1随后由下游酶如fad2作用并且转化成c18:2。如上文所讨论的,当lpcat基因转化成芥酸品系s7211(表达crhfae)时获得类似结果。在s7211中,c18:2水平的增益也与芥酸含量的增加相关。来自两个实验的组合结果表明s7211中的crhfae最可能使用c18:1-pc而非c18:1辅酶a作为延长酶的底物。在此情景中,s7211中的pmfad2和crhfae将竞争相同底物,从而产生提高的c18:2以及vlcfa像c20:1和c22:1。如果我们的假设是正确的,那么目前可以看出pmfad2-1能比crhfae更好地竞争底物。目前寻求引导用于延长的更多底物的方法之一是使用rnai技术减小pmfad2活性。此实例描述了工程改造的微藻中的c18:2和c22:1水平的显著增加。增加c18:1到c18:1-pc的转化的lpcat酶的鉴定使得我们更好地控制c18:1磷脂池,其然后可以涉及通过调节pmfad2-1活性来制备更多多不饱和脂肪酸或vlcfa。表63.在s7485和用psz5298(bjlpcat2)(在plsc-2/lpaat1-1基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as7485ctrl;ph52.1537.163.7249.634.910.56s7485ctrl;ph52.1837.243.7449.454.940.57s7485;t1208;d4159-1;ph52.2737.483.8740.4213.610.60s7485;t1208;d4159-41;ph52.2238.433.4140.6013.040.57s7485;t1208;d4159-24;ph52.4340.102.8238.9812.820.81s7485;t1208;d4159-23;ph51.7332.643.2647.3512.410.94s7485;t1208;d4159-18;ph52.0837.473.6642.4212.160.53表64.在s7485和用psz5299(brlpcat)(在plsc-2/lpaat1-1基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表65.在s7485和用psz5300(limdlpcat1)(在plsc-2/lpaat1-1基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as7485ctrl;ph52.1537.143.7249.624.940.58s7485ctrl;ph52.1737.223.7349.434.960.60s7485;t1208;d4161-48;ph52.1437.073.7440.8513.870.56s7485;t1208;d4161-25;ph52.4539.982.9638.0913.280.96s7485;t1208;d4161-10;ph52.0736.913.8342.5012.450.53s7485;t1208;d4161-18;ph52.0436.493.7943.2012.210.51s7485;t1208;d4161-47;ph52.3138.163.7742.4211.040.60表66.在s7485和用psz5301(limdlpcat2)(在plsc-2/lpaat1-1基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as7485ctrl;ph52.1537.143.7249.624.940.58s7485ctrl;ph52.1737.223.7349.434.960.60s7485;t1208;d4162-36;ph52.2136.643.7646.448.550.59s7485;t1208;d4162-47;ph52.3833.053.1851.207.880.43s7485;t1208;d4162-38;ph51.5130.483.5354.947.340.59s7485;t1208;d4162-21;ph52.0936.703.7547.987.190.57s7485;t1208;d4162-5;ph52.0335.683.8149.087.160.48表67.在s7485和用psz5307(atlpcat1)(在plsc-2/lpaat1-2基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表68.在s7485和用psz5308(atlpcat2)(在plsc-2/lpaat1-2基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as7485ctrl;ph52.1537.143.7249.624.940.58s7485ctrl;ph52.1737.223.7349.434.960.60s7485;t1208;d4169-26;ph51.4729.393.3348.3315.310.51s7485;t1208;d4169-41;ph52.2438.202.8239.8114.200.64s7485;t1208;d4169-19;ph52.2839.522.9839.2612.890.86s7485;t1208;d4169-38;ph52.2337.873.7541.2512.660.55s7485;t1208;d4169-37;ph52.1937.523.7941.5912.620.56表69.在s7485和用psz5309(brlpcat)(在plsc-2/lpaat1-2基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as7485;ph52.1537.163.7249.634.910.56s7485;ph52.1837.243.7449.454.940.57s7485;t1208;d4170-43;ph51.5531.353.1946.9514.780.59s7485;t1208;d4170-46;ph52.1437.433.7641.9412.520.58s7485;t1208;d4170-40;ph52.1637.873.7941.5412.420.56s7485;t1208;d4170-42;ph52.0738.063.7441.6912.300.54s7485;t1208;d4170-4;ph52.1337.533.6542.2712.240.54表70.在s7485和用psz5309(limlpcat2)(在plsc-2/lpaat1-2基因组基因座处)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。实例12:lpcat在高芥酸转基因微藻中的表达在此实例中我们证实使用高等植物溶血磷脂酰胆碱酰基转移酶(lpcat)基因改变用于产生富含亚油酸和/或极长链脂肪酸(vlcfa)的油的转基因藻类品系中的油的含量和组成。来自在此的实例11的lpcat基因在s7211中表达。s7211是。我们的结果显示异源lpcat酶在s7211中的表达引起亚油酸(c18:2)和芥酸(c22:1)含量在单个株中相对于在亲本中增强大于3倍。用于在品系s7211中表达拟南芥溶血磷脂酰胆碱酰基转移酶atlpcat)的构建体[psz5296]:在此实例中,生成用构建体psz5296转化的s7211,其表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和拟南芥lpcat基因(靶向内源pmlpaat1-1基因组区域)。构建体可以被书写为plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat1-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供如下。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因表达的内源桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的pmsad2-2v2启动子。atlpcat1的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的桑葚型无绿藻plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5296中所含转化用dna的核苷酸序列:用于在s7211中表达来自高等植物的atlpcat1和atlpcat2、brlpcat、bjlpcat1、bjlpcat2、limdlpcat1和limdlpcat2基因的构建体:除了靶向plsc-2/pmlpaat1-1基因座(psz5296)的拟南芥lpcat1之外,已构建靶向plsc-2/lpaat1-2基因座(psz5307)的拟南芥lpcat1、靶向plsc-2/lpaat1-1基因座(psz5297)的拟南芥lpcat2、靶向plsc-2/lpaat1-2基因座(psz5308)的拟南芥lpcat2、靶向plsc-2/pmlpaat1-1基因座(psz5299)的芜菁lpcat、靶向plsc-2/pmlpaat1-2基因座(psz5309)的芜菁lpcat、靶向plsc-2/pmlpaat1-1基因座(psz5346)的芥菜lpcat1、靶向plsc-2/pmlpaat1-2基因座(psz5351)的芥菜lpcat1、靶向plsc-2/pmlpaat1-1基因座(psz5298)的芥菜lpcat2、靶向plsc-2/pmlpaat1-2基因座(psz5352)的芥菜lpcat2、靶向plsc-2/pmlpaat1-1基因座(psz5300)的荷包蛋花lpcat1、靶向plsc-2/pmlpaat1-2基因座(psz5353)的荷包蛋花lpcat1、靶向plsc-2/pmlpaat1-1基因座(psz5301)的荷包蛋花lpcat2以及靶向plsc-2/pmlpaat1-2基因座(psz5310)的荷包蛋花lpcat2,以用于在s7211中表达。这些构建体可以被描述为:psz5307-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat1-cvnr::plsc-2/lpaat1-2psz5297-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat2-cvnr::plsc-2/lpaat1-1psz5308-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat2-cvnr::plsc-2/lpaat1-2psz5299-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brlpcat-cvnr::plsc-2/lpaat1-1psz5309-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brlpcat-cvnr::plsc-2/lpaat1-2psz5346-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjlpcat1-cvnr::plsc-2/lpaat1-1psz5351-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjlpcat1-cvnr::plsc-2/lpaat1-2psz5298-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjlpcat2-cvnr::plsc-2/lpaat1-1psz5352-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjlpcat2-cvnr::plsc-2/lpaat1-2psz5300-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat1-cvnr::plsc-2/lpaat1-1psz5353-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat1-cvnr::plsc-2/lpaat1-2psz5301-plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat2-cvnr::plsc-2/lpaat1-1psz5310-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-limdlpcat2-cvnr::plsc-2/lpaat1-2所有这些构建体具有与psz5296相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向的基因组区域和/或对应lpcat基因。这些构建体中的相关限制性位点也与psz5296中相同。分别为plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼和atlpcat1、atlpcat2、brlpcat、bjlpcat1、bjlpcat2、limdlpcat1以及limdlpcat2基因的序列。以粗体文本显示的相关限制性位点以5'-3'分别显示,示出在下文中。psz5307、psz5308、psz5309、psz5310、psz5351、psz5352以及psz5353中的plsc-2/lpaat1-25'侧翼的序列。plsc-2/lpaat1-25'侧翼:psz5307、psz5308、psz5309、psz5310、psz5351、psz5352以及psz5353中的plsc-2/lpaat1-23'侧翼的序列。plsc-2/lpaat1-23'侧翼:psz5297和psz5308中所含拟南芥lpcat2(atlpcat2)的核苷酸序列。atlpcat2:psz5299和psz5309中所含芜菁lpcat(brlpcat)的核苷酸序列。brlpcat:psz5346和psz5351中所含芥菜lpcat1(bjlpcat1)的核苷酸序列。bjlpcat1:psz5298和psz5352中所含芥菜lpcat2(bjlpcat2)的核苷酸序列。bjlpcat2:psz5300和psz5353中所含荷包蛋花lpcat1(limdlpcat1)的核苷酸序列。limdlpcat1:psz5301和psz5310中所含荷包蛋花lpcat2(limdlpcat2)的核苷酸序列。limdlpcat2:为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s7211中。将初级转化子以克隆方式纯化并使其在ph7.0下生长。s7211在ph调节的、amt03(铵转运蛋白03)启动子的控制下表达来自海甘蓝的fae。因此亲本(s7211)和所得lpcat转化的品系两者需要在ph7.0下生长以允许最大脂肪酸延长酶(fae)基因表达。来自用psz5296(d4157)、psz5307(d4168)、psz5297(d4158)、psz5308(d4169)、psz5299(d4160)、psz5309(d4170)、psz5346(d4207)、psz5351(d4212)、psz5298(d4159)、psz5352(d4213)、psz5300(d4161)、psz5353(d4214)、psz5301(d4162)以及psz5310(d4171)转化到s7211中的一系列代表性克隆的所得谱分别示出在表71至84中。表达任何上述lpcat基因的所有转基因株引起c18:2的超过2倍的增加。在s7211;t1172;d4157-14;ph7(在plsc-2/lpaat1-1基因座处表达atlpcat1)中的c18:2增加是2.54倍(相对于亲本s7211)。这些结果证明在藻类宿主中的异源lpcat基因表达增强了c18:1辅酶a到c18:1-pc的转化。pc相关的c18:1随后由下游酶如fad2作用并且转化成c18:2。与c18:2的增加一致,也存在c20:1和c22:1的显著且明显的增加。虽然c20:1水平的增加仅是相对于亲本的1.5-2倍,但是在lpaat1-1或lpaat1-2基因座处测试的大部分基因中c22:1水平的增加超过3倍。在s7211;t1174;d4171-11;ph7的情况下,c22:1水平的增加是相对于亲本(1.36%)的5.3倍(7.23%)。类似地,在s7211;t1173;d4162-10;ph7的情况下,c22:1的增加是相对于亲本(1.36%)的3.84倍(5.23%)。存在我们迄今在任何藻类基础或转基因品系中获得的最高c22:1水平中的一些。这些结果表明s7211中的crhfae最可能使用c18:1-pc而非c18:1辅酶a作为延长酶的底物。在此情景中,s7211中的pmfad2和crhfae将竞争相同底物,从而产生提高的c18:2以及vlcfa像c20:1和c22:1。可以看出,pmfad2-1比crhfae更好地竞争底物。增加c18:1到c18:1-pc的转化的lpcat酶的鉴定使得我们更好地控制c18:1磷脂池,其然后可以涉及通过调节pmfad2-1活性来制备更多多不饱和脂肪酸或vlcfa。表71.在s3150、s7211和用psz5296(在plsc-2/lpaat1-1基因组基因座处的atlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表72.在s3150、s7211和用psz5307(在plsc-2/lpaat1-2基因组基因座处的atlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1173;d4168-12;ph731.1321.201.734.964.44s7211;t1173;d4168-7;ph733.1220.261.524.904.08s7211;t1173;d4168-15;ph732.8620.821.604.633.79s7211;t1173;d4168-1;ph732.3421.121.674.773.67s7211;t1173;d4168-3;ph732.8620.831.544.753.67s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph7586.620.560.190.0s3150;ph557.77.080.540.110.0表73.在s3150、s7211和用psz5297(在plsc-2/lpaat1-1基因组基因座处的atlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1172;d4158-4;ph727.6822.421.724.605.56s7211;t1172;d4158-18;ph731.7621.241.384.754.14s7211;t1172;d4158-5;ph722.5923.561.634.384.09s7211;t1172;d4158-1;ph721.7423.811.754.354.04s7211;t1172;d4158-25;ph731.2921.821.454.903.95s7211a;ph748.239.690.754.021.34s7211b;ph748.249.650.754.011.33s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表74.在s3150、s7211和用psz5308(在plsc-2/lpaat1-2基因组基因座处的atlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表75.在s3150、s7211和用psz5299(在plsc-2/lpaat1-1基因组基因座处的brlpcat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1172;d4160-13;ph742.7515.971.876.424.14s7211;t1172;d4160-10;ph731.8021.321.424.663.58s7211;t1172;d4160-5;ph733.6821.021.364.523.17s7211;t1172;d4160-3;ph732.5021.861.374.343.03s7211;t1172;d4160-12;ph731.0722.481.683.783.02s7211a;ph748.109.650.784.031.34s7211b;ph748.119.640.774.011.33s3150;ph758.006.620.560.190.00s3150;ph557.77.080.540.110.00表76.在s3150、s7211和用psz5309(在plsc-2/lpaat1-2基因组基因座处的brlpcat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1174;d4170-9;ph731.4620.981.694.533.33s7211;t1174;d4170-7;ph729.6822.071.774.293.12s7211;t1174;d4170-6;ph738.9817.160.923.761.63s7211;t1174;d4170-3;ph734.8018.500.953.601.51s7211;t1174;d4170-5;ph740.5516.640.913.681.50s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表77.在s3150、s7211和用psz5346(在plsc-2/lpaat1-1基因组基因座处的bjlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3ac20:1c22:1s7211;t1181;d4207-4;ph729.6921.891.795.044.50s7211;t1181;d4207-6;ph732.5520.691.564.713.68s7211;t1181;d4207-12;ph736.1617.751.513.891.83s7211;t1181;d4207-2;ph740.6916.610.943.741.58s7211;t1181;d4207-21;ph738.5317.691.153.661.47s7211;ph747.8110.210.884.271.54s7211;ph747.9610.110.904.281.55s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表78.在s3150、s7211和用psz5351(在plsc-2/lpaat1-2基因组基因座处的bjlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4212-19;ph732.1920.591.664.753.13s7211;t1181;d4212-16;ph738.6519.571.734.412.70s7211;t1181;d4212-4;ph737.2317.561.124.142.59s7211;t1181;d4212-7;ph740.9917.160.993.881.74s7211;t1181;d4212-10;ph740.3517.231.003.821.74s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表79.在s3150、s7211和用psz5298(在plsc-2/lpaat1-1基因组基因座处的bjlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表80.在s3150、s7211和用psz5352(在plsc-2/lpaat1-2基因组基因座处的bjlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4213-8;ph742.8511.601.144.562.43s7211;t1181;d4213-10;ph737.3518.741.384.042.23s7211;t1181;d4213-2;ph739.1317.391.063.842.00s7211;t1181;d4213-4;ph740.1617.181.023.831.77s7211;t1181;d4213-9;ph739.0117.521.223.861.69s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表81.在s3150、s7211和用psz5300(在plsc-2/lpaat1-1基因组基因座处的limdlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1173;d4161-1;ph738.7013.221.425.924.02s7211;t1173;d4161-10;ph734.4519.361.465.143.94s7211;t1173;d4161-2;ph739.1512.891.435.803.90s7211;t1173;d4161-9;ph733.9419.191.495.003.74s7211;t1173;d4161-5;ph734.3619.611.485.013.70s7211a;ph748.239.690.754.021.34s7211b;ph748.249.650.754.011.33s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表82.在s3150、s7211和用psz5353(在plsc-2/lpaat1-2基因组基因座处的limdlpcat1)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表83.在s3150、s7211和用psz5301(在plsc-2/lpaat1-1基因组基因座处的limdlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1173;d4162-10;ph738.4017.611.867.295.28s7211;t1173;d4162-1;ph737.7313.941.276.064.41s7211;t1173;d4162-11;ph737.2714.921.456.334.34s7211;t1173;d4162-2;ph736.2315.031.556.234.16s7211;t1173;d4162-9;ph737.9014.291.416.084.16s7211a;ph748.239.690.754.021.34s7211b;ph748.249.650.754.011.33s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00表84.在s3150、s7211和用psz5310(在plsc-2/lpaat1-2基因组基因座处的limdlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1174;d4171-11;ph726.0017.762.446.637.23s7211;t1174;d4171-3;ph732.3019.300.977.565.37s7211;t1174;d4171-9;ph736.4714.361.305.753.86s7211;t1174;d4171-12;ph737.0715.141.495.863.75s7211;t1174;d4171-2;ph739.1813.711.545.683.41s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph758.006.620.560.190.00s3150;ph557.707.080.540.110.00实例13:拟南芥pdct在高芥酸和高油酸转基因藻类中的表达在此实例中我们证实使用拟南芥磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(atpdct)基因改变用于产生富含亚油酸和/或极长链脂肪酸(vlcfa)的油的转基因藻类品系中的油的含量和组成。以质粒产生的脂肪酸并不总是可立即用于tag生物合成。二酰基甘油(dag)代表非极性与膜脂质生物合成之间的重要分枝点。dag可以经由cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt)转化为pc,并且然后经由脂肪酸去饱和酶对酰基残基进一步去饱和。存在至少两种可能的路径,从而将来自pc的酰基残基结合到tag中。首先,可以经由dag-cpt的可逆作用释放(经由水解)pc的dag部分,从而变成可用于经由dgat进行tag组装。第二种路径涉及称为磷脂酰胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(pdct)的酶。像dag-cpt一样,pdct介导磷脂酰胆碱(pc)与二酰基甘油(dag)之间的对称相互转化,从而在形成tag之前在dag池中富集pc改性的脂肪酸(c18:2和c18:3)。已经将atpdct报道为pc与dag池之间的相互转化的主要路径,而dag-cpt起较小作用。根据此信息,我们决定在藻类宿主中表达atpdct。我们在高芥酸品系s7211中表达atpdct。我们还在经典诱变的高油酸基本品系s8028中表达atpdct,该品系产生比基本品系s3150(57%)显著更多的c18:1(68%)但并不产生芥酸。s8028是根据2013年3月13日提交的共同拥有的申请号61/779,708中所披露的方法制成的品系。确切地说,s8028是具有低c16:0滴度和高c18:1的品系k的耐浅蓝菌素分离株,其根据61/779,708的实例14所制成。对atpdct的序列进行密码子优化以在桑葚型无绿藻中表达并且将其转化到s7211和s8028中。我们的结果显示atpdct在芥酸品系s7211和高油酸基本品系s8028中的表达引起亚油酸(c18:2)在单个株中的超过3倍的增强。另外,在s7211中在单个株中芥酸(c22:1)含量相对于亲本的显著增加。用于在s7211和s8028中表达拟南芥磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(atpdct)的构建体[psz5344]:构建体psz5344表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和拟南芥lpcat基因(靶向内源pmlpaat1-1基因组区域)。构建体psz5344可以被书写为plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpdct-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供如下。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的pmsad2-2启动子。atpdct的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5344中所含转化用dna的核苷酸序列:用于在s7211和s8028中表达plsc-2/pmlpaat1-2基因座处的atpdct的构建体:除了靶向在plsc-2/pmlpaat1-1基因座(psz5344)的拟南芥pdct之外,构建靶向plsc-2/lpaat1-2基因座(psz5349)的拟南芥pdct,以在s7211和s8028中表达。该构建体可以被描述为:psz5349-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atpdct-cvnr::plsc-2/lpaat1-2psz5439具有与psz5344相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向这些构建体中的相关限制性位点的基因组区域也与psz5344中相同。psz5349中所用的plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼示出如下。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5349中的plsc-2/lpaat1-25'侧翼:psz5349中的plsc-2/lpaat1-23'侧翼:为了确定它们对脂肪酸谱的影响,将上述两个构建体独立地转化到s7211和s8028中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。如上文所讨论的,s7211在ph调节的、pmsad2v-2(铵转运蛋白03)启动子的控制下表达来自海甘蓝的fae。因此亲本(s7211)和所得pdct转化的品系两者需要在ph7.0下生长以允许最大脂肪酸延长酶(fae)基因表达。将s8028及其用atpdct转化的衍生物品系在ph5.0下培养。来自用psz5344(d4205)和psz5349(d4210)转化到s7211和s8028中的一系列代表性克隆的所得谱分别示出在表85至88中。将pdct表达到藻类宿主中的期望多少增加了c18:2和/或vlcfa(在s7211中),因为我们的宿主具有中度lpcat活性,该活性通常在基本品系中产生5%-7%c18:2。然而,与我们的期望相反,在s7211和s8028二者中在plsc-2/lpaat1-1或plsc-2/lpaat1-2基因组基因座处表达pdct的品系中存在超过2.5倍的c18:2水平增加。在最佳情景下,c18:2水平的增加在s7211;t1181;d4210-10;ph7中是相对于亲本的2.85倍(27.12%对比亲本s7211的9.53%)并且在s8028;t1226;d4205-1;ph5中是3.19倍(18.76%对比亲本s8028中的5.88%)。pdct表达也导致s7211中的c22:1水平显著增加。在最佳情景下,c22:1从亲本中的1.36%增加到s7211;t1181;d4210-10;ph7中的5.04%,增加了3.7倍。在此所报道的表达pdct的品系中的c18:2增加甚至比高等植物lpcat基因在s7211中表达(早期报道)时更明显。lpcat过量表达引起c18:1辅酶a到c18:1-pc的转化增加,其随后可用于通过分别竞争fad2和fae酶活性来进一步去饱和和/或延长。由于pdct有效去除pc相关多不饱和脂肪酸以最终结合到dag池中,所以我们的结果明显表明经由宿主中的内源性dag-cpt将pc转化成dag多少是无效的。此无效性经由将高等植物pdct基因植入到藻类基因组中来去除。另外,一旦有效的pc至dag转化经由表达atpdct而发生,则这可能增加上游内源pmlpcat酶的效率并且引起c18:1辅酶a到c18:1-pc的转化增加。在此阶段,不清楚由crhfae进行的延长是否对c18:1-pc发生(与c18:1辅酶a相反),因为pmfad2-1似乎比crhfae更好地竞争底物。在具有极低fad2活性的品系中表达crhfae和atpdct将有助于理解藻类宿主中去饱和与延长之间的关系。总之,增加c18:1到c18:1-pc的转化的lpcat(上文所讨论的)和此时atpdct酶的鉴定使得我们更好地控制c18:1磷脂池,其然后可以涉及通过调节pmfad2-1活性来制备更多多不饱和脂肪酸或vlcfa。表85.在s3150、s7211和用psz5344(在plsc-2/lpaat1-1基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4205-9;ph730.0324.051.234.882.44s7211;t1181;d4205-1;ph731.2024.321.045.042.36s7211;t1181;d4205-8;ph734.9622.050.865.522.16s7211;t1181;d4205-6;ph731.6623.970.985.472.15s7211;t1181;d4205-18;ph726.9224.510.994.612.11s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00表86.在s3150、s7211和用psz5349(在plsc-2/lpaat1-2基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表87.在s8028和用psz5344(在plsc-2/lpaat1-1基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s8028;t1226;d4205-1;ph554.1918.760.710.120.00s8028;t1226;d4205-47;ph556.1418.220.790.190.00s8028;t1226;d4205-48;ph557.9816.790.560.110.00s8028;t1226;d4205-5;ph557.9316.780.610.130.00s8028;t1226;d4205-20;ph557.3916.310.570.150.00s8028(ph5);ph568.135.880.540.110.00s8028(ph5);ph568.085.850.540.150.00表88.在s8028和用psz5349(在plsc-2/lpaat1-2基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s8028;t1226;d4210-34;ph554.6117.530.850.160.00s8028;t1226;d4210-7;ph558.4317.430.500.180.00s8028;t1226;d4210-20;ph551.9517.000.600.110.00s8028;t1226;d4210-14;ph555.6516.740.770.190.00s8028;t1226;d4210-3;ph556.4216.720.650.180.00s8028(ph5);ph568.135.880.540.110.00s8028(ph5);ph568.085.850.540.150.00实例14:pdct在高亚麻酸转基因微藻中的表达在此实例中我们证实使用拟南芥磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(atpdct)基因改变用于产生富含亚油酸和/或亚麻酸的油的转基因藻类品系中的油的含量和组成。我们确定atpdct表达对于表达亚麻fad3去饱和酶的亚麻酸品系s3709中的c18:3水平的作用。根据共同拥有的申请wo2012/106560的实例11制备s3709。对atpdct进行密码子优化以在藻类宿主中表达并且将其转化到s3709中。我们的结果显示atpdct在索拉兹米(solazyme)亚麻酸品系s3709中的表达引起亚麻酸(c18:3)含量在单个株中相对于亲本增强超过2倍。用于在芥酸品系s3709中表达拟南芥磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(atpdct)的构建体[psz5344]:生成用构建体psz5344转化的s3709,其表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和拟南芥pdct基因(靶向内源pmlpaat1-1基因组区域)。被引入以在s7211中表达的构建体psz5344可以被书写为plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atpdct-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供如下。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因表达的内源桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的pmsad2-v2启动子。atpdct的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5344中所含转化用dna的核苷酸序列:除了靶向在plsc-2/pmlpaat1-1基因座(psz5344)的拟南芥pdct之外,构建靶向plsc-2/lpaat1-2基因座(psz5349)的拟南芥pdct,以在s7211中表达。这些构建体可以被描述为:psz5349-plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atpdct-cvnr::plsc-2/lpaat1-2psz5439具有与psz5344相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向这些构建体中的相关限制性位点的基因组区域也与psz5344中相同。psz5344中所用的plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼提供如下。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5349中的plsc-2/lpaat1-25'侧翼:psz5349中的plsc-2/lpaat1-23'侧翼:为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s3709中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。s3709在ph调节的、pmsad2-v2(铵转运蛋白03)的控制下表达来自亚麻的lnfad3。因此亲本(s3709)和所得pdct转化的品系两者需要在ph7.0下生长以允许最大脂肪酸去饱和酶(fad3)基因表达。来自用psz5344(d4205)和psz5349(d4210)转化到s3709中的一系列代表性克隆的所得谱分别示出在表89和90中。表达atpdct基因的单个转基因株引起超过2倍的c18:3增加(表89和90)。在s3709;t1228;d4205-36;ph7中的c18:3增加是12.17倍(14.51%),而在s3709;t1228;d4210-4;ph7中的增加是相对于亲本s3709(6.66%)的1.89倍(12.61%)。如以上实例13所讨论的,增强atpdct对pc相关多不饱和脂肪酸的去除与在我们的宿主中仅表达异源pdct的情况相比增加了c18:2含量。然而,与s3709亲本不同,并非所有可用c18:2均转化成c18:3。这最可能是由于lnfad3在s3709中的次最佳表达。由于lpcat和pdct两种酶将多不饱和物引导到dag上,所以将这两种活性组合在一起并在各种背景品系像s3709(亚麻酸品系)、s8028(高油酸基本品系)或s7211(芥酸品系)中表达它们将是有益的。表89.在s3709和用psz5344(在plsc-2/lpaat1-1基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as3709(ph7);ph71.8628.852.5457.220.426.66s3709(ph7);ph71.9029.002.5456.890.456.81s3709;t1228;d4205-36;ph72.6232.742.4838.677.1214.51s3709;t1228;d4205-1;ph71.9427.622.5745.099.2811.53s3709;t1228;d4205-4;ph72.4229.482.1543.0310.9110.22s3709;t1228;d4205-44;ph71.8028.812.5352.843.189.20s3709;t1228;d4205-33;ph72.0631.792.7552.210.079.17表90.在s3709和用psz5349(在plsc-2/lpaat1-2基因组基因座处的atpdct)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as3709(ph7);ph71.8628.852.5457.220.426.66s3709(ph7);ph71.9029.002.5456.890.456.81s3709;t1228;d4210-4;ph72.1126.682.5950.054.0012.61s3709;t1228;d4210-36;ph71.9729.442.8545.406.6711.93s3709;t1228;d4210-11;ph71.9227.352.5348.826.1910.98s3709;t1228;d4210-38;ph72.1829.202.3645.089.829.25s3709;t1228;d4210-43;ph71.9728.812.4746.389.579.21实例15:dag-cpt在高芥酸转基因微藻中的表达在此实例中我们证实使用高等植物cdp-胆碱:1,2-sn-二酰基甘油胆碱磷酸转移酶(dag-cpt)基因改变用于产生富含亚油酸和/或极长链脂肪酸(vlcfa)的油的转基因藻类品系中的油的含量和组成。我们使用公共数据库中可用的拟南芥atdag-cpt(np_172813)鉴定来自芜菁和芥菜的内部组装转录组的相应dag-cpt基因。所有内部鉴定的基因(brdag-cpt和bjdag-cpt)的密码子优化的序列连同atdag-cpt基因均在品系s7211中表达。s7211的制备是如上文所讨论的。我们的结果显示dag-cpt基因在索拉兹米芥酸品系s7211中的的表达引起亚油酸(c18:2)和芥酸(c22:1)含量在单个株中相对于在亲本中增强。用于在芥酸品系s7211中表达拟南芥磷脂酰胆碱二酰基甘油胆碱磷酸转移酶(atdag-cpt)的构建体[psz5295]:在此实例中,生成来自s7211的用构建体psz5295转化的转基因株。这些品系表达靶向内源pmlpaat1-1基因组区域处的卡尔酵母mel1基因和拟南芥dag-cpt基因。被引入以在s7211中表达的构建体psz5295可以被书写为plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atdag-cpt-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供如下。该构建体中的相关限制性位点以小写字母加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因表达的内源桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的pmsad2-v2启动子。atdag-cpt的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5295中所含转化用dna的核苷酸序列:用于在s7211中在plsc-2/pmlpaat1-1或plsc-2/pmlpaat1-2基因座处表达atdag-cpt、bjdag-cpt和brdag-cpt的构建体:除了靶向plsc-2/pmlpaat1-1基因座(psz5295)的拟南芥dag-cpt之外,已构建靶向plsc-2/lpaat1-2基因座(psz5305)的拟南芥dag-cpt、靶向plsc-2/pmlpaat1-1基因座(psz5345)的brdag-cpt、靶向plsc-2/pmlpaat1-2基因座(psz5350)的brdag-cpt、靶向plsc-2/pmlpaat1-1基因座(psz5347)的bjdag-cpt以及靶向plsc-2/pmlpaat1-2基因座(psz5306)的bjdag-cpt,以用于在s7211中表达。这些构建体可以被描述为:psz5305plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atdag-cpt-cvnr::plsc-2/lpaat1-2psz5345plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brdag-cpt-cvnr::plsc-2/lpaat1-1psz5306plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjdag-cpt-cvnr::plsc-2/lpaat1-2psz5347plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-bjdag-cpt-cvnr::plsc-2/lpaat1-1psz5350plsc-2/lpaat1-2::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brdag-cpt-cvnr::plsc-2/lpaat1-2所有这些构建体具有与psz5295相同的载体主链;可选择标记物、启动子以及3’utr,差别仅在于用于构建体靶向的基因组区域和/或相关dag-cpt基因。这些构建体中的相关限制性位点也与psz5295中相同。图3至图6分别指示了plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼以及brdag-cpt和bjdag-cpt基因的序列。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5305、psz5306和psz5350中的plsc-2/lpaat1-25'侧翼:psz5305、psz5306和psz5350中的plsc-2/lpaat1-23'侧翼:psz5345和psz5350中的brdag-cpt序列:psz5306和psz5347中的bjdag-cpt序列:为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s7211中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。来自由用psz5295(d4156)、psz5305(d4166)、psz5345(d4206)、psz5350(d4211)、psz5347(d4208)和psz5306(d4167)转化到由c22:1水平分选的s7211中引起的一系列代表性克隆的所得脂肪酸谱分别示出在表91至96中。将dag-cpt表达到藻类宿主中的期望可能增强了dag-酰基辅酶a从pc中的去除并引起tag中的多不饱和脂肪和/或vlcfa的增加,因为我们的宿主具有中度lpcat活性,该活性通常在基本品系中产生5%-7%c18:2。在plsc-2/lpaat1-1或plsc-2/lpaat1-2基因组基因座处的品系表达dag-cpt中获得显著和持久的c18:2和vlcfa水平增加。这些结果表明在宿主中由内源dag-cpt进行的pc到dag的转化有点低效并且可以经由将相应高等植物同源基因移植到藻类基因组中来扩增。另外,一旦有效的pc至dag转化发生,则这可能增加上游内源pmlpcat酶的效率并且引起c18:1辅酶a到c18:1-pc的转化增加。总之,增加c18:1到c18:1-pc的转化的早期讨论的lpcat和pdct以及dag-cpt酶的鉴定以及它们最终从pc移除以结合到dag中使得我们更好地控制c18:1磷脂池,其然后可以涉及通过调节pmfad2-1活性来制备更多多不饱和脂肪酸或vlcfa。表91.在s3150、s7211和用psz5295(在plsc-2/lpaat1-1基因组基因座处的atdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1172;d4156-5;ph737.4515.681.266.184.16s7211;t1172;d4156-14;ph739.2515.001.205.773.47s7211;t1172;d4156-4;ph741.7813.041.295.803.43s7211;t1172;d4156-3;ph738.6115.681.406.023.30s7211;t1172;d4156-12;ph739.8014.611.165.613.27s7211;ph748.109.650.784.031.34s7211;ph748.119.640.774.011.33s3150;ph7586.620.560.190s3150;ph557.77.080.540.110表92.在s3150、s7211和用psz5305(在plsc-2/lpaat1-2基因组基因座处的atdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1173;d4166-4;ph738.3315.161.535.643.33s7211;t1173;d4166-8;ph737.9916.121.325.533.19s7211;t1173;d4166-6;ph739.1714.891.415.543.07s7211;t1173;d4166-5;ph738.7115.111.385.452.99s7211;t1173;d4166-7;ph739.7514.341.375.362.99s7211a;ph748.239.690.754.021.34s7211b;ph748.249.650.754.011.33s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00表93.在s3150、s7211和用psz5345(在plsc-2/lpaat1-1基因组基因座处的brdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4206-13;ph747.4311.530.854.631.76s7211;t1181;d4206-15;ph745.6012.370.854.491.71s7211;t1181;d4206-12;ph747.6611.260.894.361.66s7211;t1181;d4206-5;ph746.3811.510.914.441.65s7211;t1181;d4206-7;ph746.2212.730.584.431.65s7211a;ph747.769.530.744.051.37s7211b;ph747.739.530.794.021.36s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00表94.在s3150、s7211和用psz5350(在plsc-2/lpaat1-2基因组基因座处的brdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4211-20;ph736.8415.571.696.214.09s7211;t1181;d4211-8;ph737.8714.561.906.143.92s7211;t1181;d4211-18;ph738.4914.391.585.863.67s7211;t1181;d4211-2;ph740.1214.081.655.933.57s7211;t1181;d4211-3;ph738.4515.171.365.522.94s7211;ph747.8110.210.884.271.54s7211;ph747.9610.110.904.281.55s3150;ph757.996.620.560.190s3150;ph557.77.080.540.110表95.在s3150、s7211和用psz5306(在plsc-2/lpaat1-1基因组基因座处的bjdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表96.在s3150、s7211和用psz55347(在plsc-2/lpaat1-2基因组基因座处的bjdag-cpt)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc18:1c18:2c18:3a总c20:1c22:1s7211;t1181;d4208-11;ph738.6113.921.506.214.38s7211;t1181;d4208-15;ph737.6614.220.986.043.67s7211;t1181;d4208-5;ph740.6913.041.465.553.45s7211;t1181;d4208-10;ph740.2713.431.515.943.41s7211;t1181;d4208-20;ph739.8313.841.335.132.29s7211;ph747.8110.210.884.271.54s7211;ph747.9610.110.904.281.55s3150;ph757.996.620.560.190.00s3150;ph557.707.080.540.110.00实例16:lpcat在高亚麻酸转基因微藻中的表达在此实例中我们证实使用高等植物溶血磷脂酰胆碱酰基转移酶(lpcat)基因改变用于产生富含亚油酸和/或亚麻酸的油的转基因藻类品系中的油的含量和组成。在此实例11和12中讨论了拟南芥lpcat2(atlpcat2np_176493.1)和芜菁lpcat(brlpcat)核酸序列。对atlpcat1和brlpcat两者的序列进行密码子优化以在我们的宿主表达并且在s3709中表达。在实例14中描述了s3709。我们的结果显示,异源lpcat酶s3709的表达使c18:3含量在单个株中是相对于亲本的超过两倍。用于在品系s3709中表达拟南芥溶血磷脂酰胆碱酰基转移酶-2(atlpcat2)的构建体[psz5297]:在此实例中,生成来自s3709的用构建体psz5297转化的转基因株,其表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和拟南芥lpcat2(atlpcat2)基因(靶向内源pmlpaat1-1基因组区域)。被引入以在s3709中表达的构建体psz5297可以被写成plsc-2/lpaat1-15'侧翼::pmhxt1-scarmel1-cvnr:pmsad2-2v2-atlpcat2-cvnr::plsc-2/lpaat1-13'侧翼。转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、加下划线粗体指示,并且从5’至3’端分别为bspqi、kpni、spei、snabi、ecori、spei、aflii、saci、bspqi。bspqi位点界定转化用dna的5'和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在plsc-2/lpaat1-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1启动子由小写字母、加框文本指示。mel1的起始子atg和终止子tga由大写字母斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶(nr)基因3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻的内源pmsad2-v2启动子。atlpcat2的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该基因的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr同样由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s1920plsc-2/lpaat1-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5297中所含转化用dna的核苷酸序列:用于在s3709中表达brlpcat的构建体:除了靶向在plsc-2/pmlpaat1-1基因座(psz5297)的拟南芥lpcat2之外,构建靶向plsc-2/pmlpaat1-1基因座(psz5299)的芜菁lpcat,以在s3709中表达。该构建体可以被描述为:psz5299plsc-2/lpaat1-1::pmhxt1-scarmel1-cvnr:pmsad2-2v2-brlpcat-cvnr::plsc-2/lpaat1-1psz5299具有与psz5297相同的载体主链、可选择标记物、启动子以及3’utr,差别仅在于对应的lpcat基因。这些构建体中的相关限制性位点也与psz5296中相同。图5至图4分别指示plsc-2/lpaat1-25'侧翼、plsc-2/lpaat1-23'侧翼和atlpcat1、atlpcat2、brlpcat、bjlpcat1、bjlpcat2、limdlpcat1以及limdlpcat2基因的序列。以粗体文本显示的相关限制性位点以5'-3'分别显示。brlpcat序列示出如下。psz5299中所含芜菁lpcat(brlpcat)的核苷酸序列。为了确定它们对脂肪酸谱的影响,将上述所有构建体独立地转化到s3709中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。来自用psz5297(d4158)和psz5299(d4160)转化到s3709中的一系列代表性克隆的所得脂肪酸谱分别示出在表97和98中。表达任何上述lpcat基因的所有转基因株引起c18:3的显著增加。相对于亲本s3709(6.66%),在s3709;t1228;d4158-10;ph7中的c18:3增加是1.8倍(12%),而在s3709;t1228;d4160-17;ph7中的增加是1.76倍(11.75%)。然而,与s3709亲本不同,并非所有可用c18:2均转化成c18:3,这最可能是由于bnfad3在s3709中的次最佳表达。该转化可经由优化s3709中的油菜fad3活性或者表达来自另一种高等植物像亚麻的更好fad3酶活性来进一步增强。表97.在s3709和用psz5297(在plsc-2/lpaat1-1基因组基因座处的atlpcat2)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。表98.在s3150、s7211和用psz5299(在plsc-2/lpaat1-1基因组基因座处的brlpcat)dna转化的代表性衍生物转基因株中的不饱和脂肪酸谱。样品idc14:0c16:0c18:0c18:1c18:2c18:3as3709;ph71.8628.852.5457.220.426.66s3709;ph71.9029.002.5456.890.456.81s3709;t1228;d4160-17;ph71.9829.372.7449.802.1911.75s3709;t1228;d4160-40;ph72.4128.902.0348.674.6211.54s3709;t1228;d4160-26;ph72.6429.942.1148.143.8811.53s3709;t1228;d4160-18;ph72.5730.032.0647.994.4711.26s3709;t1228;d4160-4;ph72.0331.421.9247.433.9510.89本发明所描述的实施例仅旨在示例,并且许多变化以及修改对于本领域技术人员来说应该是清楚的。所有这类变化和修改旨在处于本发明的范围之内。举例来说,在要求基因敲除的情况下,可以使用敲减技术(包括突变和如rnai或反义等抑制性物质的表达)来达到相当的结果。实例17:藻类品系和具有小于4%的饱和脂肪、小于1%的c18:2和大于90%的c18:1的油在此实例中,我们描述如下品系,其中我们经由下调内源fata或fad2活性、过量表达kasii或sad2基因来修改脂肪酸谱以使油酸累积最大化并且使总饱和物和多不饱和物最小化。所得品系(包括s8695)产生具有>94%的c18:1、<4%的总饱和物和<1%的c18:2的油。以与s8695相同的方式制备的克隆分离株s8696具有大致上相同的脂肪酸谱。通过两次连续转化产生品系s8695。首先用psz4769(fad25'1-pmhxt1v2-scarmel1-pmpgk-pmsad2-2p-pmkasii-cvnr-pmsad2-2p-pmsad2-1-cvnr-fad23')转化高油酸基本品系s7505,其中构建体破坏fad2等位基因的单个拷贝,同时过量表达桑葚型无绿藻kasii和pmsad2-1。所得品系s8045在相同条件下产生具有7.3%的总饱和物的87.3%的c18:1;s7505产生18.9%的总饱和物(表99)。随后用构建体psz5173(fata13'::crtub2-scsuc2-cvnr:crtub2-hpfad2-cvnr::fata15')转化s8045,该构建体破坏fata等位基因以进一步减少c16:0并且表达发夹fad2以减少c18:2。所得品系之一s8197产生0.5%c18:2并且总饱和物水平由于c16:0脂肪酸减少而下降至4.9%。我们还观察到尽管s8197对于蔗糖转化酶标记物而言是稳定的,但是此品系的蔗糖水解活性不太理想。然后用构建体psz5563(6sa::pmldh1-atthic-pmhsp90:crtub2-scsuc2-pmpgh-cvnr:pmsad2-2v2-oesad-cvnr::6sb)转化品系s8197,该构建体过量表达来自油橄榄的一种或多种硬脂酰-acp去饱和酶基因。此转化的目标是进一步减少总饱和物水平。为了增加品系s8197中的蔗糖水解活性,我们也在psz5563中引入了蔗糖转化酶基因的另一个拷贝。所得品系s8695产生1.6%c18:0,相比之下在s8197中产生2.1%,因此,s8695中的饱和物水平比其亲本品系s8197少约0.5%。表99.在摇瓶实验中在品系s7505、s8045、s8197和s8695之间的脂肪酸谱的比较。品系s8045的生成:品系s8045是由psz4769(fad25'1-pmhxt1v2-scarmel1-pmpgk-pmsad2-2p-pmkasii-cvnr-pmsad2-2p-pmsad2-1-cvnr-fad23')转化用高油酸基本品系s7505生成的转化子之一。psz4769转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、粗体并加下划线指示并且5’-3’对应地为bspq1、kpni、spei、snabi、bamhi、avrii、spei、clai、bamhi、spei、clai、paci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表允许经由同源重组在fad2-1基因座处靶向整合的fad2-15'基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因表达的桑葚型无绿藻hxt1启动子以加框文本指示。mel1基因的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。桑葚型无绿藻pgk3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的桑葚型无绿藻sad2-2启动子。pmkasii的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。原始小球藻s106硬脂酰基-acp去饱和酶转运肽位于起始子atg与asci位点之间。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由加框斜体文本指示的另一个桑葚型无绿藻sad2-2启动子。pmsad2-1的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由粗体小写字母文本指示的fad2-13'基因组区域。psz4769中所含转化用dna的核苷酸序列:品系s8197的生成:品系s8197是由psz5173(fata13'::crtub2-scsuc2-cvnr:crtub2-hpfad2-cvnr::fata15')转化用品系s8045生成的转化子之一。psz5173转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、粗体并加下划线指示并且5’-3’对应地分别为bspqi、kpni、asci、mfei、spei、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表允许经由同源重组在fata1基因座处靶向整合的fata13’基因组dna。沿5’到3’方向继续向前,驱动酵母蔗糖转化酶基因表达的莱氏衣藻β-微管蛋白启动子以加框文本指示。转化酶的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。普通小球藻硝酸还原酶3’utr是由小写字母加下划线文本指示,后接由加框斜体文本指示的另一种莱氏衣藻β-微管蛋白启动子。发夹fad2盒由粗体斜体指示。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由粗体小写字母文本指示的fad2-15'基因组区域。psz5173中所含转化用dna的核苷酸序列:品系s8695的生成:品系s8695是由psz5563(6sa::pmldh1-atthic-pmhsp90:crtub2-scsuc2-pmpgh-cvnr:pmsad2-2v2-oesad-cvnr::6sb)转化用品系s8197生成的转化子之一。psz5563转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、粗体并加下划线指示并且5’-3’对应地为bspqi、spei、kpni、asci、mfei、avrii、ecorv、spei、asci、clai、saci、bspqi。bspqi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表允许经由同源重组在6s基因座处靶向整合的6sa基因组dna。沿5’到3’方向继续向前,驱动拟南芥thic基因表达的桑葚型无绿藻ldh1启动子以加框文本指示。thic基因的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。桑葚型无绿藻hsp903'utr是由小写字母加下划线文本指示,后接由加框斜体文本指示的莱氏衣藻β-微管蛋白启动子。转化酶的起始子atg和终止子tga由大写字母、粗斜体指示,同时编码区以小写字母斜体指示。桑葚型无绿藻pgh3'utr是由小写字母加下划线文本指示,后接由小写字母加下划线文本指示的普通小球藻硝酸还原酶3’utr。利用由加框斜体文本指示的桑葚型无绿藻sad2-2启动子驱动油橄榄sad基因表达。oesad的起始子atg和终止子tga密码子由大写字母、粗斜体指示,同时该编码区的其余部分以粗斜体指示。原始小球藻s106硬脂酰基-acp去饱和酶转运肽位于起始子atg与asci位点之间。普通小球藻硝酸还原酶3'utr由小写字母加下划线文本指示,后接由粗体小写字母文本指示的6sb基因组区域。psz5563中所含转化用dna的核苷酸序列:实例18:酮脂酰辅酶a还原酶(kcr)、羟酰基辅酶a水合酶(hacd)和烯醇基辅酶a还原酶(ecr)的表达在此实例中,披露了参与桑葚型无绿藻(utex1435)中极长链脂肪酸生物合成的酶酮脂酰辅酶a还原酶(kcr)、羟酰基辅酶a水合酶(hacd)和烯醇基辅酶a还原酶(ecr)的表达的结果。确切地说,我们证实来自内部组装的海甘蓝转录组的异源ecr、hacd或kcr基因在solazyme芥酸品系s7211和s7708(上文讨论的)中的表达引起二十碳烯酸(c20:1)和芥酸(c22:1)增加。在以上实例中讨论了s7211和s7708的制备。高等植物和大部分其他真核生物具有用于延长脂肪酸超过c18的高度特异性延长系统。每个延长反应每次缩合两个碳,由丙二酰辅酶a缩合成酰基,接着进行还原、脱水和最终还原反应。位于胞液中的膜结合蛋白fae(或kcs)催化丙二酰辅酶a与酰基缩合。延长系统的附加组分未在高等植物中更详细表征。先前已证实异源fae在桑葚型无绿藻(wo2013/158908,通过引入结合)中的功能,此实例披露了异源kcr、hacd和ecr酶活性在已经表达功能性fae基因的品系中的表达。将拟南芥kcr、hacd和ecr蛋白质序列用作饵剂以开发来自桑葚型无绿藻的相应全长基因以及内部组装的海甘蓝、葱芥(alliariapetiolata)、erysimumallioni、心叶海甘蓝(crambecordifolia)以及金色宝石糖芥(erysimumgoldengem)转录组。已发现由桑葚型无绿藻转录组鉴定的kcr、hacd和ecr基因与其高等植物同源物具有相当大趋异性。桑葚型无绿藻和高等植物kcr、hacd和ecr蛋白质序列的序列比对示出在图3至图5中。先前,我们鉴定海甘蓝fae(kcs)为宿主中的最佳异源fae之一,并且因此我们决定对来自海甘蓝的kcr、hacd和ecr基因进行密码子优化并合成这些基因并且在s7211(海甘蓝fae品系)和s7708(银扇草fae品系)中表达这些基因。在桑葚型无绿藻kcr、hacd和ecr与对应植物序列之间的序列同一性示出在以下表100-102中。表100.表101.表102.用于在芥酸品系s7211和s7708中表达海甘蓝烯醇基辅酶a还原酶(ecr)的构建体-[psz5907]生成用psz5907转化的品系s7211和s7708,其表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和海甘蓝ecr基因(靶向内源pmfad2-1基因组区域)。被引入以在s7211和s7708中表达的构建体psz5907可以被书写为:psz5907:fad2-1-15’侧翼::pmhxt1-scarmel1-cvnr:bufferdna:pmsad2-2v2-crhecr-cvnr::fad2-13’侧翼。转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、加下划线粗体指示,并且从5’至3’端分别为ndei、kpni、spei、snabi、ecori、spei、xhoi、saci以及xbai。ndei和xbai位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在fad2-1基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1v2启动子由小写字母、加框文本指示。大写斜体表示mel1的起始子atg和终止子tga,而编码区用小写斜体表示。桑葚型无绿藻磷酸葡萄糖激酶(pgk)基因3'utr由小写下划线文本表示,随后缓冲液/间隔区-1dna序列是由小写粗体斜体文本表示。缓冲dna后紧接着是由加框斜体文本表示的桑葚型无绿藻的内源性sad2-2启动子。大写粗体斜体表示crhecr的起始子atg密码子和终止子tga密码子,而小写斜体表示该基因的其余部分。普通小球藻硝酸还原酶3’utr由小写字母加下划线文本指示,后接由粗体小写字母文本指示的s3150fad2-1基因组区域。对最终构建体进行测序以确保正确的阅读框和靶向序列。质粒psz5907中所含转化用dna的核苷酸序列:用于在s7211和s7708中表达海甘蓝羟酰基辅酶a脱水酶(hacd)和酮脂酰辅酶a还原酶(kcr)基因的构建体除了靶向fad2-1基因座(psz5909)的海甘蓝kcr,已构建靶向fad2-1基因座(psz5907)的海甘蓝ecr和靶向fad2-1基因座(psz5908)的海甘蓝hacd,以用于在s7211和s7708中表达。这些构建体可以被描述为:psz5908-fad2-1-15'::pmhxt1-scarmel1-cvnr:bufferdna:pmsad2-2v2-crhhacd-cvnr::fad2-13'psz5909-fad2-1-15'::pmhxt1-scarmel1-cvnr:bufferdna:pmsad2-2v2-crhkcr-cvnr::fad2-13'这两个构建体都具有与psz5907相同的载体主链;可选择标记物、启动子以及3’utr,除了crhecr分别被crhacd或crkcr置换外。这些构建体中的相关限制性位点也与psz5907中相同。crhhacd和crhkcr的核苷酸序列示出如下。以粗体文本显示的相关限制性位点以5'-3'分别显示。psz5908中的crhhacd基因:psz5909中的crhkcr基因:crhkcr基因在psz5909中的表达为了确定它们对脂肪酸谱的影响,将上述所有三个构建体独立地转化到s7211或s7708中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。品系s7211和s7708在ph调节的、amt03(铵转运蛋白03)启动子的控制下分别表达来自海甘蓝或银扇草的fae。因此两个亲本(s7211和s7708)和所得kcr、ecr和hacd转化的品系需要在ph7.0下生长以允许最大脂肪酸延长酶(fae)基因表达。来自用psz5907(d4905)、psz5908(d4906)和psz5909(d4907)转化到s7708和s7211中的一系列代表性克隆的所得谱分别示出在表103至105中。在s7708和s7211二者中,crhecr、crhhacd或crhkcr的表达导致c20:1和c22:1含量增加。表103.用d4905(crhecr)转化的s7708和s7211品系的脂肪酸谱。样品idc18:1c18:2c18:3αc20:1c22:1s7708;ph749.418.890.642.901.53s7211;ph746.6411.160.794.761.84s7708;t1379;d4905-9;ph743.0411.151.003.502.71s7708;t1379;d4905-35;ph752.868.210.733.341.95s7708;t1379;d4905-31;ph752.758.190.743.311.93s7708;t1379;d4905-25;ph752.728.180.733.311.89s7708;t1379;d4905-10;ph747.359.450.743.061.83s7211;t1380;d4905-4;ph747.289.200.785.262.06s7211;t1380;d4905-3;ph747.5310.420.764.971.91s7211;t1380;d4905-5;ph748.368.750.745.011.83s7211;t1380;d4905-1;ph747.438.520.774.881.75表104.用d4906(crhhacd)转化的s7708和s7211品系的脂肪酸谱。样品idc18:1c18:2c18:3αc20:1c22:1s7708;ph749.418.890.642.901.53s7211;ph746.6411.160.794.761.84s7708;t1379;d4906-2;ph746.838.680.653.872.20s7708;t1379;d4906-7;ph750.826.780.603.822.00s7708;t1379;d4906-4;ph747.888.640.613.561.99s7708;t1379;d4906-8;ph749.996.970.643.701.97s7708;t1379;d4906-11;ph749.836.960.623.621.91s7211;t1380;d4906-2;ph745.588.950.815.872.40s7211;t1380;d4906-1;ph745.738.900.805.722.28s7211;t1380;d4906-3;ph746.9110.220.805.021.90s7211;t1380;d4906-4;ph746.6810.610.774.771.77表105.用d4907(crhkcr)转化的s7708和s7211品系的脂肪酸谱。样品idc18:1c18:2c18:3αc20:1c22:1s7708;ph749.418.890.642.901.53s7211;ph746.6411.160.794.761.84s7708;t1379;d4907-7;ph746.119.620.623.932.86s7708;t1379;d4907-6;ph747.529.090.624.072.60s7708;t1379;d4907-2;ph749.276.820.624.152.57s7708;t1379;d4907-4;ph749.456.750.594.082.47s7708;t1379;d4907-9;ph748.058.990.623.812.32s7211;t1380;d4907-7;ph745.618.940.855.912.66s7211;t1380;d4907-6;ph746.738.710.795.902.46s7211;t1380;d4907-3;ph744.9410.980.815.492.44s7211;t1380;d4907-2;ph747.548.730.755.852.42s7211;t1380;d4907-4;ph746.589.110.765.762.41实例19:酰基辅酶a羧化酶(acc酶)的表达在此实例中,我们证实上调芥酸品系s7708和s8414中的胞质同聚酰基辅酶a羧化酶(acc酶)引起所得转基因品系中的c22:1含量的三倍或更多倍的增加。s7708是表达如上文所讨论的银扇草延长酶并根据共同拥有的wo2013/158938制备的品系。品系s8414是表达海甘蓝脂肪酸延长酶/3-酮脂酰辅酶a合酶(fae/kcs)的分离株并且与s7211(实例10)重组地相同。在微藻中脂肪酸延长超过c18需要四种关键性胞质/er酶的协同作用,这些酶为酮酰基co-a合酶(kcs,又称为脂肪酸延长酶,fae)、酮脂酰辅酶a还原酶(kcr)、羟酰基辅酶a水合酶(hacd)和烯醇基辅酶a还原酶(ecr)。每个延长反应每次缩合两个碳,由丙二酰辅酶a缩合成酰基,接着进行还原、脱水和最终还原反应。kcs(或fae)催化丙二酰辅酶a与酰基引物缩合。丙二酰辅酶a经由多结构域胞质同聚acc酶对胞质酰基辅酶a的不可逆羧化来生成。对于有效和持续的脂肪酸延长,足够的丙二酰辅酶a的不可用性可能变成瓶颈。在微藻细胞中,丙二酰辅酶a也用于产生黄酮类(falvonoid)、花青素、丙二酸d-氨基酸和丙二酰氨基环丙烷甲酸,这进一步降低其用于脂肪酸延长的可用性。使用生物信息学途径,鉴定桑葚型无绿藻中的acc酶的两个等位基因。pmacc酶1-1编码2250个氨基酸的蛋白质,而pmacc酶1-2编码2540个氨基酸的蛋白质。pmacc酶1-1和pmacc酶1-2的成对蛋白质比对示出在图6a和图6b中。给定蛋白质的大尺寸,我们决定用s7708和s8414中的强ph可调节铵转运蛋白3(pmamt03)启动子劫持内源acc酶启动子。“启动子劫持”经由将amt03启动子插入在s7708和s8414中的内源pmaccc酶1-1或pmacc酶1-2启动子与pmacc酶1-1或pmacc酶1-2蛋白质的起始密码子之间,从而破坏内源启动子并用桑葚型无绿藻amt03启动子替代它来实现。这引起由amt03启动子而非内源启动子驱动的桑葚型无绿藻acc酶的表达。在s7708转基因中,lafae和劫持的acc酶由amt03启动子驱动。amt03启动子是驱动在ph7下的表达以及在ph5下表达最少的启动子。在s8414中,crhfae由pmsad2-2v2启动子驱动,该启动子并非ph调节型启动子,并且因此pmacc酶的作用可以容易经由在ph7下运行脂质测定来监测。桑葚型无绿藻acc酶1-1和桑葚型无绿藻acc酶1-2的氨基酸比对示出在图6a和图6b中。桑葚型无绿藻acc酶1-1和a-2之间的序列同一性是92.3%。用于在芥酸品系s7708中上调桑葚型无绿藻酰基辅酶a羧化酶(pmacc酶)的构建体是psz5391。生成用psz5391转化的品系s7708,其表达卡尔酵母mel1基因(允许其在含有蜜二糖的培养基上选择和生长)和由pmamt03启动子驱动的上调的桑葚型无绿藻acc酶。被引入以在s7708中表达的构建体psz5391可以被书写为:pmacc酶1-1::pmhxt1v2-scarmel1-pmpgk:bdna:pmamt03::pmacc酶1-1。转化用dna的序列提供如下。构建体中的相关限制性位点以小写字母、加下划线粗体指示,并且从5’至3’端分别为bsabi、kpni、spei、snabi、bamhi、ecori、spei以及sbfi。basbi和sbfi位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在acc酶基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动卡尔酵母mel1基因(编码将蜜二糖代谢转化成葡萄糖和半乳糖所需要的α半乳糖苷酶活性)表达的内源性桑葚型无绿藻己糖转运蛋白1v2启动子由由小写字母、加框文本指示。大写斜体表示mel1的起始子atg和终止子tga,而编码区用小写斜体表示。桑葚型无绿藻磷酸葡萄糖激酶(pgk)基因3'utr由小写下划线文本表示,随后缓冲液/间隔区-1dna序列是由小写粗体斜体文本表示。缓冲dna后紧接着是由加框小写字母文本指示的桑葚型无绿藻的内源amt03启动子,后接由粗体小写字母文本指示的pmaccc酶1-1基因组区域。大写字母粗体斜体指示由前述pmamt03启动子上调所靶向的内源pmacc酶1-1基因的起始atg。对最终构建体进行测序以确保正确的阅读框和靶向序列。转化到s7708中的质粒psz5391所含转化用dna的核苷酸序列:除了上文所述的psz5931之外,已构建使用用于转化到s7708或s8414中的pmamt03劫持的pmacc酶1-2启动子的构建体。这些构建体描述为:psz5932-pmaccase1-2::pmhxt1v2-scarmel1-pmpgk-bdna:bdna:pmamt03::pmaccase1-2psz6106-pmaccase1-1::pmldh1v2p-atthic(l337m)-pmhsp90-bdna:pmamt03::pmaccase1-1psz6107-pmaccase1-2::pmldh1v2p-atthic(l337m)-pmhsp90-bdna:pmamt03::pmaccase1-2psz5932具有与psz5931相同的载体主链、可选择标记物、启动子以及3’utr,差别仅在于用于整合的pmacc酶侧翼。psz5931靶向pmacc酶1-1,而psz5932靶向pmacc酶1-2基因组基因座。pmacc酶1-25’侧翼和pmacc酶1-23’侧翼的核苷酸序列示出如下。以加下划线粗体文本显示的相关限制性位点以5'-3'分别显示。分别转化到s7708和s8414中的质粒psz5392和psz6107所含pmaccase5’侧翼的核苷酸序列:分别转化到s7708和s8414中的质粒psz5392和psz6107所含pmaccase3’侧翼的核苷酸序列:psz6106与psz5931相同,而psz6107与psz5932相同,除了可选择标记模块。psz5931和psz5932二者使用由pmhxt1v2启动子驱动的卡尔酵母mel1和pmpgkas3'utr作为可选择标记模块,而psz5073和psz5074使用由pmldh1启动子驱动的拟南芥thic和pmhsp903'utr。psz6106和psz6107中所含pmldh1启动子、atthic基因和pmhsp903'utr的核苷酸序列示出如下。转化到s8414中的psz6106和psz6107所含pmldh1启动子(加框小写字母文本)、cpsad转运肽(加下划线小写字母文本)和atthic-l337m(小写字母斜体文本)基因以及pmhsp903'utr(大写字母文本)的核苷酸序列。以粗体加下划线文本显示的沿5'-3’方向的限制性位点分别为kpni、nhei、asci、snabi以及bamhi。为了确定其对脂肪酸谱的影响,将上文所述的构建体独立地转化到s7708(psz5391;d4383和psz5392;d4384)或s8414(psz6106;d5073和psz6107;d5074)中。将初级转化子以克隆方式纯化并使其在ph7.0下于标准脂质产生条件下生长。选择ph7以允许由ph调节的amt03(铵转运蛋白03)启动子上调的pmacc酶1-1或pmacc酶1-2基因的最大表达。来自用psz5391(d4383)、psz5392(d4384)、psz6106(d5073)和psz6107(d5074)转化的一系列代表性克隆的所得谱示出在以下表106至110中。表106.代表性s7708和用d4383转化的品系的脂肪酸谱(psz5391-pmacc酶1-1上调)。表107.代表性s7708和用d4383转化的品系的主要脂肪酸谱(psz5392-pmacc酶1-2上调)。d4383-1(7.61%c22:1)和d4384-1(6.71%c22:1)显示相对于亲本s7708的3倍c22:1水平增加。随后发现两种品系具有稳定的表型。d5073-45(13.61%c22:1)和d5074-15(9.62%c22:1)显示相对于亲本s8414(4.60%c22:1)的2.95和2.11倍c22:1水平增加。用d5073或d5074转化的所选s8414品系在ph5和ph7下运行以调节pmamt03驱动的pmacc酶1-1或pmacc酶1-2基因表达(表110)。在ph5.0下关闭pmacc酶1-1或pmacc酶1-2在所有所选品系中引起接近亲本水平的c22:1,从而确认pmacc酶上调对宿主中的极长链脂肪酸生物合成的正面影响。这些结果最后证实经由上调pmacc酶1-1或pmacc酶1-2来增加丙二酰辅酶a引起表达异源脂肪酸延长酶的桑葚型无绿藻中的极长链脂肪酸生物合成显著增加。ph5/ph7实验不能针对s7708衍生的转化子进行,因为亲本s7708中的异源lafae也由pmamt03驱动并且在ph5.0下运行这些品系也将引起延长酶关闭。表108.代表性s8414和用d5073转化的品系的脂肪酸谱(psz6106-pmacc酶1-1上调)。表109.代表性s8414和用d5074转化的品系的脂肪酸谱(psz6107-pmacc酶1-2上调)。表110.用在ph5和ph7下运行的d5073和d5074转化的所选s8414品系的脂肪酸谱。实例20:3-酮脂酰辅酶a还原酶(kcr)、烯醇基辅酶a还原酶(ecr)、羟酰基辅酶a水合酶(hacd)和乙酰辅酶a羧化酶(acc酶)的表达在此实例中,我们报道了参与桑葚型无绿藻(utex1435)中极长链脂肪酸生物合成的3-酮脂酰辅酶a还原酶(kcr)、烯醇基辅酶a还原酶(ecr)或羟酰基辅酶a水合酶(hacd)的共同表达的结果。同时我们还通过劫持pmacc酶1-1或pmacc酶1-2的启动子并用pmamt03启动子置换它来上调内源胞质同聚乙酰辅酶a羧化酶(acc酶)。我们的结果证实在s8414和s8242中将异源kcr和ecr或hacd活性与上调的内源acc酶活性组合引起所得转基因株中的c22:1水平显著增加(超过4倍)。s8414是如上文所述的。s8242经由在如实例10所讨论的s7708中表达荷包蛋花lpaat来生成。海甘蓝脂肪酸延长酶(crhfae)是无绿藻中非常有活性的fae。对编码crhkcr、crhhacd和crhecr的核酸进行密码子优化并合成这些核酸并且在s7211(crhfae品系)和s7708(银扇草fae品系)中表达它们。将密码子优化的基因克隆到适当表达载体中并且将其转化到s7708和s7211中。每个伙伴基因在s7708和s7211二者中的表达引起vlcfa生物合成改进。c22:1的增加是相对于亲本品系的1.2倍至1.9倍之间。进一步,上文讨论的是,通过上调内源pmacc酶增加丙二酰辅酶a的可用性并且这导致已经表达fae(在s7708和s8414背景中3倍或更多倍的c22:1增加)的品系中的长链脂肪酸生物合成显著增加。为了进一步增加vlcfa生物合成,我们进行以下:在已经表达fae(s8414)的品系中将kcr、ecr和hacd活性与上调的pmacc酶组合以使vlcfa生物合成最大化;以及以上活性在品系像s8242中的表达进一步增加vlcfa生物合成,因为除fae活性之外,s8242也表达偏好来自荷包蛋花的lpaat的芥酸(limdlpaat)。我们使构建体在s8414(3.3%c22:1;pmsad2-2v2-crhfae-pmhsp90)和s8242(5%-7%c22:1;pmamt03-lafae-cvnr和pmsad2-2v2-limdlpaat-cvnr)中共同表达crhkcr(由pmacpp1或pmg3pdh启动子驱动)连同crhecr或crhhacd(由pmg3pdh或pmacpp1启动子驱动)。构建体靶向pmacc酶1-1或pmacc酶1-2基因座,同时用ph可调节铵转运蛋白3(pmamt03)启动子劫持内源pmacc酶1-1或pmacc酶1-2的启动子。“启动子劫持”经由在s8414和s8242中将pmamt03启动子插入在内源pmaccc酶1-1或pmacc酶1-2启动子与pmacc酶1-1或pmacc酶1-2基因的起始密码子之间来实现。用于在芥酸品系s8414和s8242中共同表达ecr和kcr同时上调桑葚型无绿藻酰基辅酶a羧化酶(pmacc酶)的构建体-[pszpsz6114)用构建体psz6114转化s8414和s8242品系,其表达由pmldh1v2启动子驱动的(允许其在没有硫胺素的培养基上选择和生长)拟南芥thic基因的突变体版本(l337m)、由pmacpp1启动子驱动的crhecr、由pmg3pdh启动子驱动的crhkcr以及由pmamt03启动子(启动子劫持)驱动的内源桑葚型无绿藻acc酶。构建体psz5391是上文所述的。用于在s8414和s8242中表达的构建体psz6114可以被书写为:pmaccase1-1::pmldh1v2p-atthic(l337m):pmhsp90:bdna:pmacpp1-crhecr-cvnr:pmg3pdh-crhkcrcvnr:pmamt03::pmaccase1-1。转化用dna(psz6114)的序列提供如下。构建体中的相关限制性位点以小写字母、加下划线粗体指示,并且从5’至3’端分别为ndei、kpni、ncoi、snabi、bamhi、ecori、spei、xhoi、xbai、spei、xhoi、ecorv、spei以及sbfi。ndei和asei位点界定转化用dna的5'端和3'端。粗体、小写字母序列代表来自s3150的允许通过同源重组在acc酶基因座处靶向整合的基因组dna。沿5’到3’方向继续向前,驱动拟南芥thic表达的内源桑葚型无绿藻乳酸脱氢酶(ldh)启动子由小写字母、加框文本指示。大写斜体表示atthic的起始子atg和终止子tga,而编码区用小写斜体表示。桑葚型无绿藻热休克蛋白90(hsp90)基因3'utr由小写下划线文本表示,随后缓冲液/间隔区-1dna序列是由小写粗体斜体文本表示。缓冲dna后紧接着是由加框的小写文本表示的桑葚型无绿藻的内源酰基载体蛋白(acpp1)启动子。大写斜体表示海甘蓝烯醇基辅酶a还原酶(crhecr)基因的起始子atg和终止子tga,而编码区用小写斜体表示。普通小球藻硝酸还原酶(cvnr)基因3’utr由小写字母加下划线文本指示,后接由小写字母加框文本指示的内源g3pdh启动子。大写斜体表示海甘蓝酮脂酰辅酶a还原酶(crhkcr)基因的起始子atg和终止子tga,而编码区用小写斜体表示。普通小球藻硝酸盐还原酶(cvnr)基因3’utr由小写字母加下划线文本指示。cvnr3‘utr后紧接着是由加框小写字母文本指示的桑葚型无绿藻的内源amt03启动子,后接由粗体小写字母文本指示的pmaccc酶1-1基因组区域。大写字母粗体斜体指示由前述pmamt03启动子上调所靶向的内源pmacc酶1-1基因的起始atg。对最终构建体进行测序以确保正确的阅读框和靶向序列。转化到s8414和s8242中的质粒psz6114所含转化用dna的核苷酸序列:除了靶向pmacc酶1-1基因座同时上调pmacc酶1-1基因(psz6114)的海甘蓝ecr和海甘蓝kcr基因之外,设计若干其他构建体以用于转化到s8414和s8242中。这些构建体可以被描述为:psz6115-pmaccase1-1::pmldh1v2p-atthic(l337m)-pmhsp90:bdna::pmacpp1-crhhacd-cvnr:pmg3pdh-crhkcr-cvnr:pmamt03::pmaccase1-1psz6116-pmaccase1-1::pmldh1v2p-atthic(l337m)-pmhsp90;bdna::pmg3pdh-crhecr-cvnr:pmacpp1-crhkcr-cvnr:pmamt03::pmaccase1-1psz6117-pmaccase1-1::pmldh1v2p-atthic(l337m)-pmhsp90:bdna::pmg3pdh-crhhacd-cvnr:pmacpp1-crhkcr-cvnr:pmamt03::pmaccase1-1psz6118-pmaccase1-2::pmldh1v2p-atthic(l337m):pmhsp90:bdna:pmacpp1-crhecr-cvnr:pmg3pdh-crhkcr-cvnr:pmamt03::pmaccase1-2psz6119-pmaccase1-2::pmldh1v2p-atthic(l337m)-pmhsp90:bdna::pmacpp1-crhhacd-cvnr:pmg3pdh-crhkcr-cvnr:pmamt03::pmaccase1-2psz6120-pmaccase1-2::pmldh1v2p-atthic(l337m)-pmhsp90:bdna::pmg3pdh-crhhacd-cvnr:pmacpp1crhkcr-cvnr:pmamt03::pmaccase1-2psz6115在每个方面都类似于psz6114,除了由pmacpp1启动子驱动的基因外。在psz6115中,pmacpp1启动子驱动crhhacd基因表达,而在psz6114中,其驱动crhecr的表达。crhhacd的核苷酸序列示出如下。psz6116与psz6114的差别在于crhecr由pmg3pdh驱动并且crhkcr由pmacpp1启动子驱动,而这在psz6114中是相反的。类似地,psz6118类似于psz6116,除了crhhacd由pmg3pdh驱动并且crhkcr由pmacpp1启动子驱动,而这在psz6115中是相反的。psz6118、psz6119和psz6120分别与psz6114、psz6115和psz6117相同,除了前面的构建体靶向pmacc酶1-2基因座而后面的构建体靶向pmacc酶1-1基因座。用于在psz6118、psz6119和psz6120中靶向的pmaccase1-25侧翼和pmaccase1-23’侧翼序列示出如下。由pmamt03上调的内源pmacc酶1-2的起始子atg以大写粗体和斜体字母指示。以加下划线粗体文本显示的相关限制性位点以5'-3'分别显示。pss6115、psz6117、psz6119和psz61120中的crhhacd基因的核苷酸序列:质粒psz6118、psz6119和psz6120分别含有的pmacc酶5'侧翼的核苷酸序列:质粒psz6118、psz6119和psz6120所含有的pmacc酶3'侧翼的核苷酸序列:为了确定它们对脂肪酸谱的影响,将上述构建体独立地转化到s8414和s8242中。对主要转化子进行克隆纯化并且使其在标准脂质产生条件下在ph7.0下生长。选择ph7以允许由ph调节的amt03(铵转运蛋白03)启动子上调的pmacc酶1-1或pmacc酶1-2基因的最大表达。来自用psz6114(d5062)、psz6115(d5063)、psz6116(d5064)、psz6117(d5065)、psz6118(d5066)、psz6119(d5067)以及psz6120(d5068)转化到s8414和s8242中的一系列代表性克隆的所得谱示出在表111-117中。在s8414和s8242两者的背景下表达crhecr和crhkcr或crhhacd和crkkcr与上调的pmacc酶1-1或pmacc酶1-2的组合的所有转基因株中,存在c22:1水平的显著增加。在s8414背景中,品系s8414;t1435;d5062-6(18.92%)、s8414;t1435;d5063-5(18.36%)、s8414、t1439、d5065-4(19.15%),c22:1水平的增加分别是相对于亲本s8414(4.69%)的4.03倍、3.91倍和4.08倍。对于s8242、t1439;d5063-7(20.47%)和s8242、t1439;d5065-2(18.21%)同样如此,其中c22:1的增加分别是相对于亲本s8242(5.03%)的4.06倍和3.62倍。用d5062、d5063、d5064、d5065、d5066、d5067或d5068转化的所选s8414品系在ph5和ph7下运行以调节pmamt03驱动的pmacc酶1-1或pmacc酶1-2基因表达(表118)。通过在ph5.0下培养来降低pmacc酶1-1或pmacc酶1-2的表达引起所有所选品系中的c22:1显著降低(2.5倍或更多倍的降低),从而确认pmacc酶上调对宿主中的极长链脂肪酸生物合成(vlcfa)的贡献。然而几乎在所有品系中降低的c22:1水平大于亲本s8414中的水平,从而证实异源kcr和ecr或hacd在桑葚型无绿藻中的的vlcfa生物合成方面的影响(与s7708背景中的结果一致-早期ip实例)。本文所披露的结果证实经由上调pmacc酶1-1或pmacc酶1-2连同异源kcr和ecr或hacd酶的组合表达增加可用丙二酰辅酶a引起已经表达异源脂肪酸延长酶的桑葚型无绿藻中的vlcfa生物合成的显著增加。表111.代表性s8414和用d5062(psz6114)转化的s8242品系的脂肪酸谱。表112.代表性s8414和用d5063(psz6115)转化的s8242品系的主要3-日脂肪酸谱。表113.代表性s8414和用d5064(psz6116)转化的s8242品系的主要3-日脂肪酸谱。表114.代表性s8414和用d5065(psz6117)转化的s8242品系的主要3-日脂肪酸谱。表115.代表性s8414和用d5066(psz6118)转化的s8242品系的主要3-日脂肪酸谱。表116.代表性s8414和用d5067(psz6119)转化的s8242品系的主要3-日脂肪酸谱。表117.代表性s8414和用d5068(psz6120)转化的s8242品系的主要3-日脂肪酸谱。表118.在ph5和ph7下运行的用d5062-d5068转化的所选s8414品系的3-日脂肪酸谱。序列seqidno:16s5'基因组供体序列gctcttcgccgccgccactcctgctcgagcgcgcccgcgcgtgcgccgccagcgccttggccttttcgccgcgctcgtgcgcgtcgctgatgtccatcaccaggtccatgaggtctgccttgcgccggctgagccactgcttcgtccgggcggccaagaggagcatgagggaggactcctggtccagggtcctgacgtggtcgcggctctgggagcgggccagcatcatctggctctgccgcaccgaggccgcctccaactggtcctccagcagccgcagtcgccgccgaccctggcagaggaagacaggtgaggggggtatgaattgtacagaacaaccacgagccttgtctaggcagaatccctaccagtcatggctttacctggatgacggcctgcgaacagctgtccagcgaccctcgctgccgccgcttctcccgcacgcttctttccagcaccgtgatggcgcgagccagcgccgcacgctggcgctgcgcttcgccgatctgaggacagtcggggaactctgatcagtctaaacccccttgcgcgttagtgttgccatcctttgcagaccggtgagagccgacttgttgtgcgccaccccccacaccacctcctcccagaccaattctgtcacctttttggcgaaggcatcggcctcggcctgcagagaggacagcagtgcccagccgctgggggttggcggatgcacgctcaggtaccseqidno:26s3'基因组供体序列gagctccttgttttccagaaggagttgctccttgagcctttcattctcagcctcgataacctccaaagccgctctaattgtggagggggttcgaatttaaaagcttggaatgttggttcgtgcgtctggaacaagcccagacttgttgctcactgggaaaaggaccatcagctccaaaaaacttgccgctcaaaccgcgtacctctgctttcgcgcaatctgccctgttgaaatcgccaccacattcatattgtgacgcttgagcagtctgtaattgcctcagaatgtggaatcatctgccccctgtgcgagcccatgccaggcatgtcgcgggcgaggacacccgccactcgtacagcagaccattatgctacctcacaatagttcataacagtgaccatatttctcgaagctccccaacgagcacctccatgctctgagtggccaccccccggccctggtgcttgcggagggcaggtcaaccggcatggggctaccgaaatccccgaccggatcccaccacccccgcgatgggaagaatctctccccgggatgtgggcccaccaccagcacaacctgctggcccaggcgagcgtcaaaccataccacacaaatatccttggcatcggccctgaattccttctgccgctctgctacccggtgcttctgtccgaagcaggggttgctagggatcgctccgagtccgcaaacccttgtcgcgtggcggggcttgttcgagcttgaagagcseqidno:3酿酒酵母转化酶蛋白质序列mllqaflfllagfaakisasmtnetsdrplvhftpnkgwmndpnglwydekdakwhlyfqynpndtvwgtplfwghatsddltnwedqpiaiapkrndsgafsgsmvvdynntsgffndtidprqrcvaiwtyntpeseeqyisysldggytfteyqknpvlaanstqfrdpkvfwyepsqkwimtaaksqdykieiyssddlkswklesafanegflgyqyecpglievpteqdpsksywvmfisinpgapaggsfnqyfvgsfngthfeafdnqsrvvdfgkdyyalqtffntdptygsalgiawasnweysafvptnpwrssmslvrkfslnteyqanpetelinlkaepilnisnagpwsrfatnttltkansynvdlsnstgtlefelvyavnttqtisksvfadlslwfkgledpeeylrmgfevsassffldrgnskvkfvkenpyftnrmsvnnqpfksendlsyykvyglldqnilelyfndgdvvstntyfmttgnalgsvnmttgvdnlfyidkfqvrevkseqidno:4针对在桑葚型无绿藻(utex1435)中表达进行密码子优化的酿酒酵母转化酶蛋白质编码序列atgctgctgcaggccttcctgttcctgctggccggcttcgccgccaagatcagcgcctccatgacgaacgagacgtccgaccgccccctggtgcacttcacccccaacaagggctggatgaacgaccccaacggcctgtggtacgacgagaaggacgccaagtggcacctgtacttccagtacaacccgaacgacaccgtctgggggacgcccttgttctggggccacgccacgtccgacgacctgaccaactgggaggaccagcccatcgccatcgccccgaagcgcaacgactccggcgccttctccggctccatggtggtggactacaacaacacctccggcttcttcaacgacaccatcgacccgcgccagcgctgcgtggccatctggacctacaacaccccggagtccgaggagcagtacatctcctacagcctggacggcggctacaccttcaccgagtaccagaagaaccccgtgctggccgccaactccacccagttccgcgacccgaaggtcttctggtacgagccctcccagaagtggatcatgaccgcggccaagtcccaggactacaagatcgagatctactcctccgacgacctgaagtcctggaagctggagtccgcgttcgccaacgagggcttcctcggctaccagtacgagtgccccggcctgatcgaggtccccaccgagcaggaccccagcaagtcctactgggtgatgttcatctccatcaaccccggcgccccggccggcggctccttcaaccagtacttcgtcggcagcttcaacggcacccacttcgaggccttcgacaaccagtcccgcgtggtggacttcggcaaggactactacgccctgcagaccttcttcaacaccgacccgacctacgggagcgccctgggcatcgcgtgggcctccaactgggagtactccgccttcgtgcccaccaacccctggcgctcctccatgtccctcgtgcgcaagttctccctcaacaccgagtaccaggccaacccggagacggagctgatcaacctgaaggccgagccgatcctgaacatcagcaacgccggcccctggagccggttcgccaccaacaccacgttgacgaaggccaacagctacaacgtcgacctgtccaacagcaccggcaccctggagttcgagctggtgtacgccgtcaacaccacccagacgatctccaagtccgtgttcgcggacctctccctctggttcaagggcctggaggaccccgaggagtacctccgcatgggcttcgaggtgtccgcgtcctccttcttcctggaccgcgggaacagcaaggtgaagttcgtgaaggagaacccctacttcaccaaccgcatgagcgtgaacaaccagcccttcaagagcgagaacgacctgtcctactacaaggtgtacggcttgctggaccagaacatcctggagctgtacttcaacgacggcgacgtcgtgtccaccaacacctacttcatgaccaccgggaacgccctgggctccgtgaacatgacgacgggggtggacaacctgttctacatcgacaagttccaggtgcgcgaggtcaagtgaseqidno:5莱氏衣藻tub2(b-tub)启动子/5’utrctttcttgcgctatgacacttccagcaaaaggtagggcgggctgcgagacggcttcccggcgctgcatgcaacaccgatgatgcttcgaccccccgaagctccttcggggctgcatgggcgctccgatgccgctccagggcgagcgctgtttaaatagccaggcccccgattgcaaagacattatagcgagctaccaaagccatattcaaacacctagatcactaccacttctacacaggccactcgagcttgtgatcgcactccgctaagggggcgcctcttcctcttcgtttcagtcacaacccgcaaacseqidno:6普通小球藻硝酸还原酶3'utrgcagcagcagctcggatagtatcgacacactctggacgctggtcgtgtgatggactgttgccgccacacttgctgccttgacctgtgaatatccctgccgcttttatcaaacagcctcagtgtgtttgatcttgtgtgtacgcgcttttgcgagttgctagctgcttgtgctatttgcgaataccacccccagcatccccttccctcgtttcatatcgcttgcatcccaaccgcaacttatctacgctgtcctgctatccctcagcgctgctcctgctcctgctcactgcccctcgcacagccttggtttgggctccgcctgtattctcctggtactgcaacctgtaaaccagcactgcaatgctgatgcacgggaagtagtgggatgggaacacaaatggaaagcttseqidno:7具有酿酒酵母suc2基因以及莱氏衣藻β-微管蛋白启动子/5’utr和普通小球藻硝酸还原酶3'utr的密码子优化的表达盒的核苷酸序列ctttcttgcgctatgacacttccagcaaaaggtagggcgggctgcgagacggcttcccggcgctgcatgcaacaccgatgatgcttcgaccccccgaagctccttcggggctgcatgggcgctccgatgccgctccagggcgagcgctgtttaaatagccaggcccccgattgcaaagacattatagcgagctaccaaagccatattcaaacacctagatcactaccacttctacacaggccactcgagcttgtgatcgcactccgctaagggggcgcctcttcctcttcgtttcagtcacaacccgcaaacggcgcgccatgctgctgcaggccttcctgttcctgctggccggcttcgccgccaagatcagcgcctccatgacgaacgagacgtccgaccgccccctggtgcacttcacccccaacaagggctggatgaacgaccccaacggcctgtggtacgacgagaaggacgccaagtggcacctgtacttccagtacaacccgaacgacaccgtctgggggacgcccttgttctggggccacgccacgtccgacgacctgaccaactgggaggaccagcccatcgccatcgccccgaagcgcaacgactccggcgccttctccggctccatggtggtggactacaacaacacctccggcttcttcaacgacaccatcgacccgcgccagcgctgcgtggccatctggacctacaacaccccggagtccgaggagcagtacatctcctacagcctggacggcggctacaccttcaccgagtaccagaagaaccccgtgctggccgccaactccacccagttccgcgacccgaaggtcttctggtacgagccctcccagaagtggatcatgaccgcggccaagtcccaggactacaagatcgagatctactcctccgacgacctgaagtcctggaagctggagtccgcgttcgccaacgagggcttcctcggctaccagtacgagtgccccggcctgatcgaggtccccaccgagcaggaccccagcaagtcctactgggtgatgttcatctccatcaaccccggcgccccggccggcggctccttcaaccagtacttcgtcggcagcttcaacggcacccacttcgaggccttcgacaaccagtcccgcgtggtggacttcggcaaggactactacgccctgcagaccttcttcaacaccgacccgacctacgggagcgccctgggcatcgcgtgggcctccaactgggagtactccgccttcgtgcccaccaacccctggcgctcctccatgtccctcgtgcgcaagttctccctcaacaccgagtaccaggccaacccggagacggagctgatcaacctgaaggccgagccgatcctgaacatcagcaacgccggcccctggagccggttcgccaccaacaccacgttgacgaaggccaacagctacaacgtcgacctgtccaacagcaccggcaccctggagttcgagctggtgtacgccgtcaacaccacccagacgatctccaagtccgtgttcgcggacctctccctctggttcaagggcctggaggaccccgaggagtacctccgcatgggcttcgaggtgtccgcgtcctccttcttcctggaccgcgggaacagcaaggtgaagttcgtgaaggagaacccctacttcaccaaccgcatgagcgtgaacaaccagcccttcaagagcgagaacgacctgtcctactacaaggtgtacggcttgctggaccagaacatcctggagctgtacttcaacgacggcgacgtcgtgtccaccaacacctacttcatgaccaccgggaacgccctgggctccgtgaacatgacgacgggggtggacaacctgttctacatcgacaagttccaggtgcgcgaggtcaagtgacaattggcagcagcagctcggatagtatcgacacactctggacgctggtcgtgtgatggactgttgccgccacacttgctgccttgacctgtgaatatccctgccgcttttatcaaacagcctcagtgtgtttgatcttgtgtgtacgcgcttttgcgagttgctagctgcttgtgctatttgcgaataccacccccagcatccccttccctcgtttcatatcgcttgcatcccaaccgcaacttatctacgctgtcctgctatccctcagcgctgctcctgctcctgctcactgcccctcgcacagccttggtttgggctccgcctgtattctcctggtactgcaacctgtaaaccagcactgcaatgctgatgcacgggaagtagtgggatgggaacacaaatggaggatccseqidno:8桑葚型无绿藻(utex1435)amt03启动子ggccgacaggacgcgcgtcaaaggtgctggtcgtgtatgccctggccggcaggtcgttgctgctgctggttagtgattccgcaaccctgattttggcgtcttattttggcgtggcaaacgctggcgcccgcgagccgggccggcggcgatgcggtgccccacggctgccggaatccaagggaggcaagagcgcccgggtcagttgaagggctttacgcgcaaggtacagccgctcctgcaaggctgcgtggtggaattggacgtgcaggtcctgctgaagttcctccaccgcctcaccagcggacaaagcaccggtgtatcaggtccgtgtcatccactctaaagagctcgactacgacctactgatggccctagattcttcatcaaaaacgcctgagacacttgcccaggattgaaactccctgaagggaccaccaggggccctgagttgttccttccccccgtggcgagctgccagccaggctgtacctgtgatcgaggctggcgggaaaataggcttcgtgtgctcaggtcatgggaggtgcaggacagctcatgaaacgccaacaatcgcacaattcatgtcaagctaatcagctatttcctcttcacgagctgtaattgtcccaaaattctggtctaccgggggtgatccttcgtgtacgggcccttccctcaaccctaggtatgcgcgcatgcggtcgccgcgcaactcgcgcgagggccgagggtttgggacgggccgtcccgaaatgcagttgcacccggatgcgtggcaccttttttgcgataatttatgcaatggactgctctgcaaaattctggctctgtcgccaaccctaggatcagcggcgtaggatttcgtaatcattcgtcctgatggggagctaccgactaccctaatatcagcccgactgcctgacgccagcgtccacttttgtgcacacattccattcgtgcccaagacatttcattgtggtgcgaagcgtccccagttacgctcacctgtttcccgacctccttactgttctgtcgacagagcgggcccacaggccggtcgcagccseqidno:9针对在桑葚型无绿藻中表达进行密码子优化的原始小球藻(utex250)硬脂酰基acp去饱和酶转运肽cdna序列actagtatggccaccgcatccactttctcggcgttcaatgcccgctgcggcgacctgcgtcgctcggcgggctccgggccccggcgcccagcgaggcccctccccgtgcgcgggcgcgccseqidno:10赖特萼距花fatb2硫酯酶核酸序列;基因库登录号u56104atggtggtggccgccgccgccagcagcgccttcttccccgtgcccgccccccgccccacccccaagcccggcaagttcggcaactggcccagcagcctgagccagcccttcaagcccaagagcaaccccaacggccgcttccaggtgaaggccaacgtgagcccccacgggcgcgcccccaaggccaacggcagcgccgtgagcctgaagtccggcagcctgaacaccctggaggacccccccagcagcccccccccccgcaccttcctgaaccagctgcccgactggagccgcctgcgcaccgccatcaccaccgtgttcgtggccgccgagaagcagttcacccgcctggaccgcaagagcaagcgccccgacatgctggtggactggttcggcagcgagaccatcgtgcaggacggcctggtgttccgcgagcgcttcagcatccgcagctacgagatcggcgccgaccgcaccgccagcatcgagaccctgatgaaccacctgcaggacaccagcctgaaccactgcaagagcgtgggcctgctgaacgacggcttcggccgcacccccgagatgtgcacccgcgacctgatctgggtgctgaccaagatgcagatcgtggtgaaccgctaccccacctggggcgacaccgtggagatcaacagctggttcagccagagcggcaagatcggcatgggccgcgagtggctgatcagcgactgcaacaccggcgagatcctggtgcgcgccaccagcgcctgggccatgatgaaccagaagacccgccgcttcagcaagctgccctgcgaggtgcgccaggagatcgccccccacttcgtggacgccccccccgtgatcgaggacaacgaccgcaagctgcacaagttcgacgtgaagaccggcgacagcatctgcaagggcctgacccccggctggaacgacttcgacgtgaaccagcacgtgagcaacgtgaagtacatcggctggattctggagagcatgcccaccgaggtgctggagacccaggagctgtgcagcctgaccctggagtaccgccgcgagtgcggccgcgagagcgtggtggagagcgtgaccagcatgaaccccagcaaggtgggcgaccgcagccagtaccagcacctgctgcgcctggaggacggcgccgacatcatgaagggccgcaccgagtggcgccccaagaacgccggcaccaaccgcgccatcagcacctgaseqidno:11赖特萼距花fatb2硫酯酶氨基酸序列;基因库登录号u56104mvvaaaassaffpvpaprptpkpgkfgnwpsslsqpfkpksnpngrfqvkanvsphpkangsavslksgslntledppssppprtflnqlpdwsrlrtaittvfvaaekqftrldrkskrpdmlvdwfgsetivqdglvfrerfsirsyeigadrtasietlmnhlqdtslnhcksvgllndgfgrtpemctrdliwvltkmqivvnryptwgdtveinswfsqsgkigmgrewlisdcntgeilvratsawammnqktrrfsklpcevrqeiaphfvdappviedndrklhkfdvktgdsickgltpgwndfdvnqhvsnvkyigwilesmptevletqelcsltleyrrecgresvvesvtsmnpskvgdrsqyqhllrledgadimkgrtewrpknagtnraistseqidno:12来自psz2046的密码子优化的椰c12:0偏好型lpaat的编码区atggacgcctccggcgcctcctccttcctgcgcggccgctgcctggagtcctgcttcaaggcctccttcggctacgtaatgtcccagcccaaggacgccgccggccagccctcccgccgccccgccgacgccgacgacttcgtggacgacgaccgctggatcaccgtgatcctgtccgtggtgcgcatcgccgcctgcttcctgtccatgatggtgaccaccatcgtgtggaacatgatcatgctgatcctgctgccctggccctacgcccgcatccgccagggcaacctgtacggccacgtgaccggccgcatgctgatgtggattctgggcaaccccatcaccatcgagggctccgagttctccaacacccgcgccatctacatctgcaaccacgcctccctggtggacatcttcctgatcatgtggctgatccccaagggcaccgtgaccatcgccaagaaggagatcatctggtatcccctgttcggccagctgtacgtgctggccaaccaccagcgcatcgaccgctccaacccctccgccgccatcgagtccatcaaggaggtggcccgcgccgtggtgaagaagaacctgtccctgatcatcttccccgagggcacccgctccaagaccggccgcctgctgcccttcaagaagggcttcatccacatcgccctccagacccgcctgcccatcgtgccgatggtgctgaccggcacccacctggcctggcgcaagaactccctgcgcgtgcgccccgcccccatcaccgtgaagtacttctcccccatcaagaccgacgactgggaggaggagaagatcaaccactacgtggagatgatccacgccctgtacgtggaccacctgcccgagtcccagaagcccctggtgtccaagggccgcgacgcctccggccgctccaactcctgaseqidno:13ploop5'基因组供体序列gctcttcgctaacggaggtctgtcaccaaatggaccccgtctattgcgggaaaccacggcgatggcacgtttcaaaacttgatgaaatacaatattcagtatgtcgcgggcggcgacggcggggagctgatgtcgcgctgggtattgcttaatcgccagcttcgcccccgtcttggcgcgaggcgtgaacaagccgaccgatgtgcacgagcaaatcctgacactagaagggctgactcgcccggcacggctgaattacacaggcttgcaaaaataccagaatttgcacgcaccgtattcgcggtattttgttggacagtgaatagcgatgcggcaatggcttgtggcgttagaaggtgcgacgaaggtggtgccaccactgtgccagccagtcctggcggctcccagggccccgatcaagagccaggacatccaaactacccacagcatcaacgccccggcctatactcgaaccccacttgcactctgcaatggtatgggaaccacggggcagtcttgtgtgggtcgcgcctatcgcggtcggcgaagaccgggaaggtaccseqidno:14ploop3'基因组供体序列gagctcagcggcgacggtcctgctaccgtacgacgttgggcacgcccatgaaagtttgtataccgagcttgttgagcgaactgcaagcgcggctcaaggatacttgaactcctggattgatatcggtccaataatggatggaaaatccgaacctcgtgcaagaactgagcaaacctcgttacatggatgcacagtcgccagtccaatgaacattgaagtgagcgaactgttcgcttcggtggcagtactactcaaagaatgagctgctgttaaaaatgcactctcgttctctcaagtgagtggcagatgagtgctcacgccttgcacttcgctgcccgtgtcatgccctgcgccccaaaatttgaaaaaagggatgagattattgggcaatggacgacgtcgtcgctccgggagtcaggaccggcggaaaataagaggcaacacactccgcttcttagctcttccseqidno:15包括莱氏衣藻β-微管蛋白启动子/5’utr和普通小球藻硝酸还原酶3'utr的neor表达盒seqidno:16椰1-酰基-sn-甘油-3-磷酸酰基转移酶(lpaat)mdasgassflrgrclescfkasfgyvmsqpkdaagqpsrrpadaddfvdddrwitvilsvvriaacflsmmvttivwnmimlillpwpyarirqgnlyghvtgrmlmwilgnpitiegsefsntraiyicnhaslvdiflimwlipkgtvtiakkeiiwyplfgqlyvlanhqridrsnpsaaiesikevaravvkknlsliifpegtrsktgrllpfkkgfihialqtrlpivpmvltgthlawrknslrvrpapitvkyfspiktddweeekinhyvemihalyvdhlpesqkplvskgrdasgrsnsseqidno:17包含原始小球藻s106硬脂酰基-acp去饱和酶转运肽的pmkasii(桑葚型无绿藻kasii)atggccaccgcatccactttctcggcgttcaatgcccgctgcggcgacctgcgtcgctcggcgggctccgggccccggcgcccagcgaggcccctccccgtgcgcgggcgcgccgccgccgccgccgacgccaaccccgcccgccccgagcgccgcgtggtgatcaccggccagggcgtggtgacctccctgggccagaccatcgagcagttctactcctccctgctggagggcgtgtccggcatctcccagatccagaagttcgacaccaccggctacaccaccaccatcgccggcgagatcaagtccctgcagctggacccctacgtgcccaagcgctgggccaagcgcgtggacgacgtgatcaagtacgtgtacatcgccggcaagcaggccctggagtccgccggcctgcccatcgaggccgccggcctggccggcgccggcctggaccccgccctgtgcggcgtgctgatcggcaccgccatggccggcatgacctccttcgccgccggcgtggaggccctgacccgcggcggcgtgcgcaagatgaaccccttctgcatccccttctccatctccaacatgggcggcgccatgctggccatggacatcggcttcatgggccccaactactccatctccaccgcctgcgccaccggcaactactgcatcctgggcgccgccgaccacatccgccgcggcgacgccaacgtgatgctggccggcggcgccgacgccgccatcatcccctccggcatcggcggcttcatcgcctgcaaggccctgtccaagcgcaacgacgagcccgagcgcgcctcccgcccctgggacgccgaccgcgacggcttcgtgatgggcgagggcgccggcgtgctggtgctggaggagctggagcacgccaagcgccgcggcgccaccatcctggccgagctggtgggcggcgccgccacctccgacgcccaccacatgaccgagcccgacccccagggccgcggcgtgcgcctgtgcctggagcgcgccctggagcgcgcccgcctggcccccgagcgcgtgggctacgtgaacgcccacggcacctccacccccgccggcgacgtggccgagtaccgcgccatccgcgccgtgatcccccaggactccctgcgcatcaactccaccaagtccatgatcggccacctgctgggcggcgccggcgccgtggaggccgtggccgccatccaggccctgcgcaccggctggctgcaccccaacctgaacctggagaaccccgcccccggcgtggaccccgtggtgctggtgggcccccgcaaggagcgcgccgaggacctggacgtggtgctgtccaactccttcggcttcggcggccacaactcctgcgtgatcttccgcaagtacgacgagatggactacaaggaccacgacggcgactacaaggaccacgacatcgactacaaggacgacgacgacaagtgaseqidno:18包含原始小球藻s106硬脂酰基acp去饱和酶转运肽的pmkasii(桑葚型无绿藻kasii)matastfsafnarcgdlrrsagsgprrparplpvrgraaaaadanparperrvvitgqgvvtslgqtieqfyssllegvsgisqiqkfdttgytttiageikslqldpyvpkrwakrvddvikyvyiagkqalesaglpieaaglagagldpalcgvligtamagmtsfaagvealtrggvrkmnpfcipfsisnmggamlamdigfmgpnysistacatgnycilgaadhirrgdanvmlaggadaaiipsgiggfiackalskrndeperasrpwdadrdgfvmgegagvlvleelehakrrgatilaelvggaatsdahhmtepdpqgrgvrlcleralerarlapervgyvnahgtstpagdvaeyrairavipqdslrinstksmighllggagaveavaaiqalrtgwlhpnlnlenpapgvdpvvlvgprkeraedldvvlsnsfgfgghnscvifrkydemdykdhdgdykdhdidykddddkseqidno:19密码子优化的地钱fae3(基因库登录号aap74370)seqidno:20地钱fae3(基因库登录号aap74370)mdsraqnrdggedvkqellsagddgkvpcptvaigirqrlpdflqsvnmkyvklgyhylithamflltlpafflvaaeigrlgheriyrelwthlhlnlvsimacssalvagatlyfmsrprpvylvefacyrpderlkvskdffldmsrrtglfssssmdfqtkitqrsglgdetylppailasppnpcmreareeaamvmfgaldelfeqtgvkpkeigvlvvncslfnptpsmsamivnhyhmrgnikslnlggmgcsaglisidlardllqvhgntyavvvstenitlnwyfgddrsklmsncifrmggaavllsnkrrerrrakyellhtvrthkgaddkcfrcvyqeedstgslgvslsrelmavagnalkanittlgplvlplseqilffaslvarkflnmkmkpyipdfklafehfcihaggravldeleknldltewhmepsrmtlyrfgntsssslwyelayteaqgrvkrgdrlwqiafgsgfkcnsavwralrtvkppvnnawsdvidrfpvklpqfseqidno:21布氏锥虫elo3(基因库登录号aax70673)seqidno:22布氏锥虫elo3(基因库登录号aax70673)mypthrdlilnnysdiyrsptchyhtwhtlihtpinellfpnlprecdfgydipyfrgqidvfdgwsmihftssnwcipitvclcyimmiaglkkymgprdggrapiqaknyiiawnlflsffsfagvyytvpyhlfdpenglfaqgfystvcnngayygngnvgffvwlfiyskifelvdtffllirknpviflhwyhhltvllycwhaysvrigtgiwfatmnysvhsvmylyfamtqygpstkkfakkfskfittiqilqmvvgiivtfaamlyvtfdvpcytslansvlglmmyasyfvlfvqlyvshyvspkhvkqeseqidno:23密码子优化的酿酒酵母elo1(基因库登录号p39540)seqidno:24酿酒酵母elo1(基因库登录号p39540)mvsdwknfclekasrfrptidrpffniylwdyfnravgwatagrfqpkdfeftvgkqplseprpvllfiamyyvvifggrslvksckplklrfisqvhnlmltsvsflwlilmveqmlpivyrhglyfavcnveswtqpmetlyylnymtkfvefadtvlmvlkhrkltflhtyhhgatallcynqlvgytavtwvpvtlnlavhvlmywyyflsasgirvwwkawvtrlqivqfmldlivvyyvlyqkivaayfknactpqcedclgsmtaiaagaailtsylflfisfyievykrgsasgkkkinknnseqidno:25utex1439、utex1441、utex1435、utex1437桑葚型无绿藻的23srrnatgttgaagaatgagccggcgacttaaaataaatggcaggctaagagaattaataactcgaaacctaagcgaaagcaagtcttaatagggcgctaatttaacaaaacattaaataaaatctaaagtcatttattttagacccgaacctgagtgatctaaccatggtcaggatgaaacttgggtgacaccaagtggaagtccgaaccgaccgatgttgaaaaatcggcggatgaactgtggttagtggtgaaataccagtcgaactcagagctagctggttctccccgaaatgcgttgaggcgcagcaatatatctcgtctatctaggggtaaagcactgtttcggtgcgggctatgaaaatggtaccaaatcgtggcaaactctgaatactagaaatgacgatatattagtgagactatgggggataagctccatagtcgagagggaaacagcccagaccaccagttaaggccccaaaatgataatgaagtggtaaaggaggtgaaaatgcaaatacaaccaggaggttggcttagaagcagccatcctttaaagagtgcgtaatagctcactgseqidno:26cupsr23lpaat2-1maiaaaaviflfgliffasgliinlfqalcfvlirplsknayrrinrvfaelllsellclfdwwagaklklftdpetfrlmgkehalviinhmteldwmvgwvmgqhfgclgsiisvakkstkflpvlgwsmwfseylylerswakdkstlkshierlidyplpfwlvifvegtrftrtkllaaqqyavssglpvprnvliprtkgfvscvshmrsfvpavydvtvafpktsppptllnlfegqsimlhvhikrhamkdlpesddavaewcrdkfvekdalldkhnaedtfsgqevchsgsrqlksllvviswvvvttfgalkflqwsswkgkafsaiglgivtllmhvlilssqaersnpaevaqaklktglsiskkvtdkenseqidno:27cupsr23lpaat3-1maiaaaavivplsllffvsglivnlvqavcfvlirplskntyrrinrvvaellwlelvwlidwwagvkikvftdhetfhlmgkehalvicnhksdidwlvgwvlgqrsgclgstlavmkksskflpvlgwsmwfseylflerswakdeitlksglnrlkdyplpfwlalfvegtrftrakllaaqqyaassglpvprnvliprtkgfvssvshmrsfvpaiydvtvaipktsppptlirmfkgqssvlhvhlkrhlmkdlpesddavaqwcrdifvekdalldkhnaedtfsgqelqetgrpiksllvviswavlevfgavkflqwssllsswkglafsgiglgvitllmhililfsqserstpakvapakpknegessktemekekseqidno:28cupsr23lppatx的氨基酸序列meipphclcspspapsqlyykkkkhailqtqtpyryrvsptcfapprlrkqhpyplpvlcypkllhfsqpryplvrshlaeagvayrpgyellgkirgvcfyavtaavalllfqcmlllhpfvllfdpfprkahhtiaklwsicsvslfykihikglenlppphspavyvsnhqsfldiytlltlgrtfkfiskteiflypiigwamymlgtiplkrldsrsqldtlkrcmdlikkgasvfffpegtrskdgklgafkkgafsiaakskvpvvpitligtgkimppgseltvnpgtvqviihkpiegsdaeamcnearatishslddseqidno:29cupsr23lpaatx编码区的cdna序列atggagatcccgcctcactgtctctgttcgccttcgcctgcgccttcgcaattgtattacaagaagaagaagcatgccattctccaaactcaaactccctatagatatagagtttccccgacatgctttgcccccccccgattgaggaagcagcatccttaccctctccctgtcctctgctatccaaaactcctccacttcagccagcctaggtaccctctggttagatctcatttggctgaagctggtgttgcttatcgtccaggatacgaattattaggaaaaataaggggagtgtgtttctatgctgtcactgctgccgttgccttgcttctatttcagtgcatgctcctcctccatccctttgtgctcctcttcgatccatttccaagaaaggctcaccataccatcgccaaactctggtctatctgctctgtttctcttttttacaagattcacatcaagggtttggaaaatcttcccccaccccactctcctgccgtctatgtctctaatcatcagagttttctcgacatctatactctcctcactctcggtagaaccttcaagttcatcagcaagactgagatctttctctatccaattatcggttgggccatgtatatgttgggtaccattcctctcaagcggttggacagcagaagccaattggacactcttaagcgatgtatggatctcatcaagaagggagcatccgtctttttcttcccagagggaacacgaagtaaagatgggaaactgggtgctttcaagaaaggtgcattcagcatcgcagcaaaaagcaaggttcctgttgtgccgatcacccttattggaactggcaagattatgccacctgggagcgaacttactgtcaatccaggaactgtgcaagtaatcatacataaacctatcgaaggaagtgatgcagaagcaatgtgcaatgaagctagagccacgatttctcactcacttgatgattaaseqidno:30cupsr23lpaat2-1编码区的cdna序列atggcgattgcagcggcagctgtcatcttcctcttcggccttatcttcttcgcctccggcctcataatcaatctcttccaggcgctttgctttgtccttattcggcctctttcgaaaaacgcctacmggagaataaacagagtttttgcagaattgttgttgtcggagcttttatgcctattcgattggtgggctggtgctaagctcaaattatttaccgaccctgaaacctttcgccttatgggcaaggaacatgctcttgtcataattaatcacatgactgaacttgactggatggttggatgggttatgggtcagcattttggttgccttgggagcataatatctgttgcgaagaaatcaacaaaatttcttccggtattggggtggtcaatgtggttttcagagtacctatatcttgagagaagctgggccaaggataaaagtacattaaagtcacatatcgagaggctgatagactaccccctgcccttctggttggtaatttttgtggaaggaactcggtttactcggacaaaactcttggcagcccagcagtatgctgtctcatctgggctaccagtgccgagaaatgttttgatcccacgtactaagggttttgtttcatgtgtaagtcacatgcgatcatttgttccagcagtatatgatgtcacagtggcattccctaagacttcacctccaccaacgttgctaaatcttttcgagggtcagtccataatgcttcacgttcacatcaagcgacatgcaatgaaagatttaccagaatccgatgatgcagtagcagagtggtgtagagacaaatttgtggaaaaggatgctttgttggacaagcataatgctgaggacactttcagtggtcaagaagtttgtcatagcggcagccgccagttaaagtctcttctggtggtaatatcttgggtggttgtaacaacatttggggctctaaagttccttcagtggtcatcatggaaggggaaagcattttcagctatcgggctgggcatcgtcactctacttatgcacgtattgattctatcctcacaagcagagcggtctaaccctgcggaggtggcacaggcaaagctaaagaccgggttgtcgatctcaaagaaggtaacggacaaggaaaactagseqidno:31cupsr23lpaax3-1编码区的cdna序列atggcgattgctgcggcagctgtcatcgtcccgctcagcctcctcttcttcgtctccggcctcatcgtcaatctcgtacaggcagtttgctttgtactgattaggcctctgtcgaaaaacacttacagaagaataaacagagtggttgcagaattgttgtggttggagttggtatggctgattgattggtgggctggtgtcaagataaaagtattcacggatcatgaaacctttcaccttatgggcaaagaacatgctcttgtcatttgtaatcacaagagtgacatagactggctggttgggtgggttctgggacagcggtcaggttgccttggaagcacattagctgttatgaagaaatcatcaaagtttctcccggtattagggtggtcaatgtggttctcagagtatctattccttgaaagaagctgggccaaggatgaaattacattaaagtcaggtttgaataggctgaaagactatcccttacccttctggttggcactttttgtggaaggaactcggttcactcgagcaaaactcttggcagcccagcagtatgctgcctcttcggggctacctgtgccgagaaatgttctgatcccgcgtactaagggttttgtttcttctgtgagtcacatgcgatcatttgttccagccatatatgatgttacagtggcaatcccaaagacgtcacctccaccaacattgataagaatgttcaagggacagtcctcagtgcttcacgtccacctcaagcgacacctaatgaaagatttacctgaatcagatgatgctgttgctcagtggtgcagagatatattcgtcgagaaggatgctttgttggataagcataatgctgaggacactttcagtggccaagaacttcaagaaactggccgcccaataaagtctcttctggttgtaatctcttgggcggtgttggaggtatttggagctgtgaagtttcttcaatggtcatcgctgttatcatcatggaagggacttgcattttcgggaataggactgggtgtcatcacgctactcatgcacatactgattttattctcacaatccgagcggtctacccctgcaaaagtggcaccagcaaagccaaagaatgagggagagtcctccaagacggaaatggaaaaggaaaagtagseqidno:32针对桑葚型无绿藻进行密码子优化的cupsr23lpaatx编码区的cdna序列atggagatccccccccactgcctgtgctccccctcccccgccccctcccagctgtactacaagaagaagaagcacgccatcctgcagacccagaccccctaccgctaccgcgtgtcccccacctgcttcgcccccccccgcctgcgcaagcagcacccctaccccctgcccgtgctgtgctaccccaagctgctgcacttctcccagccccgctaccccctggtgcgctcccacctggccgaggccggcgtggcctaccgccccggctacgagctgctgggcaagatccgcggcgtgtgcttctacgccgtgaccgccgccgtggccctgctgctgttccagtgcatgctgctgctgcaccccttcgtgctgctgttcgaccccttcccccgcaaggcccaccacaccatcgccaagctgtggtccatctgctccgtgtccctgttctacaagatccacatcaagggcctggagaacctgccccccccccactcccccgccgtgtacgtgtccaaccaccagtccttcctggacatctacaccctgctgaccctgggccgcaccttcaagttcatctccaagaccgagatcttcctgtaccccatcatcggctgggccatgtacatgctgggcaccatccccctgaagcgcctggactcccgctcccagctggacaccctgaagcgctgcatggacctgatcaagaagggcgcctccgtgttcttcttccccgagggcacccgctccaaggacggcaagctgggcgccttcaagaagggcgccttctccatcgccgccaagtccaaggtgcccgtggtgcccatcaccctgatcggcaccggcaagatcatgccccccggctccgagctgaccgtgaaccccggcaccgtgcaggtgatcatccacaagcccatcgagggctccgacgccgaggccatgtgcaacgaggcccgcgccaccatctcccactccctggacgactgaseqidno:33针对桑葚型无绿藻进行密码子优化的cupsr23lpaat2-1编码区的cdna序列atggcgatcgcggccgcggcggtgatcttcctgttcggcctgatcttcttcgcctccggcctgatcatcaacctgttccaggcgctgtgcttcgtcctgatccgccccctgtccaagaacgcctaccgccgcatcaaccgcgtgttcgcggagctgctgctgtccgagctgctgtgcctgttcgactggtgggcgggcgcgaagctgaagctgttcaccgaccccgagacgttccgcctgatgggcaaggagcacgccctggtcatcatcaaccacatgaccgagctggactggatggtgggctgggtgatgggccagcacttcggctgcctgggctccatcatctccgtcgccaagaagtccacgaagttcctgcccgtgctgggctggtccatgtggttctccgagtacctgtacctggagcgctcctgggccaaggacaagtccaccctgaagtcccacatcgagcgcctgatcgactaccccctgcccttctggctggtcatcttcgtcgagggcacccgcttcacgcgcacgaagctgctggcggcccagcagtacgcggtctcctccggcctgcccgtcccccgcaacgtcctgatcccccgcacgaagggcttcgtctcctgcgtgtcccacatgcgctccttcgtccccgcggtgtacgacgtcacggtggcgttccccaagacgtcccccccccccacgctgctgaacctgttcgagggccagtccatcatgctgcacgtgcacatcaagcgccacgccatgaaggacctgcccgagtccgacgacgccgtcgcggagtggtgccgcgacaagttcgtcgagaaggacgccctgctggacaagcacaacgcggaggacacgttctccggccaggaggtgtgccactccggctcccgccagctgaagtccctgctggtcgtgatctcctgggtcgtggtgacgacgttcggcgccctgaagttcctgcagtggtcctcctggaagggcaaggcgttctccgccatcggcctgggcatcgtcaccctgctgatgcacgtgctgatcctgtcctcccaggccgagcgctccaaccccgccgaggtggcccaggccaagctgaagaccggcctgtccatctccaagaaggtgacggacaaggagaactgaseqidno:34针对桑葚型无绿藻进行密码子优化的cupsr23lpaax3-1编码区的cdna序列atggccatcgcggcggccgcggtgatcgtgcccctgtccctgctgttcttcgtgtccggcctgatcgtcaacctggtgcaggccgtctgcttcgtcctgatccgccccctgtccaagaacacgtaccgccgcatcaaccgcgtggtcgcggagctgctgtggctggagctggtgtggctgatcgactggtgggcgggcgtgaagatcaaggtcttcacggaccacgagacgttccacctgatgggcaaggagcacgccctggtcatctgcaaccacaagtccgacatcgactggctggtcggctgggtcctgggccagcgctccggctgcctgggctccaccctggcggtcatgaagaagtcctccaagttcctgcccgtcctgggctggtccatgtggttctccgagtacctgttcctggagcgctcctgggccaaggacgagatcacgctgaagtccggcctgaaccgcctgaaggactaccccctgcccttctggctggcgctgttcgtggagggcacgcgcttcacccgcgcgaagctgctggcggcgcagcagtacgccgcgtcctccggcctgcccgtgccccgcaacgtgctgatcccccgcacgaagggcttcgtgtcctccgtgtcccacatgcgctccttcgtgcccgcgatctacgacgtcaccgtggccatccccaagacgtcccccccccccacgctgatccgcatgttcaagggccagtcctccgtgctgcacgtgcacctgaagcgccacctgatgaaggacctgcccgagtccgacgacgccgtcgcgcagtggtgccgcgacatcttcgtggagaaggacgcgctgctggacaagcacaacgccgaggacaccttctccggccaggagctgcaggagaccggccgccccatcaagtccctgctggtcgtcatctcctgggccgtcctggaggtgttcggcgccgtcaagttcctgcagtggtcctccctgctgtcctcctggaagggcctggcgttctccggcatcggcctgggcgtgatcaccctgctgatgcacatcctgatcctgttctcccagtccgagcgctccacccccgccaaggtggcccccgcgaagcccaagaacgagggcgagtcctccaagaccgagatggagaaggagaagtgaseqidno:35seqidno:36seqidno:37seqidno:38seqidno:39seqidno:40seqidno:41seqidno:42seqidno:43seqidno:44seqidno:45seqidno:46seqidno:47seqidno:48seqidno:49seqidno:50seqidno:51seqidno:52seqidno:53seqidno:54seqidno:55seqidno:56seqidno:57seqidno:58seqidno:59seqidno:60seqidno:61seqidno:62seqidno:63油菜lpaatcdsmamaaavivplgilffisglvvnllqavcyvlvrpmskntyrkinrvvaetlwlelvwivdwwagvkiqvfaddetfnrmgkehalvvcnhrsdidwlvgwilaqrsgclgsalavmkksskflpvigwsmwfseylflernwakdestlqsglqrlndfprpfwlalfvegtrfteaklkaaqeyaasselpvprnvliprtkgfvsavsnmrsfvpaiydmtvaipktsppptmlrlfkgqpsvvhvhikchsmkdlpepedeiaqwcrdqfvakdalldkhiaadtfpgqkeqnigrpikslavvvswaclltlgamkflhwsnlfsswkgialsafglgiitlcmqilirssqserstpakvapakpkdnhqsgpssqteveekqkseqidno:64成熟天然桑葚型无绿藻kasii氨基酸序列aaaaadanparperrvvitgqgvvtslgqtieqfyssllegvsgisqiqkfdttgytttiageikslqldpyvpkrwakrvddvikyvyiagkqalesaglpieaaglagagldpalcgvligtamagmtsfaagvealtrggvrkmnpfcipfsisnmggamlamdigfmgpnysistacatgnycilgaadhirrgdanvmlaggadaaiipsgiggfiackalskrndeperasrpwdadrdgfvmgegagvlvleelehakrrgatilaelvggaatsdahhmtepdpqgrgvrlcleralerarlapervgyvnahgtstpagdvaeyrairavipqdslrinstksmighllggagaveavaaiqalrtgwlhpnlnlenpapgvdpvvlvgprkeraedldvvlsnsfgfgghnscvifrkydeseqidno:65成熟桑葚型无绿藻硬脂酰酰基-acp去饱和酶(sad2-1)gavaapgrraasrplvvhavaseaplgvppsvqrpspvvyskldkqhrltperlelvqsmgqfaeervlpvlhpvdklwqpqdflpdpespdfedqvaelrarakdlpdeyfvvlvgdmiteealptymamlntldgvrddtgaadhpwarwtrqwvaeenrhgdllnkycwltgrvnmravevtinnliksgmnpqtdnnpylgfvytsfqeratkyshgntarlaaehgdkglskicgliasdegrheiaytrivdeffrldpegavaayanmmrkqitmpahlmddmghgeanpgrnlfadfsavaekidvydaedycrilehlnarwkvderqvsgqaaadqeyvlglpqrfrklaektaakrkrvarrpvafswisgreimvseqidno:66psz3870中所含转化用dna的核苷酸序列seqidno:67psz2533中所含pmuapa1启动子的核苷酸序列seqidno:68psz3869中所含pmhxt1启动子的核苷酸序列seqidno:69psz3935中所含pmsod启动子的核苷酸序列seqidno:70psz3936中所含pmatpb1启动子的核苷酸序列seqidno:71psz3937中所含pmef1-1启动子的核苷酸序列seqidno:72psz3938中所含pmef1-2启动子的核苷酸序列seqidno:73psz3939中所含pmacp1启动子的核苷酸序列seqidno:74psz3940中所含pmacp2启动子的核苷酸序列seqidno:75psz3941中所含pmc1lyr1启动子的核苷酸序列seqidno:76psz3942中所含pmamt1-1启动子的核苷酸序列seqidno:77psz3943中所含pmamt1-2启动子的核苷酸序列seqidno:78psz3944中所含pmamt3-1启动子的核苷酸序列seqidno:79psz3945中所含pmamt3-2启动子的核苷酸序列seqidno:80psz4768(d3870)中所含转化用dna的核苷酸序列seqidno:81桑葚型无绿藻sad2-2v3启动子gtgaaaactcgctcgaccgcccgcgtcccgcaggcagcgatgacgtgtgcgtgacctgggtgtttcgtcgaaaggccagcaaccccaaatcgcaggcgatccggagattgggatctgatccgagcttggaccagatcccccacgatgcggcacgggaactgcatcgactcggcgcggaacccagctttcgtaaatgccagattggtgtccgataccttgatttgccatcagcgaaacaagacttcagcagcgagcgtatttggcgggcgtgctaccagggttgcatacattgcccatttctgtctggaccgctttaccggcgcagagggtgagttgatggggttggcaggcatcgaaacgcgcgtgcatggtgtgtgtgtctgttttcggctgcacaatttcaatagtcggatgggcgacggtagaattgggtgttgcgctcgcgtgcatgcctcgccccgtcgggtgtcatgaccgggactggaatcccccctcgcgaccctcctgctaacgctcccgactctcccgcccgcgcgcaggatagactctagttcaaccaatcgacaseqidno:82荷包蛋花(limdlpaat,uniprot登录号:q42870)maktrtsslrnrrqlkpavaatadddkdgvfmvllscfkifvcfaivlitavawglimvlllpwpymrirlgnlyghiigglviwiygipikiqgsehtkkraiyisnhaspidaffvmwlapigtvgvakkeviwypllgqlytlahhiridrsnpaaaiqsmkeavrviteknlslimfpegtrsrdgrllpfkkgfvhlalqshlpivpmiltgthlawrkgtfrvrpvpitvkylppintddwtvdkiddyvkmihdvyvrnlpasqkplgstnrsnseqidno:83绣线菊(limalpaat,uniprot登录号:q42868)maktrtsslrnrrqlktavaatadddkdgifmvllscfkifvcfaivlitavawglimvlllpwpymrirlgnlyghiigglviwlygipieiqgsehtkkraiyisnhaspidaffvmwlapigtvgvakkeviwypllgqlytlahhiridrsnpaaaiqsmkeavrviteknlslimfpegtrsgdgrllpfkkgfvhlalqshlpivpmiltgthlawrkgtfrvrpvpitvkylppintddwtvdkiddyvkmihdiyvrnlpasqkplgstnrskseqidno:84海甘蓝亚种fae基因库登录号:ay793549mtsinvkllyhyvitnlfnlcffpltaivagkasrltiddlhhlyysylqhnvitiaplfaftvfgsilyivtrpkpvylveyscylpptqcrssiskvmdifyqvrkadpfrngtcddsswldflrkiqersglgdethgpegllqvpprktfaaareeteqvivgalknlfentkvnpkdigilvvnssmfnptpslsamvvntfklrsnvrsfnlggmgcsagviaidlakdllhvhkntyalvvstenityniyagdnrsmmvsnclfrvggaaillsnkprdrrrskyelvhtvrthtgaddksfrcvqqgddengktgvslskditevagrtvkkniatlgplilplsekllffvtfmakklfkdkvkhyyvpdfklaidhfcihaggravidvleknlglapidveasrstlhrfgntssssiwyelayieakgrmkkgnkvwqialgsgfkcnsavwvalsnvkastnspwehcidrypvkidsdsaksetraqngrsseqidno:85银扇草fae基因库登录号:acj61777mtsinvkllyhyvitnffnlcffpltailagkasrlttndlhhfysylqhnlitltllfaftvfgsvlyfvtrpkpvylvdyscylppqhlsagisktmeifyqirksdplrnvalddsssldflrkiqersglgdetygpeglfeipprknlasareeteqvingalknlfentkvnpkeigilvvnssmfnptpslsamvvntfklrsniksfnlggmgcsagviaidlakdllhvhkntyalvvstenitqniytgdnrsmmvsnclfrvggaaillsnkpgdrrrskyrlahtvrthtgaddksfgcvrqeeddsgktgvslskditgvagitvqknittlgplvlplsekilfvvtfvakkllkdkikhyyvpdfklavdhfcihaggravidvleknlglspidveasrstlhrfgntssssiwyelayieakgrmkkgnkawqiavgsgfkcnsavwvalrnvkasanspwehcihkypvqmysgssksetraqngrsseqidno:86atlpcat1np_172724.2mdmssmagsigvsvavlrfllcfvatipvsfacrivpsrlgkhlyaaasgaflsylsfgfssnlhflvpmtigyasmaiyrpkcgiitfflgfayligchvfymsgdawkeggidstgalmvltlkviscsmnyndgmlkeeglreaqkknrliqmpslieyfgyclccgshfagpvyemkdylewtegkgiwdttekrkkpspygatirailqaaicmalylylvpqypltrftepvyqewgflrkfsyqymagftarwkyyfiwsiseasiiisglgfsgwtddaspkpkwdraknvdilgvelaksavqiplvwniqvstwlrhyvyerlvqngkkagffqllatqtvsavwhglypgymmffvqsalmiagsrviyrwqqaispkmamlrnimvfinflytvlvlnysavgfmvlslhetltaygsvyyigtiipvglillsyvvpakpsrpkprkeeseqidno:87atlpcat2np_176493.1melldmnsmaasigvsvavlrfllcfvatipisflwrfipsrlgkhiysaasgaflsylsfgfssnlhflvpmtigyasmaiyrplsgfitfflgfayligchvfymsgdawkeggidstgalmvltlkviscsinyndgmlkeeglreaqkknrliqmpslieyfgyclccgshfagpvfemkdylewteekgiwavsekgkrpspygamiravfqaaicmalylylvpqfpltrftepvyqewgflkrfgyqymagftarwkyyfiwsiseasiiisglgfsgwtdetqtkakwdraknvdilgvelaksavqiplfwniqvstwlrhyvyerivkpgkkagffqllatqtvsavwhglypgyiiffvqsalmidgskaiyrwqqaippkmamlrnvlvlinflytvvvlnyssvgfmvlslhetlvafksvyyigtvipiavlllsylvpvkpvrpktrkeeseqidno:88brlpcats16_br_trinity_38655-orf1(框架2)mismdmdsmaasigvsvavlrfllcfvatipvsffwrivpsrlgkhvyaaasgvflsylsfgfssnlhflvpmtigyasmamyrpkcgiitfflgfayligchvfymsgdawkeggidstgalmvltlkviscavnyndgmlkeeglreaqkknrliempslieyfgyclccgshfagpvyemkdylqwtegtgiwdssekrkqpspylatlraifqagicmalylylvpqfpltrftepvyqewgfwkkfgyqymagqtarwkyyfiwsiseasiiisglgfsgwtddeaspkpkwdraknvdilgvelaksavqiplvwniqvstwlrhyvyerlvksgkkagffqllatqtvsavwhglypgymmffvqsalmiagsrviyrwqqaispklgvlrsmmvfinflytvlvlnysavgfmvlslhetltaygsvyyigtiipvglillsyvvpakpyrakprkeeseqidno:89bjlpcat1s15_bj_trinity_73901-orf1(框架3)mismdmdsmaasigvsvavlrfllcfvatipvsffwrivpsrlgkhiyaaasgvflsylsfgfssnlhflvpmtigyasmamyrpkcgiitfflgfayligchvfymsgdawkeggidstgalmvltlkviscavnyndgmlkeeglreaqkknrliempslieyfgyclccgshfagpvyemkdylqwtegtgiwdssekrkqpspylatlraifqagicmalylylvpqfpltrftepvyqewgfwkkfgyqymagqtarwkyyfiwsiseasiiisglgfsgwtdddaspkpkwdraknvdilgvelaksavqiplvwniqvstwlrhyvyerlvksgkkagffqllatqtvsavwhglypgymmffvqsalmiagsrviyrwqqaispklgvlrsmmvfinflytvlvlnysavgfmvlslhetltaygsvyyigtiipvglillsyvvpakpyrakprkeeseqidno:90bjlpcat2_ptx_sample_s15_bj_merged_transcripts-orf1(框架3)mismdmnsmaasigvsvavlrfllcfvatipvsfawrivpsrlgkhiyaaasgvflsylsfgfssnlhflvpmtigyasmamyrpkcgiitfflgfayligchvfymsgdawkeggidstgalmvltlkviscavnyndgmlkeeglreaqkknrliqmpslieyfgyclccgshfagpvyemkdylqwtegkgiwdssekrkqpspygatlraifqagicmalylylvpqfpltrftepvyqewgflkkfgyqymagqtarwkyyfiwsiseasiiisglgfsgwtdddaspkpkwdraknvdilgvelaksavqiplvwniqvstwlrhyvyerlvksgkkagffqllatqtvsavwhglypgymmffvqsalmiagsrviyrwqqaispklamlrnimvfinflytvlvlnysavgfmvlslhetltaygsvyyigtiipvglillsyvvpakpsrpkprkeeseqidno:91limdlpcat1s03_ld_trinity_38978-orf2(框架3)mdldmdsmassigvsvpvlrfllcyaatipvsficrfvpgktpknvfsaatgaflsylsfgfssnihflipmtlgyasmalyrakcgivtfflafgyligchvyymsgdawkeggidatgalmvltlkviscsvnyndgllkeeglrpsqkknrlsslpsfieyvgyclccgthfagpvyemkdylewtagkgiwaksekakspspflpalrallqgavcmvlylylvpqyplsqftspvyqewgfwkrlsyqymagftarwkyyfiwsiseasvilsglgfsgwtdssppkprwdraknvdilgvefatsgaqvplvwniqvstwlrhyvydrlvktgkkpgffqllatqttsavwhglypgylfffvqsalmiagskviyrwkqalppsasvlqkilvfanflytllvlnyscvgfmvlsmhetiaaygsvyyvgtivpivltilgsiipvkprrtkvqkeqseqidno:92limdlpcat2s03_ld_trinity_29594-orf1(框架1)mnmqnaalligvsvpvfrflvsflatvpvsflwryapgnlgkhvyaagsgallsclafgllsnlhflvlmvmgycsmvfyrskcgiltfvlgftyligchfyymsgdawkdggmdatgslmvltlkviscainyndgllkeeglreaqkknrlinlpsvveyvgyclccgshfagpvfemkdylqwtkkkgiwaakerspspyvatirallqaaicmvvymylvprfplstlaepiyqewgfwkklsyqyitgfssrwkyffvwsiseasmiisglgfsgwtdtspqnpqwdraknvdilraelpesavvlplvwnihvstwlrhyvyerlikngkkpgffellatqtvsavwhglypgyiiffvhtalmiagsrviyrwrqavppnmalvkkmltfmnllytvlilnysyvgfrvlnlhetlaahrsvyyvgtilpiififlgyifpakpsrpkprkqqseqidno:93psz5344;atpdctseqidno:94psz5295:atdag-cptseqidno:95psz5345和psz5350中的brdag-cptseqidno:96psz5306和psz5347中的bjdag-cptseqidno:97psz5296;atlpcat1seqidno:98atlpcat2seqidno:99brlpcatseqidno:100bjlpcatseqidno:101limdlpcat1seqidno:102limdlpcat2seqidno:103psz5297:atlpcatseqidno:104psz5119seqidno:105psz5120和psz5348中的plsc-2/lpaat1-25'侧翼的序列seqidno:106psz5120和psz5348中的plsc-2/lpaat1-23'侧翼seqidno:107psz5343和psz5348中所含绣线菊lpaat(limalpaat)seqidno:108psz5346和psz5351中所含芥菜lpcat1(bjlpcat1)seqidno:109psz5298和psz5352中所含芥菜lpcat2(bjlpcat2)seqidno:110psz5298seqidno:111seqidno:112seqidno:113seqidno:114seqidno:115seqidno:116seqidno:117seqidno:118seqidno:119seqidno:120seqidno:121seqidno:122seqidno:123seqidno:124seqidno:125seqidno:126seqidno:127seqidno:128seqidno:129seqidno:130seqidno:131seqidno:132seqidno:133seqidno:134seqidno:135seqidno:136seqidno:137seqidno:138seqidno:139seqidno:140seqidno:141seqidno:142seqidno:143seqidno:144seqidno:145seqidno:146gattcatatcatcaaatttcgcatatgtttcacgagttgctcacaacatcggcaaatgcgttgttgttccctgtttttacaccttgccagggcctggtcaaagcttgacagtttgaccaaattcaggtggcctcatctctttcgcactgatagacattgcagatttggaagacccagccagtacattacatgcacagccatttgctcctgcaccatgaacttgccacttttgtgcgccggtcgggggtgatagctcggcagccgccgatcccaaaggtcccgcggcccaggggcacgagaccccccgacacgattaaatagccaaaatcagtcagaacggcacctccaccctacccgaatctgacaaggtcatcaaacgcgcgaaacaacggcgagggtgcgttcgggaagcgcgcgtagttgacgcaagaagcctgggtcaggctggagggccgcgagaagatcgcttcctgccgagtctgcacccacgcctcgagcgcaccgtccgcgaacaaccaaccccttttcgcgagccctggcattctttcaattgccaaggatgcacatgtgacacgtatagccattcggctttgtttgtgcctgcttgactcgcgccatttaattgttttgtgccggtgagccgggagtcggccactcgtctccgagccgcagtcccggcgccagtcccccggcctctgatctgggtccggaagggttggtataggagcagtctcggctatctgaagcccgttaccagacactttggccggctgctttccaggcagccgtgtactcttgcgcagtcggtaccseqidno:147actagtatgacggtggccaatcccccggaagccccgttcgacagcgagggttcctcgctggcgcccgacaatgggtccagcaagcccaccaagctgagctccacccggtccctgctgtccatctcctaccgggagctctcgcgttccaagtgcgtacaggggcgagggcaccttttgttggtgttgtttgggcgggcctcggtactgggaggaggaggaatgcgtgcacacctctgcggttttagatgcaatgcgacaagtgcctgctgatgcattttctagacatgaagcatctcgtattcgagtctcaacgcgggtgtgcgctcctcactccgtgcagccagcagtcgcggtcgttcacttcgcggggggtgccagggaggacggacgtttcggatgagctggagcgccgcatcctcgagtggcagggcgatcgcgccatccacaggtcggttgggtgggaaagggggagtaccggggtcaggtcagaagtcgtgcatttacaggcatgcatctgcacatcgtgcgcacgcgcacgtctttggccgcttgtctcaagactcttgcactcgtttcctcatgcaccataatcaattccctcccccctcgcaaactcacagcgtgctggtggccaacaacggtctggcggcggtcaagttcatccggtcgatccggtcgtggtcgtacaagacgtttgggaacgagcgcgcggtgaagctgattgcgatggcgacgcccgagggcatgcgcgcggacgcggagcacatccgcatggcggaccagtttgtggaggtccccggcggcaagaacgtgcagaactacgccaacgtgggcctgatcacctcggtggcggtgcgcaccggggtggacgcggtgcctgcaggseqidno:148seqidno:149seqidno:150seqidno:151seqidno:152当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1