聚合酶的制作方法
本发明属于分子生物学领域,具体来说属于酶领域,更具体来说属于聚合酶领域。本发明还属于核酸测序领域。
背景技术:
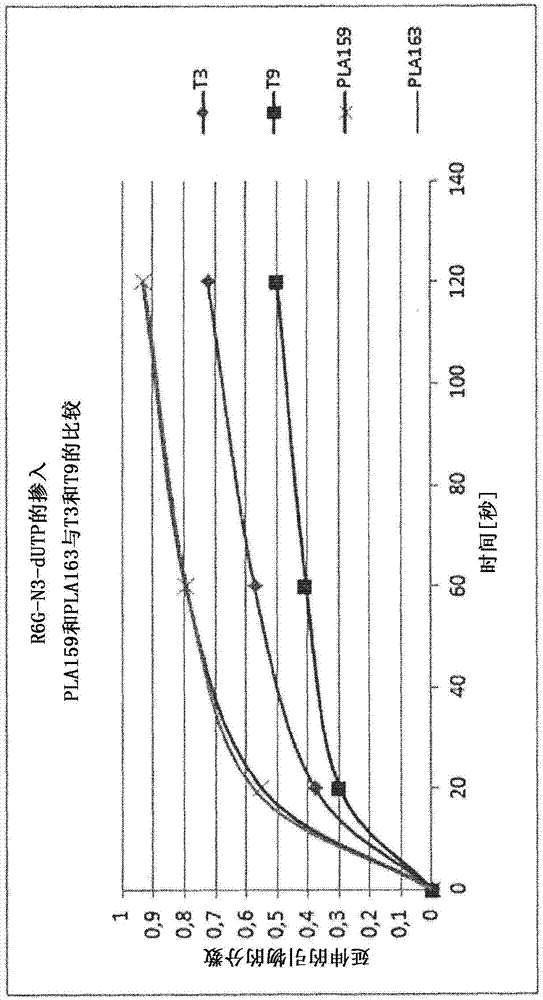
:本发明涉及聚合酶,特别是修饰的dna聚合酶,其与对照聚合酶相比显示出修饰核苷酸的掺入改进。在本发明中还包括将所述修饰的聚合酶用于dna测序、特别是下一代测序的方法。基于与大肠杆菌dna聚合酶i、ii和iii的氨基酸相似性,存在三个主要的dna聚合酶超家族。它们分别被称为a、b和c家族聚合酶。尽管a和b家族聚合酶的晶体学分析揭示出用于核苷酸结合位点的共同结构核心,但在家族内良好保守的序列基序在各家族之间仅仅微弱地保守,并且在这些聚合酶辨别核苷酸类似物的方式上存在显著差异。使用dna聚合酶的早期实验揭示出掺入修饰的核苷酸例如双脱氧核苷酸(ddntp)的困难性。因此,存在对dna聚合酶进行修饰以提高核苷酸类似物的掺入速率的几个实例。这些实例大多数集中于a家族聚合酶的变体,目的是增加双脱氧核苷酸链终止物的掺入。例如,tabor和richardson(proc.natl.acad.sci.(usa)1995;92:6339)描述了将水生嗜热菌(t.aquaticus)dna聚合酶中667位的苯丙氨酸用酪氨酸替换及其对所述dna聚合酶辨别双脱氧核苷酸的影响。为了提高修饰核苷酸的掺入效率,利用了dna聚合酶或对dna聚合酶进行工程改造以使其缺少3'-5'外切核酸酶活性(命名为exo-)。9°n聚合酶的exo-变体由perler等人1998年在us5756334中并由southworth等人在proc.natl.acad.sci.(usa)1996;93:5281中描述。gardner和jack(nucl.acidsres.1999;27:2545)描述了在ventdna聚合酶中增强核糖核苷酸、2'和3'脱氧核糖核苷酸和2',3'-双脱氧核糖核苷酸掺入的突变。vent聚合酶中的两个独立的突变y412v和a488l,提高了所述酶使用核苷酸atp的相对活性。此外,在y412和a488处的其他替换也提高核糖核苷酸的掺入,尽管程度较低。结论是,412位残基处的氨基酸侧链的大体积充当“空间位阻门”,阻断核糖核苷酸糖的2'-羟基接近结合位点。然而,使用虫草素(3'-脱氧腺苷三磷酸)时的速率提高仅为2倍,表明所述y412v聚合酶变体也对3'糖羟基的缺失敏感。对于a488残基来说,活性的改变更不容易合理地说明。预测a488是远离核苷酸结合位点的点;在这里,活性的增强通过酶反应所需的活化能的改变来解释。这些vent中的突变对应于9°n聚合酶中的y409和a485。a488l突变的通用性已通过下述极端嗜热聚合酶中的同源突变得到确认:pfudna聚合酶的a486y变体(evans等,nucl.acidsres.2000;28:1059)。在所述聚合酶基因中引入一系列随机突变,并鉴定了具有改进的ddntp掺入的变体。与野生型相比,a486y突变使测序梯中ddntp/dntp的比率提高150倍。然而,y410向a或f的突变产生的变体与野生型酶相比,产生更差的测序梯。关于进一步信息,参考国际公开号wo01/38546。9°ndna聚合酶的a485l变体(gardner和jack,nucl.acidsres.2002;30:605)。这项研究证实了485位氨基酸处丙氨酸向亮氨酸的突变增强了缺少3'糖羟基部分的核苷酸类似物(acyntp和双脱氧ntp)的掺入。tspjdf-3dna聚合酶的a485t变体(arezi等,j.mol.biol.2002;322:719)。在这篇论文中,将随机突变引入到jdf-3聚合酶中,从其中鉴定到ddntp的掺入提高的变体。两个突变a485t和p410l与野生型酶相比,独立地提高ddntp摄入。在组合时,这些突变具有累加效应,并使ddntp掺入提高250倍。这篇论文证实了dna聚合酶的两个区域的同时突变可以对核苷酸类似物掺入具有累加效应。此外,这篇报告证实了与上述y409相邻的p410也在核苷酸糖类似物的辨别中发挥作用。wo01/23411描述了使用vent的a488l变体将双脱氧核苷酸和无环核苷酸(acyclonucleotide)掺入到dna中。所述申请还覆盖了利用这些核苷酸类似物和在485位残基处突变的9°ndna聚合酶的变体的测序方法。wo2005/024010a1也涉及a基序区的修饰和9°ndna聚合酶。然而,所述修饰目前仍未显示出足够高的修饰核苷酸掺入速率。因此,获得具有修饰核苷酸的这种高掺入速率的酶,将是有益的。技术实现要素:为了提高某些dna测序方法的效率,本发明人分析了是否可以对dna聚合酶进行修饰以产生这些3'取代的核苷酸类似物的提高的掺入速率。本发明涉及包含下述突变的b家族聚合酶:a基序区中的突变,其中苏氨酸是所述a基序区的第二个氨基酸,其中所述a基序区与9°n中的408至410位氨基酸同源;如果存在于所述b家族聚合酶中将引起3’-5’外切核酸酶活性的降低或消除的突变,其中所述聚合酶还在所述a基序区中另外包含下述突变中的一者或两者:l408y或l408f和/或p410s或p410g。本发明还涉及修饰的聚合酶在dna测序中的用途和包含这种酶的试剂盒。在本文中,“掺入”意味着通过与修饰的核苷酸的5'磷酸基团形成磷酸二酯键,将所述修饰的核苷酸连接到第二个核苷酸的游离3'羟基。所述修饰的核苷酸连接到的第二个核苷酸通常出现在多核苷酸链的3'末端处。在本文中,当在本发明的情形中使用时,“修饰的核苷酸”和“核苷酸类似物”是指已在3'糖羟基处进行修饰,以使该取代基的尺寸比天然存在的3’羟基更大的核苷酸。这些术语可互换使用。在本文中,术语“大的3'取代基”是指在3'糖羟基处的、尺寸比天然存在的3'羟基更大的取代基。在本文中,“改进的”掺入被定义为包括与对照聚合酶相比,至少一种修饰的核苷酸的掺入效率和/或观察到的掺入速率的提高。然而,本发明不仅限于修饰核苷酸的绝对掺入速率的改进。正如下文所示,所述聚合酶还掺入其他的修饰和所谓的暗核苷酸(darknucleotide),因此,“改进的掺入”应该被相应地解释为也涵盖任何这些其他性质的改进,不论掺入速率是否提高。所述“改进”不必在所有循环中都是恒定的。因此,“改进”可以是在低温下和/或在比对照酶更宽的温度范围内掺入所述修饰的核苷酸的能力。在本文中,“改进”可以是在使用较低浓度的修饰核苷酸作为底物时掺入所述修饰核苷酸的能力。优选地,当在纳摩尔范围内的底物浓度下工作时,所述改变的聚合酶应该表现出修饰核苷酸的可检测的掺入。在本文中,“改变的聚合酶”意味着所述聚合酶与对照聚合酶相比具有至少一个氨基酸改变。一般来说,这种改变包含至少一个氨基酸被另一个氨基酸替换。在某些情况下,这些改变是保守改变,以维持所述蛋白质的总体电荷分布。然而,本发明不仅限于保守替换。在本发明中也设想了非保守替换。此外,本发明设想了所述聚合酶中的修饰可以是从所述蛋白质缺失或向其添加一个或多个氨基酸,只要所述聚合酶与对照聚合酶相比,对于在3’糖羟基处被修饰以使该取代基的尺寸比天然存在的3’羟基更大的核苷酸的掺入来说具有改进的活性即可。在本文中,“核苷酸”被定义为包括核苷酸和核苷。核苷与核苷酸相同,包含通过糖苷键连接到核糖或脱氧核糖的嘌呤或嘧啶碱基,但是它们缺少使其成为核苷酸的磷酸残基。在所述定义中包括在3'糖羟基处进行修饰之前的合成和天然存在的核苷酸。在本文中和整个本说明书中,聚合酶的氨基酸序列内的突变以下述形式书写:(i)野生型聚合酶中存在的单字母氨基酸,(ii)所述聚合酶氨基酸序列中的变化的位置,和(iii)改变的聚合酶中存在的单字母氨基酸。因此,在氨基酸序列的409位置处野生型聚合酶中的酪氨酸残基向改变的聚合酶中的缬氨酸残基的突变,将被书写为y409v。这是分子生物学中的标准程序。发明详述使用本发明的聚合酶实现的修饰类似物的掺入速率的陡然提高是出人意料的。实施例显示,甚至现有的带有突变的聚合酶也不表现出这些高掺入速率。本发明涉及一种b家族聚合酶,其包含下述突变:a基序区中的突变,其中在天然形式中酪氨酸是所述a基序区的第二个氨基酸,其中所述a基序区与9°n中的408至410位氨基酸同源;如果存在于所述b家族聚合酶中将引起3’-5’外切核酸酶活性的降低或消除的突变,其中所述聚合酶还在所述a基序区中另外包含下述突变中的一者或两者:l408y或l408f和/或p410s或p410g。对于这些其他修饰来说,它们可以互换,因此所述酶可能具有例如l408y和p410s、l408y和p410g、l408f和p410s或l408f和p410g。优选地,除了所述突变之外还存在其他突变,其中苏氨酸是所述a基序区的第二个氨基酸,其中所述a基序区与9°n中的408至410位氨基酸同源。所述改变的聚合酶通常并优选地是“分离的”或“纯化的”多肽。“分离的多肽”意味着基本上不含污染性细胞组分例如在自然界中可能与所述多肽结合的糖类、脂类、核酸或其他蛋白质杂质的多肽。本发明人将组氨酸标签用于纯化,但也可以使用其他手段。优选地,至少所述改变的聚合酶可以是“重组”多肽。本发明的改变的聚合酶可以是b家族类型的dna聚合酶或其突变体或变体。b家族dna聚合酶包括大量古菌dna聚合酶、人类dna聚合酶α以及t4、rb69和噬菌体dna聚合酶。a家族聚合酶包括聚合酶例如taq和t7dna聚合酶。在一个实施方式中,所述聚合酶选自任何b家族古菌dna聚合酶、人类dna聚合酶α或t4、rb69和噬菌体dna聚合酶。优选地,所述聚合酶选自具有突变y409t的9°n聚合酶、具有突变y412t的vent聚合酶、具有突变y410t的pfu聚合酶、具有突变y409t的jdf-3聚合酶和具有突变e615t的taq聚合酶。理想情况下,所述聚合酶包含对应于下述9°n聚合酶突变的一个或多个突变或其组合:d215a,d315a,d141a和/或e143a。在优选实施方式中,所述聚合酶包含对应于9°n的d141a和e143a或d215a和d315a的突变。优选地,所述修饰的聚合酶还另外包含对应于9°n聚合酶中的a485l的突变。这个突变对应于vent中的a488l。几个其他研究组已发表了关于此突变的研究。pfudna聚合酶的a486y变体(evans等,nucl.acidsres.2000;28:1059)。在所述聚合酶基因中引入一系列随机突变,并鉴定具有改进的ddntp掺入的变体。与野生型相比,a486y突变使测序梯中ddntp/dntp的比率提高150倍。然而,y410向a或f的突变产生的变体与野生型酶相比,产生更差的测序梯;也参见wo01/38546。9°ndna聚合酶的a485l变体(gardner和jack,nucl.acidsres.2002;30:605)。这项研究证实了485位氨基酸处丙氨酸向亮氨酸的突变增强了缺少3'糖羟基部分的核苷酸类似物(acyntp和双脱氧ntp)的掺入。tspjdf-3dna聚合酶的a485t变体(arezi等,j.mol.biol.2002;322:719)。在这篇论文中,将随机突变引入到jdf-3聚合酶中,从其中鉴定到ddntp的掺入提高的变体。wo01/23411描述了使用vent的a488l变体将双脱氧核苷酸和无环核苷酸掺入到dna中。所述申请还覆盖了利用这些核苷酸类似物和在485位残基处突变的9°ndna聚合酶的变体的测序方法。理想地并且优选地,所述酶具有下述突变组:(i)d215a、d315a、l408y、y409t、p410s和a485l,或(ii)d215a、d315a、l408f、y409t、p410g和a485l。优选地,所述聚合酶为3’-5’外切核酸酶负型,并具有下述突变:l408y、y409t、p410s和a485l,或l408f、y409t、p410g和a485l。本发明涉及具有本文中示出的突变的聚合酶,所述聚合酶与对照聚合酶相比,表现出在3’糖羟基处已被修饰以使该取代基的尺寸比天然存在的3’羟基更大的核苷酸的掺入速率的提高。这些核苷酸公开在wo2004018497a2中。在此,公开了一种修饰的核苷酸分子,其包含嘌呤或嘧啶碱基以及具有共价附连的可移除的3'-oh阻断基团的核糖或脱氧核糖的糖组成部分,使得所述3'碳原子附连一组结构:-o-z,其中z是-c(r')2-n(r")2'c(r')2-n(h)r"和-c(r')2-n3中的任一者,其中每个r"是可移除的保护基团或其一部分;每个r'独立地是氢原子、烷基、取代的烷基、芳烷基、烯基、炔基、芳基、杂芳基、杂环基、酰基、氰基、烷氧基、芳氧基、杂芳氧基或酰胺基或通过连接基团附连的可检测标记物;或者(r')2代表式=c(r”')2的亚烷基,其中每个r”'可以相同或不同,并选自氢和卤素原子和烷基;并且其中所述分子可以反应,以产生其中每个r"与h交换的中间体,所述中间体在水性条件下解离以产生具有游离3'-oh的分子。本发明还涉及编码本发明的聚合酶的核酸分子,以及包含所述核酸分子的表达载体。本发明还涉及一种用于将核苷酸掺入到dna中的方法,所述核苷酸在3’糖羟基处已被修饰以使该取代基的尺寸比天然存在的3’羟基更大,所述方法包括下述物质:(i)权利要求1至7任一项的聚合酶,(ii)模板dna,(iii)一种或多种核苷酸,其在3’糖羟基处已被修饰以使该取代基的尺寸比天然存在的3’羟基更大。本发明还涉及本发明的聚合酶在方法例如核酸标记或测序中的用途。本发明的聚合酶在需要将核苷酸掺入到多核苷酸中的各种不同技术中是有用的,这些技术包括测序反应、多核苷酸合成、核酸扩增、核酸杂交测定、单核苷酸多态性研究和其他这类技术。利用本发明的修饰的聚合酶的所有这些用途和方法都包含在本发明的范围之内。在测序中,带有3'阻断物的核苷酸的使用允许以受控的方式将连续的核苷酸掺入到多核苷酸链中。在每个核苷酸添加之后,3'阻断物的存在阻止其他核苷酸掺入到所述链中。在掺入的核苷酸的本质已被确定之后,可以将所述阻断物移除,留下游离的3'羟基用于添加下一个核苷酸。通过dna合成进行测序理想地需要与待测序的寡核苷酸相反受控地(即每次一个)掺入正确的互补核苷酸。这允许在多个循环中通过添加核苷酸进行准确测序,因为每次一个对每个核苷酸残基进行测序,因此阻止了一系列不受控制的掺入发生。所述掺入的核苷酸使用与其附连的适合的标记物,在移除所述标记物部分并进行后续的下一轮测序之前读出。为了确保只发生单个掺入,需要对所述测序核苷酸进行结构修饰(“阻断基团”)以确保单个核苷酸掺入,但其随后阻止任何其他核苷酸掺入到多核苷酸链中。所述阻断基团随后必须在不干扰待测序dna的完整性的反应条件下是可移除的。然后可以通过掺入下一个阻断的标记的核苷酸继续进行测序循环。为了实用,整个过程应该由高产率、高特异性的化学和酶步骤构成,以便于多个测序循环。为了在dna测序中有用,核苷酸、更通常为核苷酸三磷酸,通常需要3’-oh阻断基团,以防止用于将它掺入到多核苷酸链中的聚合酶在所述核苷酸上的碱基已被添加之后继续复制。用于测序反应的dna模板通常包含具有游离3'羟基的双链区,其在测序反应中充当用于添加其他核苷酸的引物或起始点。待测序的dna模板区域将在互补链上悬垂出该游离3'羟基。带有所述游离3'羟基的引物可以作为独立组分(例如短的寡核苷酸)添加,其杂交到所述模板的待测序区域。或者,引物和待测序的模板链可以各自形成部分自互补的核酸链的一部分,所述部分自互补的核酸链能够形成分子内双链体例如发夹环结构。将核苷酸连续添加到游离3'羟基,导致以5'至3'方向合成多核苷酸链。在每个核苷酸添加之后,确定已被添加的碱基的本质,由此为所述dna模板提供序列信息。如果所述修饰的核苷酸可以充当链终止物,则这种dna测序将是可行的。在所述修饰的核苷酸已被掺入到与模板的待测序区域互补的生长的多核苷酸链中之后,没有游离的3'-oh可用于进一步的直接序列延伸,因此聚合酶不能添加其他核苷酸。在掺入到所述生长的链中的碱基的本质已被确定后,可以移除3'阻断物以允许添加下一个后续核苷酸。通过对使用这些修饰的核苷酸衍生的产物进行定序,有可能推演出所述dna模板的dna序列。如果每个修饰的核苷酸附连有已知对应于特定碱基的不同标记物以便于在每个掺入步骤中添加的碱基之间进行辨别,则这些反应可以在单一实验中进行。或者,可以分开地进行含有每种修饰的核苷酸的独立反应。在优选实施方式中,所述修饰的核苷酸带有标记物以便于它们的检测。优选地,它是荧光标记物。每种核苷酸类型可以带有不同的荧光标记物。然而,所述可检测的标记物不必定是荧光标记物。可以使用允许检测核苷酸在dna序列中的掺入的任何标记物。适用于本发明的第二和第三方面的用于检测荧光标记的核苷酸的一种方法,包括使用对所述标记的核苷酸特异的波长的激光或使用其他适合的照射源。在一个实施方式中,来自于所述核苷酸上的标记物的荧光可以通过ccd相机检测。如果dna模板被固定在表面上,优选地可以将它们固定在表面上以形成高密度阵列。最优选地并且与本发明的申请人所开发的技术相符,所述高密度阵列包含单分子阵列,其中在所述阵列上每个可检测的分立位点处存在单个dna分子。包含通过光学手段单个可分辨的核酸分子的单分子阵列以及这些阵列在测序中的使用,描述在例如wo00/06770中,其内容通过引用并入本文。包含包括发夹环结构的单个可分辨的核酸分子的单分子阵列描述在wo01/57248中,其内容也通过引用并入本文。本发明的聚合酶适合与按照wo00/06770或wo01/57248的公开制备的单分子阵列联合使用。然而,应该理解,本发明的范围不打算限于所述聚合酶与单分子阵列的结合使用。基于单分子阵列的测序方法,可以通过向所述单分子阵列添加荧光标记的修饰的核苷酸和改变的聚合酶来工作。互补的核苷酸将与每个核苷酸片段的第一个碱基进行碱基配对,并在由改进的聚合酶催化的反应中添加到引物。剩余的游离核苷酸将被移除。然后,对每种修饰核苷酸特异的波长的激光将激发掺入的修饰核苷酸上的适合标记物,引起所述标记物产生荧光。这种荧光可以被适合的ccd相机检测,所述相机可以扫描整个阵列以鉴定每个片段上掺入的修饰核苷酸。因此,可以潜在地并行检测数百万的位点。然后可以将荧光移除。所述掺入的修饰核苷酸的身份将揭示出样品序列中与其配对的碱基的身份。然后将掺入、检测和鉴定的循环重复约25次,以确定附连到所述阵列的每个可检测的寡核苷酸片段中的前25个碱基。因此,通过对阵列上可检测的所有分子进行同时测序,可以确定以单拷贝方式附连到所述阵列的数百万个寡核苷酸片段的前25个碱基。显然,本发明不限于测序25个碱基。取决于所需的序列信息的细节水平和阵列的复杂度,可以测序许多种或多或少的碱基。使用适合的生物信息学程序,可以将产生的序列与特定参考序列对齐并比较。这将允许确定各种已知和未知的遗传变异,例如单核苷酸多态性(snp)。本发明的改变的聚合酶的用途不限于使用单分子阵列的测序应用。所述聚合酶可以与需要使用聚合酶将核苷酸掺入到多核苷酸链中的任何类型的基于阵列(特别是任何基于高密度阵列)的测序技术联合使用,特别是依赖于具有大的3'取代基(比天然羟基更大)例如3'阻断基团的修饰的核苷酸的掺入的任何基于阵列的测序技术。本发明的聚合酶可用于在基本上任何类型的通过核酸分子在固相支持物上的固定而形成的阵列上进行核酸测序。除了单分子阵列之外,适合的阵列可以包括例如多路多核苷酸或簇集阵列,其中所述阵列上的不同区域包含单一多核苷酸分子的多个拷贝或甚至少量不同多核苷酸分子的多个拷贝(例如两个互补核酸链的多个拷贝)。具体来说,本发明的聚合酶可用于wo98/44152中描述的核酸测序方法中,所述公开的内容通过引用并入本文。这份国际申请描述了位于固相支持物上不同位置处的多个模板的并行测序方法。所述方法依赖于标记的核苷酸在多核苷酸链中的掺入。本发明的聚合酶可用于国际申请wo00/18957中描述的方法中,所述国际申请的内容通过引用并入本文。这份申请描述了一种固相核酸扩增和测序方法,其中将大量不同核酸分子形成阵列,并通过核酸群落的形成以高密度同时进行扩增,随后对所述核酸群落进行测序。本发明的改变的聚合酶可用于这种方法的测序步骤中。核酸分子的多路多核苷酸或簇集阵列可以使用本领域中公知的技术来产生。例如,wo98/44151和wo00/18957两者描述了核酸扩增方法,其允许将扩增产物固定在固相支持物上以便形成包含固定化核酸分子的簇或“群落”的阵列。wo98/44151和wo00/18957的与簇集阵列的制备和这些阵列作为模板用于核酸测序的用途相关的内容,通过引用并入本文。在按照这些方法制备的簇集阵列上存在的核酸分子,是适合于使用本发明的聚合酶进行测序的模板。然而,本发明不打算在按照这些特定方法制备的簇集阵列上进行的测序反应中使用所述聚合酶。本发明的聚合酶也可用于荧光原位测序的方法中,例如mitra等人(analyticalbiochemistry2003;320:55)描述的方法。此外,另一方面,本发明提供了一种试剂盒,其包含:(a)本发明的聚合酶,以及任选地本发明的多种不同的单独核苷酸和/或用于它们的包装材料。实施例产生了各种不同的9°n突变体。令人吃惊的是,在这种方法中发现了两种突变体,其对修饰的核苷酸显示出格外好的掺入速率。所述聚合酶的氨基酸序列包含下述替换突变:pla159[seqidno2]:d215a/d315a/l408y/y409t/p410s/a485l/c-端his标签pla163[seqidno4]:d215a/d315a/l408f/y409t/p410g/a485l/c-端his标签下面的表1描绘了在本研究中开发的新的合成测序聚合酶。第2-5列描述了与以前可商购的9°n聚合酶变体therminatoriii聚合酶(在本文中也被称为t3)相比,它们的氨基酸序列中的变化:突变体纯化通过ni-nta-superflow柱将带有his标签的突变聚合酶以制备规模进行纯化。根据sds凝胶分析(图1),所述突变体为99%纯。单碱基掺入测定法(ce测定法)为了度量不同聚合酶突变体掺入标记的核苷酸(=核苷酸+阻断基团+连接物-荧光基团)的能力,进行了单碱基掺入测定。将标记的通用引物和各自用于试验四种标记的核苷酸之一或四种暗核苷酸(=核苷酸+阻断基团)之一的四种未标记的模板,用于延伸反应。以2:1的比率使用分别为24个碱基对和18个碱基对的杂交的模板引物对。通过向反应添加酶或核苷酸来起始反应。在120秒的时间框架内,以确定的间隔测量在标记的引物的3'末端处的一个碱基延伸,并使用毛细管电泳分析仪进行分析。延伸和未延伸的引物的量通过电泳图的荧光峰面积进行计算,并将比率对时间进行作图。与t3和t9相比,pla159和pla163的标记核苷酸和暗核苷酸的掺入的详细数据,示出在图2至9中。使用标记的核苷酸,所有聚合酶都显示出良好的掺入性能。pla159在使用所有核苷酸时具有最高的掺入速率。它们甚至比t3参比更高。所述新的聚合酶突变体总体来说在ce测定法中表现好得多。不添加匹配核苷酸情况下的外切核酸酶活性为了测量外切核酸酶活性,将12.5nmfam标记的引物退火到25nm模板dna。在退火步骤后向所述模板/引物混合物添加聚合酶。将反应混合物在不添加核苷酸的情况下在65℃温浴60分钟。在所述温浴期后,通过毛细管电泳分析反应产物。降解的寡核苷酸和未降解的寡核苷酸的尺寸有差异(未降解的寡核苷酸的峰值尺寸:7-7.2;降解的寡核苷酸:<7)。在不同尺寸的峰的荧光峰面积的帮助下,计算降解的引物的量。与t3和t9相似,突变的聚合酶pla159和pla163两者都未显示出可检测的外切核酸酶活性,因为未能检测到比fam引物峰更小的峰。聚合酶未消化的引物消化的引物t3100%未检出t9100%未检出pla159100%未检出pla163100%未检出阳性对照51%49%表1:t3、t9、pla159、pla163和表现出外切核酸酶活性的聚合酶(阳性对照)的外切核酸酶活性[%]。pla159和pla163没有显示出外切核酸酶活性。使用匹配核苷酸时的错误掺入在实验设置中,将酶与模板-引物混合物和4种核苷酸(3种不匹配的核苷酸和1种匹配的核苷酸)温浴。在2分钟以及30分钟后测量掺入(图10),所述2分钟是在genereader运行的延伸期间为核苷酸掺入提供的时间框架。将pla159和pla163与t3和t9进行比较。由于错配掺入可能妨碍测序性能,因此应该选择具有很少或没有错配掺入的聚合酶用于测序。pla159和pla163仅在30分钟后表现出错配掺入,并且所述错误掺入率基本上与t3和t9参比相当。在模板a和模板c上,pla159在30分钟后显示出不显著的错配掺入(分别为0,027和0,013)。pla163的错配掺入仅在模板t上测量到(0,043)。阳性对照t3和t9也显示出低水平的错配掺入。对于t3来说,在模板t和模板c上,在2分钟温浴后已经检测到错配掺入(0,007和0,009)。所述比率在30分钟后略微提高(0,012和0,023)。对于t9来说,错配掺入仅在模板c上在30分钟温浴后检测到(0,034)。由于这两种聚合酶被用作测序聚合酶,因此这些低水平的错误掺入看起来对测序反应没有影响。因此,假定测量到的pla159和pla163的低水平错误掺入不妨碍任何测序反应。pla159和pla163的潜在的错配掺入是不显著的,并且不太可能对测序反应具有负面影响。两种突变体对标记的核苷酸和暗核苷酸显示出出色的掺入速率,并且可用于使用修饰的核苷酸的应用例如下一代测序。由于外切核酸酶活性以及错配掺入两者可能对酶的测序反应适用性有影响,因此我们将两者相对于t3和t9进行了评估。我们的数据表明,pla159和pla163不显示出升高的错配掺入或外切核酸酶活性。根据性能数据并考虑到对新的合成测序聚合酶的所有要求(活性、错配掺入、外切核酸酶活性),两种聚合酶pla159和pla163都比本领域中已知的聚合酶更好。几种野生型聚合酶和反转录酶与t3的比较将t3对标记核苷酸的掺入活性与不同聚合酶和反转录酶进行比较。为了将t3(9°nexo-/l408s/y409a/p410v)与9°n野生型聚合酶的exo-变体进行比较,使用了rox-n3-datp(图11,黑色条)。也将所述t3聚合酶与带有单一突变(therminator聚合酶;突变a485l)或双重突变(therminator聚合酶l408q)的其他9°nexo-突变体以及带有单一突变(l408q)的kodexo-突变体、野生型taq聚合酶、来自于qiagen的omniscript和由enzymatics销售的exo-克列诺(klenow)聚合酶进行比较。为了将这些酶与t3聚合酶进行比较,使用r6g-n3-dutp(黑色/白色条)。另外,使用cy5-n3-dgtp将各种不同的可商购rt酶与t3进行比较(白色条)。所有试验的酶对于在相应实验中使用的修饰的核苷酸都没有显示出掺入活性。因此,那些突变单独地不增强所试验的修饰核苷酸的掺入。结论:野生型酶如taq-聚合酶、omniscript、其他反转录酶、9°n或kod聚合酶的具有单一突变l408q的exo-变体,对所试验的标记核苷酸不显示出可检测的掺入活性。测定条件:聚合酶:1μg/ml核苷酸浓度:125nm模板:25nm引物:12,5nm温浴时间:2min温度:65℃所分析的聚合酶:酶名称可替选名称供应商9°nexo-/l408s/y409a/p410v–t3t3neb9°nexo-//therminator聚合酶/nebtherminator聚合酶l408q//kodexo-l408q//taq-聚合酶/qiagen克列诺exo-/enzymaticsomniscript//accuscriptrt/agilenttechnologiesmaximahminusrt/thermoscientificsuperscriptiirt/lifetechnologiesqscript/quantabiosciencesm-mulvrt/neb酶序列附图说明图1:与pla91、pla97和therminatoriii聚合酶相比,pla159和pla163突变体的凝胶分析。pla159示出在第4道中,pla163示出在第8道中。图2:ce活性数据(标记的核苷酸):与t3和修饰的neb9°n聚合酶(在本文中被称为t9)相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmr6g-n3-dutp。与t9和t3相比,pla159和pla163在使用标记的核苷酸r6g-n3-dutp时显示出更高的掺入率。图3:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmalexa-n3-dctp。与t9和t3相比,pla159在使用标记的核苷酸alexa-n3-dctp时显示出更高的掺入率。pla163显示出比t9更高的掺入率和与t3相近的掺入率。图4:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmrox-n3-datp。与t9和t3相比,pla159和pla163在使用标记的核苷酸rox-n3-datp时显示出更高的掺入率。图5:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmcy5-n3-dgtp。与t9和t3相比,pla159和pla163在使用标记的核苷酸cy5-n3-dgtp时显示出更高的掺入率。图6:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmn3-dttp。与t3相比,pla159在使用暗核苷酸n3-dttp时显示出更高的掺入率。图7:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmn3-datp。pla159在使用暗核苷酸n3-datp时显示出比t9更高的掺入率和与t3相比相近的掺入率。图8:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmn3-dctp。与t3相比,pla159在使用暗核苷酸n3-dctp时显示出更高的掺入率。pla163的掺入率高于t9并与t3相近。图9:与t3和t9相比,pla159和pla163在ce测定法中的性能。在实验中,使用1μg/ml酶和125nmn3-dgtp。与t3相比,pla159在使用暗核苷酸n3-dgtp时显示出相近的掺入率。pla163的掺入率与t9相当。所有聚合酶在使用n3-dgtp时都显示出高的掺入率。图10a-d:t3、t9、pla159和pla163的核苷酸错误掺入测量值。对每种模板使用ce测定法确定掺入。图11:t3与各种聚合酶和反转录酶的活性比较。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1