一种自发荧光可降解聚柠檬酸酯的非病毒基因载体及其制备方法与流程
本发明属于可降解生物医用材料技术领域,具体涉及一种自发荧光可降解聚柠檬酸酯的非病毒基因载体及其制备方法。
背景技术:
近年来,随着基因治疗研究的不断深入,开发具有目的基因靶向、可控并有效表达的载体是基因治疗成功的关键。虽然目前采用的基因治疗中,约有80%的载体是病毒性载体,但是由于其免疫原性高且存在潜在的致癌性,所以它的使用存在很多安全问题,但是非病毒载体能够很好地解决这些问题,并且包装尺寸小、成本低,所以非病毒载体越来越受到人们的关注。
目前,对于合成型生物可降解高分子材料的使用中,聚酯类生物材料以可控的力学及降解性能和优异的生物相容性的特点,成为最具发展潜力的一类生物材料。聚酯类生物材料可分为线性聚酯生物材料和网络型聚酯生物材料,前者有:聚ε-己内酯(PCL)、聚丙交酯(PLA)等,后者有:聚癸二酸-甘油酯(PGS)、聚柠檬酸-1,8-辛二醇酯(POC)等。POC由柠檬酸和1,8-辛二醇通过缩合反应形成的,具有合成单体无毒、生物相容性良好、反应条件容易达到并且反应过程中不引入杂质、后期成型容易、供应丰富、价格便宜,并且POC的单体柠檬酸还是人体三羧酸代谢产物,而且其上三个羧酸基团可以进行多次修饰,但是POC表面没有正电荷,而且水溶性很差,使其作为基因载体在机体内的应用受到了很大的局限,如果能够通过进一步修饰POC,使其表面电荷和水溶性得到提高,在机体中的应用将会得到很大的提高。
技术实现要素:
本发明的目的在于提供一种自发荧光可降解聚柠檬酸酯的非病毒基因载体及其制备方法,该方法工艺简单,制得的弹性体具有良好的生物相容性和基因转染效率。
为达到上述目的,本发明采用以下技术方案予以实现:
一种自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备方法,包括以下步骤:
1)将摩尔比为1:1的柠檬酸和二醇加入到50mL的圆底烧瓶中进行热聚合,待反应单体柠檬酸和二醇在160℃油浴中全部熔解后,立即降温至140℃,氮气环境或真空条件下反应5小时;反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)称取的0.5mmol水溶性聚柠檬酸酯POCG溶于15mL,50mM,pH为4~6的MES缓冲液中,搅拌使其完全溶解;再加入1.5mmol的EDC,室温搅拌30min;随后加入1.5mmol的NHS,室温搅拌12h;再加入阳离子聚合物,室温搅拌12h;产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到POCG-PEI聚合物;
3)将POCG-PEI聚合物和基因按照(2~10):1的氮磷比加入到10μl,50mM,pH为7.4的HEPES缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
本发明进一步的改进在于:
步骤1)中的热聚合在氮气气氛、惰性气体或真空环境下进行。
步骤1)中的二醇为1,8-辛二醇和聚乙二醇,柠檬酸、1,8-辛二醇和聚乙二醇的摩尔比为1:(1~0.4):(0~0.6)。
步骤2)中的阳离子聚合物为聚乙烯亚胺、聚赖氨酸、聚β-氨酯或聚酰胺-胺型树状物;其中,聚乙烯亚胺的分子量为:600Da、1.8K Da或10K Da。
步骤3)中的基因为DNA、siRNA或miRNA;POCG-PEI聚合物和DNA、siRNA或miRNA溶解到HEPES缓冲液中,得POCG-PEI/DNA复合物、POCG-PEI/siRNA复合物或POCG-PEI/miRNA复合物。
POCG-PEI聚合物和DNA、siRNA或miRNA均是以(2~10):1的氮磷比溶解到HEPES缓冲液中的。
本发明上述方法制备的自发荧光可降解聚柠檬酸酯的非病毒基因载体,该聚合物的结构式为:
与现有技术相比,本发明具有以下有益效果:
本发明针对现有基因载体所存在的生物相容性差、基因转染效率低等缺点,提供了一种自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备方法,该方法以人体天然代谢产物柠檬酸、1,8-辛二醇和聚乙二醇为单体,通过热聚合得到聚柠檬酸酯高分子预聚物(POCG);将该预聚物与不同分子量的聚乙烯亚胺(PEI)通过催化聚合,得到PEI接枝的高分子聚合物(POCG-PEI)。本发明的制备方法简单,且无有机溶剂残留,所使用的热聚合合成方法环保、操作方便、原料成本低。实验结果证明:该方法制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)具有良好的生物相容性和较高的基因转染效率,能够有效的携带基因(DNA/siRNA/miRNA)进入细胞,并且表现出一定的生物学效应。
本发明中所使用的柠檬酸、1,8-辛二醇和聚乙二醇具有良好的生物相容性和降解性,通过引入PEG,很好的改善了POC的溶解性,且PEG对于阳离子聚合物(POCG-PEI)的修饰,可以屏蔽阳离子表面的正电荷,降低其毒性和免疫原性,从而提高细胞兼容性和转染率,还可以增加阳离子聚合物在血浆中的稳定性,并减少复合物被网状内皮系统(RES)清除,延长其在血液循环中滞留的时间。
本发明还具有以下优点:
(1)本发明所使用的聚柠檬酸-二醇或多元醇(POCG预聚物)是一种可降解脂肪族聚酯高分子,其单体生物相容性良好,且廉价易得。
(2)本发明利用聚乙二醇对聚柠檬酸-二醇或多元醇(POC预聚物)进行改性,PEG的共价接入,改善了原本聚柠檬酸-二醇或多元醇的水溶性。
(3)本发明中聚乙烯亚胺(PEI)的接入,使得原本不具有表面正电荷的聚柠檬酸-二醇或多元醇(POC预聚物)展现出了一定的表面正电荷,能够有效的通过静电作用结合基因(DNA/siRNA/miRNA),并进入细胞内,并具有较高的基因转染效果。
(4)本发明中制备的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)在紫外激发下具有很强的荧光,可以实时监测材料在细胞内的动向。
(5)本发明中使用的溶剂为缓冲液,所制备的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)不存在任何的有机溶剂。
【附图说明】
图1是本发明合成的自发荧光可降解聚柠檬酸酯的非病毒基因载体中各单体以及聚合物的结构式。
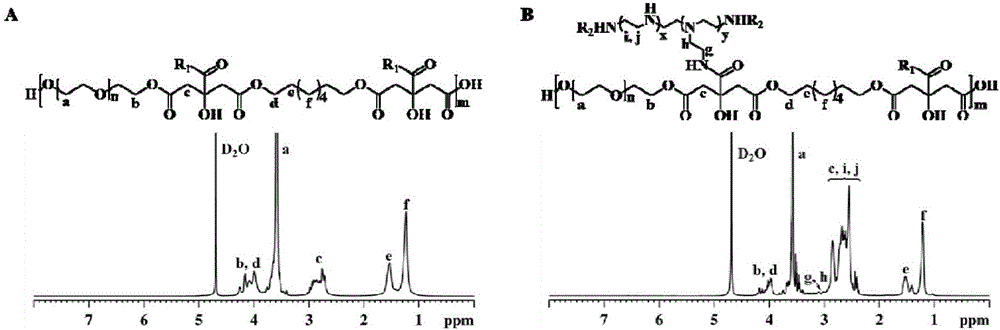
图2是制得的POCG预聚物和POCG-PEI聚合物的1H-NMR图谱。
图3为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)的光学特性。
图4为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)对于成肌细胞(C2C12,图4A)和人乳腺癌细胞(MCF-7,图4B)细胞毒性的测定。
图5为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)的活细胞荧光成像以及基因转染结果。
【具体实施方式】
下面结合附图对本发明做进一步详细描述:
本发明致力于制备一种具有良好的生物相容性和较高基因转染效率的自发荧光可降解聚柠檬酸酯的非病毒基因载体,实现其能携带基因进入细胞并产生一定生物学效应。聚柠檬酸酯预聚物(POC)因为具有可控的生物降解、良好的生物相容性以及低成本,已经广泛应用于生物医学领域。然而POC水溶性极差并且表面不含任何正电荷,导致其作为基因载体的应用受到了限制;聚乙二醇(PEG),又称聚(环氧乙烷)或聚氧乙烯,是环氧乙烷的寡聚物或聚合物,是一种无毒性、无刺激性的聚合物,具有良好的亲水性,如果用PEG修饰POC,就可以改善POC的溶解性,且PEG对于阳离子聚合物的修饰,可以屏蔽阳离子表面的正电荷,降低其毒性和免疫原性,从而提高细胞兼容性和转染率,还可以增加阳离子聚合物在血浆中的稳定性,并减少复合物被网状内皮系统(RES)清除,延长其在血液循环中滞留的时间;聚乙烯亚胺(PEI)含氮原子密度大,氨基种类多、数量大,导致其正电荷密度较大,可以与DNA之间强力结合,而且超支化的PEI含有大量的伯仲叔三种氨基,有较宽的质子缓冲区间,即独特的“质子海绵效应”,高分子量PEI虽然转染效率很高,但其细胞毒性较大,而低分子量PEI的细胞毒性很低,但其转染效率却很低。因此,在本发明中,利用PEI、PEG对聚柠檬酸酯(POC)的聚合反应所形成的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI),不仅具有良好的生物相容性和较高基因转染效率,而且材料在紫外照射下具有荧光特征,能够实时监测材料在细胞内的动向,是一种用于基因治疗的自发荧光可降解聚柠檬酸酯的非病毒基因载体。
为了更好的理解本发明,下面结合具体实施方式对本发明进行详细说明,但本发明的内容不仅仅局限于下面的实施例。
实施例1
1)POCG预聚物的制备:将总质量6g的柠檬酸和1,8-辛二醇按照1:1的摩尔比加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 600聚合物的制备:称取的0.5mmol聚柠檬酸酯(POCG)于DMSO中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量600Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体、DMSO溶剂以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 600留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 600聚合物和DNA按照3:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例2
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.4:0.6加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 600聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量600Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 600留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 600聚合物和DNA按照3:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例3
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 600聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量600Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 600留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 600聚合物和DNA按照8:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例4
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 600聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量600Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 600留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 600聚合物和siRNA按照10:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例5
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 600聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量600Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 600留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 600聚合物和miRNA按照10:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例6
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 1.8K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量1.8K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 1.8K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 1.8K聚合物和DNA按照4:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例7
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 1.8K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量1.8K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 1.8K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 1.8K聚合物和siRNA按照8:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例8
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 1.8K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量1.8K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 1.8K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 1.8K聚合物和miRNA按照8:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例9
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 10K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量10K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 10K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 10K聚合物和DNA按照2:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例10
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 10K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量10K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 10K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 10K聚合物和siRNA按照4:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例11
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PEI 10K聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入分子量10K Da的聚乙烯亚胺,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PEI 10K留作后用。
3)自发荧光可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PEI 10K聚合物和miRNA按照4:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到自发荧光可降解聚柠檬酸酯的非病毒基因载体。
实施例12
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PLL聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入聚赖氨酸,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PLL留作后用。
3)可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PLL聚合物和DNA 按照10:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到可降解聚柠檬酸酯的非病毒基因载体。
实施例13
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PAE聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入聚β-氨酯,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PAE留作后用。
3)可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PAE聚合物和siRNA按照10:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到可降解聚柠檬酸酯的非病毒基因载体。
实施例14
1)POCG预聚物的制备:将总质量6g的柠檬酸、1,8-辛二醇和聚乙二醇按照摩尔比1:0.7:0.3加入到50mL圆底烧瓶中,氮气环境下搅拌放入160℃油浴中熔解;待反应单体柠檬酸、1,8-辛二醇和聚乙二醇全部熔解后,温度立即降至140℃,氮气环境下反应5小时。反应产物在去离子水中透析纯化2天,冷冻干燥留做后用;
2)POCG-PAMAM聚合物的制备:称取的0.5mmol水溶性聚柠檬酸酯(POCG)于15mL,50mM,pH 4-6的MES缓冲液中搅拌使其完全溶解,再加入1.5mmol EDC,室温搅拌30min,随后加入1.5mmol NHS,室温搅拌12h,再加入聚酰胺-胺型树状物,室温搅拌12h,产物在去离子水中透析纯化2天,以除去未发生反应的单体以及催化剂EDC和NHS,冷冻干燥得到阳离子聚合物POCG-PAMAM留作后用。
3)可降解聚柠檬酸酯的非病毒基因载体的制备:将POCG-PAMAM聚合物和miRNA按照10:1的氮磷比加入到10μl,50mM,pH 7.4的HEPES缓冲液中,37℃温育30分钟以便形成稳定的纳米复合物,即得到可降解聚柠檬酸酯的非病毒基因载体。
本发明所制备的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)可以有效的结合各种基因(DNA/siRNA/miRNA),并且形成的复合物能够有效的防止基因被机体内的核酸酶降解,在聚阴离子(肝素钠)的作用下,基因又能有效的从材料中释放出来,POCG-PEI也表现出良好的生物相容性以及较高的基因转染效率,同时,POCG-PEI也表现出一定的荧光特性和光学稳定性,这使得在基因转染过程中对于材料的实时监测提供了可能,下面结合实验数据详细分析。
由本发明方法制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体,其结构式为:
图1是本发明合成的自发荧光可降解聚柠檬酸酯的非病毒基因载体中各种单体以及聚合物的结构式,其中A为柠檬酸的结构式,B为1,8-辛二醇的结构式,C为聚乙二醇的结构式,D为POCG预聚物的结构式,E为POCG-PEI聚合物的结构式。
图2是制得的POCG预聚物和POCG-PEI聚合物的1H-NMR图谱,从图2A中可以看出,1,8-辛二醇上的亚甲基(-CH2)质子峰分别位于1.2,1.5,3.9和4.1ppm,聚乙二醇上的亚甲基(-CH2)质子峰分别位于3.5,4.2和4.3ppm,而位于2.6-3.0ppm的多重峰归属于柠檬酸的亚甲基质子;其中3.9,4.1,4.2和4.3ppm的出现说明POCG的成功合成,此外,图2B中,2.4和2.9ppm的为聚乙烯亚胺的亚甲基峰(-NHCH2CH2-),而3.0和3.1ppm的质子峰(-CONHCH2-)的出现说明PEI已成功接枝到POCG预聚物上并形成了新的POCG-PEI聚合物。
图3为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)的光学特性。从图3A和3B可以看出,POCG-PEI在365nm的激发波长下表现出最强的荧光强度,其发生波长在440nm,从图3C中可以看出,预聚物POCG和单体PEI具不具备荧光特性,只有两者结合在一起,在紫外激发下才会表现出一定的荧光特性。
图4为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)对于成肌细胞(C2C12,图4A)和人乳腺癌细胞(MCF-7,图4B) 细胞毒性的测定。可以看出,POCG-PEI 600和POPCG-PEI 1.8K相比POCG-PEI 10K的细胞毒性特别低,甚至对细胞的增殖有一定的促进作用。
图5为本发明制得的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI)的活细胞荧光成像以及基因转染结果,图5A的蓝光表示POCG-PEI聚合物,图5B的红光表示细胞核,图5C的绿光是miRNA转染后在细胞中表达的一种绿色荧光蛋白,图5E是细胞在明场条件下的照片,图5D和5F是几种照片的合并图。可以看出,POCG-PEI聚合物可以携带基因顺利进入细胞并使基因表达,这些结果为POCG-PEI聚合物有望作为一种基因载体提供了可能。
本发明中所制备的自发荧光可降解聚柠檬酸酯的非病毒基因载体(POCG-PEI),制备过程简单,可以有效的结合各种基因(DNA/siRNA/miRNA),并且形成的复合物能够有效的防止基因被机体内的核酸酶降解,在聚阴离子(肝素钠)的作用下,基因又能有效的从材料中释放出来,POCG-PEI也表现出良好的生物相容性以及较高的基因转染效率,同时,POCG-PEI也表现出一定的荧光特性和光学稳定性,因此该聚合物体在基因治疗中有着很好的应用前景。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!