一种端粒酶活性比色检测法的制作方法
本发明属于肿瘤检测技术领域,具体涉及一种基于溶液颜色变化而实现癌细胞中端粒酶活性简单、灵敏裸眼比色检测的方法。
背景技术:
端粒是一种位于真核细胞染色体末端的特殊结构,由端粒DNA和端粒相关蛋白构成,其端粒DNA由非编码的重复序列组成,不同物种的重复序列不同,如人的端粒DNA由5′-TTAGGG-3′重复序列组成,长度为4~15kb不等。端粒的主要功能是保护染色体末端、防止染色体融合、重组和降解。在正常细胞中,随着细胞的不断增殖,端粒会逐渐的缩短,当端粒缩短到一定程度时,染色体不稳定,细胞就会衰老、死亡。端粒酶是由RNA模板、端粒相关蛋白组成的一种核糖核蛋白酶,具有逆转录酶的活性,可以以自身RNA为模板,通过逆转录合成端粒重复序列并连接到染色体末端,用来补偿细胞分裂时端粒长度的缩短,从而让肿瘤细胞获得无限增殖的能力。有研究表明80%以上的肿瘤细胞中都可以检测到端粒酶活性,而在正常体细胞中无端粒酶活性。同时,研究表明,抑制端粒酶活性,可以抑制肿瘤细胞的增值,到达治疗肿瘤的目的。因此,端粒酶被认为是一种重要的肿瘤的标示物,灵敏且简单的端粒酶活性检测方法对于肿瘤的临床诊断、治疗以及预后评估都有很重要的意义(Multiplexed electrical detection of cancer markers with nanowire sensor arrays[J].Nat.Biotechnol.2005,23,1294-1301)。
截止目前,端粒重复序列扩增法(TRAP)仍然是经典的端粒酶活性检测方法(Kim,N.W.;Piatyszek,M.A.;Prowse,K.R.;Harley,C.B.;West,M.D.;Ho,P.L.C.;Coviello,G.M.;Wright,W.E.;Weinrich,S.L.;Shay,J.W.Specific Association of Human Telomerase Activity with Immortal Cells and Cancer[J].Science 1994,266,2011-2015.)。该方法是基于聚合酶链式反应(PCR),当细胞存在端粒酶活性时,端粒酶引物会被延长,在引物的3’末端加上数量不等的TTAGGG端粒序列,通过PCR对被延长的引物进行扩增,再经过凝胶电泳和染色,对扩增产物进行检测,实现端粒酶活性的检测。该方法虽然灵敏度高,但是TRAP法受到PCR衍生的一些问题的影响,如细胞裂解液中DNA聚合酶抑制剂的影响,产生假阴性信号,PCR非特异扩增产生假阳性信号等。
近年来,为了克服TRAP法存在的问题,许多无需PCR的端粒酶分析方法已经被建立。其中,比色法因其可以实现裸眼检测、无需仪器辅助的优势而受到许多研究者的青睐。
技术实现要素:
本发明所要解决的技术问题是克服现有技术中端粒酶活性检测所需仪器价格昂贵、实用性不强等缺陷,提供一种基于辣根过氧化物酶(HRP)催化3,3',5,5'-四甲基联苯氧化,实现简单灵敏的端粒酶活性比色检测方法。
解决上述技术问题所采用的技术方案由下述步骤组成:
1、将氨基化的磁珠与醛基化的端粒酶引物反应,使端粒酶引物偶联到磁珠表面,并用戊醛与磁珠表面多余的氨基反应,制备成磁珠/端粒酶引物复合物。
2、将待测细胞进行裂解提取端粒酶,以提取的端粒酶RNA为模板,对磁珠/端粒酶引物复合物进行延长。
3、将磁珠/端粒酶引物复合物和步骤2的延长产物分别与生物素修饰的cDNA探针进行杂交。
4、将步骤3的两个杂交产物分别与链霉亲和素-辣根过氧化物酶在37℃下培育30~40分钟。
5、将步骤4的两个培育产物分别与3,3',5,5'-四甲基联苯胺显色液在33~37℃下反应10~20分钟,反应完后,观察两个溶液的颜色,若待测细胞对应溶液的颜色比磁珠/端粒酶引物复合物对应溶液的颜色深,说明待测细胞有活性端粒酶,否则,待测细胞无活性端粒酶。
上述醛基化的端粒酶引物的序列为5’-CHO-TTTTTTTTTTTTTTTTTTTTAATCCGTCGAGC AGAGTT-3’;所述生物素修饰的cDNA探针的序列为5’-生物素-TTTTTTTTTTCCCTAACCCTAACCCTAA-3’。
上述的3,3',5,5'-四甲基联苯胺显色液是1.0mg/mL3,3',5,5'-四甲基联苯胺的乙醇溶液、pH=5.2的柠檬酸-Na2HPO4缓冲溶液、体积浓度为30%的H2O2水溶液按照体积比100:900:1的混合液。
本发明结合磁分离,利用辣根过氧化物酶对3,3',5,5'-四甲基联苯胺的催化作用,构建了一种裸眼比色检测端粒酶活性的方法。当存在活性端粒酶时,端粒酶与修饰在磁珠表面的端粒酶引物结合,使端粒酶引物沿着3’端进行延长,形成由多个TTAGGG重复序列的单链寡核苷酸。这段形成的TTAGGG重复序列可以与多个生物素修饰的cDNA杂交,结合到磁珠表面的cDNA可以捕获链霉亲和素-辣根过氧化物酶,被捕获到磁珠表面的辣根过氧化物酶可以催化3,3',5,5'-四甲基联苯胺发生氧化,使溶液由无色变成蓝色,此过程的反应速度快,产生的蓝色明显。通过溶液颜色的变化,即可实现对端粒酶活性的比色检测。本发明方法通过溶液颜色的变化实现简单灵敏的端粒酶活性比色检测,而且可以检测不同类型癌细胞中端粒酶活性的表达水平,区分癌细胞与正常细胞,在以端粒酶为标示物的癌症检测和以端粒酶为靶标的治疗监测方面具有重要的意义。
附图说明
图1是活性海拉细胞(HeLa)、失活海拉细胞、正常细胞(HL-7702)、无cDNA、无HRP及CHAPS裂解液对应3,3',5,5'-四甲基联苯胺显色液的照片。
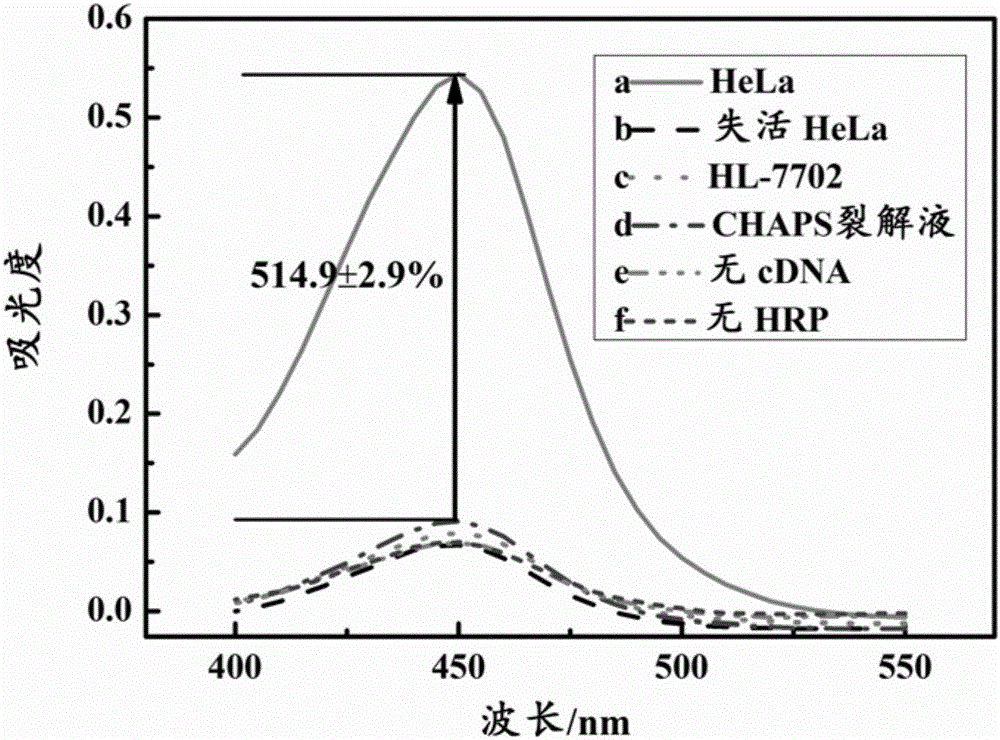
图2是3,3',5,5'-四甲基联苯胺显色液在活性海拉细胞(HeLa)、失活海拉细胞、正常细胞(HL-7702)、CHAPS裂解液、无cDNA及无HRP对应3,3',5,5'-四甲基联苯胺显色液的紫外可见吸收光谱。
图3是不同数量海拉细胞(HeLa)对应3,3',5,5'-四甲基联苯胺显色液的照片。
图4是不同数量海拉细胞(HeLa)对应3,3',5,5'-四甲基联苯胺显色液的吸收光谱。
图5是不同类型的细胞对应3,3',5,5'-四甲基联苯胺显色液的吸光度。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但是本发明的保护范围不仅限于这些实施例。
实施例1
以检测海拉细胞(HeLa)中的端粒酶为例,具体检测方法如下:
1、将3.2μL浓度为50mg/mL氨基化的磁珠(NH2-MB,由陕西北美基因股份有限公司)用0.1mol/L PBS缓冲溶液清洗3次,然后将清洗干净的氨基化的磁珠加入到360μL 0.1mol/L PBS缓冲溶液中,并加入40μL浓度为2μmol/L醛基化的端粒酶引物(由生工生物工程(上海)股份有限公司提供,序列为:5’-CHO-TTTTTTTTTTTTTTTTTTTTAATCCGTCGAGCAGAGTT-3’),于30℃旋涡震荡反应2小时。反应完后,用等体积0.1mol/L PBS-T缓冲溶液和0.1mol/L PBS缓冲溶液各洗涤两次,然后将清洗后的磁珠分散于400μL 0.1mol/L PBS缓冲溶液中,并向其中加入25.2μL浓度为7mmol/L的正戊醛水溶液,于25℃旋涡震荡反应10小时。反应完后,用0.1mol/L PBS缓冲溶液清洗3次,除去未反应的正戊醛,得到磁珠/端粒酶引物复合物。将磁珠/端粒酶引物复合物分散于400μL 0.1mol/L PBS缓冲溶液中,置于冰箱中4℃保存备用。
2、按照常规方法将培养好的HeLa细胞进行裂解提取端粒酶,获得含端粒酶的细胞裂解液;取步骤1所得的磁珠/端粒酶引物复合物溶液20μL,用端粒酶延长缓冲溶液洗涤3次,然后用2×端粒酶延长缓冲溶液定容至10μL,再向其中加入1μL 10μmol/L dNTPs水溶液和200个海拉细胞所对应的含端粒酶的细胞裂解液,用无菌无酶水定容至20μL,于30℃震荡培育3小时,进行端粒酶延长反应,然后通过磁性分离的方法用0.1mol/L PBS-T缓冲溶液和0.1mol/L PBS缓冲溶液各洗涤两次,得到端粒酶引物的延长产物。
3、将磁珠/端粒酶引物复合物和步骤2得到的端粒酶引物的延长产物分别分散于20μL 0.1mol/L PBS缓冲溶液中,然后分别加入1μL 2μmol/L生物素修饰的cDNA(由生工生物工程(上海)股份有限公司提供,序列为5’-生物素-TTTTTTTTTTCCCTAACCCTAACCCTAA-3’)的PBS缓冲溶液(0.1mol/L),于35℃震荡培育1.5小时,进行杂交反应,然后通过磁性分离的方法用10mmol/L PBS-T缓冲溶液洗涤3次,分别得到两个杂交产物。
4、将步骤3的两个杂交产物分别分散于20μL 10mmol/L PBS-T缓冲溶液中,并分别加入1μL 0.5μg/mL链霉亲和素-辣根过氧化物酶(由北京博奥森生物技术有限公司提供),于37℃震荡培育30分钟,再通过磁性分离的方法用10mmol/L PBS-T缓冲溶液洗涤3次,分别得到两个培育产物。
5、将步骤(4)的两个培育产物分别加入到40μL 3,3',5,5'-四甲基联苯胺显色液中(1.0mg/mL 3,3',5,5'-四甲基联苯胺的乙醇溶液、pH=5.2的柠檬酸-Na2HPO4缓冲溶液、体积浓度为30%的H2O2水溶液按照体积比100:900:1的混合液),在37℃下反应15分钟,反应完后,通过磁性分离的方法将磁珠与溶液分开,裸眼观察两个溶液的颜色。
上述检测方法的步骤2中,将200个海拉细胞所对应的含端粒酶的细胞裂解液分别用热失活的海拉细胞(HeLa)裂解液或正常细胞(HL-7702)裂解液或纯粹的CHAPS裂解液替换,进行对比实验。
同时,发明人在上述检测海拉细胞(HeLa)中端粒酶的过程中,分别以不加链霉亲和素-辣根过氧化物酶或生物素修饰的cDNA,进行对比实验。
由图1的实验结果可见,不加生物素修饰cDNA或链霉亲和素-辣根过氧化物酶时,溶液均未出现明显的颜色,与磁珠/端粒酶引物复合物对应的溶液颜色基本相同,而生物素修饰cDNA和链霉亲和素-辣根过氧化物酶同时存在时,海拉细胞(HeLa)对应的溶液出现了明显的蓝色,即海拉细胞(HeLa)对应溶液的颜色比磁珠/端粒酶引物复合物对应溶液的颜色深,说明海拉细胞(HeLa)有活性端粒酶,同时说明存在活性端粒酶时,端粒酶引物会被延长,生物素化cDNA能与被延长的端粒酶引物杂交,最终链霉亲和素-辣根过氧化物酶会结合到磁珠表面,催化3,3',5,5'-四甲基联苯胺显色液产生颜色的变化。另外,在生物素修饰cDNA和链霉亲和素-辣根过氧化物酶同时存在时,热失活的海拉细胞(HeLa)、正常细胞(HL-7702)、纯粹的CHAPS裂解液对应的溶液颜色均为无色,与磁珠/端粒酶引物复合物对应溶液的颜色相同,说明热失活的海拉细胞(HeLa)和正常细胞(HL-7702)、纯粹的CHAPS裂解液无活性端粒酶。该检测结果与紫外可见吸收光谱仪检测的吸光度结果一致(见图2)。
为了证明本发明的有益效果,发明人采用实施例1的方法,对不同数量海拉细胞对应的端粒酶进行检测,结果如图3和4所示。从图3可知,随着海拉细胞的增加,3,3',5,5'-四甲基联苯胺显色液产生的颜色逐渐加深,通过裸眼观察,能将5个海拉细胞产生的颜色与空白区分开,利用紫外可见光谱能将1个海拉细胞产生的颜色与空白区分开(见图4)。说明本发明方法可以对端粒酶活性实现灵敏的比色检测。
为了进一步证明本发明的有益效果,发明人采用实施例1的方法,对不同类型的细胞中的端粒酶进行检测,结果如图5所示。由图5可知,当海拉细胞(HeLa)、胃癌细胞(AGS)、人急性淋巴白血病细胞(CCRF-CEM)、人乳腺癌细胞(MDA-MB-231)等癌细胞存在时,能产生较大的吸光度值,而失活海拉细胞及人正常肝细胞(HL-7702)存在时,吸光度均小于0.1。说明本发明方法可以用于不同种类癌细胞中端粒酶活性的检测,能区分正常细胞与癌细胞。
上述检测方法中,所用的端粒酶延长缓冲溶液中包含有20mmol/L三羟甲基氨基甲烷-盐酸缓冲溶液,pH=8.3,1.5mmol/L MgCl2,1mmol/L EGTA,63mmol/L KCl,0.05%吐温-20,0.2mmol/L dNTPs,0.1mg/mL BSA(Wang J.S.,Wu L.,Ren J.S.,and Qu X.G.[J].Visualizing Human Telomerase Activity with Primer-Modified Au Nanoparticles.Small.2012,8(2):259-264);所用的0.1mol/L PBS缓冲溶液是含0.1mmol/L KCl、10mmol/L MgCl2的0.1mmol/L pH=7.4的磷酸钠缓冲溶液,0.1mol/L PBS-T缓冲溶液是含0.1mmol/L KCl、10mmol/L MgCl2、0.02%(体积浓度)吐温-20的0.1mmol/L pH=7.4的磷酸钠缓冲溶液,10mmol/L PBS-T缓冲溶液是含0.4mol/L NaCl、0.1%(体积浓度)吐温-20的10mmol/L pH=7.4的磷酸钠缓冲溶液。
- 还没有人留言评论。精彩留言会获得点赞!