鳖亚科生物成分特异性实时荧光检测方法及其试剂盒与流程
本发明属于PCR检测领域,更具体地,本发明涉及鳖亚科生物成分特异性实时荧光检测方法及其试剂盒。
背景技术:
鳖亚科生物俗称甲鱼,隶属爬虫纲Reptilia龟鳖目(Testudines)、鳖科(Trionychidae),为软壳水生龟的统称,中国现存最主要的有中华鳖(Pelodiscus sinensis)、鼋(Pelochelys cantorii)、山瑞鳖(Palea steindachneri)等,其中最为常见的为中华鳖,最受人们欢迎,其需求量也最大,经济价值也最高。
鳖亚科生物不但味道鲜美、高蛋白、低脂肪,而且是含有多种维生素和微量元素的滋补珍品,能够增强身体的抗病能力及调节人体的内分泌功能,也是提高母乳质量、增强婴儿的免疫力及智力的滋补佳品(国家药典委员会,中华人民共和国药典,iv部[Z],北京:北京化学工业出版社,2000:1-317)。它不仅是餐桌上的美味佳肴,而且是一种用途很广的滋补药品和中药材料,自古以来就被人们视为滋补的营养保健品。由于鳖亚科生物具有较高的营养价值以及药用价值,近些年需求量逐年增加。2013年我国鳖亚科生物总产量达30万吨。
大多数鳖亚科生物(如中华鳖),自然外塘养殖需要3年以上的时间才能作为商品上市。由于其生长周期慢,对于一些加工品鳖亚科生物商品,一些不法商家,受利益驱使,用一些非鳖亚科生物材料来假冒替换鳖亚科生物的现象时有发生。
目前,中国的鳖亚科生物制品主要有粉、液、酒、胶囊等,这些深加工产品由于缺乏完整的形态学特征,故很难从形态学上鉴定。某些不法商贩为利益最大化,常用非鳖亚科生物成分充当鳖亚科生物,这不仅影响鳖亚科生物贸易市场的公正性,而且还侵害了消费者的合法权益。为了维护消费者权 益,规范交易市场,因此建立鳖亚科生物成分的分子检测方法尤为重要。
加工品鳖亚科生物,由于缺乏外观特征,其真伪很难辨别。而目前,还未见国内外有公开报道针对鳖亚科生物成分鉴定方法。
因此,本领域需要建立快速、准确、易推广的鳖亚科生物成分的鉴定方法,用于对鳖亚科生物进行明确的区分。
技术实现要素:
本发明的目的在于提供鳖亚科生物成分特异性实时荧光检测方法及其试剂盒。
在本发明的第一方面,提供一种鉴定鳖亚科生物成分的方法,所述方法包括:
以待测样品的DNA为模板,以SEQ ID NO:1和SEQ ID NO:2所示的引物进行PCR扩增;若发生特异性扩增,则表明待测样品中包含鳖亚科生物成分。
在一个优选例中,所述的方法中,以SEQ ID NO:1和SEQ ID NO:2所示的引物以及SEQ ID NO:3所示的Taqman探针进行实时荧光PCR检测。
在另一优选例中,所述的方法中,以真核生物18S rRNA作为检测内参,检测真核生物18S rRNA的引物如SEQ ID NO:4和SEQ ID NO:5所示。
在另一优选例中,所述的方法中,以SEQ ID NO:4和SEQ ID NO:5所示的引物以及SEQ ID NO:6所述的Taqman探针进行真核生物18S rRNA的实时荧光PCR检测。
在另一优选例中,所述的方法中,所述的待测样品是食品、饮料、保健品。
在本发明的另一方面,提供一种用于鉴定鳖亚科生物成分的引物,所述引物是引物对,其序列如SEQ ID NO:1和SEQ ID NO:2所示。
在本发明的另一方面,提供一种用于鉴定鳖亚科生物成分的Taqman探针,所述的探针序列如SEQ ID NO:3所示。
在本发明的另一方面,提供所述的引物和所述的Taqman探针的用途,用于从待测样品中鉴定鳖亚科生物成分。
在本发明的另一方面,提供一种鉴定鳖亚科生物成分的试剂盒,其中包括前面所述的引物和Taqman探针。
在另一优选例中,所述试剂盒中还包括:检测真核生物18S rRNA的引物,其序列如SEQ ID NO:4和SEQ ID NO:5所示;较佳地,还包括SEQ ID NO:6所述的Taqman探针。
在另一优选例中,所述试剂盒中还包括选自以下的试剂:DNA提取试剂,Taq酶,PCR缓冲液,DNA聚合酶,和/或说明鉴定鳖亚科生物成分的方法的使用说明书。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
图1、特异性试验结果。
图2、鳖亚科生物特异性序列标准曲线及曲线方程。
图3、实际样品PCR扩增结果。其中,A、B为2种鳖亚科生物罐头;C、D、E为三种鳖亚科生物干粉。
具体实施方式
本发明人经过广泛而深入的研究,首次揭示一种可特异性鉴定鳖亚科生物成分的引物,所述引物针对含有鳖亚科生物成分的DNA可发生特异性扩增(获得阳性结果),而对没有鳖亚科生物成分的DNA不发生特异性扩增(获得阴性结果)。为了简化PCR扩增方法,本发明人还设计了配合所述引物的、用于进行实时荧光PCR的Taqman探针。采用所述的引物配合Taqman探针,可良好地应用于鉴定鳖亚科生物成分,并且具有良好的再现性、灵敏度。
引物和探针
本发明人通过鳖亚科生物及其它物种在基因层面的比较和筛选,确定将线粒体细胞色素b基因作为检测的靶基因,经比对分析和反复试验,获得了特异性地扩增鳖亚科生物的引物、探针,从而建立了用于检测鳖亚科生物成 分的实时荧光PCR方法,达到鉴定鳖亚科生物成分的目的,确保食品质量安全。
因此,本发明提供一种引物,所述的引物具SEQ ID NO:1和SEQ ID NO:2所示的核苷酸序列。
本发明的这些引物还可以用放射性同位素、生物素、酶、荧光素或其他化学发光物质进行标记。
本发明还提供一种探针,所述的探针具有SEQ ID NO:3所示的核苷酸序列;较佳地,所述的探针是Taqman探针,从而便于实时荧光检测。
本发明还提供了一组适用于检测内参的引物探针,其以真核生物18S rRNA作为检测靶标。
作为本发明的优选方式,提供了以真核生物18S rRNA作为检测内参,检测真核生物18S rRNA的引物,其序列如SEQ ID NO:4和SEQ ID NO:5所示。更优选地,还提供了特异性鉴定所述引物的扩增产物的Taqman探针,其序列如SEQ ID NO:6所示。
PCR方法
基于本发明所提供的适用于鉴定鳖亚科生物成分的特异性引物及探针,本发明还提供了一种鉴定鳖亚科生物成分的方法,所述方法包括:以待测样品的DNA为模板,以SEQ ID NO:1和SEQ ID NO:2所示的引物进行PCR扩增;若发生特异性扩增,则表明待测样品中包含鳖亚科生物成分。
获取待测样品的DNA的方法是本领域技术人员所熟知的技术,例如可采取传统的酚/氯仿/异戊醇法,或者可采用一些商购的DNA提取试剂盒,这类试剂盒是本领域技术人员熟知的。
聚合酶链反应(PCR)技术是本领域技术人员熟知的技术,其基本原理是体外酶促合成特异DNA片段的方法。本发明的方法可采用常规的PCR技术进行。
在本发明的优选实施方式中,采用Taqman实时荧光PCR检测技术:在PCR扩增时,在加入一对引物的同时加入一个特异性的标记有荧光素的Taqman探针,该探针为一寡核苷酸,其两端分别标记一个报告荧光基团和一 个淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’→3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,荧光素游离于反应体系中,在特定光激发下发出荧光,随着循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得Ct(cycle threshold,Ct)值。Ct值,即PCR扩增过程中扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数,它与模板的起始拷贝数的对数存在线性关系,模板DNA量越多,荧光达阈值的循环数越少,也即Ct值越小,从而实现对起始模板定量及定性的分析。
利用本发明的引物及探针,只需进行PCR反应和/或琼脂糖凝胶电泳,并通过判断相应的PCR产物的有无,就可以准确、快速地判断待测样品是否含有鳖亚科生物成分,而且所需的样品量很少,对于微量的鳖亚科生物成分也能检出,灵敏度非常高。
经全面测试,本发明建立的检测方法是特异于鳖亚科生物成分的检测,该检测方法绝对检测下限与定量下限都为1pg;且具有良好的可重复性,因此建立的该检测方法满足日常检测的要求。对于市售的实际样本的检测,其结果表明,五份标注含“鳖亚科生物”成分的实际样本,五份样本都能检出鳖亚科生物成分,其中有4分样本课本可能不同程度的含有其它非鳖亚科生物成分的材料,表明加工的鳖亚科生物商品存在掺假现象。
因此,本发明建立的鳖亚科生物成分实时荧光PCR检测特异性高、灵敏度高、可重复性好,可适用于食品中鳖亚科生物成分的检测,且满足口岸和相关实验室日常检测要求,并为我国鳖亚科生物贸易市场的规范化和有序化提供了必要的技术支撑。
试剂盒
本发明还涉及一种用于鉴定鳖亚科生物成分的试剂盒,所述试剂盒中含有SEQ ID NO:1和SEQ ID NO:2所示的引物;更佳地,所述的试剂盒中还含有SEQ ID NO:3所示的探针。
作为本发明的优选方式,所述的试剂盒中还包括:如SEQ ID NO:4和SEQ ID NO:5所示的引物,用于扩增内参基因。更佳地,所述的试剂盒中还包括: 如SEQ ID NO:6所示的探针。
此外,所述的试剂盒还可含有其它鉴定鳖亚科生物成分的试剂,如(但不限于):
(A)各种PCR反应用试剂,例如但不限于:Taq酶,PCR缓冲液,dNTP,DNA聚合酶等;或
(B)各种提取DNA(即制备PCR反应模板)所需的试剂,例如但不限于:酚、氯仿、异戊醇、NaCl等;或
(C)提取DNA的试剂盒。
此外,所述的试剂盒中还可含有鉴定鳖亚科生物成分的使用说明书和/或标准操作程序。
本发明所述的试剂盒可实现快速检测、批量检测鳖亚科生物成分的目的。
本发明的主要优点在于:
(1)首次揭示一种可特异性鉴定鳖亚科生物成分的引物,所述的引物特异性良好,对于多种鳖亚科生物成分能够实现特异性扩增,而对于鳖亚科生物以外的其它物质则不能特异性扩增。并且,所述引物具有良好的再现性、结果稳定可靠。
(2)利用所述的引物或含有所述引物的检测试剂盒,可快速、大批量地检测鳖亚科生物成分,从待测样品中快速准确地区分真假鳖亚科生物成分,并且所需样品量少,操作简单。
(3)较佳地,本发明应用Taqman实时荧光PCR技术,可快速实现待测样品如食品中鳖亚科生物源性成分的准确鉴定。
(4)本发明的方法的推广应用对保障产品的质量,保护消费者知情权和选择权,维护正常的经济秩序等提供了技术支持。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
I.材料与方法
1、实验材料
向全国各地的甲鱼养殖场收集、购买甲鱼,收集到的甲鱼样本共计13种,包括黄沙鳖(Truogx sinensis)、黑鳖(Aspideretes nigricans)、珍珠鳖(Apalone ferox)、山瑞鳖(Palea steindachneri)、角鳖(Apalone spinifera)、小鳖(Pelodiscus parviformis)、印度小头鳖(Chitra indica)、缅甸缘板鳖(Lissemys scutata)以及来自五个省份(广西、湖南、信阳、浙江萧山、山东)的中华鳖(Pelodiscus sinensis)。
2、主要试剂和仪器
本实验所用主要试剂有实时荧光2×Taqman Master Mix(Applied Biosystems,美国);引物及探针。
本实验所用主要仪器设备有ViiA7实时荧光定量PCR仪(Applied Biosystems,美国);微量分光光度计(GE公司Nanovue Plus,美国);超净工作台和生物安全柜。
3、方法
(1)DNA提取
所有鳖亚科生物(甲鱼)基因组DNA提取与纯化均采用苯酚/氯仿法。具体操作如下:取100mg新鲜冷冻鳖亚科生物(甲鱼)样本,加800μL组织细胞裂解液(Tiangen,GP1),混匀,加100μg蛋白酶K,混匀,65℃孵育20min(每间隔数分钟震荡混匀1次);加等体积苯酚/氯仿,混匀,12000rpm离心10min;将上清液转移至新的离心管,加等体积的氯仿,混匀,12000rpm离心5min;将上清转液移至新的离心管,加1/10体积的3M NaAc(pH5.2),2倍体积冰乙醇,混匀,-20℃孵育30min,12000rpm,4℃离心30min;去上清液,75%的乙醇洗涤2次,12000rpm,4℃离心2min;去上清,室温干燥30min,加100μL TE使DNA重新悬浮。利用微量分光光度计(GE公司NanoPlus,美国)测定A260、A280及A230的吸收值,确定DNA的浓度和纯度,置-20℃保存备用。
(2)引物和探针设计
本发明人根据鳖亚科物种的基因组特点并综合分析与鳖亚科有亲缘关系较近的其它物种的基因组特点,经过大量的分析比较,确定以鳖亚科细胞色素b基因(Cytochrome b基因,Cytb基因)作为特异性基因,并且以该基因上的多个特定位点设计检测引物和探针来分析检测结果的特异性和准确性。
经反复检测验证,本发明人确定鳖亚科生物成分检测靶序列及特异性引物探针如表1。
表1、鳖亚科生物成分实时荧光PCR引物、探针序列
备注:探针也可选用其它合适的荧光报告基团和荧光淬灭基团组合。
(3)PCR反应体系及条件
18S rRNA PCR
18S rRNA PCR反应体系总体积25μL:
PCR扩增反应条件为:
50℃热启动2min;
95℃预变性10min;
95℃变性15s,60℃退火/延伸60s,共计40个循环;
60℃收集荧光信号。
鳖亚科生物成分实时荧光PCR
PCR反应体系总体积25μL:
PCR扩增反应条件为:
50℃热启动2min;
95℃预变性10min;
95℃变性15s,58℃退火/延伸60s,共计40个循环;
58℃收集荧光信号。
(4)特异性实验
为了测试建立的鳖亚科生物Real-time定量PCR检测方法的特异性,本发明采用此定量检测方法,以绵羊、牛、山羊、马、猪、鸡、鼠、猴、鸭、鱼、鹅、乌龟、大豆、棉籽、玉米以及13种鳖亚科生物基因组DNA为模板,进行实时荧光PCR扩增,每个样本三个平行试验。
(5)标准曲线的建立
为建立该检测方法的标准曲线,确定检测方法的可重复性,本发明人利用鳖亚科生物DNA的5浓度梯度稀释液(10、1、0.1、0.01、0.001ng/μL)分别进行扩增,每个浓度设置4个平行。分析统计实验结果,建立以DNA模板量的对数值为横坐标,相对应Ct值为纵坐标的标准曲线,并计算R2和反应效率(E)。
反应效率E计算公式:E=[100(-1/k)-1]×100%(k为标准曲线斜率)
(6)灵敏度实验和可重复性分析
选取鳖亚科生物材料提取基因组DNA,如中华鳖(江苏)、黄沙鳖、美国山瑞、角鳖、珍珠鳖,将提取的基因组DNA溶液稀释至0.1、0.01、0.001、0.0005、0.0001ng/μL,即浓度梯度为0.2、0.02、0.002、0.001、0.0002ng进行实时荧光PCR扩增,每个浓度设置5个平行,实验重复4次,即每个浓度得到20个对应的Ct值,计算阳性扩增的次数。分析统计实验结果,确定绝对检测下限LOD值(检出率>95%)与绝对定量下限LOQ值(检出率100%,RSDr≤25%)(GM Food and Feed,Definition of Minimum Performance Requirements for Analytical Methods of GMO Testing,European Network of GMO laboratories(ENGL),13October 2008,Date of application;13April 2009)。另外,对本发明对建立的检测方法进行可重复性分析,确定Ct值的标准偏差(SD)与相对标准偏差(RSDr)。
(7)实际样品测试
为验证建立的检测方法的实际可应用性,本发明人收集来自市场标注含“鳖亚科生物”成分的5份鳖样,并对实际样品进行测试。每个样品分别提取三份DNA,对其进行18SrRNA以及建立的鳖亚科生物成分检测的引物和探针进行实时荧光PCR扩增,每份DNA样品1个平行反应,DNA模板量100ng。
II.实施例
实施例1、核酸提取结果
所有提取的动植物基因组DNA经微量分光光度计及0.8%凝胶电泳检测,DNA浓度在500~600ng/μL之间,OD260/OD280值在1.8~2.0之间,基因组DNA完整性良好。
结果表明,所提取的基因组DNA符合进一步定量实验的要求。
实施例2、特异性实验
本发明利用常见动植物基因组DNA为模板,对建立的鳖亚科生物定量PCR检测方法的特异性进行了测试,当以真核生物18SrRNA引物/探针进行PCR扩增反应时,所有动植物样品均出现显著的S型扩增曲线,而阴性对照和空白对照则无。当以鳖亚科生物引物/探针进行PCR扩增反应时,只有鳖亚科生物样品有明显的S型扩增曲线,而其它常见动植物、阴性对照和空白对照则无,如图1。
因此,本发明建立的实时荧光定量PCR检测方法高特异于鳖亚科生物。
实施例3、标准曲线的建立
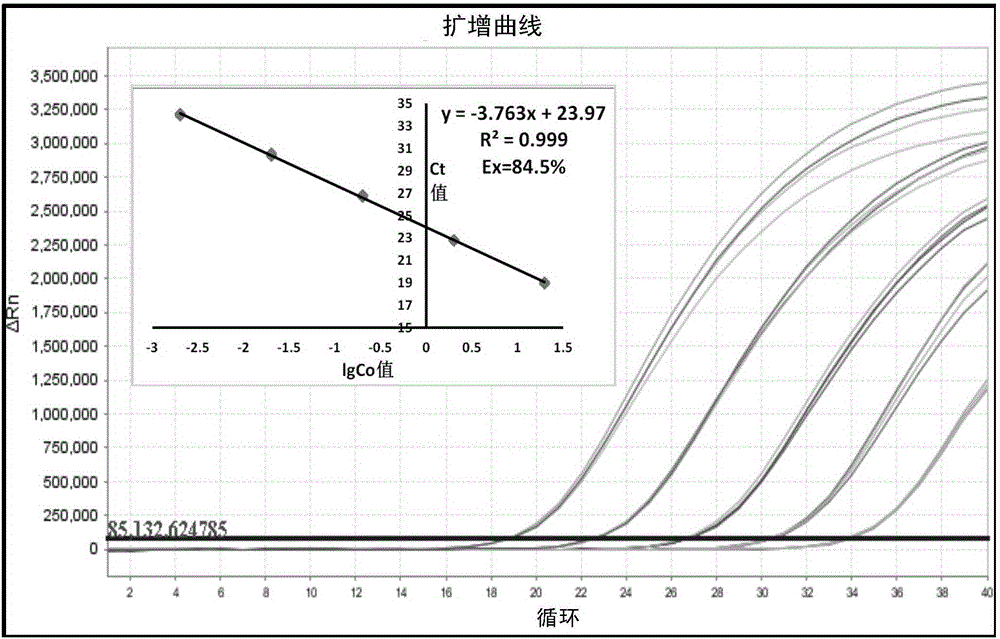
本实施例中,利用鳖亚科生物DNA的5个浓度梯度稀释液为模板(10、1、0.1、0.01、0.001ng/μL),如中华鳖(江苏),分别进行扩增,建立标准曲线。如图2,鳖亚科生物特异性标准曲线的线性方程为y=-3.763x+23.97,回归系数R2值为0.999,反应效率E为84.5%。
结果表明,本发明设计的引物探针对鳖亚科生物成分反应效率高,且建立的标准曲线线性好,可用于鳖亚科生物成分的检测。
实施例4、灵敏度试验和可重复性分析
分别利用鳖亚科生物(中华鳖(江苏)、黄沙鳖、美国山瑞、角鳖、珍珠鳖)的5个浓度梯度稀释液(0.1、0.01、0.001、0.0005、0.0001ng/μL)为模板,对建立的实时荧光PCR检测体系进行灵敏度试验和可重复性分析,结果如表2、表3所示。当样品浓度为0.0001ng/μL时,20次扩增反应中,中华鳖(江苏)、黄沙鳖、美国山瑞、角鳖、珍珠鳖阳性扩增次数分别为3、14、16、7、11,不符合检出率≧95%的置信区间(即20次扩增,阳性结果≧19);当样品浓度为0.0005ng/μL时,20次扩增反应,所有鳖亚科生物样本均得到20次阳性结 果,符合检出率≧95%的置信区间,且RSDr=0.01%≤25%,故中华鳖样品可稳定检出与可定量的的最低浓度均为0.0005ng/μL,即LOD与LOQ值均为1pg DNA(模板量2μL)。
如表3所示,分别分析统计鳖亚科生物样本的4个不同模板浓度在3次重复3个平行试验的标准偏差(SD)和相对标准偏差(RSDr)。中华鳖(江苏)SD值介于0.17—1.00,RSDr值介于0.01-0.03%;黄沙鳖SD值介于0.17-0.79,RSDr值介于0.01-0.02%;美国山瑞SD值介于0.10-1.38,RSDr介于0.00-0.04%;角鳖SD值介于0.21-0.6,RSDr0.01-0.02%;珍珠鳖SD值介于0.17-0.14,RSDr值为0.01%。5种鳖亚科生物的SD值在介于0.1-1.38,RSDr值介于0.01-0.04%≤25%,在相关标准范围之内,因此建立的鳖亚科生物成分实时荧光PCR检测方法有很好的可重复性。
表2、鳖亚科生物成分实时荧光检测方法灵敏度实验结果
注:*3/20指20次检测检出3次。
表3、鳖亚科生物成分实时荧光检测方法可重复性分析
注:Rep指一次试验3个平行反应的平均Ct值,平均CtR值指三次重复试验3个平行反应的平均Ct值。
实施例5、方法实用性验证
对5份来自市售标注含“甲鱼”成分的鳖样品进行实际测试,包括:2种甲鱼罐头(样品A、B);三种甲鱼干粉(样品C、D、E)。
结果显示,2份实际样品(A、B)在采用18S rRNA引物扩增时,均出现显著的S型扩增曲线,表明样品均成功提取出适于扩增的DNA;当2份实际样品采用前述建立的鳖亚科生物成分实时荧光PCR方法扩增时,样品均出现显著的S型扩增曲线,如图3,表明本发明建立的鳖亚科生物成分检测方法可运用于实际样品;但是,发现C、D、E这3种干粉甲鱼样本样品Ct值较靠后,说明这3种样品可能不同程度的掺有非甲鱼粉末。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺